50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行
 rainday12202022-10-04 11:39:541条回答
rainday12202022-10-04 11:39:541条回答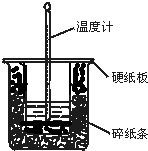 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
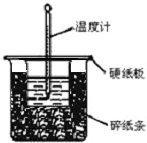
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是______.
(2)烧杯间填满碎纸条的作用是______.
(3)实验改用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量不相等,所求中和热相等,简述理由:______.

已提交,审核后显示!提交回复
共1条回复
 eagle520 共回答了16个问题
eagle520 共回答了16个问题 |采纳率100%- 解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;(2)中和热测定实验成败的关键是保温工作;(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
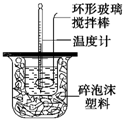
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若用用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1NaOH溶液进行上述实验,测得中和热数值相等,故答案为:因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关.点评:
本题考点: 中和热的测定.
考点点评: 本题主要考查了中和热的测定,注意中和热与酸、碱的物质的量无关,可以根据所学知识进行回答,难度不大. - 1年前
相关推荐
- 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
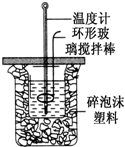
(1)图中环形搅拌棒能否用铜质用品代替______,原因是______
(2)烧杯间填满碎纸条的作用是______
(3)每一次平行实验至少需要观察记录几次温度数值______
(4)大烧杯上如不盖硬纸板,求得的中和热数值______(填“偏大”“偏小”“无影响”).
(5)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所求中和热______(填“相等”“不相等”). 2712228971年前1
2712228971年前1 -
 心言手语88 共回答了12个问题
心言手语88 共回答了12个问题 |采纳率100%解题思路:(1)根据金属棒是热的良导体,易传热;
(2)中和热测定实验成败的关键是保温工作;
(3)根据温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度;
(4)不盖硬纸板,会有一部分热量散失;
(5)根据中和热的概念和实质来回答.(1)铜质搅拌棒的导热性好,易传热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低,故答案为:不能;铜质搅拌棒易传热,散发热量,热量损失较大;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(3)温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,求出两者的平均值,混合反应后测最高温度,最后求出温度差,一共记录3次温度数,故答案为:3次;
(4)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(5)中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所求中和热相等;
故答案为:相等;点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生中和热测定,保温工作是实验成功的关键,掌握实验原理即可解答,难度不大.1年前查看全部
- 用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在
 用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
(1)实验时,装置中大、小烧杯口应在同一水平线上.若不在,测定的中和热数值______ (偏高、偏低).
(2)某同学实验记录的数据如表所示,其中记录的终止温度是指______温度;
(3)若本次实验中50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液的质量均为50g,中和后生成的溶液的比热容为4.18J/(g•℃),列式计算本次实验所测得的中和热.验验
编号起始温度(℃) 终止温度
(℃)温度差
(℃)盐酸 氢氧化钠 平均值 1 25.5 25.0 25.25 28.5 3.25 2 24.4 24.8 24.65 27.8 3.15 3 25.0 24.5 24.75 26.5 1.75  虚心求教1231年前1
虚心求教1231年前1 -
 江湖我独行 共回答了14个问题
江湖我独行 共回答了14个问题 |采纳率92.9%解题思路:(1)中和热测定实验成败的关键是保温工作;
(2)中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
(3)先判断数据的有效性,然后计算出平均温度差,再根据Q=m•c•△T计算反应放出的热量,中和热△H=-
计算即可.Q n(H2O) (1)装置中大、小烧杯口不在同一水平线上,会导致热量散失,结果偏低;
故答案为:偏低;
(2)氢氧化钠溶液与盐酸完全反应后混合溶液的最高温度为终止温度,
故答案为:完全反应后混合溶液的最高;
(3)第三次得到温度差误差较大,应该舍弃,所以平均温度差为:[3.25℃+3.15℃/2]=3.2℃,溶液的质量为:100ml×1g/ml=100g,则该反应中放出的热量为:Q=m•c•△T=100g×4.18J/(g•℃)×3.2℃=1337.6J,即1.3376kJ,则△H=-[1.3376kj/0.025mol]=-53.504kJ/mol
答:本次实验所测得的中和热为△H=-53.504kJ/mol.点评:
本题考点: 中和热的测定.
考点点评: 本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念以及测定反应热的误差等问题.1年前查看全部
- 在无土栽培中,需配制1L含0.50mol•L-1的NH4Cl、0.16mol•L-1KCl、0.24mol•L-1K2S
在无土栽培中,需配制1L含0.50mol•L-1的NH4Cl、0.16mol•L-1KCl、0.24mol•L-1K2SO4的混合溶液,但当时没有K2SO4固体,若用(NH4)2SO4固体代替,需用KCl、NH4Cl、(NH4)2SO4三种固体的物质的量(单位为 mol)分别为( )
A.0.40、0.50、0.12
B.0.66、0.50、0.24
C.0.64、0.50、0.24
D.0.64、0.02、0.24 qqqq有点累1年前1
qqqq有点累1年前1 -
 kan00544 共回答了17个问题
kan00544 共回答了17个问题 |采纳率100%解题思路:根据n=cV计算各物质的物质的量,进而计算混合液中各离子的物质的量,再根据离子守恒可知,n[(NH4)2SO4]=n(SO42-),n( KCl)=n( K+ ),n(NH4Cl)+n(KCl)=n( Cl- ),据此计算解答.1L混合液中,n(NH4Cl)=1L×0.5mol/L=0.5mol、n(KCl)=1L×0.16mol/L=0.16mol、n(K2SO4)=1L×0.24mol/L=0.24mol,
故n( Cl- )=n(NH4Cl)+n( KCl)=0.5mol+0.16mol=0.66mol;
n( K+ )=n( KCl)+2n( K2SO4)=0.16mol+2×0.24mol=0.64mol;
n(SO42-)=n( K2SO4)=0.24mol;
用KCl、NH4Cl、(NH4)2SO4配制,则:
n[(NH4)2SO4]=n(SO42-)=0.24mol;
n( KCl)=n( K+ )=0.64mol;
n(NH4Cl)=n( Cl- )-n( KCl)=0.66mol-0.64mol=0.02mol;
故选D.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了物质的量浓度的有关计算,难度不大,注意从守恒的角度解答,原溶液中离子物质的量和配制溶液中的离子物质的量相同.1年前查看全部
- 在量热计中(如图)将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mo
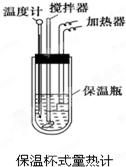 在量热计中(如图)将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
在量热计中(如图)将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
(1)试求CH3COOH的中和热△H表达数值式.
(2)上述数值结果与57.3kJ/mol有偏差,产生原因可能是______
a.实验装置保温、隔热效果差
b.配制0.55mol/L NaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数. nick691年前1
nick691年前1 -
 ligangainannan 共回答了31个问题
ligangainannan 共回答了31个问题 |采纳率93.5%解题思路:(1)根据化学反应热的计算公式Q=-cm△T来计算;
(2)a.实验装置保温、隔热效果必须好;b.配制0.55mol/L NaOH溶液时视线要和凹液面相平;
c.允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中;d.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度;e.量取NaOH溶液的体积时视线要和凹液面相平;(1)CH3COOH的中和热Q=△H=Q=-cm△T=
[150.5J/K+4.184J•(g•K)−1×200g]×(300.7−298)K
0.05mol=-5.33×104 J•mol-1=-53.3 kJ•mol-1,
答:CH3COOH的中和热△H=-53.3 kJ•mol-1;
(2)a.实验装置保温、隔热效果必须好,否则影响实验结果,故a正确;
b.配制0.55mol/L NaOH溶液时俯视刻度线读数,会导致所量的氢氧化钠浓度偏大,影响实验结果,故b正确;
c.允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c错误;
d.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,直接测定影响实验结果,故d正确;
e.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,影响实验结果,故e正确;
故答案为:abde;点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生中和热的测定知识,注意稀的强酸和强碱溶液发生中和反应生成1mol水所放出的热量即为中和热.注意测定反应热的误差.1年前查看全部
- 在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-
 在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
(1)CH3COOH的中和热△H=______.
(2)在做中和反应的反应热的测定实验时,下列操作错误的是______
A.反应前酸、碱溶液的温度要相同
B.测量溶液的温度计要一直插在溶液中
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应进行更完全,可以是酸(碱)适当过量
E.若用KOH代替NaOH,对测定结果有影响.
(3)你认为CH3COOH的中和热与HCl的中和热数值相比,______较大,其原因______. lovejun1年前1
lovejun1年前1 -
 gonghuan0625 共回答了21个问题
gonghuan0625 共回答了21个问题 |采纳率95.2%解题思路:(1)先根据溶液反应放出的热量Q=-cm△T+150.5J•0C-1×△T,再根据中和热△H=-
计算即可;Q n(H2O)
(2)A.反应前酸、碱溶液的温度要相同;
B.为观察溶液温度的变化,温度计要一直插在溶液中;
C.向酸(碱)中分次加入碱(酸),导致部分热量损失,读出的最高温度偏小;
D.为了使反应进行更完全,酸或碱要过量;
E.KOH代替NaOH都是强碱,符合中和热的概念;
(3)醋酸是弱酸,电离过程需要吸收能量.(1)温度差△t=300.7K-298.0K=2.7K,Q=cm△t=2.7K×4.184J•(g•K)-1×200g+150.5J•K-1×2.7K=2665.71J=2.67kJ,△H=[-Q
n(H2O)=-
2.67kJ/0.05mol]=-53.3 kJ/mol;
故答案为:-53.3 kJ/mol;
(2)A.为减少误差,反应前酸、碱溶液的温度要相同,故A不选;
B.为观察溶液温度的变化,测量溶液的温度计要一直插在溶液中,故B不选;
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸),导致部分热量损失,读出的最高温度偏小,故C选;
D.为了使反应进行更完全,可以是酸(碱)适当过量,故D不选;
E.用KOH代替NaOH,KOH也是强碱,符合中和热的概念,对测定结果无影响,故E选;
故答案为:CE;
(3)CH3COOH是弱酸,电离过程需要吸收能量,所以CH3COOH的中和热与HCl的中和热数值相比,HCl较大;
故答案为:HCl;CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热,中和时放热较少.点评:
本题考点: 中和热的测定.
考点点评: 本题考查中和热的测定,题目难度不大,注意理解中和热的概念以及热量计算公式的应用中热量单位的换算.1年前查看全部
- 在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1
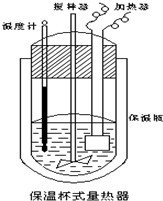 在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.
在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.
(1)试求CH3COOH的中和热△H=______.
(2)CH3COOH的中和热的文献值为56.1KJ•mol-1,则请你分析在(1)中测得的实验值偏差可能的原因______.
(3)实验中NaOH过量的目的是______. _若谷1年前1
_若谷1年前1 -
 御风飘舞 共回答了20个问题
御风飘舞 共回答了20个问题 |采纳率100%解题思路:(1)根据化学反应热的计算公式Q=-cm△T来计算;
(2)根据中和热的测定中能够导致放出的热量偏低的因素进行解答;
(3)为了确保CH3COOH溶液完全被中和,从而提高实验的准确度,所用NaOH稍过量.(1)温度从25.0℃升高到27.7℃,△T=(298+27.7)K-(298+25)K=(27.7-25)K,CH3COOH的中和热Q=△H=Q=-cm△T=
[150.5J/K+4.184J•(g•K)−1×200g]×(27.7−25)K
0.05mol=-5.33×104 J•mol-1=-53.3 kJ•mol-1,
故答案为:△H=-53.3 kJ•mol-1;
(2)CH3COOH的中和热的文献值为-56.1kJ/mol,实际上测定数值偏低,可能原因有:①量热计的保温瓶效果不好,②酸碱溶液混合不迅速,③温度计不够精确等,
故答案为:①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等;
(3)酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以实验中NaOH过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度,
故答案为:使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度;点评:
本题考点: 中和热的测定.
考点点评: 本题考查中和热的测定,注意掌握测定中和热的原理、操作方法,以及热量计算公式的应用,题目难度不大.1年前查看全部
- 在无土栽培中,需配制1L含0.50mol•L -1 的NH 4 Cl、0.16mol•L -1 KCl、0.24mol•
在无土栽培中,需配制1L含0.50mol•L -1 的NH 4 Cl、0.16mol•L -1 KCl、0.24mol•L -1 K 2 SO 4 的混合溶液,但当时没有K 2 SO 4 固体,若用(NH 4 ) 2 SO 4 固体代替,需用KCl、NH 4 Cl、(NH 4 ) 2 SO 4 三种固体的物质的量(单位为mol)分别为( ) A.0.40、0.50、0.12 B.0.66、0.50、0.24 C.0.64、0.50、0.24 D.0.64、0.02、0.24  8meeriusr1年前1
8meeriusr1年前1 -
 lily8595 共回答了14个问题
lily8595 共回答了14个问题 |采纳率85.7%1L混合液中,n(NH 4 Cl)=1L×0.5mol/L=0.5mol、n(KCl)=1L×0.16mol/L=0.16mol、n(K 2 SO 4 )=1L×0.24mol/L=0.24mol,
故n( Cl - )=n(NH 4 Cl)+n(KCl)=0.5mol+0.16mol=0.66mol;
n( K + )=n(KCl)+2n(K 2 SO 4 )=0.16mol+2×0.24mol=0.64mol;
n(SO 4 2- )=n(K 2 SO 4 )=0.24mol;
用KCl、NH 4 Cl、(NH 4 ) 2 SO 4 配制,则:
n[(NH 4 ) 2 SO 4 ]=n(SO 4 2- )=0.24mol;
n(KCl)=n( K + )=0.64mol;
n(NH 4 Cl)=n( Cl - )-n(KCl)=0.66mol-0.64mol=0.02mol;
故选D.1年前查看全部
- 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH,
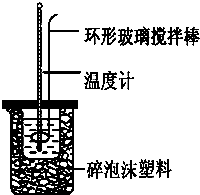 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是______.
(2)如用0.50mol•L-1盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将______(填“偏大”、“偏小”、“不变”)
(3)实验得到表中的数据:
经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=______实验次数 起始温度t1/℃ 终止温度t2/℃ 盐酸 NaOH溶液 1 20.2 20.3 23.7 2 20.3 20.5 23.8 3 21.5 21.6 24.9
[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算]. jacksunken1年前1
jacksunken1年前1 -
 huanping 共回答了22个问题
huanping 共回答了22个问题 |采纳率95.5%(1)不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体,
故答案为:Cu传热快,热量损失大;
(2)氢氧化钠固体溶于水放热,溶液温度升高,所以实验中测得的“中和热”数值将偏大,
故答案为:偏大;
(3)50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH的质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),△T=t2-t1=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为[1.4212KJ×1mol/0.025mol]=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,
故答案为:-56.8kJ/mol.1年前查看全部
- (16分)(2012•广东)碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L ﹣1 KI、0.2%淀粉溶液、0
(16分)(2012•广东)碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L ﹣1 KI、0.2%淀粉溶液、0.20mol•L ﹣1 K 2 S 2 O 8 、0.10mol•L ﹣1 Na 2 S 2 O 3 等试剂,探究反应条件对化学反应速率的影响.
已知:S 2 O 8 2 ﹣ +2I ﹣ =2SO 4 2 ﹣ +I 2 (慢) I 2 +2S 2 O 3 2 ﹣ =2I ﹣ +S 4 O 6 2 ﹣ (快)
(1)向KI、Na 2 S 2 O 3 与淀粉的混合溶液中加入一定量的K 2 S 2 O 8 溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S 2 O 3 2 ﹣ 与S 2 O 8 2 ﹣ 初始的物质的量需满足的关系为:n(S 2 O 3 2 ﹣ ):n(S 2 O 8 2 ﹣ ) .
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx= ml,理由是 .实验
序号体积V/ml K 2 S 2 O 8 溶液 水 KI溶液 Na 2 S 2 O 3 溶液 淀粉溶液 ① 10.0 0.0 4.0 4.0 2.0 ② 9.0 1.0 4.0 4.0 2.0 ③ 8.0 Vx 4.0 4.0 2.0
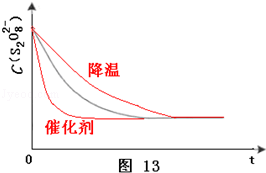
(3)已知某条件下,浓度c(S 2 O 8 2 ﹣ )~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S 2 O 8 2 ﹣ )~反应时间t的变化曲线示意图(进行相应的标注).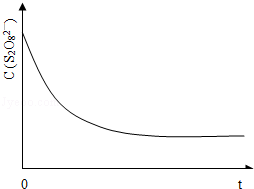
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:2Li(s)+I 2 (s)=2LiI(s)△H
已知:4Li(s)+O 2 (g)=2Li 2 O(s)△H 1
4LiI(s)+O 2 (g)=2I 2 (s)+2Li 2 O(s)△H 2
则电池反应的△H= ;碘电极作为该电池的 极. dgzjking1年前1
dgzjking1年前1 -
 白小白catt 共回答了19个问题
白小白catt 共回答了19个问题 |采纳率78.9%1年前查看全部
- (1)用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图1所
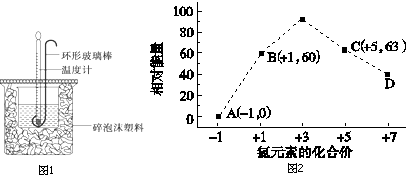 (1)用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
①烧杯间填满碎泡沫塑料的作用是______.
②若大烧杯上改为盖薄铁板,求得的反应热数值:______(填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的热化学方程式______.
(2)①已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1则以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:______.
②由气态基态原子形成1mol化学键释放的最低能量叫键能.已知表中所列键能数据,则N2(g)+3H2(g)⇌2NH3(g)△H=______kJ•mol-1.
③一定条件下,在水溶液均为1mol以下离子 Cl-、ClO-、ClO2-、ClO3-、ClO4-的能量(kJ)相对大小如图2所示,则3ClO-(aq)═ClO3-(aq)+2Cl-(aq)的△H=______kJ•mol-1.化学键 H-H N-H N≡N 键能kJ•mol-1 436 391 945  想爱的猫1年前1
想爱的猫1年前1 -
 drewafg32 共回答了24个问题
drewafg32 共回答了24个问题 |采纳率83.3%解题思路:(1)①中和热测定实验成败的关键是保温工作;
②若大烧杯上改为盖薄铁板,会使一部分热量散失;
③根据热化学方程式的意义以及书写方法来回答;
(2)①根据盖斯定律计算反应热,据此书写该热化学反应方程式;
②反应焓变=生成物键能之和-反应物键能之和计算得到;
③反应焓变=产物能量之和-反应物能量之和计算得到.(1)①烧杯间填满碎泡沫塑料的作用是:保温(或隔热、或减少热量损失),故答案为:保温(或隔热、或减少热量损失);
②若大烧杯上改为盖薄铁板,会使一部分热量散失,求得的反应热数值偏小,故答案为:偏小;
③50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液反应生成0.025mol水,产生的热量为1.42kJ,则生成1mol水放热56.8kJ,即HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1,故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1;
(2)①a、CH4(g)+H2O(g)═CO (g)+3H2(g)△H=+206.2kJ•mol-1,
b、CH4(g)+CO2(g)═2CO (g)+2H2(g)△H=+247.4kJ•mol-1,
由盖斯定律可知,a×2-b可得CH4(g)+2H2O(g)═CO2(g)+4H2(g),
其反应热△H=(+206.2kJ•mol-1)×2-(+247.4kJ•mol-1)=+165.0 kJ•mol-1,
即热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ•mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ•mol-1;
CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165kJ•mol-1
②N2(g)+3H2(g)⇌2NH3(g)△H=a kJ/mol,△H=945KJ/mol+3×436KJ/mol-6×391KJ/mol=-93KJ/mol;
故答案为:-93;
③3ClO-(aq)═ClO3-(aq)+2Cl-(aq)的△H=(63+0-3×60)kJ/mol=-117kJ/mol,故答案为:-117.点评:
本题考点: 中和热的测定;热化学方程式.
考点点评: 本题涉及反应热的测定方法、热化学方程式的书写以及盖斯定律的应用等知识,属于综合知识的考查,难度较大.1年前查看全部
- 某学生实验小组用50mL 0.50mol•L-1的盐酸与50mL 0.50mol•L-1的NaOH溶
 某学生实验小组用50mL 0.50mol•L-1的盐酸与50mL 0.50mol•L-1的NaOH溶液在图所示的装置中进行中和反应反应热的测定.
某学生实验小组用50mL 0.50mol•L-1的盐酸与50mL 0.50mol•L-1的NaOH溶液在图所示的装置中进行中和反应反应热的测定.
(1)图中装置缺少一种仪器,该仪器名称为______.
(2)下列说法正确的是______.
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的硝酸代替稀盐酸溶液进行实验. lipusen1年前1
lipusen1年前1 -
 吹牛要上税 共回答了15个问题
吹牛要上税 共回答了15个问题 |采纳率86.7%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;
(2)A、导致混合液体积增大,混合液的温度减小;
B、酸碱混合时要迅速,并且不能搅拌,防止热量的散失;
C、烧杯间填满碎纸条的作用是保温;
D、根据中和热的含义来判断.(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,
故答案为:环形玻璃搅拌器;
(2)A、小烧杯内残留有水,会导致混合液的体积变大,混合液温度降低,温度差减小,测得的反应热数值偏小,故A正确;
B、在中和热的测定过程中,酸碱混合时要迅速,并且不能搅拌,防止热量的散失,保证放出的热量都体现在温度计温度的升高上,故B错误;
C、烧杯间填满碎纸条的作用是保温,减少热量的散失,故C错误;
D、中和热的含义是稀的强酸和强碱溶液反应生成1mol水的过程中所放出的热量,可用相同浓度和体积的硝酸代替稀盐酸溶液进行实验求出的中和热数值相同,故D正确;
故答案为:AD.点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的装置和误差分析,可以根据所学知识进行回答,难度不大.1年前查看全部
- 在量热器中将50ml、0.50mol•L-1CH3COOH溶液与50ml、0.55mol•L-1NaOH溶液混合,温度从
 在量热器中将50ml、0.50mol•L-1CH3COOH溶液与50ml、0.55mol•L-1NaOH溶液混合,温度从25.16℃升高到27.46℃.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J•0C-1,C=4.18J•g-1•0C-1,溶液的密度为1g•cm-3.
在量热器中将50ml、0.50mol•L-1CH3COOH溶液与50ml、0.55mol•L-1NaOH溶液混合,温度从25.16℃升高到27.46℃.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J•0C-1,C=4.18J•g-1•0C-1,溶液的密度为1g•cm-3.
(1)试求CH3COOH的“中和热”.
(2)请你分析(1)中测得的实验值偏差可能是什么原因造成的?______.
(3)若HNO3 (aq)+NaOH(aq)=NaNO3(aq)+H2O(l);△H=-57.3KJ•mol-1;
现有①稀H2SO4与Ba(OH)2(aq) ②浓H2SO4与Ba(OH)2(aq)
③HNO3与Ba(OH)2(aq)反应生成1molH2O(l) 的反应热分别为△H1、△H2、△H3,
则△H1、△H2、△H3三者由小到大的关系为:______. 郭小芙_1年前1
郭小芙_1年前1 -
 ziyoubiao111 共回答了14个问题
ziyoubiao111 共回答了14个问题 |采纳率100%解题思路:(1)先根据溶液反应放出的热量Q=-cm△T+150J•0C-1×△T,再根据中和热△H=-
计算即可.Q n(H2O)
(2)根据中和热的测定中能够导致放出的热量偏低的因素进行解答;
(3)稀的强酸与强碱生成1molH2O放出的热量为中和热,注意形成沉淀放热,浓硫酸溶于水时放出大量的热量.(1)温度差△t=27.46℃-25.16℃=2.3℃,Q=cm△t=2.3℃×4.18J/(g•℃)×100g+150J•0C-1×2.3℃=1306.4J=1.31kJ,△H=[−Q
n(H2O)=
1.31kJ/0.025mol]=-52.4kJ/mol;
答:CH3COOH的中和热△H=-53.3 kJ/mol,
(2)(1)中测得的实验值偏低,可能原因有:①量热计的保温瓶效果不好,②弱酸电离要吸热;
故答案为:①量热计的保温瓶效果不好,②弱酸电离要吸热;
(3)HNO3、KOH为强酸与强碱,其稀溶液发生中和反应的热效应:H+(aq)十OH-(aq)=H2O△H3=-57.3kJ/mol,稀H2SO4与Ba(OH)2(aq)形成沉淀,放出热量,放出的热量大于57.3kJ,则△H1<-57.3kJ/mol,浓硫酸溶于水时放出大量的热量;热量远大于57.3kJ,△H2<-57.3kJ/mol,所以△H2<△H1<△H3;
故答案为:△H2<△H1<△H3.点评:
本题考点: 中和热的测定.
考点点评: 本题考查了中和热的计算,大小比较,题目难度中等,注意掌握测定中和热的原理、操作方法.1年前查看全部
- 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8
 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-═2SO42-+I2(慢)I2+2S2O32-═S4O62-+2I- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的______(填化学式)耗尽后,溶液颜色将由无色变成为蓝色.为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<______.
(2)某同学设计实验如下表所示:
该实验的目的是______;表中V1=______mL,理由是______.0.20mol•L-1K2S2O8溶液的体积/mL 0.10mol•L-1Na2S2O3溶液的体积/mL H2O的体积/mL 0.50mol•L-1KI溶液的体积 淀粉溶液 实验1 10.0 4.0 0.0 4.0 2.0 实验2 9.0 4.0 1.0 4.0 2.0 实验3 8.0 4.0 V1 4.0 2.0
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注) 洹畔一叟1年前1
洹畔一叟1年前1 -
 彪悍的毛一定结实 共回答了25个问题
彪悍的毛一定结实 共回答了25个问题 |采纳率92%(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生S2O82-+2I-═2SO42-+I2(慢),后发生I2+2S2O32-═S4O62-+2I- (快),当S2O32-耗尽后,碘才能与淀粉作用显示蓝色,根据I2+2S2O32-═S4O62-+2I- (快)方程式知,I2与S2O32-的物质的量的关系为1:2,即1mol碘需2molS2O32-,根据方程式S2O82-+2I-═2SO42-+I2知,生成1mol碘需为1molS2O82-,即n(S2O32-):n(S2O82-)=2:1,为确保能观察到蓝色,碘需有剩余,即n(S2O32-):n(S2O82-)<2:1,
故答案为:Na2S2O3;<2;
(2)对照实验1和2发现,实验2取的0.20mol•L-1K2S2O8溶液的体积9mL,比实验1少了1mL,说明取的K2S2O8物质的量少,加水1mL,保证了溶液的体积不变,所以在其它条件不变的情况下,探究的是该反应速率与K2S2O8浓度的关系,同样原理对照实验1和3,为保证溶液的体积相同,须加2mL水,
故答案为:探究该反应速率与K2S2O8浓度的关系;2 mL;理由是保证反应物K2S2O8浓度改变,而其他的不变,才到达实验目的;
(3)保持其它条件不变,降低温度,反应速率降低,到达液颜色将由无色变成为蓝色的时间变长,而使用催化剂,能加快化学反应速率,所以到达液颜色将由无色变成为蓝色的时间变短,故答案为: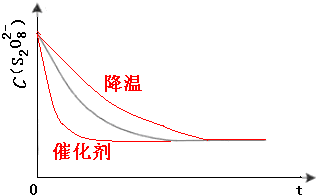 .
1年前查看全部
.
1年前查看全部
- 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是______.
(2)若大烧杯上不盖硬纸板,求得的中和热△H______(填“偏大”“偏小”或“无影响”). rf0fa51年前1
rf0fa51年前1 -
 憨包包 共回答了21个问题
憨包包 共回答了21个问题 |采纳率90.5%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;(2)不盖硬纸板,会有一部分热量散失.(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌器;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小.点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的装置和误差分析,可以根据所学知识进行回答,难度不大.1年前查看全部
- 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.50mol•L-1 H
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.50mol•L-1 H2SO4、2mol•L-1 H2SO4、18.4mol•L-1 H2SO4
实验一:甲组同学研究的实验报告如下表:
(2)甲组同学的实验目的是______;根据控制变量法,要得出正确的实验结论,还需要控制的实验条件是______.实验步骤 实验现象 实验结论 ①分别取等体积的2mol.L-1 H2SO4
于试管中
②分别投入大小、形状相同的
Cu、Fe、
Mg.镁反应速率比铁快,
铜不反应(1)______
实验二:乙组同学为了研究不同浓度的硫酸对反应速率的影响,设计了以下实验: (3)用此装置进行定量实验,应选用上述的实验药品是:______;
(3)用此装置进行定量实验,应选用上述的实验药品是:______;
(4)乙组同学应该测定的实验数据是______:
(5)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):______. agidrh1年前1
agidrh1年前1 -
 心灵之药 共回答了21个问题
心灵之药 共回答了21个问题 |采纳率95.2%解题思路:(1)金属活泼性不同,反应速率不同;
(2)甲组实验中,金属不同,酸相同;控制变量法要求温度等外因相同;
(3)由实验探究不同浓度的硫酸对反应速率的影响可知,则选相同金属,不同浓度酸即可;
(4)乙组同学应该测定时间及气体的体积;
(5)此实验忽视了温度应相同.(1)由实验现象可知,镁反应速率比铁快,铜不反应,则金属活泼性不同,反应速率不同,结论为金属性越强化学反应速率越快,
故答案为:金属性越强化学反应速率越快;
(2)甲组实验中,金属不同,酸相同,则该实验研究物质性质对化学反应速率的影响;控制变量法要求温度等外因相同,
故答案为:研究物质性质对化学反应速率的影响;温度相同;
(3)由实验探究不同浓度的硫酸对反应速率的影响可知,则选相同金属,不同浓度酸即可,则选给定的金属镁或铁和不同浓度的酸反应,来确定酸的浓度对反应速率的影响,因浓硫酸具有强氧化性,常温下能和金属铁之间发生钝化,和金属镁反应生成的是二氧化硫,而不是氢气,所以试剂为镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4,
故答案为:镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4;
(4)乙组同学应该测定时间及气体的体积,从而计算反应速率,则实验数据是测一定时间内产生气体的体积,故答案为:测一定时间内产生气体的体积;
(5)因温度影响反应速率,则此实验忽视了温度应相同,故答案为:温度对反应速率的影响.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的影响及探究,侧重实验探究能力和分析能力的考查,注意物质本性为确定反应速率的内因,把握外因对反应速率影响及控制变量法分析实验方案,题目难度中等.1年前查看全部
- (2012•广东)碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•
(2012•广东)碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-=2SO42-+I2(慢)I2+2S2O32-=2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的______耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)______.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx=______ ml,理由是______.实验
序号体积V/ml K2S2O8溶液 水 KI溶液 Na2S2O3溶液 淀粉溶液 ① 10.0 0.0 4.0 4.0 2.0 ② 9.0 1.0 4.0 4.0 2.0 ③ 8.0 Vx 4.0 4.0 2.0
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注).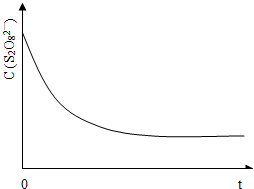
(4)碘也可用作心脏起捕器电源-锂碘电池的材料,该电池反应为:2Li(s)+I2 (s)=2LiI(s)△H
已知:4Li(s)+O2 (g)=2Li2O(s)△H1
4LiI(s)+O2 (g)=2I2 (s)+2Li2O(s)△H2
则电池反应的△H=△H1−△H2 2 ;碘电极作为该电池的______极.△H1−△H2 2  hjcmdl1年前1
hjcmdl1年前1 -
 狂爱JAY伦 共回答了19个问题
狂爱JAY伦 共回答了19个问题 |采纳率84.2%解题思路:(1)根据KI、Na2S2O3与淀粉的反应原理解答,注意反应过程的快慢问题;
(2)根据实验目的及表格数据分析,从而确定Vx的大小及理由,注意探究物质的量浓度对反应速率影响时,其它条件应相同;
(3)降低温度,化学反应速率减小,则到达平衡时间延长;加入催化剂,增大反应速率,则缩短反应到达平衡时间;
(4)将第一个方程式与第二个方程式相减再除以2,焓变进行相应改变,正极上得电子发生还原反应.(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生S2O82-+2I-═2SO42-+I2(慢),后发生I2+2S2O32-═S4O62-+2I- (快),当S2O32-耗尽后,碘才能与淀粉作用显示蓝色,根据I2+2S2O32-═S4O62...
点评:
本题考点: 探究影响化学反应速率的因素;原电池和电解池的工作原理.
考点点评: 本题考查了实验探究,注意探究外界条件对化学反应影响时,只能改变一个条件,其它条件必须相同,否则不能得出正确结论,难度较大.1年前查看全部
- 在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1
 在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.
在如图所示的量热计中,将100mL 0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.
(1)试求CH3COOH的中和热△H=-53.3kJ/mol-53.3kJ/mol.
(2)CH3COOH的中和热的文献值为56.1KJ•mol-1,则请你分析在(1)中测得的实验值偏差可能的原因①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等.
(3)实验中NaOH过量的目的是使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度. shoujiqq1年前1
shoujiqq1年前1 -
 vitaoss 共回答了19个问题
vitaoss 共回答了19个问题 |采纳率73.7%(1)温度从25.0℃升高到27.7℃,△T=(298+27.7)K-(298+25)K=(27.7-25)K,CH3COOH的中和热Q=△H=Q=-cm△T=
[150.5J/K+4.184J•(g•K)−1×200g]×(27.7−25)K
0.05mol=-5.33×104 J•mol-1=-53.3 kJ•mol-1,
故答案为:△H=-53.3 kJ•mol-1;
(2)CH3COOH的中和热的文献值为-56.1kJ/mol,实际上测定数值偏低,可能原因有:①量热计的保温瓶效果不好,②酸碱溶液混合不迅速,③温度计不够精确等,
故答案为:①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等;
(3)酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以实验中NaOH过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度,
故答案为:使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度;1年前查看全部
- 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.50mol•L-1,保
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.50mol•L-1,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol•L-1.下列有关判断正确的是( )
A. x+y<z
B. 平衡向正反应方向移动
C. B的转化率增大
D. C的体积分数下降 mingtianhaizai1年前1
mingtianhaizai1年前1 -
 七抽 共回答了20个问题
七抽 共回答了20个问题 |采纳率85%解题思路:平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,如平衡不移动,则A的浓度应降低为0.25mol/L,而此时为0.3mol/L,则说明降低压强平衡向逆方向移动,以此进行判断.平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L,说明降低压强平衡向逆方向移动,则
A.降低压强平衡向逆方向移动,说明反应物气体的计量数之和大于生成物气体的计量数,应为x+y>z,故A错误;
B.由以上分析可知平衡向逆方向移动,故B错误;
C.平衡向逆方向移动,B的转化率降低,故C错误;
D.平衡向逆方向移动,C的体积分数下降,故D正确.
故选D.点评:
本题考点: 化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查化学平衡移动知识,题目难度不大,注意从浓度的变化的角度判断平衡移动的方向,结合压强对平衡移动的影响分析.1年前查看全部
- 在无土栽培中,需配制1L含0.50mol•L-1的NH4Cl、0.16mol•L-1KCl、0.24mol•L-1K2S
在无土栽培中,需配制1L含0.50mol•L-1的NH4Cl、0.16mol•L-1KCl、0.24mol•L-1K2SO4的混合溶液,但当时没有K2SO4固体,若用(NH4)2SO4固体代替,需用KCl、NH4Cl、(NH4)2SO4三种固体的物质的量(单位为 mol)分别为( )
A. 0.40、0.50、0.12
B. 0.66、0.50、0.24
C. 0.64、0.50、0.24
D. 0.64、0.02、0.24 damilj1年前1
damilj1年前1 -
 dusje 共回答了18个问题
dusje 共回答了18个问题 |采纳率83.3%解题思路:根据n=cV计算各物质的物质的量,进而计算混合液中各离子的物质的量,再根据离子守恒可知,n[(NH4)2SO4]=n(SO42-),n( KCl)=n( K+ ),n(NH4Cl)+n(KCl)=n( Cl- ),据此计算解答.1L混合液中,n(NH4Cl)=1L×0.5mol/L=0.5mol、n(KCl)=1L×0.16mol/L=0.16mol、n(K2SO4)=1L×0.24mol/L=0.24mol,
故n( Cl- )=n(NH4Cl)+n( KCl)=0.5mol+0.16mol=0.66mol;
n( K+ )=n( KCl)+2n( K2SO4)=0.16mol+2×0.24mol=0.64mol;
n(SO42-)=n( K2SO4)=0.24mol;
用KCl、NH4Cl、(NH4)2SO4配制,则:
n[(NH4)2SO4]=n(SO42-)=0.24mol;
n( KCl)=n( K+ )=0.64mol;
n(NH4Cl)=n( Cl- )-n( KCl)=0.66mol-0.64mol=0.02mol;
故选D.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了物质的量浓度的有关计算,难度不大,注意从守恒的角度解答,原溶液中离子物质的量和配制溶液中的离子物质的量相同.1年前查看全部
- 在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-
 在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
在量热计中将100mL 0.50mol•L-1的CH3COOH溶液与100mL 0.55mol•L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J•K-1,溶液密度均为1g•mL-1,生成溶液的比热容c=4.184J•(g•K)-1.
(1)CH3COOH的中和热△H=______.
(2)实验中NaOH过量的目的是______.
(3)你认为CH3COOH的中和热与HCl的中和热数值相比,______较大,其原因是______.
(4)若用KOH代替NaOH,对测定结果______(填“有”或“无”)影响. sicily1年前1
sicily1年前1 -
 想飞1019 共回答了15个问题
想飞1019 共回答了15个问题 |采纳率86.7%解题思路:(1)先根据溶液反应放出的热量Q=-cm△T+150.5J•0C-1×△T,再根据中和热△H=-
计算即可;Q n(H2O)
(2)酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差;
(3)CH3COOH是弱酸,电离过程需要吸收能量;
(4)KOH也是强碱,符合中和热的概念.(1)温度差△t=300.7K-298.0K=2.7K,Q=cm△t=2.7K×4.184J•(g•K)-1×200g+150.5J•K-1×2.7K=2665.71J=2.67kJ,△H=[−Q
n(H2O)=-
2.67kJ/0.05mol]=-53.3 kJ/mol,故答案为:-53.3 kJ/mol;
(2)酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,
故答案为:过量的碱能保证CH3COOH完全被中和,从而提高实验准确度;
(3)CH3COOH是弱酸,电离过程需要吸收能量,所以CH3COOH的中和热与HCl的中和热数值相比,HCl较大;
故答案为:HCl;CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热,中和时放热较少;
(4)用KOH代替NaOH,KOH也是强碱,符合中和热的概念,对测定结果无影响,故答案为:无.点评:
本题考点: 中和热的测定.
考点点评: 本题考查中和热的测定,题目难度不大,注意理解中和热的概念以及热量计算公式的应用中热量单位的换算.1年前查看全部
大家在问
- 1英语翻译
- 21,怎么求f(x)=x/(1+x-2x^2)的关于x的幂级数展开式呀? 2,求f(x)=xe^x展开成x的幂级数
- 3在21~50中合数有什么
- 4下列结论:①有一组对边平行,且两个角是直角的四边形是矩形;②两条对角线相等的四边形是矩形;③两组对边分别相等的四边形是矩
- 5y大于等于x的绝对值..这个图像怎么画?
- 6征庄辛于赵是什么特殊句式
- 7甲乙两人分别从相距30KMAB两地同时出发相向而行经过3H后相距3KM.在经过2H甲到B地所剩的路
- 8英语翻译我弟弟非常喜欢吃肉
- 9化学的物质与结构百科上说成键电子对n=与中心原子成键的原子个数,可是要是有双健或是三建怎么办,例如乙烯分子有三个sp2杂
- 10根据中文,完成句子他们正忙着为聚会做准备.Ther _____busy _____ready _______the pa
- 11有人说,钟的时钟和分钟一天内会重合24次,你认为这种说法是否正确?请说明理由
- 12某商店在出售某种商品时,以m元的价格出售,亏本20%
- 13在线求指导:第一次世界大战的特点
- 14关于数字推理题1,1,2,3,4,7,6,( )1,1,2,6,8,11,( )求下一个数字麻烦请把过程写出来,
- 15热浓硫酸将乙酸乙酯碳化的化学方程式及解析