钠,镁,铝的电子层数相同,核电荷数逐渐增大,原子半径逐渐减小,核对和对电子吸引力组建增强,因此失电
 huoyuexin_ruc2022-10-04 11:39:541条回答
huoyuexin_ruc2022-10-04 11:39:541条回答帮忙把这句话里的“核对和对电子吸引力组建增强”这句话断一下句.
铝的电子层数相同,核电荷数逐渐增大,原子半径逐渐减小,核对核对电子吸引力组建增强,因此失电
打错了 应该是这句话“核对核对电子吸引力组建增强”

已提交,审核后显示!提交回复
共1条回复
 dongnao96 共回答了18个问题
dongnao96 共回答了18个问题 |采纳率83.3%- 应该说的是原子核对核外电子的吸引力逐渐增强,因此失电子能力越弱,也就是越难失去电子
- 1年前
相关推荐
- 元素周期表第四主族电子层问题第四周期,主族和副族的电子层排序依次是什么?什么时候是2 8 8 什么时候是2 8 18 紧
元素周期表第四主族电子层问题
第四周期,主族和副族的电子层排序依次是什么?什么时候是2 8 8
什么时候是2 8 18
紧急,并又额外加分 女报MM1年前1
女报MM1年前1 -
 jasmineisjane 共回答了18个问题
jasmineisjane 共回答了18个问题 |采纳率83.3%中间的副族,含有d层,因为d层能装10个电子(即含有5条轨道),所以最外层就有3s3p3d(2+6+10=18个电子)
另外,就是按照Hund规则,电子总是先以自旋相同的方式分占不同的轨道,直至半满.1年前查看全部
- 中专化学题【7】A+ 、B2+ 、C- 、D2- 四种离子具有相同的电子层结构.现有以下排列顺序:1.B2+>A+>C-
中专化学题【7】
A+ 、B2+ 、C- 、D2- 四种离子具有相同的电子层结构.现有以下排列顺序:1.B2+>A+>C->D2- 2.C->D2->A+>B2+ 3.B2+>A+>D2->C- 4.D2->C->A+>B2+.四种离子的半径以及四种元素原子序数由大到小的的顺序分别是?
A.1、4 B.4、1 C.2、3 D.3、2 sandy_mayfly1年前1
sandy_mayfly1年前1 -
 爱你不变心相连 共回答了16个问题
爱你不变心相连 共回答了16个问题 |采纳率93.8%答案:B
原子序数大小关系是B>A>C>D,当离子结构相同时,半径随原子序数的增大而减小1年前查看全部
- Al>D,Al和D形成简单离子后,它们的电子层相差一层
 花裳云1年前2
花裳云1年前2 -
 斯情已逝 共回答了18个问题
斯情已逝 共回答了18个问题 |采纳率94.4%氯化铝.
请说明铝大于D是在哪方面?原子半径还是原子序数什么的.1年前查看全部
- 化学原子结构题有a、b、c、d四种主族元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a 阳离子的正电荷数小于
化学原子结构题
有a、b、c、d四种主族元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a 阳离子的正电荷数小于b阳离子的正电荷数,c阴离子的负电荷数大于d阴离子的负电荷数,则他们的离子半径的关系是( ).
(A)、a>b>c>d; (B)、b>a>d>c; (C)、c>a>d>b; (D)、c>d>a>b. 酒肉小和尚1年前3
酒肉小和尚1年前3 -
 小筑的小猪 共回答了20个问题
小筑的小猪 共回答了20个问题 |采纳率90%A B C D 可看作Na Mg N O 明显选D1年前查看全部
- 非金属离子的电子层数越多,它对应的酸的酸性就越强,那金属酸性又有什么决定呢?
 小沁1331年前1
小沁1331年前1 -
 yanling753 共回答了22个问题
yanling753 共回答了22个问题 |采纳率81.8%酸分成有含氧酸和无氧酸.如:
1、无氧酸:R-H
当R的半径越大,即电子层数越多,R-H的结合力越小,越容易断键,发生电离,所以酸性越强.
其中R可以是非金属也可以是金属.
2、含氧酸:R-O-H
当R的半径越大,R-O的键合力越小,O-H的结合力越强,H越不容易离去,酸性越小.这点正好与无氧酸相反.
你所说的情况应该是无氧酸的类型,即氢酸,如酸性HCl < HBr < HI即属于这种情况.如果是金属同样,比如酸性:NH3 < PH3 < AsH3 < SbH31年前查看全部
- 五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构.A和B、
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:⑴五种元素中,原子半径最大的是?非金属性最强的是?(填元素符号)
⑵由A和B、D、E形成的共价化合物中,热稳定性最差的是?(用化学式表示)
⑶A和E形成的化合物与A和B形成的化合物反应,产物的化学式为?其中存在的化学键类型为?
⑷D最高价氧化物的水化物的化学式为?
⑸单质D在充足的单质E中燃烧,反应的化学方程式为?D在不充足的E中燃烧,生成的主要产物的化学式为?
⑹单质E与水反应的离子方程式为? 小卡0851年前2
小卡0851年前2 -
 wangjh3 共回答了17个问题
wangjh3 共回答了17个问题 |采纳率70.6%A:H B:N C:Na D:P E:CL
(1):c元素半径最大(应该是Na);e元素非金属性最强(应该是CL)
(2):PH3
(3):NH4CL;极性共价键和离子键
(4):H3PO4
(5):2P+5CL2===2PCL5;2P+3CL2===2PCL3
(6):CL2+H2O===H++CL-+HCLO1年前查看全部
- x元素的最高正价和最低负价的绝对值之差为6,y和x的原子的次外层电子层上都有8个电子,x和y形成的
x元素的最高正价和最低负价的绝对值之差为6,y和x的原子的次外层电子层上都有8个电子,x和y形成的
化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是? 闪光的Robben1年前1
闪光的Robben1年前1 -
 我不怕你鸟 共回答了26个问题
我不怕你鸟 共回答了26个问题 |采纳率84.6%元素的最高正价是最外层电子全部失去形成,元素的最低负价是得到电子使最外层电子达到8电子结构.因此,最高负价和最低负价的绝对值之和等于8,.
题目给出X元素最高负价和最低负价的绝对值之差为6,因此最高正价是+7,最低负价为-1,是第VIIA族元素.
X次外层有8个电子,因此电子层结构为:2 8 7,是Cl元素.
Cl元素形成的化合物,在水中能够电离出单独的离子,说明电离出的是Cl-,电子层结构为:2 8 8
Y原子与Cl原子构成化合物,所以在水中也电离出Y离子是正离子,电子层结构也是2 8 8,说明Y原子的电子层结构可能是2 8 8 1(K)或2 8 8 2(Ca).
该化合物可能是KCl或CaCl2.1年前查看全部
- Cu的原子中的n=3的电子层中,有哪些简并轨道?
Cu的原子中的n=3的电子层中,有哪些简并轨道?
课本的答案是3p,3d,为什么3s不是呢? 小红不是帽1年前1
小红不是帽1年前1 -
 王者风云 共回答了9个问题
王者风云 共回答了9个问题 |采纳率100%把同一亚层(即l相同),伸展方向不同的原子轨道称为等价轨道或简并轨道
3S轨道只有一种方向的轨道1年前查看全部
- 1:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子
1:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子 这里2s是表示2个s轨道吗?还是表示L层的s轨道所以叫2s.p轨道同问.
 pixi1年前0
pixi1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 元素X的核电荷数为a,他的阳离子X m+与元素Y的阴离子Y n-的电子层结构相同则元素Y的核电荷数是多少?
 六月清雅1年前1
六月清雅1年前1 -
 干-妹妹 共回答了21个问题
干-妹妹 共回答了21个问题 |采纳率85.7%a-m-n1年前查看全部
- 有ABCDE五种微粒A微粒中有14个中子,核外M层上有2个电子B微粒得到2个电子后,其电子层结构和Ne相同.C微粒带有一
有ABCDE五种微粒
A微粒中有14个中子,核外M层上有2个电子
B微粒得到2个电子后,其电子层结构和Ne相同.
C微粒带有一个单位的正电荷,核电核数为11
D微粒核外有18个电子,当失去1个电子时呈中性
E微粒不带电,其质量数为1
求分别为什么元素
BCE所属元素两两组合时,可形成那些离子化合物和共价化合物,
BCD所属三种元素共同组合时所形成的物质有多种, xklc1年前3
xklc1年前3 -
 婚姻问题mm 共回答了23个问题
婚姻问题mm 共回答了23个问题 |采纳率78.3%正确
A微粒中有14个中子,核外M层上有2个电子
→电子排布为2、8、2,应为Mg
B微粒得到2个电子后,其电子层结构和Ne相同.
→其原子核外电子排布为2、6,应为O.
C微粒带有一个单位的正电荷,核电核数为11
→应为Na+
D微粒核外有18个电子,当失去1个电子时呈中性
→失电子后排布为2、8、7.该微粒为Cl―
E微粒不带电,其质量数为1
→只能为H了
BCE即Na、O、H可形成的离子化合物有NaOH、NaH、Na2O、Na2O2:共价化合物有H2O、H2O2.
BCD即O、Na、Cl.化合物有NaClO、NaClO3、NaClO4(都是高中可以接触到的)1年前查看全部
- 已知1~18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构,下列关
已知1~18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构,下列关系正确的是( ) A.质子数:c>d B.离子的还原性:Y 2- >Z - C.氢化物的稳定性:H 2 Y>HZ D.原子半径:X<W  herogui1年前1
herogui1年前1 -
 HL566 共回答了12个问题
HL566 共回答了12个问题 |采纳率66.7%因四种离子的电子层结构相同,所以质子数a、b、c、d的大小关系应为a>b>d>c,且Y、Z在上一周期,Y在Z的左边,Y的非金属性小于Z;W、X在下一周期,X在W的左边,X的金属性大于W.
A、质子数d>c,故A错误;
B、离子的还原性:Y 2- >Z - ,故B正确;
C、氢化物稳定性应为HZ>H 2 Y,故C错误;
D、原子半径大小关系应为X>W,故D错误;
故选B.1年前查看全部
- 最多可容纳8个电子的电子层一定是第二电子层..这句话为什么不对
 偶米希望1年前1
偶米希望1年前1 -
 lin8899 共回答了19个问题
lin8899 共回答了19个问题 |采纳率94.7%核外电子排布规律:最外电子层:最多可容纳8个电子1年前查看全部
- 已知1—18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构,则下列
已知1—18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构,则下列叙述或表示方法正确的是()
A.四种元素位于同一周期 B.氢化物的稳定性:H 2 Y>HZ C.离子的氧化性: a W 3+ > b X + D.a+3=c-2  abchhs1231年前1
abchhs1231年前1 -
 kyzxtpin1988 共回答了19个问题
kyzxtpin1988 共回答了19个问题 |采纳率94.7%C
1年前查看全部
- 在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和.则该元素的核电荷数为(
在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和.则该元素的核电荷数为( )
A.30
B.12
C.17
D.20 剑折有寸利1年前1
剑折有寸利1年前1 -
 东巴鱼 共回答了17个问题
东巴鱼 共回答了17个问题 |采纳率88.2%解题思路:由于该元素原子含有M、N电子层,故K层、L层已经排满,K电子层和L电子层的电子数之和为10,所以M电子层和N电子层的电子数之和也为10.电中性原子核电荷数=质子数=核外电子数.据此判断由于该元素原子含有M、N电子层,故K层、L层已经排满,K电子层和L电子层的电子数之和为10,所以M电子层和N电子层的电子数之和也为10,故该元素原子核外电子数为10+10=20,所以该元素核电荷数为20.
故选:D.点评:
本题考点: 原子核外电子排布;核电荷数.
考点点评: 考查核外电子排布规律等,比较基础,掌握核外电子排布规律并能灵活运用.1年前查看全部
- 已知核电荷数均小于18的X、Y、Z、W四种元素原子的电子层数相同,而原子半径依次增大,则下列物质中酸性最强的是 A.HX
已知核电荷数均小于18的X、Y、Z、W四种元素原子的电子层数相同,而原子半径依次增大,则下列物质中酸性最强的是
A.HXO 4 B.H 2 YO 4 C.H 3 ZO 4 D.H 4 WO 4  我要提问请你回答1年前1
我要提问请你回答1年前1 -
 想顶就顶1 共回答了21个问题
想顶就顶1 共回答了21个问题 |采纳率95.2%A
电子层数相同,说明位于同一周期。同周期自左向右原子半径逐渐减小,非金属性逐渐增强。因为原子半径依次增大,则所以非金属性强弱顺序是X>Y>Z>W。非金属性越强,最高价氧化物的水化物的酸性越强,答案选A。1年前查看全部
- A+、B2+、C-、D2-四种离子具有相同的电子层结构,现有以下排列排序:
A+、B2+、C-、D2-四种离子具有相同的电子层结构,现有以下排列排序:
①B2+>A+>C->D2-
②C->D2->A+>B2+
③B2+>A+>D2->C-
④D2->C->A+>B2+
四种离子的半径由大到小及四种元素的原子序数由大到小的顺序分别是( )
A. ①④
B. ④①
C. ②③
D. ③② lyk06041年前6
lyk06041年前6 -
 vasoul 共回答了26个问题
vasoul 共回答了26个问题 |采纳率84.6%解题思路:A+、B2+、C-、D2-四种离子具有相同的电子层结构,核外电子数相等,令核外电子数为x,则A、B、C、D的原子序数分别为x+1、x+2、x-1、x-2;电子层结构相同,核电荷数越大离子半径越小,据此解答.A+、B2+、C-、D2-四种离子具有相同的电子层结构,核外电子数相等,令核外电子数为x,则A、B、C、D的原子序数分别为x+1、x+2、x-1、x-2,故原子序数(核电荷数)B2+>A+>C->D2-;
电子层结构相同,核电荷数越大离子半径越小,故离子半径D2->C->A+>B2+,
故选:B.点评:
本题考点: 微粒半径大小的比较.
考点点评: 本题考查离子半径的比较,难度不大,根据电子层结构相同确定核电荷数的大小关系是关键.1年前查看全部
- (8分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层
(8分)已知a、b、c、d、e五种元素的原子序数依次递增,a、b、c、d位于前三周期。a位于周期表的s区,其原子中电子层数和未成对电子数相同;b的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;d原子的核外成对电子对数与未成对电子数之比为3:1。a、b、d三种元素组成的一种化合物m是新装修居室中常含有的一种有害气体,a、b两种元素组成的原子个数之比为1∶1的化合物n是常见的有机溶剂。e有“生物金属”之称,e 4 + 和氩原子的核外电子排布相同。
(1)d元素在元素周期表中的位置为第 周期 族。
(2)下列叙述正确的是 (填写序号)。
a.水的沸点比m高得多,是因为水分子间能形成氢键,而m分子间不能形成氢键
b.m的中心原子采用sp 3 杂化
c.n分子中含有6个σ键和1个大π键
d.bd 2 晶体的熔点、沸点都比二氧化硅晶体的低
(3)已知c 2 d是一种***剂,根据等电子原理可推知c 2 d的空间构型为 。
(4)e的一种氧化物q,其晶胞结构如图所示,则q的化学式为 。
 过客在品味苦旅1年前1
过客在品味苦旅1年前1 -
 xiaominyp 共回答了16个问题
xiaominyp 共回答了16个问题 |采纳率93.8%(1)二(1分)VIA(1分)(2)ad(2分,漏选得1分,错选倒扣分,本空不出现负分)
(3)直线形(2分)(4)TiO 2 (2分)
1年前查看全部
- 下列原子各电子层中电子数不合理的是( )
下列原子各电子层中电子数不合理的是( )
A. 21Sc:K(2)L(8)M(8)N(3)
B. 24Cr:K(2)L(8)M(13)N(1)
C. 32Ge:K(2)L(8)M(18)N(4)
D. 29Cu:K(2)L(8)M(18)N(1) 海与火1年前1
海与火1年前1 -
 blue_raining 共回答了22个问题
blue_raining 共回答了22个问题 |采纳率77.3%解题思路:根据能量最低原理写出电子排布式,可确定各电子层中电子数是否合理.A.Sc的电子排布式为1s22s22p63s23p63d14s2,各电子层中电子数应为K(2)L(8)M(9)N(2),故A错误;
B.Cr的电子排布式为1s22s22p63s23p63d54s1,各电子层中电子数应为K(2)L(8)M(13)N(1),故B正确;
C.Ge的电子排布式为1s22s22p63s23p63d104s24p2,各电子层中电子数应为K(2)L(8)M(18)N(4),故C正确;
D.CuCr的电子排布式为1s22s22p63s23p63d104s1,各电子层中电子数应为K(2)L(8)M(18)N(1),故D正确.
故选A.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查核外电子排布,题目难度中等,注意看电子排步不能只看主量子数,还要看副量子数和磁量子数,也不是次外层一定要到18电子才稳定,基态原子电子排步是按照能量最低原理,洪特规则和包利不相容原理来排的,先填满能量低的轨道,再填能量高的轨道,即ns→(n-2)f→(n-1)d→np的顺序排列,第24号元素Cr和第29号元素Cu是因为在3d电子层上的电子接近半满或全满才将外层的电子填到内层的,这样可以使原子处在一个较低能量的状态下,更稳定.这种类型例外应该可以只记Cr和Cu.1年前查看全部
- xy两元素的原子,当他们分别获得两个电子形成稀有气体元素原子的电子层结构时,x放出的能量大.zw两元素的原子,当他们分别
xy两元素的原子,当他们分别获得两个电子形成稀有气体元素原子的电子层结构时,x放出的能量大.zw两元素的原子,当他们分别失去一个电子形成稀有气体元素原子电子层结构时,w吸收的能量多.则x,y,z,w形成的化合物中最有可能是离子化合物的是?
A Z2X
B.Z2Y
C.W2X
D.W2Y
为什么. 我是阿紫1年前2
我是阿紫1年前2 -
 慕容乔子 共回答了13个问题
慕容乔子 共回答了13个问题 |采纳率84.6%鉴于高中以学习短周期元素为主,对于xy两元素,得两个电子形成稀有气体元素原子的电子层结构,可以是氧或硫,x放出的能量大即X的电子亲和能大,更易得电子,也就是氧化性强,所以x为氧.y为硫.
zw两元素失去一个电子形成稀有气体元素原子电子层结构,一般为第一主族元素,w吸收的能量多,就是w不易失去电子,还原性弱,可能是氢或锂.z可能为钠.
由于两种元素化合物组成的化合物中两元素电负性相差越大,晶体中离子成分越高.电负性相差最大的显然是钠和氧,即z2x.
综上所述,答案错了.1年前查看全部
- 求Sc,Ti,V,Cr,Mn,Fe,Co,Ni,Cu,Zn,Ga,Ge的电子层结构示意图
 jinsen_yi1年前1
jinsen_yi1年前1 -
 黄海111 共回答了14个问题
黄海111 共回答了14个问题 |采纳率85.7%Sc:+21 2 8 9 2
Ti:+22 2 8 10 2
V:+23 2 8 11 2
Cr:+24 2 8 13 1
Mn:+25 2 8 13 2
Fe:+26 2 8 14 2
Co:+27 2 8 15 2
Ni:+28 2 8 16 2
Cu:+29 2 8 18 1
Zn:+30 2 8 18 2
Ga:+31 2 8 18 3
Ge:+32 2 8 18 41年前查看全部
- D的+2价阳离子的电子层结构结构与Ne原子相同.那D的离子示意图是.
 rcndrec1年前2
rcndrec1年前2 -
 流浪喈 共回答了26个问题
流浪喈 共回答了26个问题 |采纳率92.3%Mg2+
2,81年前查看全部
- 在第n电子层中,当它作为原子的最外层时,容纳电子数最多与n-1层相同;当它作为原子的次外层时,其电子数比n+1层最多容纳
在第n电子层中,当它作为原子的最外层时,容纳电子数最多与n-1层相同;当它作为原子的次外层时,其电子数比n+1层最多容纳电子数多10个,则此电子层是( )
A.K层
B.L层
C.M层
D.N层 水城一小卒1年前1
水城一小卒1年前1 -
 huo19992002 共回答了18个问题
huo19992002 共回答了18个问题 |采纳率83.3%解题思路:在第n电子层中,当它作为原子的最外层时,容纳电子数最多与n-1层相同,最外层电子数最大是8,则其n-1电子层电子数是8;当它作为原子的次外层时,其电子数比n+1层最多容纳电子数多10个,当K层为次外层时最多排列2个电子、当L层为次外层时,最多排列8个电子,当次外层为M层时,最多排列电子数是18,据此分析解答.在第n电子层中,当它作为原子的最外层时,容纳电子数最多与n-1层相同,最外层电子数最大是8,则其n-1电子层电子数是8;
当K层为次外层时最多排列2个电子、当L层为次外层时,最多排列8个电子,当次外层为M层时,最多排列电子数是18,当它作为原子的次外层时,其电子数比n+1层最多容纳电子数多10个,n+1层为最外层时其电子数最多8个,所以n层最多排列18个电子,所以该电子层为M层,
故选C.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查了原子核外电子排布,明确电子排布规律是解本题关键,每个电子层上最多排列2n2个电子,且还要遵循最外层不超过8个、次外层不超过18个、倒数第三层不超过32个电子的排布规律,这几个规律必须同时遵循,题目难度不大.1年前查看全部
- gA、B、C为三种短周期元素,A、B在同一周期,A、C的最低价离子分别为A2-、C--,B2+和C-具有相同的电子层
gA、B、C为三种短周期元素,A、B在同一周期,A、C的最低价离子分别为A2-、C--,B2+和C-具有相同的电子层
结构.
下列判断正确的是
A.原子序数A>C>B
B.原子半径A>B>C
C.离子半径A2-
>C->B2D.
D.原子核最外层电子数A》>C 》B
打得有点不好,请见谅,请给出具体的分析, 123456789asx1年前2
123456789asx1年前2 -
 dd狂人 共回答了17个问题
dd狂人 共回答了17个问题 |采纳率94.1%AB同一周期,根据A、C的最低价离子分别为A2-、C-,B2+和C-具有相同的电子层以及这句话来判断,C在AB的上一周期,B在A之前.所以原子序数为A>B>C,可以假设A为硫,B为镁,C为氟
A项错误
B原子半径应该是B大于A大于C
C离子半径应该是A最大,C其次,B最小,所以C正确
D最外层电子数A最大,B其次,C最小1年前查看全部
- 请问如果是电子层结构相同的一个阳离子、一个原子和一个阴离子,应该怎样比较它们的电离能大小?(它们都是稳定结构,搞不懂怎么
请问如果是电子层结构相同的一个阳离子、一个原子和一个阴离子,应该怎样比较它们的电离能大小?(它们都是稳定结构,搞不懂怎么比较,)
 飘摇5201年前1
飘摇5201年前1 -
 配套 共回答了23个问题
配套 共回答了23个问题 |采纳率91.3%阳离子的核电荷数最大,原子的其次,阴离子的最小
核电荷数越大,对电子的吸引力越大,电子越不容易电离,电离能越大1年前查看全部
- 下列说法正确的是( )A.两原子之间的相互作用叫做化学键B.失电子难的原子获得电子能力一定强C.电子层结构相同的不同离
下列说法正确的是( )
A.两原子之间的相互作用叫做化学键
B.失电子难的原子获得电子能力一定强
C.电子层结构相同的不同离子,其半径随着核电荷数增大而减小
D.在化学反应中某元素由化合态变为游离态,该元素一定被还原 一定要好好生活1年前1
一定要好好生活1年前1 -
 huangchensj 共回答了16个问题
huangchensj 共回答了16个问题 |采纳率81.3%解题思路:A.相邻原子之间的强烈相互作用叫做化学键;
B.失电子难的原子获得电子的能力不一定强;
C.电子层结构相同的不同离子,离子半径随着原子序数的增大而减小;
D.在化学反应中某元素由化合态变为游离态,该元素不一定被还原,根据元素得失电子判断被氧化还是被还原.A.相邻原子之间强烈的相互作用叫做化学键,相互作用包含吸引力和排斥力,故A错误;
B.失电子难的原子获得电子的能力不一定强,如稀有气体原子,故B错误;
C.电子层数越多,离子半径越大,但电子层结构相同的不同离子,离子半径随着原子序数的增大而减小,故C正确;
D.在化学反应中某元素由化合态变为游离态,该元素不一定被还原,如氯离子转化为氯气时氯元素被氧化,故D错误;
故选C.点评:
本题考点: 化学键;元素周期律的作用.
考点点评: 本题考查较综合,涉及化学键的概念、氧化还原反应、离子半径的比较等知识点,化学键概念中注意关键词“相邻”“相互作用”,为易错点.1年前查看全部
- 能级组最多容纳的电子数与电子层最多容纳的电子数有何不同
 best321671年前1
best321671年前1 -
 有泪不流 共回答了17个问题
有泪不流 共回答了17个问题 |采纳率88.2%电子层,或称电子壳,是指一组拥有相同主量子数n的原子轨道.n=1表明第一层电子层(K层),n=2表明第二电子层(L层),依次n=3、4、5时表明第三(M层)、第四(N层)、第五(O层).一般随着n值的增加,即按K、L、M、N、O…的顺序,电子的能量逐渐升高.也就是说K层是1s,L层是2s2p,M层是3s3p3d,以此类推.s轨道可以容纳自旋相反的两个电子,p轨道有三个亚层,可以容纳6个电子,d轨道有5个亚层,容纳10个电子,f轨道7个亚层14个电子.这样就是很理想的情况,K层最多2个电子,L层8个,M层18个,这就是所谓2n^2规则.
但是现实中,电子的排列并不是这么理想的,轨道能量的高低并不完全是照着主量子数和角量子数的顺序来的,于是科学家鲍林把能量相近电子轨道划分成能级组,按照能量从低到高,鲍林的划分是 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p这7个能级组,这才是电子排列的时候的真正顺序.同上可以算出按照这个能级组的划分,最多容纳的电子数应该是2、8、8、18、18、32、32.事实上,这正是元素周期表不同周期的列数.
它们的区别基本上就是这样了.1年前查看全部
- X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布.H2在X单质中燃烧,产生苍白色火焰;Y元素的气...
X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布.H2在X单质中燃烧,产生苍白色火焰;Y元素的气...
X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布.H2在X单质中燃烧,产生苍白色火焰;Y元素的气态氢化物是H2Y,其最高价氧化物中的Y的质量分数为40%;Z元素的离子具有紫色的焰色反应.(1)根据以上条件,推断X、Y、Z各是什么元素?(2)写出X、Y、Z最高价氧化物的水化物的化学式. lzf_nyt1年前1
lzf_nyt1年前1 -
 rea-iou 共回答了24个问题
rea-iou 共回答了24个问题 |采纳率87.5%X肯定是Cl Y是S Z 是K
X:HClO4 Y:H2SO4 K:KOH1年前查看全部
- 继续,化学题1.A.B两种离子具有相同的电子层,A B两元素的单质都能与水剧烈反应,在反应中A单质为氧化剂,B为还原剂,
继续,化学题
1.A.B两种离子具有相同的电子层,A B两元素的单质都能与水剧烈反应,在反应中A单质为氧化剂,B为还原剂,则
(1)A离子的结构示意图为( )B原子的结构示意图是( )
2.A.B.C.D.E为原子序数依次增大的主族元素,已知A.B.E三原子的最外层共有11个电子层,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答,
(1)写出下列元素符号A( )B( )
3.由0.2gH2,8.8gCO2,5.6gCO组成的混和气体,在相同的条件下对氢气的相对密度是( )
我想问一下第三题是怎么算的 koni291年前1
koni291年前1 -
 jiangln 共回答了21个问题
jiangln 共回答了21个问题 |采纳率95.2%第一题A是Na B是F2
第二题A 是Na B是Al
第三题14.61年前查看全部
- 一种熔雪剂,主要成分XY2,x,y分别为前20号元素,其阴阳离子电子层结构相同,且1molxy2含有54mol电子.
一种熔雪剂,主要成分XY2,x,y分别为前20号元素,其阴阳离子电子层结构相同,且1molxy2含有54mol电子.
求:1.该熔雪剂的化学式
2.x与氢元素形成化合物的电子式
3.元素d,e原子的最外层电子数是其电子层数的2倍,d与y相邻,d与e能形成一种非急性分子,求d,e,y分别是什么! hh_wxb1年前1
hh_wxb1年前1 -
 iQue 共回答了13个问题
iQue 共回答了13个问题 |采纳率92.3%1.CaCl2
2.H:Ca:H
3.d:c e:s y:Cl1年前查看全部
- ABCD为短周期中相邻两周其中的元素,其原子序数A>B>C>D.D和A形成简单离子后,他们的电子层相差两层.已知A处于n
ABCD为短周期中相邻两周其中的元素,其原子序数A>B>C>D.D和A形成简单离子后,他们的电子层相差两层.已知A处于n族,D处于m族,且A原子和A离子的电子层数相同.B的气态氢化物的化学式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等.C和A可形成CA3型化合物,C和A、B在同一周期,B与A左右相邻.试回答:
(1)若n-m=6,则A、D形成的化合物的化学式为——
(2)D的原子序数为——(用含m的代数式表示)
(3)向B的氢化物水溶液中滴入A单质的水溶液,可析出B单质,发生反应的化学方程式为——,向A的氢化物水溶液中投入C单质,反应的离子方程式为—— caoriben1231年前1
caoriben1231年前1 -
 深海市长 共回答了20个问题
深海市长 共回答了20个问题 |采纳率85%你好!
答案如下:
(1)化学式为LiCl
(2)m+2
(3)Cl2+H2S=S↓+2HCl 2AL+6HCL=2ALCL3+3H2 ↑(麻烦自己化成离子方程式吧)
注意A为Cl B为S C为Al D为Li1年前查看全部
- 给我书说离子的 结构中的数字,和电子层上的电子数的关系,具体说就是怎么算.
给我书说离子的 结构中的数字,和电子层上的电子数的关系,具体说就是怎么算.
例如 ○ 2 8 2
圆圈里的数字又不是2+8+2,有时会多1或者少1,这是为什么? xqyying19771年前3
xqyying19771年前3 -
 yuko1105 共回答了21个问题
yuko1105 共回答了21个问题 |采纳率95.2%圆圈里的是正电荷数(=原子序数,显正电),外面的是电子数(显负电)
如果相等就是原子比如 Na +11 2 8 1
外面的电子数可以少,就代表失去了电子,所以就显正电,是阳离子,比如Na+ +11 2 8
电子数还可以多,是得到了电子,显负电,是阴离子,比如
Cl- +17 2 8 8
不知这样讲你能否明白1年前查看全部
- 科学家是如何测出原子核外最多有7个电子层的?又是如何测出最外层最多有8个电子的?次外层有18个电子的?
 ciwei051年前1
ciwei051年前1 -
 tt走开 共回答了19个问题
tt走开 共回答了19个问题 |采纳率89.5%原子核最外层不一定只有7个电子层,只是目前发现的元素最多只有7个电子层.至于每层的电子数量是推算出来的,因为按照原子轨道理论,最外层最多有8个电子,次外层有18个电子,这样才符合计算出的结果和自然的一些现象.1年前查看全部
- 某基态原子的3d能级中有一个电子,其第四电子层中的电子数为( )
某基态原子的3d能级中有一个电子,其第四电子层中的电子数为( )
A. 0
B. 2
C. 3
D. 4 旧时想念1年前3
旧时想念1年前3 -
 月下晒书 共回答了23个问题
月下晒书 共回答了23个问题 |采纳率91.3%解题思路:根据构造原理,核外电子排满4s再排3d,3d能级中有一个电子,不存在洪特规则特例情况,因此4s上的电子数为2.根据构造原理,核外电子排满4s再排3d,3d能级中有一个电子,不存在洪特规则特例情况,s能级最多容纳2个电子,因此4s上的电子数为2,
故选B.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查了原子核外电子排布,难度不大,解题时注意洪特规则特例的情况,掌握构造原理是解题的关键.1年前查看全部
- 高一快乐寒假化学题目有ABCD四种元素,它们的原子序数依次增大,由BCD形成的离子具有相同的电子层结构.CD单质都能跟水
高一快乐寒假化学题目
有ABCD四种元素,它们的原子序数依次增大,由BCD形成的离子具有相同的电子层结构.CD单质都能跟水剧烈反应,1molC单质跟水反应放出11.2L(标准状况)B气体单质,1molD单质跟水反应产生11.2(标准状况)气体,此时转化成具有氖原子核外电子层结构的离子.试推断:
1、这四种元素的名称A__B__C__D__
2、C原子的结构示意图_______________D原子的结构示意图_______________
3、这四种元素的原子半径大小的顺序为_________________
4、写出C单质与水的化学方程式___________________
5、写出D单质与水的离子方程式___________________ 空心气泡泡1年前1
空心气泡泡1年前1 -
 南方狼人 共回答了17个问题
南方狼人 共回答了17个问题 |采纳率88.2%D反应生成的是A气体吧
所以可以猜测C是氟,B是氧,D是钠,A是氢
验证
2F2 + 2H2O = 4HF + O2
2mol 22.4L
1mol 11.2L
2Na + 2H2O = 2NaOH + H2
2mol 22.4L
1mol 11.2L
正确
2、(这个很好写了)
3、Na大于O大于F大于H
4、2F2 + 2H2O = 4HF + O2
5、2Na + 2H2O = 2NaOH + H2 气体1年前查看全部
- 已知1~18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构,则下列
已知1~18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构,则下列叙述或表示方法正确的是 [ ]A.四种元素位于同一周期
B.氢化物的稳定性H 2 Y>HZ
C.离子的氧化性 a W 3+ > b X +
D.a+3=c-2 haixiaoba1年前1
haixiaoba1年前1 -
 夜雨1680 共回答了15个问题
夜雨1680 共回答了15个问题 |采纳率86.7%C1年前查看全部
- (8分)现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构
(8分)现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构与Ne原子相同,2gB的氧化物与100ml 0.5mol/L的
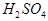 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物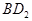 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
(1)五种元素的名称是B________;D ;E________.
(2) 形成化合物 的化学键类型是: .
的化学键类型是: .
(3)用电子式表示化合物BD 2 的形成过程。 .
(4) A的氢氧化物的水溶液和C单质发生反应的离子方程式: . snsn261年前1
snsn261年前1 -
 害虫头头 共回答了17个问题
害虫头头 共回答了17个问题 |采纳率88.2%(1) B_镁;D氯;E 氧。 (每空1分)
(2)离子键、(极性)共价键。(1分,只填一种键不给分)
(3)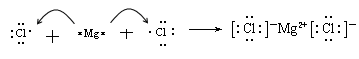 (2分)
(2分)
(4)2OH - +2Al +2H 2 O=2AlO 2 - +3 H 2 ↑。(2分)
根据B单质与D单质反应后可形成离子化合物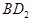 ,说明B是第ⅡA,D是第 Ⅶ A 。2gB的氧化物与100ml 0.5mol/L的
,说明B是第ⅡA,D是第 Ⅶ A 。2gB的氧化物与100ml 0.5mol/L的 恰好完全反应,所以B的氧化物的相对分子质量是40,因此B是镁,则A是Na,C是Al,D是Cl,E是O。
恰好完全反应,所以B的氧化物的相对分子质量是40,因此B是镁,则A是Na,C是Al,D是Cl,E是O。
(2)过氧化钠中含有离子键和非极性键。
(3)氯化镁是离子化合物,其形成过程为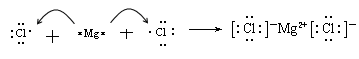 。
。
(4)铝和氢氧化钠反应的方程式为2OH - +2Al +2H 2 O=2AlO 2 - +3 H 2 ↑。1年前查看全部
- 有A、B、C、D、E五种微粒:①A微粒核内有14个中子,核外M电子层上有2个电子;②B微粒得到2个电子后,其电子层结构与
有A、B、C、D、E五种微粒:
①A微粒核内有14个中子,核外M电子层上有2个电子;
②B微粒得到2个电子后,其电子层结构与Ne相同;
③C微粒带有一个单位的正电荷,核电荷数为11;
④D微粒核外有18个电子,当失去1个电子时呈电中性;
⑤E微粒不带电,其质量数为1.
依次写出A、B、C、D、E各微粒的符号
______、______、______、______、______. 招亲不招福1年前1
招亲不招福1年前1 -
 砂锅大的拳头 共回答了21个问题
砂锅大的拳头 共回答了21个问题 |采纳率81%解题思路:①根据原子核外电子排布及质量数判断核素;
②根据原子核外电子排布判断元素;
③根据电子数、核电荷数、电荷数的关系判断元素;
④根据电子数、核电荷数、电荷数的关系判断元素;
⑤根据质子数、中子数、质量数的关系判断元素.①由“核外M电子层上有2个电子”知,该元素的核外电子排布为2、8、2,;质子数为12,质量数为26;所以是质子数为12,质量数为26的镁元素;
②Ne的核外电子数是10,B微粒得到2个电子后,其电子层结构与Ne相同,所以B是O元素;
③C的核电荷数为11,C微粒带有一个单位的正电荷,核电荷数=原子序数,所以C是钠离子;
④由题意知,该元素的原子核外有17个电子,原子的核外电子数=核内质子数=原子序数,所以D是氯离子;
⑤由题意知,E是质子数为1,中子数为0,质量数为1的H元素.
故答案为:2612Mg;O;Na+;Cl-;11H.点评:
本题考点: 原子核外电子排布;质量数与质子数、中子数之间的相互关系.
考点点评: 本题考查了原子核外电子排布及质子数、中子数、质量数的相互关系等知识点,侧重考查学生对这些知识点的掌握情况.1年前查看全部
- A和B两种元素的原子,当它们分别获得1个电子形成稀有气体原子的电子层结构时,
A和B两种元素的原子,当它们分别获得1个电子形成稀有气体原子的电子层结构时,
A放出的能量大于B,则可推断()
A .A的氧化性小于B
B.A的还原性大于B
C.B的还原性大于A
D.A的氧化性大于B 一叶独落1年前3
一叶独落1年前3 -
 xj_330 共回答了20个问题
xj_330 共回答了20个问题 |采纳率95%CD
由题A比B更易得电子1年前查看全部
- X、Y、Z、W四种短周期元素,若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子氧化性强于等电荷的X阳离子的氧化性
X、Y、Z、W四种短周期元素,若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子氧化性强于等电荷的X阳离子的氧化性,Z的阴离子半径大于等电荷的Y的阴离子半径,且Z离子所带电荷数的绝对值是W离子的两倍,W离子与Z离子的电子层相差两层.试推断这四种元素X_______,Y_________,Z_________,W_______.
 dy6141年前4
dy6141年前4 -
 dol3k 共回答了22个问题
dol3k 共回答了22个问题 |采纳率86.4%X、Y、Z、W四种短周期元素,Z离子所带电荷数的绝对值是W离子的两倍,一般可得z离子和y离子带两个单位的负电荷,又因为Z的阴离子半径大于等电荷的Y的阴离子半径,所以z为硫元素、y为氧元素.同时说明w离子带一个单位的正电...1年前查看全部
- 现有ABCD四种元素,前三种元素的离子结构和氖原子的电子层结构相同
现有ABCD四种元素,前三种元素的离子结构和氖原子的电子层结构相同
H2B,0.2molC原子能从酸中置换产生2.24L标准状况的H2;D的原子核中没有中子.(1)根据以上条件写出ABCD各元素名称—A:氟 B:氧 C:钠 D:氢—. 阳光翔光1年前1
阳光翔光1年前1 -
 ccl0317 共回答了17个问题
ccl0317 共回答了17个问题 |采纳率94.1%0.2molC原子能从酸中置换产生2.24L=0.1mol标准状况的H2,所以C是一价金属,D的原子核中没有中子只有氢元素AB没谈到啊题干缺损,猜想卤素单质通入水置换出气体的是氟气 前三种元素的离子结构和氖原子的电子层结构相同,说明是10电子构型,A没有正价态的化合物只有氟-1价,B的氢化物分子式为H2B,只有氧符合离子十电子构型,再者就是钠1年前查看全部
- 无机推断题X、Y均为短周期元素,X原子核外各电子层的电子数之比为1∶4∶1,X比Y原子多3个电子.下列叙述中正确的是 (
无机推断题
X、Y均为短周期元素,X原子核外各电子层的电子数之比为1∶4∶1,X比Y原子多3个电子.下列叙述中正确的是 ( )
A.X元素的最高氧化物对应的水化物是强碱
B.Y元素的最高氧化物对应的水化物的分子式可表示为HYO4
C.电解Y的钠盐溶液可制备Y的单质?
D.Y的单质与H2O反应在同类元素中最剧烈
我觉得选B,为什么? 资深书棍1年前1
资深书棍1年前1 -
 trtrtrtrtr 共回答了21个问题
trtrtrtrtr 共回答了21个问题 |采纳率85.7%由题目可知,X为Mg,Y为F.
选择答案D.
A:元素的最高氧化物对应的水化物是中强碱(或者是弱碱)
B:的氧化性比O还强,不可能形成HFO4
C:能由NaF制备单质F2
D:F能从水中迅速发生不可逆置换出氧气,而其他的则是发生可逆的歧化反应1年前查看全部
- 电子层符号为K、L、M、N、O、P、Q,为什么不是A、B、C、D、E、F呢?
电子层符号为K、L、M、N、O、P、Q,为什么不是A、B、C、D、E、F呢?
电子层符号是怎样来的? 龙楚楚--1年前2
龙楚楚--1年前2 -
 双鱼小妮子 共回答了19个问题
双鱼小妮子 共回答了19个问题 |采纳率89.5%亨利·莫斯莱和巴克拉首次于X-射线吸收研究的实验中发现电子层.巴克拉把它们称为K、L和、M(以英文子母排列)等电子层(最初 K 和 L 电子层名为 B 和 A,改为 K 和 L 的原因是预留空位给未发现的电子层).这些字母后来被n值1、2、3等取代.1年前查看全部
- 原子核外电子排布遵循下列规律:(1)电子将尽可能排布在离核近的、能量低的电子层上;(2)每层最多容纳电子2n2(n为层数
原子核外电子排布遵循下列规律:
(1)电子将尽可能排布在离核近的、能量低的电子层上;
(2)每层最多容纳电子2n2(n为层数);
(3)最外层电子数不超过8个,次外层不超过18个电子,倒数第三层不超过32个电子.近年科学家发现的核电荷数为118的元素,其核外电子排布应是( )
A.2、8、18、32、32、18、8
B.2、8、18、32、18、18、22
C.2、8、18、32、50、8
D.2、8、32、32、18、8 聊也痛不聊也痛1年前1
聊也痛不聊也痛1年前1 -
 jzcenter 共回答了23个问题
jzcenter 共回答了23个问题 |采纳率95.7%解题思路:在原子结构示意图中,质子数即核电荷数等于核外电子数,核电荷数为118则核外也应有118个电子;核外电子在分层排布时,应遵循各电子层最多容纳电子数2n2(n为电子层数,且次外层电子数不超过18个).A、核外电子数=2+8+18+32+32+18+8=118,与核电荷数相等,且符合最外层不超过8、次外层不超过18个电子的规律;故A正确;
B、核外电子数=2+8+18+32+18+18+22=136,与核电荷数不等,不是核电荷数为118的元素的原子核外电子的排布;故B不正确;
C、核外电子数=2+8+18+32+50+8=118,与核电荷数相等,最外层也不超过8个电子,但其次外层电子数为50,不符合次外层电子数不超过18个的规律;故C不正确;
D、核外电子数=2+8+18+32+18+8=86,与核电荷数不等,不是核电荷数为118的元素的原子核外电子的排布;故D不正确.
故选A.点评:
本题考点: 原子的定义与构成.
考点点评: 在原子的结构示意图中,质子数即核电荷数等于核外电子总数,根据原子结构中的这一关系,可判断微粒是否为原子.1年前查看全部
- 钾原子电子层为什么是2 8 8 1?而不是2 8 9?不是电子层都是2 8 18 32.什么的吗...为什么第三层就得8
钾原子电子层为什么是2 8 8 1?而不是2 8 9?不是电子层都是2 8 18 32.什么的吗...为什么第三层就得8
书上不是写第三层最大是18个电子吗? littletang1231年前1
littletang1231年前1 -
 舜耕渔夫 共回答了16个问题
舜耕渔夫 共回答了16个问题 |采纳率93.8%当作为最外层的时候一般是不能超过8个的,所谓的18个是指在非最外层的情况下所产生的.
其实这里牵扯到了电子层的能量排布问题,具体是与电子亚层的排布相关.1年前查看全部
- 已知1-18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构, 下列
已知1-18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构, 下列关系正确的是 [ ]
A.质子数c>b
B.离子的还原性Y 2- >Z -
C.氢化物的稳定性H 2 Y>HZ
D.原子半径X sukiya10081年前1
sukiya10081年前1 -
 敲错了门的爱 共回答了14个问题
敲错了门的爱 共回答了14个问题 |采纳率85.7%B1年前查看全部
- 化学竞赛题~原子结构X、Y、Z是三种主族元素.已知Xm+与Yn-具有相同的电子层结构,Zm-半径大于Yn-半径,则它们的
化学竞赛题~原子结构
X、Y、Z是三种主族元素.已知Xm+与Yn-具有相同的电子层结构,Zm-半径大于Yn-半径,则它们的原子序数由大到小的顺序是 ( )
算出来了X>Y,Z的位置怎么判断呢? bkv29381年前1
bkv29381年前1 -
 guoqiansheng1984 共回答了24个问题
guoqiansheng1984 共回答了24个问题 |采纳率91.7%Zm-半径大于Yn-半径
若 Z和Y是同周期的元素,则 Z1年前查看全部
- X,Y两种元素的原子,它们分别获得一个电子后,都能形成稀有气体原子的电子层结构,此过程中X放出的能量大于Y,下列推断不正
X,Y两种元素的原子,它们分别获得一个电子后,都能形成稀有气体原子的电子层结构,此过程中X放出的能量大于Y,下列推断不正确的是()
A、X¯的还原性强于Y¯
B、X¯的还原性弱于Y¯
C、Y的氧化性强于X
D、Y的氧化性弱于X
(我只是有一点不明白:老师上课时在黑板上分析此题时写了KLM上分别标2、4、6,他是怎么解得啊?希望大家能用这种方法解答~
246可能是关于能量的吧? 十样蛮笺1年前1
十样蛮笺1年前1 -
 齐齐yy1 共回答了13个问题
齐齐yy1 共回答了13个问题 |采纳率92.3%你们老师讲得不明白,还是听我来讲吧.我也是中学化学老师的.
X放出的能量大于Y
→X更易得电子
→非金属性:X>Y
→B、D正确.1年前查看全部
- 电子层排列规律笔记上记的:“最外层最多放8个电子”可是 Ca 2 8 8 2 这样的排布第三层为什么不可以是"9”呢?第
电子层排列规律
笔记上记的:“最外层最多放8个电子”可是 Ca 2 8 8 2 这样的排布第三层为什么不可以是"9”呢?第三层不是最外层啊...难道不能是 Ca 2 8 9 1 honlang5051年前1
honlang5051年前1 -
 爱你我学不会 共回答了21个问题
爱你我学不会 共回答了21个问题 |采纳率100%原子轨道分为s,p,d,f 轨道,s 层只能放2个电子,p层只能放6个电子.钙的电子排布应该是:1s2 1p2 2s2 2p6 3s2 3p6 4s2,字母前面的数字代表第几层轨道,字母后面的数字代表在这个轨道上的电子数.在第三层,轨道排布为3s2 3p6 ,那就是8个电子咯.1年前查看全部
大家在问
- 1举例说明下列个代数式的意义πa平方-9分之a的平方怎么举例啊?
- 2金属受热时是不是一定会产生电流
- 3英语翻译求标准的英文!越多越好 贬义的啊
- 4高速公路上的小汽车开始以30m/s的速度行驶了12km,以后降速为25m/s又行驶了15km,小汽车全程中的平均速度是多
- 5分解因式:36M的平方乘于(A+B)的平方-25M的平方乘于(A-B)的平方
- 6分解因式36m^2(a+b)^2-25m^2(a-b)^2
- 7已知A={x|x是菱形},B{x|x是矩形},求A交B?
- 8想一想,百分数与分数有什么相同点
- 9两个点电荷Q1 Q2相距R时 相互作用力为F 当它们之间距离为2R时 相互作用大小变为
- 10百分数意义与分数意义完全相同( )添对或错
- 11两个素数的和是33,这两个素数分别是多少?
- 12如何形容我和整个宇宙的关系?我在宇宙中到底有多小?
- 13两个不同质数的和是14,它们的积是33,这两个质数分别是______和______.
- 14想想在当时的条件下,早期人类为何多生活的大河流域
- 15早期人类为何多生活在大河流域
