研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入
 圣斗士-一辉2022-10-04 11:39:541条回答
圣斗士-一辉2022-10-04 11:39:541条回答试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数.(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O)

已提交,审核后显示!提交回复
共1条回复
 garylineker 共回答了14个问题
garylineker 共回答了14个问题 |采纳率92.9%- 解题思路:(1)先算出二氧化碳气体的质量,然后写出化学方程式并代入二氧化碳气体的质量计算出碱式碳酸铜的质量,最后计算铜矿中碱式碳酸铜的质量分数.
(2)根据化学方程式计算出氯化铜的质量,然后计算出反应后溶液的质量,最后计算出溶液中溶质的质量分数.(1)依题意,CO2的质量=73克+15克-85.8克=2.2克.设铜矿中碱式碳酸铜的质量为X,生成氯化铜质量为Y.
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 27044
XY 2.2克
[222/44]═[X/2.2克]
得:X=11.1克
[270/44]═[Y/2.2克]
得:Y=13.5克
∴铜矿中碱式碳酸铜的质量分数为=[11.1g/15g]×100%=74%.
(2)根据(1)的计算可知,反应后溶液的质量=85.8克-(15克-11.1克)=81.9克.
∴所得溶液中溶质的质量分数=[13.5克/81.9克]×100%═16.5%.
答:铜矿中碱式碳酸铜的质量分数为74%;所得溶液中溶质的质量分数为16.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 掌握化学方程式的计算格式和规范性,本题的易错点:反应后溶液的质量要减去矿石的杂质. - 1年前
相关推荐
- 研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入
研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),消耗73g盐酸,称得烧杯中剩余物质的质量为85.8g.
试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数.(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O) gtj4380011年前1
gtj4380011年前1 -
 一品茗茶 共回答了18个问题
一品茗茶 共回答了18个问题 |采纳率88.9%解题思路:(1)先算出二氧化碳气体的质量,然后写出化学方程式并代入二氧化碳气体的质量计算出碱式碳酸铜的质量,最后计算铜矿中碱式碳酸铜的质量分数.
(2)根据化学方程式计算出氯化铜的质量,然后计算出反应后溶液的质量,最后计算出溶液中溶质的质量分数.(1)依题意,CO2的质量=73克+15克-85.8克=2.2克.设铜矿中碱式碳酸铜的质量为X,生成氯化铜质量为Y.
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 27044
X Y 2.2克
[222/44]═[X/2.2克]
得:X=11.1克
[270/44]═[Y/2.2克]
得:Y=13.5克
∴铜矿中碱式碳酸铜的质量分数为=[11.1g/15g]×100%=74%.
(2)根据(1)的计算可知,反应后溶液的质量=85.8克-(15克-11.1克)=81.9克.
∴所得溶液中溶质的质量分数=[13.5克/81.9克]×100%═16.5%.
答:铜矿中碱式碳酸铜的质量分数为74%;所得溶液中溶质的质量分数为16.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 掌握化学方程式的计算格式和规范性,本题的易错点:反应后溶液的质量要减去矿石的杂质.1年前查看全部
- 物理研究型小论文 读物理学家的某件事或一生写一篇读后感
物理研究型小论文 读物理学家的某件事或一生写一篇读后感
论文字数不超过一百不少于五十 读后感按一篇作文写 jinmi1年前2
jinmi1年前2 -
 jordan236 共回答了11个问题
jordan236 共回答了11个问题 |采纳率72.7%介绍照相机
照相机的工作原理,概略地说是应用光学成像原理,通过照相镜头将被摄物体成像在感光材料上.下面将粗略地介绍摄影光学成像原理:人类对于光的本性的认识,光线的传播及透镜成像原理.
人类对于光的本性的认识经历了漫长而又曲折的过程.在整个18世纪中,光的微粒流理论在光学中仍占优势,人们普遍认为光是微小的粒子组成的,从点光源发出并以直线向四面八方辐射.19世纪初,以杨氏(Young)和菲涅耳(Fresnel)的著作为代表逐步发展成今天的波动光学体系.如今对光的本性认识是:光和实物一样,是物质的一种,它同时具有波的性质和微粒(量子)的性质,但从整体来说,它既不是波,也不是微粒,也不是它们的混合物.
从本质上,讲光和一般无线电波并无区别,光和电磁波一样是横波,即波的振动方向与传播方向垂直.一个发光体就是电磁波的发射源,发光体发射的电磁波向周围空间传播,和水波波动产生的波浪向四周传播相似.强度最大或最小的两点距离称为波长,用λ表示.传播一个波长所需的时间称为周期,用T表示,一个周期就是一个质点完成一次振动所需要的时间.1秒内振动的次数称为频率,用ν表示.经过1s振动传播的距离称为速度,用“v”表示.波长、频率、周期和速度之间有如下关系:
v=λ/T ,ν=1/T,v=λν
由此可见,光的波长与频率成反比.实际上光波只占整个电磁波波段的很小一部分.波长在400~700nm的电磁波能够为人眼所感觉,称为可见光,超过这个范围人眼就感觉不到了.不同波长的可见光在我们的眼睛中产生不同的颜色感觉,按照波长由长到短,光的颜色依次是红、橙、黄、绿、青、蓝、紫等色.不同波长的电磁波在真空中具有完全相同的传播速度,数值是c=300,000km/s.
下面叙述几何光学的几个基本定律——光线的传播规律:
(1)光的直线传播定律 光在均匀介质中,是沿着直线传播的,即在均匀介质中光线为一直线.光的直线传播现象在日常生活中随时随地可以见到,如物体被光照射而成影,小孔成像等.光的直线传播引出了光线这个概念.
(2)光的独立传播定律 光的传播是独立的,当不同光线从不同方向通过介质某一点时,彼此互不影响.当两支光线会聚于空间某一点时,它的作用为简单的叠加.光线的这一性质,使被拍摄物体各点的光互不影响地进入照相镜头,在成像面上成像.
(3)光的反射定律 当光传播到两种不同介质的分界面时,就会改变传播方向,发生光的反射.光的反射定律指出: ①入射光线、反射光线和分界面上光投射点的法线在同一平面内,人射光线与反射光线分别位于法线的两侧.
②人射角和反射角相等.入射光线与法线N的夹角记为入射角,用i表示;反射光线与法线N的夹角记为反射角,用α表示.则有i=α.光的反射现象还具有可逆性,假如光线逆着原来反射光线方向入射到界面上,那么它将逆着原来入射光线的方向反射出去.随着界面的不同,反射又可分为定向反射和漫反射.从一个方向入射到光亮、平整的镜子上的光线,入射点都落到同一平面上,其反射都向着同一方向,则称为定向反射.当光从一个方向投射到粗糙表面上时(如毛玻璃面等),由于粗糙面可以看成由许多角度不同的小平面组成,光线便从各个不同的方向反射出去,称为漫反射.但需注意在漫反射现象中,就每一条光线而言都还是遵循反射定律的.
光的反射,在照相术中起着相当重要的作用.例如人本身并不发光,但当光线从各个角度照射到人身上后,光线便可从各个角度有所反射.我们常利用反射光进行拍照,就是遵循光的反射定律.1年前查看全部
- 常见的函数图像我要写数学研究型报告,题目是生活中的函数模型,帮我画一下函数图像,二次,一次,反比例,正比例……
 我以被你宠坏1年前2
我以被你宠坏1年前2 -
 annking 共回答了17个问题
annking 共回答了17个问题 |采纳率100%1年前查看全部
- 成语的结构语文课 研究型活动,让研究 成语的来源和结构,
 杨qq1年前2
杨qq1年前2 -
 jacky4102 共回答了16个问题
jacky4102 共回答了16个问题 |采纳率81.3%成语简介
成语,chengyu,idioms(周祖谟)
语言词汇中的一部分定型的词组或短句。汉语成语有固定的结构形式和固定的说法,表示一定的意义,在语句中是作为一个整体来应用的。例如:
言简意赅 勇往直前 相反相成 实事求是
诲人不倦 经年累月 千钧一发 缘木求鱼
削足适履 七手八脚 细大不捐 坐井观天
成语有很大一部分是从古代相承沿用下来的,在用词方面往往不同于现代汉语。其中有古书上的成句,也有从古人文章中压缩而成的词组,还有来自人民口里常说的习用语。有些意义从字面上可以理解,有些从字面上就不易理解,特别是典故性的。如“汗牛充栋”、“虎踞龙蟠”、“东山再起”、“草木皆兵”之类,在汉语成语里占有一定的比例。汉语历史悠久,成语特别多,这也是汉语的一个特点。
成语是一种现成的话,跟习用语、谚语相近,但是也略有区别。最主要的一点是习用语和谚语是口语性质的,成语大都出自书面,属于文语性质的。其次在语言形式上,成语几乎都是约定俗成的四字结构,字面不能随意更换,而习用语和谚语总是松散一些,可多可少,不限于四个字。例如“快刀斩乱麻”、“九牛二虎之力”、“驴唇不对马嘴”、“前怕狼,后怕虎”,这是常说的习用语;“百闻不如一见”、“真金不怕火炼”、“有志者事竟成”、“路遥知马力,日久见人心”,这是一些经验之谈,表示一个完整的意思,属于谚语一类。成语跟习用语、谚语是不一样的。
成语大都有一定的出处。如“狐假虎威”出于《战国策·楚策》,“鹬蚌相争”出于《燕策》,“画蛇添足”出于《齐策》,“刻舟求剑”出于《吕氏春秋·察今》,“自相矛盾”出于《韩非子·难势》,都是古代的寓言。如“完璧归赵”出于《史记·廉颇蔺相如列传》,“破釜沉舟”出于《史记·项羽本纪》,“草木皆兵”出于《晋书·苻坚载记》,“一箭双雕”出于《北史·长孙晟传》,“口蜜腹剑”出于《唐书·李林甫传》,都是历史上的故事。至于截取古书的文句用为四字成语的更为普遍。如“有条不紊”取自《尚书·盘庚》“若纲在纲,有条而不紊”,“举一反三”取自《论语·述而》“举一隅,不以三隅反,则不复也”,“痛心疾首”取自《左传》成公十三年“斯是用痛心疾首,昵就寡人”,“分庭抗礼”取自《庄子·渔父》“万乘之主,千乘之君,未尝不分庭抗礼”,“奴颜婢膝”取自晋代葛洪《抱朴子·交际》“以岳峙独立者为涩吝疏拙,以奴颜婢膝者为晓解当世”, “胸有成竹”取自宋代苏轼《文与可画筼筜谷偃竹记》“画竹必先得成竹于胸中”。诸如此类,不胜枚举。其他采用古人文章成句的也为数很多。如“忧心忡忡”出自《诗经·召南·草虫》,“外强中干”出自《左传》僖公十五年,“以逸待劳”出自《孙子·军争》,“水落石出”出自苏轼《后赤壁赋》,“萍水相逢”出自唐代王勃《滕王阁序》,“牢不可破”出自唐代韩愈《平淮西碑》。
在人民口里常说的一些四字习用语也可以归入成语里来。如“咬文嚼字”、“拖泥带水”、“阳奉阴违”、“不三不四”、“心直口快”之类,与成语的结构相同。在成语中也有些是接受外来文化而出现的。如“天花乱坠”、“当头棒喝”、“不可思议”、“不二法门”都是。
成语一般都是四字格式,不是四字的较少。如“五十步笑百步”、“ 欲速则不达”、“ 醉翁之意不在酒”。成语一般所以用四个字,这与汉语本身句法结构和古汉语以单音词为主有关系。
四字的语法结构主要有以下几种形式:
主谓式:名副其实、盛气凌人、杞人忧天、胸有成竹;
动宾式:好为人师、莫名其妙、视为畏途;
联合主谓式:天翻地覆、水落石出、手舞足蹈;
联合动宾式:知己知彼、养精蓄锐、防微杜渐、发号施令;
联合名词式:粗心大意、南辕北辙、镜花水月;
联合动词式:突飞猛进、勇往直前;
动补式:逍遥法外、问道于盲;
兼语式:以邻为壑、令人生畏。
成语的结构是多种多样的,上面只是简单举例的性质。成语在语言表达中有生动简洁、 形象鲜明的作用。它的本身就有不少比喻和对比以及加重的措辞方法。如“阳奉阴违”、“外强中干”、“五光十色”、“一知半解”、“七嘴八舌”、“患得患失”、“不寒而栗”等各有妙用。所以文学家对成语的运用都非常注意。1年前查看全部
- 研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入
研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),称得烧杯中剩余物质的质量为85.8g.试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数.
(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+ CO2↑+3H2O) wzx1211年前1
wzx1211年前1 -
 zdzjiangsu 共回答了11个问题
zdzjiangsu 共回答了11个问题 |采纳率81.8%告诉你方法:铜矿中碱式碳酸铜[Cu2(OH)2CO3与稀盐酸反应(恰好完全)你可以根据化学方程求出Cu2(OH)2CO3的质量来(剩余物质的质量为8.58g.即2CuCl2),在去除以15g就得第一问答案,第二问也就是变相在求生成的水的质量,你用求出的CuCl2的质量去除以CuCl2和3H2O的质量就可以了(杯中剩余物质的质量为85.8g. 你确定不是8.85g)1年前查看全部
- (2008•南京一模)某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200mL&
(2008•南京一模)某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.
(1)a 的取值范围是______.
(2)向反应后所得溶液中逐渐加入4mol/L的NaOH溶液,当沉淀质量达到最大值时,加入的NaOH溶液的体积是______mL,沉淀的最大质量是______g.(用含a 的代数式表示)
(3)继续加入NaOH溶液至沉淀不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数(写出计算过程). hxfdir1年前1
hxfdir1年前1 -
 wuduoling 共回答了24个问题
wuduoling 共回答了24个问题 |采纳率100%解题思路:(1)根据极限法求出极限点;
(2)根据溶液中的HCl、MgCl2、AlCl3与碱反应求出NaOH的物质的量;
(4)根据合金当中Al元素的质量与MgO中O元素的质量相等,求出Al质量分数;(1)根据氢气体积,可以确定氢气物质的量为[3.36L/22.4L/mol]=0.15mol,则反应的氢离子的物质的量为0.15×2=0.3mol,
HCl溶液中HCl物质的量为0.2L×5mol/L=1mol,则盐酸未完全反应.
根据Mg和Al与盐酸的反应可知,当氢气的量固定时,合金全为Mg时合金质量最大,当合金全为Al时合金质量最
Mg~H2 2Al~3H2
0.15mol 0.15mol 0.1mol0.15mol
所以两种状况下合金质量分别为:Mg:0.15mol×24g/mol=3.6g,Al:0.1mol×24g/mol=2.7g,
故答案为:2.7<a<3.6;
(2)根据反应过程我们可以发现
Mg~H2~2HCl~Mg2+~2NaOH~Mg(OH)2
Al~[3/2]H2~3HCl~Al3+~3NaOH~Al(OH)3
HCl(过量)~NaOH,故此不难发现,新引入的NaOH的物质的量与酸的物质的量相等,
酸的物质的量为0.2L×5mol/L=1mol,故NaOH的物质的量亦为1mol,NaOH溶液体积为[1mol/4mol/L]=0.25L=250mL,
由于沉淀当中只引入了OH-,故沉淀质量应为原合金质量a加上新引入的OH-的质量,而引入的OH-的物质的量为氢气物质的量的2倍,
所以沉淀的质量为:[3.36L/22.4L/mol]×2×17g/mol+ag=(a+5.1)g,
故答案为:250;(a+5.1)g;
(3)这一问我们依然需要通过宏观物质变化思考:易知最终物质为MgO,而最终MgO的质量与最初合金的质量相等,故可知合金当中Al元素的质量与MgO中O元素的质量相等,
所以合金当中Mg与Al的质量比即为MgO中Mg与O质量比相等,而MgO当中两元素质量比即为原子量之比,故合金当中Al质量分数为:w(Al)=[16/(24+16)]×100%=40%
答:原混合物中铝的质量分数为40%.点评:
本题考点: 铝的化学性质;镁的化学性质;有关混合物反应的计算;有关范围讨论题的计算.
考点点评: 在问题(2)中很容易忘记过量的HCl,从而导致错误的解答,而问题(3)若采用常规方法则难以解答,采用了守恒法可以起到事倍功半的效果.1年前查看全部
- 某省盛产石灰石,其中含有的杂质为二氧化硅(不溶于水,高温下难以分解的酸性氧化物).某中学初三化学研究型小组的同学为了测定
某省盛产石灰石,其中含有的杂质为二氧化硅(不溶于水,高温下难以分解的酸性氧化物).某中学初三化学研究型小组的同学为了测定某矿山石灰石的纯度,取2.0克该矿石石灰石样品,将20.0克盐酸平均分成四份,分四次加入到样品中,充分反映后测定剩余固体的质量,数据见下表:
次数 1 2 3 4
加入盐酸质量/g 5.0 5.0 5.0 5.0
剩余固体质量/g 1.3 0.6 0.2 0.2
试求:(1)2.0g石灰石样品中杂质的质量.
(2)石灰石样品中碳酸钙的质量分数.
(3)加入的盐酸中溶质的质量分数是多少?
要详细的过程和讲解为什么这样做,还有最好讲一讲怎么想的,什么依据,就是那个固体剩余物包括什么,包括剩余物和生成物吗?还有为什么剩余固体质量到0.2克就停了,在反映完后石灰石中碳酸钙没有了、盐酸还有剩余是不是?
先谢过各位了,尽量准确些,不要有错误哦~ wangjbroger1年前1
wangjbroger1年前1 -
 hxqlxg123 共回答了19个问题
hxqlxg123 共回答了19个问题 |采纳率94.7%样品中有碳酸钙和二氧化硅,碳酸钙能与盐酸反应,而二氧化硅不与盐酸反应,故当反应不再进行,也就是固体质量不再发生改变时,此时的固体就是二氧化硅的质量.
第1次,固体由2克变为1.3克,反应掉的碳酸钙质量为0.7克,以此类推,第2次应变为0.6克,事实上如此,第3次应变为0,但事实上第3次没有这样变,说明此时碳酸钙已反应完,而盐酸没有反应完.
(1)2.0g石灰石样品中杂质的质量.0.2克,就是没有反应完的固体质量.
(2)石灰石样品中碳酸钙的质量分数.
(2-0.2)/2=90%
(3)
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
2-1.3 X
100:0.7=73:X
X= 0.511克
加入的盐酸中溶质的质量分数是:0.511/5=10.22%
此处只有第1次反应的数据,即5克盐酸恰好能与0.7克碳酸钙完全反应.1年前查看全部
- 市场上有一种在蚊帐内使用的小型直流电动机电风扇.某物理研究型学习小组想测定电风扇正常运行时的机械功率,于是找到了一台这样
市场上有一种在蚊帐内使用的小型直流电动机电风扇.某物理研究型学习小组想测定电风扇正常运行时的机械功率,于是找到了一台这样的电风扇并从铭牌上读出了额定电压U,但其它字迹不清楚.该小组成员取出电池,并从电风扇连接电池的正、负两极各接出一条引线.提供的器材有电流表、电压表、滑动变阻器、备用电池若干节、电键、若干导线、固定电池的电池盒.

(1)测量时,选择的电路图比较合理的是______图(选填“图1”或“图2”).
(2)该小组进行了如下的实验步骤:
(A)按事先设计的电路连接各元件,并将变阻器的滑动片移动到最左端;
(B)合上开关,将滑动片从最左端开始缓慢向右移动,使电压表和电流表都有明显的示数,但电风扇并未转动,读出此时电压表和电流表的读数分别为U0、I0;
(C)…;请补写步骤(C)的实验操作过程:______.
(D)用测得的物理量表示电动机M正常运转时输出的机械功率P输出=IU-I2
.U0 I0 IU-I2.
.U0 I0
(3)该小组同学找了甲、乙两个不同规格的电风扇继续进行测量,用伏安法分别测出甲、乙两个电风扇的伏安特性曲线如图所示.若他们将甲、乙两个电风扇串连接在6V的恒压电源两端,则甲的实际功率为______W,乙的实际功率为______ W.
(要求保留作图求解的痕迹) 2006skywalker1年前0
2006skywalker1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一同学在研究型学习中准备研究高中运动员的100米赛跑,他将100m跑的模型建立如下:第一次,运动员听到发令枪响后,反应0
一同学在研究型学习中准备研究高中运动员的100米赛跑,他将100m跑的模型建立如下:第一次,运动员听到发令枪响后,反应0.30s起跑,然后以1.50m/s 2 的加速度作匀加速直线运动,运动员达到9.00m/s的速度后,匀速跑了73.00m后作匀减速直线运动,匀减速时的加速度为1.00m/s 2 ;第二次,运动员听到发令枪响后,仍然反应0.30s起跑,然后仍然以1.50m/s 2 的加速度作匀加速直线运动,运动员达到12.00m/s的速度后,匀速跑了47.28m后作匀减速直线运动,匀减速时的加速度为1.00m/s 2 。请画出第一次运动员运动的v-t图,并通过计算比较在此同学的运动模型中,第几次的跑步成绩更好?
 一成不变1年前0
一成不变1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入
研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O)(假如铜矿中的杂质不与稀盐酸反应,也不溶于水),称得烧杯中剩余物质的质量为85.8g.试求:
(1)铜矿中碱式碳酸铜的质量分数;
(2)所得溶液中溶质的质量分数. lucassocct1年前1
lucassocct1年前1 -
 xmh1983 共回答了17个问题
xmh1983 共回答了17个问题 |采纳率76.5%解题思路:(1)先算出二氧化碳气体的质量,然后写出化学方程式并代入二氧化碳气体的质量计算出碱式碳酸铜的质量,最后计算铜矿中碱式碳酸铜的质量分数.
(2)根据化学方程式计算出氯化铜的质量,然后计算出反应后溶液的质量,最后计算出溶液中溶质的质量分数.依题意,生成CO2的质量为:73g+15g-85.8g=2.2g
设铜矿中碱式碳酸铜的质量为x,生成氯化铜质量为y
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 27044
X y2.2g
[222/44=
x
2.2g]
x=11.1g
[270/44=
y
2.2g]
y=13.5g
(1)铜矿中碱式碳酸铜的质量分数为:[11.1g/15g]×100%=74%
(2)所得溶液中溶质的质量分数为:
13.5g
85.5g+(15g−11.1g)×100%=16.5%
答案:
(1)铜矿中碱式碳酸铜的质量分数为74%
(2)所得溶液中溶质的质量分数为16.5%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 掌握化学方程式的计算格式和规范性,本题的易错点:反应后溶液的质量要减去矿石的杂质.1年前查看全部
- 研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu 2 (OH) 2 CO 3 ]的质量分数.现称取15g该铜矿样品放入烧杯中
研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu 2 (OH) 2 CO 3 ]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),消耗73g盐酸,称得烧杯中剩余物质的质量为85.8g.
试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数.(反应的化学方程式为:Cu 2 (OH) 2 CO 3 +4HCl=2CuCl 2 +CO 2 ↑+3H 2 O) dd1年前1
dd1年前1 -
 Adam-2000 共回答了17个问题
Adam-2000 共回答了17个问题 |采纳率94.1%(1)依题意,CO 2 的质量=73克+15克-85.8克=2.2克.设铜矿中碱式碳酸铜的质量为X,生成氯化铜质量为Y.
Cu 2 (OH) 2 CO 3 +4HCl=2CuCl 2 +CO 2 ↑+3H 2 O
222 27044
X Y 2.2克
222
44 ═
X
2.2克
得:X=11.1克
270
44 ═
Y
2.2克
得:Y=13.5克
∴铜矿中碱式碳酸铜的质量分数为=
11.1g
15g ×100%=74%.
(2)根据(1)的计算可知,反应后溶液的质量=85.8克-(15克-11.1克)=81.9克.
∴所得溶液中溶质的质量分数=
13.5克
81.9克 ×100%═16.5%.
答:铜矿中碱式碳酸铜的质量分数为74%;所得溶液中溶质的质量分数为16.5%.1年前查看全部
- 某中学研究型进修小组举办《红楼梦》读书交流会。主题是“《红楼梦》诗词鉴赏”。请为版主写一则开场白。要求:①紧扣主题;②表
某中学研究型进修小组举办《红楼梦》读书交流会。主题是“《红楼梦》诗词鉴赏”。请为版主写一则开场白。要求:①紧扣主题;②表达得体,富有文采;③不写称号语、问候语;④不跨越60字。(4分)
 dd3986dd1年前1
dd3986dd1年前1 -
 启个吊名真麻烦 共回答了21个问题
启个吊名真麻烦 共回答了21个问题 |采纳率95.2%⑴、“满纸荒唐言”,“谁解其中味”,绝世奇书《红楼梦》中的诗词也是难得的艺术瑰宝。让我们走进宝山,去欣赏他们的璀璨与绚丽吧。
⑵、“好风凭借力,送我上青云”这是宝钗的思想写照,“一年三百六十日,风刀霜剑严相逼”这是黛玉的生活环境,《红楼梦》诗词文质兼美。今天我们将对它进行专题鉴赏,希望同窗们积极发言。
1年前查看全部
- 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 mL
某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 mL 5 mol/L HCl溶液中,共收集到标准状况下的氢气3.36 L。
(1)a 的取值范围是_______。
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液,当沉淀质量达到最大值时,加入的NaOH溶液的体积是_____mL,沉淀的最大质量是______g。(用含a 的代数式表示)
(3)继续加入NaOH溶液至沉淀不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数(写出计算过程)。 zhh04181年前1
zhh04181年前1 -
 彭勃支持张亚飞 共回答了22个问题
彭勃支持张亚飞 共回答了22个问题 |采纳率95.5%(1)2.7<a<3.6
(2)250 ;(a+5.1) g
(3)w(Al)=[16/(24+16)]×100%=40%1年前查看全部
- 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200mL 5mol/L
某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.
(1)a 的取值范围是______.
(2)向反应后所得溶液中逐渐加入4mol/L的NaOH溶液,当沉淀质量达到最大值时,加入的NaOH溶液的体积是______mL,沉淀的最大质量是______g.(用含a 的代数式表示)
(3)继续加入NaOH溶液至沉淀不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数(写出计算过程). 悠悠7771年前1
悠悠7771年前1 -
 小擦皮 共回答了15个问题
小擦皮 共回答了15个问题 |采纳率100%(1)根据氢气体积,可以确定氢气物质的量为
3.36L
22.4L/mol =0.15mol,则反应的氢离子的物质的量为0.15×2=0.3mol,
HCl溶液中HCl物质的量为0.2L×5mol/L=1mol,则盐酸未完全反应.
根据Mg和Al与盐酸的反应可知,当氢气的量固定时,合金全为Mg时合金质量最大,当合金全为Al时合金质量最
Mg~H 2 2Al~3H 2
0.15mol 0.15mol 0.1mol0.15mol
所以两种状况下合金质量分别为:Mg:0.15mol×24g/mol=3.6g,Al:0.1mol×24g/mol=2.7g,
故答案为:2.7<a<3.6;
(2)根据反应过程我们可以发现
Mg~H 2 ~2HClH~Mg 2+ ~2NaOH~Mg(OH) 2
Al~
3
2 H 2 ~3HCl~Al 3+ ~3NaOH~Al(OH) 3
HCl(过量)~NaOH,故此不难发现,新引入的NaOH的物质的量与酸的物质的量相等,
酸的物质的量为0.2L×5mol/L=1mol,故NaOH的物质的量亦为1mol,NaOH溶液体积为
1mol
4mol/L =0.25L=250mL,
由于沉淀当中只引入了OH - ,故沉淀质量应为原合金质量a加上新引入的OH - 的质量,而引入的OH - 的物质的量为氢气物质的量的2倍,
所以沉淀的质量为:
3.36L
22.4L/mol ×2×17g/mol+ag=(a+5.1)g,
故答案为:250;(a+5.1)g;
(3)这一问我们依然需要通过宏观物质变化思考:易知最终物质为MgO,而最终MgO的质量与最初合金的质量相等,故可知合金当中Al元素的质量与MgO中O元素的质量相等,
所以合金当中Mg与Al的质量比即为MgO中Mg与O质量比相等,而MgO当中两元素质量比即为原子量之比,故合金当中Al质量分数为:w(Al)=[16/(24+16)]×100%=40%
答:原混合物中铝的质量分数为40%.1年前查看全部
- (2010•孝感)研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入
(2010•孝感)研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),消耗73g盐酸,称得烧杯中剩余物质的质量为85.8g.
试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数.(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O) 写在你睡以后1年前1
写在你睡以后1年前1 -
 香雪海9333 共回答了27个问题
香雪海9333 共回答了27个问题 |采纳率88.9%解题思路:(1)先算出二氧化碳气体的质量,然后写出化学方程式并代入二氧化碳气体的质量计算出碱式碳酸铜的质量,最后计算铜矿中碱式碳酸铜的质量分数.
(2)根据化学方程式计算出氯化铜的质量,然后计算出反应后溶液的质量,最后计算出溶液中溶质的质量分数.(1)依题意,CO2的质量=73克+15克-85.8克=2.2克.设铜矿中碱式碳酸铜的质量为X,生成氯化铜质量为Y.
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 27044
X Y 2.2克
[222/44]═[X/2.2克]
得:X=11.1克
[270/44]═[Y/2.2克]
得:Y=13.5克
∴铜矿中碱式碳酸铜的质量分数为=[11.1g/15g]×100%=74%.
(2)根据(1)的计算可知,反应后溶液的质量=85.8克-(15克-11.1克)=81.9克.
∴所得溶液中溶质的质量分数=[13.5克/81.9克]×100%═16.5%.
答:铜矿中碱式碳酸铜的质量分数为74%;所得溶液中溶质的质量分数为16.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 掌握化学方程式的计算格式和规范性,本题的易错点:反应后溶液的质量要减去矿石的杂质.1年前查看全部
- 初中地理研究型报告怎么写三千字,生活中的
 冉西梁1年前1
冉西梁1年前1 -
 hexiansheng 共回答了17个问题
hexiansheng 共回答了17个问题 |采纳率82.4%论文:题目,关键词,内容章要,正文,标示,参考文献.
首先确定主题,为什么研究,再来是正文可以写你们研究的过程和发现,其中最好有一些参考文献或参考资料,最后是总结!大致就是这样了!1年前查看全部
- 某研究型小组的同学前往当地的石灰石矿区进行调查,他们取得了若干块石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的
某研究型小组的同学前往当地的石灰石矿区进行调查,他们取得了若干块石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,40g稀盐酸分四次加入,测量过程所得数据见下表【杂质不溶于水.不与盐酸反应】
序号 第一次 第二次 第三次 第四次
加入稀盐酸质量(g) 10 10 10 10
剩余固体质量(g) 5.5 m 1.2 1.2
计算:
1.8g石灰石样品中杂质有( )g
2.样品中的碳酸钙质量分数是( )
3.上表中m的值应为( )
4.要得到280kg的CaO,需要质量分数为百分之80的石灰石多少千克?
【我要详细的解题思路 最好在说明下 :(剩余固体质量)是什么意思】 xy123xyhi1年前1
xy123xyhi1年前1 -
 唧唧庆 共回答了24个问题
唧唧庆 共回答了24个问题 |采纳率87.5%1 和2 问简单
第三次和第四次加盐酸后,剩余固体质量不变,那么剩余的就是不和盐酸反应的杂质,所以含杂质为1.2g 那么纯净的CaCO3质量为8-1.2=6.8g
所以质量分数为6.8/8=85%
第三问 我们分析 第一次加10g盐酸,溶解了2.5g,就是说反应掉了2.5gCaCO3
那么溶解掉全部的6.8g,需要盐酸的质量为2.5/10=6.8/X X=27.2g 也就是说要全部溶解6.8gCaCO3需要盐酸27.2g 而第二次加的盐酸总共只有20g,所以溶解的碳酸钙为5g,那么剩余的质量为8-5=3g 也就是m值为31年前查看全部
- 研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入
研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),称得烧杯中剩余物质的质量为85.8g.试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数.
(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+ CO2↑+3H2O)
这个的答案是:
依题意,生成CO2的质量为:73g+15g-85.8g=2.2g(1分)
设铜矿中碱式碳酸铜的质量为x,生成氯化铜质量为y(0.
Cu2(OH)2CO3+4HCl=2CuCl2+ CO2↑+3H2O
222 270 44
X y 2.2g
= x=11.1g(1分)
= y=13.5g(1分)
(1)铜矿中碱式碳酸铜的质量分数为:×100%=74%(1分)
(2)所得溶液中溶质的质量分数为:×100%=16.5%(1分)
答:铜矿中碱式碳酸铜的质量分数为74%,所得溶液中溶质的质量分数为16.5%(0.
可是原题里面没有告诉你盐酸滴进去的质量啊是不是题目漏了盐酸的质量? 阿ty诺1年前1
阿ty诺1年前1 -
 王丽虎 共回答了19个问题
王丽虎 共回答了19个问题 |采纳率94.7%你说的对,原题里面是漏了盐酸的质量.从答案可以看出,盐酸的质量受73克.
依题意,生成CO2的质量为:73g+15g-85.8g=2.2g1年前查看全部
- 某中学研究型学习小组举办《红楼梦》读书交流会。主题是“《红楼梦》诗词鉴赏”。请为主持人写一则开场白。要求:①紧扣主题
某中学研究型学习小组举办《红楼梦》读书交流会。主题是“《红楼梦》诗词鉴赏”。请为主持人写一则开场白。要求:①紧扣主题;②表达得体,富有文采;③不写称呼语、问候语;④不超过60字。
答:____________________________________________________ caffey1年前1
caffey1年前1 -
 momark 共回答了21个问题
momark 共回答了21个问题 |采纳率100%(示例)“满纸荒唐言”“谁解其中味”,绝世奇书《红楼梦》中的诗词也是难得的艺术瑰宝。让我们走进宝山,去欣赏他们的璀璨与绚丽吧。(答案不唯一)1年前查看全部
- 某研究型学习小组利用下列装置进行气体的制取,请分析并填空.
某研究型学习小组利用下列装置进行气体的制取,请分析并填空.
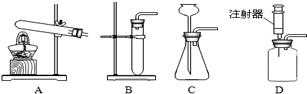
(1)实验室用高锰酸钾来制取氧气,应选择发生装置为______ (填字母),称若用该装置制取氧气时,发现水槽中的水染成了紫红色,其原因可能是______.
(2)老师提出用碳酸钠粉末与稀盐酸制取二氧化碳,其反应的化学方程式为______
为了完成该实验,有四位同学组装了以上发生装置,你认为最合适的一套装置是______(填序号),该装置的最大优点是______. 无双12341年前1
无双12341年前1 -
 lppqq 共回答了21个问题
lppqq 共回答了21个问题 |采纳率85.7%解题思路:(1)从用高锰酸钾的方法制取氧气,由于反应需要加热,所以发生装置应选A;实验室用加热分解高锰酸钾的方法制取氧气时,由于高锰酸钾粉末会随着氧气流进入导管继续进入水槽,使水槽中的水变红,为避免这一现象的发生,往往会要试管口放一棉花团去分析解答;
(2)从用碳酸钠粉末与稀盐酸反应生成二氧化碳、水和氯化钠,由于反应不需加热,故发生装置不能选A;二者接触就会发生反应,且反应速率过快,生成的二氧化碳不易收集,故发生装置不能选C和B;可选D,装置D的优点是,可以通过注射器控制加入稀盐酸的速度来达到控制产生二氧化碳速度的目的去分析解答;(1)用高锰酸钾的方法制取氧气,由于反应需要加热,所以发生装置应选A;实验室用加热分解高锰酸钾的方法制取氧气时,由于高锰酸钾粉末会随着氧气流进入导管继续进入水槽,使水槽中的水变红,为避免这一现象的发生,往往会要试管口放一棉花团.故答案为:A 试管口没放棉花团;
(2)用碳酸钠粉末与稀盐酸反应生成二氧化碳、水和氯化钠,其反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;由于反应不需加热,故发生装置不能选A;二者接触就会发生反应,且反应速率过快,生成的二氧化碳不易收集,故发生装置不能选C和B;可选D,装置D的优点是,可以通过注射器控制加入稀盐酸的速度来达到控制产生二氧化碳速度的目的;故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑ D 控制反应的发生与停止.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;制取氧气的操作步骤和注意点;二氧化碳的实验室制法;书写化学方程式、文字表达式、电离方程式.
考点点评: 牢记固固加热制气及固液反应制气的装置的特点.1年前查看全部
大家在问
- 1英语论文中标点符号之后是不是需要空格啊
- 2老师在黑板上写出三个算式:52-32=8×2,92-72=8×4,152-32=8×27,王华接着又写了两个具有同样规律
- 3在△ABC中(AB-3AC)⊥CB,则角A的最大值为 都是向量啊
- 4农杆菌侵染植物细胞,进去的是质粒还是农杆菌
- 5写出所给副词的比较级和最高级
- 6以下这两种机械运动简图分别什么意思,有什么区别?
- 7这两道题用递等式计算,能简便的要简便
- 8"disagree"和“against”在句子中怎么用啊.
- 9形容一个人长时间友好耐心的为他人解决某个问题,用哪个成语来形容
- 10当我进来的时候Jane正在读报纸.英语翻译.
- 11根据溶解度的不同如何给物质分类?
- 12对于等差数列除以等比数列前n项和的求解
- 13一个正方形的长是9厘米,宽比长短3厘米.长方形的面积是______平方厘米.
- 14阅读理解. The tea gardens in Sri Lanka
- 15一部5卷的文集按任意次序放到书架上去,试求下列概率: