镀铜时为什么不用石墨作阳极
 要的是什么2022-10-04 11:39:541条回答
要的是什么2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 xuboolang 共回答了24个问题
xuboolang 共回答了24个问题 |采纳率95.8%- 答:镀铜现行的有两种方法:一是用不溶性阳极,一般用不锈钢,二是用可溶性阳极,即用铜.用可溶性阳极不用频繁的添加铜的化合物(如硫酸铜)简单方便,在某些场合要用到不溶性阳极,用石墨也可以,但是与不锈钢比,石墨电极在电镀过程中容易损坏,要更换,而经过加工后不易损坏的石墨阳极在电导率、溶出率等都存在这样那样的问题,还是不如用不锈钢来得方便.
- 1年前
相关推荐
- 下列说法正确的是 ( ) A.钢铁发生电化腐蚀的正极反应式:Fe-2e - ="=" Fe 2 + B.为实现铁上镀铜
下列说法正确的是 ( )
A.钢铁发生电化腐蚀的正极反应式:Fe-2e - ="=" Fe 2 + B.为实现铁上镀铜,可让铁做阳极. C.粗铜精炼时,与电源正极相连的是纯铜 D.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl - -2e - ==Cl 2 ↑  bosswood1年前1
bosswood1年前1 -
 yylhit1 共回答了19个问题
yylhit1 共回答了19个问题 |采纳率68.4%D
A错误,原电池正极是得电子的反应。
B错误,铁上镀铜,铜应做阳极。
C错误,粗铜精炼时,与电源正极相连的是电解池阳极,材料应是粗铜。
D正确。阳极失电子,氯离子失电子能力比氢氧根离子强,所以由氯离子失去电子变成氯气。1年前查看全部
- 二氧化碳气体保护焊焊丝上的镀铜在焊接中起什么作用?
 salina8001年前1
salina8001年前1 -
 wqingii 共回答了25个问题
wqingii 共回答了25个问题 |采纳率80%镀铜层在焊接中起的作用不大,严格来说起的是负面作用,会增加焊缝中铜的含量,不利于焊缝的机械性能保证,但一般不会有太大影响.它的主要作用还是在焊丝的存放过程中防止表面锈蚀的,以胶增加焊接时的导电性能.1年前查看全部
- 英语翻译最后测试分析织物用纳米包覆后的空心微珠进行涂层整理后的红外光谱,发现前处理后包覆纳米TiO2,镀银、二次镀铜后包
英语翻译
最后测试分析织物用纳米包覆后的空心微珠进行涂层整理后的红外光谱,发现前处理后包覆纳米TiO2,镀银、二次镀铜后包覆纳米铁氧体后的微珠有良好的红外反射率,可运用于防红外纺织品;包覆纳米TiO2、镀银后包覆纳米ZnO-TiO2的微珠在近红外伪装运用方面有其独特的优势. feelingkid1年前1
feelingkid1年前1 -
 偶月320 共回答了11个问题
偶月320 共回答了11个问题 |采纳率90.9%Finally tests the analysis fabric to carry on the coating afternanometer gable hollow micro bead to reorganize after the infraredspectrum,after before discovered processes gable nanometer TiO2,after the silver-plating,two copper-plating the gable nanometerferrites micro bead has the good infrared index of reflection,mayutilize to guards against the infrared textile; After gable nanometerTiO2,the silver-plating the gable nanometer ZnO-TiO2 micro bead hasits unique superiority in the near-infrared camouflage using theaspect.1年前查看全部
- 下列分别利用了金属的哪些性质?(1)用铜制导线 ;(2)门把手镀铜 ;(3)用黄金制作首饰 ;(4)用钨丝作灯丝 ;(5
下列分别利用了金属的哪些性质?
(1)用铜制导线 ;(2)门把手镀铜 ;(3)用黄金制作首饰 ;(4)用钨丝作灯丝 ;(5)铁锭可以制铁丝 ;(6)铝合金制作门窗 .(7)铝加工成铝箔作为包装材料 ;(8)水银用在温度计中
还有..
假黄金和稀硫酸反应的化学方程式是什么? 爱情oo1年前2
爱情oo1年前2 -
 e_coliR1 共回答了19个问题
e_coliR1 共回答了19个问题 |采纳率100%1导电性,
2耐腐蚀性,
3稳定性
4熔点高
5延展性
6稳定性
7延展性
8膨胀性(热胀冷缩)
利用假黄金中的金属的化学性质,比如锌.
Zn+H2SO4=H2+ZnSO41年前查看全部
- 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
(1)铸造以上硬币用到的材料都是______(填“非金属材料”或“金属材料”).
(2)以上硬币中涉及到Fe、Cu、Al、Ni(镍),已知镍能够发生如下反应:Ni+H 2 SO 4 ═NiSO 4 +H 2 ↑Fe+NiCl 2 ═Ni+FeCl 2 ,四种金属的活动性有强到弱的顺序为______(用元素符号表示).
(3)铁制品易生锈,写出一种防止其生锈的方法:______. 吴人飞飞1年前1
吴人飞飞1年前1 -
 忧郁的zippo 共回答了23个问题
忧郁的zippo 共回答了23个问题 |采纳率82.6%(1)钢芯镀镍、钢芯镀铜、铝合金或不锈钢都是属于金属材料,故填:金属材料;
(2)已知在金属活动性顺序中Al>Fe>H>Cu,根据Ni+H 2 SO 4 ═NiSO 4 +H 2 ↑可知,Ni>H,根据Fe+NiCl 2 ═Ni+FeCl 2 可知,Fe>Ni,故这四种金属的活动性顺序为Al>Fe>Ni>Cu,故填:
Al、Fe、Ni、Cu;
(3)铁在有水喝氧气并存时易生锈,防锈就是使铁与水货氧气隔绝,可以在铁制品表面喷漆,以防止生锈,故填:在铁制品表面喷漆.1年前查看全部
- 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
(1)铸造以上硬币用到的材料都是______(填“合成材料”或“金属材料”).
(2)选择铸造硬币的材料不需要考虑的因素是______
(填序号).
A.金属的导电性
B.金属的耐腐蚀性
C.金属的硬度
D.金属价格与硬币面值的吻合度. haorenchangming1年前1
haorenchangming1年前1 -
 小林15 共回答了29个问题
小林15 共回答了29个问题 |采纳率93.1%解题思路:(1)依据硬币的组成成分分析材料的种类;
(2)根据硬币的流通特点分析硬币应具有的特点要求,特别是其耐腐蚀、硬度、及价值的相关因素(1)根据题干可知硬币的组成成分都是金属的合金,所以铸造以上硬币用到的材料都是金属材料;
(2)根据硬币的流通特点可知:铸造出的硬币要有较强的耐腐蚀性、硬度较大且硬币价值与面值的吻合度要接近,而金属的导电性不是铸造硬币所考虑的因素.
故答案为:(1)金属材料;(2)A.点评:
本题考点: 金属材料及其应用;金属的物理性质及用途.
考点点评: 此题是一道与金属相关的考查题,解题的关键是充分理解和掌握金属和合金的性质以及其它相关的知识.1年前查看全部
- 想用硫酸铜晶体镀铜需要怎么做我手里现有一些硫酸铜,想用来往铁件上镀铜,请问都需要哪些步骤?镀铜用硫酸铜溶液都需要加入什么
想用硫酸铜晶体镀铜需要怎么做
我手里现有一些硫酸铜,想用来往铁件上镀铜,请问都需要哪些步骤?
镀铜用硫酸铜溶液都需要加入什么东西? 情伤人1年前3
情伤人1年前3 -
 GOD777 共回答了21个问题
GOD777 共回答了21个问题 |采纳率81%首先,你需要往铁上镀铜,因此应该采用电解的方法,需准备一个碳棒和一个电源.
第一,将铁棒与电源的负极相连,碳棒(石墨)与电源的正极相连.这样铁棒就作为阴极,碳棒作为阳极.
第二,将两帮插入溶液中,通电即可.
电解方程式:
阴极:Cu(2+)+2e(-)=Cu
阳极:4OH(-)-4e(-)=2H2O+O2↑1年前查看全部
- 镀铜铁制品可不可以在弱酸性条件下使用
 章vancouver1年前1
章vancouver1年前1 -
 4g_xiaomi 共回答了13个问题
4g_xiaomi 共回答了13个问题 |采纳率92.3%弱酸弱碱都不好 会加快腐蚀1年前查看全部
- 镀铜可以防止铁制品腐蚀 电镀时用铜而不用石墨做阳极的原因
 遗世封尘1年前2
遗世封尘1年前2 -
 lizhen19830721 共回答了12个问题
lizhen19830721 共回答了12个问题 |采纳率66.7%镀铜现行的有两种方法:一是用不溶性阳极,一般用不锈钢,二是用可溶性阳极,即用铜.用可溶性阳极不用频繁的添加铜的化合物(如硫酸铜)简单方便,在某些场合要用到不溶性阳极,用石墨也可以,但是与不锈钢比,石墨电极在电镀过程中容易损坏,要更换,而经过加工后不易损坏的石墨阳极在电导率、溶出率等都存在这样那样的问题,还是不如用不锈钢来得方便.1年前查看全部
- 为防止铁制品生锈,在铁制品表面电镀一层铜可起防锈作用。下列关于镀铜铁制品的说法不正确的是 A.是一种合金 B.不可盛硝酸
为防止铁制品生锈,在铁制品表面电镀一层铜可起防锈作用。下列关于镀铜铁制品的说法不正确的是
A.是一种合金 B.不可盛硝酸银溶液 C.防锈原因之一是铁隔绝了空气 D.可以盛放稀盐酸  我明年毕业1年前1
我明年毕业1年前1 -
 wyzhero 共回答了25个问题
wyzhero 共回答了25个问题 |采纳率92%A
1年前查看全部
- 电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜
电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
[提出问题]三种电镀液中溶质的成分是什么?
[探究实验1]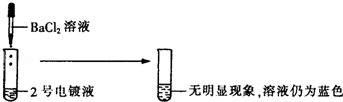
[表达与交流]甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1) (填“正确”或“不正确”).
[探究实验2]
[反思与评价]乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价(2) .
[探究实验3]根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3) 生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
解释与结论:探究实验3中发生反应的化学方程式为(4) ,请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上(5). 厦忆1年前1
厦忆1年前1 -
 垂裳 共回答了14个问题
垂裳 共回答了14个问题 |采纳率100%(1)正确;(2)不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)白色沉淀;(4)CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3 ) 2 ;(5)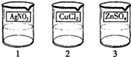
(1)2号电镀液中的溶质如果是硫酸铜,则硫酸铜和氯化钡反应会生成白色沉淀,和体重的无现象矛盾,,所以2号电镀液中的溶质一定不是硫酸铜,故答案为:正确;
(2)3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,也可能含硝酸银,因为硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,硝酸银与氯化钡反应生成氯化银是白色沉淀,故答案为:不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)根据题目中的实验现象,2号电镀液一定含有铜离子,3号电镀液一定含有硫酸根离子,1号电镀液是可溶的银盐,即硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,1号电镀液与少量的2号电镀液混合,会生成白色沉淀,故答案为:白色沉淀;
(4)氯化铜和硝酸银发生复分解反应,即CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3 ) 2 ,故答案为:CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3 ) 2 ;
(5)1号电镀液是硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,故答案为: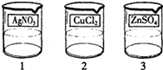 .
1年前查看全部
.
1年前查看全部
- 焦磷酸盐镀铜废水该如何处理?
 killer281年前1
killer281年前1 -
 dreamof20066 共回答了16个问题
dreamof20066 共回答了16个问题 |采纳率87.5%最好是离子交换树脂吸附处理,这样处理的结果彻底,处理后的物质富集后既可以略加调整后回添到镀槽中,也可以提取其中的化工原料.1年前查看全部
- (2012•哈尔滨)电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中
(2012•哈尔滨)电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
[提出问题]三种电镀液中溶质的成分是什么?
[探究实验1]
[表达与交流]甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1)______(填“正确”或“不正确”).
[探究实验2]
[反思与评价]乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价(2)______.
[探究实验3]根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3)______生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
解释与结论:探究实验3中发生反应的化学方程式为(4)______,请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上(5). hh帮你顶1年前1
hh帮你顶1年前1 -
 5016021 共回答了14个问题
5016021 共回答了14个问题 |采纳率85.7%解题思路:(1)硫酸铜和氯化钡反应会生成白色沉淀;
(2)可溶性的银盐、硫酸盐均和氯化钡反应生成白色沉淀;
(3)银盐中只有硝酸银是易溶的,氯化银是常见的难溶性白色沉淀,硝酸银和氯化铜反应会生成白色沉淀;
(4)硝酸银和氯化铜之间发生复分解反应,会生成白色沉淀;
(5)根据实验想先来判断具体的物质.(1)2号电镀液中的溶质如果是硫酸铜,则硫酸铜和氯化钡反应会生成白色沉淀,和题中的无现象矛盾,所以2号电镀液中的溶质一定不是硫酸铜,故答案为:正确;
(2)3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,也可能含硝酸银,因为硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,硝酸银与氯化钡反应生成氯化银是白色沉淀,故答案为:不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)根据题目中的实验现象,2号电镀液一定含有铜离子,3号电镀液一定含有硫酸根离子,1号电镀液是可溶的银盐,即硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,1号电镀液与少量的2号电镀液混合,会生成白色沉淀,故答案为:白色沉淀;
(4)氯化铜和硝酸银发生复分解反应,即CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2,故答案为:CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2;
(5)1号电镀液是硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,贴上标签后为: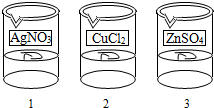 ,故答案为:
,故答案为: .
.点评:
本题考点: 实验探究物质的组成成分以及含量;盐的化学性质;常见离子的检验方法及现象;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道化学综合试验知识题目,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- ①白铁(铁上镀锌)②马口铁(铁上镀锡)③铜质奖章(铁上镀铜),当镀层破坏后,铁腐蚀速率由快到慢的顺序是
①白铁(铁上镀锌)②马口铁(铁上镀锡)③铜质奖章(铁上镀铜),当镀层破坏后,铁腐蚀速率由快到慢的顺序是
[ ]
A.③①②
B.②①③
C.③②①
D.①②③ 小猛仔1年前4
小猛仔1年前4 -
 lesetao 共回答了23个问题
lesetao 共回答了23个问题 |采纳率82.6%C
解析:③是铜铁原电池,由于铁比铜活泼好多,所以铁被腐蚀而且最快
②是铜锡原电池,由于铁比锡活泼,但是没有和铜那样活泼性差的很大,所以铁被腐蚀但是不是最快
①是锌铁原电池,锌比铁活泼,所以锌先被腐蚀,铁反而受保护!1年前查看全部
- 电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜
电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
[提出问题]三种电镀液中溶质的成分是什么?
[探究实验1]
[表达与交流]甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1)______(填“正确”或“不正确”).
[探究实验2]
[反思与评价]乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价(2)______.
[探究实验3]根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3)______生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
解释与结论:探究实验3中发生反应的化学方程式为(4)______,请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上(5). toproad1年前1
toproad1年前1 -
 ziweixing 共回答了15个问题
ziweixing 共回答了15个问题 |采纳率80%解题思路:(1)硫酸铜和氯化钡反应会生成白色沉淀;
(2)可溶性的银盐、硫酸盐均和氯化钡反应生成白色沉淀;
(3)银盐中只有硝酸银是易溶的,氯化银是常见的难溶性白色沉淀,硝酸银和氯化铜反应会生成白色沉淀;
(4)硝酸银和氯化铜之间发生复分解反应,会生成白色沉淀;
(5)根据实验想先来判断具体的物质.(1)2号电镀液中的溶质如果是硫酸铜,则硫酸铜和氯化钡反应会生成白色沉淀,和题中的无现象矛盾,所以2号电镀液中的溶质一定不是硫酸铜,故答案为:正确;
(2)3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,也可能含硝酸银,因为硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,硝酸银与氯化钡反应生成氯化银是白色沉淀,故答案为:不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)根据题目中的实验现象,2号电镀液一定含有铜离子,3号电镀液一定含有硫酸根离子,1号电镀液是可溶的银盐,即硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,1号电镀液与少量的2号电镀液混合,会生成白色沉淀,故答案为:白色沉淀;
(4)氯化铜和硝酸银发生复分解反应,即CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2,故答案为:CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2;
(5)1号电镀液是硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,贴上标签后为: ,故答案为:
,故答案为: .
.点评:
本题考点: 实验探究物质的组成成分以及含量;盐的化学性质;常见离子的检验方法及现象;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道化学综合试验知识题目,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- (2013•锦州)我国第四套人民币硬币中,一元币为钢芯镀镍合金,伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢,在选择铸造
(2013•锦州)我国第四套人民币硬币中,一元币为钢芯镀镍合金,伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢,在选择铸造硬币的材料时,不需要考虑的因素是( )
A.金属的硬度
B.金属的导热性
C.金属的耐腐蚀性
D.金属价格与硬币面值的吻合度 Foresting1年前1
Foresting1年前1 -
 EBMW 共回答了14个问题
EBMW 共回答了14个问题 |采纳率100%解题思路:在选择铸造硬币的材料时,需要考虑的因素有金属的硬度、金属的耐腐蚀性、金属价格与硬币面值的吻合度.在选择铸造硬币的材料时,需要考虑的因素有金属的硬度、金属的耐腐蚀性、金属价格与硬币面值的吻合度,至于金属是否导热不需要考虑.故答案为:B
点评:
本题考点: 金属的物理性质及用途.
考点点评: 此题联系生活实际,体现了化学学习的重要性,提高学生利用化学知识解决实际问题的能力.1年前查看全部
- 一块表面积为5平方米的薄铁板双面镀铜后,铁板的质量增加了4.45千克,求所镀铜的厚度,
 小熊的爱_gg1年前4
小熊的爱_gg1年前4 -
 mumusansan 共回答了16个问题
mumusansan 共回答了16个问题 |采纳率93.8%镀铜的体积为
V=m/ρ=4450g/(8.9 g/cm³)=500cm³=0.05m³
厚度d=V/S=0.05m³/5m²=0.01m=1cm
即所镀铜的厚度为1cm1年前查看全部
- 问几道初2物理题,谢谢大家.!①工人师傅给一块表面积为5CM²的薄铁板镀铜,双面镀铜后的铁板质量增加了4.45
问几道初2物理题,谢谢大家.!
①工人师傅给一块表面积为5CM²的薄铁板镀铜,双面镀铜后的铁板质量增加了4.45KG,则镀铜的厚度为——————MM.
②某同学用天平称量物体质量,用了10G、5G、1G砝码各一个,游码放在0.1G处横梁正好平衡,结果发现物体和砝码的位置放反了,砝码放在左边,而物体放在右边,该同学打算从头做一遍,另一个同学说,这样也可以计算,那么另一位同学所讲的正确读数为————.
③一实心金属球,在空气中称重是时重为G,当金属球的一半浸入某液体时,弹簧测力计的时数为F,他此时受到的浮力为————,当金属球2/3浸入该液体时,弹簧测力计的时数为——————.
④从高处落下的乒乓球又从地面弹起,若不计摩擦阻力的影响,在它上升的过程中下列叙述正确的是:
A.势能增大,机械能增加
B.势能增大,动能减小,但机械能不变
C.势能增大,动能不变,机械能增大
D.势能、动能都增大,机械能增大
⑤用拖拉机深耕时,一般都走得很慢,这是为了:
A.减少动能
B.获得较大的牵引力
C.节省柴油
D.保证耕地质量
⑥甲、乙两台机器,甲的机械效率是百分之八十五,乙的机械效率是百分之六十,则
A.相等时间内,甲机器做工多
B.做相同的工,甲用的时间少
C.甲机器比乙机器省力
D.以上说法都不对
⑦甲、乙两物体在同一水平面上,甲的动能比乙的动能大,下列说法正确的是
A.甲物体的质量一定比乙物体大
B.甲物体的速度一定比乙物体的大
C.甲物体做工的本领一定比乙高
D.以上说法都不对
⑧物体在一对平衡力的作用下运动,则物体的
A.机械能可能改变,动能不变
B.机械能一定不变,动能不变
C.机械能可能改变,动能可能改变
D.机械能一定不能改变,动能可能改变
⑨一辆汽车的发动机最大输出功率为100千瓦,它在水平公路上匀速行驶时,受到的阻力为1000牛,则汽车的最大行驶速度是————.如果汽车的速度是36千米/时汽车的最大牵引力是————.如果汽车以54千米/时的速度行驶,遇到的阻力是3500牛,这时汽车发动机的功率是————.
谢谢大家了.! uckor1年前1
uckor1年前1 -
 宝贝曹骏 共回答了14个问题
宝贝曹骏 共回答了14个问题 |采纳率92.9%(1)V=m/p=4.45*1000/8.92=498.9cm^3,
h=v/2s=49.9cm
(2)16-0.1=15.9g
(3)G-F
4F/3-G/3
(4)B 无外力做功机械能守恒
(5)B P=F*v
(6)D
(7)D
(8)A
(9)100m/s,v=p/f
10000N,F=P/V
52500w,F=f,P=F*V1年前查看全部
- 电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜
电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号(如图1),某小组同学通过实验对三种电镀液中溶质成分进行探究.
【提出问题】三种电镀液中溶质的成分是什么?
【探究实验1】如图2: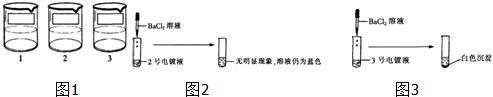
【表达与交流】甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1)______(填“正确”或“不正确”).
【探究实验2】如图3:
【反思与评价】乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价且说明理由(2)______.
【探究实验3】根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3)______生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.3号电镀液中的溶质是(4)______.
【解释与结论】探究实验3中发生反应的化学方程式为(5)______. BLF123451年前1
BLF123451年前1 -
 hot555 共回答了17个问题
hot555 共回答了17个问题 |采纳率94.1%解题思路:(1)向2号电镀液中滴加BaCl2溶液,无明显现象,溶液仍为蓝色,说明该溶液中含有铜离子,不含硫酸根离子;
(2)向3号电镀液中滴加BaCl2溶液,有白色沉淀,由此仅能判断3号电镀液中的溶质可以是硫酸锌,也可以是硝酸银;
(3)若1号电镀液为锌盐,取少量的1号电镀液与少量的2号电镀液混合,不会立即出现有明显现象;
(4)由分析(3)可推出3号电镀液中的溶质只能是硫酸锌(ZnSO4);
(5)依据实验中存在的反应事实书写化学方程式.(1)向2号电镀液中滴加BaCl2溶液,无明显现象,溶液仍为蓝色,说明该溶液中含有铜离子,不含硫酸根离子;故填正确;
(2)向3号电镀液中滴加BaCl2溶液,有白色沉淀,由此仅能判断3号电镀液中的溶质可以是硫酸锌,也可以是硝酸银;故填不正确,也有可能溶质是硝酸银;
(3)若1号电镀液为锌盐,取少量的1号电镀液与少量的2号电镀液混合,不会立即出现有明显现象;故1号电镀液溶质为硝酸银,故填白色沉淀;(4)由分析(3)可推出3号电镀液中的溶质只能是硫酸锌(ZnSO4);故填硫酸锌(ZnSO4);
(5)依据实验中存在的反应事实书写化学方程式:CuCl2+2AgNO3═2AgCl↓+Cu(NO3)2
故答案为:
(1)正确;
(2)不正确,也有可能溶质是硝酸银;
(3)白色沉淀;
(4)硫酸锌(ZnSO4);
(5)CuCl2+2AgNO3═2AgCl↓+Cu(NO3)2点评:
本题考点: 实验探究物质的组成成分以及含量;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 通过实验现象判断反应事实,一定要联想各种可能性,防止挂一漏万,判断失误.1年前查看全部
- 下列叙述不正确的是( )A.铁表面镀铜的装置中,铜作阳极B.船底镶嵌锌块,锌作负极,以防船体被腐蚀C.钢铁吸氧腐蚀的正
下列叙述不正确的是( )
A.铁表面镀铜的装置中,铜作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH-
D.电解精炼铜时,阳极溶解的铜与阴极析出的铜质量相等 keaiok1年前1
keaiok1年前1 -
 歪歪YM 共回答了15个问题
歪歪YM 共回答了15个问题 |采纳率86.7%解题思路:A.电镀时,镀层作阳极,镀件作阴极;
B.作原电池负极的金属被腐蚀,作原电池正极的金属被保护;
C.钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应;
D.电解精炼铜时,阳极上失电子的金属不仅有铜还有杂质.A.电镀时,镀层作阳极,镀件作阴极,所以铁表面镀铜时,铜作阳极,铁作阴极,故A正确;
B.锌、铁和海水构成原电池,锌易失电子作负极,铁作正极被保护,故B正确;
C.钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-═4OH-,故C正确;
D.电解精炼铜时,阳极上失电子的金属不仅有铜还有杂质,阴极上铜离子放电生成铜,所以阳极溶解的铜与阴极析出的铜质量不相等,故D错误;
故选:D.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,难点是电极反应式的书写.1年前查看全部
- 在一块表面积为S的铁件上镀铜后,铁件的质量增加了m千克,求所镀铜的厚度(铜密度=8.9*103kg/m^3)
 凭栏听海1年前1
凭栏听海1年前1 -
 xx_10 共回答了18个问题
xx_10 共回答了18个问题 |采纳率94.4%设厚度为X,则 SX*8.9*10^3=m
解得X=m/( 8.9*10^3S)1年前查看全部
- 化学题 关于在铁钥匙上镀铜为了在铁钥匙上镀铜,则把铁钥匙做____极,与直流电源的____极相连;铜做___极,与直流电
化学题 关于在铁钥匙上镀铜
为了在铁钥匙上镀铜,则把铁钥匙做____极,与直流电源的____极相连;铜做___极,与直流电源的___极相连.含有___离子的溶液做电镀液.阴极的电极反应式为_________________.阴极的电极反应式为______________.阴极发生的是____反应,阳极___反应. 紫风铃_灵王1年前1
紫风铃_灵王1年前1 -
 学苑中心0 共回答了25个问题
学苑中心0 共回答了25个问题 |采纳率92%为了在铁钥匙上镀铜,则把铁钥匙做(阴)极,与直流电源的(负)极相连;铜做(阳)极,与直流电源的(正)极相连.含有(铜)离子的溶液做电镀液.阴极的电极反应式为((Cu2+)+(2e-)=Cu).阴极的电极反应式为(Cu-(2e-)==(Cu2+)).阴极发生的是还原反应,阳极氧化反应.
另外,楼主,第二个“阴极”应该是“阳极”吧………………
至于原理,由于样机上发生的是失电子反应,而金属只能失电子,所以阳极上的铜会不断溶解,变成离子进入溶液中,而溶液中的铜离子则会在阴极上得电子,从而生成单质铜析出,就发生了电镀.顺便说一下含铜离子溶液的选择,这个一般来讲都是选用硫酸铜溶液.1年前查看全部
- 1.在一块表面积为6立方米的铁块上镀铜后,铁块的质量正佳了1.068千克.求所镀铜的厚度?
 Suny_uu1年前1
Suny_uu1年前1 -
 zhangjin0113 共回答了18个问题
zhangjin0113 共回答了18个问题 |采纳率94.4%简单的题目
首先假设厚度是X,那么就有后来的体积是(1+2X)的立方,后来的体积减去原来的体积,就是铜的体积,而铜的体积可以根据密度和质量求的出来,然后解一个一元二次方程,就可以求出X了1年前查看全部
- 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。
我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。
(1)铸造以上硬币用到的材料都是 (填“合成材料”或“金属材料”)。
(2)选择铸造硬币的材料不需要考虑的因素是 (填序号)。
A. 金属的导电性
B. 金属的耐腐蚀性
C. 金属的硬度
D. 金属价格与硬币面值的吻合度
(3)以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:
Ni+ H 2 SO 4 = NiSO 4 + H 2 ↑ Fe+ Ni Cl 2 = Ni + FeCl 2
这两个反应的基本类型都是 。四种金属活动性由强到弱的顺序为 (用元素符号表示)。 yanzi_lcy1年前1
yanzi_lcy1年前1 -
 laogui110 共回答了16个问题
laogui110 共回答了16个问题 |采纳率87.5%(1)金属材料
(2)A
(3)置换反应 Al > Fe > Ni > Cu1年前查看全部
- A.(选修模块3-3)(1)镀铜的工艺应用很广泛.如果镀膜内铜原子的个数要求是8×1022个/米2,取1g铜,均匀镀在物
 A.(选修模块3-3)
A.(选修模块3-3)
(1)镀铜的工艺应用很广泛.如果镀膜内铜原子的个数要求是8×1022个/米2,取1g铜,均匀镀在物体表面时,则能镀膜的面积为______米2.(已知铜的摩尔质量为64g/mol,结果保留两位有效数字)
(2)固定在水平面上的气缸内封闭着一定质量的理想气体,气缸壁是导热的,缸外环境保持恒温,大气压强恒定不变,活塞与气缸壁光滑接触且不漏气.现用水平外力拉活塞缓慢地向右移动一段距离,在此过程中,下列说法正确的是
A.该气体温度不变,压强减小
B.该气体压强不变,温度降低
C.水平外力大小不变
D.因为有水平外力作用,此过程违反热力学第二定律
(3)题(2)所研究的过程中,如果环境温度发生变化,气缸中的气体推动活塞做功3×105J,同时吸收热量为2×105J,则此过程中理想气体的内能是增加还是减少?增加或减少了多少? wukaikui1年前1
wukaikui1年前1 -
 为什么你要伤我 共回答了19个问题
为什么你要伤我 共回答了19个问题 |采纳率78.9%解题思路:(1)根据质量求出铜的物质的量,进而可以求得铜的原子的个数,再计算镀膜的面积;
(2)向右移动,气体的体积增加,气体对外做功,根据热力学第一定律来分析气体的内能的变化;
(3)根据热力学第一定律来分析气体的内能的变化.(1)1g铜的物质的量为n=[m/M]=[1/64]mol,
1g铜的原子的个数为N=nNA=[1/64]×6.02×1023个
能镀膜的面积为
1
64×6.02×1023
8×1022=0.12m2,
(2)气体的体积变大,对外做功,
由于,活塞缓慢地向右移动的,并且气缸壁是导热的,缸外环境保持恒温,所以气体的温度不变,体积变大,所以压强减小,所以A正确,B错误;
在向右移动的过程中,气体的压强逐渐的减小,根据活塞的受力平衡可得,水平外力逐渐的变大,所以C错误;
在变化的过程中,气体不断的从外界吸收热量,此过程没有违反热力学第二定律,所以D错误.
故选A.
(3)气缸中的气体推动活塞做功3×105J,是对外做功,所以W=-3×105J,
吸收热量为Q=2×105J,
根据△E=W+Q=-3×105J+2×105J=-1×105J,
所以气体的内能减少1×105J.
故答案为:
(1)0.12 (2)A (3)减少,1×105J点评:
本题考点: 理想气体的状态方程;热力学第一定律.
考点点评: 利用热力学第一定律判断气体的内能变化的时候要注意做功W和热量Q的符号,对外做功和放热为负的,对气体做功和吸热为正的.1年前查看全部
- (2012•徐汇区一模)将表面镀铜的铝件浸入某种酸中后快速提出,可除去镀层而不损坏铝件.可选用的酸是( )
(2012•徐汇区一模)将表面镀铜的铝件浸入某种酸中后快速提出,可除去镀层而不损坏铝件.可选用的酸是( )
A.浓硫酸
B.盐酸
C.稀硝酸
D.浓硝酸 随风08291年前1
随风08291年前1 -
 lutao1981 共回答了11个问题
lutao1981 共回答了11个问题 |采纳率90.9%解题思路:选择的试剂能与铜反应而除去,并保证铝不能反应.并结合铜、铝的性质选择.A、在加热条件下,铜与浓硫酸反应,但加热条件下铝在浓硫酸中发生,不能钝化,故A错误;
B、浓盐酸与铝反应,铜不能反应,故B错误.
C、稀硝酸既与铜反应也与铝反应,故C错误;
D、铜与浓硝酸反应,铝在浓硝酸中发生钝化,故D正确;
故选D.点评:
本题考点: 硝酸的化学性质;浓硫酸的性质;铝的化学性质.
考点点评: 以除去镀在铝表面的铜为载体,考查铜、铝的性质,难度不大.注意钝化应为常温,常见的酸有浓硫酸、浓硝酸,常见的金属有铁、铝.1年前查看全部
- 某同学用镀铜的石墨做阳极、石墨做阴极电解稀硫酸,用曲线I表示电解过程中阴极增加的质量(△m)随时间(t)的
某同学用镀铜的石墨做阳极、石墨做阴极电解稀硫酸,用曲线I表示电解过程中阴极增加的质量(△m)随时间(t)的
a 为什么
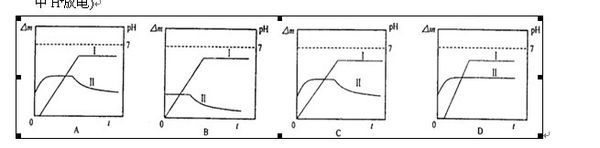
 wcwo1年前1
wcwo1年前1 -
 飞艇与小慧鱼 共回答了21个问题
飞艇与小慧鱼 共回答了21个问题 |采纳率81%整个电解过程可分为四段:
①刚开始电解时,阳极:Cu - 2e- = Cu2+,阴极:2H+ + 2e- = H2↑,这时溶液中H+减少,pH增大,阴极质量不变.
②一段时间后,Cu2+迁移到阴极附近,阴极反应变为:Cu2+ + 2e- = Cu,阴极质量开始增加.由于阳极消耗铜的速率与阴极生成铜的速率相同,溶液中Cu2+浓度不变,pH不变.
③当阳极铜镀层溶解完全后,这时阳极反应变为:2H2O - 4e- = O2↑ + 4H+,溶液pH开始减小.
④又过一段时间,当溶液中的Cu2+反应完全后,阴极反应又变为:2H+ + 2e- = H2↑,阴极质量不再增加,总反应为电解水,溶剂减少,硫酸浓度增大,溶液pH还要减小.
所以选A.1年前查看全部
- 甲醛化学镀铜工艺中要求PH值大于11,请教此处11是通过实验作出的结果吗,怎么根据标准电极电位分析?
 0208蕾蕾1年前1
0208蕾蕾1年前1 -
 wajuch1215 共回答了22个问题
wajuch1215 共回答了22个问题 |采纳率81.8%用pH计测定的,有在线pH计.1年前查看全部
- 以铜棒作阳极,在铁棒.以铜棒作阳极,在铁棒(与铜棒质量相等)表面镀铜,用硫酸铜溶液作电解质溶液,若电镀结束时两极质量差为
以铜棒作阳极,在铁棒.
以铜棒作阳极,在铁棒(与铜棒质量相等)表面镀铜,用硫酸铜溶液作电解质溶液,若电镀结束时两极质量差为128g,则此时在铁棒上析出铜的质量是( ) A.8g B.16g C.32g D.64g 烈特1年前1
烈特1年前1 -
 暗箱 共回答了18个问题
暗箱 共回答了18个问题 |采纳率83.3%D设铜铁质量为a,析出铜的质量为X,则,(a+X)-(a-X)=128解得X为64g1年前查看全部
- 你好请问用硫酸铜溶给铁丝镀铜PH值应控制在什么范围
 D雁北飞1年前3
D雁北飞1年前3 -
 jane1024 共回答了15个问题
jane1024 共回答了15个问题 |采纳率86.7%要是传统的硫酸镀铜工艺的话,是强酸性,小于1,或者说,硫酸含量大于10%1年前查看全部
- 1元/1米的光缆能用吗?会像1元/1米的网线(铁丝和铝丝镀铜)不好用吗?
 男人水坑1年前1
男人水坑1年前1 -
 rainldl 共回答了27个问题
rainldl 共回答了27个问题 |采纳率81.5%当然可以用.
你芯数少,价格当然低.芯数高的话,价格就高了.
还有,不同结构,价格也不同,会有小范围的浮动.
同时,有一些可能是处理的光缆,也就是自己买的光缆用不了了,剩下一点,处理了,价格当然低了.
主要注意,在使用前,先检测一下性能,其次,时间不要太长的光缆,有一定的防护措施的光缆.1年前查看全部
- 镀铜槽中的铜球纯化(发白)除了是盐酸(氯离子)高了以外还有可能是什么原因?,
镀铜槽中的铜球纯化(发白)除了是盐酸(氯离子)高了以外还有可能是什么原因?,
我们现在的管控CUSO4 135-155g/l H2SO4120-150g/l 氯离子 50-70 PPM 我们电镀ASD为5-7
打错字了是钝化 琳子三梦1年前1
琳子三梦1年前1 -
 _莉莉安_ 共回答了20个问题
_莉莉安_ 共回答了20个问题 |采纳率85%那就是Cu多了 多到达到饱和程度 CuSO4被析出来了.应该是这样的 要么就是水质不好 含有不少的Ca2+ +上过量的SO2- 形成CaSO4 少数沉淀了 常见的就是硫酸钙了.白色的1年前查看全部
- 求一道简单的微分应用题!有一批半径为1厘米的球,为了提高球表面的光洁度要镀上一层铜,镀铜的厚度定为0.01厘米,试估计每
求一道简单的微分应用题!
有一批半径为1厘米的球,为了提高球表面的光洁度要镀上一层铜,镀铜的厚度定为0.01厘米,试估计每只球需铜要多少克?(铜的密度是8.9克1立方厘米)
球的体积V=4/3Пr^3,则v'=4Пr^2由题意知r=1cm,取△r=0.01cm.
dV=4Пr^2*0.01
≈0.1257cm^3
已知铜的密度是8.9克1立方厘米,所以每只球需铜1.11873克.
但是答案是1.16克!请问我错在什么地方了!
球的体积不是V=4/3Пr^3会是什么?S是什么?面积么? 过客8031年前2
过客8031年前2 -
 kevin_kzc 共回答了18个问题
kevin_kzc 共回答了18个问题 |采纳率77.8%你的过程没有错
只是有效数字取的不对
当П取3.14时,你得到的结果也应该保留小数点后两位
dv=0.13
0.13*8.9=1.161年前查看全部
- 五金产品镀铜后经过烧焊冷却后出现镀铜层表面有氧化层脱层现象是什么原因?
 wutao_00001年前1
wutao_00001年前1 -
 xiaofeiyang 共回答了9个问题
xiaofeiyang 共回答了9个问题 |采纳率88.9%焊接时温度过高.例如:给一般镀件加热,镀层也会脱落.1年前查看全部
- 电解精炼铜和给某种金属镀铜都需要电解质溶液补充铜离子吗?
 水生嫂1年前1
水生嫂1年前1 -
 pc1115 共回答了17个问题
pc1115 共回答了17个问题 |采纳率94.1%不是,电解精炼铜时粗铜做阳极,电解过程中会有铜离子生成,因此不需要补充,而镀铜则需要补充1年前查看全部
- 工人师傅给一块上下面的表面积和为5㎡的薄铁板镀铜,双面镀铜后的铁板质量增加了4.45kg,则镀铜厚度为
 yyso6301年前1
yyso6301年前1 -
 TeresaD 共回答了14个问题
TeresaD 共回答了14个问题 |采纳率78.6%用4.45除铜的密度再除以2再除以表面积就可以了,应该是0.05mm1年前查看全部
- 氯离子对光亮酸性镀铜有什么影响?
 zhouyiqun19831年前1
zhouyiqun19831年前1 -
 天使冰灵动 共回答了15个问题
天使冰灵动 共回答了15个问题 |采纳率86.7%光亮酸铜溶液中必须含有适量的氯离子才能得到光亮铜层,其含量一般在20-100mg/L.过多或过少都不利.当含量过低时溶液的整平性、走位和光亮度下降,易产生树枝状和烧焦现象,电流开不大.当含量过高时会使低电流密度区不亮,镀层光亮度下降,易烧焦.过多的氯离子也是出现麻点的重要原因.为了避免出现氯离子过多或过少的情况,应定期分析镀液氯离子含量,更重要的是避免带入氯离子.入槽前用稀硫酸活化,配液时使用纯水.不要轻易往溶液中加氯离子,要经过化验和实验验证.当经化验分析确实氯离子过多时用如下方法清除.(1)银盐法 在镀液中加入硫酸银或碳酸银使与过多的氯离子反应生成氯化银沉淀而后过滤除去.每10mg氯离子约需硫酸银45mg或碳酸银31mg.此法虽好,但银价昂贵,使用较少.(2)锌粉法 在镀液中加入锌粉,充分搅拌,其把二价铜离子还原为一价铜离子和铜粉,一价铜离子与过多的氯离子反应生成氯化亚铜沉淀过滤后除去.1年前查看全部
- 关于纳米换算某硬币的材料是钢芯镀铜合金,直径为2.0cm,一个铜原子的直径为0.26nm,铜原子一个接着一个排成一条直线
关于纳米换算
某硬币的材料是钢芯镀铜合金,直径为2.0cm,一个铜原子的直径为0.26nm,铜原子一个接着一个排成一条直线,约需多少个铜原子才能排成2.0cm>? 一晚豌豆1年前3
一晚豌豆1年前3 -
 chongsw 共回答了19个问题
chongsw 共回答了19个问题 |采纳率89.5%一纳米是10的-9次方米,根据我的计算,大概是7.7乘以10的7次方个1年前查看全部
- 一块表面积为5平方米的薄铁板双面镀铜后,铁板的质量增加了4.45克,求所镀铜的厚度,
 gianohe1年前2
gianohe1年前2 -
 mail07 共回答了16个问题
mail07 共回答了16个问题 |采纳率81.3%5*2*x*密度=4.45
解方程1年前查看全部
- 铁制首饰表面镀铜的化学方程式是什么
 mars19111年前2
mars19111年前2 -
 斯韵 共回答了13个问题
斯韵 共回答了13个问题 |采纳率92.3%Fe+CuSO4=FeSO4+Cu1年前查看全部
- 求硫脲浸铜配方!钢铁上预镀铜!溶液有硫酸铜 硫酸硫脲 还用什么?
 4936841071年前1
4936841071年前1 -
 linken_lu 共回答了16个问题
linken_lu 共回答了16个问题 |采纳率81.3%化学浸渍有两种:一种是浸丙烯基硫脲,适于酸性镀铜工艺;另一种是浸焦磷酸盐法,适于焦磷酸盐镀铜工艺.
浸丙烯基硫脲法是在酸性溶液中加入一定量的丙烯基硫脲,使其吸附在钢铁件表面,抑制浸铜时的置换反应速度,使工件表面生成一层结合致密、有光泽的置换镀层.该工艺分预浸和浸铜两步.
预浸溶液由硫酸(H2S04,相对密度1.84)55mL/L,丙烯基硫脲0.1~0.2g/L组成,室温浸渍40~70s.
浸铜溶液组成为硫酸铜(CuS04·5H20)50g/L,硫酸(H2S04,相对密度1.84)55mL/L,丙烯基硫脲0.15~O.3g/L组成.室温下浸渍40~60s.1年前查看全部
- 中国第五套人民币五角硬币的表面是镀铜的吗?铜是紫色的,那硬币怎么会是土黄色的呢?
 masulii1年前1
masulii1年前1 -
 彩旗飘飘好 共回答了18个问题
彩旗飘飘好 共回答了18个问题 |采纳率94.4%好像是合成金属,不光光是铜,如果是镀铜爱生铜锈.1年前查看全部
- 在一块表面积为6m2的铁件上镀铜后,铁件的质量增加了1.068kg,求所镀铜的厚度.(ρ铜=8.9×103kg/m3)
 可否让一切随风1年前3
可否让一切随风1年前3 -
 wang_Mf123 共回答了22个问题
wang_Mf123 共回答了22个问题 |采纳率95.5%解题思路:根据铜的质量和密度,利用密度公式变形可求得其体积,又知道铁件的表面积,然后可求得所镀铜的厚度.铁件的质量增加了1.068kg,即为所镀铜的质量,
∵ρ=[m/V],
∴镀铜的体积V=[m/ρ]=[1.068kg
8.9×103kg/m3=1.2×10-4m3,
∴所镀铜的厚度h=
V/S]=
1.2×10-4m3
6m2=2×10-5m=0.02mm.
答:所镀铜的厚度为0.02mm.点评:
本题考点: 密度公式的应用.
考点点评: 此题主要考查密度公式的应用,明确铁件的质量增加了1.068kg,即为所镀铜的质量,是解答此题的关键.1年前查看全部
- 五角硬币的钢芯镀铜合金材质和一角硬币的不锈钢材质分别是铁磁还是顺磁还是抗磁?要分可以多给
 hbcyjnpxxy1年前1
hbcyjnpxxy1年前1 -
 效哲 共回答了16个问题
效哲 共回答了16个问题 |采纳率87.5%普通钢是铁磁性的,但是不锈钢分两组,铁素体不锈钢和马氏体不锈钢是铁磁性的,而奥氏体不锈钢是顺磁性的,铜是抗磁性的,五角硬币的钢芯镀铜合金材质的,由于内部是钢芯而外部是镀铜,虽然铜是抗磁性的,但是由于是镀铜,镀层佷薄,整体来看应该是铁磁性的,我不知道一角硬币的不锈钢到底是哪一类,如果是其他不锈钢种,则是铁磁性的,如果是奥氏体不锈钢则是顺磁性的,不好回答.1年前查看全部
- 请教:铁镀锡、铁镀铜、上海宝钢.英文.
 洋洋得意11年前1
洋洋得意11年前1 -
 美美小悟空 共回答了25个问题
美美小悟空 共回答了25个问题 |采纳率88%tin plated,brass plated and BAO Steel1年前查看全部
- 焦磷酸镀铜ph过低会发生什么情况
 anycallday1年前1
anycallday1年前1 -
 湖北逸贤 共回答了16个问题
湖北逸贤 共回答了16个问题 |采纳率81.3%焦磷酸根发生水解,生成磷酸根,导致电镀槽的P比偏低,镀层变粗糙.1年前查看全部
- 这个奇迹般的化学试验室镀铜法...这样怎么可能镀得上?
这个奇迹般的化学试验室镀铜法...这样怎么可能镀得上?
我用一根铁条,放到硫酸铜溶液里,镀了一层铜,但是那层铜一搓就掉;但是我进行如下操作后,我把一些锌粒放到试管里,然后加入稀盐酸,在反应进行时,加入硫酸铜溶液,并把铁条放入,取出铁条,洗净,上面的铜我用砂纸都没搓掉,请解释一下并说明一下里面都发生了什么反应? 精制碘盐1年前3
精制碘盐1年前3 -
 xingxingshui 共回答了24个问题
xingxingshui 共回答了24个问题 |采纳率95.8%有氧化还原反应
其中反应的是Zn、HCl、CuSO4
首先:Zn+2HCl = H2+ZnCl2
当加入硫酸铜溶液和铁条后,铁条与锌粒必然接触(试管嘛),加上ZnCl2的参与,达成原电池,反应如下:
Zn+CuSO4 == ZnSO4+Cu;
当你看到这的时候会想到,这和第一个实验的那相差无几啊?只是把Fe换成Zn,难不成他们两之间有这么大的差别,答案是错的.
第一个实验附着不致密的原因是当铜被还原出来后,期间有铁原子被氧化,形成空隙.
而第二个实验中附着致密的原因是:
铁原子没有被氧化,原因是有锌的保护,这种保护叫做:牺牲阳极保护法.这也是电镀的原理.
友情链接(百度百科..电镀:http://baike.baidu.com/link?url=1zk5uMB6LjjZIg3Bw_RAX3xqlo0VVjVZgAbCanEX9eW3AE84oJwH-UHT1hWuIdOs )
望采纳啊!1年前查看全部
- 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
(1)铸造以上硬币用到的材料都是______(填“非金属材料”或“金属材料”).
(2)以上硬币中涉及到Fe、Cu、Al、Ni(镍),已知镍能够发生如下反应:Ni+H2SO4═NiSO4+H2↑Fe+NiCl2═Ni+FeCl2,四种金属的活动性有强到弱的顺序为______(用元素符号表示).
(3)铁制品易生锈,写出一种防止其生锈的方法:______. qq英语241年前1
qq英语241年前1 -
 lxslfree 共回答了21个问题
lxslfree 共回答了21个问题 |采纳率90.5%解题思路:根据已有的知识进行分析,硬币是金属材料制成的,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,防锈就是破坏铁生锈的条件.(1)钢芯镀镍、钢芯镀铜、铝合金或不锈钢都是属于金属材料,故填:金属材料;
(2)已知在金属活动性顺序中Al>Fe>H>Cu,根据Ni+H2SO4═NiSO4+H2↑可知,Ni>H,根据Fe+NiCl2═Ni+FeCl2可知,Fe>Ni,故这四种金属的活动性顺序为Al>Fe>Ni>Cu,故填:
Al、Fe、Ni、Cu;
(3)铁在有水喝氧气并存时易生锈,防锈就是使铁与水货氧气隔绝,可以在铁制品表面喷漆,以防止生锈,故填:在铁制品表面喷漆.点评:
本题考点: 金属材料及其应用;金属活动性顺序及其应用;金属锈蚀的条件及其防护.
考点点评: 本题考查了金属的有关知识,完成此题,可以依据已有的金属的性质以及金属活动性顺序及其意义进行.1年前查看全部
- 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
(1)铸造以上硬币用到的材料都是______(填“合成材料”或“金属材料”)
(2)以上硬币中涉及Fe,Cu,Al,Ni(镍),已知Ni能够发生如下反应:
Ni+H2SO4═H2↑+NiSO4Fe+NiCl2═Ni+FeCl2
这两个反应的基本类型都是______.四种金属的活动性由强到弱的顺序为______(用元素符号表示). 左手1231年前1
左手1231年前1 -
 娃哈哈br2 共回答了19个问题
娃哈哈br2 共回答了19个问题 |采纳率89.5%解题思路:(1)依据硬币的组成成分分析材料的种类;
(2)根据金属活动性顺序的具体应用对金属的活动性进行分析,依据反应的反应物生成物种类判断反应的类型.(1)根据题干所知硬币的组成成分都是金属的合金,所以铸造以上硬币用到的材料都是金属材料;故填:金属材料;
(2)由金属活动性顺序的具体应用可知:活动性在氢前的金属可以与稀酸反应生成氢气,金属活动性强的金属可以把金属活动性比它弱的金属从其盐溶液中置换出来,所以据Ni+H2SO4═H2↑+NiSO4,Fe+NiCl2═Ni+FeCl2可知:Ni活动性在氢前且比铁弱,结合金属活动性顺序表可知四种金属的活动性顺序是:Al>Fe>Ni>Cu,从反应类型上看Ni+H2SO4═H2↑+NiSO4 ,Fe+NiCl2═Ni+FeCl2都是一种单质与一种化合物反应生成另一种单质与另一种化合物,故都是置换反应.
故答案为:置换反应;Al>Fe>Ni>Cu.点评:
本题考点: 金属材料及其应用;金属活动性顺序及其应用;反应类型的判定.
考点点评: 此题是一道与金属相关的考查题,解题的关键是充分理解和掌握金属活动性顺序表的意义以及其它相关的知识.1年前查看全部
大家在问
- 1一只雌猫一次产了三只小猫,这三只小猫在毛色上不完全相同,则说明物体具有( ) A.遗传性 B.变异性 C.进化性 D.
- 21993年的一天,有一个男子曾说:“今天我的生日已经过了,我发现我现在的年龄正好是我出生年份的那一个数的4个数字之和.”
- 3有1角和5角硬币共40枚,一共8元.其中5角有多少枚?完整方程
- 4关于环己酮溶解环己酮只是溶剂,PVC和PC用环乙酮黏合后,还用环己酮再进行溶解.如果用环己酮溶解的话,请问对PVC和PC
- 5My computer is broken 对划线部分提问
- 6已知数列{an}的前n项和Sn=(n^2+n)/2,n属于n*,设bn=2^an+[(-1)^n]*an,求数列{bn}
- 72.3.3.5.8.11.63.67.3968
- 8已知sin(2分之派加a)=m,则cos(派减a)=
- 9三道英语语法1This is___the term"it rains cats and dogs."has come i
- 10能合成激素的细胞一定能合成酶和ATP吗?
- 11阅读下面一首唐诗,完成后面的题目。(8分)
- 12英语翻译Like for like.Like knows like.Like father like son.Like
- 13四棱锥 S-ABCD 底面ABCD为正方形,侧棱SD垂直底面 E,F为AB SC 中点 设SD=2DC,求2面角A-EF
- 14EXCEL函数 符合条件取值,否则查找另一个符合条件的值
- 15将某班学生分成x组,若每组定为6人,则多余3人,若每组定为7人,则差5人.请写出组数x满足的方程( )
