测废酸氮含量需要用硫酸亚铁标准溶液,而硫酸亚铁的标准溶液怎么标定的?
 zyclb2022-10-04 11:39:541条回答
zyclb2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 wangjjie1 共回答了17个问题
wangjjie1 共回答了17个问题 |采纳率88.2%- 请查阅分光光度法测定铁的全过程
- 1年前
相关推荐
- (2011•东莞模拟)某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,
(2011•东莞模拟)某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示.
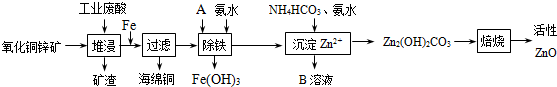
已知:Fe(OH)2为絮状沉淀难以过滤除去,各离子开始沉淀及完全沉淀时的pH如下表所示.
请回答下列问题:离子 开始沉淀时的pH 完全沉淀时的pH Fe2+ 6.3 9.7 Fe3+ 1.5 3.2 Zn2+ 6.2 8.0
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)______ Ksp(ZnS)(选填“>”“<”或“=”).
(2)堆浸后加入Fe粉发生的反应离子方程式为:______、______.
(3)加入A 物质的目的是______,物质A可使用下列物质中的______.(填字母,双选)
A.KMnO4B.O2C.H2O2D.NaOH
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在______范围之间.
(5)溶液B中主要溶质的化学式是______. 小不懂格格1年前1
小不懂格格1年前1 -
 bodatv 共回答了14个问题
bodatv 共回答了14个问题 |采纳率92.9%解题思路:氧化铜锌矿先用稀硫酸溶解,然后向所得溶液中加入铁粉将铜置换出来,加氧化剂将Fe2+氧化成Fe3+,加氨水调节溶液的PH,将其除去,再用碳酸氢铵洗涤溶液,得到溶解度较小的碱式碳酸锌,最后焙烧得到氧化锌.
(1)相同条件下,溶解度大的物质先溶解;
(2)堆浸后加入Fe粉与溶液中铜离子和氢离子发生氧化还原反应;
(3)将Fe2+氧化成Fe3+,以便除去;考虑除杂过程不引入新的杂质;
(4)PH的范围应是使铁沉淀完全而锌不沉淀;
(5)结合题给信息利用工业废酸和氮肥考虑.(1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS),故答案为:<;
(2)堆浸后加入Fe粉与溶液中铜离子和氢离子发生氧化还原反应,发生的反应离子方程式分别为:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,
故答案为:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑;
(3)将Fe2+氧化成Fe3+,以便除去;除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,考虑不引入新的杂质,应选BC,
故答案为:将Fe2+氧化成Fe3+,以便除去;BC;
(4)从图表数据可知,铁离子沉淀完全的PH为3.2,锌离子开始沉淀的PH为6.2.故除铁PH范围为:3.2~6.2,故答案为:3.2~6.2;
(5)因所用废酸为硫酸,B又可作氮肥,所以B为(NH4)2SO4;故答案为:(NH4)2SO4.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;难溶电解质的溶解平衡及沉淀转化的本质;铜金属及其重要化合物的主要性质;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题属于工艺流程图方面题目,要搞清实验目的和题给信息,结合流程和题目设问正确解题,本题难度中等.1年前查看全部
- 副产盐酸就是废酸吗是不是所有副产盐酸都是废酸
 hulifeng1年前4
hulifeng1年前4 -
 xuxuzbd 共回答了15个问题
xuxuzbd 共回答了15个问题 |采纳率80%不是,氯碱工业的盐酸不是废酸
制CCl4的盐酸也不是废酸.都可做化工原料.1年前查看全部
- 某工厂排出的废水经测定溶液的PH小于7,这种废水对农作物有害.为降低其酸性并且能够看到废酸是否已除尽最好选用( )
某工厂排出的废水经测定溶液的PH小于7,这种废水对农作物有害.为降低其酸性并且能够看到废酸是否已除尽最好选用( )
A.生石灰
B.石灰石
C.氢氧化钠
D.氢氧化钙 gqfox1年前1
gqfox1年前1 -
 不得不思悟自然 共回答了18个问题
不得不思悟自然 共回答了18个问题 |采纳率100%解题思路:根据题干提供的信息进行分析,废水的pH<7,说明废水呈酸性,加入的物质需能与酸反应,有明显的现象,且对废水不能造成2次污染,据此分析解答即可;个、生石灰与水反应生成氢氧化钙,氢氧化钙能够与酸发生中和反应,但是没有明显的现象,该方法不可行;
B、石灰石能与酸反应,因此能用它除掉酸性物质,并且有明显的现象--气泡,能够看到废酸是否已除尽,该方法可行;
C、氢氧化钠能够与酸发生中和反应,无明显的现象,并且氢氧化钠碱性太强,稍过量容易对水造成2次污染,且价格较高,所以不能选用;
D、氢氧化钙能够与酸发生中和反应,但是没有明显的现象,该方法不可行;
故选B.点评:
本题考点: 酸的化学性质;溶液的酸碱性与pH值的关系.
考点点评: 本题考查了废水的处理,完成此题,可以依据废水中的杂质的性质进行,要求所加的试剂能与酸反应且不会造成2次污染的原则.1年前查看全部
- 你在实验室实验时,有过把实验后的废酸或废碱直接倒入下水道的情况吗?如果有,学完本单元,你认为这种做法好不好?应如何正确处
你在实验室实验时,有过把实验后的废酸或废碱直接倒入下水道的情况吗?如果有,学完本单元,你认为这种做法好不好?应如何正确处理试验后的废酸或废碱?谈谈你的想法.
 pianzi19711年前4
pianzi19711年前4 -
 dwb1969 共回答了23个问题
dwb1969 共回答了23个问题 |采纳率87%这中做法不好!因为酸碱物质都有腐蚀性,会把下水道腐蚀掉!我们做完实验一般实验桌旁都有废液桶,老师叫我们把做完实验的废液倒进里面的.如果没有,那就找一些物质给他反应掉.如:酸液用碱液反应,碱液用酸液反应.
要看具体是什么物质.1年前查看全部
- (14分)某科研小组设计出利用工业废酸(10%H 2 SO 4 )来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物
(14分)某科研小组设计出利用工业废酸(10%H 2 SO 4 )来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。
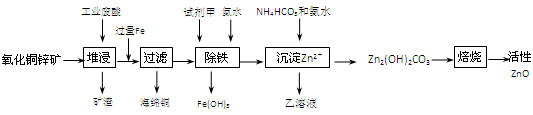
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:离子 开始沉淀时的pH 完全沉淀时的pH Fe 2 + 6.34 9.7 Fe 3 + 1.48 3.2 Zn 2 + 6.2 8.0
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H 2 SO 4 的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:K sp (CuS) K sp (ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO 4 B.HNO 3 C.H 2 O 2 D.Cl 2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH) 3 反应的离子方程式 。
(5)298K时,残留在乙溶液中的c(Fe 3 + )在 __ mol/L以下。
[Fe(OH) 3 的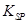 = 2.70×10 -39 ]
= 2.70×10 -39 ]
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn 2+ ”步骤中发生反应的化学方程式 。 26101691年前1
26101691年前1 -
 幸福猫HRM工作室 共回答了24个问题
幸福猫HRM工作室 共回答了24个问题 |采纳率83.3%(1)<(2)C(3)3.2~6.2
(4)Fe 3+ +3NH 3 ·H 2 O ="==" Fe(OH) 3 ↓+3 NH 4 +
(5)2.7×10 -20.4
(6)(NH 4 ) 2 SO 4
(7)2ZnSO 4 +NH 4 HCO 3 +3 NH 3 ·H 2 O="=" Zn 2 (OH) 2 CO 3 ↓+2(NH 4 ) 2 SO 4 + H 2 O
(1)ZnS和CuS均存在溶解平衡:ZnS(s) ZnS(aq)=Zn 2 + +S 2 - CuS(s)
ZnS(aq)=Zn 2 + +S 2 - CuS(s) CuS(aq)=Cu 2 + +S 2 - ,当c(H + )增大的情况下,c(S 2 - )减小的情况下,前者平衡正向移动,即离子积c(Zn 2 + )×c(S 2 - )小于Ksp(ZnS),并且离子积c(Cu 2 + )×c(S 2 - )大于Ksp(CuS),则Ksp(ZnS)较大
CuS(aq)=Cu 2 + +S 2 - ,当c(H + )增大的情况下,c(S 2 - )减小的情况下,前者平衡正向移动,即离子积c(Zn 2 + )×c(S 2 - )小于Ksp(ZnS),并且离子积c(Cu 2 + )×c(S 2 - )大于Ksp(CuS),则Ksp(ZnS)较大
(2)从表格数据可知,在较低pH下Fe 3 + 已经全部沉淀完全,但Fe 2 + 与Zn 2 + 沉淀的pH范围重合,故需要先用氧化剂将Fe 2 + 氧化,再沉淀除去,为不引入杂质同时不能与加入的氨水反应,H 2 O 2 最合适:2Fe 2 + +H 2 O 2 +2H + =2Fe 3 + +2H 2 O
(3)由所给数据可知,为保证Fe 3 + 沉淀完全,但Zn 2 + 不能沉淀,可将pH控制在3.2~6.2之间
(4)Fe 3+ +3NH 3 ·H 2 O ="==" Fe(OH) 3 ↓+3 NH 4 +
(5)乙溶液中pH最小为6.2,c(OH — )最小为10 — 6.2 mol/L,c(Fe 3 + )最大为 =2.7×10 -20.4 mol/L
=2.7×10 -20.4 mol/L
(6)(NH 4 ) 2 SO 4
(7)由流程中参加反应的物质及生成物可知发生的反应为:2ZnSO 4 +NH 4 HCO 3 +3 NH 3 ·H 2 O="=" Zn 2 (OH) 2 CO 3 ↓+2(NH1年前查看全部
- (2011•邯郸二模)2011年邯郸市化学实验操作考试有一题是测定废酸液的酸碱度并试验其某些性质,小明同学分别做了废酸液
(2011•邯郸二模)2011年邯郸市化学实验操作考试有一题是测定废酸液的酸碱度并试验其某些性质,小明同学分别做了废酸液与紫色石蕊试液、金属锌、生锈铁钉反应的实验,在进行废酸液(主要含有稀盐酸)与生锈铁钉反应的实验时,他发现溶液由无色变为黄色,请你帮他写出产生该现象的化学反应方程式______.
【发现问题】小明在回收铁钉时又发现铁钉表面出现了气泡,他对此时溶液的成分产生了兴趣,此时溶液的溶质是什么?
【实验探究】小明同学思考分析后认为:此时溶液显______性.为了确定溶液的成分,他进行了如下实验:
【进行实验】
【反思交流】通过以上探究,还能得出废酸液的其它两点化学性质:______,______.实验内容 实验现象 实验结论 方案一:取上层清液于试管中,向其中加入过量NaOH溶液. ______. 清液中含有的三种
溶质是______.方案二:①取上层清液于试管中,向其中加入______溶液,②将产生气体通入澄清石灰水 ①产生气体,②气体使澄清石灰水变浑浊.  biandande1年前1
biandande1年前1 -
 师傅啊 共回答了16个问题
师傅啊 共回答了16个问题 |采纳率100%解题思路:根据氧化铁和盐酸反应会生成氯化铁进行分析;
【实验探究】根据酸会与活泼金属反应进行分析;
【进行实验】根据氢氧化钠会与氯化铁、氯化亚铁生成沉淀,盐酸会与碳酸钠反应生成二氧化碳气体进行分析;
【反思交流】根据题中的反应现象总结酸的化学性质.氧化铁和盐酸反应会生成氯化铁和水,化学方程式为:6HCl+Fe2O3=2FeCl3+3H2O;
【实验探究】铁和盐酸反应生成氯化亚铁和氢气,收铁钉时又发现铁钉表面出现了气泡,说明溶液显酸性;
【进行实验】氢氧化钠和氯化亚铁会生成氢氧化亚铁沉淀和氯化钠,氢氧化钠和氯化铁会生成氢氧化铁沉淀和氯化钠,碳酸钠会与盐酸反应生成氯化钠、水和二氧化碳,所以,
实验内容实验现象 实验结论
开始没有出现沉淀,然后出现红褐色沉淀 HCl、FeCl2、FeCl3
碳酸钠 【反思交流】通过上面的分析可知,废酸液会与氢氧化钠反应,也会与碳酸钠反应,所以还能得出废酸液的其它两点化学性质:
废酸液会与碱反应,废酸液会与盐反应.
故答案为:6HCl+Fe2O3=2FeCl3+3H2O;
【实验探究】酸;
【进行实验】
实验内容实验现象 实验结论
开始没有出现沉淀,然后出现红褐色沉淀 HCl、FeCl2、FeCl3
碳酸钠 【反思交流】废酸液会与碱反应,废酸液会与盐反应.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;酸的化学性质;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析题中的反应原理,然后将题中信息和课本知识的联系,看清每步操作的目的或反应实质即可较快解答.1年前查看全部
- (2006•兰州)2006年5月29日我市某公司苯胺(C6H7N)生产车间一废酸单元发生火灾事故,造成重大伤亡.下面有关
(2006•兰州)2006年5月29日我市某公司苯胺(C6H7N)生产车间一废酸单元发生火灾事故,造成重大伤亡.下面有关苯胺(C6H7N)的叙述中错误的是( )
A.苯胺是由6个碳原子、7个氢原子、1个氮原子构成
B.苯胺的相对分子质量93
C.苯胺是由碳、氢、氮三种元素组成
D.苯胺分子中C、H、N原子的个数比为6:7:1 下辈子的眼泪1年前1
下辈子的眼泪1年前1 -
 迪坎贝穆托姆博 共回答了19个问题
迪坎贝穆托姆博 共回答了19个问题 |采纳率89.5%根据苯胺(C6H7N)可知:
A、苯胺是由6个碳原子、7个氢原子、1个氮原子构成,此说法错误,应说“一个苯胺分子是由6个碳原子、7个氢原子、1个氮原子构成”,故A错误;
B、苯胺的相对分子质量=12×6+1×7+14×1=93,说法正确,故B正确;
C、苯胺是由碳、氢、氮三种元素组成,说法正确,故C正确;
D、苯胺分子中C、H、N原子的个数比为6:7:1,说法正确,故D正确.
故选A.1年前查看全部
- (14分))某科研小组设计出利用工业废酸(10%H 2 SO 4 )来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废
(14分))某科研小组设计出利用工业废酸(10%H 2 SO 4 )来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。
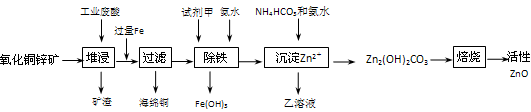
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:离子 开始沉淀时的pH 完全沉淀时的pH Fe 2 + 6.34 9.7 Fe 3 + 1.48 3.2 Zn 2 + 6.2 8.0
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H 2 SO 4 的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下: K sp (CuS) K sp (ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO 4 B.O 2 C.H 2 O 2 D.Cl 2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH) 3 反应的离子方
程式 。
(5)298K时,残留在乙溶液中的c(Fe 3 + )在 __ mol/L以下。
[Fe(OH) 3 的 = 2.70×10 -39 ]
= 2.70×10 -39 ]
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn 2+ ”步骤中发生反应的化学方程式 。 hide131年前1
hide131年前1 -
 心碎男人123456 共回答了16个问题
心碎男人123456 共回答了16个问题 |采纳率93.8%(14分)
(1)<(2分)
(2)B C(2分)
(3)3.2~6.2(2分)
(4)Fe 3+ +3NH 3 ·H 2 O ="==" Fe(OH) 3 ↓+3 NH 4 + (2分)
(5)2.7×10 -21 (2分)
(6)(NH 4 ) 2 SO 4 (2分)
(7)2ZnSO 4 +NH 4 HCO 3 +3 NH 3 ·H 2 O="=" Zn 2 (OH) 2 CO 3 ↓+2(NH 4 ) 2 SO 4 + H 2 O (2分)
(1)在H 2 SO 4 的作用下ZnS可以溶解而CuS不溶,显然 K sp (CuS)< K sp (ZnS);
(2)除杂的同时不能引入新的杂技,所以A、D不可选,在H 2 O 2 和O 2 的作用下,Fe 2+ 被氧化为Fe 3+ 离子。
(3)根据298K时各离子开始沉淀及完全沉淀时的pH分析可知,要将Fe 3+ 离子充分沉淀完全,而不能使Zn 2+ 沉淀,pH应控制在3.2~6.2 范围之间;
(4)NH 3 ·H 2 O是弱碱,在书写离子方程式时不能拆成离子的形式:
(5)Zn 2+ 沉淀的pH应控制在8.0以上,所以,残留在乙溶液中的c(Fe 3 + )≤2.7×10 -21
(6)乙的溶液可直接用作氮肥主要是含有(NH 4 ) 2 SO 4 ;
(7)2ZnSO 4 +NH 4 HCO 3 +3 NH 3 ·H 2 O="=" Zn 2 (OH) 2 CO 3 ↓+2(NH 4 ) 2 SO 4 + H 2 O1年前查看全部
- (2006•兰州)2006年5月29日我市某公司苯胺(C6H7N)生产车间一废酸单元发生火灾事故,造成重大伤亡.下面有关
(2006•兰州)2006年5月29日我市某公司苯胺(C6H7N)生产车间一废酸单元发生火灾事故,造成重大伤亡.下面有关苯胺(C6H7N)的叙述中错误的是( )
A.苯胺是由6个碳原子、7个氢原子、1个氮原子构成
B.苯胺的相对分子质量93
C.苯胺是由碳、氢、氮三种元素组成
D.苯胺分子中C、H、N原子的个数比为6:7:1 不是为你而流1年前1
不是为你而流1年前1 -
 管吃的LULUTU 共回答了17个问题
管吃的LULUTU 共回答了17个问题 |采纳率82.4%解题思路:A、根据苯胺(C6H7N)可知,其分子构成;
B、根据苯胺(C6H7N)可知,其相对分子质量;
C、根据苯胺(C6H7N)可知,其元素组成;
D、根据苯胺(C6H7N)可知,其分子中原子个数比.根据苯胺(C6H7N)可知:
A、苯胺是由6个碳原子、7个氢原子、1个氮原子构成,此说法错误,应说“一个苯胺分子是由6个碳原子、7个氢原子、1个氮原子构成”,故A错误;
B、苯胺的相对分子质量=12×6+1×7+14×1=93,说法正确,故B正确;
C、苯胺是由碳、氢、氮三种元素组成,说法正确,故C正确;
D、苯胺分子中C、H、N原子的个数比为6:7:1,说法正确,故D正确.
故选A.点评:
本题考点: 原子的有关数量计算;物质的元素组成;相对分子质量的概念及其计算.
考点点评: 掌握原子的有关数量计算;掌握相对分子质量的概念及其计算;掌握元素质量比的计算.1年前查看全部
- 某科研小组利用工业废酸(10 %H 2 SO 4 ) 来浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用。流程如下图所示
某科研小组利用工业废酸(10 %H 2 SO 4 ) 来浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用。流程如下图所示: 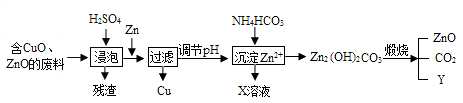
(1)写出氧化锌与硫酸反应的化学方程式: ,Zn→Cu的化学方程式为 。
(2)物质X可用作氮肥,化学式为 ______ ;该化肥不能与 ________ 。
(3)请推出物质Y的化学式:____________________ 。 abadian1年前1
abadian1年前1 -
 gxh2001hui 共回答了16个问题
gxh2001hui 共回答了16个问题 |采纳率87.5%(1)ZnO+H 2 SO 4 ==ZnSO 4 +H 2 O;Zn+CuSO 4 ==Cu+ZnSO 4
(2)(NH 4 ) 2 SO 4 ;碱性物质
(3)H 2 O1年前查看全部
- (20j3•东城区二模)某小组利用稀废酸浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用.其实验流程如图所示(已知金属氧
(东城区二模)某小组利用稀废酸浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用.其实验流程如图所示(已知金属氧化物与稀硫酸反应时,元素化合价不发生改变,且图多部分物质已略去).
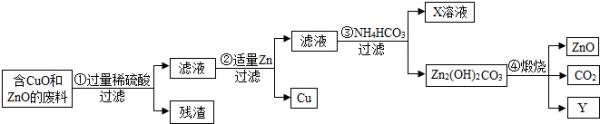
(j)该流程多的过滤操作所使用的玻璃仪器是烧杯、玻璃棒和______,其多玻璃棒的作用是______.
(2)①多氧化铜与稀硫酸反应的化学方程式是______,②多生成金属Cu的化学方程式是______.
(3)b的化学式是______.
(4)煅烧Zn2(OH)2CO3的化学方程式是Zn2(OH)2CO3
2ZnO+CO2↑+H2O高温 .Zn2(OH)2CO3.
2ZnO+CO2↑+H2O高温 . 你们真早1年前1
你们真早1年前1 -
 低处苍生 共回答了21个问题
低处苍生 共回答了21个问题 |采纳率90.5%解题思路:(1)根据过滤操作用到的仪器和玻璃棒的作用回答本题;(2)根据化学方程式的书写方法回答;(3)根据废物的综合利用流程图和物质间的反应分析推断物质X的化学式,根据X的性质分析;(4)根据方程式的书写方法回答.(1)过滤操作所使用四玻璃仪器是烧杯、玻璃棒、量漏斗;玻璃棒四作用是引流;
(2)氧化铜与硫酸反应生成了硫酸铜和水,反应四化学方程式:CuO+H2S04═CuS04+H20;由于锌四活泼性大于铜,可以将锌与硫酸铜反应来实现
Zn→Cu四转变,反应物是锌和硫酸铜,生成物是铜和硫酸锌,所以反应四化学方程式是:Zn+CuSO4═Cu+ZnS04;
(2)由废物四综合利用流程图和物质间四反应可知滤液中含有硫酸根离子,与碳酸氢铵反应能生成硫酸铵,所以物质X是硫酸铵,化学式是:(NH4)2S04;
(t)由元素守恒可知,煅烧碱式碳酸锌生成氧化锌、二氧化碳和水,用观察法配平,反应条件是高温,所以方程式是:Zn2(OH)2COt
高温
.
2ZnO+CO2↑+H2O
故答案为:(1)漏斗;引流;(2)CuO+H2SO4=CuSO4+H2O;Zn+CuSO4=ZnSO4+Cu;(t)(NH4)2SO4;(4)Zn2(OH)2COt
高温
.
2ZnO+CO2↑+H2O.点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题看上去是一道分析推断图框题,但题目考查的知识点全是课本基础知识,熟练掌握酸碱盐的化学性质即可解答本题.1年前查看全部
- 下列物质的用途中,主要利用其物理性质的是 A.盐酸可用于除铁锈 B.干冰可用作人工降雨 C.用熟石灰中和化工厂的废酸 D
下列物质的用途中,主要利用其物理性质的是
A.盐酸可用于除铁锈 B.干冰可用作人工降雨 C.用熟石灰中和化工厂的废酸 D.小苏打可用于治疗胃酸过多  tina10071年前1
tina10071年前1 -
 玄月无痕 共回答了20个问题
玄月无痕 共回答了20个问题 |采纳率80%B
1年前查看全部
- 若用20%的氢氧化钠溶液中和2mol硫酸的废酸溶液,则需要该氢氧化钠溶液多少克
若用20%的氢氧化钠溶液中和2mol硫酸的废酸溶液,则需要该氢氧化钠溶液多少克
我算了氢氧化钠4mol 摩尔数是40g/mol 那么质量是160g嘛?20%要来干嘛的= =
 岁月的灰烬1年前1
岁月的灰烬1年前1 -
 善良不是软弱 共回答了13个问题
善良不是软弱 共回答了13个问题 |采纳率76.9%2NaOH+H2SO4=Na2SO4+2H2O
看出需要4mol氢氧化钠
m=40×4=160g
根据20%得到
m溶液=160/20%=800g
不懂的欢迎追问,1年前查看全部
- 关于混合二元酸二甲酯(DBE)产品的原料是己二酸装置生产过程中产生的废酸水,求详细资料!
关于混合二元酸二甲酯(DBE)产品的原料是己二酸装置生产过程中产生的废酸水,求详细资料!
请各位朋友帮忙,生产混合二元酸二甲酯(DBE)时用的主要原料是己二酸装置生产过程中产生的二元酸废液,然后经过蒸发提纯后得到的由己二酸、丁二酸、戊二酸的混合物结片,那么这个混合物结片在市场销售中的学名是什么?
这三种酸的混合物的物理性质和化学性质是什么?
它除用做DBE外还有什么其他用途?
储存及运输有什么要求?
总之关于这个产品的一切详细资料都要!选为满意答案后再追加100分,拜托各位了!
 neptuneyang1年前1
neptuneyang1年前1 -
 极品小女人 共回答了20个问题
极品小女人 共回答了20个问题 |采纳率95%利用尼龙厂己二酸装置排出的二元酸废液和醇酮装置排出的废液为原料,生产4、5、6碳二羧酸产品.
该产品主要是由己二酸、戊二酸、丁二酸组成的混合物.
本产品为浅绿色或淡黄色固体,是由17±5%的己二酸、58±5%的戊二酸和22±5%的丁二酸组成的混合物.
与碱反应生成酯.用它可分离己二酸、戊二酸和丁二酸.
也可以用来生产多醇聚酯,增塑剂,农用杀虫剂等.
包装:采用衬膜丙纶编织袋包装,每袋净重25kg
A线一级品:三种酸总含量为93-84%
其中:戊二酸60%±5,己二酸27%±5,丁二酸12%±5
B线一级品:己二酸60%±5,戊二酸27%±5,丁二酸12%±5
A线与B线区别(上画线部分),品名:4,5,6碳二羧酸,俗名:混合二元酸,二羧酸,尼龙酸,混酸,二元酸等.1年前查看全部
- 帮忙翻译下,感谢生产薄板而产生的废酸液如果不加处理,直接排放,会造成严重的环境污染.出于环境保护的需要,废酸液必须加以回
帮忙翻译下,感谢
生产薄板而产生的废酸液如果不加处理,直接排放,会造成严重的环境污染.出于环境保护的需要,废酸液必须加以回收,酸再生就是通过对废酸液的回收和处理,生产出工业用盐酸和氧化铁粉.无论是大的钢铁企业,还是中小型钢铁企业都必须配套酸再生相关设备.
本次我们在马钢(合肥)公司承建的酸再生项目,是我单位首次承建类似项目.本文就如何有效地开展酸再生建安项目施工组织,如何更加有效调动施工中各个部门的协调配合,如何加强对关键施工点的控制而展开论述.本文的主要内容包括酸再生钢结构构件和设备的制作和安装;非金属设备的安装;设备调试;现场质量控制;工程质量、文明施工及环保保证措施;安全施工措施及环保保证措施等.
通过这次对德国CMI公司设备的安装,掌握酸再生设备先进的安装技术,为以后承接类似工程打下良好的技术和工艺基础.
 园之果1年前1
园之果1年前1 -
 mckoyo 共回答了14个问题
mckoyo 共回答了14个问题 |采纳率85.7%The waste acid in producing sheet produced without treatment, direct emissions, will cause serious environmental pollution. The need for environmental protection, waste acid liquid must be recycled, acid regeneration is based on the recycling and disposal of waste acid, hydrochloric acid for industrial use and iron oxide powder production. Large iron and steel enterprises, or small and medium-sized iron and steel enterprises must complete acid regeneration equipment.
This time we in Magang (Hefei) acid regeneration project the company contracted, is my unit construction of similar projects for the first time. This article on how to carry out acid regeneration Chienan project construction organization effectively, how to more effectively mobilize the coordination of various departments in the construction of coordination, and discussed how to strengthen the control of key construction points. The main contents of this paper include the production and installation of steel structure and the acid regeneration equipment; non metals equipment installation; commissioning; quality control; quality assurance measures, civilized construction and environmental protection; construction safety measures and environmental protection guarantee measures.
Through the German CMI company equipment installation, master installation technology acid regeneration equipment advanced, is to lay a good technical and technological foundation of similar projects later.1年前查看全部
- (2014•山东模拟)利用工业废酸(含10%H2SO4)处理废弃氧化铜铝矿(含CuO、Al2O3及不溶性杂质,且杂质不参
(2014•山东模拟)利用工业废酸(含10%H2SO4)处理废弃氧化铜铝矿(含CuO、Al2O3及不溶性杂质,且杂质不参与反应)冶炼铝的主要流程如图1:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH,见下表:
回答下列问题:沉淀物 Fe(OH)3 Fe(OH)2 AlOH)3 开始沉淀 2.3 7.5 3.4 完全沉淀 3.2 9.7 4.4
(1)操作②中的离子方程式为______,操作⑤中生成沉淀的离子方程式为______.
(2)操作③中加入过量的H2O2的目的是______.
(3)若Z溶液pH=5(25°C),则溶液中c(NH4+)与c(SO42-)的大小关系为______.
(4)Al-AgO池是一种新型电源,其原理如图2所示:该电池负极反应式为:______.
(5)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中.金属铝为______极;镀铝后能防止钢材腐蚀,其原因是______.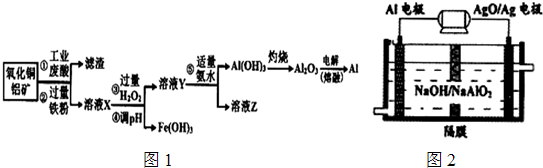
 不告诉你咋地了1年前1
不告诉你咋地了1年前1 -
 zhujiok 共回答了12个问题
zhujiok 共回答了12个问题 |采纳率83.3%解题思路:该工艺流程原理为:氧化铜铝矿加入工业废酸,溶解氧化铜、氧化铝,加入过量铁粉,除去溶液中铜离子,过滤,滤渣中主要为Cu、Fe等,滤液X中含有铝离子、亚铁离子,再加入过氧化氢,将亚铁离子氧化为铁离子,通过调节PH值,使铁离子转化为氢氧化铁而除去,溶液Y含有铝离子等,加入氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝生成金属铝,溶液Z主要含有硫酸铵,
(1)由工艺流程可知,操作②是Fe与Cu2+反应;操作⑤是铝离子与氨水反应生成氢氧化铝;
(2)加入过氧化氢,将亚铁离子氧化为铁离子,便于与铝离子分离;
(3)铵根离子水解,溶液呈酸性,但水解程度不大,据此判断;
(4)Al为负极,在碱性条件下放电生成AlO2-、H2O;
(5)电镀池中镀层金属作阳极,镀层金属作阳极;
在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀.该工艺流程原理为:氧化铜铝矿加入工业废酸,溶解氧化铜、氧化铝,加入过量铁粉,除去溶液中铜离子,过滤,滤渣中主要为Cu、Fe等,滤液X中含有铝离子、亚铁离子,再加入过氧化氢,将亚铁离子氧化为铁离子,通过调节PH值,使铁离子转化为氢氧化铁而除去,溶液Y含有铝离子等,加入氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝生成金属铝,溶液Z主要含有硫酸铵,
(1)由工艺流程可知,操作②是Fe与Cu2+反应,反应离子方程式为:Fe+Cu2+=Fe2++Cu,
操作⑤是铝离子与氨水反应生成氢氧化铝,反应离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Fe+Cu2+=Fe2++Cu;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)加入过氧化氢,将亚铁离子氧化为铁离子,通过调节PH值,使铁离子转化为氢氧化铁而除去,
故答案为:加入过氧化氢,将亚铁离子氧化为铁离子,利于与Al3+分离;
(3)硫酸铵溶液中铵根离子水解,溶液呈酸性,故c(NH4+)<2c(SO42-),但水解程度不大,所以c(SO42-)<c(NH4+),故c(SO42-)<(c(NH4+)<2c(SO42-),
故答案为:c(SO42-)<(c(NH4+)<2c(SO42-);
(4)Al为负极,在碱性条件下放电生成AlO2-、H2O,负极电极反应式为:Al+4OH--3e-=AlO2-+2H2O,
故答案为:Al+4OH--3e-=AlO2-+2H2O;
(5)电镀池中镀层金属作阳极,镀层金属作阳极,故在钢材表面镀铝,镀铝电解池中,金属铝为阳极,
在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀,
故答案为:阳;在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀.点评:
本题考点: 镁、铝的重要化合物;化学电源新型电池;铜金属及其重要化合物的主要性质.
考点点评: 本题以冶炼铝为载体,考查学生对工艺流程的理解、对操作的分析评价、盐类水解、原电池、电解池等,理解工艺流程是关键,是对所学知识的综合考查,难度中等.1年前查看全部
- 要中和含2mol硫酸的废酸溶液,需要氢氧化钠的物质的量是多少?质量是多少?
要中和含2mol硫酸的废酸溶液,需要氢氧化钠的物质的量是多少?质量是多少?
急急!
若用10%的氢氧化钠溶液来中和改废酸溶液,则需要氢氧化钠溶液多少克? fm831年前3
fm831年前3 -
 文仔哥2007 共回答了12个问题
文仔哥2007 共回答了12个问题 |采纳率100%中和反应的实质为:酸当中的氢离子和碱当中的氢氧根离子结合,生成水,
所以酸碱中和的实质用离子方程式可表示为:H(+)+ OH(-)=H2O
根据本题可写为:H(+) + OH(-) = H2O
因为一个硫酸分子中含有两个氢离子,所以1mol硫酸中含有2mol氢离子,
又因为一个NaOH中含有一个氢氧根离子,所以1molNaOH中含有1mol氢氧根离子
所以本题中,氢离子为4mol;则氢氧根离子为4mol
设氢氧化钠溶液的质量为X
则:10%X=40*4
得:X=1600克1年前查看全部
- 金华新闻,实际装有10吨左右废酸.废酸的主要成分有硫酸、硝酸和盐酸,浓度有70%.” 这个毒大吗?
金华新闻,实际装有10吨左右废酸.废酸的主要成分有硫酸、硝酸和盐酸,浓度有70%.” 这个毒大吗?
那个烟有毒吗?我下午三点四十五分左右经过那里,还没到就看见很多粉红色的烟在往空中飘,我骑车走近刚好消防车也来了,那时还没封路,就看见四五个下水管道的盖子里面在冒黑色,往上升就变成粉红色,我还停下来看了一下,一股很刺鼻的味道,反正很难闻,看了两下就走了,回来时路封了,新闻采访车也来了还有几个记者在拍照,问下这个什么酸有毒吗?毒性大不大啊,我好象闻了些进去了,刚开始没封路我是从浓烟里面穿过去的 kelecoke1年前1
kelecoke1年前1 -
 马尾河船歌 共回答了18个问题
马尾河船歌 共回答了18个问题 |采纳率94.4%那是有关部门处理过的,我家就住在旁边,处理过后就无毒了 抢沙发1年前查看全部
- (2012•南通)某科研小组利用工业废酸(10%H2S04)来浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用.流程如下
(2012•南通)某科研小组利用工业废酸(10%H2S04)来浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用.流程如下图所示:
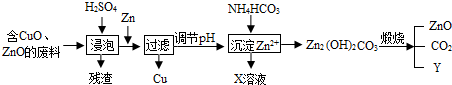
(1)写出氧化锌与硫酸反应的化学方程式:______,Zn→Cu的化学方程式为______.
(2)物质X可用作氮肥,化学式为______;该化肥不能与______混合使用.
(3)请推出物质Y的化学式:______. wangziyilong11年前1
wangziyilong11年前1 -
 ljk2008 共回答了20个问题
ljk2008 共回答了20个问题 |采纳率85%解题思路:(1)根据氧化锌与硫酸反应生成了硫酸锌和水分析,根据Zn、Cu的活泼性分析;
(2)根据废物的综合利用流程图和物质间的反应分析推断物质X的化学式,根据X的性质分析;
(3)根据质量守恒定律推断Y的化学式.(1)氧化锌与硫酸反应生成了硫酸锌和水,反应的化学方程式:ZnO+H2S04═ZnS04+H20;由于锌的活泼性大于铜,可以将锌与硫酸铜反应来实现
Zn→Cu的转变,反应的化学方程式是:Zn+CuSO4═Cu+ZnS04;
(2)由废物的综合利用流程图和物质间的反应可知,物质X是硫酸铵,可用作氮肥,化学式是:(NH4)2S04,由于铵盐与碱性物质反应放出氨气降低肥效,所以,该化肥不能与碱性物质 混合使用;
(3)由元素守恒可知,煅烧碱式碳酸锌碳酸锌生成氧化锌、二氧化碳和水,水的化学式是:H2O.
故答为:(1)ZnO+H2S04═ZnS04+H20Zn+CuSO4═Cu+ZnS04(2)(NH4)2S04,碱性物质(3)H2O.点评:
本题考点: 金属活动性顺序及其应用;常见化肥的种类和作用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题看上去是一道分析推断图框题,但题目考查的知识点全是课本基础知识,熟练掌握酸碱盐的化学性质即可解答本题.1年前查看全部
- 如何测废酸里面铁离子的浓度,急,
 徐无鬼81111年前2
徐无鬼81111年前2 -
 ssl1900 共回答了18个问题
ssl1900 共回答了18个问题 |采纳率94.4%可采用化学沉淀法,取一定体积的废液v,加入过量NaOH搅拌,将沉淀滤出,用蒸馏水清洗数次,再干燥沉淀Fe(OH)3称质量,算出铁的质量分数,再算铁的摩尔质量,最后铁的摩尔质量除以一定体积的废液v,即可知废酸里面铁离子的浓度1年前查看全部
- 若废酸是盐酸硫酸硝酸的混合酸,则从反应产物在农业上再利用角度考虑,固体最好选用纯碱 还是小苏打还是碳
若废酸是盐酸硫酸硝酸的混合酸,则从反应产物在农业上再利用角度考虑,固体最好选用纯碱 还是小苏打还是碳
碳酸氢铵 新A09911年前1
新A09911年前1 -
 Γ九五二七 共回答了13个问题
Γ九五二七 共回答了13个问题 |采纳率76.9%用碳酸氢铵最好,产物分别为氯化铵,硫酸铵,和硝酸铵,都是化肥,可以直接用于农业生产1年前查看全部
- (7分)(2012•南通)某科研小组利用工业废酸(10%H 2 S0 4 )来浸泡含有氧化铜、氧化锌的废料,实现废物的综
(7分)(2012•南通)某科研小组利用工业废酸(10%H 2 S0 4 )来浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用.流程如下图所示:

(1)写出氧化锌与硫酸反应的化学方程式: _________ ,Zn→Cu的化学方程式为 _________ .
(2)物质X可用作氮肥,化学式为 _________ ;该化肥不能与 _________ 混合使用.
(3)请推出物质Y的化学式: _________ . 3860426891年前1
3860426891年前1 -
 totowc 共回答了18个问题
totowc 共回答了18个问题 |采纳率94.4%(1)ZnO+H 2 S0 4 ═ZnS0 4 +H 2 0 Zn+CuSO 4 ═Cu+ZnS0 4 (2)(NH 4 ) 2 S0 4 ,碱性物质(3)H 2 O
(1)氧化锌与硫酸反应生成了硫酸锌和水,反应的化学方程式:ZnO+H 2 S0 4 ═ZnS0 4 +H 2 0;由于锌的活泼性大于铜,可以将锌与硫酸铜反应来实现Zn→Cu的转变,反应的化学方程式是:Zn+CuSO 4 ═Cu+ZnS0 4 ;
(2)由废物的综合利用流程图和物质间的反应可知,物质X是硫酸铵,可用作氮肥,化学式是:(NH 4 ) 2 S0 4 ,由于铵盐与碱性物质反应放出氨气降低肥效,所以,该化肥不能与碱性物质混合使用;
(3)由元素守恒可知,煅烧碱式碳酸锌碳酸锌生成氧化锌、二氧化碳和水,水的化学式是:H 2 O。1年前查看全部
- 题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
最终分别要得到氯化铵和硫酸铵,提示是用溶解性,我不知道具体的, haifeng5321年前2
haifeng5321年前2 -
 yang_cheng7261 共回答了22个问题
yang_cheng7261 共回答了22个问题 |采纳率81.8%查找一下在不同温度下两种物质的溶解度,找一个合适的温度可以分离出两种物质的晶体!1年前查看全部
大家在问
- 1水解电离程度比较为什么NaClO 与 HClO 混合时,水解大于电离CH3COOH 与 CH3COONa 混合时,电离大
- 2如果把物理学家看做哲学家的话,他们是最出色的哲学家
- 3y=根号3cosx-1-2cos^2x的定义域
- 4我的成绩没有以前好(英语翻译)急求答案
- 5全站仪大气修正指数k= 1.是科立达442全站仪。K=0.14,还有一个是K=0.
- 6remains,remainder,rest,remnant的区别
- 7氢离子浓度与铜离子的浓度相差不远,氢离子先放电?xiexie
- 8氢氧化钠滴入碳酸氢钡,生成?碳酸钡+碳酸钠+水?
- 9碳酸钡氢氧化钠法纯化氯化钠为什么会有钡离子
- 10怎么做一个顶天立地的人
- 11英语成绩很不理想 用英语翻译
- 12八分之七-六分之五= 九分之二加二分之一= 七分之六-三分之二= 十分之三+四分之一=
- 13把二分之一,四分之三,五分之四,十二分之五按从小到大的顺序进行排列
- 14氢氧化钙溶液中加入下列哪种物质不能使ph值显著降低?
- 15内江市对城区沿江两岸的部分路段进行亮化工程建设,整个工程拟由甲、乙两个安装公司共同完成.从两个公司的业务资料看到:若两个
