盖斯定律方程式能进行加减?那么不就能构造方程式了?
 ss飘扬2022-10-04 11:39:543条回答
ss飘扬2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 良夜孤枕 共回答了10个问题
良夜孤枕 共回答了10个问题 |采纳率60%- 因为一个反应的过程中的能量变化只与始态和终态有关.与过程无关.盖斯定律就是指过程中的能量变化只与始态和终态有关.那么,一步完成的反应与分几步的能量变化相同.只要把方程式相加减,变成总的变化就可以了.可能这个反应实际不能发生,都没有问题的.
- 1年前
 ikea1220 共回答了104个问题
ikea1220 共回答了104个问题 |采纳率- 方程式叠加只是求某些量的过程。
方程式是 只有实验中会发生的实验,才能写的,一切只以实验事实为依据。 - 1年前
 satan_dream 共回答了2个问题
satan_dream 共回答了2个问题 |采纳率- 盖斯定律的加减只用于计算方程式的反应热上 而有的反应的发生是有条件的 不能自己构造方程式
- 1年前
相关推荐
- (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
 (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
热效应相同.试运用盖斯定律回答下列问题:
已知:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q1 kJ/mol,
C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,H2O(g)=H2O(l);△H3=-Q3 kJ/mol.若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为______kJ.
(2)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
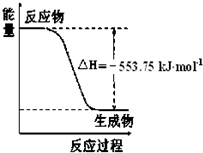
①如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请写出表示丙烷燃烧热的热化学方程式______.
②近年来已经研制出丙烷燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式:______.
③某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出 3360ml(标准状况)氧气体,阴极析出金属 10.4g,在该含氧酸盐中金属的化合价为______,在该实验中,若不考虑能量的损失,电池中消耗丙烷的质量最少是______g(结果精确至0.01g).
④二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔.1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为______. 98988111年前1
98988111年前1 -
 我有你就够了 共回答了20个问题
我有你就够了 共回答了20个问题 |采纳率100%解题思路:(1)依据热化学方程式,结合盖斯定律计算得到热化学方程式;
(2)①分析图象得到生成1mol水的焓变△H=-553.75KJ/mol;依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
②丙烷燃料电池,该电池的电解质溶液为KOH溶液,燃料在负极失电子发生氧化反应,氧气再正极得到电子发生还原反应,注意电解质溶液为碱溶液的环境;
③依据电解过程中电极反应中电子转移守恒,计算氧气和金属的计算关系得到;做为电池电极溶液整个电路中电子转移守恒得到丙烷物质的量,结合摩尔质量计算质量;
④依据热化学方程式结合混合气体物质的量和放热列式计算得到二甲醚和丙烷物质的量之比.(1)①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q1 kJ/mol,
②C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l);△H3=-Q3 kJ/mol.
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q1-Q2+3Q3)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q1-0.5Q2+1.5Q3 )KJ,
故答案为:0.5Q1-0.5Q2+1.5Q3;
(2)①图象是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol,则写出的热化学方程式为:
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol;
②丙烷燃料电池,该电池的电解质溶液为KOH溶液,燃料丙烷在负极失电子发生氧化反应,电极反应为:C3H8-20e-+26 OH-=3CO32-+17H2O,
故答案为:C3H8-20e-+26 OH-=3CO32-+17H2O;
③某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出 3L360ml(标准状况)氧气物质的量=[3.36/22.4L/mol]=0.15mol,阴极析出金属 10.4g,物质的量=[10.4g/52g/mol]=0.2mol;依据电子守恒,结合电极反应得到:阳极极反应:4OH--4e-=2H2O+O2↑,阴极电极反应:Mx++xe-=M;依据电子守恒得到,
xO2~4xe-~4M
x4x 4
0.15mol 0.6mol 0.2mol
x=3;
依据电子转移守恒可知,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);1molC3H8(g)反应电子转移20mol,转移0.6mol电子消耗丙烷为0.03mol;电池中消耗丙烷的质量=0.03mol×44g/mol=1.32g;
故答案为:+3;1.32;
④1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,设1mol混合气体中二甲醚物质的量x,丙烷物质的量为1-x,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,得到丙烷燃烧放热(1-x)2215KJ;依据条件得到:1645KJ-1455xKJ=(1-x)2215KJ,计算得到x=0.75,则混合丙烷物质的量为0.25mol,则混合气体中丙烷和二甲醚物质的量之比=0.25:0.75=1:3,故答案为:1:3.点评:
本题考点: 用盖斯定律进行有关反应热的计算;有关反应热的计算;热化学方程式;化学电源新型电池.
考点点评: 本题考查了热化学方程式的知识分析,热化学方程式的计算,盖斯定律的计算应用,电极原理的电子守恒的计算应用,电极反应书写方法,电极反应计算应用是解题关键,题目难度中等.1年前查看全部
- (1)1840年前后,瑞士科学家盖斯指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态
(1)1840年前后,瑞士科学家盖斯指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态
(1)1840年前后,瑞士科学家盖斯指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定律”.现已知:在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.31kJ/mol、285.83kJ/mol和393.5kJ/mol,则反应C(s)+2H2(g)═CH4(g)的反应热△H=______,根据以上信息,你认为“盖斯定律”在我们确定一些化学反应的反应热时有何重要意义:______.
(2)已知:2H2(g)+O2(g)═2H2O(g)△H12H2(g)+O2(g)═2H2O(l)△H22CO(g)+O2(g)═2CO2(g)△H3
①1mol液态水转化为气态水的焓变△H为______
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是______.
 xyj99991年前1
xyj99991年前1 -
 rose的谎言 共回答了22个问题
rose的谎言 共回答了22个问题 |采纳率86.4%(1)实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol,则它们的热化学反应方程式分别为:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;
②H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ/mol;
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol;
根据盖斯定律,由①+②×2-③得,C(s)+2H2(g)=CH4(g),△H=[(-393.5kJ/mol)+(-285.8kJ/mol)×2]-(-890.3kJ/mol)=-74.8kJ/mol,
在我们确定一些化学反应的反应热,有些反应很难实现或很难直接测定其反应热,可以用“盖斯定律”间接测定,故“盖斯定律”在我们确定一些化学反应的反应热时可以帮助我们间接的测定一些反应的反应热.
故答案为:-74.8kJ/mol;对于一些很难用实验方法直接测定热量变化的化学反应的反应热可以用“盖斯定律”间接测定;
(2)①2H2(g)+O2(g)=2H2O(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
两式相减除以2得到:H2O(l)═H2O(g)△H=
△H1?△H2
2kJ/mol;故答案为:H2O(l)═H2O(g)△H═
△H1?△H2
2kJ/mol;
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,设氢气和一氧化碳物质的量分别为x,y
由热化学方程式2H2(g)+O2(g)=2H2O(g)△H1 可知,Xmol氢气燃烧放出的热量为:
x△H1
2KJ
由热化学方程式2CO(g)+O2(g)=2CO2(g)△H3 可知,ymolCO燃烧放出的热量为:
y△H3
2KJ
则
x△H1
2KJ=
y△H3
2KJ 解得[X/y]=
△H1
△H3
所需CO和H2的体积比等于物质的量之比=
△H1
△H3,
故答案为:
△H1
△H3.1年前查看全部
- 盖斯定律疑问.请看上面的百度百科词条,为什么给盖斯定律加了一个“定容”,定容好像和盖斯定律无关啊?
 犬_犬1年前2
犬_犬1年前2 -
 无敌laura 共回答了25个问题
无敌laura 共回答了25个问题 |采纳率88%因为Hess得出这个结论使用了状态函数的概念.
只有在恒压条件下,反应热全部用于使焓增加.
只有在定容条件下,反应热全部用于是热力学能增加.
而焓与热力学能都是状态函数,众所周知状态函数只与过程的始末态相关,与中间经历了怎样的过程无关.
而热和功,你的物理老师肯定告诉过你这俩没有一个具备状态函数的特点.它们都不是状态函数,都与经历的过程有关.
好了,如果不是恒压过程/定容过程,那么热必定不会完全提供给焓/热力学能,那么剩下的热一定与化学反应过程有关,那么建立在状态函数法基础之上的Hess定律当然就不能适用了.
换一种说法,Hess定律是热力学第二定律的直接应用.我们之所以可以使用Hess定律来衡量一个复杂反应的热效应,是因为Hess定律是这样定义的:总反应热只与反应的始末态相关,与反应经历了怎样的过程无关.对吧?这样我们就可以把一个复杂的反应分解成许许多多简单的反应,然后分别测量这些简单反应的热效应,加和之后肯定与复杂反应的热效应相等.
但是呢,如果Hess定律的使用前提被破坏掉了呢?也就是说,复杂反应的总反应热不单单与始末态相关,还与它经历的过程有关的时候,Hess定律还正确么?答案当然是否定的.而为了使Hess定律的使用前提有效,故而必须规定恒压/定容条件下才能使用Hess定律.反过来说,如果不在恒压/定容的条件下,那么复杂反应的总反应热一定与过程有关.
也就是说,只有在可以用焓与热力学能衡量全部的反应热时,Hess定律才是正确的,因为焓与热力学能的计算只需始末态的数据而不关心过程.状态函数如果现在还没讲的话可以先放着不管~只需要记住状态函数只与始末态有关而与过程无关即可.1年前查看全部
- 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定
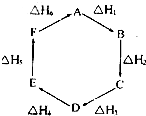 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )
A.A→F,△H=-△H 6
B.△H1+△H 2+△H 3+△H 4+△H 5+△H 6=1
C.C→F,△H=△H 1+△H 2+△H 6
D.△H 1+△H 2+△H 3═△H 4+△H5+△H 6 流星夜雨落1年前1
流星夜雨落1年前1 -
 飘香四季美 共回答了28个问题
飘香四季美 共回答了28个问题 |采纳率82.1%解题思路:盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关;反应的分析改变,焓变符号改变.A、F→A,△H=△H6,则A→F,△H=-△H6,故A正确;
B、6个△H全部相加,是A→A的△H,应等于零,即△H1+△H 2+△H 3+△H 4+△H 5+△H 6=0,故B错误;
C、F→C的△H=△H6+△H1+△H2,则C→F的△H=-(△H6+△H1+△H2),故C错误;
D、A→D的△H=△H1+△H2+△H3,D→A的△H=△H4+△H5+△H6,二者的绝对值相等,符号相反,即|△H 1+△H 2+△H 3|=|△H 4+△H5+△H 6|,故D错误;
故选A.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了盖斯定律的含义理解和计算应用,主要是焓变的分析判断,题目难度中等.1年前查看全部
- 盖斯定律到底如何应用?那个加合法看了半天还是不知道他怎么化的 0 0郁闷了
 华视9111年前1
华视9111年前1 -
 tybbting 共回答了14个问题
tybbting 共回答了14个问题 |采纳率85.7%所有生成物和反应物看成多元一次方程的未知数,把反应热看作生成物的一项,式与式之间的加减小学就学过了,等式左右都出现的项可以消去.1年前查看全部
- (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同. 试运用盖斯定律回答下列问题:
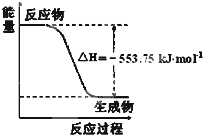 (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同. 试运用盖斯定律回答下列问题:
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同. 试运用盖斯定律回答下列问题:
已知:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH(l);
△H2=-Q2 kJ/mol,H2O(g)=H2O(l);△H3=-Q3 kJ/mol.若使23g液态无水酒精完全
燃烧,并恢复到室温,则整个过程中放出的热量为______kJ.
(2)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)
过程中的能量变化图,请写出表示丙烷燃烧热的热化学方程式______. wxppjf1年前1
wxppjf1年前1 -
 明天的阳光更灿烂 共回答了16个问题
明天的阳光更灿烂 共回答了16个问题 |采纳率93.8%解题思路:(1)依据热化学方程式,结合盖斯定律计算得到热化学方程式,即可解答;
(2)分析图象得到生成1mol水的焓变△H=-553.75KJ/mol;依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变.(1)①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q1 kJ/mol,
②C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l);△H3=-Q3 kJ/mol.
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q1-Q2+3Q3)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q1-0.5Q2+1.5Q3 )KJ,△H=(-0.5Q1+0.5Q2-1.5Q3)KJ/mol
,故答案为:(0.5Q1-0.5Q2+1.5Q3);
(2)图象是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol,则写出的热化学方程式为:
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol.点评:
本题考点: 反应热和焓变;有关反应热的计算.
考点点评: 本题考查了热化学方程式的书写、盖斯定律的运用,题目难度不大.1年前查看全部
- 热反应方程式的高一化学题1840年盖斯根据大量实验得出规律:“不管化学反应是一步完成还是分几步完成,只要反应的始态与终态
热反应方程式的高一化学题
1840年盖斯根据大量实验得出规律:“不管化学反应是一步完成还是分几步完成,只要反应的始态与终态均相同,其热效应总是相同的"
(1)、已知:①C(石墨,s)+O2(g)——》CO2(g)+393.5kJ
②CO(g)+0.5O2(g)——》CO2(g)+282.6kJ
则C(石墨)跟CO2气体反应生成CO气体的热化学方程式是:
(2)、已知白磷和红磷分别在氧气中完全燃烧:
①P4(白磷)+5O2(g)——》P2O5(s)+2983.2kJ
②4P(红磷)+5O2(g)——》P2O5(s)+2954kJ
写出红磷转化为白磷的热化学方程式:
根据该热化学方程式,可推知红磷与白磷相比较,(红磷/白磷)更稳定 0315lcy1年前5
0315lcy1年前5 -
 楼上好乘凉 共回答了26个问题
楼上好乘凉 共回答了26个问题 |采纳率88.5%(1) C(s)+CO2(g)+171.7kj——》2 CO(g)
(2) 4P(红磷)+29.2kj——》P4(白磷) 红磷要吸热才能转化成红磷,能量低的物质更稳定,所以红磷比白磷稳定1年前查看全部
- 1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应
1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.”这是18世纪发现的一条重要规律,称为盖斯定律.已知1mol 金刚石和石墨分别在氧气中完全燃烧时放出的热量为:金刚石,395.41kJ;石墨,393.51kJ.则金刚石转化石墨时,放热还是吸热?______,其数值是_______,由此看来更稳定的是______.若取金刚石和石墨混合晶体共1mol 在O 2 中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为______(用含Q的代数式表示).  蓝色梦依旧1年前0
蓝色梦依旧1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的观点“不管化学过
同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究.已知:
P4(s、白磷)+5O2(g)═P4O10(s);△H=-2983.2kJ•mol-1
P(s、红磷)+[5/4] O2(g)═[1/4]P4O10(s);△H=-738.5kJ•mol-1
试写出白磷转化为红磷的热化学方程式______. bbamm991年前1
bbamm991年前1 -
 guoyanyunyan 共回答了16个问题
guoyanyunyan 共回答了16个问题 |采纳率87.5%解题思路:利用盖斯定律可以解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.已知:①P4(s、白磷)+5O2(g)═P4O10(s);△H=-2983.2kJ•mol-1
②P(s、红磷)+[5/4] O2(g)═[1/4]P4O10(s);△H=-738.5kJ•mol-1
据盖斯定律,①-②×4可得:P4(s,白磷)═4P(s,红磷)△H═-2983.2kJ•mol-1-(-738.5kJ•mol-1)×4=-29.2 kJ•mol-1
故答案为:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查学生利用盖斯定律来计算化学反应的焓变这一知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。已知:
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。已知:
H 2 O(g)= H 2 O(l) △H 1 =-Q 1 kJ·mol -1 (Q 1 >0)
C 2 H 5 OH(g)= C 2 H 5 OH(l) △H 2 =-Q 2 kJ·mol -1 (Q 2 >0)
C 2 H 5 OH(g)+3O 2 (g)= 2CO 2 (g)+3H 2 O(g) △H 3 =-Q 3 kJ·mol -1 (Q 3 >0)
若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)[ ]A.Q 1 + Q 2 +Q 3
B.0.5(Q 1 +Q 2 +Q 3 )
C.0.5 Q 1 -1.5Q 2 +0.5Q 3
D.1.5 Q 1 -0.5Q 2 +0.5Q 3 pansy60231年前1
pansy60231年前1 -
 爱上浪漫的紫雨 共回答了20个问题
爱上浪漫的紫雨 共回答了20个问题 |采纳率80%D1年前查看全部
- guess 怎么读一个手表的牌子中文该怎么读?是意思是“猜”的盖斯,
 源儿小小1年前1
源儿小小1年前1 -
 逆天唯我 共回答了18个问题
逆天唯我 共回答了18个问题 |采纳率88.9%法国牌子吧 古依斯1年前查看全部
- 盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.已知:①H 2
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.已知:①H 2
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
已知:①H 2 O(g)═H 2 O(l);△H=-Q 1 kJ/mol;
②C 2 H 5 OH(g)═C 2 H 5 OH(l);△H=-Q 2 kJ/mol;
③C 2 H 5 OH(g)+3O 2 (g)═2CO 2 (g)+3H 2 O(g);△H=-Q 3 kJ/mol.
下列判断正确的是( )A.酒精的燃烧热为Q 3 kJ B.若使23 g液体酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q 1 -0.5Q 2 +0.5Q 3 )kJ C.H 2 O(g)→H 2 O(l)释放出了热量,所以该过程为化学变化 D.从反应③可知1mol C 2 H 5 OH(g)的能量高于2CO 2 (g)和3H 2 O(g)的总能量
 神奇熊猫宝宝1年前1
神奇熊猫宝宝1年前1 -
 chris_zley 共回答了12个问题
chris_zley 共回答了12个问题 |采纳率100%A、C 2 H 5 OH(g)+3O 2 (g)═2CO 2 (g)+3H 2 O(g);△H=-Q 3 kJ/mol.反应中生成的水是气体,不是稳定氧化物,故燃烧热不是Q 3 kJ,故A错误;
B、依据热化学方程式:①H 2 O(g)═H 2 O(l);△H=-Q 1 kJ/mol;
②C 2 H 5 OH(g)═C 2 H 5 OH(l);△H=-Q 2 kJ/mol;
③C 2 H 5 OH(g)+3O 2 (g)═2CO 2 (g)+3H 2 O(g);△H=-Q 3 kJ/mol.
结合盖斯定律计算,③-②+①×3;得到C 2 H 5 OH(l)+3O 2 (g)═2CO 2 (g)+3H 2 O(l);△H=-(3Q 1 -Q 2 +Q 3 )kJ/mol.
23 g液体酒精物质的量为0.5mol,反应放热为:(1.5Q 1 -0.5Q 2 +0.5Q 3 )kJ,故B正确;
C、气态水变化为液态水是物质状态变化,无新物质生成;故C错误;
D、③C 2 H 5 OH(g)+3O 2 (g)═2CO 2 (g)+3H 2 O(g);△H=-Q 3 kJ/mol.反应是放热反应,1mol C 2 H 5 OH(g)和3molO 2 的总能量高于2CO 2 (g)和3H 2 O(g)的总能量,故D错误;
故选B.1年前查看全部
- 焓指的是能量还是单指热能?在一个化学变化之中向各形式的能的转化量的比值为定值吗?假设焓单指热能,那么我们怎样由盖斯定理推
焓指的是能量还是单指热能?在一个化学变化之中向各形式的能的转化量的比值为定值吗?假设焓单指热能,那么我们怎样由盖斯定理推出 在一个化学变化之中向各形式的能的转化量的比值为定值?如果不成比例,怎样由此事实说明盖斯定理的逻辑错误?注:如果假设不成立,此问题无意义.
 7686967686961年前1
7686967686961年前1 -
 小虫8822 共回答了27个问题
小虫8822 共回答了27个问题 |采纳率92.6%焓 hán ㄏㄢˊ ◎ 物理学上指单位质量的物质所含的全部热能.亦称“热函”.熵 shāng ㄕㄤˉ ◎ 物理学上指热能除以温度所得的商,标志热量转化为功的程度.◎ 科学技术上泛指某些物质系统状态的一种量(liàng)度,某些物质系统状态可能出现的程度.亦被社会科学用以借喻人类社会某些状态的程度.1年前查看全部
- 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定
 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,由如图判断下列关系错误的是( )
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,由如图判断下列关系错误的是( )
A.A→F,△H=-△H6
B.△H1+△H 2+△H 3+△H 4+△H 5+△H6=1
C.C→F,|△H|=|△H 1+△H 2+△H 6|
D.△H1+△H2+△H 3=-△H 4-△H5-△H 6 子懿1年前1
子懿1年前1 -
 3899 共回答了21个问题
3899 共回答了21个问题 |采纳率95.2%解题思路:盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关;反应的分析改变,焓变符号改变,据此进行解答.A.根据图示可知,F→A的焓变△H=△H6,则A→F焓变为:△H=-△H6,故A正确;
B、6个△H全部相加,是A→A的△H,应等于零,即:△H1+△H 2+△H 3+△H 4+△H 5+△H6=0,故B错误;
C、F→C的焓变为:△H=△H6+△H1+△H2,则C→F的焓变为:△H=-(△H6+△H1+△H2),则:|△H|=|△H 1+△H 2+△H 6|,故C正确;
D、A→D的△H=△H1+△H2+△H3,D→A的△H=△H4+△H5+△H6,二者的绝对值相等,符号相反,故D正确;
故选B.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了盖斯定律的含义及其应用,题目难度不大,试题侧重基础知识的考查,注意掌握盖斯定律的内容及其应用,试题有利于培养学生灵活应用所学知识的能力.1年前查看全部
- 盖斯定律认为能量总是守恒的,不管化学反应过程是一步完成或分几步完成,整个过程的热效应是相同的。
盖斯定律认为能量总是守恒的,不管化学反应过程是一步完成或分几步完成,整个过程的热效应是相同的。
已知:①H 2 O(g)=H 2 O(l) ΔH 1 =-Q 1 kJ/mol
②C 2 H 5 OH(g)=C 2 H 5 OH(l) ΔH 2 =-Q 2 kJ/mol
③C 2 H 5 OH(g)+3O 2 (g)=2CO 2 (g)+3H 2 O(g)ΔH 3 =-Q 3 kJ/mol
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)()A.Q 1 +Q 2 +Q 3 B.1.5Q 1 -0.5Q 2 +0.5Q 3 C.0.5Q 1 -1.5Q 2 +0.5Q 3 D.0.5(Q 1 +Q 2 +Q 3 )  sdluobei1年前1
sdluobei1年前1 -
 习惯apple 共回答了18个问题
习惯apple 共回答了18个问题 |采纳率94.4%B 根据盖斯定律①×3-②+③得,C 2 H 5 OH(l)+3O 2 (g)=3H 2 O(l)+2CO 2 (g) ΔH=(-3Q 1 +Q 2 -Q 3 )kJ/mol=-(3Q 1 -Q 2 +Q 3 )kJ/mol,23 g液态无水酒精即0.5 mol完全燃烧放出的热量为(3Q 1 -Q 2 +Q 3 )...1年前查看全部
- 盖斯定律告诉我们:化学反应不管是一步完成,还是几步完成,其反应热是相同的.已知P4(s,白磷)、P(s,红磷)的燃烧热分
盖斯定律告诉我们:化学反应不管是一步完成,还是几步完成,其反应热是相同的.已知P4(s,白磷)、P(s,红磷)的燃烧热分别是mkJ/mol和n kJ / mol,则热化学方程式P4(s,白磷)=4P(s,红磷)的值为
x05A、(m-4n)kJ/mol B、(n-m)kJ/mol
x05C、4(m-n)kJ/mol D、4(n-m)kJ/mol 梦幻忧郁1年前4
梦幻忧郁1年前4 -
 张金禄 共回答了21个问题
张金禄 共回答了21个问题 |采纳率90.5%答案应该是A
1) P4 + 5O2 == 2P2O5 △H= m
4P + 5O2 == 2P2O5 △H= 4n (是4n的原因是,燃烧热指的是1mol该物质完全燃烧所放出的热量,根据方程式,P的系数为4则燃烧热也为原来的4倍)
2) 上下两式相减,则有 P4 ==4P ,△H = m-4n1年前查看全部
- 按照盖斯定律,结合下列反应方程式,回答问题.已知:
按照盖斯定律,结合下列反应方程式,回答问题.已知:
(1)NH3(g)+HCl(g)=NH4Cl(s)△H=-176KJ•mol-1
(2)NH3(g)+H2O(l)=NH3•H2O(aq)△H=-35.1KJ•mol-1
(3)HCl(g)+H2O(l)=HCl(aq)△H=-72.3KJ•mol-1
(4)NH3•H2O(aq)+HCl(aq)=NH4Cl(aq)+H2O(l)△H=-52.3KJ•mol-1
(5)NH4Cl(S)+H2O(l)=NH4Cl(aq)△H=Q
则第(5)个方程式中的反应热是______ KJ•mol-1. 柯广1年前1
柯广1年前1 -
 hdsd312 共回答了19个问题
hdsd312 共回答了19个问题 |采纳率73.7%解题思路:根据盖斯定律进行解答.根据盖斯定律:(2)+(4)-(1)+(3)得
NH4Cl(S)+H2O(l)=NH4Cl(aq)△H=(-35.1KJ•mol-1)+(-52.3KJ•mol-1)-(-176KJ•mol-1)+(-72.3KJ•mol-1)
即 NH4Cl(S)+H2O(l)=NH4Cl(aq)△H=+16.3KJ•mol-1
所以第(5)个方程式中的反应热是+16.3KJ•mol-1,故答案为:+16.3KJ•mol-1.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.1年前查看全部
- (1)1840年前后,瑞士科学家盖斯指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤
(1)1840年前后,瑞士科学家盖斯指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”.现已知在25℃、101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1和393.5kJ•mol-1,写出表示这三种物质燃烧热的热化学方程式:______;H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ•mol-1H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ•mol-1;______.
并计算反应C(s)+2H2(g)═CH4(g)的反应热△H=______.
(2)已知:2H2(g)+O2(g)═2H2O(g)△H1
2H2(g)+O2(g)═2H2O(l)△H2
2CO(g)+O2(g)═2CO2(g)△H3
①写出液态水转化为气态水的热化学方程式:H2O(l)═H2O(g)△H=△H1−△H2 2 H2O(l)═H2O(g)△H=△H1−△H2 2
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是△H1 △H3 .△H1 △H3  nlj9581年前1
nlj9581年前1 -
 casey19851128 共回答了17个问题
casey19851128 共回答了17个问题 |采纳率94.1%解题思路:(1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据燃烧热的定义写出热化学方程式;
(2)根据燃烧热写出热化学方程式,再利用盖斯定律来计算;
(3)利用盖斯定律来计算;根据物质的质量与热量之间的关系;(1)CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1和393.5kJ•mol-1,写出表示这三种物质燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1;H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8 kJ•mol-1;C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1;H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8 kJ•mol-1;C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1.
(2)①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1;
②C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1;
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
依据盖斯定律,①×2+②-③得到:C(S)+2H2(g)=CH4(g)△H=-74.8KJ/mol;故答案为:-74.8KJ/mol;
(2)①2H2(g)+O2(g)═2H2O(g)△H1
②2H2(g)+O2(g)═2H2O(l)△H2
由[①−②/2]得,H2O(l)═H2O(g)△H=
△H1−△H2
2,故答案为:H2O(l)═H2O(g)△H=
△H1−△H2
2;
②设放出的热量为Q,由2H2(g)+O2(g)═2H2O(g)△H1得需要H2的物质的量[2Q/△H1 ],由2CO(g)+O2(g)═2CO2(g)△H3得需要CO的物质的量为[2Q/△H3],所需CO和H2的体积比=物质的量之比是[△H1/△H3],故答案为:[△H1/△H3];点评:
本题考点: 热化学方程式;有关反应热的计算;用盖斯定律进行有关反应热的计算.
考点点评: 本题主要考查了燃烧热、热化学方程式的书写、盖斯定律的运用以及化学计算,难度不大,根据相关概念即可完成.1年前查看全部
- 英语口语哥们,伙计,怎么说?英语发音是这样的(盖斯),怎么拼写?
 wbjx3361年前5
wbjx3361年前5 -
 zt19831110 共回答了21个问题
zt19831110 共回答了21个问题 |采纳率100%guys 伙计们1年前查看全部
- 1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时
1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律,称为盖斯定律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:
C(金刚石、s)+O 2 (g)=CO 2 (g);△H=-395.41kJ/mol,
C(石墨、s)+O 2 (g)=CO 2 (g);△H=-393.51kJ/mol,
则金刚石转化石墨时的热化学方程式为:__________________________。由此看来更稳定的碳的同素异形体为:____________。若取金刚石和石墨混合晶体共1mol 在O 2 中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为_____________(用含Q的代数式表示)。 吐烟圈1年前0
吐烟圈1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 1840年,俄国化学家盖斯从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖
1840年,俄国化学家盖斯从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的作用,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知7.2g碳在12.8g的氧气中燃烧,至反应物耗尽,放出x kJ热量。已知单质碳的燃烧热为y  则1mol C与反应生成CO的反应热△H为[ ]
则1mol C与反应生成CO的反应热△H为[ ]A.-y 
B.-(10x-y)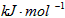
C.-(5x-0.5y)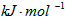
D.-(2.5x-0.5y)
 水果po1年前1
水果po1年前1 -
 另类我醉型 共回答了12个问题
另类我醉型 共回答了12个问题 |采纳率91.7%D1年前查看全部
- (2008•佛山二模)盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.
(2008•佛山二模)盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.
已知:H2O(g)=H2O(l)△H1=-Q1kJ•mol-1(Q1>0)
C2H5OH(g)=C2H5OH(l)△H2=-Q2kJ•mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-Q3kJ•mol-1(Q3>0)
若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)( )
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5 Q1-1.5 Q2+0.5Q3
D.1.5 Q1-0.5 Q2+0.5Q3 yuxin96181年前1
yuxin96181年前1 -
 ameiamei 共回答了19个问题
ameiamei 共回答了19个问题 |采纳率89.5%解题思路:先写出乙醇燃烧生成液态水时的化学方程式,利用盖斯定律及三个已知热化学方程式求出该反应的反应热△H.再次求出23克乙醇的物质的量进一步求出放出的热量.三个已知方程式为H2O(g)=H2O(l)△H1=-Q1kJ•mol-1 (1)
C2H5OH(g)=C2H5OH(l)△H2=-Q2kJ•mol-1 (2)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-Q3kJ•mol-1(3)
乙醇燃烧生成液态水时的化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H
利用盖斯定律求得目标方程式=3(1)-(2)+(3),
即△H=3△H1-△H2+△H3=-(3Q1-Q2+Q3),
23克乙醇的物质的量为[23g/46g/mol]=0.5mol,
故放出的热量为0.5×(3Q1-Q2+Q3),
故选D.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题是一个利用盖斯定律解题的一个典型题目,注意第一步写出目标方程式,第二部利用盖斯定律求出它的反应热,最后利用热化学方程式求反应热,注意化学方程式的处理.1年前查看全部
- 同素异形体互相转换的反应热相当小而且转换速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是
同素异形体互相转换的反应热相当小而且转换速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”的观点来计算反应热.
已知:P4(S,白磷)+5O2(g)=P4O10 (S) H=-2983.2KJ/mol
P(s,红磷)+5/4O2(g)=1/4P4O10(s) H=-738.5KJ/mol
则白磷转化为红磷的热化学方程式为( ),相同情况下,能量状态较低的是( )白磷的稳定性比红磷( )(填高或低) 鼹鼠星人之谜mm1年前4
鼹鼠星人之谜mm1年前4 -
 zhidong871 共回答了14个问题
zhidong871 共回答了14个问题 |采纳率85.7%(1) - 4*(2),得:P4(s) == 4P(s) △H = -29.2KJ/mol
可见白磷转化为红磷是放热的,说明能量状态较低的是( 红磷 )
白磷的稳定性比红磷( 低 )(填高或低)1年前查看全部
- 根据盖斯定律求反应热已知:(1)NH3(g)+HCl(g)==NH4Cl(s) 反应热=-176KJ/mol(2)NH3
根据盖斯定律求反应热
已知:
(1)NH3(g)+HCl(g)==NH4Cl(s) 反应热=-176KJ/mol
(2)NH3(g)+H2O(l)==NH3·H2O(aq) 反应热=-35.1KJ/mol
(3)HCl(g)+H2O(l)==HCl(aq) 反应热=-72.3KJ/mol
(4)NH3(aq)+HCl(aq)==NH4Cl(aq) 反应热=-52.3KJ/mol
求:NH4Cl(s)+2H2O==NH4Cl(aq)的反应热 matsutakako1年前1
matsutakako1年前1 -
 冰雨连天 共回答了19个问题
冰雨连天 共回答了19个问题 |采纳率94.7%NH4Cl(s)== NH3(g)+HCl(g) 反应热=176KJ/mol 即-(1)
NH3(g)+H2O(l)==NH3·H2O(aq)反应热=-35.1KJ/mol即(2)
HCl(g)+H2O(l)==HCl(aq)反应热=-72.3KJ/mol即(3)
NH3(aq)+HCl(aq)==NH4Cl(aq) 反应热=-52.3KJ/mol即(4)
-(1)+(2)+(3)+(4)得到NH4Cl(s)+2H2O==NH4Cl(aq)
176KJ/mol-35.1KJ/mol-72.3KJ/mol-52.3KJ/mol=+16.3kJ/mol1年前查看全部
- 盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
①反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0).如图示意图(图二)中,
能正确表示总反应过程中能量变化的是______(填字母)
②已知:H2O(g)═H2O(l)△H1=-Q1kJ/mol
C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ/mol
C2H5OH (g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ/mol
若使23g C2H5OH(l)完全燃烧,并恢复到室温,则整个过程中放出的热量为______kJ.
③碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+[1/2]O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有______. goodweather41年前1
goodweather41年前1 -
 篮球天才2006 共回答了20个问题
篮球天才2006 共回答了20个问题 |采纳率100%解题思路:①根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题;
②依据热化学方程式,结合盖斯定律计算得到热化学方程式;
③设计实验、利用盖斯定律计算C(s)+1/2O2(g)=CO(g)的△H,需要知道碳和一氧化碳的燃烧热才能计算得到;①由反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)可以看出,A+B→C(△H<0)是放热反应,A和B的能量之和大于C,由①A+B→X (△H>0)可知这步反应是吸热反应,X→C(△H<0)是放热反应,故X的能量大于A+B;A+B的能量大于C;X 的能量大于C,图象d符合,
故答案为:d;
②依据盖斯定律计算;
①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q3 kJ/mol,
②C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l);△H3=-Q1 kJ/mol.
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q3-Q2+3Q1)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q3-0.5Q2+1.5Q1 )KJ;
故答案为:0.5Q3-0.5Q2+1.5Q1;
③设计实验、利用盖斯定律计算C(s)+1/2O2(g)=CO(g)的△H,需要知道碳和一氧化碳的燃烧热才能计算得到;
故答案为:碳、一氧化碳的燃烧热.点评:
本题考点: 反应热和焓变;有关反应热的计算.
考点点评: 本题考查了盖斯定律的计算应用,物质的能量分析应用和化学反应的能量变化,热化学方程式的计算和盖斯定律的计算应用是解题关键,题目难度中等.1年前查看全部
- 天才少年------比尔.盖斯 读了短文,你认为比尔.盖斯取得成功的因素有哪些
 金龙鱼000071年前1
金龙鱼000071年前1 -
 tonly529 共回答了18个问题
tonly529 共回答了18个问题 |采纳率88.9%1、适应生活
2、努力去成功,那才是你的人格资本
3、别希望不劳而获
4、习惯律己
5、不要忽视小事
6、从错误中吸取教训
7、事事自己动手
8、你往往只有一次机会
9、时间在你手中
10、做该做的事
11、善待身边的人1年前查看全部
- 按照盖斯定律,结合下列反应方程式,回答问题。已知:
按照盖斯定律,结合下列反应方程式,回答问题。已知:
(1)NH 3 (g)+HCl(g)=NH 4 Cl(s) △H=-176KJ·mol -1
(2)NH 3 (g)+H 2 O(l)=NH 3 ·H 2 O(aq) △H=-35.1KJ·mol -1
(3)HCl(g)+H 2 O(l)=HCl(aq) △H=-72.3KJ·mol -1
(4)NH 3 ·H 2 O(aq)+ HCl(aq)=NH 4 Cl(aq)+ H 2 O(l) △H=-52.3KJ·mol -1
(5)NH 4 Cl(S)+ H 2 O(l)= NH 4 Cl(aq) △H=Q
则第(5)个方程式中的反应热是_________________________ 紫球1年前1
紫球1年前1 -
 puinga 共回答了19个问题
puinga 共回答了19个问题 |采纳率100%+16.3kJ·mol -11年前查看全部
- 盖斯定律认为能量总是守恒的:化学反应无论是一步完成还是分步完成,整个过程中的热效应是相同的。已知:
盖斯定律认为能量总是守恒的:化学反应无论是一步完成还是分步完成,整个过程中的热效应是相同的。已知:
①H 2 O(g)=H 2 O(l) △H=-Q1kJ/mol
②C 2 H 5 OH(g)=C 2 H 5 OH(l) △H=- Q2 kJ/mol
③C 2 H 5 OH(g)+3O 2 (g)=2CO 2 (g)+3H 2 O(g) △H=-Q3kJ/mol
下列判断正确的是[ ]A.酒精的燃烧热为Q3 kJ
B.若46 g液体酒精完全燃烧且最后恢复到室温,其释放出的热量为(3Q1-Q2+Q3)kJ
C.H 2 O(g)=H 2 O(l)释放出热量,所以该过程为化学变化
D.从反应③可知1 mol C 2 H 5 OH(g)的能量高于2 mol CO 2 (g)和3 mol H 2 O(g)的总能量 当代孔乙己1年前1
当代孔乙己1年前1 -
 丁军珊 共回答了16个问题
丁军珊 共回答了16个问题 |采纳率93.8%B1年前查看全部
- 同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是
同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P 4 (s,白磷)+5O 2 (g)====P 4 O 10 (s)
ΔH="-2" 983.2 kJ·mol -1 ①
P(s,红磷)+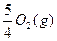 ====
====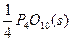
ΔH="-738.5" kJ·mol -1 ②
则白磷转化为红磷的热化学方程式为_________。相同状况下,能量状态较低的是_________;白磷的稳定性比红磷_________(填“高”或“低”)。 jeeyu1年前1
jeeyu1年前1 -
 linjun349 共回答了16个问题
linjun349 共回答了16个问题 |采纳率93.8%P 4 (s,白磷)====4P(s,红磷)
ΔH="-29.2" kJ·mol -1 红磷 低
①-4×②得P 4 (s,白磷)=4P(s,红磷) ΔH=ΔH 1 -4ΔH 2 ="-2" 983.2 kJ·mol -1 -4×(-738.5 kJ·mol -1 )="-29.2" kJ·mol -1 ,即P 4 (s,白磷)====4P(s,红磷) ΔH="-29.2" kJ·mol -1 。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。1年前查看全部
- (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
已知:C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H1=-Q1 kJ•mol-1,
C2H5OH(g)═C2H5OH(l);△H2=-Q2 kJ•mol-1;
H2O(g)═H2O(l);△H3=-Q3 kJ•mol-1.
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为______kJ.(用Q1、Q2、Q3表示)
(2)丙烷是一种优良的燃料,近年来已经研制出丙烷(C3H8)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式______. aik291年前1
aik291年前1 -
 stanleybee 共回答了18个问题
stanleybee 共回答了18个问题 |采纳率100%解题思路:(1)依据热化学方程式,结合盖斯定律计算得到热化学方程式;
(2)丙烷燃料电池,该电池的电解质溶液为H2SO4溶液,燃料在负极失电子发生氧化反应,氧气再正极得到电子发生还原反应,注意电解质溶液为酸溶液的环境.(1)①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H1=-Q1 kJ/mol,
②C2H5OH(g)=C2H5OH(l)△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l)△H3=-Q3 kJ/mol,
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q1-Q2+3Q3)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q1-0.5Q2+1.5Q3 )KJ,
故答案为:0.5Q1-0.5Q2+1.5Q3;
(2)丙烷燃料电池,该电池的电解质溶液为H2SO4溶液,燃料丙烷在负极失电子发生氧化反应,电极反应为:C3H8-20e-+6H2O=3CO2+20 H+,
故答案为:C3H8-20e-+6H2O=3CO2+20 H+.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学电源新型电池.
考点点评: 本题考查了热化学方程式及其电极反应式知识,盖斯定律的运用,电极反应书写方法是解题关键,题目难度中等.1年前查看全部
- 盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
已知:①H2O(g)═H2O(l);△H=-Q1 kJ/mol;
②C2H5OH(g)═C2H5OH(l);△H=-Q2kJ/mol;
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.
下列判断正确的是( )
A.酒精的燃烧热为Q3kJ
B.若使23 g液体酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q1-0.5Q2+0.5Q3)kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.从反应③可知1mol C2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量 一叶清舟my1年前1
一叶清舟my1年前1 -
 此时彼刻喔 共回答了26个问题
此时彼刻喔 共回答了26个问题 |采纳率73.1%解题思路:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、依据盖斯定律结合热化学方程式计算得到;
C、气态水变化为液态水是物质状态变化,无新物质生成;
D、依据反应前后能量守恒分析判断;A、C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.反应中生成的水是气体,不是稳定氧化物,故燃烧热不是Q3kJ,故A错误;
B、依据热化学方程式:①H2O(g)═H2O(l);△H=-Q1 kJ/mol;
②C2H5OH(g)═C2H5OH(l);△H=-Q2kJ/mol;
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.
结合盖斯定律计算,③-②+①×3;得到C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l);△H=-(3Q1-Q2+Q3)kJ/mol.
23 g液体酒精物质的量为0.5mol,反应放热为:(1.5Q1-0.5Q2+0.5Q3)kJ,故B正确;
C、气态水变化为液态水是物质状态变化,无新物质生成;故C错误;
D、③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.反应是放热反应,1mol C2H5OH(g)和3molO2的总能量高于2CO2(g)和3H2O(g)的总能量,故D错误;
故选B.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了反应热量变化的分析判断,燃烧热的概念应用,盖斯定律的计算应用,反应过程中能量守恒的应用,题目较简单.1年前查看全部
- 盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H 2 O(g)= H 2 O(l) △H 1 =-Q 1 kJ·mol -1 (Q 1 >0)
C 2 H 5 OH(g)= C 2 H 5 OH(l) △H 2 =-Q 2 kJ·mol -1 (Q 2 >0)
C 2 H 5 OH(g)+3O 2 (g)=2CO 2 (g)+3H 2 O(g) △H 3 = -Q 3 kJ·mol -1 (Q 3 >0)若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)A.Q 1 + Q 2 +Q 3 B.0.5(Q 1 +Q 2 +Q 3 ) C.0.5 Q 1 -1.5 Q 2 +0.5Q 3 D.1.5 Q 1 -0.5 Q 2 +0.5Q 3  7饭泡8喝91年前1
7饭泡8喝91年前1 -
 nbzhrx 共回答了15个问题
nbzhrx 共回答了15个问题 |采纳率93.3%D
1年前查看全部
- 盖斯定律认为能量总是守恒的,不管化学反应过程是一步完成或分几步 完成,整个过程的热效应是相同的.已知:①H2O
盖斯定律认为能量总是守恒的,不管化学反应过程是一步完成或分几步 完成,整个过程的热效应是相同的.已知:①H2O(g)═H2O(l)△H1=-Q1kJ•mol-1
②C2H5OH(g)═C2H5OH(l)△H=-Q2kJ•mol-1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H=-Q3kJ•mol-1
若使23g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)
A.Q1+Q2+Q3
B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3
D.0.5 (Q1+Q2+Q3) 腐烂的光明1年前1
腐烂的光明1年前1 -
 shirley-YLSHE 共回答了19个问题
shirley-YLSHE 共回答了19个问题 |采纳率84.2%解题思路:根据盖斯定律书写液体酒精燃烧生成液态水的热化学方程式,再根据反应热计算放出的热量.已知:①H2O(g)═H2O(l)△H1═-Q1kJ•mol-1
②C2H 5OH(g)═C2H 5OH(l)△H2═-Q 2 kJ•mol-1
③C2 H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3═-Q3kJ•mol-1
由盖斯定律③-②+①×3得:C2 H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(-Q3+Q 2-3Q1)kJ•mol-1=-(Q3-Q 2+3Q1)kJ•mol-1,
23g液态酒精的物质的量为[23g/46g/mol]=0.5mol,所以完全燃烧恢复到室温,放出的热量为0.5mol×(Q3-Q 2+3Q1)=(0.5Q 3-0.5Q2+1.5Q1)kJ,
故选:B.点评:
本题考点: 有关反应热的计算;反应热和焓变.
考点点评: 考查根据盖斯定律计算反应热,难度中等,关键是构造目标热化学反应方程式,注意反应热的符号.1年前查看全部
- 根据盖斯定律求啊298K时碳和氢气生成1摩尔C2H2反应的焓变
 81155321年前1
81155321年前1 -
 逸寰 共回答了16个问题
逸寰 共回答了16个问题 |采纳率93.8%根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)的反应焓变.
方法是:你把C+02的方程式 加上 H2+02反应的方程式(即等号两边相加)得到④方程式△H4
再把C2H2+O2的反应方程式反过来写,注意△H3=2599KJ/MOL ⑤方程式△H5
最后把④+⑤的方程式等号两边相加,并约去相同项,且△H4+△H5(注意正负号不要改变得出肯定是负值) 即得到1molC2H2的反应焓变了.
答案-630.7kj/mol1年前查看全部
- 下列叙述正确的是( )A.生成物总能量一定低于反应物总能量B.放热反应的反应速率总是大于吸热反应的反应速率C.应用盖斯
下列叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可以计算某些难于直接测量的反应的反应热
D.△H大于零的反应是放热反应 kgsboy1年前1
kgsboy1年前1 -
 内战 共回答了20个问题
内战 共回答了20个问题 |采纳率90%解题思路:A、化学反应不是吸热反应就是放热反应;
B、反应速率是单位时间内物质浓度变化计算,与吸热放热无直接关系;
C、难于直接测量的反应的反应热可以用盖斯定律计算得到;
D、△H大于零的反应是吸热反应.左、化学反应不是吸热反应就是放热反应,生成物总能量不一定低于反应物总能量,故左错误;
B、反应速率是单位时间内物质浓度变化计算,与吸热放热无直接关系,放热反应的反应速率不一定大于吸热反应的反应速率,故B错误;
C、难于直接测量的反应的反应热可以用盖斯定律计算0到,故C正确;
左、△H大于零的反应是吸热反应,故左错误;
故选C.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了化学反应的能量变化判断,盖斯定律的理解应用,题目较简单.1年前查看全部
- 盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
已知:①H 2 O(g)═H 2 O(l);△H=-Q 1 kJ/mol;
②C 2 H 5 OH(g)═C 2 H 5 OH(l);△H=-Q 2 kJ/mol;
③C 2 H 5 OH(g)+3O 2 (g)═2CO 2 (g)+3H 2 O(g);△H=-Q 3 kJ/mol.
下列判断正确的是( )A.酒精的燃烧热为Q 3 kJ B.若使23 g液体酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q 1 -0.5Q 2 +0.5Q 3 )kJ C.H 2 O(g)→H 2 O(l)释放出了热量,所以该过程为化学变化 D.从反应③可知1mol C 2 H 5 OH(g)的能量高于2CO 2 (g)和3H 2 O(g)的总能量  rong6191年前1
rong6191年前1 -
 A20011121 共回答了14个问题
A20011121 共回答了14个问题 |采纳率71.4%A、C 2 H 5 OH(g)+3O 2 (g)═2CO 2 (g)+3H 2 O(g);△H=-Q 3 kJ/mol.反应中生成的水是气体,不是稳定氧化物,故燃烧热不是Q 3 kJ,故A错误;
B、依据热化学方程式:①H 2 O(g)═H 2 O(l);△H=-Q 1 kJ/mol;
②C 2 H 5 OH(g)═C 2 H 5 OH(l);△H=-Q 2 kJ/mol;
③C 2 H 5 OH(g)+3O 2 (g)═2CO 2 (g)+3H 2 O(g);△H=-Q 3 kJ/mol.
结合盖斯定律计算,③-②+①×3;得到C 2 H 5 OH(l)+3O 2 (g)═2CO 2 (g)+3H 2 O(l);△H=-(3Q 1 -Q 2 +Q 3 )kJ/mol.
23 g液体酒精物质的量为0.5mol,反应放热为:(1.5Q 1 -0.5Q 2 +0.5Q 3 )kJ,故B正确;
C、气态水变化为液态水是物质状态变化,无新物质生成;故C错误;
D、③C 2 H 5 OH(g)+3O 2 (g)═2CO 2 (g)+3H 2 O(g);△H=-Q 3 kJ/mol.反应是放热反应,1mol C 2 H 5 OH(g)和3molO 2 的总能量高于2CO 2 (g)和3H 2 O(g)的总能量,故D错误;
故选B.1年前查看全部
- (1)1840年前后,瑞士科学家盖斯指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤
(1)1840年前后,瑞士科学家盖斯指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定律”.现已知:在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.31kJ/mol、285.83kJ/mol和393.5kJ/mol,则反应C(s)+2H2(g)═CH4(g)的反应热△H=______,根据以上信息,你认为“盖斯定律”在我们确定一些化学反应的反应热时有何重要意义:______.
(2)已知:2H2(g)+O2(g)═2H2O(g)△H12H2(g)+O2(g)═2H2O(l)△H22CO(g)+O2(g)═2CO2(g)△H3
①1mol液态水转化为气态水的焓变△H为
kJ/mol△H1−△H2 2
kJ/mol△H1−△H2 2
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是△H1 △H3 .△H1 △H3  iwangcai1年前1
iwangcai1年前1 -
 zxj12265414 共回答了22个问题
zxj12265414 共回答了22个问题 |采纳率90.9%解题思路:(1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.碳单质、氢气、甲烷的热化学方程式分别为:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;
②H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ/mol;
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol,根据盖斯定律计算得到所需热化学方程式;
(2)①依据热化学方程式和盖斯定律计算得到所需让化学方程式;
②依据热化学方程式列式计算得到.(1)实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol,则它们的热化学反应方程式分别为:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;
②H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ/mol;
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol;
根据盖斯定律,由①+②×2-③得,C(s)+2H2(g)=CH4(g),△H=[(-393.5kJ/mol)+(-285.8kJ/mol)×2]-(-890.3kJ/mol)=-74.8kJ/mol,
在我们确定一些化学反应的反应热,有些反应很难实现或很难直接测定其反应热,可以用“盖斯定律”间接测定,故“盖斯定律”在我们确定一些化学反应的反应热时可以帮助我们间接的测定一些反应的反应热.
故答案为:-74.8kJ/mol;对于一些很难用实验方法直接测定热量变化的化学反应的反应热可以用“盖斯定律”间接测定;
(2)①2H2(g)+O2(g)=2H2O(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
两式相减除以2得到:H2O(l)═H2O(g)△H=
△H1−△H2
2kJ/mol;故答案为:H2O(l)═H2O(g)△H═
△H1−△H2
2kJ/mol;
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,设氢气和一氧化碳物质的量分别为x,y
由热化学方程式2H2(g)+O2(g)=2H2O(g)△H1 可知,Xmol氢气燃烧放出的热量为:
x△H1
2KJ
由热化学方程式2CO(g)+O2(g)=2CO2(g)△H3 可知,ymolCO燃烧放出的热量为:
y△H3
2KJ
则
x△H1
2KJ=
y△H3
2KJ 解得[X/y]=
△H1
△H3
所需CO和H2的体积比等于物质的量之比=
△H1
△H3,
故答案为:
△H1
△H3.点评:
本题考点: 热化学方程式;反应热和焓变.
考点点评: 本题考查了热化学方程式书写和盖斯定律的计算应用,掌握基础是关键,题目较简单.1年前查看全部
- 同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的观点“不管化学过
同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究.已知:
P4(s、白磷)+5O2(g)=P4O10(s);△H=-2983.2kJ•mol-1
P(s、红磷)+[5/4]O2(g)=[1/4]P4O10(s);△H=-738.5kJ•mol-1
(1)试写出红磷转化为白磷的热化学方程式______;
(2)由此可知白磷的稳定性比红磷______.(填写“强”或“弱”) 2572582591年前1
2572582591年前1 -
 semiac1 共回答了20个问题
semiac1 共回答了20个问题 |采纳率90%解题思路:(1)根据盖斯定律可以计算化学反应的焓变,进而书写热化学方程式;
(2)物质具有的能量越低越稳定.(1)红磷转化为白磷的化学方程式为:4P(s、红磷)=P4(s、白磷),可以看成是下列两个反应方程式的和:P4O10(s)=P4(s、白磷)+5O2(g);△H=2983.2kJ•mol-1
;4P(s、红磷)+5O2(g)=P4O10(s);△H=-738.5×4kJ•mol-1=-2954kJ•mol-1;
根据盖斯定律,红磷转化为白磷4P(s、红磷)=P4(s、白磷)的△H=2983.2kJ/mol-2954kJ•mol-1=29.2KJ/mol,故答案为:4P(s、红磷)=P4(s、白磷)△H=+29.2KJ/mol;
(2)根据红磷转化为白磷的热化学方程式可知过程是一个吸热反应,所以红磷具有的能量低于白磷,能量越低越稳定,所以白磷的稳定性比红磷弱,故答案为:弱.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查学生利用盖斯定律来计算化学反应的焓变这一知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应
1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.”这是18世纪发现的一条重要规律,称为盖斯定律.已知1mol 金刚石和石墨分别在氧气中完全燃烧时放出的热量为:金刚石,395.41kJ;石墨,393.51kJ.则金刚石转化石墨时,放热还是吸热?______,其数值是_______,由此看来更稳定的是______.若取金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,则金刚石和石墨的物质的量之比为[Q−393.51/395.41−Q][Q−393.51/395.41−Q](用含Q的代数式表示).
 mozhile1年前0
mozhile1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
已知:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,H2O(g)=H2O(l);△H3=-Q3 kJ/mol.若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中△H为______kJ.(用Q1、Q2、Q3表示) 生命是什么1年前1
生命是什么1年前1 -
 mykk66 共回答了20个问题
mykk66 共回答了20个问题 |采纳率100%解题思路:依据热化学方程式,结合盖斯定律计算得到热化学方程式(1)①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q1 kJ/mol,
②C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l);△H3=-Q3 kJ/mol.
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q1-Q2+3Q3)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q1-0.5Q2+1.5Q3 )KJ,△H=(-0.5Q1+0.5Q2-1.5Q3)KJ/mol
,故答案为:-0.5Q1+0.5Q2-1.5Q3.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了热化学方程式的知识分析,盖斯定律的运用,题目难度不大.1年前查看全部
- 按照盖斯定律,结合下述反应方程式,已知:
按照盖斯定律,结合下述反应方程式,已知:
(1)NH3(g)+HCl(g)===NH4Cl(s) △H1=-176kJ/mol
(2)NH3(g)+H2O(l)===NH3.H2O(aq) △H2=-35.1kJ/mol
(3)HCl(g) +H2O(l)===HCl(aq) △H3=-72.3kJ/mol
(4)NH3(aq)+ HCl(aq)===NH4Cl(aq) △H4=-52.3kJ/mol
(5)NH4Cl(s)+2H2O(l)=== NH4Cl(aq) △H5=?
则第(5)个方程式中的反应热△H是________.
[学生]根据盖斯定律和上述反应方程式得:
(4)+ (3)+ (2)- (1)= (5),即Q= +16.3kJ/mol
问,为啥是(4)+ (3)+ (2)- (1)= (5)求详细讲解
我列了两个式子:NH3(g)+HCl(aq)=NH4Cl(aq)△H=-87.4和NH3(g)+HCl(g)=NH4Cl(s)△H=-176 但我认为第2个式子变成第一个 也就是HCl(g)变成(aq)应该是放热,所以是-176-72.3+所求的=-87.4 但和答案不一样啊 美的冒鼻涕泡泡1年前1
美的冒鼻涕泡泡1年前1 -
 gljxrose 共回答了18个问题
gljxrose 共回答了18个问题 |采纳率88.9%不是HCl(g)HCl(g)就可以的问题,前边的氯化氢是变成aq了 但是产物还没变啊.
不是说反应物变了状态,产物状态也会跟着变的,这么想是错的.
4+3后 NH3(aq)+HCl(g) +H2O(l)===NH4Cl(aq) 抵消掉了 HCl(aq)
由此 ,一步步加减1年前查看全部
大家在问
- 1请让我看看你的全家福照片吧用英语怎么说?
- 2下列函数既是奇函数,又在区间[-1,1]上单调递减的是( )
- 3假定你是星光中学的学生李华,拟参加题为“The Importance of Good Sleep”的某英文报举办的英文征
- 4稀释浓硫酸实验现象原因是
- 5根号108等于
- 6如图所示:某海军基地位于A处.在其正南方向200海里处有一重要目标B,在B的正东方向200海里处有一重要目标C,小岛D位
- 7某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如右图.反应在t1min时到达平衡,依图所
- 8已知a+1=b+2=c+3,求代数式(a-b)²+(b-c)²+(a-c)²的值.
- 9世界表层洋流的分布怎么记啊?
- 10英语翻译请问如何用英文翻译:相亲相爱一家人这是一首歌的名字,翻译的时候能否短一点?不过还是要先谢谢maxitang
- 11二是素数还是合数
- 12在( )里填上数字,使每个数都是3的倍数
- 13haven't the foggiest
- 14仿照例句,将下列句子补充完整。例句:没有理想的人,他的生活如荒凉的戈壁,冷冷清清,没有活力。 &
- 15如图,AB平行CD平行EF,∠B=55°,∠CEF=150°,求∠BCE的度数.
