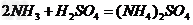盖尔达法分解蛋白质的过程可表示为蛋白质 硫酸铵 氨,为了测定某牛奶样品中蛋白质的含量,取30ml
 05nn2022-10-04 11:39:541条回答
05nn2022-10-04 11:39:541条回答 盖尔达法分解蛋白质的过程可表示为蛋白质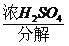 硫酸铵 硫酸铵 氨,为了测定某牛奶样品中蛋白质的含量,取30ml牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(nh 3 ),用50g4.9%稀 氨,为了测定某牛奶样品中蛋白质的含量,取30ml牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(nh 3 ),用50g4.9%稀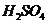 溶液吸收后,剩余的酸需要用38.0g4.0%的naoh溶液中和,问 溶液吸收后,剩余的酸需要用38.0g4.0%的naoh溶液中和,问(1)已知硫酸吸收氨气时发生化合反应生成(nh 4 ) 2 so 4 ,请写出上述过程中与硫酸有关的反应的化学方程式。 (2)30ml牛奶***含有多少克氮? (3)如果蛋白质中含氮16%(质量分数),则牛奶中含蛋白质的质量分数是多少?(牛奶的密度为1.03g/cm 3 ) |

已提交,审核后显示!提交回复
共1条回复
相关推荐
- 对牛奶中的蛋白质进行下列实验:取30.0mL牛奶,用盖尔达法分解蛋白质,把氮完全转化为氨,用50.0mL0.5mol/L
对牛奶中的蛋白质进行下列实验:取30.0mL牛奶,用盖尔达法分解蛋白质,把氮完全转化为氨,用50.0mL0.5mol/L的H2SO4溶液吸收后,剩余的酸用1mol/LnaOH溶液中和,需38.0ml.盖尔达法是:
蛋白质(浓硫酸、分解)→硫氨酸(浓NaOH溶液、水蒸气)→氨
(1)x05求30.0 mL 牛奶中含有多少克氮.
(2)x05如果蛋白质中含氮百分之16(质量分数),计算牛奶中含蛋白质的质量分数
(已知牛奶的密度是1.03g/mL). nicenana1年前1
nicenana1年前1 -
 vivian0524 共回答了16个问题
vivian0524 共回答了16个问题 |采纳率81.3%0.5mol/L硫酸50.0mL中H+有0.5mol/L*0.05L*2=0.05mol
加入的NaOH溶液中OH-有1mol/L*0.038L=0.038mol
由此 可得氨气共消耗了0.012molH+即氨气有0.012mol
M氮=0.012mol*14g/mol=0.168g
(2).M蛋白质=M氮/16%=0.168g/16%=1.05g
牛奶质量 M牛奶=30cm3*1.03g/cm3=30.9g
蛋白质的质量分数=M蛋白质/M牛奶*100%=1.05g/30.9g*100%=3.4%1年前查看全部
- 硫酸与氨的反应原题是:取30.0mL牛奶用盖尔达法分解蛋白质,把氮完全转化成氨,用50.0mL0.5mol/L硫酸吸收后
硫酸与氨的反应
原题是:取30.0mL牛奶用盖尔达法分解蛋白质,把氮完全转化成氨,用50.0mL0.5mol/L硫酸吸收后,剩余的酸用1.0mol/L氢氧化钠溶液中和,需38.0mL.问30.0mL牛奶中含有多少克氮.
用硫酸吸收氨这一步怎么回事,我不会啊!各位帮帮忙 宁静心恒远1年前2
宁静心恒远1年前2 -
 zhgtv 共回答了23个问题
zhgtv 共回答了23个问题 |采纳率100%H2S04+2NH3=(NH4)2SO41年前查看全部
大家在问
- 1买来一些大米,第一次吃了45千克,第二次吃了总数的4分之1,二次吃的恰好比一次少25%,买来多少千克大米.
- 2在两条直线L1和L2之间有AB两点,要从A处出发到L1处,再到L2处,最后再到点B.怎样路程最短?
- 3什么是方差?咋求?
- 4what do you think of the basketball yesterday?— It is the mo
- 5Junelle Lynch knocked on more than 200 doors in the Gayln Ma
- 6用三个6和两个0,写出符合下面要求的五位数。一个零也不读出来的有哪两个?
- 7xy^2-x分解因式
- 8为什么当电压下降10%白炽灯的实际损耗的功率为而定功率的20%?有公式吗
- 92cu2o+cu2s→6cu+so2↑双线桥法
- 10同学们种480棵向日葵,中蓖麻的棵数比向日葵多25%.同学们种蓖麻多少棵?
- 11What nationality are you?是否等于What is your nationality?
- 12核苷一磷酸与核苷酸二者有区别吗?具体区别在哪?
- 13老师让我们以《心中的美景》为题写一篇600字作文
- 14数学题,快一点,过程小红,小明,小刚定期去少年宫学习.小明每隔5天去一次,小红每隔6天去一次.小刚每隔9天去一次,如果9
- 15the dog was in the basket(否定句,一般疑问句及两种回答)