在强碱溶液中NA+ K- ALO2- CO32- 一定能大量共存,为什么?
 狂啸原野2022-10-04 11:39:541条回答
狂啸原野2022-10-04 11:39:541条回答
在强碱溶液中NA+ K- ALO2- CO32- 一定能大量共存,为什么?
CO32-不是不能与OH-共存吗?
CO32-不是不能与OH-共存吗?

已提交,审核后显示!提交回复
共1条回复
 花飞尽flower 共回答了14个问题
花飞尽flower 共回答了14个问题 |采纳率92.9%- 这些离子互相之间不会反应,也都不能与OH-反应.
碳酸根和氢氧根是可以共存的,碳酸氢根不能与氢氧根共存:
HCO3- + OH- = H2O + (CO3)2-
所以LZ肯定是记错了哦,碳酸根是碳酸氢根与氢氧根反应的产物~ - 1年前
相关推荐
- (1/2)请帮我解答这个问题,PH=2的强酸溶液和PH=11的强碱溶液相混合,若要使混合后的溶液的PH=3,则强...
(1/2)请帮我解答这个问题,PH=2的强酸溶液和PH=11的强碱溶液相混合,若要使混合后的溶液的PH=3,则强...
(1/2)请帮我解答这个问题,PH=2的强酸溶液和PH=11的强碱溶液相混合,若要使混合后的溶液的PH=3,则强酸溶液与强碱溶液的体积之比为什么 桃花扇20041年前1
桃花扇20041年前1 -
 懒残大师 共回答了20个问题
懒残大师 共回答了20个问题 |采纳率95%PH=2的强酸溶液和PH=11的强碱溶液分别设为V1 V2
混合后显酸性,则混合后的C(H+)=(0.01V1-0.001V2)/(V1+V2)=0.001
V1:V2=2:91年前查看全部
- 常温下,pH=10的强碱AOH和pH=4的酸HnB等体积混合后溶液显酸性,生成的盐化学式为_______________
常温下,pH=10的强碱AOH和pH=4的酸HnB等体积混合后溶液显酸性,生成的盐化学式为_____________________.AOH与HnB完全中和所得溶液呈_________性,其原因用离子方程式表示为__________________________
 石上生泉1年前3
石上生泉1年前3 -
 野狼社 共回答了13个问题
野狼社 共回答了13个问题 |采纳率92.3%AHn-1B 碱性 Bn- + H2O = OH- + HB(n-1)-1年前查看全部
- 强酸和强碱与糖类物质反应会发生碳化现象吗?
强酸和强碱与糖类物质反应会发生碳化现象吗?
单糖和低聚糖与强酸、强碱的反应规律我是知道的,但由于没有做过试验,我想知道他们相遇后会不会有碳化现象出现,如果出现了能否解释现象,如果没有出现又是为什么? 涞捉苍蝇的1年前1
涞捉苍蝇的1年前1 -
 si_no_v 共回答了16个问题
si_no_v 共回答了16个问题 |采纳率87.5%强酸中只有浓硫酸才会引起碳化反应,这属于脱水反应,强碱不会引起碳化反应1年前查看全部
- 为什么弱酸强碱盐与强酸弱碱盐溶液中由水电离的氢离子浓度等与由水电离的氢氧根离子浓度?
 654485hh1年前1
654485hh1年前1 -
 pingpangdang 共回答了21个问题
pingpangdang 共回答了21个问题 |采纳率85.7%因为水电离出来的氢氧根离子和氢离子浓度永远相同不管是在酸性还是碱性都是一样的
满意请采纳1年前查看全部
- 强酸或强碱在水溶液中电离是属于什么反映?
强酸或强碱在水溶液中电离是属于什么反映?
是放热反应还是吸热反应还是都不是? zjpnc1年前1
zjpnc1年前1 -
 ganlinqun 共回答了15个问题
ganlinqun 共回答了15个问题 |采纳率100%电离一定是吸热反应1年前查看全部
- 为什么等物质的量一元弱酸和一元强碱反应会呈碱性?是因为它们生成的盐导致的吗
 RADO手表1年前1
RADO手表1年前1 -
 yeloth 共回答了21个问题
yeloth 共回答了21个问题 |采纳率81%是的,就是因为它们生成的盐导致的
因为一元弱酸和一元强碱混合后生成强碱弱酸盐,其中强碱可以认为是不会水解的.而弱酸根因为和H+的结合能力较强因此会发生水解,即
(X-)+ H2O = HX + (OH-)
从而使溶液显碱性.
(X-)代表弱酸根,可以不是一价.1年前查看全部
- 氧化铍BeO是两性氧化物,与强碱溶液生成的盐是偏铍酸盐还是四羟基合铍酸盐?
 雪飞飞1年前4
雪飞飞1年前4 -
 三界王 共回答了19个问题
三界王 共回答了19个问题 |采纳率84.2%根据对角线规则,铍与铝的性质相似,也应该生成多羟基盐.注意在老教材中依然沿用偏铝酸的表示方法实际上是不符合事实的.1年前查看全部
- 为什么铝离子不能用强碱沉淀?铝离子都是用浓氨水沉淀.为什么不能用氢氧化钠,亲氧化钾等等沉淀呢?
 九天揽月81101年前4
九天揽月81101年前4 -
 小手术刀 共回答了19个问题
小手术刀 共回答了19个问题 |采纳率89.5%氢氧化铝是两性,会与过量的强碱反应,生成偏铝酸根
方程式是Al(OH)3+OH-=AlO2 - +2H2O
而氨水是弱碱,偏铝酸根只存在于强碱性环境中1年前查看全部
- 三道关于离子共存的题1.以下离子在强碱溶液中可大量共存的是(B)A.K+ Na+ HCO3- Cl-B.Na+ Ba2+
三道关于离子共存的题
1.以下离子在强碱溶液中可大量共存的是(B)
A.K+ Na+ HCO3- Cl-
B.Na+ Ba2+ Cl- NO3-
C.NH4+ K+ Cl- NO3-
D.K+ Na+ ClO- S2-
2.某无色溶液能使紫色石蕊试纸显红色,测出溶液中含有Ba2+和NO3-,以下各组可在溶液中大量共存的是(C)
A.SO4 2-,HCO3-,Cl-,K+
B.Fe2+,Na+,Cl-.Zn2+
C.NH4+,Mg2+,Cl-,Na+
D.CO3 2-,Na+,Cl-,OH-
3.常温下,在无色透明的溶液中,其中[H+]=2*10^-7,能大量共存的是(A)
A.K+,NO3-,Al3+,Cl-
B.MnO4-,K+,SO4 2-,Na+
C.K+,SO4 2-,HCO3 -,Na+
D.Cu2+,Cl-,SO4 2-,K+
答案已经知道了,请告诉我每个错误选项错在哪里, ad5685681年前5
ad5685681年前5 -
 xinhe 共回答了20个问题
xinhe 共回答了20个问题 |采纳率95%1.强碱性溶液
A HCO3(-)+OH(-)=CO3(2-)+H2O
C NH4+会和OH-反应生成一水合氨
D 强氧化性的ClO-会和强还原性的S2-反应
2溶液时酸性的
A Ba2+会和SO42-生成白色沉淀
B Fe2+有浅绿色,不是无色溶液错
D CO32-和H+不能大量共存
3.6<PH=-lg[H+]<7
弱酸性
B中MnO4-是紫红色的,不是无色
C中HCO3-会和H+反应
D中Cu2+蓝色,不是无色1年前查看全部
- 强碱能与二氧化硅反应,那为什么碱液还能放在玻璃瓶中?
 小楠楠_51年前1
小楠楠_51年前1 -
 LAOLIU6666 共回答了20个问题
LAOLIU6666 共回答了20个问题 |采纳率80%不会持续反应,会生成一种氧化膜使强碱和二氧化硅相隔绝.如果接触面积变大的话还会发生反应.4楼的关于接触面的计算方法不太懂.不过好象是那么回事.一般广口瓶都有磨砂口和光的两种,装强碱的玻璃瓶都是光口的.1年前查看全部
- I.强酸与强碱的稀溶液发生中和反应的热化学方程式:H + (aq)+OH - (aq)═H 2 O(1)△H=-57.3
I.强酸与强碱的稀溶液发生中和反应的热化学方程式:H + (aq)+OH - (aq)═H 2 O(1)△H=-57.3kJ•mol -1 1L 0.5mol•L -1 的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H 1 、△H 2 、△H 3 则三者关系为______(用<、>或=表示).
II.在饱和Mg(OH) 2 溶液中c(OH - )=1.0×10 -4 mol/L.,若往该溶液中加入NaOH溶液,使溶液中的c(OH - )变为原来的10倍,则Mg(OH) 2 在此溶液中的溶解度在理论上将变为原来的______倍. happy08081年前0
happy08081年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 化学——电解质(高中知识)①强酸是共价化合物?②强碱是离子化合物?③大多数盐是离子化合物?④弱酸是共价化合物?⑤弱碱是共
化学——电解质(高中知识)
①强酸是共价化合物?
②强碱是离子化合物?
③大多数盐是离子化合物?
④弱酸是共价化合物?
⑤弱碱是共价化合物或者是离子化合物?
(氨水和氢氧化铝是共价化合物?氢氧化铁是离子化合物?)
不要过于繁琐的补充
麻烦正确简明的答案和简单的补充
氢氧化铝到底是共价化合物还是离子化合物? mengwenshaohan1年前4
mengwenshaohan1年前4 -
 mouseyao 共回答了11个问题
mouseyao 共回答了11个问题 |采纳率90.9%1.是
2.是
3.是,Pb(Ac)2,HgCl2等少数除外
4.不一定,如果是有机酸,且含多个酸性基团,可能是离子化合物,因为只要有离子键就是离子化合物
5.一水合氨是共价化合物,氢氧化铁也是共价化合物1年前查看全部
- 用酸滴定碱为什么用已知强酸滴定强碱酚酞过多碱的物质量浓度会偏大?
 文艺小生1年前1
文艺小生1年前1 -
 人类天使 共回答了14个问题
人类天使 共回答了14个问题 |采纳率92.9%强碱滴定强酸常用的指示剂是酚酞,变色后溶液呈现弱碱性.1年前查看全部
- 25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;
25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷(C8H18)的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol
B.KOH(aq)+[1/2]H2SO4(aq)=[1/2]K2SO4(aq)+H2O(l)△H=-57.3kJ/mol
C.C8H18(l)+[25/2]O2(g)=8CO2(g)+9H2O(g)△H=-5518 kJ/mol
D.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol 吃烤肉要喝啤酒1年前1
吃烤肉要喝啤酒1年前1 -
 ttp5858 共回答了10个问题
ttp5858 共回答了10个问题 |采纳率90%解题思路:A、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,醋酸是弱酸,电离要吸热;
B、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,
C、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量;
D、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量,反应热与化学计量数成正比.A、因醋酸是弱酸,电离要吸热,所以该反应的反应热△H不是-57.3kJ/mol,故A错误;
B、符合中和热的概念,故B正确;
C、反应热化学方程式中生成的水是气体,不是稳定氧化物,故C错误;
D、热化学方程式中不是1mol物质燃烧,所以热化学方程式为:2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036kJ/mol,故D错误;
故选B.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了中和热、燃烧热的概念应用,注意概念的内涵理解是解题关键.1年前查看全部
- (1)肥皂是家庭日常用品,通常用油脂与强碱通过______反应来获得,试写出由硬脂酸甘油酯制肥皂的化学方程式:_____
(1)肥皂是家庭日常用品,通常用油脂与强碱通过______反应来获得,试写出由硬脂酸甘油酯制肥皂的化学方程式:______;
(2)请将分离下列有机混合物所用的试剂、分离方法及主要仪器填写在下表中混合物 试剂 分离方法 主要仪器 甲烷(乙烯) ______ ______ ______ 乙酸乙酯(乙酸) ______ ______ ______ 肥皂(甘油) ______ ______ ______  ws110pp1年前0
ws110pp1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 化学有机选择下列说法错误的是:( )A.酸与醇在强碱催化下加热,生成物一定有酯B.乙酸和甲醇可酯化成甲酸乙酯C.酯化反应
化学有机选择
下列说法错误的是:( )
A.酸与醇在强碱催化下加热,生成物一定有酯
B.乙酸和甲醇可酯化成甲酸乙酯
C.酯化反应的逆反应称为水解反应
D.果类,花类中的香味,是由于含有低级脂类 leier2501年前5
leier2501年前5 -
 命人 共回答了16个问题
命人 共回答了16个问题 |采纳率81.3%A和B都是错误的
A.在强碱作用下不可能发生酯化反应(可以想想强碱催化脂类水解)
B.生成的是乙酸甲酯1年前查看全部
- 为什么硝酸强碱盐溶液在蒸发灼烧后得到固体物质为亚硝酸盐
 撒野881年前2
撒野881年前2 -
 chgwei 共回答了17个问题
chgwei 共回答了17个问题 |采纳率100%因为硝酸盐中的+5价N具有强氧化性,在加热时可以氧化-2价的氧(必须是固体形式,溶液不行)
2NaNO3 ===2NaNO2 + O2↑
那么为什么强碱盐能得到亚硝酸盐呢?
这涉及很复杂的问题,关键看按照两种方式分解的倾向大小(△G),哪种更负就按照哪种去分解.对于强碱盐来说生成亚硝酸盐更稳定,对于其他金属来说生成氧化物更稳定.
现在就当一个结论记住好了.
欢迎追问 在线回答1年前查看全部
- 由于碱金属形成的碱均为强碱,所以碱金属形成的盐均不会水解对吗
 天下一贼1年前3
天下一贼1年前3 -
 你丫住嘴 共回答了23个问题
你丫住嘴 共回答了23个问题 |采纳率78.3%楼上说的是错的.
镁并不是碱金属,至于第一主族的金属才是碱金属.
比如钠,钾等等
碱金属形成的是强碱,但并不代表碱金属形成的盐不会水解,因为水解并不只是阳离子能够水解,阴离子也能够水解.
比如在碳酸钠中,钠离子不会水解,但是碳酸根离子会水解.
所以这样的说法是错误的.1年前查看全部
- 等体积等浓度的MOH强碱溶液和HA 弱碱溶液混合后混合溶液中有关离子浓度的关系正确的是?
等体积等浓度的MOH强碱溶液和HA 弱碱溶液混合后混合溶液中有关离子浓度的关系正确的是?
c(M+)+C(OH-)=c(A-)+c(H+)
成立的理由,
00 独自阑珊1年前1
独自阑珊1年前1 -
 昨天今天还是明天 共回答了18个问题
昨天今天还是明天 共回答了18个问题 |采纳率94.4%我觉得是 c(M+)+c(H+)=c(A-)+C(OH-)
对于我的式子 是“电荷守恒 ” 对于所有溶液都是电中性的,阴离子带的电荷数=阳离子的电荷数
而你的式子是 “ c(M+)+C(OH-)=c(A-)+c(H+)” 我就不理解了1年前查看全部
- 强酸和强碱在稀溶液中完全中和生成1molH2O(l),放出57.3kJ热量,浓硫酸与氢氧化钠溶液反应生成1molH2O(
强酸和强碱在稀溶液中完全中和生成1molH2O(l),放出57.3kJ热量,浓硫酸与氢氧化钠溶液反应生成1molH2O(l),
反应放出57.3kJ热量,这句话为什么不对 wewelove1年前1
wewelove1年前1 -
 最佳cc 共回答了19个问题
最佳cc 共回答了19个问题 |采纳率100%浓硫酸与氢氧化钠溶液反应生成1molH2O(l),反应放出大于57.3kJ热量
因为浓硫酸稀析会放出一部分热量1年前查看全部
- 中和滴定,强碱滴入弱酸,应用酚酞.但不会促进弱酸电离吗?怎么测待测弱酸氢离子浓度?
中和滴定,强碱滴入弱酸,应用酚酞.但不会促进弱酸电离吗?怎么测待测弱酸氢离子浓度?
中和滴定,强碱滴入弱酸,应用酚酞.因为生成强碱弱酸盐,显碱性.但不会促进弱酸电离吗?改变了原弱酸氢离子浓度,还怎么测待测弱酸氢离子浓度? 龙嵴1年前2
龙嵴1年前2 -
 cxksfoasdfo 共回答了16个问题
cxksfoasdfo 共回答了16个问题 |采纳率81.3%中和滴定是利用酸和碱反应,间接求出酸的物质的量浓度.中和滴定时,酸的体积、碱的浓度都是已知的,使用指示剂是判断何时恰好酸被完全反应,根据使用碱的体积就可以求出酸的浓度了.好好理解一下中和滴定吧.1年前查看全部
- 苯磺酸钠和氢氧化钠为什么能反应 看到有人说强碱制弱碱 但是亚硫酸钠和苯酚钠都不是弱电解质或沉淀啊
 云飘海1年前1
云飘海1年前1 -
 走叉路的猪 共回答了19个问题
走叉路的猪 共回答了19个问题 |采纳率84.2%苯磺酸钠和氢氧化钠(在溶液中)不能发生反应.
在加热熔融这样比较强烈的条件下,二者才可以发生反应,生成苯酚钠:
C6H5-SO3Na + NaOH → C6H5ONa + Na2SO3
这个反应的发生与“强碱制弱碱”没有任何关系,不要被误导.
在高中阶段,这个反应的原理是比较难解释的,可以把它当做工业上制苯酚的方法记下来.1年前查看全部
- 硫代硫酸钠 是强酸弱碱盐吗?什么叫强酸弱碱盐?NaOH难道不是强碱?
 lk471年前2
lk471年前2 -
 yumincheng 共回答了26个问题
yumincheng 共回答了26个问题 |采纳率96.2%不是.它是强碱弱酸盐.
NaOH是强碱,H2S2O3是弱酸,所以它是强碱弱酸盐.
其他类似1年前查看全部
- 简单化学,在线等XYZ都是第三周期的元素,X的氧化物对应水化物为强碱,Z的原子半径最小。下列说法一定不正确的是如果Y的最
简单化学,在线等
XYZ都是第三周期的元素,X的氧化物对应水化物为强碱,Z的原子半径最小。下列说法一定不正确的是如果Y的最高价氧化物的水化物难溶于水,则Y一定是Al为什么选这个? Cl2和SO2都能用水吸收,减少污染吗?
 xixilove0011年前4
xixilove0011年前4 -
 二进制嘿嘿 共回答了20个问题
二进制嘿嘿 共回答了20个问题 |采纳率80%因为氢氧化铝为沉淀、而铝前面氢氧化物可溶…后面为非金属氧化。物……没有氢痒化物、用水吸收少的可怜,几乎没用……望采纳1年前查看全部
- 硫代硫酸钠怎么水解?滴定的时候硫代硫酸钠是怎样反应的?用 碘酸钾 KIO3 滴定 硫代硫酸钠Na2S2O3它不是强碱弱酸
硫代硫酸钠怎么水解?
滴定的时候硫代硫酸钠是怎样反应的?用 碘酸钾 KIO3 滴定 硫代硫酸钠Na2S2O3
它不是强碱弱酸盐吗?为什么不水解?抛开那个滴定的话呢?会水解的吧.
这样的话,会水解请给方程式;不水解请给理由. ZHOUlangui1年前1
ZHOUlangui1年前1 -
 小肥宝宝 共回答了17个问题
小肥宝宝 共回答了17个问题 |采纳率94.1%硫代硫酸钠不水解.1年前查看全部
- 什么碱能和氢氧化铝反应强碱 有那些碱能反应?
 hsygggggg1年前4
hsygggggg1年前4 -
 瀦姗姗 共回答了20个问题
瀦姗姗 共回答了20个问题 |采纳率85%强碱
常见的有KOH、NaOH、Ba(OH)2 、Ca(OH)21年前查看全部
- 强酸和强碱都有什么性质,
 kk33236231年前1
kk33236231年前1 -
 yixiaosheng 共回答了23个问题
yixiaosheng 共回答了23个问题 |采纳率82.6%就初一而言,只需要这样打就可以了强碱: 溶于水能发生完全电离,溶液能使特定指示剂变色的物质(如使石蕊变蓝,使酚酞变红等),在标准情况下,PH值大于7.在溶液中完全电离的碱是强碱.(最简单的说法)强酸:溶于水能发...1年前查看全部
- 强酸和强碱的中和热怎么定义?
 qq狂歌1年前2
qq狂歌1年前2 -
 棋落无悔 共回答了20个问题
棋落无悔 共回答了20个问题 |采纳率100%在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热.
注意几点:
1、酸和碱必须是稀溶液,因为浓溶液稀释时会有热效应;
2、酸和碱必须是强酸、强碱,因为弱酸或弱碱在中和过程中要电离,吸收热量;
3、必须以生成1 mol水为标准;
4、中和生成的盐必须是可溶盐,因为若生成沉淀,生成沉淀的过程也伴随着热效应,如硫酸和氢氧化钡就不行.1年前查看全部
- 强酸弱碱、强碱弱酸、强酸强碱、弱酸弱碱怎样区分?
强酸弱碱、强碱弱酸、强酸强碱、弱酸弱碱怎样区分?
希望还能 列举出一些 huangfengteng1年前3
huangfengteng1年前3 -
 jc8881234 共回答了22个问题
jc8881234 共回答了22个问题 |采纳率95.5%强酸强碱盐:Na2SO4、NaCl等(不水解,水溶液呈中性)
强酸弱碱盐:AlCl3、Fe2(SO4)3等(水解,水溶液呈酸性)
强碱弱酸盐:Na2CO3、K3PO4等(水解,水溶液呈碱性)
弱酸弱碱盐:(NH4)2CO3、CH3COONH4等(水解,谁强呈谁性)1年前查看全部
- 酸碱指示剂问题为什么强碱滴定弱酸时常用酚酞作指示剂,强酸滴定强碱时常用甲基橙作指示剂?
 玉米粥1年前1
玉米粥1年前1 -
 哨兵的爱 共回答了17个问题
哨兵的爱 共回答了17个问题 |采纳率94.1%强碱滴定弱酸等当点时,溶液相当于强碱弱酸盐溶液,由于水解略显碱性,故应用酚酞(变色范围8-10).
强酸滴定弱碱等当点时,溶液相当于弱碱强酸盐溶液,由于水解略显酸性,故应用甲基橙(变色范围3.1-4.4).1年前查看全部
- 氨水我知道是碱,但是请问是强碱还是弱碱
 Chris_Rcq1年前1
Chris_Rcq1年前1 -
 印小阿 共回答了17个问题
印小阿 共回答了17个问题 |采纳率94.1%弱碱性.
危险标记:20(碱性腐蚀品)
反应平衡常数Kb = 1.8×10−5.
1M氨水的pH值为11.63,大约有0.42%的NH3变为NH4+.
氨水工厂
氨水是实验室中氨的常用来源.它可与含铜(II)离子的溶液作用生成深蓝色的配合物,也可用于配置银氨溶液等分析化学试剂.
物理性质
性状:无色透明液体,有强烈的刺激性气味.
熔点:-77℃
蒸汽压:1.59kPa(20℃)
相对密度:氨含量越多,密度越小.质量分数28%的氨水相对密度0.91,35%的0.88,
电离常数:K=1.8×10ˇ-5(25℃)
稳定性:受热或见光易分解
其它:极易挥发出氨气.浓氨水对呼吸道和皮肤有刺激作用,并能损伤中枢神经系统.1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH 3 OH+3O 2 +4OH - 2CO 3 2- +6H 2 O,则下列说法错误的是[ ]
2CO 3 2- +6H 2 O,则下列说法错误的是[ ]A.放电时CH 3 OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH 3 OH-6e - +8OH - =CO 3 2- +6H 2 O
D.充电时每生成1mol CH 3 OH转移6mol电子 coangel1年前1
coangel1年前1 -
 poppy05 共回答了10个问题
poppy05 共回答了10个问题 |采纳率90%A1年前查看全部
- 25度时,将ph=5的强酸与ph=10的强碱溶液等体积混合,求混合溶液ph
 evlancer1年前3
evlancer1年前3 -
 showmutou 共回答了13个问题
showmutou 共回答了13个问题 |采纳率92.3%强酸pH=5 ;
强碱pH=10.pOH=14-10=4 .
混合液的氢氧根量浓度:
[OH]=[10^-4 - 10^-5]/2
=[10*10*-5 - 10^-5]/2
=0.5*9*10^-5
=4.5*10*-5
混合液 pOH=-(lg4.5+lg10^-5)
=-(0.6532 - 5)
=-(-4.35)
=4.35
混合液 pH=14-4.35=9.65 .1年前查看全部
- 常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198 g·mol -1 ,且其中各元素的质量比为:钾:金属B:氧=39:28:32。
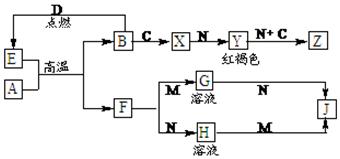
请回答下列问题:
(1)C的化学式为 ,Z的化学式为 。
(2)写出检验X中阳离子的方法 。
(3)写出E和A在高温下反应的化学方程式为 。
(4)写出A和N反应的离子方程式 。 yinxiangsc1年前1
yinxiangsc1年前1 -
 gjl6866 共回答了15个问题
gjl6866 共回答了15个问题 |采纳率100%1年前查看全部
- 在无色强碱溶液中,下列各组离子能够大量共存的是
在无色强碱溶液中,下列各组离子能够大量共存的是
A NH4+ HCO3- Cl- K+
B Cl- Na+ NO3- Ca2+
C K+ Ba2+ Cl- NO3-
D Cu2+ NH4+ I- Cl- bud_chen1年前1
bud_chen1年前1 -
 mjerome 共回答了19个问题
mjerome 共回答了19个问题 |采纳率89.5%A 会生成氨气 HCO3- 会变成CO3 2-
B 会生成氢氧化钙微溶物
C 可以
D 有色 而且会有沉淀会有气体1年前查看全部
- 怎么判断酸碱混合是哪个过量?强酸弱碱或强碱弱酸混合,什么时候考虑生成物的水解,什么时候不考虑
 xjktgsyhw1年前3
xjktgsyhw1年前3 -
 ydy123 共回答了16个问题
ydy123 共回答了16个问题 |采纳率81.3%看混合后氢离子和氢氧根哪个的物质的量多,哪个就过量.因为要进行中和反应,生成水,多的就是过量的.
生成物的水解只要是一强一弱生成的盐都要考虑,两个都为强就不用考虑1年前查看全部
- 一元强酸(0PH=A)和一元强碱(PH=B)以VA和VB的体积混合恰好中和.(在线等!答得好有追加分!)
一元强酸(0PH=A)和一元强碱(PH=B)以VA和VB的体积混合恰好中和.(在线等!答得好有追加分!)
一元强酸(0PH=A)和一元强碱(PH=B)以VA和VB的体积混合恰好中和,已知VA 告知1年前1
告知1年前1 -
 ssm163 共回答了22个问题
ssm163 共回答了22个问题 |采纳率90.9%A=3 B=6.都酸性不可能
A=5 B=10
[H+]A=1*10^-5MOL/L
[OH-]B=1*10^-4MOL/L
所以VA>VB,也不可能1年前查看全部
- 下列物质中属于强碱的是( ) A小苏打 B氨水 C洗涤剂 D氢氧化钠
 南宁的天空1年前3
南宁的天空1年前3 -
 片片啊片片 共回答了22个问题
片片啊片片 共回答了22个问题 |采纳率81.8%选D.
A.小苏打是盐
B.氨水是弱碱
C.洗涤剂是乳化剂
D.氢氧化钠是强碱
主要靠记忆这个内容.1年前查看全部
- 酚酞遇浓的强碱为什么不变色?
 tearn1年前2
tearn1年前2 -
 御风行客 共回答了22个问题
御风行客 共回答了22个问题 |采纳率86.4%因为酚酞在PH=8~10变色,如果碱性太强,PH>10,那么照样是无色.1年前查看全部
- 室温下测得强碱NaOH的浓度为1.0 x 10-3 mol.L-1,计算该溶液的pH.
 jingweiju1101年前1
jingweiju1101年前1 -
 pipi1288 共回答了17个问题
pipi1288 共回答了17个问题 |采纳率76.5%其中氢氧根浓度为0.001则PH为111年前查看全部
- 强酸与强碱不等体积混合求PH值.例如:PH=1的盐酸与PH=13的强碱不等体积混合,体积比为1:9,混合后PH值为多少?
 击败猫的鱼1年前1
击败猫的鱼1年前1 -
 lq3623541 共回答了19个问题
lq3623541 共回答了19个问题 |采纳率89.5%计算混合前的氢离子数和氢氧根数,再算混合后的氢离子浓度.比如本题,酸的氢离子数是0.1mol,碱的氢氧根数是0.9mol,中和后还剩0.8mol,若溶液体积是10L,则氢氧根浓度为0.08mol/L,用十的负十四次方除以它,再求负指数,可以得到pH为11-log1.25(这里假设1:9就是1L:9L)1年前查看全部
- 强酸和强碱反映生成.强酸和弱碱生成.之类的总结 记得以前在参考书上看过
强酸和强碱反映生成.强酸和弱碱生成.之类的总结 记得以前在参考书上看过
还有一个问题 可以用FeCl3溶液 溴水来鉴别 己烯 甲苯 丙醛 理由是什么谢谢 雨中的风筝1年前2
雨中的风筝1年前2 -
 alyforever 共回答了20个问题
alyforever 共回答了20个问题 |采纳率85%能使溴水褪色者是己烯;
丙醛有还原性,可使黄色的三氯化铁几乎便无色;
剩下的则是甲苯.1年前查看全部
- 坩埚钳易不易被强碱腐蚀?易被热的强碱腐蚀( )
坩埚钳易不易被强碱腐蚀?易被热的强碱腐蚀( )
还有坩埚的主要用途及使用的注意事项 wyy8209281年前2
wyy8209281年前2 -
 好脾气不是没脾气 共回答了20个问题
好脾气不是没脾气 共回答了20个问题 |采纳率100%对
坩埚耐热耐酸,但是不能用于熔融碱的加热,因为坩埚中有SiO2等氧化物高温时与熔融碱反应
加热固体 分解或除水等1年前查看全部
- Ca(oH)2不是微溶于水吗,为什么还是强碱.那它在水中会有沉淀么
 dsf435dgbf1年前1
dsf435dgbf1年前1 -
 hw198288 共回答了16个问题
hw198288 共回答了16个问题 |采纳率81.3%Ca(oH)2不是微溶于水指的是它的溶解度,与是不是强碱关系不大,它溶解在水中的部分是完全溶解的,所以Ca(oH)2是强碱.它在水中应该没有沉淀,一般所见的沉淀应该是 Ca(oH)2与空气中的CO2接触后产生的CaCO3.1年前查看全部
- 复分解反应存在这样一个规律:较强酸可制取较弱酸.盐类的水解也是复分解反应,弱酸强碱盐对应的弱酸越弱,其盐越容易发生水解.
复分解反应存在这样一个规律:较强酸可制取较弱酸.盐类的水解也是复分解反应,弱酸强碱盐对应的弱酸越弱,其盐越容易发生水解.
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CO2+H2O+NaClO===NaHCO3+HClO
弱酸的酸性由强到弱的顺序为CH3COOH、H2CO3、HClO、HCN、C6H5OH、HCO(注意:Na2CO3对应的弱酸为HCO,NaHCO3对应的弱酸为H2CO3A反应若生成HClO,则可与Na2CO3起反应生成NaClO和NaHCO3,A不能发生,B能发生
为什么A不能反映呢?我根本看不懂答案,明明强酸制弱酸,HClO不是可以制HCO(即Na2CO3)吗? leo_hu1年前3
leo_hu1年前3 -
 shastef 共回答了21个问题
shastef 共回答了21个问题 |采纳率90.5%CO2 + H2O就是H2CO3.H2CO3是二元酸,其一级电离:H2CO3 = H+ + HCO3-
与NaClO反应时,其实只有其一级电离出来的H+与ClO-发生反应,所以是得到NaHCO3与HClO
这里体现的强制弱,是“H2CO3”制“HClO".1年前查看全部
- 酸碱混合常温下,将体积V1,PH=a,的某一元强碱与体积为V2,PH=b的某二元强酸混合.若所得溶液的PH=11,且a=
酸碱混合
常温下,将体积V1,PH=a,的某一元强碱与体积为V2,PH=b的某二元强酸混合.
若所得溶液的PH=11,且a=13,b=2,则V1:V2=__:__ liang36267991年前1
liang36267991年前1 -
 yu6112 共回答了19个问题
yu6112 共回答了19个问题 |采纳率89.5%(V1*0.1-V2*0.01)/(V1+V2)=0.001
V1:V2=1:91年前查看全部
- 化学以弱碱和盐制强碱用硫化氢和硫酸铜溶液可以制硫酸,是弱酸制强酸 那么有没有一种弱碱和盐可以制强碱? 可以多举几个例子吗
 鉃麮钫銄1年前1
鉃麮钫銄1年前1 -
 尼克库博 共回答了23个问题
尼克库博 共回答了23个问题 |采纳率82.6%氨是弱碱,甲基化后生成甲胺,是强碱.其他广义的:水,醇等是弱碱,与金属钠反应生成强碱.碳酸氢钠、碳酸氢钾等是较弱的碱,加热生成碱性较强的碳酸盐.氯化钠电解得到氢氧化钠.还有络合的超强碱,也是用一般强碱制的,但碱性更强.1年前查看全部
- 分别在强酸溶液,强碱溶液中什么离子不能共存
 a4480757031年前2
a4480757031年前2 -
 eamison 共回答了16个问题
eamison 共回答了16个问题 |采纳率81.3%强酸:
氢氧根,偏铝酸根,碳酸根,碳酸氢根,醋酸根,亚硫酸根,亚硫酸氢根,氟离子,硫离子,硫氢根,亚铜离子,次氯酸根,硅酸根等
强碱:
氢离子,铝离子,镁离子,铜离子,亚铁离子,铁离子,铵根离子,碳酸氢根,亚硫酸氢根,硫氢根,汞离子,银离子,亚铜离子等1年前查看全部
- 如何判断盐是酸性还是碱性,但看成分,不知道是不是强酸或者是强碱.
 feiji021031年前2
feiji021031年前2 -
 漠之水 共回答了17个问题
漠之水 共回答了17个问题 |采纳率82.4%如果是强酸强碱盐像硫酸钠氯化钠就是中性;
是弱酸强碱盐像碳酸钠的酸根离子就会水解生成碳酸氢根和氢氧根呈碱性;
强酸弱碱盐像硫酸铁,氯化铝金属离子会水解放出氢离子所以呈酸性;
弱酸弱碱盐就要看这两种离子谁的水解性更强,谁强显示对方的性质,例如某种铵盐中铵根离子水解性强就显酸性.1年前查看全部
大家在问
- 1AL3+、ALO2-、CO32-、H2PO4-加入强酸或强碱都能使离子浓度降低的是哪个
- 2(1)(-1/2)²+1/2×(2/3-|2/3-2|)=?(2)(-3/2)×[-3²×(-2/3
- 3他说英语和我说的一样多为什么不用as many as
- 4一个口里面一个女字读什么?口里一个子字又读什么`?>还有口里一个男读什么`?
- 5关于矩阵初等变换的疑问,求教!为什么? (A E)把经过初等变换之后左边化为单位矩阵则右边的就是A^-1 可
- 6找出发音不同的一项 dress yours whose(划线部分是s)
- 7划线字母与其他三个发音不同的是:A yes B student C pen D help 划线部分都是e
- 8(数列)这道题最后的等于怎么证我只证到小于1,可不可以直接往下写:所以小于等于1?
- 9[(x-4)/0.2]-2.5=(x-3)/0.05(算出过程)快!
- 10表达载体和克隆载体一样吗?有什么区别?实验室常用有哪些?
- 11把0.06708保留三个有效数字的近似值是( )
- 12铁的冶炼实验必须有--装置,防止--?
- 13怎么叫勾函数Y=X+K/X Y=X+1/2X 是勾函数类型吗?
- 14找规律填数:3、9、11、17、20______、______、36、41….
- 15高中数学直线方程有哪些表示方法?

