谁有化学必修1的全部笔记……我一定采纳
 3766762372022-10-04 11:39:544条回答
3766762372022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 苗王 共回答了4个问题
苗王 共回答了4个问题 |采纳率75%- 我有。
- 1年前
 皇马曼联 共回答了1个问题
皇马曼联 共回答了1个问题 |采纳率- 金秀贤。不是。。肯定不是塞那你还说……亲,做过吗?有点模糊求你了。。我们下午交。。你不是已经做了吗?那只是选择题这么多,又模糊……自己先试着做呗……这么多问题去问谁也不会全部回答的好吗?亲。同步解析与测评。。第一单元测试卷。。。只是需要一点安慰。。体谅我。。你读高一?你猜对了……...
- 1年前
 uwjls 共回答了3个问题
uwjls 共回答了3个问题 |采纳率66.7%- 我又,采纳后发图片
- 1年前
 san爱马天宇 共回答了1个问题
san爱马天宇 共回答了1个问题 |采纳率- 空间里有
- 1年前
相关推荐
- 讲 [化学必修1第三章金属及其化合物] 的深浅程度,比如钠的性质书上只有与氧气和水,其他的讲不讲?讲多少?
 hzx1331年前6
hzx1331年前6 -
 月萱 共回答了13个问题
月萱 共回答了13个问题 |采纳率100%这节内容主要是让学生掌握钠与水反应的现象及解释,跟乙醇反应在以后高二有机里会仔细讲解的.钠与氧气反应的情况要同学掌握条件不同产物不同,同时还要他们记住过氧化钠是淡黄色物质.
在这节内容中,要学生掌握这两个钠的性质会运用就很不错了.还有这节内容除了讲钠的性质还要稍微提及钠的氧化物过氧化钠、氧化钠的部分性质.
我建议你可以结合作业本或者配套练习,这样就能掌握好深难度.对于高一学生是简单掌握最好!
祝你上课愉快!1年前查看全部
- 高一化学必修1人教版第二章复习题答案
 watching1年前1
watching1年前1 -
 草莓小王子 共回答了15个问题
草莓小王子 共回答了15个问题 |采纳率86.7%1、(1)化学反应(2)化学 热;化学能与电能的相互转化;热能转化为化学能;光能转化为化学能(3)1、2、4
2、(1)洗净、擦干(2)将铁块锉成铁屑,将硫磺研磨成细粉,并混合均匀;加热引发反应
3、C
4、C
5、(1)12g碳充分燃烧生成CO2比它不充分燃烧生成CO要多放出283KJ的热能,如果煤炭不完全燃烧,不仅浪费能源,而且生成大气污染物CO和煤炭粉尘等.(2)比较一步转化与两部转化的热效应大小
6、选用不同浓度的纯碱溶液或盐酸进行试验,确定可用于实验室制取的合适温度
7、(1)负极 锂是非常活泼的金属(2)锂极易与水反应 (3)体积小、重量轻、电压高(4伏以上)、比能量高(单位质量或单位体积电池的输出能量)、寿命长(5~10年)1年前查看全部
- 化学必修1《自然界中的元素》p105一道习题
 llailh1年前3
llailh1年前3 -
 motokosato 共回答了16个问题
motokosato 共回答了16个问题 |采纳率93.8%X:CO2,NO2 C:NO,CO2 D:HNO3 A:C B:HNO3 E:NO F:Cu CuSO41年前查看全部
- 化学必修1不会,又不想买参考书,有什么好的复习材料能有效提高啊?
化学必修1不会,又不想买参考书,有什么好的复习材料能有效提高啊?
现在在学必修2 ,买的《世纪金榜360教材解读》感觉非常好.可是必修1用的王后雄.只是知识列举和难题.根本不能提高.到现在还是不行.计算实验都不会.物质的性质、方程式老记不住.我知道要多练,可是题都不会.都灰心了.
如果再买必修1参考书肯定浪费时间.况且基础性的东西我大部分都会,只是应用起来不熟练.
方程式要怎么理解?也不是每一个都有实验的啊, jifei7741年前1
jifei7741年前1 -
 zhaoyuyan 共回答了16个问题
zhaoyuyan 共回答了16个问题 |采纳率93.8%你的问题或许与辅导书没多少关系,我想你可以把你的基础知识学扎实一点,方程式不是靠识记的,他需要你来理解他,只有真正的理解了无论遇到什么情况都不会忘了的你先把基础弄好后觉得做简单题没啥问题了,然后可以尝试着做点难题,祝你成功啊!1年前查看全部
- 求:高一人教版化学必修1第一单元测试卷
求:高一人教版化学必修1第一单元测试卷
题目多一点,主要是物质的量方面的题目! 忠侯史等1年前2
忠侯史等1年前2 -
 妄言君 共回答了13个问题
妄言君 共回答了13个问题 |采纳率92.3%人教版的1年前查看全部
- 高一年级人教版化学必修1课后练习参考答案
 xw6071年前3
xw6071年前3 -
 坏丫头421 共回答了20个问题
坏丫头421 共回答了20个问题 |采纳率95%一、填空题
1.3.01×1023,1.5×6.02×1023,18
2.Cl2,CO,Cl2
3.Cl2,71
4.卤素,7,HX,X2O7、酸性,酸性,增大,减弱
5.碱金属,1,MOH,碱,增大,增强
6.可溶性钡盐与可溶性硫酸盐或稀硫酸之间的反应
BaCl2+Na2SO4 = BaSO4↓+2NaCl
7.Br-、I-、Cl-
8.氧化剂,还原剂,既不是氧化剂也不是还原剂
9.1.42
10.36
11.c/3、4c/3
*12.
二、选择题
1.C 2.A 3.B 4.D 5.D 6.B 7.A 8.C 9.A 10.B 11.B、D 12.C 13.B 14.B 15.D
16.B 17.D 18.A
三、问答题
1.(1)适量的H2SO4,CO32- + 2H+ = H2O+CO2↑
(2)适量的NaOH,Mg2+ + 2OH- = Mg(OH)2↓
2.在原混合物中一定存在Na2CO3,一定不存在CaCO3、Na2SO4、CuSO4,可能存在(NH4)2CO3
3.(1)偏低 (2)偏低 (3)偏低
4.(1)A:H2、 B:Cl2、 C:CO2、 D:HCl
(2) HCl+AgNO3=AgCl↓+HNO3
Cl- + Ag+ = AgCl↓
H2+Cl2 2HCl
CO2 + Ca(OH)2 = CaCO3↓+H2O
CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
(3) 制取H2:Zn + 2HCl = ZnCl2 + H2↑
制取Cl2:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
制取CO2:CaCO3+2HCl=CaCl2+CO2↑+H2O
(实验装置图和收集方法略.)
(4)没有酒精灯、未垫石棉网、第二个洗气瓶中的导气管错、两个洗气瓶的位置应颠倒
5.A:BaSO4、B:Al(OH)3、C:Ba(OH)2、D:CuCl2、E:NaOH
6.(1)C+2H2SO4(浓)△CO2↑+2H2O+2SO2↑
(2)品红溶液、褪色
四、计算题
1.(1)24.0% (2) 2.68 mol/L
2.(1)Fe、56,S、32
3.24、40、56
4.(1)12 mol/L (2)1 mol
*5.2∶1
*6.(1)13.4 L (2)271年前查看全部
- 求高中化学必修1必修2化学与生活有机化学基础化学反应原理所有方程式包括实验现象用途或意义和仪器
 缘自kk1年前2
缘自kk1年前2 -
 盈袖 共回答了26个问题
盈袖 共回答了26个问题 |采纳率92.3%一、化学方程式以及离子方程式
1、钠在空气中燃烧(黄色的火焰)
2Na + O2 Na2O2
钠块在空气中变暗
4Na+O2=2Na2O
Na2O在空气中加热(变黄)
2Na2O+O2=2Na2O2
2、钠与水反应(浮、熔、游、响、红)
2Na + 2H2O = 2 NaOH + H2 ↑
2Na + 2H2O = 2Na+ + 2OH-+H2 ↑
3、过氧化钠与水的反应(放热反应、Na2O2是
强氧化剂,用于漂白)
2Na2O2 + 2H2O = 4NaOH + O2 ↑
2Na2O2+2H2O =4Na++4OH-+O2↑
碱性氧化物Na2O与水的反应
Na2O+H2O=2NaOH
4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
5、苏打(纯碱)与盐酸反应
①盐酸中滴加纯碱溶液
Na2CO3+2HCl = 2NaCl+ H2O+CO2↑
CO32- + 2H+ = H2O + CO2↑
②纯碱溶液中滴加盐酸,至过量
Na2CO3 + HCl =NaHCO3 + NaCl
CO32- + H+ = HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑
HCO3-+H+ = H2O +CO2↑
6、小苏打受热分解
2NaHCO3 Na2CO3 + H2O +CO2 ↑
7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热
NaHCO3 + NaOH Na2CO3 + H2O
HCO3-+ OH - = H2O + CO32-
(若是溶液中反应有离子方程式)
8、金属锂在空气中燃烧
4Li + O2 2Li2O
9、氯气的性质
铜丝在氯气中剧烈燃烧(棕色烟)
Cu + Cl2 CuCl2
之后加水,可得绿色溶液(浓)或蓝色溶液(稀)
Cl2 +2FeCl2 =2FeCl3
2Cl2+2NaBr=2NaCl+Br2
Cl2 +2NaI =2NaCl+I2
Cl2+SO2 +2H2O=H2SO4 +2HCl
2Na + Cl2 2NaCl
10、铁在氯气中剧烈燃烧(棕红色烟)
2Fe + 3Cl2 3FeCl3
11、氢气在氯气中燃烧(苍白色火焰瓶口有白雾)
H2 + Cl2 2HCl
氟气与氢气反应(黑暗处即可爆炸)
H2+F2=2HF
12、氯气溶于水(新制氯水中含H+ 、Cl -、ClO -、OH-、Cl2、HClO、H2O)
Cl2 + H2O = HCl + HClO
Cl2 + H2O = H+ + Cl - + HClO
13、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂)
2HClO 2HCl + O2↑
14、工业制漂白粉的原理及漂白粉的失效
2Ca(OH)2+2Cl2 =Ca(ClO)2+CaCl2+2H2O
2Ca(OH)2+2Cl2=2Ca2++2ClO-+2Cl-+2H2O
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO 2HCl + O2↑
Ca2++2ClO-+CO2+H2O =CaCO3↓+ 2HClO
15、氯气的实验室制法:(仪器:分液漏斗,圆底烧瓶)
MnO2 +4HCl(浓) MnCl2+Cl2↑+2H2O
MnO2 +4H++2Cl- Mn2++Cl2↑+2H2O
16、新制氯水注入盛溴化钠溶液的试管中
Cl2 + 2NaBr = Br2 + 2NaCl
Cl2 + 2Br- = Br2 + 2Cl-
17、铁与硫加热反应 Fe + S FeS
铁与氧气加热反应 3Fe+2O2 Fe3O4
铁在氯气中加热反应 2Fe+3Cl2 2FeCl3
20、铜与浓硫酸反应:
Cu+2H2SO4 (浓) CuSO4 +2H2O+SO2 ↑
21、碳与浓硫酸反应:
C+2H2SO4(浓) 2H2O+CO2↑+2SO2↑
22、工业制单质硅(碳在高温下还原二氧化硅)
SiO2 + 2C Si + 2CO↑
23、二氧化硅与氢氧化钠反应
SiO2 + 2NaOH = Na2SiO3 + H2O
SiO2 + 2OH - = SiO32- + H2O
24、氮气和氢气反应(工业合成氨)
N2 + 3H2 2NH3
25、氮气和氧气放电下反应(雷雨发庄稼)
N2 + O2 2NO
2NO + O2 2NO2
二氧化氮溶于水
3NO2 + H2O 2HNO3 + NO
3NO2 + H2O 2H++ 2NO3-+NO
26、HNO3与Fe的反应
Al、Fe遇冷浓HNO3、浓硫酸钝化(常温)
Fe与浓HNO3加热
Fe+6HNO3 Fe(NO3)3+3NO2↑+3H2O
Fe与稀HNO3反应
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
27、NO2 、O2 的混合气通入水中无剩余气体
4NO2 + O2 + 2H2O = 4 HNO3
28、NO 、O2 的混合气通入水中无剩余气体
4NO + 3O2 + 2H2O = 4 HNO3
31. 氨的催化氧化
4NH3 +5O2 4NO + 6H2O
32. 碳酸氢铵受热分解
NH4HCO3 NH3 ↑+ H2O↑ + CO2↑
33. 用浓盐酸检验氨气(白烟生成)
HCl + NH3 = NH4Cl
34. 硫酸铵溶液与氢氧化钠溶液混合加热
(NH4)2SO4 +2NaOH 2NH3↑+Na2SO4 +2H2O
NH4+ + OH - NH3 ↑+ H2O
35. 硝酸铵溶液与氢氧化钠溶液混合(不加热)
NH4NO3 + NaOH = NH3•H2O + NaNO3
NH4+ + OH- = NH3•H2O
36. 铝箔在氧气中剧烈燃烧
4Al + 3O2 2Al2O3
37. 铝片与稀盐酸反应
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 6H+ = 2Al3+ +3H2↑
38. 铝与氢氧化钠溶液反应
2Al+2NaOH +2H2O = 2NaAlO2- +3H2↑
2Al + 2OH - +2H2O = 2AlO2- + 3H2↑
39. 铝与三氧化二铁高温下反应(铝热反应)
2Al + Fe2O3 2Fe + Al2O3
40. 镁在二氧化碳中燃烧
2Mg + CO2 2MgO + C
41. 氧化铝溶于氢氧化钠溶液
Al2O3 + 2NaOH 2NaAlO2 +H2O
Al2O3 + 2OH - = 2AlO2- + H2O
42. 硫酸铝溶液中滴过量氨水
Al2(SO4)3 +6NH3•H2O=2Al(OH)3↓+(NH4)2SO4
Al3+ + 3 NH3•H2O = Al(OH)3↓+ 3NH4+
43. ①氢氧化铝溶液中加盐酸
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
②Al(OH)3与NaOH溶液反应
Al(OH)3 + NaOH NaAlO2 +2 H2O
Al(OH)3 + OH- =[Al(OH)4]-+2 H2O
44. 高温下铁与水反应
3Fe + 4H2O(g) Fe3O4 + 4H2
45. 铁与盐酸反应
Fe + 2HCl = FeCl2 + H2↑
Fe + 2H+ = Fe2+ + H2↑
46. 氧化铁溶于盐酸中
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
47. 氯化铁中滴入氢氧化钠溶液(红褐色沉淀)
FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaCl
Fe3+ + 3OH - = Fe(OH)3 ↓
48. 氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)
4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3
49. 氯化亚铁溶液中通入氯气
2FeCl2 + Cl2 = 2FeCl3
2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
50. 氯化铁溶液中加入铁粉
2FeCl3 + Fe = 3FeCl2
2Fe3+ + Fe = 3Fe2+
51 用KSCN检验的存在离子方程式
Fe3++3SCN-= Fe (SCN)3 (血红色)1年前查看全部
- 化学必修1:硫和氮的氧化物
 月亮zz爱zz1年前1
月亮zz爱zz1年前1 -
 tt8888 共回答了19个问题
tt8888 共回答了19个问题 |采纳率94.7%硫(俗称硫磺)是一种黄色晶体,质脆,易研成粉末.硫不溶于水,微溶于酒精,易溶于二硫化碳.二氧化硫(SO2)是无色、有刺激性气味的气体,密度比空气的大,易液化,易溶于水,以1:40的比例溶于水.
硫与硫的氧化物在空气中燃烧:
点燃
S+O2 = SO2
A二氧化硫具有氧化性:SO2+2H2S(氢硫酸)=3S↓+2H2O
现象:有黄色沉淀产生.现象:有黄色沉淀产生.
B具有漂白性:二氧化硫能使品红溶液褪色,但如果把品红溶液加热,溶液会恢复原来颜色.
具有漂白性的物质:Hclo Na2O2 SO2 活性炭 H2O2
SO2+Cl2+2H2O=H2SO4+2HCl当体积1:1混合时它完全没有漂白性.(溶液没有褪色)
C与碱反应:
高温
SO2+CaO=CaSO3
SO2+Ca(OH)2=CaSO3+H2O (CaSO3易被氧化成CaSO4沉淀.
D具有还原性:
催化剂
2SO2+O2= 2SO3
△
aNO2和溴蒸汽鉴别(两种气体都是红褐色的)
1) 加水 瓶内变红褐色——NO2
2) 瓶内不变是溴蒸汽
b酸酐:酸脱水的产物
H2CO3—CO2
H2SO4—SO3
HNO3—N2O5
HN2—N2O3
ESO2是一种酸性氧化物,它溶于水生成硫酸.
催化剂
2SO2+O2= 2SO3
△
SO3+H2O=H2SO4
三氧化硫与碱性氧化物反应时生成硫酸盐
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O
(1) 氮的氧化物有(+1、+2、+3、+4、+5)五种价态,六种氧化物.
(2) 一氧化氮是五色无味的气体,不溶于水,密度接近于空气(只能用排水集气法
高温或放电
NO2+O2==========2NO
NO和NO2的物理性质
一氧化碳通常是五色五味的气体,二氧化氮是红棕色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水.
化学性质
一氧化氮:不与水反应,在通常情况下易被氧气氧化成二氧化氮.
2NO2+H2O=2HNO3+NO
反应现象:无色气体变为红棕色有刺激性气味的气体.
二氧化氮:难被氧气氧化,易与水反应生成HNO3和NO.
在通常情况下,二氧化氮还能自身化合成无色的四氧化二氮(N2O4).1年前查看全部
- 化学必修1的题铜和稀硫酸不反应,但加入硝酸钾后,铜减少,液体变蓝,有气体生成.这是为什么呀?稀硫酸和硝酸钾反应?
 心情Frank1年前4
心情Frank1年前4 -
 arthurlee00 共回答了15个问题
arthurlee00 共回答了15个问题 |采纳率93.3%在溶液中,稀硫酸提供氢离子,硝酸钾提供硝酸根,结合成稀硝酸,众所周知铜可以和稀硝酸反应现象就是你后面说的1年前查看全部
- 化学必修1人教版实验1-5(P16)
化学必修1人教版实验1-5(P16)
最下面的学与问1,为何洗涤液也要注入?
补充图片
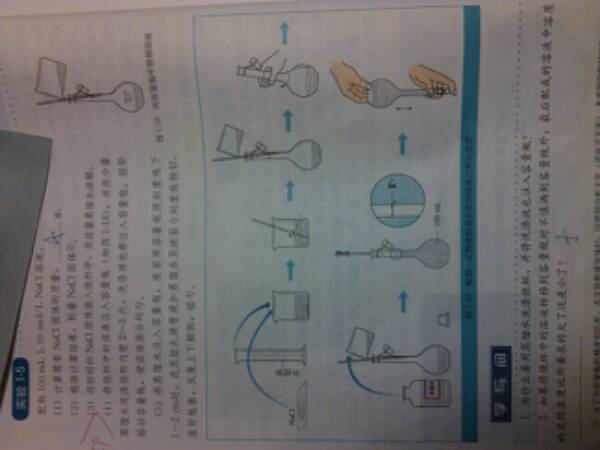
 shengglay1年前1
shengglay1年前1 -
 b21kk 共回答了22个问题
b21kk 共回答了22个问题 |采纳率86.4%因为洗涤液中有残留的NaCl
如果把洗涤不注入的话会导致浓度偏低,相当于在溶液不变溶质减少了
望楼主采纳~
不懂的继续追问1年前查看全部
- 求高一必修一英语语法和短语归纳必修2,必修3英语归纳3归纳生物必修1归纳化学必修1归纳这个虽然自己可以做,但还是想吸取别
求高一必修一英语语法和短语归纳
必修2,必修3英语归纳
3归纳
生物必修1归纳
化学必修1归纳
这个虽然自己可以做,但还是想吸取别人的学习方法, liersgroom1年前2
liersgroom1年前2 -
 dxcc 共回答了19个问题
dxcc 共回答了19个问题 |采纳率94.7%(一)直接引述别人的原话,叫做直接引语;用自己话转述别人的话,叫做间接引语.间接引语一般构成宾语从句.直接引语必须放在引号内,间接引语则不用引号.直接引语改为间接引语时,除将引语部分变成宾语从句外,还必须对直接引语中的人称、时态、指示代词、时间状语、地点状语等进行改变.
1. 时态的变化:直接引语变为间接引语时,通常受转述动词said, asked等的影响而使用过去化的时态,即把原来的时态向过去推,也就是一般现在时变为一般过去时,现在进行时变为过去进行时,等等.例如:
Tom said to me,“My brother is doing his homework.”
→Tom said to me that his brother was doing his homework.
2. 人称代词、指示代词、时间状语、地点状语等等的变化: 根据意义进行相应的变化,例如:
She asked Jack,“Where have you been?”
→She asked Jack where he had been.
He said,“These books are mine.”
→He said that those books were his.
(二)直接引语改为间接引语时,都使用陈述语序,但是因为原句的句式不同,所以变成间接引语时所用的连词会有所不同.直接引语如果是一般疑问句,用连接词whether或if;如果是特殊疑问句,则用疑问词引导间接引语.转述的动词一般用asked,可以在其后加上一个间接宾语me, him, her, us等.如:
She said,“Is your father at home?”
→She asked me if/whether my father was at home.
“What do you do every Sunday?”My friend asked me.
→My friend asked me what I did every Sunday.
直接引语如果是祈使句,改为间接引语时,要将祈使句的动词原形变为带to的不定式,并在不定式的前面根据原句的语气(即请求或命令)加上ask, tell, order等动词,如果祈使句为否定式,则在不定式前加not.其句型为:ask / tell / order someone (not) to do something. 例如:
She said to us,“Please sit down.”
→She asked us to sit down.
He said to him,“Go away!”
→He ordered him to go away.
He said, “Don’t make so much noise, boys.”
→He told the boys not to make so much noise.
二. 各种时态的被动语态
被动语态概述
被动语态的概念:它是动词的一种形式,表示主语与谓语之间的执行或被执行关系.主动语态表示主语是谓语动作的执行者,例如:They saw the little boy crying by the river. 被动语态表示主语是谓语动作的承受者,例如:The little boy was seen crying by the river.
被动语态的构成
被动语态的形式是由“助动词be+动词的过去分词”构成.助动词be随着主语的人称、数、时态等的不同而变化.几种常见时态的被动语态形式如下:
1. 一般现在时 am/is/are + 过去分词
例如:Rice is planted in the south of China.
2. 一般过去时 was/were + 过去分词
例如:These trees were planted the year before last.
3. 一般将来时 will/shall + be + 过去分词
例如:A sports meeting will be held next week in our school.
4. 现在进行时 am/is/are + being + 过去分词
例如:Your radio is being repaired now.
5. 过去进行时 was/were + being + 过去分词
When he got there, the problem was being discussed.
6. 现在完成时 have/has + been + 过去分词
His work has been finished.
Has his work been finished? Yes, it has. / No, it hasn’t.
7. 过去完成时 had + been + 过去分词
注意:
1.除了be之外的其它系动词如get, stay等也可以和过去分词构成被动语态.例如:Their questions haven’t got answered.
2. 含有情态动词的谓语变成被动语态使用“情态动词+ be + 过去分词”结构.例如:
More attention should be paid to the old in this country.
This work can’t be done until Mr. Black comes.
3. 含有“be going to”, “be to”等结构的谓语,其被动语态分别用“be going to + be + 过去分词”和“be to + be + 过去分词”.例如:
The problem is going to be discussed at the next meeting.
All these books are to be taken to the library.
4. 被动语态与系表结构的区别:“连系动词+用作表语的过去分词”构成的系表结构,与被动语态的形式完全一样,所以应注意它们的区别.被动语态中的过去分词是动词,多强调动作;系表结构中的过去分词相当于形容词,多强调状态.前者通常可用by 引出动作的执行者,而后者则不可以.例如:
The map was changed by someone.(被动结构)
That custom remained unchanged for many centuries.(系表结构)
系表结构中的过去分词通常可被very修饰,被动语态中的过去分词往往要用much修饰.
例如:
He was very excited.(系表结构)
He was much excited by her words.(被动结构)
5. 主动形式表被动意义.有些动词的主动形式有被动意味,如 open, read, sell, shut, wash, wear, write等.此时句子的主语一般是物.例如:
These books sell well. 这些书很畅销.
The door won’t shut. 这门关不上.
The clothes wash well. 这些衣服很好洗.1年前查看全部
- 化学必修1化学方程式汇总
 好好说话没是1年前2
好好说话没是1年前2 -
 老妹我爱你 共回答了23个问题
老妹我爱你 共回答了23个问题 |采纳率78.3%必修1化学方程式总结
1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑
5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu
6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl
7、钠在空气中燃烧:2Na + O2 △ Na2O2
钠与氧气反应:4Na + O2 = 2Na2O
8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑
9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2
10、钠与水反应:2Na + 2H2O = 2NaOH + H2↑
11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑
12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
13、氧化钙与水反应:CaO + H2O = Ca(OH)2
14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O
15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O
16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O
17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4
19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
20、氢氧化铁加热分2Fe(OH)3 △ Fe2O3 + 3H2O↑
21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3?H2O = 2Al(OH)3↓ + 3(NH3)2SO4
22、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O
23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O
24、氢氧化铝加热分2Al(OH)3 △ Al2O3 + 3H2O
25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2
26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3
27、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O
硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑
28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO3
29、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O
30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓
31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
32、氯气与金属铁反应:2Fe + 3Cl2 点燃 2FeCl3
33、氯气与金属铜反应:Cu + Cl2 点燃 CuCl2
34、氯气与金属钠反应:2Na + Cl2 点燃 2NaCl
35、氯气与水反应:Cl2 + H2O = HCl + HClO
36、次氯酸光照分2HClO 光照 2HCl + O2↑
37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O
38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3
40、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO
41、二氧化硫与水反应:SO2 + H2O ≈ H2SO3
42、氮气与氧气在放电下反应:N2 + O2 放电 2NO
43、一氧化氮与氧气反应:2NO + O2 = 2NO2
44、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO
45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂 2SO3
46、三氧化硫与水反应:SO3 + H2O = H2SO4
47、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑
48、浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑ + 2H2O
49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑
50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑
51、氨水受热分NH3?H2O △ NH3↑ + H2O
52、氨气与氯化氢反应:NH3 + HCl = NH4Cl
53、氯化铵受热分NH4Cl △ NH3↑ + HCl↑
54、碳酸氢氨受热分NH4HCO3 △ NH3↑ + H2O↑ + CO2↑
55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2O
56、氨气的实验室制取:2NH4Cl + Ca(OH)2 △ CaCl2 + 2H2O + 2NH3↑
57、氯气与氢气反应:Cl2 + H2 点燃 2HCl
58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O
59、SO2 + CaO = CaSO3
60、SO2 + 2NaOH = Na2SO3 + H2O
61、SO2 + Ca(OH)2 = CaSO3↓ + H2O
62、SO2 + Cl2 + 2H2O = 2HCl + H2SO4
63、SO2 + 2H2S = 3S + 2H2O
64、NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O
65、Si + 2F2 = SiF4
66、Si + 2NaOH + H2O = NaSiO3 +2H2↑
67、硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO
(石英沙)(焦碳) (粗硅)
粗硅转变为纯硅:Si(粗) + 2Cl2 △ SiCl4
SiCl4 + 2H2 高温 Si(纯)+ 4HCl
化合反应
1、镁在空气中燃烧:2Mg + O2 点燃 2MgO
2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
4、氢气在空气中燃烧:2H2 + O2 点燃 2H2O
5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
6、硫粉在空气中燃烧: S + O2 点燃 SO2
7、碳在氧气中充分燃烧:C + O2 点燃 CO2
8、碳在氧气中不充分燃烧:2C + O2 点燃 2CO
9、二氧化碳通过灼热碳层: C + CO2 高温 2CO
10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3
12、生石灰溶于水:CaO + H2O === Ca(OH)2
13、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O
14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl
分解反应
15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑
16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17、水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
18、碳酸不稳定而分H2CO3 === H2O + CO2↑
19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑
置换反应
20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑
22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑
23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
24、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO
27、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
其他
28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4
29、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
32、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O
35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
一. 物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
二.几个分解反应:
13. 水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑
15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑
16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17. 碳酸不稳定而分H2CO3 === H2O + CO2↑
18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑
三.几个氧化还原反应:
19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑
23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑
32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑
33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(3)碱性氧化物 +酸 -------- 盐 + 水
37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
(5)酸 + 碱 -------- 盐 + 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O
51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(6)酸 + 盐 -------- 另一种酸 + 另一种盐
59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4
66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH
(8)盐 + 盐 ----- 两种新盐
70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3
71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
五.其它反应:
72.二氧化碳溶解于水:CO2 + H2O === H2CO3
73.生石灰溶于水:CaO + H2O === Ca(OH)2
74.氧化钠溶于水:Na2O + H2O ==== 2NaOH
75.三氧化硫溶于水:SO3 + H2O ==== H2SO4
76.硫酸铜晶体受热分CuSO4?5H2O 加热 CuSO4 + 5H2O
77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2
离子方程式
1、氢氧化铁溶于硝酸
2、氢氧化钾与硫酸中和
3、金属铁溶于稀硫酸
4、碳酸钠中滴加足量稀盐酸
5、硫酸铜溶液与氢氧化钡溶液混合
6、氢氧化钡溶液和氯化镁溶液混合
7、氯化钡溶液和硫酸钾溶液混合
8、用盐酸除铁锈
9、硫酸铁溶液和氢氧化钾溶液混合
10、金属铝溶于硫酸
Fe(OH)3+3H+===Fe3+ +3H2O
OH-+H+==H2O
Fe+2H+==Fe2+ +H2
CO32- + 2H+===H2O+CO2
Cu2+ + SO42- +Ba2+ +2OH-====BaSO4+Cu(OH)2
Mg2+ + 2OH- ===Mg(OH)2
Ba2+ + SO42- ==BaSO4
Fe2O3+6H+===2Fe3+ + 3H2O
Fe3+ + 3OH- ===Fe(OH)3
2Al+6H+==2Al3+ +3H21年前查看全部
- 化学必修1第一节物质分类习题答案
化学必修1第一节物质分类习题答案
1.现有下列10种物质:①H2O、②空气、③Mg、④CaO、⑤H2SO4、⑥Ca(OH)2、⑦CuSO4·5H2O、⑧碘酒、⑨C2H5OH和⑩NaHCO3.
其中,属于混合物的是 (填序号,下同);属于氧化物的是 ;属于酸的是 ;属于碱的是 ;属于盐的是 ;属于有机物的是 .
2.请对下列5种酸进行分类:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、磷酸(H3PO4)和氢硫酸(H2S),并说出分类的方法和依据.
3.对于混合物,你能从哪些角度对它们进行分类?举例说明.
4.查阅有关资料,列举几个具体实例,说明分类法对于科学发展的重要意义.
5.完成下列表格.
6.当光束通过下列分散系时,可能产生丁达尔效应的是( ).
A.NaCl溶液 B.Fe(OH)3溶液 C.盐酸 D.稀豆浆
7.胶体区别于其他分散系的本质特征是什么?举例说明胶体的应用. 嘎嘎01271年前1
嘎嘎01271年前1 -
 111zhu 共回答了15个问题
111zhu 共回答了15个问题 |采纳率86.7%一、 混合物:2 8
氧化物:4
酸 :5
碱 :6
盐 :7 10
有机物:1 9
二、1、从酸的强度上来讲:盐酸、硫酸、硝酸是强酸;磷酸是中强酸;而氢硫酸为二元弱酸.
2、从酸的氧化性强弱来分:浓硫酸、硝酸是强氧化性酸;而氢硫酸是强还原性酸.
3、从酸的熔沸点来分:硫酸、磷酸是高沸点酸;而盐酸、硝酸、氢硫酸为低沸点酸.
4、从电离的H离子个数来分:盐酸、硝酸是一元酸;硫酸、氢硫酸是二元酸;磷酸是三元酸.
参考资料: http://zhidao.baidu.com/question/37328659.html
三、混合物,首先是它们中的组份在一定条件下,不互相反应.(1)固-固类(2)固-液类(3)固-气类(例空气和灰尘)(4)液-液类(例如油和水)(5)气-液类(例如河水中溶解的氧气)(6)气-气类(例如空气);如果从组成分类有:单质和单质;单质和化合物;化合物和化合物;有机物和无机物;如果从元数分类:有二元;三元;四元;五元等等.
四、比如2种物质化学反应有可能因为彼此量的多少而产出不同的物质.所以我们要控制反应物以获得我们需要的生成物.
五、
六 、 B
七、胶体区别于其他分散系的本质特征是什么?举例说明胶体的应用
第一问一般填的是微粒直径大小
应用1.明矾净水1年前查看全部
- 化学必修1有关量浓度的计算题要10道 不要选择和填空题
 simpleamy1年前1
simpleamy1年前1 -
 犬夜叉叉 共回答了19个问题
犬夜叉叉 共回答了19个问题 |采纳率84.2%1.实验室用18mol•L-1浓H2SO4配制1.5mol•L-1稀H2SO4溶液250mL,需用多少ml的浓硫酸,需加入多少ml的水?
2.在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g•cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为?
3.某10% NaOH溶液,加热蒸发掉100g水后得到80mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为?
4.常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g•cm-3的混合溶液.计算:
(1)混合后溶液的质量分数.
(2)混合后溶液的物质的量浓度.
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
5.4mLO2和3mLNxHy(x1年前查看全部
- 化学必修1物质的分类的那个活动探究题
 lin07221年前3
lin07221年前3 -
 后花溪 共回答了20个问题
后花溪 共回答了20个问题 |采纳率90%所有的,书上没有吗?好久没学化学了,空怕写不了……1年前查看全部
- 想预习一下高中的知识,可是不可能每一科都预习,应该如何取舍呢?化学必修1用预习吗
 华证wwuu部1年前1
华证wwuu部1年前1 -
 shenweiping 共回答了13个问题
shenweiping 共回答了13个问题 |采纳率84.6%预习可以以数学,物理为主.这两课在高一难度较大,在高二高三对基础要求高,你可以考虑一下.1年前查看全部
- 化学必修1实验题怎么分析
 qimiya1年前2
qimiya1年前2 -
 hylan13 共回答了25个问题
hylan13 共回答了25个问题 |采纳率96%把题目中给出的物质全部列出来(细心很关键),然后按照步骤,写出反应(一般都是在草稿纸上),然后看看反应的生成物会不会继续反应,有没有一些东西离开体系(难溶气体)或者留在体系内(沉淀未过滤),然后定量计算要求的东西,ove1年前查看全部
- 化学必修1重点知识给我发一份
 依萌1年前2
依萌1年前2 -
 liu_xing6655399 共回答了18个问题
liu_xing6655399 共回答了18个问题 |采纳率94.4%一、 研究物质性质的方法和程序
1. 基本方法:观察法、实验法、分类法、比较法
2. 基本程序:
用比较的方法对观察到的现象进行分析、综合、推论,概括出结论.1年前查看全部
- 人教版高一化学必修1第一章试题
 Brianshau1年前2
Brianshau1年前2 -
 樱花树下的xx 共回答了17个问题
樱花树下的xx 共回答了17个问题 |采纳率100%必修一《从实验学化学》单元测试题(时间45分钟,满分100分)班级_________ 姓名__________ 座号_________一、 单选题(每小题只有一个正确答案,每小题4分,共48分.)1. 下列实验操作均要用玻璃棒,其中玻璃棒的...1年前查看全部
- 化学必修1专题3如图中A~J均为中学化学常见物质 A,D是金属单质
 leo_to1年前4
leo_to1年前4 -
 jimaodilaoshu 共回答了21个问题
jimaodilaoshu 共回答了21个问题 |采纳率90.5%A 是Al
B是Fe2O3 发生铝热反应
C是Al2O3
D是Fe
E是AlCl3
F是NaAlO2
G是FeCl2
H是Fe(OH)2
I是Fe(OH)3
J是FeCl31年前查看全部
大家在问
- 1CH3CHOHCOOH能自己跟自己酯化吗?一分子的
- 2polyester什么意思
- 3我真的很生气 人家说我是书呆子 死读书 也不想成为书呆子 我想成为一个能活学活用 很有用什么都懂的人
- 4列代数式:a与b的差的绝对值的相反数的倒数是?
- 5高中物理力学选修3-5和热学选修3-3哪个重要
- 6“0000”用一个成语表示
- 7已知 向量a向量b,(2a+b)•(a-2b)=-(3√3)/2,求a与b的夹角
- 8写词语:放任自己,不加约束写一个词语
- 9某校七年一班班委会成员在校活动室开会,每人坐一张凳子,凳子只有3条腿的圆登和4条腿的方凳两种,有人数了一下,人腿加上他们
- 10在矩形abcd中 ab=6 bc=10 点E是cd边上的一点,△bce沿be折叠得到bfe,且点f落在ad边上
- 11下列叙述正确的是( )A.因为Na2CO3+SiO2 高温 . Na2SiO3+CO2↑
- 12已知tanx=-[1/2],则sin2x+3sinxcosx-1的值为( )
- 13请解出方程,要有过程哦!
- 14__he couldn't understand was__,as a teacher of chinese,he wa
- 15按要求改写句子we shall(trave round the world)if we win a lot of mon
