1molAL与足量稀盐酸反应生成的是1.5NA个H2分子而不是NA个H2分子谢谢了,大神帮忙啊
 gamania0072022-10-04 11:39:541条回答
gamania0072022-10-04 11:39:541条回答请问上面那道题怎么解答,还有18gH2O所含的电子数目为10NA?怎么算

已提交,审核后显示!提交回复
共1条回复
 blackmail908 共回答了23个问题
blackmail908 共回答了23个问题 |采纳率82.6%- 列出方程式:2Al+6HCl=2AlCl3+3H2 由方程式可以看出,2mol Al 与稀盐酸充分反应可生成3mol H2,也就是说,1mol Al 与稀盐酸充分反应可生成1.5mol的H2,所以1molAL与足量稀盐酸反应生成的是1.5NA个H2分子而不是NA个H2分子.至于18gH2O(也就是1mol H2O)所含的电子数目为10NA,1mol氧原子的电子数就等于它的核电荷数,是8mol,2mol氢原子的电子数也等于它的核电荷数,是2mol,也就是说,1mol H2O 中有10mol电子,即电子数目为10NA.
- 1年前
相关推荐
- 金属与酸反应的先后顺序如铁和铝的混合粉末投入足量稀盐酸中,谁先反应?
 w916661年前3
w916661年前3 -
 jingkecike1 共回答了23个问题
jingkecike1 共回答了23个问题 |采纳率91.3%金属活动性越强的先反应,铝先和稀盐酸反应.1年前查看全部
- 1mol 镁与足量稀盐酸反应生成NA个H2分子 对还是错
 伟人伊湖水1年前3
伟人伊湖水1年前3 -
 rose2cabbage 共回答了13个问题
rose2cabbage 共回答了13个问题 |采纳率92.3%对,Mg+2HCl=MgCl2+H2↑
1mol x=1mol 根据n=N/NA得N=NA1年前查看全部
- 250g含碳酸钙80%的石灰石与足量稀盐酸反应,求该石灰石中碳酸钙质量是:?最多能制得二氧化碳质量是?!?
 hongchazhe1年前1
hongchazhe1年前1 -
 守望荷塘 共回答了20个问题
守望荷塘 共回答了20个问题 |采纳率95%⑴250gx80% =200g .
⑵ CaCO3 + 2HCl = CO2 + ...
100 44
200 g ×
X= 88 g1年前查看全部
- 1.黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量.
1.黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量.
2.根据下表提供的数据,通过计算说明分别用煤(主要成分为C)、甲烷(CH4)作燃料时,对温室效应产生的差异.

 一直梦想流浪1年前1
一直梦想流浪1年前1 -
 T_poisson 共回答了10个问题
T_poisson 共回答了10个问题 |采纳率100%1.设锌的质量为x
Zn+2HCL=ZnCL+H2
65 2
x 0.2g
解得x=6.5g
答:.
2.解C+O2=CO2 CH4+2O2=CO2+H2O
12 44 16 44
m m(C燃烧生成) m m(CH4)燃烧生成)
m(C燃烧生成的CO2) =44m÷12=3.67m m(CH4)燃烧生成的CO2)=44m÷16=2.75m
m(C燃烧生成的CO2)>m(CH4)燃烧生成的CO2)
答:.1年前查看全部
- 现有4mol铝及足量稀盐酸和稀氢氧化钠溶液,若使铝完全转变为AL(OH)3,所需HCL和NAOH的物质的量之和最少应为(
现有4mol铝及足量稀盐酸和稀氢氧化钠溶液,若使铝完全转变为AL(OH)3,所需HCL和NAOH的物质的量之和最少应为( )
A.6mol B.4mol C.16mol D.8mol
我也是这么想的 但老师的答案是A,还是老师答案错了 李鳕1年前1
李鳕1年前1 -
 luomu 共回答了14个问题
luomu 共回答了14个问题 |采纳率100%抱歉,刚才我答错了
3molAl+3MolNaOH
1molAl+3MOlHCl
AlCl+3NaAlO2+6H2O=4Al(OH)31年前查看全部
- 将40g石灰石样品投入盛有足量稀盐酸的烧杯中,充分反应后烧杯中剩余物质的总质量比原
将40g石灰石样品投入盛有足量稀盐酸的烧杯中,充分反应后烧杯中剩余物质的总质量比原
来烧杯中稀盐酸的总质量增加了26.8g(1)生成二氧化碳的质量(2)参加反应的HCL的质量(3)原石灰石中碳酸钙的纯度 peteraini1年前1
peteraini1年前1 -
 tirips 共回答了15个问题
tirips 共回答了15个问题 |采纳率93.3%(1)生成二氧化碳的质量 40g-26.8g=13.2g
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 73 44
x y 13.2g
100/x=73/y=44/13.2g
x=30g
y=21.9g
(2)参加反应的HCL的质量 21.9g
(3)原石灰石中碳酸钙的纯度 30g/40g*100%=75%1年前查看全部
- 取一种镁铝合金10g,用足量稀盐酸溶解后
 252512421年前1
252512421年前1 -
 南北ww 共回答了17个问题
南北ww 共回答了17个问题 |采纳率88.2%会产生氢气,根据氢气量不同能大概算出该合金中镁铝比,嗯.1年前查看全部
- 黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量.
 kerruy1年前1
kerruy1年前1 -
 秋夜如风 共回答了18个问题
秋夜如风 共回答了18个问题 |采纳率88.9%解题思路:位于H前面的金属能置换出盐酸、稀硫酸中的氢(除浓硫酸、硝酸外),Cu的活动性在(H)后,故不能和稀盐酸发生反应.只有锌和稀盐酸发生了反应.根据化学方程式即可计算出黄铜中锌的质量,进而计算出铜的质量.设生成0.2g氢气,需锌的质量为X,
Zn+2HCl═ZnCl2+H2↑
65 2
X 0.2g
∴65:2=x:0.2g,
解之得:x=6.5g,
铜的质量=20g-6.5g=13.5g.
答:铜的质量为13.5g.点评:
本题考点: 根据化学反应方程式的计算;金属活动性顺序及其应用.
考点点评: 此题通过对生活实践中的具体问题,考查了运用活动性顺序等基础知识解决实际问题的能力以及对实际问题进行分析综合的能力,理解有关规律:金属与酸、盐溶液发生置换反应的条件,Zn与酸、盐溶液发生置换反应时,生成物中Zn显+2价,金属与混合盐溶液反应的优先置换原理.1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙,讲一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,
鸡蛋壳的主要成分是碳酸钙,讲一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,
可观察到鸡蛋一边冒气泡一边沉到杯底,一会又慢慢上浮,到接近液面时又下沉.请解释这一现象. 碧情1年前1
碧情1年前1 -
 138257675 共回答了14个问题
138257675 共回答了14个问题 |采纳率85.7%鸡蛋壳表面附有CO2气体,有浮力的作用上浮,接近液面时气体溢出去,鸡蛋壳的密度大于盐酸的密度,又沉下去了.我是这么理解的,也不知道对不对1年前查看全部
- 在Zn和Caco3组成的混合物中加入足量稀盐酸,完全反应后,将生成的所有气体共2.4克全部通入石灰水中得到5克
在Zn和Caco3组成的混合物中加入足量稀盐酸,完全反应后,将生成的所有气体共2.4克全部通入石灰水中得到5克
为什生成的是二氧化碳和氢气 宠物店里的故事1年前2
宠物店里的故事1年前2 -
 fanjunlawyer 共回答了12个问题
fanjunlawyer 共回答了12个问题 |采纳率100%在Zn和Caco3组成的混合物中加入足量稀盐酸,完全反应后,将生成的所有气体CaCO3+2HCl=CaCl2+H2O+CO2 CO2+Ca(OH)2=CaCO3+H2O CaCO3---CO2--1年前查看全部
- 同质量的金属与足量稀盐酸反应,生成的氢气的量多少怎么比较?
 ccoooo251年前1
ccoooo251年前1 -
 kiyochan 共回答了12个问题
kiyochan 共回答了12个问题 |采纳率83.3%首先要明白 生成1克氢气,需要 铝9克 镁12克 铁 28克 锌 32.5克(相对原子质量/化合价)
第二,等质量的金属与足量稀盐酸反应,生成氢气的质量由多到少的顺序:铝>镁>铁>锌
提示:这类题目 一定认真读题,看一看 酸是否过量 只要酸过量 就是上述方法可以解决
加油!1年前查看全部
- 将1.5g两种金属的混合物粉末与足量稀盐酸反应,反应完全后,得到标准状况下的氢气1.12L
将1.5g两种金属的混合物粉末与足量稀盐酸反应,反应完全后,得到标准状况下的氢气1.12L
则两种金属可能是A:Mg和Cu
B:Zn和Cu
C:Al和Fe
D:Mg和Al 冰融水释1年前1
冰融水释1年前1 -
 刮雪 共回答了19个问题
刮雪 共回答了19个问题 |采纳率78.9%假设反应物是一种金属M,摩尔质量为m,与酸反应后价态为+2
m 2
1.5g 1.12L/22.4L*2
m/1.5g=2/(1.12L/22.4L*2)
m=30
由于是两种金属的混合物粉末,如果两种金属的摩尔质量都小于30,则无论如何反应生成的氢气体积都会大于1.12L故不行,同样,两种金属的摩尔质量都大于30也不行,只有一大一小才有可能可以.
选项中的金属:Mg的摩尔质量为24,Cu不与稀盐酸反应,可设其摩尔质量为无穷大,Zn为65,Al为27*2/3=18(注:因Al与酸反应呈+3价)Fe为64,根据上面的规则,A正确,B中两种金属摩尔质量都大于30,错误,C正确,D错误.
故选AC1年前查看全部
- 15g金属混合物与足量稀盐酸反应生成5.62g气体混合物成分?Al和Zn.Mg和Cu
15g金属混合物与足量稀盐酸反应生成5.62g气体混合物成分?Al和Zn.Mg和Cu
两个选项:Al和Zn.还是 Mg和Cu sbvfb_ll1年前1
sbvfb_ll1年前1 -
 吴彦博 共回答了13个问题
吴彦博 共回答了13个问题 |采纳率84.6%Al和Zn
5.62g气体只能是H2 ∴H2有0.25mol 则电子转移了0.5mol
假设这些H2都是AL反应得到的,那么需AL4.5g,所以必须有Zn.
假设这些H2都是Mg反应得到的,那么需Mg6g,所以必须要有另外一种相对分子质量更大的金属参与反应,但是Cu放在稀盐酸中不反应.
综上应选前者
这是用了极限法1年前查看全部
- 锌粒投入硫酸铜溶液中,反应后有锌粒剩余,所得的溶液中的溶质为什么是硫酸锌 那么铁和足量稀盐酸呢
 weiweiacer1年前1
weiweiacer1年前1 -
 jideh123 共回答了24个问题
jideh123 共回答了24个问题 |采纳率91.7%因为锌过量,H+都反应掉了啊.铁于足量的 稀盐酸最后得到的是盐酸和氯化亚铁的混合物1年前查看全部
- 这种铁合金5.6克与足量稀盐酸反应,生成氢气0.2克
这种铁合金5.6克与足量稀盐酸反应,生成氢气0.2克
有一种铁合金,取这种铁合金5.6克与足量的稀盐酸完全反应,生成氢气0.2克,下列有关铁合金的成分正确的是
A.铁和铜 B铁和镁 C铁 镁和锌 D 铁、镁和铜 天元nn1年前3
天元nn1年前3 -
 wwfcdn 共回答了23个问题
wwfcdn 共回答了23个问题 |采纳率73.9%选D
选A的话生成H2会少,选B或C则会多1年前查看全部
- 碳酸钠与碳酸氢钠的混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,增加了b克能求出碳酸钠的质量分数吗
 苦海划舟1年前1
苦海划舟1年前1 -
 qq2000 共回答了14个问题
qq2000 共回答了14个问题 |采纳率92.9%可以的
11n(Na2CO3)-25.5n(NaHCO4)=b
得到n(Na2CO3)与n(NaHCO3)的关系,带入下式即可计算.
求:106n(Na2CO3)/[106n(Na2CO3)+84n(NaHCO3)]=1年前查看全部
- 这种铁合金5.6克与足量稀盐酸反应,生成氢气0.2克
这种铁合金5.6克与足量稀盐酸反应,生成氢气0.2克
有一种铁合金,取这种铁合金5.6克与足量的稀盐酸完全反应,生成氢气0.2克,下列有关铁合金的成分正确的是
A.铁和铜 B铁和镁 C铁 镁和锌 D 铁、镁和铜
正确答案是C 这边走那边走1年前1
这边走那边走1年前1 -
 唐木 共回答了23个问题
唐木 共回答了23个问题 |采纳率87%要生成氢气0.2克
需FE的质量=0.2/2*56=5.6=5.6
m(Mg)=0.2/2*24=2.4g5.6
镁和锌 介于5.6中间
选C1年前查看全部
- 有一包不纯的CaCO3样品,其中只含有一种杂质,现取该样品5g与足量稀盐酸反应生成2.3gCO2,则所混杂质可能是(
有一包不纯的CaCO3样品,其中只含有一种杂质,现取该样品5g与足量稀盐酸反应生成2.3gCO2,则所混杂质可能是( )
A. K2CO3
B. Na2CO3
C. MgCO3
D. NaHCO3 小鱼的tt1年前2
小鱼的tt1年前2 -
 gfgfiueg 共回答了21个问题
gfgfiueg 共回答了21个问题 |采纳率85.7%解题思路:要计算含有的另一种杂质,可以根据归一法求混合物的相对分子质量,之后分析给定物质的相对分子质量.设该盐为纯净的+2价碳酸盐,设该金属为M,对应的碳酸盐的相对分子质量为x.
MCO3+2HCl=MCl2+CO2↑+H2O
x 44
5g2.3g
[x/5g=
44
2.3g]
解得:x≈95.7;
由于碳酸钙的相对分子质量为100,所以所含杂质的相对分子质量必须小于95.7,给定物质中碳酸镁的相对分子质量为84,碳酸氢钠的相对分子质量为84,小于97.故选CD.
故选CD.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了混合碳酸盐与酸反应生成二氧化碳质量,完成此题,需使用极值法和平均值法.1年前查看全部
- 高中摩尔计算的格式12gMg与足量稀盐酸unhealthy,充分反应,消耗多少克HCl?生成MgCl2的物质的量为多少?
高中摩尔计算的格式
12gMg与足量稀盐酸unhealthy,充分反应,消耗多少克HCl?生成MgCl2的物质的量为多少?该反应中Mg形成Mg2+时,失去的电子数位多少?
请把格式和答案给我,
打错了,那个unhealthyhi混合 为了遗忘1年前1
为了遗忘1年前1 -
 sara_lu 共回答了15个问题
sara_lu 共回答了15个问题 |采纳率73.3%Mg+2HCl=MgCl2+H2
24 71
12 x
计算可知x=36.5g
充分反应,消耗36.5g克HCl
12gMg为0.5mol
根据物料守恒
生成的MgCl2的物质的量为0.5mol
1molMg形成Mg2+时,失去2mol电子
所以,
该反应中0.5molMg形成Mg2+时
失去的电子数为1mol1年前查看全部
- 用含碳酸钙250克的石灰石与足量稀盐酸反映,可以制取二氧化碳多少克?
 VV淡定刷屏1年前3
VV淡定刷屏1年前3 -
 longwu198512 共回答了8个问题
longwu198512 共回答了8个问题 |采纳率87.5%CaCO3+2HCl=CaCl2+H2O+CO2
100 44
250克 X,X=110克1年前查看全部
- 将镁条在二氧化碳中燃烧.的生成物置于足量稀盐酸中可观察到的现象是什么?
 xmy45111年前5
xmy45111年前5 -
 妇炎洁 共回答了21个问题
妇炎洁 共回答了21个问题 |采纳率100%2Mg+CO2=点燃==2MgO+C
MgO+2HCl==MgCl2+H2O
C(黑色)不与盐酸反应
MgO白色固体溶解
如还有疑问~欢迎追问1年前查看全部
- 已部分变质的Ca(OH)2固体试样10g,与足量稀盐酸反应,产生2.2gCO2,则该固体中Ca(OH)2的质量分数为
已部分变质的Ca(OH)2固体试样10g,与足量稀盐酸反应,产生2.2gCO2,则该固体中Ca(OH)2的质量分数为
答案是50%,但我不懂为什么算出CACO3的质量后可以直接用10g减啊?不是还要把CACO3的m带回第一个方程求得变质的CA(OH)2的m吗? 2007之最冷的冬季1年前1
2007之最冷的冬季1年前1 -
 zcx798 共回答了18个问题
zcx798 共回答了18个问题 |采纳率72.2%用2.2克CO2可以算出CaCO3是5克.所以那个变质后的混合物里面,有5克的碳酸钙和5克的氢氧化钙.所以直接算就可以了.
你的想法是,想算出那5克碳酸钙在变质之前的氢氧化钙的质量,你想的其实很好,只是题目问的是变质后的混合物里的含量,所以不必再考虑原始的成分了.
如果提问说原有的氢氧化钙有多少变质了,那么就要按你想的再算一步了.1年前查看全部
- 22.2g石灰石样品与足量稀盐酸反应,生成CO28.8g.求
22.2g石灰石样品与足量稀盐酸反应,生成CO28.8g.求
(1)该石灰石中CaCO3的质量分数;
(2)生成氯化钙的质量;
(3)该石灰石中钙元素的质量分数. 江南小妹妹1年前1
江南小妹妹1年前1 -
 eaac55362 共回答了13个问题
eaac55362 共回答了13个问题 |采纳率92.3%CaCO3+2H+=Ca2+ +H2O+CO2
1.生成CO28.8g,所以有20gCaCO3,所以该石灰石中CaCO3的质量分数是90%
2.生成氯化钙的质量为22.2克
3.该石灰石中钙元素的质量分数为20*0.4/22.2=36%1年前查看全部
- 向碳酸钙中加入足量稀盐酸和向碳酸钠中加入足量稀盐酸的离子方程式一样么
 fiokjvuir1年前4
fiokjvuir1年前4 -
 hxd20052005 共回答了26个问题
hxd20052005 共回答了26个问题 |采纳率96.2%不一样.
分别是:
CaCO3 + 2H+ == Ca2+ + H2O + CO2↑
CO3^2- + 2H+ == H2O + CO2↑1年前查看全部
- 实验室用5g不纯的锌与足量稀盐酸反应,得到0.1g氢气,则该不纯的锌中含锌的质量分数为多少?(该反应的化学方程式为Zn+
实验室用5g不纯的锌与足量稀盐酸反应,得到0.1g氢气,则该不纯的锌中含锌的质量分数为多少?(该反应的化学方程式为Zn+2HCl═ZnCl2+H2↑)
 zhaoxiguo9661年前1
zhaoxiguo9661年前1 -
 我是无怨无 共回答了16个问题
我是无怨无 共回答了16个问题 |采纳率93.8%解题思路:由氢气的质量根据锌与盐酸反应的化学方程式可以计算出该不纯的锌中锌的质量分数.设该不纯的锌中锌的质量分数为x.
Zn+2HCl═ZnCl2+H2↑
65 2
5g•x 0.1g
[65/2]=[5g•x/0.1g],x=65%
答:该不纯的锌中锌的质量分数为65%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查含杂质物质的化学方程式计算,难度较大.1年前查看全部
- (2013•株洲)鸡蛋壳的主要成分是碳酸钙,将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可以观察到鸡蛋冒气泡,该气泡的
(2013•株洲)鸡蛋壳的主要成分是碳酸钙,将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可以观察到鸡蛋冒气泡,该气泡的主要成分是( )
A.H2
B.CO2
C.O2
D.N2 云雾笼罩1年前1
云雾笼罩1年前1 -
 我是狼外婆1976 共回答了15个问题
我是狼外婆1976 共回答了15个问题 |采纳率93.3%鸡蛋壳的主要成分是碳酸钙,碳酸钙能与盐酸反应生成二氧化碳气体,生成的二氧化碳气体附在蛋壳表面,分析所给的选项可以知道选项B正确.
故选B.1年前查看全部
- 将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H 2 的质量与反应时间的关系如图所示,据图回答:
将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H 2 的质量与反应时间的关系如图所示,据图回答: 
(1)金属X是 ____________ ,判断的理由为______________ 。
(2)从图中你还能获得的信息有 ___________________ (答一条即可)。 day8boy1年前1
day8boy1年前1 -
 子雯 共回答了22个问题
子雯 共回答了22个问题 |采纳率95.5%1年前查看全部
- 解释下列现象1.鸡蛋壳的主要成分是碳酸钙,将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可观察到鸡蛋一边冒气泡一边沉到杯
解释下列现象
1.鸡蛋壳的主要成分是碳酸钙,将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面是又下沉.
2.馒头、面包等发面食品的一个特点是面团中有许多小孔,它们事发面食品松软可口.根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠在其中的作用. 俺也披个小tt21年前1
俺也披个小tt21年前1 -
 东鱼 共回答了11个问题
东鱼 共回答了11个问题 |采纳率90.9%碳酸钙、碳酸氢钠分别和酸反应生成CO21年前查看全部
- 黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量.
 seabeachking28861年前3
seabeachking28861年前3 -
 金斯沃 共回答了23个问题
金斯沃 共回答了23个问题 |采纳率95.7%解题思路:位于H前面的金属能置换出盐酸、稀硫酸中的氢(除浓硫酸、硝酸外),Cu的活动性在(H)后,故不能和稀盐酸发生反应.只有锌和稀盐酸发生了反应.根据化学方程式即可计算出黄铜中锌的质量,进而计算出铜的质量.设生成0.2g氢气,需锌的质量为X,
Zn+2HCl═ZnCl2+H2↑
65 2
X 0.2g
∴65:2=x:0.2g,
解之得:x=6.5g,
铜的质量=20g-6.5g=13.5g.
答:铜的质量为13.5g.点评:
本题考点: 根据化学反应方程式的计算;金属活动性顺序及其应用.
考点点评: 此题通过对生活实践中的具体问题,考查了运用活动性顺序等基础知识解决实际问题的能力以及对实际问题进行分析综合的能力,理解有关规律:金属与酸、盐溶液发生置换反应的条件,Zn与酸、盐溶液发生置换反应时,生成物中Zn显+2价,金属与混合盐溶液反应的优先置换原理.1年前查看全部
- 化学方程式的计算题1.某化学实验小组,用20g石灰石样品(杂质不参加化学反应,也不溶于水)放入烧杯中,加入足量稀盐酸,有
化学方程式的计算题
1.某化学实验小组,用20g石灰石样品(杂质不参加化学反应,也不溶于水)放入烧杯中,加入足量稀盐酸,有关数据如图所示:
求:(1)样品中碳酸钙的纯度?(完整步骤)
(2)高温煅烧这种石灰石100t,可得到二氧化碳气体多少吨?(完整步骤)
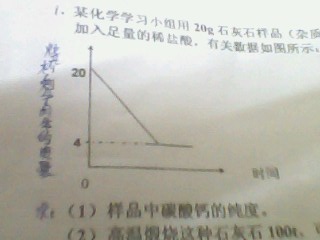
 laigenyan1年前1
laigenyan1年前1 -
 cancannn 共回答了11个问题
cancannn 共回答了11个问题 |采纳率72.7%你的图看不清楚!
如果纵坐标是烧杯中固体物质的量的话这样
石灰和盐酸反应:
CaCO3+HCl=CaCl2+CO2+H2O
剩余的4克固体是杂质,所以,纯度=(20-4)/20=80%
100上述吨石灰石的纯CaCO3是80吨
上述反应的质量比为
CaCO3+HCl=CaCl2+CO2+H2O
100 44
80 X
产出的CO2质量等于 X=80*44/100=35.2吨1年前查看全部
- 问几道科学简答题1.如何鉴别失去标签的氢氧化钠溶液和盐酸这两瓶溶液?2.在一支试管中放入一个生锈的铁钉,并加入足量稀盐酸
问几道科学简答题
1.如何鉴别失去标签的氢氧化钠溶液和盐酸这两瓶溶液?
2.在一支试管中放入一个生锈的铁钉,并加入足量稀盐酸使之反应,溶液颜色有何变化?有无气体生成?写出有关的化学方程式.
3.若用浓盐酸和锌反映制氢气,制得氢气中混有氯化氢,如何除去混在氢气中的氯化氢气体? cxd13722661年前4
cxd13722661年前4 -
 dnue 共回答了20个问题
dnue 共回答了20个问题 |采纳率90%1、测PH
2、变成绿色,有气体生成,是氢气
Fe+2HCl==FeCl2+H2(上箭号)
3、通入水中或碱性溶液中1年前查看全部
- 黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量.
 bernie11221年前2
bernie11221年前2 -
 jqq790913 共回答了15个问题
jqq790913 共回答了15个问题 |采纳率86.7%解题思路:位于H前面的金属能置换出盐酸、稀硫酸中的氢(除浓硫酸、硝酸外),Cu的活动性在(H)后,故不能和稀盐酸发生反应.只有锌和稀盐酸发生了反应.根据化学方程式即可计算出黄铜中锌的质量,进而计算出铜的质量.设生成0.2g氢气,需锌的质量为X,
Zn+2HCl═ZnCl2+H2↑
65 2
X 0.2g
∴65:2=x:0.2g,
解之得:x=6.5g,
铜的质量=20g-6.5g=13.5g.
答:铜的质量为13.5g.点评:
本题考点: 根据化学反应方程式的计算;金属活动性顺序及其应用.
考点点评: 此题通过对生活实践中的具体问题,考查了运用活动性顺序等基础知识解决实际问题的能力以及对实际问题进行分析综合的能力,理解有关规律:金属与酸、盐溶液发生置换反应的条件,Zn与酸、盐溶液发生置换反应时,生成物中Zn显+2价,金属与混合盐溶液反应的优先置换原理.1年前查看全部
- 含60g碳酸钙的石灰石与足量稀盐酸反应,生成二氧化碳的质量是多少
含60g碳酸钙的石灰石与足量稀盐酸反应,生成二氧化碳的质量是多少
、、、 风向天1年前2
风向天1年前2 -
 23180657 共回答了19个问题
23180657 共回答了19个问题 |采纳率94.7%CaCO3+2HCL=CaCL2+H2O+CO2 100.44 60.m 得m=25.4g 答:生成二氧化碳的质量是25.4g1年前查看全部
- 由镁、铝、锌三种金属单质中的两种组成的混合物共12克,与足量稀盐酸反应生成5.6升氢气(标准状况下氢气的密度为0.09克
由镁、铝、锌三种金属单质中的两种组成的混合物共12克,与足量稀盐酸反应生成5.6升氢气(标准状况下氢气的密度为0.09克/升),由此可知,此混合物中必含有的金属单质是()
A.镁
B.铝
C.锌
D.无法判断 jk0011年前5
jk0011年前5 -
 源泉023 共回答了15个问题
源泉023 共回答了15个问题 |采纳率86.7%设金属的平均适量为R
R+2HCl===RCl2+H2
解得R=47.6
而金属镁与盐酸反应的适量是24
铝与盐酸反应的适量是18
锌与盐酸反应的适量是65
如果要组成平均适量是47.6的组合,必然有多余47.6的,有小于47.6的,因此此混合金属中必然含有锌
因此选择C1年前查看全部
- 废旧计算机的某些部件含有Zn、Fe、Cu、Ag、Pt(铂)、Au(金)等金属,经物理方法初步处理后,与足量稀盐酸充分反应
废旧计算机的某些部件含有Zn、Fe、Cu、Ag、Pt(铂)、Au(金)等金属,经物理方法初步处理后,与足量稀盐酸充分反应,然后过滤,剩余的金属是( )
A. Cu、Ag、Fe
B. Pt、Cu、Zn
C. Fe、Zn
D. Pt、Ag、Cu、Au 异水寒1年前1
异水寒1年前1 -
 bestxin 共回答了15个问题
bestxin 共回答了15个问题 |采纳率86.7%解题思路:根据在金属活动性顺序中,氢前的金属可以与酸发生置换反应分析判断.在金属活动性顺序中,Zn、Fe、Cu、Ag、Pt、Au的活动性顺序为Zn>Fe>H>Cu>Ag>Pt>Au,与足量稀盐酸充分反应,由于锌和铁排在氢的前面,可以与盐酸完全反应,剩余的固体不和盐酸反应,由此可知过滤后剩余的金属是:Cu、Ag、Pt、Au;
故选项为:D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行分析,难度不大.1年前查看全部
- M克金属A(A的相对原子质量为m)与足量稀硫酸反应产生x克氢气,N克金属B(B的相对原子质量为n)与足量稀盐酸反应产生y
M克金属A(A的相对原子质量为m)与足量稀硫酸反应产生x克氢气,N克金属B(B的相对原子质量为n)与足量稀盐酸反应产生y克氢气,且x≠y,若要确定反应中A、B两种金属的化合价,至少需要知道的数据是( )
A. x与y的比值
B. x或y的确切值
C. m与n的比值
D. 酸的溶质质量分数 沈仪1年前1
沈仪1年前1 -
 lhshch 共回答了21个问题
lhshch 共回答了21个问题 |采纳率95.2%解题思路:化学式中的原子个数及化学方程式中的化学计量数根据题意都可写成字母或代数式的形式,在配平化学方程式及利用化学方程式进行计算时,可把这些字母或代数式看成一个数值,按正确的步骤进行解答.设A的化合价为a,则生成硫酸盐的化学式为A2(SO4)a,Y的化合价为b,则其氯化物的化学式为BClb,则化学方程式可写成
2A+aH2SO4═A2(SO4)a+aH2↑ 2B+2bHCl═2BClb+bH2↑
2m 2a 2n2b
Mg xNgy
由两方程式得出:[a/b]═
mx
M
ny
N由于MNmn四个数字均是已知的,所以若要确定反应中A、B两种金属的化合价,至少需要知道x与y的比值.
故选:A.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题考查学生根据化学方程式计算与化合价知识综合运用能力.1年前查看全部
- 1.66G(nh4)2SO4中含氮多少G?2.多少克硫酸铵中含氮54克?3.10克硫酸铵与足量稀盐酸反应CO2多少?
 tly88881年前1
tly88881年前1 -
 小宝宝027 共回答了10个问题
小宝宝027 共回答了10个问题 |采纳率80%(NH4)2SO4 2N
132 28
66g X
Y 54g
132/66g=28/X
X= 14g
132/Y=28/54g
Y=254.6g
66G(nh4)2SO4中含氮14G
254.6克硫酸铵中含氮54克
硫酸铵与稀盐酸不反应1年前查看全部
- 在某种不纯铁片中可能含有Mg Al Cu取5.6g跟足量稀盐酸反应得到2.24LH2 则该铁片中A一定不含镁 B一定不含
在某种不纯铁片中可能含有Mg Al Cu取5.6g跟足量稀盐酸反应得到2.24LH2 则该铁片中A一定不含镁 B一定不含铝
在某种不纯铁片中可能含有Mg Al Cu取5.6g跟足量稀盐酸反应得到2.24LH2 则该铁片中
A一定不含镁 B一定不含铝 C一定含有铜 D一定含有镁铝铜 婷love晔1年前2
婷love晔1年前2 -
 波洛徒儿 共回答了18个问题
波洛徒儿 共回答了18个问题 |采纳率83.3%5.6g也就是如果完全是铁 那么正好生成所要求的2.24
也就是说 如果含有 一定含有某物质同样质量比fe生成h2多 另一种少
因此做一个排序 同样生成1molh2 需要多少质量金属
fe 56g mg 24 al18 cu无穷多 因此 一定含有铜 镁铝一种或者都有1年前查看全部
- (2012•武清区二模)实验室用6.5g锌与足量稀盐酸反应,可制得氢气多少克?这些氢气在标准状况下为多少升?(氢气的密度
(2012•武清区二模)实验室用6.5g锌与足量稀盐酸反应,可制得氢气多少克?这些氢气在标准状况下为多少升?(氢气的密度是0.09g/L)计算结果保留至0.01.
 020tianhe1年前1
020tianhe1年前1 -
 colorsz-y 共回答了21个问题
colorsz-y 共回答了21个问题 |采纳率81%设生成氢气的质量为x
Zn+2HCl═ZnCl2+H2↑
65 2
6.5g x
[65/6.5g=
2
x]
x=0.2g
氢气在标准状况下的体积为
[0.2g/0.09g/L]=2.22l
答:生成氢气0.2g,在标准状况下2.22升1年前查看全部
- 间:2010-4-25 16:32 取矿石样品10克,加入足量稀盐酸,完全反应后,共用...
间:2010-4-25 16:32 取矿石样品10克,加入足量稀盐酸,完全反应后,共用...
间:2010-4-25 16:32
取矿石样品10克,加入足量稀盐酸,完全反应后,共用去稀硫酸154.5克,过滤得到滤渣2克(杂质不溶于水,也不与酸反应)算出赤铁矿石中氧化铁的质量分数和反应后盐酸中溶质质量分数. 正庄红花油1年前1
正庄红花油1年前1 -
 优雅的老鼠 共回答了19个问题
优雅的老鼠 共回答了19个问题 |采纳率100%氧化铁的质量=10-2=8克
赤铁矿石中氧化铁的质量分数=32/40=80%
Fe2O3+6HCl=2FeCl3+3H2O
160-------------------325
8----------------------X
X=16.25g
反应后盐酸中溶质质量分数=16.25/(154.5+8)=10%1年前查看全部
- 现有4mol铝与足量稀盐酸和NaOH溶液,若要使铝完全转化为Al(OH)3,
现有4mol铝与足量稀盐酸和NaOH溶液,若要使铝完全转化为Al(OH)3,
所需HCl和NaOH物质的量最小为()A.4molB.6molC.8mol.D24mol xuef81年前2
xuef81年前2 -
 jynh12 共回答了19个问题
jynh12 共回答了19个问题 |采纳率84.2%有3条途径
1、2Al + 6HCl = 2AlCl3 + 3H2
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
消耗HCl:12mol,NaOH:12mol
2、2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
NaAlO2 + HCl + H2O = Al(OH)3 + NaCl
消耗HCl:4mol,NaOH:4mol
3、将4molAl分成2份,
1份1mol,
2Al + 6HCl = 2AlCl3 + 3H2
1份3mol,
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
AlCl3 + 3NaAlO2 + 6H2O = 4Al(OH)3 + 3NaCl
很明显,方法3消耗的HCl和NaOH最少,消耗HCl:3mol,NaOH:3mol1年前查看全部
- 在相同条件下,将等质量的下列金属投入足量稀盐酸中,得到氢气最多的是? A Fe B Zn C Mg D Al
在相同条件下,将等质量的下列金属投入足量稀盐酸中,得到氢气最多的是? A Fe B Zn C Mg D Al
详细
能否再详细一些?? 柳御寒1年前3
柳御寒1年前3 -
 兰se妖精 共回答了13个问题
兰se妖精 共回答了13个问题 |采纳率100%金属与产生氢气的质量比:
A: 28:1
B: 32.5:1
C: 12:1
D: 9:1
根据分子量知道 D是最正确的1年前查看全部
- 把下列个组中的两种物质的溶液混合,有沉淀生成,加入足量稀盐酸,沉淀部分溶解、,过滤,过滤呈黄色,则物质是
把下列个组中的两种物质的溶液混合,有沉淀生成,加入足量稀盐酸,沉淀部分溶解、,过滤,过滤呈黄色,则物质是
ANaOH FeCL3 B NaOH CuS04
BaOH2 Fe2(SO4)3 D Na2CO3 CaCL2
写原因&方程式
下列各组物质能在pH=1的溶液中大量共存的是
A Na2CO3 NaCL CaCL2
B BaCL2 NaCL KNO3
C BaCL2 Na2SO4 H2SO4
D NaNO3 NaOH Na2SO4
写详细原因和方程式 冷月w寒雪1年前1
冷月w寒雪1年前1 -
 funstarguogu 共回答了10个问题
funstarguogu 共回答了10个问题 |采纳率100%沉淀部分溶解,表示有部分沉淀可溶于HCl(呈黄色),部分不溶解
A.错,3NaOH + FeCl3 == 3NaCl + Fe(OH)3↓(红褐色),而Fe(OH)3溶于HCl呈黄色
B.错,2NaOH + CuSO4 == Na2SO4 + Cu(OH)2↓(蓝色),而Cu(OH)2溶于HCl呈黄绿色
C.对,3Ba(OH)2 + Fe2(SO4)3 == 2Fe(OH)3↓(黄色)+ BaSO4↓(白色),Fe(OH)3溶于HCl呈黄色,BaSO4不溶于HCl
D.错,Na2CO3 + CaCl2 == 2NaCl + CaCO3↓(白色),而CaCO3溶于HCl呈无色透明
A.错,Na2CO3会与强酸反应:Na2CO3 + 2H+ == 2Na+ + CO2↑+ H2O
B.对,三种物质均不与H+反应或相互反应,可在pH=1溶液中大量共存
C.错,BaCl2会与Na2SO4及H2SO4反应:BaCl2 + SO4 2- == BaSO4↓+ 2Cl-
D.错,NaOH会与强酸反应:NaOH + H+ == Na+ + H2O1年前查看全部
- 小城同学将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯
小城同学将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯
中,可观察到的现象是(1)___________________________________;
产生此现象的原因是(2)______________________________________
____________________________________________________________
___________________________________________________________。
 fdgs2f12h5541年前1
fdgs2f12h5541年前1 -
 ii第一强人 共回答了19个问题
ii第一强人 共回答了19个问题 |采纳率84.2%(1)鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。
(2)鸡蛋壳成分中含有碳酸钙,与稀盐酸反应会产生二氧化碳
(或CaCO 3 +2HCl= CaCl 2 + H 2 O+ CO 2 ↑),二氧化碳附着在鸡蛋表面,使鸡蛋排开水的体积变大,浮力变大,大于重力,鸡蛋上浮;接近液面时,二氧化碳逸散,鸡蛋排开水的体积变小,浮力变小,小于重力,鸡蛋下沉。
1年前查看全部
- 相等质量铁与锌与足量稀盐酸反应,谁生成氢气多,为什么,
 lee72391年前4
lee72391年前4 -
 cz439535989 共回答了17个问题
cz439535989 共回答了17个问题 |采纳率94.1%Fe分子量56
Zn分子量65
他们都是生成二价氯化物体
也就是说56份量Fe和65份量Zn产生氢气一样多
相等质量铁与锌与足量稀盐酸反应,当然是Fe多啦1年前查看全部
- 0.54g某金属投入足量稀盐酸中,充分反应后,收集到标准状况下672mlH2.(1)所得H2的质量是多少克?
0.54g某金属投入足量稀盐酸中,充分反应后,收集到标准状况下672mlH2.(1)所得H2的质量是多少克?
(2)反应消耗多少摩尔HCL?
(3)若反应后金属在其氯化物中显+3价,则该金属的摩尔质量是多少? 梦儿03591年前4
梦儿03591年前4 -
 luochunyi99 共回答了16个问题
luochunyi99 共回答了16个问题 |采纳率100%1.672mlH2的物质的量是0.672/22.4=0.03mol所以H2的质量是0.03*2=0.06g2.H2中的氢元素全部来自盐酸,所以盐酸的物质的量是0.03*2=0.06mol3.设金属为M.若反应后金属在其氯化物中显+3价,则反应方程式为:2M+6HCl=2MCl3+3...1年前查看全部
- 有一根在空气中放置一段时间的镁条样品,其质量为2.56g,将该样品投入到50g足量稀盐酸中,充分反应后称得混合物的质量为
有一根在空气中放置一段时间的镁条样品,其质量为2.56g,将该样品投入到50g足量稀盐酸中,充分反应后称得混合物的质量为52.38g.(1)样品中未被氧化的没镁的质量是多少(2)该镁条未被氧化时的质量是多少
 wtuynfce7501年前1
wtuynfce7501年前1 -
 一柄断剑 共回答了22个问题
一柄断剑 共回答了22个问题 |采纳率90.9%生成氢气的质量为 2.56g+50g-52.38g=0.18g
Mg+2HCl=MgCl2+H2
24 2
x 0.18g
24/x=2/0.18g
x=2.16g
(1)样品中未被氧化的镁的质量是 2.16g
氧化镁中镁的质量为 (2.56g-2.16g)*24/40=0.24g
(2)该镁条未被氧化时的质量是 2.16g+0.24g=2.4g1年前查看全部
- 镁条有一部分被氧化,用这种镁条0.4克与足量稀盐酸反应,在标准状况下收集到0.336 升氢气.求此
镁条有一部分被氧化,用这种镁条0.4克与足量稀盐酸反应,在标准状况下收集到0.336 升氢气.求此
镁条有一部分被氧化,用这种镁条0.4克与足量稀盐酸反应,在标准状况下收集到0.336
升氢气.求此镁条的纯度 ljyyyyyyy1年前1
ljyyyyyyy1年前1 -
 ggld096c 共回答了15个问题
ggld096c 共回答了15个问题 |采纳率93.3%Mg+2HCl=H2+MgCl2
24 22.4
X 0.336
24/X=22.4/0.336 x=0.36g
0.36/0.4X100%=90%1年前查看全部
- 实验室需要标况下11.2L的CO2,现用CaCO3与250ml足量稀盐酸反应怎么以物质的量来求
 怕输才不怪1年前3
怕输才不怪1年前3 -
 紧张的可怜人 共回答了20个问题
紧张的可怜人 共回答了20个问题 |采纳率90%CaCO3 + 2HCl = CaCl2 + H2O + CO2
2mol 1mol
M×250/1000 11.2/22.4
计算M就是要用的HCl的摩尔浓度.1年前查看全部
大家在问
- 1在等比数列{an}中,如果a6=6,a9=9,那么a3为( )
- 2为什么说《塞上听吹笛》三四两句有“语意双关”的特点 (不要回答赏析)
- 3词语充值卡。(把下面的词语补充完整,并解释所填字的意思)
- 4I have orked on the problem.so i am feeling tired and___
- 5we can not deny that it is not easy to separate
- 6读“洋流模式图(图15)”,回答下列问题。
- 7fresh water generator can ______ 25 tons of fresh water
- 8I see you give it to me stop playing
- 9明媚的春天终于来了.万物复苏,大地一片生机.怎么改为排比句
- 10(1)当2m+7<0时,根号4m的平方-4m+1 + 根号9m的平方+6m+1 是多少
- 11请给我几个可以在圣诞晚会上表演的英文诗歌.或剧本.
- 12小华3次数学考试的平均分是88分。如果将第三次的考试成绩改为92分、那么小华3次考试的平均成绩是90分。你知道小华第三次
- 13图所示的四种现象中,属于光的直线传播的是
- 14某造船厂制造一艘船,实际所用天数比计划的三分之二还少七天,这样比计划提前了97天完成,问实际用的天数是多少天?
- 15再算用定滑轮拉重物的力时,滑轮本身的重力对计算结果有影响吗(题目是包含定滑轮重力的)

