2014年3月22日是第二十二届“世界水日”,保护水资源,从我做起!
 Thesonofdragon2022-10-04 11:39:541条回答
Thesonofdragon2022-10-04 11:39:541条回答(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的______倍.
(2)炼金废水中含有络离子[Au(CN)2]+,与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其电离出CN-有毒,CN-与H+结合生成毒性更强的HCN.[Au(CN)2]+的一级电离方程式:______;在碱性条件下NaClO将废水中的CN-氧化成CO和N2,其反应的离子方程式为:______.
(3)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如图所示:

请根据图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为______.
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为______.
③试确定NO3-是否存在?______(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3-)=______(若不存在,此问不必作答).
(4).聚合硫酸铁又称聚铁,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),它是一种高效的无机高分子混凝剂、净水剂. 某中学化学兴趣小组查资料获取测定聚铁中含铁量的方法:把聚铁溶于过量酸中,先用过量SnCl2将Fe3+还原成 Fe2+:Sn2++2Fe3++6Cl-=2Fe2++SnCl62-,再加入HgCl2溶液除去过量的SnCl2:Sn2++2Hg2++8Cl-=Hg2Cl2↓+SnCl62-,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+.若称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,再用0.1000mol•L-1K2Cr2O7标准溶液滴定,达到终点时,消耗标准溶液12.80mL,则聚铁中铁元素的质量分数为______%.(保留小数点后一位)

已提交,审核后显示!提交回复
共1条回复
 切半斤 共回答了27个问题
切半斤 共回答了27个问题 |采纳率88.9%- 解题思路:(1)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍;
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,第一步电离出一个CN-;
处理这种废水是在碱性条件下,NaClO将CN-氧化为碳酸根和氮气,碱性条件下生成生成碳酸根离子;
(3)配制1.0mol/L的NaOH溶液100mL,根据实验步骤所需仪器:玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管、100mL容量瓶;
②实验③中A→B过程是Al(OH)3与OH-发生反应;
③根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+和Mg2+,无铁离子,因氢氧化铁为红褐色沉淀;因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、Mg2+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(Mg2+),再根据电荷守恒确定有没有NO3-;
(4)根据6Fe2+~Cr2O72-计算出亚铁离子物质的量,进而计算聚铁中铁的质量分数.(1)ClO2和Cl2的还原产物都为Cl-,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5;
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,第一步电离出一个CN-,电离方程式为[Au(CN)2]+⇌[Au(CN)]2++CN-,
故答案为:[Au(CN)2]+⇌[Au(CN)]2++CN-;
处理这种废水是在碱性条件下,NaClO将CN-氧化为碳酸根和氮气,碱性条件下生成碳酸根离子,反应方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,
故答案为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
(3)①配制1.0mol/L的NaOH溶液100mL,根据实验步骤所需仪器:玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管、100mL容量瓶;故答案为:100mL容量瓶;
②实验③中A→B过程是Al(OH)3与OH-发生反应,其方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
③根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+、Mg2+无Fe3+,因为CO32-与Al3+不能共存,所以无CO32-;
故溶液中存在的离子为:Al3+、Mg2+、SO42-,已知硫酸钡沉淀为2.33g,则n(SO42-)=[2.33g/233g/mol]=0.01mol,
根据图象可知与Al(OH)3的OH-为:n(OH-)=0.005mol,
Al(OH)3 +OH-=AlO2-+2H2O Mg2++2OH-=Mg(OH)2↓
n(Al3+) 0.005moln(Mg2+)0.035mol-3n(Al3+)
所以n(Al3+)=0.005mol,n(Mg2+)=[0.035mol-3×0.005mol/2]=0.01mol 所以溶液中Mg2+和Al3+所带正电荷与SO42-所带负电荷不相等,因此存在NO3-,
设NO3-物质的量为nmol,根据电荷守恒得:3n(Al3+)+2n(Mg2+)=2n(SO42-)+n(NO3-)所以n(NO3-)=0.015mol,所以c(NO3-)═[0.015mol/0.1L]=0.15mol/L,
故答案为:存在;0.15mol/L;
(4)亚铁被氧化成铁离子,转移1mol电子,Cr2O72-被还原为Cr3+,转移6mol电子,
根据 6Fe2+~Cr2O72-计算出亚铁离子物质的量,
6mol 1mol
n 0.1000mol/L×0.0128L
n=[6mol×0.1000mol/L×0.0128L/1mol]=0.00768mol,
故聚铁中铁的质量分数为:
0.00768mol×
100mL
20mL×56g/mol
10.00g×100%=21.5%,
故答案为:21.5%.点评:
本题考点: 配制一定物质的量浓度的溶液;化学方程式的有关计算;氯、溴、碘及其化合物的综合应用;常见阳离子的检验;常见阴离子的检验.
考点点评: 本题考查了常见离子检验,现象的判断和离子检验,滴定的计算等.关键是图象分析离子特征和离子共存的判断,关系式的应用等,题目难度中等. - 1年前
相关推荐
- (2014•江西模拟)2014年3月22日是第二十一届“世界水日”,水与人类的生活和生产密切相关,下列相关说法正确的是(
(2014•江西模拟)2014年3月22日是第二十一届“世界水日”,水与人类的生活和生产密切相关,下列相关说法正确的是( )
A.生活中的水几乎都是纯净水
B.硬水软化常用的方法是加入活性炭
C.大量使用农药,化肥不会造成水体污染
D.由H2和O2的反应,电解水实验都能确定水是由氢、氧元素组成 dm3001年前1
dm3001年前1 -
 彤山碧 共回答了22个问题
彤山碧 共回答了22个问题 |采纳率95.5%解题思路:A、根据生活中的水的成分来分析;
B、根据硬水软化的方法来分析;
C、根据水体污染的原因来分析;
D、根据质量守恒定律来分析.A、生活中的水中往往含有可溶性杂质、微生物等,属于混合物;
B、在生活中,常用加热煮沸的方法将硬水转化为软水,活性炭具有吸附作用,只能吸附水中的色素和异味;
C、大量使用化肥和农药是导致水体污染的原因之一;
D、氢气在点燃的条件下与氧气反应生成水,水通电分解为氧气和氢气,根据质量守恒定律可知,化学反应前后元素的种类不变,由此可知这两个实验都能确定水是由氢、氧元素组成的.
故选D.点评:
本题考点: 硬水与软水;水的组成;水资源的污染与防治.
考点点评: 本题主要考查了化学与生活中有关知识,掌握它们的化学原理是解答的关键,题目难度不大.1年前查看全部
- 2014年3月22日是第22个“世界水日”,今年的主题是“水与能源”.
2014年3月22日是第22个“世界水日”,今年的主题是“水与能源”.
(1)生活中可用______区分硬水与软水,家庭中常用______方法降低水的硬度;
(2)往水中加入______能产生大量热,利用水还能产生的一种能源是______. 518168cn1年前1
518168cn1年前1 -
 carme828 共回答了22个问题
carme828 共回答了22个问题 |采纳率95.5%解题思路:(1)根据硬水含有较多的钙、镁离子的化合物,给生活和生产带来很多麻烦,生活中可用肥皂水来区分硬水和软水,硬水遇肥皂水产生的泡沫少,遇软水产生的泡沫多,常用煮沸的方法来降低水的硬度进行解答;
(2)生石灰与水反应可放出大量热,水通电会生成氢气和氧气.(1)硬水含有较多的钙、镁离子的化合物,给生活和生产带来很多麻烦,生活中可用肥皂水来区分硬水和软水,硬水遇肥皂水产生的泡沫少,遇软水产生的泡沫多,常用煮沸的方法来降低水的硬度;
(2)生石灰与水反应可放出大量热,水通电会生成氢气和氧气,故产生氢能.
故答案为:(1)肥皂水,煮沸;
(2)生石灰,氢能.点评:
本题考点: 硬水与软水;物质发生化学变化时的能量变化.
考点点评: 本题考查了水的知识,涉及的知识面较广,只有较全面地掌握有关的基础知识,才能灵活答题.1年前查看全部
- 2014年3月22日是第二十二个“世界水日”,它的主题是“水与能源”,关于水的知识有下列话题,请回答:
2014年3月22日是第二十二个“世界水日”,它的主题是“水与能源”,关于水的知识有下列话题,请回答:
(1)自来水生产过程中,可加______形成胶状物,吸附水中悬浮的杂质,使之沉降,可用______(填操作名称)除去水中不溶性杂质.
(2)可用______来检验地下水是硬水还是软水,生活中常用______的方法,既可降低水的硬度,又能杀菌消毒. Don_Nelson1年前1
Don_Nelson1年前1 -
 蔚蓝纯川 共回答了15个问题
蔚蓝纯川 共回答了15个问题 |采纳率86.7%解题思路:(1)根据加入明矾可以形成胶状物,吸附水中悬浮的杂质解答;根据过滤的原理分析回答;
(2)根据硬水、软水的鉴别、硬水的软化方法分析回答;(1)加入明矾可以形成胶状物,吸附水中悬浮的杂质,水中不溶性杂质可用过滤的方法除去;
(2)硬水中含有较多钙、镁离子,加入肥皂水,泡沫少,可用肥皂水检验硬水与软水;在对水加热煮沸时,钙、镁离子会形成不溶于水的水垢而降低含量,日常生活在加热煮沸水时降低水中钙、镁离子含量;
答案:
(1)明矾 过滤
(2)肥皂水 煮沸点评:
本题考点: 自来水的生产过程与净化方法;过滤的原理、方法及其应用;硬水与软水.
考点点评: 需要了解净化水的常用方法的操作原理,才能正确掌握净化水的常用方法,这对解答此类问题尤其重要.1年前查看全部
- (2014•娄底)2014年3月22日是第二十二个“世界水日”,它的主题是“水与能源”.关于水的知识有下列话题,请按要求
(2014•娄底)2014年3月22日是第二十二个“世界水日”,它的主题是“水与能源”.关于水的知识有下列话题,请按要求填空:
(1)自来水生产过程中,可用______方法除去水中不溶性杂质.
(2)生活中可用______来检验地下水是硬水还是软水.常用______的方法,既可降低水的硬度,又能杀菌消毒.
(3)测定地下水的酸碱度常用______.
(4)在生产生活中水是最常用的溶剂,实验室用蔗糖配制一定溶质质量分数的溶液时,可能涉及以下操作:
①图中操作中有错误的是______(填序号).
②改正错误后,表示正确的操作顺序是______(填序号).
A.⑤②①③④B.⑤①②③④C.⑤③②④①D.⑤③①④②
③玻璃棒在该实验中所起的作用是______.
(5)保护水环境、珍爱水资源,是每个公民应尽的责任和义务.下列做法有利于保护水资源的是______ (填序号).
A.大量使用化肥农药B.工业废水处理达标后再排放
C.使用含磷洗衣粉D.生活污水直接排放. 和楼主斗到底1年前1
和楼主斗到底1年前1 -
 没有天分 共回答了26个问题
没有天分 共回答了26个问题 |采纳率92.3%解题思路:(1)从过滤是把不溶于液体的物质与液体分离的一种方法去分析解答;
(2)硬水中含有较多的钙镁化合物,易生水垢,与肥皂不易起泡沫,易起渣,而软水则与肥皂易起泡沫,所以可用肥皂水区分硬水和软水;通过加热煮沸可以使硬水中的可溶性钙镁化合物发生反应以水垢的形式析出,形成含较少可溶性钙镁化合物的软水去分析解答;
(3)常用pH试纸测量溶液的酸碱度去分析解答;
(4)配制一定溶质质量分数的溶液的步骤是:计算、称量固体的质量、量取液体和体积,溶解去分析解答.
①从称量固体的质量应该把砝码放在右盘,固体放在左盘去分析解答,图中二者位置放反了;
②从正确的操作顺序为:⑤③①④②去分析解答;
③从为加速蔗糖的溶解,可用玻璃棒进行搅拌去分析解答;
(5)A、从大量使用化肥农药,农作物消耗不了的化肥和农药会污染水源和空气去分析解答;
B、从工业废水经处理后变成中水,减少了对水的污染去分析解答;
C、从含磷洗衣粉以磷酸盐作为主要助剂,磷酸盐是一种高效助洗剂,同时也是藻类的助长剂,水中的磷含量升高,水质趋向富营养化,会导致各种藻类.水草大量滋生,水体缺氧会使鱼类死亡等现象去分析解答;
D、从生活污水直接排放会污染水去分析解答;(1)过滤是把不溶于液体的物质与液体分离的一种方法,所以除去水中不溶性杂质可用过滤的方法;故答案为:过滤;
(2)硬水中含有较多的钙镁化合物,易生水垢,与肥皂不易起泡沫,易起渣,而软水则与肥皂易起泡沫,所以可用肥皂水区分硬水和软水;通过加热煮沸可以使硬水中的可溶性钙镁化合物发生反应以水垢的形式析出,形成含较少可溶性钙镁化合物的软水;故答案为:肥皂水;煮沸;
(3)常用pH试纸测量溶液的酸碱度;故答案为:用pH试纸;
(4)配制一定溶质质量分数的溶液的步骤是:计算、称量固体的质量、量取液体和体积,溶解.所以正确的操作顺序为:⑤③①④②.
①图中的③,称量固体的质量应该把砝码放在右盘,固体放在左盘,图中二者位置放反了;故答案为:③;
②由上面的分析可知:正确的操作顺序为:⑤③①④②;故答案为:D.
③为加速蔗糖的溶解,可用玻璃棒进行搅拌;故答案为:搅拌,加速溶解;
(5)A、大量使用化肥农药,农作物消耗不了的化肥和农药会污染水源和空气;故A错误;
B、工业废水经处理后变成中水,减少了对水的污染;故B正确;
C、含磷洗衣粉以磷酸盐作为主要助剂,磷酸盐是一种高效助洗剂,同时也是藻类的助长剂,水中的磷含量升高,水质趋向富营养化,会导致各种藻类.水草大量滋生,水体缺氧会使鱼类死亡等现象;故C错误;
D、生活污水主要是城市生活中使用的各种洗涤剂和污水、垃圾、粪便等,多为无毒的无机盐类,生活污水 中含氮、磷、硫多,致病细菌多,直接排放会污染水;故D错误;
故答案为:B.点评:
本题考点: 自来水的生产过程与净化方法;一定溶质质量分数的溶液的配制;过滤的原理、方法及其应用;溶液的酸碱度测定;硬水与软水;保护水资源和节约用水.
考点点评: 生活处处有化学,学会用所学的化学知识去解决生活中的实际问题.1年前查看全部
- (13分)2014年3月22日是第22届“世界水日”,请你根据所学,回答下列问题。
(13分)2014年3月22日是第22届“世界水日”,请你根据所学,回答下列问题。
(1)下图是简易净水装置。该净水装置 (填“能”或“不能”)将河水变成纯水。
(2)二氧化氯(ClO 2 )是新一代饮用水的消毒剂,工业上将氯气(Cl 2 )通入亚氯酸钠(NaClO 2 )溶液中反应来制取二氧化氯,同时生成氯化钠。写出该反应的化学方程式: 。
(3)小丽收集到一瓶浑浊的河水,她要模拟自来水厂的净水过程,最终制成蒸馏水,
过程如下图所示。
操作①的名称是 ;操作②应选用的装置是下图中的 (填序号,下同);操作③应选用的装置是下图中的 。
(Ⅰ)(Ⅱ) (Ⅲ)
(4)小丽取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明液体D是 水。(填“硬”或“软”)
(5)如图是甲、乙两种物质的溶解度曲线,回答下列问题:
①________℃时,甲、乙两种物质的溶解度相等;
②若固体甲中含有少量乙时可用_____________方法提纯甲(填”蒸发结晶“或”冷却结晶“);
③t 2 ℃用等质量的甲、乙两种物质配制甲、乙的饱和溶液需要水的质量:
甲______乙(填“>”“<”或“=”);
④实验室需要配制50g溶质质量分数为4%的氢氧化钠溶液,所需固体氢氧化钠的质量为___ __g,主要操作步骤是:计算、_______、量取、溶解.在溶解过程中用玻璃棒搅拌,其作用是______ ___. 魔狼转世731年前1
魔狼转世731年前1 -
 cara4925 共回答了12个问题
cara4925 共回答了12个问题 |采纳率100%(1)不能 (2)Cl 2 + 2NaClO 2 ="=" 2ClO 2 +2 NaCl (3)过滤 (Ⅱ) (Ⅰ)
(4)硬水 (5)t1,冷却结晶, < , 2 , 称量 ,加速溶解
1年前查看全部
- 2014年3月22日是第二十二届“世界水日”,3月22-28日是第二十七届“中国水周”,水利部确定本次活动的主题为“加强
2014年3月22日是第二十二届“世界水日”,3月22-28日是第二十七届“中国水周”,水利部确定本次活动的主题为“加强河湖管理,建设水生态文明”.下列说法正确的是( )
A.保护水资源,禁止使用化肥、农药
B.利用沉降的方法,将硬水转化成软水
C.工业废渣的任意排放,不会污染水体
D.城市浇花,使用喷灌、滴灌技术 ljrsha1年前1
ljrsha1年前1 -
 大黑牡丹 共回答了17个问题
大黑牡丹 共回答了17个问题 |采纳率64.7%解题思路:A、农药化肥要合理使用;
B、根据沉降的原理分析;
C、工业废渣的任意排放,会造成水体污染;
D、城市浇花使用喷灌、滴灌,可以节约用水.A、农药化肥要合理使用,不能禁止使用,故错误;
B、沉降的方法只能除去水中较大的不溶性颗粒,不能减少水中钙镁离子的化合物的含量,不能降低水的硬度,故错误;
C、工业废渣的任意排放,会造成水体污染,故错误;
D、城市浇花使用喷灌、滴灌,可以节约用水,故正确.
故选:D.点评:
本题考点: 水资源的污染与防治;硬水与软水;保护水资源和节约用水.
考点点评: 本考点是有关环境污染问题,属于结合课本知识的信息,环境污染主要包括空气污染、水污染、土壤污染、臭氧空洞和白色污染等.有关环境污染问题的考题是近几年中考的热点,一定要综合掌握.此类考点主要出现在选择题和填空题中.1年前查看全部
- 2014年3月22日是第二十二届“世界水日”,保护水资源,从我做起!(1)ClO2和Cl2(还原产物都为Cl-)是生
2014年3月22日是第二十二届“世界水日”,保护水资源,从我做起!(1)ClO2和Cl2(还原产物都为Cl-)是生
2014年3月22日是第二十二届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的______倍.
(2)炼金废水中含有络离子[Au(CN)2]+,与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其电离出CN-有毒,CN-与H+结合生成毒性更强的HCN.[Au(CN)2]+的一级电离方程式:______;在碱性条件下NaClO将废水中的CN-氧化成CO和N2,其反应的离子方程式为:______.
(3)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如图所示:
请根据图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为______.
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为______.
③试确定NO3-是否存在?______(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3-)=______(若不存在,此问不必作答).
(4).聚合硫酸铁又称聚铁,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),它是一种高效的无机高分子混凝剂、净水剂. 某中学化学兴趣小组查资料获取测定聚铁中含铁量的方法:把聚铁溶于过量酸中,先用过量SnCl2将Fe3+还原成 Fe2+:Sn2++2Fe3++6Cl-=2Fe2++SnCl62-,再加入HgCl2溶液除去过量的SnCl2:Sn2++2Hg2++8Cl-=Hg2Cl2↓+SnCl62-,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+.若称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,再用0.1000mol?L-1K2Cr2O7标准溶液滴定,达到终点时,消耗标准溶液12.80mL,则聚铁中铁元素的质量分数为______%.(保留小数点后一位)
 tingxue52261年前1
tingxue52261年前1 -
 芒野 共回答了27个问题
芒野 共回答了27个问题 |采纳率96.3%(1)ClO2和Cl2的还原产物都为Cl-,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5;
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,第一步电离出一个CN-,电离方程式为[Au(CN)2]+?[Au(CN)]2++CN-,
故答案为:[Au(CN)2]+?[Au(CN)]2++CN-;
处理这种废水是在碱性条件下,NaClO将CN-氧化为碳酸根和氮气,碱性条件下生成碳酸根离子,反应方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,
故答案为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
(3)①配制1.0mol/L的NaOH溶液100mL,根据实验步骤所需仪器:玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管、100mL容量瓶;故答案为:100mL容量瓶;
②实验③中A→B过程是Al(OH)3与OH-发生反应,其方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
③根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+、Mg2+无Fe3+,因为CO32-与Al3+不能共存,所以无CO32-;
故溶液中存在的离子为:Al3+、Mg2+、SO42-,已知硫酸钡沉淀为2.33g,则n(SO42-)=[2.33g/233g/mol]=0.01mol,
根据图象可知与Al(OH)3的OH-为:n(OH-)=0.005mol,
Al(OH)3 +OH-=AlO2-+2H2O Mg2++2OH-=Mg(OH)2↓
n(Al3+) 0.005moln(Mg2+)0.035mol-3n(Al3+)
所以n(Al3+)=0.005mol,n(Mg2+)=[0.035mol-3×0.005mol/2]=0.01mol 所以溶液中Mg2+和Al3+所带正电荷与SO42-所带负电荷不相等,因此存在NO3-,
设NO3-物质的量为nmol,根据电荷守恒得:3n(Al3+)+2n(Mg2+)=2n(SO42-)+n(NO3-)所以n(NO3-)=0.015mol,所以c(NO3-)═[0.015mol/0.1L]=0.15mol/L,
故答案为:存在;0.15mol/L;
(4)亚铁被氧化成铁离子,转移1mol电子,Cr2O72-被还原为Cr3+,转移6mol电子,
根据 6Fe2+~Cr2O72-计算出亚铁离子物质的量,
6mol 1mol
n 0.1000mol/L×0.0128L
n=[6mol×0.1000mol/L×0.0128L/1mol]=0.00768mol,
故聚铁中铁的质量分数为:
0.00768mol×
100mL
20mL×56g/mol
10.00g×100%=21.5%,
故答案为:21.5%.1年前查看全部
- 2014年3月22日是第22届“世界水日”,本届宣传主题是“水与能源”(Water Cooperation),
2014年3月22日是第22届“世界水日”,本届宣传主题是“水与能源”(Water Cooperation),请你根据所学,回答下列问题.
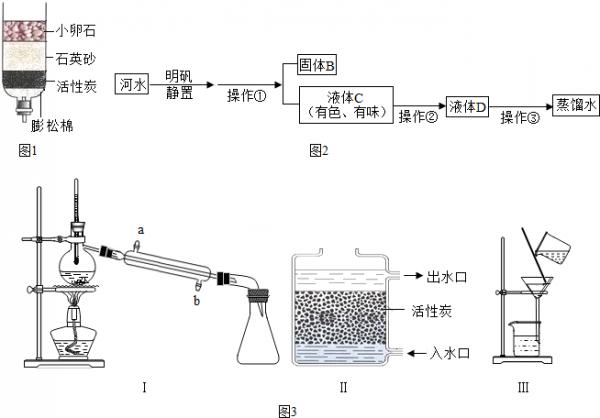
(1)如图1是简易净水装置,该净水装置______(选填“能”或“不能”)将河水变成纯水.
(2)二氧化氯(ClO2)是新一代饮用水的消毒剂,工业上将氯气(Cl2)通入亚氯酸钠(NaClO2)溶液中反应来制取二氧化氯,同时生成氯化钠.请写出该反应的化学方程式:______.
(3)小丽收集到一瓶浑浊的河水,她要模拟自来水厂的净水过程,最终制成蒸馏水,过程如图2所示,操作①的名称是______;操作②应选用的装置是如图3中的______(填序号,下同);操作③应选用的装置是如图3中的______.
(4)小丽取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明液体D是
______(选填“硬”或“软”) 水.
(5)图Ⅰ中温度计水银球位置是否正确?______(选填“正确”或“错误”),冷凝管应从______
(选填“a”或“b”)处进水. zyuki1年前1
zyuki1年前1 -
 yaojunn 共回答了14个问题
yaojunn 共回答了14个问题 |采纳率85.7%解题思路:(1)根据简易净水装置图,小卵石、石英砂、蓬松棉可以把不溶于水的物质除去,活性炭可除去水中的色素、异味等,据此分析解答即可;
(2)根据参加反应的物质及生成的物质,完成反应化学方程式的书写;
(3)过滤是分离可溶性物质与不溶性物质的方法;分析流程图可知:操作②除去了液体C中的异味、色素,说明该操作中应用了具有吸附作用的物质,如活性炭;操作③可得到纯水,说明进行了蒸馏操作;
(4)根据检验硬水、软水的方法分析解答;
(5)温度计应位于蒸馏烧瓶支管口,冷凝管下口是进水口,上口是出水口.(1)根据净水简易装置图,可知水经过小卵石可除去较大颗粒的固体不溶物,而石英砂、蓬松棉则可除去小颗粒的固体不溶物,因此小卵石、石英砂都起到过滤的作用;活性炭可除去水中的色素、异味等,经过该装置的水并不能减少其中钙、镁离子,因此不能将硬水软化;
(2)由氯气在溶液中与亚氯酸钠反应生成二氧化氯和氯化钠可知:该化学方程式为Cl2 +2NaClO2 =2NaCl+2ClO2;
(3)过滤是分离可溶性物质与不溶性物质的方法;分析流程图可知:操作①将固体和液体分开,说明采取了过滤操作,操作②除去了液体C中的异味、色素,说明该操作中应用了具有吸附作用的物质,如活性炭;操作③可得到纯水,说明进行了蒸馏操作;
(4)硬水中若加入少量肥皂水,振荡,会有较多浮渣产生;
(5)温度计应位于蒸馏烧瓶支管口,冷凝管下口是进水口,上口是出水口.
故答案为:(1)不能;
(2)Cl2+2NaClO2═2ClO2+2NaCl;
(3)过滤;Ⅱ;Ⅰ;
(4)硬.
(5)错误,b.点评:
本题考点: 水的净化;过滤的原理、方法及其应用;蒸发与蒸馏操作;自来水的生产过程与净化方法;硬水与软水;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题涉及硬水和软水的检验、净化及化学方程式的书写等基础知识,题目难度不大但涉及面较广,耐心审题、沉着作答是解题的关键.1年前查看全部
- 杭州西湖周长多少米?—。—其实我知道的,2014年3月22日,从早上11:30开始绕西湖徒步行走,下午5:30共走完两圈
杭州西湖周长多少米?
—。—其实我知道的,2014年3月22日,从早上11:30开始绕西湖徒步行走,下午5:30共走完两圈,中途不休息。步行速度1.4m/sX60秒X60分钟X3小时X2圈=30240米。求西湖周长(数据为亲身实测) 好男儿最帅1年前2
好男儿最帅1年前2 -
 逻辑辨异 共回答了26个问题
逻辑辨异 共回答了26个问题 |采纳率84.6%西湖湖面南北长3.3公里,东西宽2.8公里,水面原面积5.64平方公里,湖中岛屿面积6.3平方公里,湖岸周长15公里。1年前查看全部
- 2014年3月22日是第二十二届“世界水日”,主题是“水与能源”.
2014年3月22日是第二十二届“世界水日”,主题是“水与能源”.
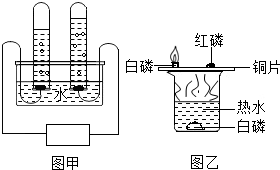
(1)水在实验室中有不同用途.
①图甲为电解水的装置图,其反应方程式为2H2O
2H2↑+O2↑通电 .2H2O;
2H2↑+O2↑通电 .
②图乙为探究燃烧条件实验,其中热水作用______.
(2)现将200g 20%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为______ g.
(3)“节约用水,从我做起”,请你任举一例生活中节约用水的措施______.
(4)开发和充分利用能源成为越来越迫切的要求.
①下列属于人们正在利用和开发的新能源的是______.
A.煤 B.天然气 C.生物质能
②做饭时,燃气灶的火焰呈现黄色或橙色,锅底出现黑色,此时就需要调节一下灶具的进风口.理由是______. ALONI1年前1
ALONI1年前1 -
 高奇 共回答了25个问题
高奇 共回答了25个问题 |采纳率84%解题思路:(1)根据水通电分解生成氢气和氧气,写出反应的化学方程式;根据燃烧的条件分析水的作用;
(2)根据稀释前后溶质的质量不变计算;
(3)举例生活中的节水即可;
(4)根据常规的能源和新能源分析选择;根据促进燃烧的方法分析理由.(1)①水通电分解生成氢气和氧气,反应的化学方程式为:2H2O
通电
.
2H2↑+O2↑;
②此组实验烧杯中的热水可以为白磷和红磷的燃烧提供热量,还可以为水中的白磷隔绝氧气;
(2)稀释前后溶质的质量不变,设加水的质量为x,则200g×20%=(200g+x)×10%,X=200g;
(3)在生活中用淘米水浇花(或其它合理答案)都能节约用水;
(4)①煤和天然气都属于常规的化石燃料,生物质能属于新能源,故选项为:C;
②做饭时,燃气灶的火焰呈现黄色或橙色,锅底出现黑色,说明氧气(或空气)不足,燃料燃烧不充分,因此需要增大氧气(或空气)的进气量;
故答案为:(1)①2H2O
通电
.
2H2↑+O2↑;②对白磷和红磷进行加热及为水中的白磷隔绝氧气;
(2)200 g;
(3)淘米水浇花(或其它合理答案)
(4)①C②说明氧气(或空气)不足,需要增大氧气(或空气)的进气量.点评:
本题考点: 电解水实验;用水稀释改变浓度的方法;燃烧与燃烧的条件;完全燃烧与不完全燃烧;保护水资源和节约用水;资源综合利用和新能源开发.
考点点评: 本题考查的知识点较多,难度不大,熟练掌握电解水的知识、燃烧的条件、溶液的稀释、常见的燃料及促进燃烧的方法是解题的关键.1年前查看全部
大家在问
- 1设f(x)是定义在(0,+∞)上的增函数,且f(xy)=f(x)+f(y),若f(3)=1且f(a)>f(a-1)+2,
- 2苯酚与甲酸的反应方程式?乳酸在浓流酸加热下的反应方程式(写多几条)
- 3有关碳酸钾探究碳酸钾性质时,向碳酸钾溶液中滴加澄清石灰水,有白色沉淀,其反应化学方程式是什么?此反应产生的废液应如何处理
- 4同义句转换 1.It often snows in Moscom.2.It's sunny today.
- 5大家来做填空题(小学五年级语文)
- 6busy 有动名词形式吗我现在正忙怎么说
- 710g锌、铜合金跟100g9.8%的稀硫酸恰好完全反应,求(1)产生氢气多少升(氢气的密度为0.097 g/mL)?(2
- 8二进制纯小数补码加减和如何判断它是否溢出,求解答
- 9同学小嘎应迷恋网吧,学业渐渐荒废.今天他又抄你作业,此时你会对他说什么?(古诗,名言,语句)
- 10在七点前回答,好人有好报,底面直径8厘米,高8厘米.求圆柱的侧面积.底面半径3厘米,高12厘米.求圆柱的侧面积.底面直径
- 11(2010•虹口区一模)a为已知实数,它使得仅有一个实数x满足不等式|x2+2ax+3a|≤2,则实数a=______.
- 12我的书屋我的梦怎么写思路是什么我的书屋我的梦 的思路是怎样的 应该怎么写
- 13圆台的俯视图不应该是圆吗,为什么是圆环,(PS 俯视图:由物体上方向下做正投影得到的视图)请
- 14在《敬重卑微》一文中,“我”敬重卑微是因为什么?
- 15(2013•乐山)为了测定某碳酸钠样品中杂质氯化钠的质量分数,李明同学进行了三次实验,反应的化学方程方程式为:Na2CO
