(2006•南和县)小明家是种植蔬菜的专业户,他学习了初三化学后告诉父母:施用适量的氮肥可以使种植的蔬菜叶色浓绿.因此,
 彼岸没有灯塔062022-10-04 11:39:541条回答
彼岸没有灯塔062022-10-04 11:39:541条回答A、碳酸氢铵[NH4HCO3]B、硫酸钾[K2SO4]C、磷矿粉[Ca3(PO4)2]
(2)他还告戒父母在施用氮肥的同时______(填“能”或“不能”)施用草木灰.理由是______.
(3)他还建议父母经常向大棚中补充气体肥料CO2,目的是促进绿色植物______作用.

已提交,审核后显示!提交回复
共1条回复
 pigclean 共回答了23个问题
pigclean 共回答了23个问题 |采纳率73.9%- 解题思路:只有熟悉铵态氮肥的作用和特性以及光合作用,才能正确解答本小题.
(1)氮肥能使植物的茎、叶生长茂盛,叶色浓绿,因此他建议买氮肥.
三个选项中只有选项A中的碳酸氢铵中含有氮元素,属于氮肥,故选A.
(2)草木灰的主要成分是碳酸钾,显碱性,铵态氮肥与碱性物质共存时能释放氨气,降低肥效.因此氮肥不能与草木灰共同施用.
(3)向大棚中补充气体肥料CO2,目的是促进绿色植物光合作用.
故答案为:
(1)A
(2)不能;草木灰和他们买的氮肥混合使用会放出氨气,降低氮肥肥效
(3)光合点评:
本题考点: 常见化肥的种类和作用;二氧化碳的用途.
考点点评: 本题主要考查铵态氮肥的作用、特性和植物的光合作用.难度较小 - 1年前
相关推荐
- (2006•南和县)推理是化学学习中常用的思维方法.以下4个推断正确的是( )
(2006•南和县)推理是化学学习中常用的思维方法.以下4个推断正确的是( )
A.氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物
B.酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应
C.燃烧一般都伴随发光、放热现象,所以有发光、放热的现象就是燃烧
D.醇类物质在空气中完全燃烧生成C02和H20,甲醇是醇类的一种,所以甲醇在空气中完全燃烧生成C02和H20 majun610271年前1
majun610271年前1 -
 caby1sxy 共回答了24个问题
caby1sxy 共回答了24个问题 |采纳率95.8%解题思路:本题运用推理来考查对概念的理解,氧化物一定有氧元素,中和反应一定是酸碱反应,燃烧发生的化学变化.A中由氧化物概念可知,氧化物必有氧元素,但硫酸,硝酸钾等也有氧元素,则含有氧元素的化合物不一定是氧化物,故A错误.
B中酸与碱反应生成盐和水是中和反应,金属氧化物和酸反应及非金属氧化物与碱反应等也能生成盐和水,则生成盐和水的反应不一定是酸与碱的反应,故B错误.
C中燃烧是化学变化,伴随有发光、放热现象,但有发光、放热的现象不一定发生化学变化,如灯泡发光为物理变化,故C错误.
D中醇类物质中有C、H、O三种元素,所以燃烧的产物根据元素的守恒可知为C02和H20,推理正确,故D正确.
故选D.点评:
本题考点: 氧化物、酸、碱和盐的概念;酸的化学性质;碱的化学性质;燃烧、爆炸、缓慢氧化与自燃.
考点点评: 推理是一种常用的化学思维方法,但不一定正确,需要科学论证,通过本题看出还要注意反例法及守恒法也是常用的思维方法,应注意不同方法的结合使用.1年前查看全部
- (2006•南和县)用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧的测定方法.实验过程是:
(2006•南和县)用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧的测定方法.实验过程是:
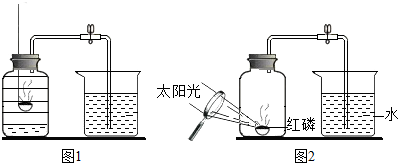
第一步:将集气瓶容积划分为五等份,并做好标记.
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸
入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的[1/5].
请回答下列问题
(1)上面的实验同时证明了氮气有______ 的化学性质.
(2)实验完毕,若进入集气瓶中水的体积不到总容积的[1/5],你认为导致这一结果的原因可能是______.
(3)某同学对实验进行反思后,提出了改进方法(如图所示 ),你认为改进后的优点是:______. rock点子1年前1
rock点子1年前1 -
 山中山水中水 共回答了19个问题
山中山水中水 共回答了19个问题 |采纳率94.7%解题思路:(1)根据实验完成后红磷有剩余,而瓶内剩余的气体主要为氮气,由此可推断得到氮气不能燃烧也不支持燃烧的化学性质;
(2)实验完毕,若进入集气瓶中水的体积不到总容积的[1/5],说明瓶内气体减少量不足[1/5],分析其原因主要为氧气未完全消耗或是冷却过程中空气进入瓶中所导致的结果,据此对实验进行分析;
(3)对比改进行前后的两种探究装置,可发现改进后不需要点燃红磷后再将燃烧匙伸入瓶中,可很好地避免因装置漏气而对结果带来的偏差.(1)若氮气能燃烧或能支持燃烧,则最终剩余气体不会是氮气或剩余氮气的体积会减小,而实验完成后剩余红磷而空气中氮气的量也没有减少,说明红磷不能在氮气中继续燃烧,可判断氮气不能支持燃烧也不能燃烧;
(2)如果实验中因红磷量不足而氧气没有完全消耗或因装置漏气而在冷却过程中进入少量空气或未冷却至室温而打开弹簧夹等,都可能出现进入集气瓶中水的体积不到总容积的[1/5]的结果;
(3)改进后的装置直接通过聚太阳光而引燃磷,避免了再次打开瓶塞而保持装置始终密封,减少了操作中人为因素所造成的偏差,可得到更准确的实验结果;
故答案为:
(1)不能燃烧,也不支持燃烧;
(2)装置漏气(或红磷的量不足等);
(3)装置始终密闭,空气没有逸出,实验结果准确.点评:
本题考点: 测定空气里氧气含量的探究.
考点点评: 对所熟悉实验的深入分析、误差分析及改进优点的评价,解答时需要较强的实验与分析能力,有一定难度.1年前查看全部
- (2006•南和县)下列各组物质中均有一种物质的类别与其他三种不同:(用化学式填空)
(2006•南和县)下列各组物质中均有一种物质的类别与其他三种不同:(用化学式填空)
①CaO,Fe2O3,CO2,CuO
②S,C,P,Cu
③O2,MgCl2,Na2SO4,KNO3
④HCl,H2O,H2SO4,HNO3
(1)这四种物质依次是:①______,②______,③______,④______.
(2)这四种物质相互作用可生成一种新的物质,颜色为绿色,该物质是______. tghjk1年前1
tghjk1年前1 -
 leefengmin 共回答了15个问题
leefengmin 共回答了15个问题 |采纳率100%解题思路:氧化物分为金属氧化物和非金属氧化物,单质分为金属单质和非金属单质,纯净物分为单质和化合物,水属于氧化物,不是酸.(1)①中的二氧化碳属于非金属氧化物,其它都是金属氧化物.
②中铜属于金属单质,其它都是非金属单质.
③中氧气属于单质,其它都是化合物.
④中水属于氧化物,其它都是酸.
故填:CO2;Cu;O2;H2O
(2)这四种物质反应能生成碱式碳酸铜.故填:Cu2(OH)2CO3点评:
本题考点: 物质的简单分类;化学式的书写及意义.
考点点评: 本题主要考查了物质的分类方法及其书写物质的化学式等方面的知识,可以依据物质的组成以及物质间的反应进行.1年前查看全部
- (2006•南和县)研究性学习:探究实验室中久置的NaOH的变质程度
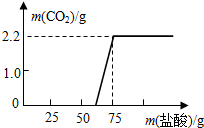 (2006•南和县)研究性学习:探究实验室中久置的NaOH的变质程度
(2006•南和县)研究性学习:探究实验室中久置的NaOH的变质程度
【研究方案】先称取13.3g的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量.从而进一步确定样品中NaOH的变质程度.
【解决问题】实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示.
填写下表:(计算结果保留小数点后一位)
【继续探究】求实验过程中与NaOH反应所用盐酸的质量.Na2CO3的质量/g 变质NaOH的质量/g NaOH的变质程度
(用质量分数表示)
【发现问题】根据“与NaOH反应所用盐酸的质量”,对照图象,你发现了什么问题? 欣儿11年前1
欣儿11年前1 -
 补充招数 共回答了15个问题
补充招数 共回答了15个问题 |采纳率93.3%解题思路:在变质的氢氧化钠中滴加盐酸,盐酸与碳酸钠产生二氧化碳气体,根据二氧化碳气体的质量可确定碳酸钠的质量.通过图示我们发现刚滴加盐酸时并没有产生二氧化碳气体.由图示可知产生的二氧化碳的质量为2.2g,则由二氧化碳的质量和化学方程式可得碳酸钠的质量为5.3g,反应的氢氧化钠的质量为4.0g,则氢氧化钠的变质程度为[4g/13.3g−5.3g+4g]×100%=33.3%.
故答案为:
Na2CO3的质量/g 5.3
变质NaOH的质量/g 4.0
NaOH的变质程度(用质量分数表示) 33.3%[继续探究]
没变质氢氧化钠质量为13.3g-5.3g=8g
设参加反应氯化氢的质量为m
NaOH+HCl=NaCl+H2O
40 36.5
8g m
[40/8g]=[36.5/m]
m=8g×[36.5/40]=7.3g;
盐酸的质量=[7.3g/14.6%]=50g.
[发现问题]NaOH被中和后,滴加盐酸,为什么没有立即产生CO2气体.点评:
本题考点: 药品是否变质的探究;碱的化学性质;碳酸钠、碳酸氢钠与碳酸钙;根据化学反应方程式的计算.
考点点评: 在碱和盐的混合溶液中滴加盐酸时,盐酸首先与碱反应,然后再跟盐反应,所以在氢氧化钠和碳酸钠的混合物中滴加盐酸,一开始没有二氧化碳产生.1年前查看全部
- 34.(2006年南和县)用来测定空气成分的方法很多,图1所示的是小明用红磷在空气中燃烧的测定方法.实验过程是:
34.(2006年南和县)用来测定空气成分的方法很多,图1所示的是小明用红磷在空气中燃烧的测定方法.实验过程是:
第一步:将集气瓶容积划分为五等份,并做好标记.
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸
入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5.
请回答下列问题:
(1)上面的实验同时证明了氮气有 的化学性质.
(2)实验完毕,进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是
.

 yogo581年前1
yogo581年前1 -
 wolong_207 共回答了18个问题
wolong_207 共回答了18个问题 |采纳率83.3%(1)氮气有很高的稳定性,不燃烧也不助燃.
(2)红磷不足,未耗尽瓶内氧气;
密封不严,有空气漏入瓶内;
当地空气中氧气含量低于正常水平;
烧杯中的水不足广口瓶体积的五分之一.1年前查看全部
- (2006•南和县)“达菲”是治疗人类感染禽流感的一种药物,而合成“达菲”的主要原料莽草酸(分子式C7H1005)存在于
(2006•南和县)“达菲”是治疗人类感染禽流感的一种药物,而合成“达菲”的主要原料莽草酸(分子式c7h1005)存在于***盛产的八角茴香中.下列说法正确的是( )
a.莽草酸中碳、氢、氧三种元素的质量比为42:5:40
b.莽草酸的相对分子质量为87
c.每个莽草酸分子中含有21个原子
d.莽草酸中碳元素的质量分数约为2l% 错一次一生1年前1
错一次一生1年前1 -
 儋州俊才 共回答了17个问题
儋州俊才 共回答了17个问题 |采纳率94.1%解题思路:A、元素质量比等于物质中元素的相对原子质量乘以原子个数之比;
B、根据相对分子质量的计算公式进行计算;
C、根据原子个数等于右下角数字之和;
D、某元素的质量分数=[某元素的相对原子质量×该元素的原子个数/该物质的相对分子质量]×100%计算.A、根据元素质量比等于元素的相对原子质量乘以原子个数之比,可推出莽草酸(分子式C7H1005)中碳、氢、氧三种元素的质量比为:(12×7):(1×10):(16×5)=42:5:40,
故A对;
B、根据相对分子质量等于各个原子的相对原子质量总和,所以莽草酸的相对分子质量=12×7+1×10+16×5=174,
故B错;
C、根据一个分子中所含的原子个数等于各元素右下角的数字之和,
所以一个莽草酸分子中含有原子个数为:7+10+5=22,
故C错;
D、根据某元素的质量分数的计算公式,可以莽草酸中碳元素的质量分数约为:[12×7/12×7+1×10+16×5]×100%=48.3%,故D错.
故选A点评:
本题考点: 元素质量比的计算;原子的有关数量计算;相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 题以生活中的常用的茴香的主要原料莽草酸为命题,考查了对化学式的含义的理解和应用能力,原子中中子数和质子数的区别和联系.1年前查看全部
- (2006•南和县)请根据下表回答有关问题:(除第(2)题外,其余各小题均用序号填空)
(2006•南和县)请根据下表回答有关问题:(除第(2)题外,其余各小题均用序号填空)
(1)表中的物质属于氧化物的是______;属于碱的是______;属于盐的是______.序 号 ① ② ③ ④ 物 质 醋酸 水 熟石灰 纯碱 化学式 CH3COOH H2O Ca(OH)2 Na2CO3
(2)利用表中的物质作为反应物,写出符合下列要求的化学方程式.
1、电解水2H2O
2H2↑+O2↑通电 .2H2O
2H2↑+O2↑通电 .
2、制取氢氧化钠______
(3)若要测定纯碱溶液的酸碱度,选用下列选项中______.
①无色酚酞试液②紫色石蕊试液③pH试纸. f3061年前1
f3061年前1 -
 Fiona不咋地 共回答了24个问题
Fiona不咋地 共回答了24个问题 |采纳率95.8%解题思路:(1)根据氧化物、酸、碱、盐的组成解答;
(2)根据物质间的反应规律解答;
(3)根据酸碱度的测定方法进行解答;(1)氧化物是由两种元素组成且其中一种是氧元素的化合物;碱是电离时电离出的阴离子全部是氢氧根离子的化合物;盐是由金属阳离子(铵根离子)和酸根阴子组成的化合物;故表中属于氧化物的是②;属于碱的是③;属于盐的是④.
(2)利用表中的物质作为反应物,电解水的化学方程式是2H2O
通电
.
2H2↑+O2↑;
能制取氢氧化钠的物质是 Na2CO3和Ca(OH)2,化学方程式为Na2CO3+Ca(OH)2═2NaOH+CaCO3↓
(3)若要测定溶液的酸碱度应用pH试纸,酚酞或石蕊只能测溶液酸碱性;
故答案为:(1)②;③;④;
(2)1、2H2O
通电
.
2H2↑+O2↑;2、Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)③.点评:
本题考点: 常见的氧化物、酸、碱和盐的判别;溶液的酸碱度测定;书写化学方程式、文字表达式、电离方程式.
考点点评: 明确酸碱盐的物质分类、性质、溶液酸碱性与酸碱度的测定是解答本题关健.1年前查看全部
- (2006•南和县)物质的用途一般都与物质的性质密切相关.某同学根据此规律进行归纳、整理,请你帮助他补充填空:
(2006•南和县)物质的用途一般都与物质的性质密切相关.某同学根据此规律进行归纳、整理,请你帮助他补充填空:
物质 性质 用途 (例)金刚石 很硬 刻划玻璃 氢气 密度小 ______ 石墨 ______ 做电极 氩气 ______ 保护气  ji7aocha1年前1
ji7aocha1年前1 -
 怡筝 共回答了23个问题
怡筝 共回答了23个问题 |采纳率87%解题思路:物质的化学性质是指在化学变化中表现出来的性质,物质的物理性质是指不需要通过化学变化表现出来的性质.氢气的密度比空气小,可以用来填充气球.故填:填充气球.
石墨具有良好的导电性,可以用来制作电极.故填:具有良好的导电性.
氩气的化学性质不活泼,可以用作保护气.故填:化学性质稳定.点评:
本题考点: 化学性质与物理性质的差别及应用;碳单质的物理性质及用途.
考点点评: 本题主要考查物质的性质和用途,物质具有多种性质,解答时应该理解物质的用途是由物质的哪种性质决定的.1年前查看全部
- (2006•南和县)化学成为一门科学开始于( )
(2006•南和县)化学成为一门科学开始于( )
A.对燃烧现象的深入研究
B.对空气组成的研究
C.用原子,分子论来研究化学反应之后
D.英国科学家汤姆生发现电子之后 lplp951年前1
lplp951年前1 -
 fffsdljf 共回答了13个问题
fffsdljf 共回答了13个问题 |采纳率92.3%解题思路:分析化学的发展史,理清各种成就的先后顺序,然后得出明确结果.A、对燃烧现象的深入研究,研究出燃烧的本质的科学家是拉瓦锡,是在化学成为一门学科之后.
B、对空气组成的研究典型实验也是拉瓦锡做的,是在化学成为一门学科之后.
C、自从原子-分子论的确立,奠定了近代化学的基础,此后化学才成为一门真正的学科,所以C对.
D、英国科学家汤姆生发现电子是在原子概念确立之后.
故选:C.点评:
本题考点: 化学的历史发展过程.
考点点评: 了解化学发展史,是对前人成就的恳定,也是我们为化学发展而奋斗的动力.1年前查看全部
- (2006•南和县)以下是三种气体的密度(O℃、101 kPa)和溶解度(20℃、lOl kPa).
(2006•南和县)以下是三种气体的密度(O℃、101 kPa)和溶解度(20℃、lOl kPa).
实验室收集SO2气体,可采用的方法是( )气体
性质H2 CO2 S02 密度/g/L 0.0 899 1.977 2.716 溶解度/g 0.0 001603 0.1688 11.28
A.向上排空气法
B.向下排空气法
C.排水集气法
D.既可用向上排空气法,又可用排水集气法 fengrsw1年前1
fengrsw1年前1 -
 wxjjt2002 共回答了16个问题
wxjjt2002 共回答了16个问题 |采纳率100%解题思路:二氧化硫的密度比二氧化碳(二氧化碳密度比空气大)还大用排空气法收集只能用向上排空气法,二氧化硫溶解度较大不能用排水法收集.从表中可以看出:①二氧化硫的密度比二氧化碳(二氧化碳密度比空气大)还大用排空气法收集,用向上排空气法,②二氧化硫溶解度较大不能用排水法收集.
故答案应该选:A点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 气体的收集方法是由该气体的密度和溶解性来决定的.当气体的密度大于空气时可以用向上排空气法,当气体的密度小于空气的密度时用向下排空气法;难溶或不易溶于水的气体可以用排水法,可溶或易溶于水的气体不能用排水法.1年前查看全部
- (2006•南和县)用化学符号填空
(2006•南和县)用化学符号填空
(1)氩气______;
(2)某气体在空气中占78%(体积百分含量),表示出它的8个分子______;
(3)某种带一个单位负电荷的阴离子有9个质子,它可能是______;
(4)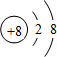 与
与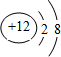 两种离子形成的化合物的化学式是______;
两种离子形成的化合物的化学式是______;
(5)温度计中填充的金属是______;
(6)地壳中含量最多的金属元素______. yeungzz1年前1
yeungzz1年前1 -
 flyyoo 共回答了17个问题
flyyoo 共回答了17个问题 |采纳率88.2%解题思路:(1)氩气是稀有气体元素,由稀有气体元素组成的单质是单原子分子,所以氩气的化学式就是表示氖元素的元素符号,进行解答;
(2)在空气中占78%(体积百分含量)的气体是氮气,根据分子表示方法在化学式前添加数字,进行解答;
(3)带一个单位负电荷的阴离子有9个质子,首先是氟离子,再是氢氧根,根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,进行解答;
(4)根据微粒结构示意图,分析其化合价,依据合物化学式的书写步骤:归类→定序→标价→交叉→约简,进行解答;
(5)温度计中填充的金属是水银,根据金属是由原子构成的物质,用它的元素符号表示这种物质,进行解答;
(6)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,正确书写元素符号即可.(1)氩气是稀有气体元素,由稀有气体元素组成的单质是单原子分子,所以氩气的化学式就是表示氖元素的元素符号,表示为;Ar;故答案为:Ar;
(2)在空气中占78%(体积百分含量)的气体是氮气,根据分子表示方法在化学式前添加数字,因此8个氮分子表示为:8N2;故答案为:8N2;
(3)带一个单位负电荷的阴离子有9个质子,首先是氟离子,再是氢氧根,根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,表示为:F-或0H-;故答案为:F-或0H-;
(4)根据微粒结构示意图,分析其化合价,氧元素化合价为-2,镁元素化合价为+2,依据合物化学式的书写步骤:归类→定序→标价→交叉→约简,两种离子形成的化合物的化学式为:MgO;故答案为:MgO;
(5)温度计中填充的金属是水银,根据金属是由原子构成的物质,用它的元素符号表示这种物质,因此表示为:Hg;故答案为:Hg;
(6)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,可知地壳中含量最多的金属元素是铝,元素符号为:Al;故答案为:Al.点评:
本题考点: 化学符号及其周围数字的意义;原子结构示意图与离子结构示意图.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础.1年前查看全部
大家在问
- 1照样子写句子船欣赏了帆,船能远航.弓欣赏了箭,箭乃远射.
- 2If I've missed out anything,Please let love make up for all
- 3设f(x)是定义在区间【-6,11】上的函数.如果f(x)在区间【-6,-2】上递减,在区间【-2,11】上递增,画出f
- 41经过老师的细心教导,我终于被评为“优秀少先队员”的光荣称号.2我们要积极响应“
- 5把5克的糖放入50克的水中,含糖率是多少?要算式
- 6英语翻译你找到房子了吗?四房的 Did you find the house ,four bedroom?这里有一套四房
- 7the man to ()you are talking is MR.SMITH
- 8(2012•梧州)为比较两个容积相同品牌不同的甲乙保温瓶的保温效果,小明同学进行了如下实验:将70℃的温水分别装入两个保
- 9(用折线在直角坐标系上表示冬至日全球的正午太阳高度变化规律),为什么老师说正午太阳高度角经计算后为-23.6度,但是地理
- 102008年8月8日,举世瞩目的第二十九届奥林匹克运动会在北京召开,来自 204个国家和地区的1万多名运动员参加了本届奥运
- 11如图所示把一个空杯子底朝天竖直下按没于水中,随着杯子没入水中深度的增加,杯中空气压强将——,杯中受
- 12听对话,回答问题。 1. Where are the two speakers?(说话人) A. At te
- 13第n个图形中有几个三角
- 14善待生灵 有时,动物界也会发生令人难以置信的故事.有一个狩猎队,把一群羚羊赶到悬崖边,准备全部活捉.约摸半小时后,羚羊群
- 15在两条平行线之间作四条垂线,这四条垂线的长度()
