Al2O3加结晶水后的化学性质与Al2O3一样吗?
 lornany2022-10-04 11:39:541条回答
lornany2022-10-04 11:39:541条回答就是Al2O3.H2O或Al2O3.3H2O

已提交,审核后显示!提交回复
共1条回复
 我的ss不是你 共回答了18个问题
我的ss不是你 共回答了18个问题 |采纳率66.7%- 一样
- 1年前
相关推荐
- 一道化学选择题下列说法正确的是A.加热胆矾晶体失去结晶水,得到白色的无水硫酸铜,这一过程叫风化B.家用石碱久置后,由块状
一道化学选择题
下列说法正确的是
A.加热胆矾晶体失去结晶水,得到白色的无水硫酸铜,这一过程叫风化
B.家用石碱久置后,由块状变成粉末状,这一变化是风化的结果
C.还有水蒸气的气体通过固体氢氧化钠时,固体表面出现水珠,这是固体氢氧化钠潮解的缘故
D.从冰箱中取出物体,表面很快出现水珠,这种现象叫潮解
为什么不能选C,水蒸气和氢氧化钠不是潮解?二氧化碳才是反应吧?
 strong9301年前1
strong9301年前1 -
 风云任务 共回答了18个问题
风云任务 共回答了18个问题 |采纳率100%潮解是物理变化,潮解是自发吸收空气中的水蒸气,不是人为的给他通水蒸气。
有些晶体能自发吸收空气中的水蒸气,在它们的固体表面逐渐形成饱和溶液,它的水蒸气压若是低于空气中的水蒸气压,则平衡向着潮解的方向进行,水分子向物质表面移动。这种现象叫做潮解。1年前查看全部
- (2011•邯郸一模)如图所示,M、N分别表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法不正确的
 (2011•邯郸一模)如图所示,M、N分别表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法不正确的是( )
(2011•邯郸一模)如图所示,M、N分别表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法不正确的是( )
A.N的溶解度受温度的影响比M大
B.t2℃时,M、N具有相同的溶解度
C.M、N两种饱和溶液,当温度从t1降至t2后,剩余溶液的溶质质量分数相等
D.M、N两种饱和溶液,当温度从t1降至t2时,一定析出相同质量的晶体 111111aa1年前1
111111aa1年前1 -
 探索灵魂 共回答了22个问题
探索灵魂 共回答了22个问题 |采纳率86.4%解题思路:A、根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
B、根据物质的溶解度曲线可以判断某一温度时物质的溶解度;
C、饱和溶液的溶质质量分数=[溶解度/100g+溶解度]×100%;
D、要判断析出晶体质量的大小,应该知道溶液质量、溶解度的方面的数据.A、由溶解度曲线可知,N的溶解度受温度的影响比M大,该选项说法正确;
B、由溶解度曲线可知,t2℃时,M、N具有相同的溶解度,该选项说法正确;
C、M、N两种饱和溶液,当温度从t1降至t2后,剩余溶液仍然是饱和溶液,此时两种物质的溶解度相等,因此溶质质量分数相等,该选项说法正确;
D、因为不知道两种饱和溶液的质量,所以不能判断析出晶体质量的大小,该选项说法不正确.
故选:D.点评:
本题考点: 固体溶解度曲线及其作用;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.1年前查看全部
- 一道化学题下列说法正确的是A.加热胆矾晶体失去结晶水,得到白色的无水硫酸铜,这一过程叫风化B.家用石碱久置后,由块状变成
一道化学题
下列说法正确的是
A.加热胆矾晶体失去结晶水,得到白色的无水硫酸铜,这一过程叫风化
B.家用石碱久置后,由块状变成粉末状,这一变化是风化的结果
C.还有水蒸气的气体通过固体氢氧化钠时,固体表面出现水珠,这是固体氢氧化钠潮解的缘故
D.从冰箱中取出物体,表面很快出现水珠,这种现象叫潮解
 有没有人爱过你1年前4
有没有人爱过你1年前4 -
 63523899 共回答了20个问题
63523899 共回答了20个问题 |采纳率75%bc
http://zhidao.baidu.com/link?url=4JHlty-By6avYI98u02gJbPeQykZU_abUSCqEvOt_wRKqt1aTzSHufKyu8AUH4CjSq7Uk0U3-aiq6okiCq3ecq1年前查看全部
- t度时,一定量得到X物质的溶液,恒温蒸发掉25g水后,可析出X晶体(无结晶水)6.5g,余下溶液的质量分数...
t度时,一定量得到X物质的溶液,恒温蒸发掉25g水后,可析出X晶体(无结晶水)6.5g,余下溶液的质量分数...
t度时,一定量得到X物质的溶液,恒温蒸发掉25g水后,可析出X晶体(无结晶水)6.5g,余下溶液的质量分数为20%,则t度时x物质的溶解度为 work12301年前1
work12301年前1 -
 纯色彩虹 共回答了14个问题
纯色彩虹 共回答了14个问题 |采纳率92.9%t度时,一定量得到X物质的溶液,恒温蒸发掉25g水后,可析出X晶体(无结晶水)6.5g,余下溶液为t度时X的饱和溶液,质量分数为20%,则t度时x物质的溶解度为 20/(100-20)*100g=25g1年前查看全部
- Ⅰ.如图1为甲、乙(均不含结晶水)两种固体物质的溶解度曲线.
Ⅰ.如图1为甲、乙(均不含结晶水)两种固体物质的溶解度曲线.
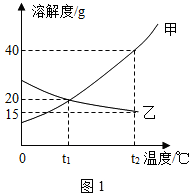
〔1〕溶解度随温度升高而增大的物质是______(填“甲”或“乙”),t1℃时,甲的溶解度______(填“大于”“小于”或“等于”)乙的溶解度;
〔2〕某同学在t1℃时开始进行如图2实验,得到相应的溶液①~③.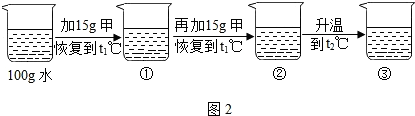
在溶液①~③中属于饱和溶液的是______(填序号)、溶质质量分数最大的是______(填序号);
(3)在溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为______〔精确到0.1%〕.
Ⅱ.某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2.小青同学设计了如图3所示实验方案来除去可溶性杂质.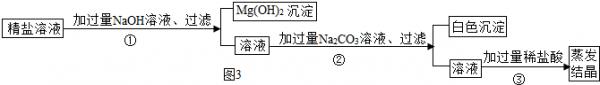
(1)步骤①的化学方程式为______.
(2)步骤②中得到的白色沉淀是______(填化学式).
(3)步骤③中加稀盐酸是为了除去溶液中的______. bbyugood1年前1
bbyugood1年前1 -
 龙鹤腾云 共回答了14个问题
龙鹤腾云 共回答了14个问题 |采纳率85.7%解题思路:Ⅰ、(1)根据溶解度曲线和交点的含义分析解答;
(2)根据甲物质在t1℃和t2℃的溶解度结合图示分析解答;
(3)根据饱和溶液溶质质量分数的计算考虑;
Ⅱ、(1)根据氯化镁与与氢氧化钠的反应写出反应的方程式;
(2)根据氯化钙与碳酸钠的反应分析生成的沉淀;
(3)根据溶液中含有的氢氧化钠、碳酸钠分析加入加稀盐酸的目的.Ⅰ、(1)由曲线可知解度随温度升高而增大的物质是甲;曲线中交点表示该温度时两种物质的溶解度相等,所以t1℃时,甲的溶解度等于乙的溶解度;
(2)甲物质在t1℃溶解度为20g,即100g水中最多溶解20g,①中加入了15g,所以为不饱和溶液,②中加入了30g,所以饱和且有10g没溶解;由于甲物质在t2℃的溶解度是40g,所以升温后原来没溶解的又溶解了,且还不饱和;溶剂不变③中的溶质质量最多,所以质量分数最大;
(3)溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,只能溶解10g,即属于饱和溶液,根据饱和时质量分数的计算式[溶解度/溶解度+100g]×100%,所以溶质质量分数为:[40g/140g]×100%=28.6%;
Ⅱ、(1)在步骤①加入的氢氧化钠能与粗盐中的氯化镁反应,生成了氢氧化镁沉淀和氯化钠,反应的方程式是:MgCl2+2NaOH=2NaCl+Mg(OH)2↓;
(2)步骤②中加入的碳酸钠能与氯化钙反应生成了CaCO3沉淀和氯化钠;
(3)由于溶液中存在过量的氢氧化钠、碳酸钠.所以,骤③中加稀盐酸是为了除去溶液中的过量的碳酸钠和氢氧化钠;
故答案为:Ⅰ、(1)甲;等于;(2)②;③;(3)28.6%;
Ⅱ、(1)MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(2)CaCO3;
(3)过量的NaOH和 Na2CO3.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液;溶质的质量分数、溶解性和溶解度的关系;氯化钠与粗盐提纯;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查综合,解答本题关键是要知道交点的含义,溶解度的大小比较,饱和溶液的判断方法和溶质质量分数的计算,及粗盐提纯实验如何除去粗盐中的可溶性杂质的问题,解答时要依据相关知识细心分析.1年前查看全部
- 硫酸铜晶体中结晶水含量的测定实验方案中,下列情况可能造成测试结果偏高的是
硫酸铜晶体中结晶水含量的测定实验方案中,下列情况可能造成测试结果偏高的是
①试样中含有加热不挥发的杂质 ②试样中含有加热易挥发的杂质 ③测试前试样已有部分脱水
④实验前坩埚未完全干燥 ⑤晶体加热脱水不完全 ⑥加热时晶体溅出[ ]A.①③④
B.②④⑤
C.②④⑥
D.①②③ 虚无缥缈鼠1年前1
虚无缥缈鼠1年前1 -
 hbfanniehu 共回答了17个问题
hbfanniehu 共回答了17个问题 |采纳率76.5%C1年前查看全部
- 含10个结晶水的碳酸钠的化学式
 BEAN_19491年前1
BEAN_19491年前1 -
 淡淡的斜阳 共回答了16个问题
淡淡的斜阳 共回答了16个问题 |采纳率93.8%na2co3●10h2o1年前查看全部
- 选择为测定Na2CO3·nH2O的n值,称xg该晶体,加热使其完全失去结晶水,最后称量剩余固体yg,则n值为53(x-y
选择
为测定Na2CO3·nH2O的n值,称xg该晶体,加热使其完全失去结晶水,最后称量剩余固体yg,则n值为
53(x-y)/9y g
怎么算的 xiaoni5021年前2
xiaoni5021年前2 -
 songhui84 共回答了19个问题
songhui84 共回答了19个问题 |采纳率94.7%Na2CO3·nH2O==Na2CO3 +nH2O
Na2CO3·nH2O xg Na2CO3 y g 化学平衡 解得N =53(x-y)/9y g1年前查看全部
- 试计算14.3gNa2CO3·10H2O晶体中结晶水的质量.多少克CuSO4·5H2O晶体中结晶水含量与14.3gNa2
试计算14.3gNa2CO3·10H2O晶体中结晶水的质量.多少克CuSO4·5H2O晶体中结晶水含量与14.3gNa2CO3·10H20晶体中结晶水含量相当?
 zhutaozhi1年前1
zhutaozhi1年前1 -
 biali 共回答了22个问题
biali 共回答了22个问题 |采纳率100%14.3gNa2CO3·10H2O晶体中结晶水的质量:14.3g*180/286=9g
与14.3gNa2CO3·10H20晶体中结晶水含量相当的CuSO4·5H2O的质量:9g*250/90=25g1年前查看全部
- 一水柠檬酸怎样失去结晶水
 blackbird_zgj1年前1
blackbird_zgj1年前1 -
 吴哲 共回答了22个问题
吴哲 共回答了22个问题 |采纳率95.5%溶了 重新结晶1年前查看全部
- 硝酸镁溶于乙醇还带结晶水吗怎么去除结晶水?如果是加热去除的话得加到多少度?怎么检测结晶水都去除干净了?
 鑫鑫鑫森森森1年前2
鑫鑫鑫森森森1年前2 -
 幻紫魅影 共回答了18个问题
幻紫魅影 共回答了18个问题 |采纳率100%不带结晶水1年前查看全部
- 在一定温度下,bg固体A能完全溶于水形成(a+b)g溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解度肯
在一定温度下,bg固体A能完全溶于水形成(a+b)g溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解度肯定不可能是( ).
A.100b/a g B.200b/a g C.100b/(a+b) g D.100(a+b)/a g 情义1年前2
情义1年前2 -
 旋转36度 共回答了15个问题
旋转36度 共回答了15个问题 |采纳率86.7%当b g固体A溶于a g水形成(a+b)g溶液时 如果是饱和溶液 则ag水最多能溶解bg固体A
所以1g水最多能溶解b/a g固体A 所以100g水最多溶解100b/a g固体A
如果不是饱和溶液 则可以溶解更多的固体A 也就是大于100b/a g
所以可能ABD 不可能是C1年前查看全部
- 在测定硫酸铜晶体的结晶水含量的试验中,怎么确认结晶水全部逸出
 wenyangbin1年前2
wenyangbin1年前2 -
 crar 共回答了12个问题
crar 共回答了12个问题 |采纳率91.7%实验时是边加热边称量,连续两次称量质量差不大于0.1克就差不多了.当然,如果你想精度高一点,改成0.05克也行.注意不要在坩埚尚热时用天平或电子秤称量,可以在火上取下来后,放在干燥器中冷却一段时间再称量.1年前查看全部
- 取某结晶水合物(A.nH2O)pg,加热使结晶水全部失去后,质量变为qg,由此可以得知该结晶水合物的相对分子质量为?
 rock7d1年前1
rock7d1年前1 -
 fjkhguy 共回答了19个问题
fjkhguy 共回答了19个问题 |采纳率94.7%取某结晶水合物(A.nH2O)pg,加热使结晶水全部失去后,质量变为qg
所以结晶水的质量为 p-q
设该结晶水合物的相对分子质量为M
所以p克水合物中H2O的质量为
(p/M)*18n
所以
(p/M)*18n=p-q
M=18np/(p-q)1年前查看全部
- 5、测定结晶水合物中结晶水含量的试验中,称量的次数至少为 ( ) A、3 B、4 C、5 D、6
 xmjcook1年前3
xmjcook1年前3 -
 没有爱情的野猪 共回答了19个问题
没有爱情的野猪 共回答了19个问题 |采纳率94.7%B1年前查看全部
- 含Fe,Ze,Mg的合金粉10.5克与200克稀硫酸溶液恰好完全反应.蒸干后得到晶体29.7克不含结晶水,
含Fe,Ze,Mg的合金粉10.5克与200克稀硫酸溶液恰好完全反应.蒸干后得到晶体29.7克不含结晶水,
则同时最多可得到氢气————-克 xuewen8881年前2
xuewen8881年前2 -
 一抹幸福 共回答了21个问题
一抹幸福 共回答了21个问题 |采纳率100%硫酸根的质量为29.7g-10.5g=19.2g,设氢气质量为x
x:19.2g=2:96
x=0.4g1年前查看全部
- 测定硫酸铜晶体中结晶水的含量为什么要反复三次
 真爱无约1年前1
真爱无约1年前1 -
 kiss_me_kiss 共回答了21个问题
kiss_me_kiss 共回答了21个问题 |采纳率95.2%是为了多次测量取平均值~
分析化学呀 做实验这样才精确1年前查看全部
- 往某硫酸铜溶液中加入某浓度的氨水,生成沉淀(已知沉淀中既不含氮元素,也不带结晶水).滤出沉淀之后,滤液经检验没有铜离子,
往某硫酸铜溶液中加入某浓度的氨水,生成沉淀(已知沉淀中既不含氮元素,也不带结晶水).滤出沉淀之后,滤液经检验没有铜离子,硫酸根离子的物质的量只有反应前的1/3,且c(氨根离子)=2c(硫酸根离子)
(1)沉淀物的化学式
(2)整条反应的化学方程式
————分—————————割————————————线——————
本人化学小白,希望尽量完整的解答过程.保证信用
——谢谢合作—— 未雨而绸缪1年前4
未雨而绸缪1年前4 -
 桃阿桃 共回答了10个问题
桃阿桃 共回答了10个问题 |采纳率100%(1)沉淀物的化学式 Cu3(OH)2(SO4)2
(2)3CuSO4 + 2NH3·H2O = (NH4)2SO4 + Cu3(OH)2(SO4)2↓
根据本题所给信息可知:反应物为CuSO4和NH3•H2O,产物存在于沉淀和滤液中,因滤液中c(NH4+)=2c(SO42-),NH4+的水解不予考虑,可知滤液为(NH4)2SO4,至此,本题的解题关键在于对沉淀化学式的确定.根据滤液中SO42-浓度是反应前浓度的1/3,可知有2/3的SO42-进入沉淀,再根据反应前后微粒守恒关系,可分析出沉淀的成分为Cu3(OH)2(SO4)21年前查看全部
- 1.把26.28gCaCl2*H2O加热到200摄氏度,使起失去全部结晶水,质量变成13.32g.肉取43.80gCaC
1.把26.28gCaCl2*H2O加热到200摄氏度,使起失去全部结晶水,质量变成13.32g.肉取43.80gCaCl2*H2O配成500ml溶液,则该溶液的物质的量浓度为多少?
2.一定温度下,在135gCuSO4溶液中取出1/3,加入5g无水CuSO4恰好达到饱和,在剩下的2/3的CuSO4溶液中,加入过量的铁粉,待反应完全后,测得溶液的质量为89.5g(1)求135gCuSO4溶液是由多少克CuSO4*5H2O晶体和多少克水配制而成的.(2)该温度下CuSO4的溶解度. bjbkwbc1年前1
bjbkwbc1年前1 -
 不只爱自己的家 共回答了18个问题
不只爱自己的家 共回答了18个问题 |采纳率100%1.CaCl2*6H2O
求得CaCl2有0.2摩尔,量浓度为0.4摩尔/升1年前查看全部
- 甲、乙两同学在室温下各取50克某溶液分别做制晶体实验,甲将溶液蒸发掉10克水后冷却至室温得晶体1.2克(晶体不含结晶水)
甲、乙两同学在室温下各取50克某溶液分别做制晶体实验,甲将溶液蒸发掉10克水后冷却至室温得晶体1.2克(晶体不含结晶水),乙将溶液蒸发掉15克水后冷却至室温,得晶体2.4克.若两人实验结果都正确,则原50克某溶液中溶质的质量分数为( )
A. 1.1%
B. 17.4%
C. 22.2%
D. 36.1% qinguojun19791年前1
qinguojun19791年前1 -
 zjy26zjy 共回答了14个问题
zjy26zjy 共回答了14个问题 |采纳率92.9%解题思路:可以把乙同学的蒸发溶液的过程分为两部分:先蒸发掉10g水,再蒸发掉5g水,由于两同学所用溶液是同样的溶液,则先蒸发掉10g水时也应该析出1.2g晶体,溶液达到饱和,再蒸发掉5g水时即蒸发饱和溶液时析出的晶体的质量为1.2g,即1.2g溶质溶解在5g水中恰好形成饱和溶液,则说明原溶液是多了5g水的饱和溶液.根据题意可知,可以将乙同学蒸发的过程表示为:50g溶液
蒸发10g水
析出1.2g晶体
蒸发掉5g水
析出1.2g晶体,说明原溶液中多了5g水,若蒸发掉这5g水,则剩余的45g溶液应为饱和溶液,有图示不难看出,1.2g溶质溶解在5g水中恰好达到饱和形成6.2g溶液,则设原溶液中即45g饱和溶液中溶质的质量为x,则
[x/45g]=[1.2g/6.2g] x=[45g×1.2g/6.2g]=8.7g
则原溶液中溶质的质量分数为:[8.7g/50g]×100%=17.4%
故选B.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题难度较大,主要考查了溶液中溶质的质量分数的有关简单的计算,重在培养学生的分析能力.1年前查看全部
- 蒸发结晶与蒸发浓缩冷却结晶过滤有什么不同 蒸发浓缩冷却结晶过滤=冷却结晶吗?要想得到带结晶水的晶体应该用什么
 打盹看帖1年前2
打盹看帖1年前2 -
 刘志刚481 共回答了23个问题
刘志刚481 共回答了23个问题 |采纳率95.7%前者是在较高温度下析出结晶,主要是用于溶解度对温度变化小的物质,后者是在较低温度下结晶,主要用于溶解度随温度变化大的物质.通常结晶温度越低,晶体含结晶水越多,硫酸钠就是个典型的例子.1年前查看全部
- 如何除去结晶水?
 yingreal05911年前1
yingreal05911年前1 -
 limitlessspace 共回答了16个问题
limitlessspace 共回答了16个问题 |采纳率81.3%mizunoer(站内联系TA)自己顶!zhwj(站内联系TA)会不会是氘代试剂中含的水?huizhang(站内联系TA)你核磁用的是什么氘代试机?如果是氘水的话,肯定有水峰啊!coffeely(站内联系TA)CDCl3 (CD3)2CO (CD3)2SO C6D6 CD3CN CD3OD D2O
1.56 2.84 3.33 0.40 2.13 4.87 4.79
几种常见氘代试剂的水峰位置,参考一下跳跳(站内联系TA)你做的实验不能说明问题.
氘代试剂一般都含水,所以核磁一般都会出水峰.
单晶衍射,热重分析,应该可以吧.hanwy(站内联系TA)做个单晶衍射可以确定是否有结晶水.oclosl(站内联系TA)很可能是氘代溶剂或者核磁管带入的水峰.mizunoer(站内联系TA)谢谢各位的热心给我解答,我是用氘代氯仿的,但是这个水峰面积很大,所以我基本排除了由于外因水引起的水峰,我现在猜测是结晶水,十一过后打算去做个热失重!如果是结晶水,有什么好办法除去结晶水吗?coffeely(站内联系TA)除结晶水的几个办法:
(1)高真空加热干燥
(2)将产物溶于甲苯或者乙醇等溶剂共沸脱水(一般选取可溶解产物的溶剂)(4)将水合物和五氧化二磷分别放入培养皿中,放入干燥器中.一段时间后就自然脱水干燥了1年前查看全部
- 将固体FeC2O4•2H2O放在一个可称出质量的容器里加热,FeC2O4•2H2O首先逐步失去结晶水,温度继续升高时,F
将固体FeC2O4•2H2O放在一个可称出质量的容器里加热,FeC2O4•2H2O首先逐步失去结晶水,温度继续升高时,FeC2O4会逐渐转变为铁的氧化物:Fe3O4、Fe2O3、FeO.现称取2.00克FeC2O4•2H2O,持续加热,剩余固体的质量随温度变化的部分数据见下表:
根据上述数据计算推断:温度/℃ 25 150 300 350 400 450 500 600 700 800 固体质量/克 2.000 1.804 1.600 1.600 0.800 0.800 0.888 0.888 0.860 0.860
(1)300℃-350℃时,固体物质质量不变的原因是______;
(2)400℃-450℃内,固体物质的化学式为______;
(3)500℃-600℃内,固体物质的化学式为______;
(4)700℃-800℃内,固体物质的化学式为______. WILSON1681年前1
WILSON1681年前1 -
 xun5899 共回答了14个问题
xun5899 共回答了14个问题 |采纳率92.9%解题思路:本题在探究物质的变化规律时,运用了物质的质量守恒和元素的质量守恒法.本题主要从固体质量的变化趋势分析判断:(1)FeC2O4•2H2O→FeC2O4+2H2O 1801442.000g x=1.600g 表明:300℃时,结晶水已全部失去.在300~350℃时,FeC2O4不分解.(2)根据铁元素质量守恒,铁原子的最小公倍数是6,于是存在下列质量关系: 6FeO→3Fe2O3→2Fe3O4 72:80:77.3 固体质量的变化趋势与表中提供数据一致.即72:80:77.3≈0.800:0.888:0.860.这表明:FeC2O4分解时,先转变为FeO,再转变为Fe2O3,最后变为Fe3O4.答:(1)分析表中的数据可知,2.000g变为1.600g 时,表明:300℃时,结晶水已全部失去.故答案为:300℃时,结晶水已全部失去,在此温度范围内,FeC2O4不分解
(2)根据铁元素守恒,FeC2O4分解时,先转变为FeO和二氧化碳和一氧化碳,铁原子的最小公倍数是6,存在下列质量关系:
6FeO→3Fe2O3→2Fe3O4
6×72:3×160:2×232
72:80:77.3.
固体质量的变化趋势与表中提供的数据一致,即72:80:77.3≈0.800:0.888:0.860.
表明:FeC2O4分解时,先转变为FeO,再转变为Fe2O3,最后变为Fe3O4.
化学方程式为:FeC2O4
350℃−400℃
.
FeO+CO2↑+CO↑;4Fe+3O2
400℃−500℃
.
Fe2O3;6Fe2O3
600℃−800℃
.
4Fe3O4+O2↑;故答案为:Fe2O3
故答案为:
(1)300℃时,结晶水已全部失去,此温度范围还没到FeC2O4分解的温度;
(2)FeO;
(3)Fe2O3;
(4)Fe3O4.点评:
本题考点: 实验数据处理或者误差分析的探究.
考点点评: 本考点利用表格和物质质量守恒,主要利用了元素守恒法,通过计算了解固体物质的变化趋势,从而根据题目给出的信息解决有关问题,本题难度较大,须认真分析,综合掌握 应答结果.1年前查看全部
- 硫酸铜晶体干燥后质量不变?不是会失去结晶水么?
 roger_san1年前1
roger_san1年前1 -
 大老鸟 共回答了15个问题
大老鸟 共回答了15个问题 |采纳率86.7%硫酸铜晶体干燥后,只剩下CuSO4'H2O晶体,所以已后的干燥重量不会减少,除非用加热干燥法,否则M不会减少.1年前查看全部
- 请问:铁红的化学式要写结晶水吗?
 难得糊涂09151年前2
难得糊涂09151年前2 -
 南柯梦狼 共回答了15个问题
南柯梦狼 共回答了15个问题 |采纳率86.7%氧化铁通常指三氧化二铁,化学式Fe2O3,分子量159.69,棕红色粉末,俗称铁红.密度5.24g/cm3,熔点1565℃.不溶于水,不与水反应.跟酸反应,生成铁盐.在高温下可被氢气、一氧化碳等还原成铁.用作颜料、抛光剂、催化剂等.灼烧硫酸亚铁或氢氧化铁制得.1年前查看全部
- 50克镁.锌.铝的混合物与适量的稀硫酸反应,得三种盐的混合溶液,然后加热.蒸发.结晶得晶体(不含结晶水)218克,则反应
50克镁.锌.铝的混合物与适量的稀硫酸反应,得三种盐的混合溶液,然后加热.蒸发.结晶得晶体(不含结晶水)218克,则反应中得氢气的质量为,急
 来点竟121年前4
来点竟121年前4 -
 Kotao_78 共回答了21个问题
Kotao_78 共回答了21个问题 |采纳率90.5%晶体中的质量除了Mg,Al,Zn外全部都是SO4,所以有218-50=168g硫酸根
而对于H2SO4,氢气质量与硫酸根质量的比值是2:96
所以氢气质量为2X168/96=3.5g1年前查看全部
- 强热绿矾晶体,除结晶水蒸发外,还发生如下化学反应:2FeSO4 △ . Fe2O3+SO2
强热绿矾晶体,除结晶水蒸发外,还发生如下化学反应:2FeSO4
Fe2O3+SO2↑+SO3↑.如果将生成的气体通入浓BaCl2溶液中,产生的现象是( )△ .
A. 生成确BaSO4和BaSO3混合沉淀
B. 生成BaSO4沉淀,有SO2气体逸出
C. 生成BaSO4沉淀,有SO3气体逸出
D. 有SO2和SO3两种气体同时逸出 jannia1年前3
jannia1年前3 -
 ghost13 共回答了19个问题
ghost13 共回答了19个问题 |采纳率89.5%解题思路:混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,注意H2SO3酸性小于HCl.混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,则没有SO3逸出;
H2SO4+BaCl2=BaSO4↓+2HCl,则有BaSO4沉淀生成;
由于H2SO3酸性小于HCl和H2SO4,则SO2不能与BaCl2溶液反应而从溶液中逸出,故得不到BaSO3沉淀;
所以产生的现象是生成BaSO4沉淀,有SO2气体逸出.
故选B.点评:
本题考点: 含硫物质的性质及综合应用.
考点点评: 本题考查二氧化硫的性质,题目难度中等,本题注意SO3和SO2性质的区别,注意H2SO3酸性小于HCl和H2SO4,则不能与BaCl2溶液反应,得不到BaSO3沉淀.1年前查看全部
- 试用杂化轨道理论说明硫酸根离子的空间构型.硫酸盐的结晶水数目经常是5或7,其中4或6被认为是阳离子结晶水,它们以配位键与
试用杂化轨道理论说明硫酸根离子的空间构型.硫酸盐的结晶水数目经常是5或7,其中4或6被认为是阳离子结晶水,它们以配位键与阳离子结合,另外一个结晶水被认为是阴离子结晶水,它与硫酸根离子以氢键相结合.试画出阴离子结晶水与硫酸根离子结合的示意图.
 稻草茂1年前1
稻草茂1年前1 -
 王金宝 共回答了23个问题
王金宝 共回答了23个问题 |采纳率91.3%SO42-的中心原子S外层有6个电子,4个O按照VSEPR理论是不提供电子的,因此共有(6+2)/2=4个电子对,为sp3杂化,正四面体构型.
O^^^O…H
^^/^^^^
^^S^^^^^^O
^/^^^^^/
O^^^O…H1年前查看全部
- 加热2.86克结晶碳酸钠(Naco3.xH2O),除去结晶水后,剩余粉末质量1.06克,则X的值为?
 抑郁的螃蟹1年前3
抑郁的螃蟹1年前3 -
 爱在没理由 共回答了15个问题
爱在没理由 共回答了15个问题 |采纳率93.3%Na2CO3.xH2O==Na2CO3+XH2O``
106+18x```````106````18x
2.86``````````1.06````
(106+18x)/106==2.86/1.06
x=101年前查看全部
- 如图是a、b两种固体物质(不含结晶水)的溶解度曲线下列说法正确的是( )
如图是a、b两种固体物质(不含结晶水)的溶解度曲线下列说法正确的是( )
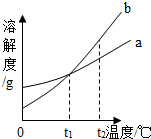 A. b的溶解度大于a的溶解度
A. b的溶解度大于a的溶解度
B. t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C. 将t2℃时的b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液
D. t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数 小冬瓜_1年前1
小冬瓜_1年前1 -
 isyangyangja 共回答了21个问题
isyangyangja 共回答了21个问题 |采纳率85.7%解题思路:A、根据溶解度曲线可以比较相同温度时(或一定温度范围内)不同物质溶解度的大小,利用图示的曲线,比较a、b两物质的溶解度大小;
B、t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体多少取决于此时溶解度的大小;
C、根据溶解度随温度变化只能判断饱和溶液的变化情况,对于不饱和溶液无法进行判断;
D、相同温度下,溶解度大的物质的饱和溶液的溶质质量分数也大,对于不饱和溶液则无此关系.A、0℃~t1℃时,a物质的溶解度大于b;在t1℃时两物质的溶解度相等;而温度高于t1℃时,b物质的溶解度又大于a.故A不正确;
B、t1℃时两物质的溶解度相等,此时将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量也相等,故B正确;
C、虽然b物质的溶解度随温度降低而减小,但却不能判断将t2℃时的b的不饱和溶液降温至t1℃,所得溶液是否饱和;故C不正确;
D、t2℃时,b物质的溶解度又大于a,可判断此时b的饱和溶液的溶质质量分数一定大于a的饱和溶液;由于该说法中没有指明是饱和溶液,故D不正确;
故选B.点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用;饱和溶液和不饱和溶液相互转变的方法;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况,可以比较在一定温度范围内的物质的溶解度大小,可以判断某温度下物质的溶解度.1年前查看全部
- 晶体有没有 结晶水就是我们做溶解度题的时候问析出nano3晶体多少,
 tany1381681年前5
tany1381681年前5 -
 百凌沙 共回答了13个问题
百凌沙 共回答了13个问题 |采纳率76.9%要视情况而定,我们说的金属单质就是晶体,很明显是不带结晶水的.另外你说的那是硝酸钠吧,它和氯化钠是一样的,是不带结晶水的.
你说的做题的时候,这个不用担心,只要题目中没有给你说这个化合物析出的时候带有结晶水,你就不用考虑.
我只是给你大致说一下,晶体可以分为四种:原子晶体,分子晶体,离子晶体,金属晶体.具体的各晶体类型的特点你可以看看高中的化学书,我记得那上面有,要不就在网上查查,1年前查看全部
- 探究水化物中的水分子个数这个实验,它的误差原因是:加热不完全,没有加热至恒重时再测量,导致测定结晶水含量偏少.冷却时没有
探究水化物中的水分子个数
这个实验,它的误差原因是:加热不完全,没有加热至恒重时再测量,导致测定结晶水含量偏少.
冷却时没有在干燥器中,导致晶体吸收水蒸气,测得的结晶水含量偏少.
加热过度,使不含结晶水的盐分解,导致测定结晶水含量偏大.
原来的晶体中有加热不分解的杂质,导致测定结晶水偏小.
我想问的是:有没有改进的地方? bajie9991年前1
bajie9991年前1 -
 云衣山襟月光杯 共回答了20个问题
云衣山襟月光杯 共回答了20个问题 |采纳率85%还有反应前反应物要研磨,使分解完全1年前查看全部
- 关于冷却结晶适用的物质请问冷却结晶这一方法适用于那些物质?为什么说易水解的物质(如氯化铁)、带结晶水的物质(如五水硫酸铜
关于冷却结晶适用的物质
请问冷却结晶这一方法适用于那些物质?
为什么说易水解的物质(如氯化铁)、带结晶水的物质(如五水硫酸铜)要用冷却结晶法? AADABHB1年前1
AADABHB1年前1 -
 千黛飘雪 共回答了15个问题
千黛飘雪 共回答了15个问题 |采纳率73.3%冷却结晶适用于一些在高温时不稳定的物质的结晶,包括易水解和带结晶水的
氯化铁在高温时水解加剧,加热浓缩极易得到氢氧化铁;五水硫酸铜如果加热浓缩容易失去结晶水变成无水硫酸铜1年前查看全部
- 【求助】含水化合物和带结晶水的化合物是一个概念吗?
 nhlxh11221年前1
nhlxh11221年前1 -
 hl_711 共回答了11个问题
hl_711 共回答了11个问题 |采纳率81.8%nnnas(站内联系TA)含水化合物包括吸附水(湿存水)和结晶水等,只要是水都算jie静水流深(站内联系TA)路过,c3e4d5(站内联系TA)不是一个概念塔尔寺(站内联系TA)含水化合物的水有很多形式,如:结构水、结晶水、沸石水、层间水等firefox1981(站内联系TA)当然不是一个概念了.结晶水可以看成是分子结构上的,是微观的,含水化合物是宏观的.ytzhang168(站内联系TA)与化合物共存的水包括表面水和结晶水.含有表面水德化合物属于混合物,而含有结晶水德化合物属于纯净物,两者的概念有质的区别.1年前查看全部
- 带结晶水物质的化学式怎么写例如:胆矾的主要成分是五水硫酸铜,化学式是写CuSO4还是CuSO4·5H2O呢?
 dffcu1年前3
dffcu1年前3 -
 苍穹星伴月 共回答了18个问题
苍穹星伴月 共回答了18个问题 |采纳率100%后者.1年前查看全部
- 1.72g生石膏(caso4.2h2o)转化为熟石膏(2caso4.h20)失去的结晶水数目为0.015NA
 lsslhl1年前1
lsslhl1年前1 -
 zlygkbaby 共回答了22个问题
zlygkbaby 共回答了22个问题 |采纳率90.9%1.72/(40+96+36)=1.72/172=0.01mol
2caso4.2h2o==2caso4.h20+3h2o
2 3
失去的结晶水数目=0.01*3/2=0.015NA
答案是对的!1年前查看全部
- 20T时有100g20%的A物质溶液,恒温蒸发掉20g水,析出5gA晶体(无结晶水)则A物质在20T是的溶解度. 要过程
 9号198204051年前2
9号198204051年前2 -
 分给我烟抽的兄弟 共回答了25个问题
分给我烟抽的兄弟 共回答了25个问题 |采纳率88%设A物质在20T是的溶解度为X100g20%的A物质溶液中含A的质量=100g*20%=20g100g20%的A物质溶液中含水的质量=100g-20g=80g恒温蒸发掉20g水后剩余溶液中含水的质量=80g-20g=60g剩余溶液中含A的质量=20g-5g=15g根据析出晶...1年前查看全部
- 过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO.
过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO.
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:2CaO2•XH2O →△ 2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 .
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g.
① 试计算样品中CaO的质量.② 试计算样品中CaO2•XH2O的X值
可以简单的认为 两组份的 cao2的mol数都是6乘以10^-3嘛?
因此由CaO2生成的CaCO3的物质的量为0.006mol.
因此由CaO生成的CaCO3的物质的量为0.007-0.006=0.001mol
怎么出来的 Smiling_angel1年前3
Smiling_angel1年前3 -
 浅浅0122 共回答了20个问题
浅浅0122 共回答了20个问题 |采纳率90%1.O2在标准状况下体积为67.2ml,也就是67.2/1000=0.0672L,换算成物质的量为0.0672/22.4=0.003mol.反应方程式可以看作是:
2CaO2→△ 2CaO + O2↑
2 1
x 0.003
因此x=0.006mol,CaO2的物质的量为0.006mol.
2.加入HCl发生如下反应:
2CaO2 + 4HCl = 2CaCl2 + 2H2O + O2 …… 2CaCO3
CaO + 2HCl = CaCl2 + H2O ……CaCO3
从上面可以看到,生成的CaCO3来源有两部分,分别是从CaO2和CaO生成.
生成的CaCO3的物质的量为0.70/100=0.007mol.
从(1)的结果可以得到CaO2的物质的量,而根据钙原子守恒,可以知道关系2CaO2 - 2CaCl2 - 2CaCO3,因此由CaO2生成的CaCO3的物质的量为0.006mol.
因此由CaO生成的CaCO3的物质的量为0.007-0.006=0.001mol.
根据钙原子守恒有关系 CaO - CaCO3 ,因此CaO也是0.001mol,即0.001*56=0.056g.
现在我们知道了0.542g样品中有0.006molCaO2和0.056gCaO,剩下的质量就是结晶水了,所以结晶水的质量为0.542-0.006*72-0.056=0.054g,即0.054/18=0.003mol.
也就是说H2O与CaO2的物质的量之比为0.006:0.003=2:1,因此X的值为0.51年前查看全部
- 哪些碱性物质含有结晶水?
 kingtzz1年前2
kingtzz1年前2 -
 泡泡蜜 共回答了19个问题
泡泡蜜 共回答了19个问题 |采纳率84.2%几乎所有的都含.碱性就会伴随一定的潮解性质.当然,还是要看具体的化学式了,结晶水可以用很多方法除去的1年前查看全部
- (2014•江宁区一模)如图是甲乙两种固体(均不含结晶水)的溶解度曲线,下列说法中正确的是( )
(2014•江宁区一模)如图是甲乙两种固体(均不含结晶水)的溶解度曲线,下列说法中正确的是( )

A.甲的溶解度小于乙的溶解度
B.t1℃时,50g水中最多溶解15g甲
C.t2℃时乙的饱和溶液降温至t1℃变为不饱和溶液
D.将t1℃时甲的饱和溶液升温至t2℃,溶质的质量分数增大 lc19841年前1
lc19841年前1 -
 malizhao 共回答了22个问题
malizhao 共回答了22个问题 |采纳率81.8%解题思路:A、比较溶解度大小须确定温度;
B、据该温度下甲的溶解度分析解答;
C、乙的溶解度随温度降低而减小,据此分析解答;
D、据甲的溶解度随温度变化分析解答.A、比较溶解度大小须确定温度,故错误;
B、t1℃时甲的溶解度是30g,即100g水中最多溶解30g的甲,所以50g水中最多溶解15g甲,正确;
C、乙的溶解度随温度降低而减小,所以将t2℃时乙的饱和溶液降温至t1℃溶解度减小,依然是饱和溶液,故错误;
D、甲的溶解度随温度升高而增大,所以将t1℃时甲的饱和溶液升温至t2℃,溶解度变大,溶质、溶剂的质量不变,所以溶质的质量分数不变,故错误;
故选:B.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
考点点评: 本题难度不大,了解溶解度概念、并能据溶解度随温度变化分析溶液状态、溶质的质量分数变化.1年前查看全部
- 下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是( )
下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是( )

A.t2℃时,在两个各盛有l00g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,所得甲、乙溶液中溶质的质量不等 B.t1℃时,等质量甲、乙溶液中所含溶剂的质量甲等于乙 C.乙中含有少量甲,可以用冷却热饱和溶液的方法提纯甲 D.t2℃时.将甲、乙饱和溶液降温至tl℃,甲溶液析出晶体的质量大于乙  心如小志1年前1
心如小志1年前1 -
 雪候小鸟 共回答了14个问题
雪候小鸟 共回答了14个问题 |采纳率85.7%A
1年前查看全部
- (2014•道外区三模)如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线.据此判断以下叙述正确的是( )
(2014•道外区三模)如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线.据此判断以下叙述正确的是( )

A.30℃时,将30克甲固体加入到60克水中得到甲的饱和溶液
B.将20℃时甲乙的饱和溶液分别升温到30℃,质量分数都变大
C.要从乙的饱和溶液中得到乙,可以采用蒸发溶剂的方法
D.20℃时,甲、乙两种物质的饱和溶液中含溶质的质量相等 心梦百合子1年前1
心梦百合子1年前1 -
 ヤ随鈊鎖欲 共回答了13个问题
ヤ随鈊鎖欲 共回答了13个问题 |采纳率84.6%解题思路:根据题目信息和溶解度曲线可知:30℃时,甲的溶解度是60g,因此将30克甲固体加入到50克水中得到甲的饱和溶液,不是60g水;将20℃时甲乙的饱和溶液分别升温到30℃,甲和乙都变为不饱和溶液,质量分数都不变,不是变大;要从乙的饱和溶液中得到乙,可以采用蒸发溶剂的方法,因为乙的溶解度受温度的影响变化不大;20℃时,相等质量的甲、乙两种物质的饱和溶液中含溶质的质量相等,必须是等质量的溶液才可以.A、30℃时,甲的溶解度是60g,因此将30克甲固体加入到50克水中得到甲的饱和溶液,不是60g水,故选项错误;
B、将20℃时甲乙的饱和溶液分别升温到30℃,甲和乙都变为不饱和溶液,质量分数都不变,不是变大,故选项错误;
C、要从乙的饱和溶液中得到乙,可以采用蒸发溶剂的方法,因为乙的溶解度受温度的影响变化不大,故选项正确;
D、20℃时,相等质量的甲、乙两种物质的饱和溶液中含溶质的质量相等,必须是等质量的溶液才可以,故选项错误;
故选C点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用.
考点点评: 本考点考查了溶解度曲线及其应用、结晶的原理、方法等,通过溶解度曲线我们可以获得很多信息,要加强记忆,理解应用,本考点主要出现在选择题和填空题中.1年前查看全部
- 结晶水合物化学式A·nH2O.A的式量为M 将a g化合物加热到结晶水全部失去.剩下b g 求n```要过程
 cwg8871年前2
cwg8871年前2 -
 只支持飞轮海 共回答了7个问题
只支持飞轮海 共回答了7个问题 |采纳率85.7%结晶水合物的式量为M+18n
a/(M+18n)=b/M
解得n=(aM/b-M)/18=M(a-b)/181年前查看全部
- (2008•浦东新区二模)如图是A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线
(2008•浦东新区二模)如图是A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,现将20gA和40gB分别置于100g水中,加热使其完全溶解,然后再冷却到t℃,下列有关叙述中正确的是( )

A.t℃时,A溶液的质量百分比浓度(溶质质量分数)小于B
B.t℃时,A、B溶液均达到饱和状态
C.t℃时,A、B溶液中均无固体物质析出
D.t℃时,A物质的溶解度小于B adang14971年前1
adang14971年前1 -
 单行道上的色盲 共回答了25个问题
单行道上的色盲 共回答了25个问题 |采纳率88%解题思路:A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,t℃时,A、B两种物质的饱和溶液的质量百分比浓度(溶质质量分数)相等,均为20%,由饱和溶液中溶质的质量分数=
×100%,计算出t℃时的溶解度;据此结合选项进行分析判断.溶解度 溶解度+100g t℃时,A、B两种物质的饱和溶液的质量百分比浓度(溶质质量分数)相等,均为20%,由饱和溶液中溶质的质量分数=
溶解度
溶解度+100g×100%,设t℃时,A、B两种物质的溶解度为S,则
S
S+100g×100%=20%,S=25g;将20gA和40gB分别置于100g水中,加热使其完全溶解,然后再冷却到t℃,A为不饱和溶液,B有晶体析出,为饱和溶液.
A、t℃时,A、B两种物质的溶解度均为25g,则t℃时,100g水中溶解20gA,能溶解25gB,则A溶液的质量百分比浓度(溶质质量分数)小于B,故选项说法正确.
B、t℃时,A溶液未达到饱和状态,B溶液达到饱和状态,故选项说法错误.
C、t℃时,A溶液中无固体物质析出,B溶液中有固体物质析出,故选项说法错误.
D、t℃时,A物质的溶解度等于B,故选项说法错误.
故选A.点评:
本题考点: 固体溶解度曲线及其作用.
考点点评: 本题难度不大,主要考查了A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,通过本题可以培养学生应用知识解决问题的能力.1年前查看全部
- 13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子
13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子量为( )
A. 23
B. 27
C. 40
D. 56 好好点1年前4
好好点1年前4 -
 inb3tv 共回答了25个问题
inb3tv 共回答了25个问题 |采纳率84%解题思路:13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,则水的质量为13.9g-7.6g=6.3g,利用组成中的质量可知,XSO4与水的物质的量之比为1:n,以此来计算解答.13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,则水的质量为13.9g-7.6g=6.3g,
若X的原子量为结晶水分子数的8倍,
XSO4与水的物质的量之比为1:n,
则
7.6g
n×8+96:
6.3
18=1:n,
解得n=7,
则X的相对原子质量为7×8=56,
故选D.点评:
本题考点: 相对原子质量及其计算.
考点点评: 本题考查相对原子质量的计算,明确定组成是解答本题的关键,题目难度不大,但计算较繁琐.1年前查看全部
- (2014•沛县一模)如图是甲物质(不含结晶水)的溶解度曲线.下列结论中,错误的是( )
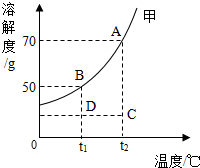 (2014•沛县一模)如图是甲物质(不含结晶水)的溶解度曲线.下列结论中,错误的是( )
(2014•沛县一模)如图是甲物质(不含结晶水)的溶解度曲线.下列结论中,错误的是( )
A.在t1℃时,将56g甲物质放入100g水中,搅拌,充分溶解后形成的溶液溶质质量分数为33.3%
B.点A描述的是t2℃时甲物质的饱和溶液
C.若不考虑水分的损失,将170gt2℃时的饱和溶液降温至t1℃能析出晶体20g
D.A、B、C、D四个点所代表的四种甲物质的溶液中,溶质的质量分数的大小关系是A=C>B=D kittyshen1年前1
kittyshen1年前1 -
 彩色的vvNIKI 共回答了23个问题
彩色的vvNIKI 共回答了23个问题 |采纳率82.6%解题思路:A、借助溶解度曲线,判断所得溶液的性质再进一步计算;
B、据溶解度曲线可解答;
C、据溶解度曲线的意义及作用解答;
D、据溶解度曲线的及其作用,溶液的质量分数的计算解此题.A、由溶解度曲线可知,t1℃时甲物质的溶解度为50g,即100g水中达饱和时溶解50g甲物质,
所以在t1℃时,将56g甲物质放入100g水中,搅拌,充分溶解,只能溶解50g,可得到溶液150g,质量分数D×100%=33.3%,故A正确;
B、据溶解度曲线,及溶解度的概念知,点A描述的是t2℃时甲物质的饱和溶液,故B正确;
C、据溶解度曲线知,t2℃时甲物质的溶解度为70克,即100g水中溶有70g甲,其溶液的质量为170g,由此可知,此溶液中水为100g,t1℃时,该物质的溶解度为50g,故若不考虑水分的损失,将170gt2℃时的饱和溶液降温至t1℃能析出晶体20g,故C正确;
D、A点是t2℃时甲的饱和溶液,B点是t1℃时甲的饱和溶液,由于甲的溶解度随着温度的升高而增大,故A点的溶解度大于B点的溶解度,A的溶质的质量分数大于B的溶质的质量分数;C、D分别为t2℃时、t1℃时甲的不饱和溶液,由于溶质的质量相等,故溶液中溶质的质量分数相等;故溶质质量分数大小关系为A>B>D=C,故错误.
故选D.点评:
本题考点: 固体溶解度曲线及其作用;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 本题主要考查了固体溶解度曲线的意义及综合运用,考查学生运用溶解度随温度变化规律分析问题的能力.1年前查看全部
- 将2.86gNA2CO3·XH2O加热,使它失去全部结晶水,这时固体物质的质量是1.06g,求1mol此结晶水合物中所含
将2.86gNA2CO3·XH2O加热,使它失去全部结晶水,这时固体物质的质量是1.06g,求1mol此结晶水合物中所含结晶水的物质的量.
标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0G,试计算此混合气体中H2和CO的质量和体积各为多少. bohwmo1年前4
bohwmo1年前4 -
 bingru72 共回答了17个问题
bingru72 共回答了17个问题 |采纳率94.1%问题1
无水Na2CO3的式量是106.2.86gNA2CO3·XH2O失去全部结晶水后,就应该为无水Na2CO3,式量是106,质量为10.6g,即为0.01mol.
2.86 - 1.06 = 1.80g,这是失去的结晶水的质量,为0.1mol
0.01mol的碳酸钠含有0.1mol的水,那么1mol则含有10mol的结晶水.
问题2
标准状况下,22.4L气体的物质的量是1mol(阿佛基德罗定律).那么8.96L气体就应含有0.4mol的气体.
设H2有X mol ,CO有Y mol
X + Y = 0.4 (1)
2X + 28Y = 6.0 (2)
解得
H2有0.2mol,即0.4g ,4.48L
CO有0.2mol,即5.6g ,4.48L1年前查看全部
- 五水硫酸铜加热至45℃时失去二分子结晶水后市什么颜色?
 碎玻璃20001年前4
碎玻璃20001年前4 -
 lyb197345 共回答了14个问题
lyb197345 共回答了14个问题 |采纳率78.6%五水硫酸铜在常温常压下很稳定,不潮解,在干燥空气中会逐渐风化,加热至45℃时失去二分子结晶水,此时为浅蓝色,110℃时失去四分子结晶水,此时为蓝白色,150℃时失去全部结晶水而成无水物,此时颜色为白色.无水物也易吸水转变为五水硫酸铜.常利用这一特性来检验某些液态有机物中是否含有微量水分.将五水硫酸铜加热至650℃高温,可分解为黑色氧化铜、二氧化硫及氧气.
绝对正确,1年前查看全部
- 高中化学关于溶液的计算盐溶于水后,会有一部分盐和水结合,而带有结晶水吗?结晶水的质量算进溶剂里吗?
 昱昊炅昊1年前1
昱昊炅昊1年前1 -
 whitecloudno1 共回答了18个问题
whitecloudno1 共回答了18个问题 |采纳率83.3%如果加入的量超过溶解度,有可见盐粒在底部,应将这部分的质量排除在外.溶液质量等于水质量加上溶解的盐的质量.此时未溶盐质量一定,但粒子不断运动.
如果全部溶解,就不存在盐和水结合的现象.1年前查看全部
大家在问
- 1常温下,1molFe放入足量的浓硫酸中转移的电子数为3Na
- 2关于向心力的一道题.麻烦能详细说下步骤 谢谢
- 3《得道多助,失道寡助》中最能体现“人和”的一句话是什么?
- 4此公以其尝试者告人,意思
- 5这是什么昆虫-蜂?这是什么昆虫-蜂类?长约4厘米,宽约1.5厘米,翅膀反光,呈现绿金色,全身黑色,头\触角和螳螂\黄蜂一
- 6下列反应属于氧化还原反应的是( ) A.CaCO 3 +2HCl====CaCl 2 +H 2 O
- 7高等代数,线性代数,求大神2、3、4小题!
- 8请帮我翻译:海星看起来就想是星星.它的颜色很鲜艳.它生活在海洋里.它喜欢跟海水去旅行.
- 9如果你有两块面包,你要用一块去换心中的水仙花,用这句名言自选角度,写作文.怎么写?
- 10东经131 北纬44是哪
- 11下面的诗句把什么比作什么1.忽如一夜春风来,千树万树梨花开.2.欲把西湖比西子,淡妆浓抹总相宜.3.谁言寸草心,报得三春
- 12你能为我画一张画吗?英文,两种说法
- 13解方程 4(x-2)=x+1 怎么解? 要过程!
- 14这两件衣服在一起搭配很好的英文
- 15英语翻译齐使者如梁,孙膑以刑徒阴见。(《孙膑》)果予以未时还家,而汝以称时气绝。(《祭妹文》)
