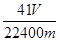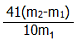氮化铝(A1N)具有耐高温、抗冲击、导热性好等优良性质,能在许多工业领域被应用.工业将氧化铝、氮气和碳在一定条件下反应制
 老王啊我是你干cc2022-10-04 11:39:541条回答
老王啊我是你干cc2022-10-04 11:39:541条回答(1)氮化铝陶瓷属于 ______.(填字母A.金属材料B.无机非金属材料)
(2)制A1N的化学反应方程式 ______.
(3)铝、氧在地壳中的含量居所有元素的第 ______位和 ______位.铝元素摄人过多对人体有害,请给大家提一条减少生活中铝元素摄入的合理化建议 ______.

已提交,审核后显示!提交回复
共1条回复
 emily_xu 共回答了20个问题
emily_xu 共回答了20个问题 |采纳率95%- 解题思路:(1)根据氮化铝陶瓷可断定其不属于金属材料,进行解答;
(2)根据氧化铝、氮气和碳在一定条件下反应制得A1N和CO,写出化学方程式,注意:写,配,等,标;
(3)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,进行解答;
结合生活中饮食和生活习惯进行解答本题.(1)根据氮化铝陶瓷可断定其不属于金属材料,所以氮化铝陶瓷属于无机非金属材料;故选B;
(2)根据氧化铝、氮气和碳在一定条件下反应制得A1N和CO,化学方程式为:Al2O3+N2+3C═2AlN+3CO;
故答案为:Al2O3+N2+3C═2AlN+3CO;
(3)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,铝、氧在地壳中的含量居所有元素的第3位和第1位;
结合生活中饮食和生活习惯,减少生活中铝元素摄入:少吃用明矾加工的食品;少用铝制容器装食品;或少使用明矾(十二水合硫酸铝钾)净水;少用铝制炊具等;
故答案为:三;一(或3,1);少吃用明矾加工的食品;少用铝制容器装食品;或少使用明矾(十二水合硫酸铝钾)净水;少用铝制炊具等.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;常见的金属和非金属的区分;金属材料及其应用;地壳中元素的分布与含量;常见中毒途径及预防方法.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力. - 1年前
相关推荐
- 氮化铝(AlN)是一种新型无机材料。某氮化铝(AlN)仅含有Al 2 O 3 杂质,某学习小组为测定该氮化铝样品中AlN
氮化铝(AlN)是一种新型无机材料。某氮化铝(AlN)仅含有Al 2 O 3 杂质,某学习小组为测定该氮化铝样品中AlN的纯度,查阅资料得知:AlN + NaOH + 3H 2 O = Na[Al(OH) 4 ] + NH 3 ↑。设计如下2种方案。
方案一:量气法——如图所示。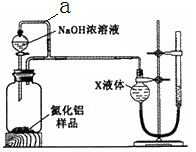
(1)按图连接好装置,检查装置气密性的方法是 。
(2) 导管a的主要作用是 。
(3)为测定生成气体的体积,量气装置中的X液体可以是: 。(填标号)
(4)若取m g样品与NaOH浓溶液完全反应后,测得生成气体的体积为V mL(标准状况)。则样品中AlN的纯度为___________。A.CCl 4 B.H 2 O C.NH 4 Cl溶液 D.植物油
方案二:重量法——如下图所示。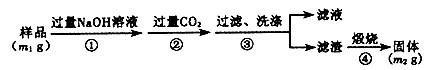
(5) 步骤①中,氧化铝与氢氧化钠溶液反应的离子方程式为_______________。
(6) 样品中AlN的纯度为___________。
(7) 若测得样品中AlN的纯度偏高,可能的原因是___________。(写1点) 西洋娃娃太岁1年前1
西洋娃娃太岁1年前1 -
 Jasonhxf780207 共回答了10个问题
Jasonhxf780207 共回答了10个问题 |采纳率100%1年前查看全部
- (5)反应结束后,某同学用右图装置进行实验来测定氮化铝样 品的质量分数(实验中导管体积忽略不计).已知:氮化铝
(5)反应结束后,某同学用右图装置进行实验来测定氮化铝样 品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气.
①广口瓶中的试剂X最好选用c(填写序号a.汽油b.酒精c.植物油d.CCl4). 【请问此处为什么选植物油 汽油不行吗】
 bottomwang1年前1
bottomwang1年前1 -
 a一点正经没有a 共回答了13个问题
a一点正经没有a 共回答了13个问题 |采纳率76.9%因为汽油易挥发,挥发上来的汽油蒸气会占一定的体积,而影响到氨气体积的测定.1年前查看全部
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成  下列有关该反应的叙述不正确的是[ ]
下列有关该反应的叙述不正确的是[ ]A.氮化铝中氮元素的化合价为-3
B.上述反应中每生成 ,N 2 得到3mol电子
,N 2 得到3mol电子
C.在氮化铝的合成反应中,N 2 是氧化剂,Al 2 O 3 是还原剂
D.该反应不属于四种基本反应类型中任一种 错着1年前1
错着1年前1 -
 beyondblanco 共回答了19个问题
beyondblanco 共回答了19个问题 |采纳率73.7%B1年前查看全部
- 氮化铝(AIN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如
氮化铝(AIN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al 2 O 3 +N 2 +3C  2AlN+3CO。下列叙述正确的是[ ]
2AlN+3CO。下列叙述正确的是[ ]A.在氮化铝的合成反应中,N 2 是还原剂,Al 2 O 3 是氧化剂
B.上述反应中每生成2 molAlN,N 2 就得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体 liceice1年前1
liceice1年前1 -
 贵机 共回答了19个问题
贵机 共回答了19个问题 |采纳率84.2%C1年前查看全部
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al 2 O 3 +N 2 +3C  2AlN+3CO,下列叙述正确的是[ ]
2AlN+3CO,下列叙述正确的是[ ]A.在氮化铝的合成反应中,N 2 是还原剂,Al 2 O 3 是氧化剂
B.上述反应中每生成2 molAlN,N 2 得到3mol电子
C.氮化铝中氮元素的化合价为-3价
D.氮化铝晶体既是氧化剂又是还原剂 剪轻萝1年前1
剪轻萝1年前1 -
 ljntim 共回答了12个问题
ljntim 共回答了12个问题 |采纳率100%C1年前查看全部
- 氮化铝(AlN)是一种新型无机材料,广泛应用与集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ中的一些装置来进行
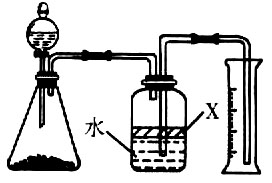
氮化铝(AlN)是一种新型无机材料,广泛应用与集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H 2 O=NaAlO 2 +NH 3 ↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计). 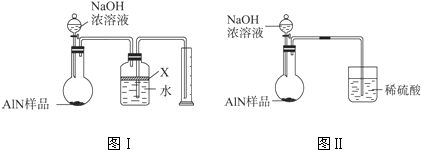
(1)实验有关操作为:a、往烧瓶中放入适量的AlN样品;b、从分液漏斗往烧瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为______.
(2)本试验中检查装置气密性的方法是______.
(3)广口瓶中的试剂X可选用______(填选项的标号).
A.浓氢氧化钠溶液 B.酒精 C.植物油 D.CCl 4
(4)广口瓶中液体未装满,测得NH 3 的体积将______(填“偏大”、“偏小”或“无影响”).
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是______.
(6)若样品的质量为wg,氨气的体积为aL(标准状况),AlN的质量分数为______. nancyliang1年前1
nancyliang1年前1 -
 天使儿也一样 共回答了20个问题
天使儿也一样 共回答了20个问题 |采纳率100%(1)应先进行装置气密性检验,然后依次加入固体药品、液体药品,最后进行气体排出水的测量,确定产生气体体积;
故答案为:c、a、b、d;
(2)通过微热或用手握热使装置内气体使气体体积变大,如果装置漏气则不会观察到装置内有明显变化;如果气密性良好,广口瓶中右侧导管水柱上升,松手后水柱回落;
故答案为:关闭分液漏斗活塞,用水紧握握热锥形瓶,广口瓶中右侧导管水柱上升,松手后水柱回落,证明气密性好;
(3)浓氢氧化钠溶液与水互溶,不能起到隔离作用.酒精易挥发,挥发出来的气体对实验有影响,同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用.而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离;
故答案为:C;
(4)本次实验的目的在于测定产生气体的体积而不是收集纯净的气体,因此,广口瓶内的原有气体不在测量内,不会对测量结果产生影响;
故答案为:无影响;
(5)氮化铝中含有碳或氧化铝杂质,氧化铝易溶于NaOH溶液,而实验结束后,若观察到锥形瓶中还有固体,说明固体不溶于氢氧化钠溶液,所以杂质是碳;
故答案为:碳、
(6)氨气的体积为aL(标况下)的物质的量为
aL
22.4L/mol =
a
22.4 mol,由方程式AlN+NaOH+H 2 O=NaAlO 2 +NH 3 ↑可知,样品中AlN的物质的量为=
a
22.4 mol,所以AlN的质量为
a
22.4 mol×41g/mol=
41a
22.4 g,样品中AIN的质量分数为
41a
22.4 g
wg ×100%=
4100a
22.4w %.
故答案为:
4100a
22.4w %.1年前查看全部
- (2008•长春一模)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一
(2008•长春一模)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C
2AlN+3CO.下列叙述正确的是( )高温 .
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体 yumi44571年前1
yumi44571年前1 -
 莫能助 共回答了10个问题
莫能助 共回答了10个问题 |采纳率90%解题思路:在一定条件下,合成氮化铝的反应为Al2O3+N2+3C
2AlN+3CO.反应中氮、碳元素化合价变化,Al、O元素的化合价不变,AlN中N的化合价为-3价.高温 .A.根据氧化还原反应的规律:(还原剂)升(化合价升高) 失(失去电子) 氧(发生氧化反应);(氧化剂)降(化合价降低) 得(得到电子) 还(发生还原反应)若说剂正相反.可以分析出,在氮化铝的合成反应中,N2的化合价由0→-3,发生改变,N2是氧化剂;Al2O3 中Al、O元素的化合价不变,既不是氧化剂也不是还原剂.故A错误;
B.在氮化铝的合成反应中,N2的化合价由0→-3,每生成2 mol AlN,N2得到的电子是3×2=6mol电子.故B错误;
C.氮化铝中Al的化合价为+3价,氮元素的化合价为-3价.故C正确;
D.氮化铝晶体是由Al3+和N3-构成的离子化合物.故D错误;
故选C.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算;晶体的类型与物质熔点、硬度、导电性等的关系.
考点点评: 本题考查了对氧化还原反应的理解、晶体类型的判断.氧化还原反应注意反应方程式中各元素前后化合价的变化,晶体类型判断应注意组成晶体的元素.1年前查看全部
- 氮化铝具有耐高温,抗冲击,导电性好等优良品质,广泛应用于电子产业,陶瓷工业等领域.在一定的条件下,
氮化铝具有耐高温,抗冲击,导电性好等优良品质,广泛应用于电子产业,陶瓷工业等领域.在一定的条件下,
氮化铝可通过如下反应制备;Al2O3+N2在一定条件下=2AlN+3CO
若要取得164kg的氮化铝,则需要参加反应的氧化铝的质量为多少 半个脚印lu1年前1
半个脚印lu1年前1 -
 小小猪2004 共回答了18个问题
小小猪2004 共回答了18个问题 |采纳率88.9%设需要氧化铝质量为X
Al2O3+N2=在一定条件下=2AlN+3CO
102 82
X 164克
X=204克
亲,有其他题目请另外发问,此问题有疑问,以上都是本人自己纯手工做的,有错误,请指出.我是诚心的想帮你,若满意请请点击在下答案旁的"好评",互相探讨,互相理解,请不要随意给差评,1年前查看全部
- 氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图I中的一些装置来进行
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应:
AlN+NaOH+H 2 O═NaAlO 2 +NH 3 ↑
根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)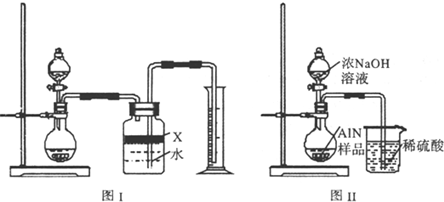
(1)实验有关操作为:a、往烧瓶中放入适量的AIN样品:b、从分液漏斗往烧瓶中加入过量的浓NaOH; C、检验装置的气密性;d、测定收集到水的体积.
正确的操作顺序为:______.
(2)本试验中(图I)检査装置气密性的方法是:______.
(3)广口瓶中的试剂X可选用______.(填选项的标号)
A.汽油B.酒精 C.植物油D.CCl 4
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是______.
(5)若实验中测得样品的质量为w g,氨气的体积为aL(标况下),则样品中AIN的质量分数为:______.
(6)有人改用图II装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AIN的质量分数.你认为是否可行?______ (填入“可行”、“不可行”),原因是______. 尽是法身1年前1
尽是法身1年前1 -
 可爱的小蘑菇 共回答了20个问题
可爱的小蘑菇 共回答了20个问题 |采纳率90%:(1)应先进行装置气密性检验,然后依次加入固体药品、液体药品,最后进行气体排出水的测量,确定产生气体体积;
故答案为:c、a、b、d;
(2)通过微热或用手握热使装置内气体使气体体积变大,如果装置漏气则不会观察到装置内有明显变化;如果气密性良好,广口瓶中右侧导管水柱上升,松手后水柱回落;
故答案为:关闭分液漏斗活塞,用水紧握握热锥形瓶,广口瓶中右侧导管水柱上升,松手后水柱回落,证明气密性好;
(3)酒精、汽油虽然都不能与氨气发生反应,但它们却都极易挥发,挥发出来的气体对实验有影响而且挥发完后不能再起到隔离氨气与水接触的作用;同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用.而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离;
故答案为:C;
(4)氮化铝中含有碳或氧化铝杂质,氧化铝易溶于NaOH溶液,而实验结束后,若观察到锥形瓶中还有固体,说明固体不溶于氢氧化钠溶液,所以杂质是碳;
故答案为:碳.
(5)氨气的体积为aL(标况下)的物质的量为
aL
22.4L/mol =
a
22.4 mol,由方程式AlN+NaOH+H 2 O=NaAlO 2 +NH 3 ↑可知,样品中AlN的物质的量为=
a
22.4 mol,所以AlN的质量为
a
22.4 mol×41g/mol=
41a
22.4 g,样品中AIN的质量分数为
41a
22.4 g
wg ×100%=
4100a
22.4w %.
故答案为:
4100a
22.4w %.
(6)氨气极易溶于稀硫酸而出现倒吸,因此,该装置不能准确测量产生氨气的量;可在导管末端连接漏斗倒扣在液面上,刚氨气大量吸收时,烧杯内液面下降而脱离接触,可以防止稀硫酸的倒吸;
故答案为:不可行;氨气极易被吸收,发生倒吸现象.1年前查看全部
- 工业制得的氮化铝(AlN)产品中常含有少量Al 4 C 3 、Al 2 O 3 、C等杂质。某同学设计了如下实验分别测定
工业制得的氮化铝(AlN)产品中常含有少量Al 4 C 3 、Al 2 O 3 、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al 4 C 3 的质量分数(忽略NH 3 在强碱性溶液中的溶解)。
(1)实验原理
①Al 4 C 3 与硫酸反应可生成CH 4 ;
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为n g,滴定管的读数为a mL。
②称取m g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为p g。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”“偏小”或“无影响”)。
③Al 4 C 3 的质量分数为 。(该实验条件下的气体摩尔体积为V m ) 第六根手指141年前1
第六根手指141年前1 -
 yellow_yy01 共回答了21个问题
yellow_yy01 共回答了21个问题 |采纳率90.5%(1)②AlN+NaOH+H 2 O NaAlO 2 +NH 3 ↑
NaAlO 2 +NH 3 ↑
(3)②K 2 、K 3 K 1 稀硫酸 ③K 1 K 3 NaOH ④打开K 2 ,通入空气一段时间
(4)①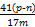 ×100% ②偏小 ③
×100% ②偏小 ③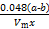 ×100%
×100%
(3)A装置是测量CH 4 的装置、D装置是吸收NH 3 的装置,从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al 4 C 3 、AlN完全反应,生成甲烷、铵盐,量取生成的甲烷,从而可测得Al 4 C 3 的质量分数;用足量NaOH溶液与生成的铵盐反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数;(4)①根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数;③Al 4 C 3 的物质的量等于甲烷的物质的量的,可求得Al 4 C 3 的质量分数1年前查看全部
- 氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝样品中可能含有碳或氧化铝中的一种杂质,现用如图Ⅰ
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝样品中可能含有碳或氧化铝中的一种杂质,现用如图Ⅰ所示的装置来进行检验。使氮化铝样品和氢氧化钠溶液反应:
AlN + NaOH + H 2 O = NaAlO 2 + NH 3 ↑ 根据反应中所产生氨气的体积来测定样品的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)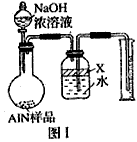
(1)实验有关操作:
A.往圆底烧瓶中放入AlN样品wg,并向广口瓶中加入水和X液体;
B.往圆底烧瓶中加入一定体积的过量的浓NaOH溶液;
C.检验装置的气密性;
D.读取收集到的水的体积;
正确的操作顺序为______________________。
(2)本实验中检验装置气密性的方法是_____________________________________。
(3)广口瓶中的试剂X可选用_______________(填选项的标号)
A、丁烷 B、酒精 C、植物油 D、四氯化碳
其理由______________________________________。
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是___________。
(5)实验结束后,量筒中收集到水的体积为aL,若当时的实验条件为标准状况,则样品中AlN的质量分数为______________________(AlN的相对分子质量为41),这一测定结果比实际值偏低,你认为可能的原因是__________________________.
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定烧杯中硫酸的增重来确定样品AlN的质量分数。你认为这样的改进是否可行?___________(填“可行”或“不可行”),理由是___________________________________________。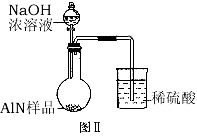
 kele271年前1
kele271年前1 -
 wuyulong9ee8 共回答了13个问题
wuyulong9ee8 共回答了13个问题 |采纳率100%(1)CABD
(2)关闭活塞,在量筒中加入足量的水浸没导管口,微热圆底烧瓶导管口有气泡产生,冷却后导管口有一段水柱稳定不动,则表示气密性良好
(3)C;NH 3 极易溶于水,植物油起到隔离水的作用,防止NH 3 溶于水,防止倒吸
(4)碳
(5)41a/22.4W×100%;一部分氨气溶于水中(答案合理即可)
(6)不行;会造成倒吸1年前查看全部
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al 2 O 3 +N 2 +3C
2AlN+3CO.下列叙述正确的是( )高温 . A.在氮化铝的合成反应中,N 2 是还原剂,Al 2 O 3 是氧化剂 B.上述反应中每生成2 mol AlN,N 2 得到3 mol电子 C.氮化铝中氮元素的化合价为-3 D.氮化铝晶体属于分子晶体  henry7891年前1
henry7891年前1 -
 爱比yy更冷_ 共回答了16个问题
爱比yy更冷_ 共回答了16个问题 |采纳率81.3%A.根据氧化还原反应的规律:(还原剂)升(化合价升高) 失(失去电子) 氧(发生氧化反应);(氧化剂)降(化合价降低) 得(得到电子) 还(发生还原反应)若说剂正相反.可以分析出,在氮化铝的合成反应中,N 2 的化合价由0→-3,发生改变,N 2 是氧化剂;Al 2 O 3 中Al、O元素的化合价不变,既不是氧化剂也不是还原剂.故A错误;
B.在氮化铝的合成反应中,N 2 的化合价由0→-3,每生成2 mol AlN,N 2 得到的电子是3×2=6mol电子.故B错误;
C.氮化铝中Al的化合价为+3价,氮元素的化合价为-3价.故C正确;
D.氮化铝晶体是由Al 3+ 和N 3- 构成的离子化合物.故D错误;
故选C.1年前查看全部
- 工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中
AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).
实验原理:Al4C3与硫酸反应可生成CH4;AlN溶于强酸产生铵盐,溶于强碱生成氨气;
实验装置(如图所示)
实验过程:
连接实验装置,检验装置的气密性.
称得D装置的质量为y g,滴定管的读数为amL.
盛取x g AlN样品置于锥形瓶中;塞好胶塞,①关闭活塞______,打开活塞______,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应.待反应进行完全后,②关闭活塞______,打开活塞______,通过分液漏斗加入过量③______(填化学式),与烧瓶内物质充分反应.④______(填入该步应进行的操作).
记录滴定管的读数为bmL,称得D装置的质量为z g.
数据分析:
⑤AlN的质量分数为______.
⑥若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积______(填“偏大”、“偏小”或“无影响”).
⑦Al4C3的质量分数为______.(该实验条件下的气体摩尔体积为Vm).
 _helen_1年前1
_helen_1年前1 -
 hww9958 共回答了20个问题
hww9958 共回答了20个问题 |采纳率100%实验过程:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数.
①、通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,故应关闭活塞K2、K3,打开活塞 K1.
故答案为:K2、K3; K1.
②、用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数.故应关闭活塞K1,打开活塞K3
故答案为:K1;K3.
③、由②中分析可知,通过分液漏斗加入过量氢氧化钠溶液.
故答案为:NaOH.
④装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收,防止测定的氨气的质量偏小.
故答案为:打开K2,通入空气一段时间.
数据分析:
⑤氨气的质量为(z-y)g,物质的量为
(z?y)g
17g/mol=[z?y/17]mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为[z?y/17]mol×41g/mol=
41(z?y)
17g,故AlN的质量分数为
41(z?y)
17g
xg×100%=
41(z?y)
17x×100%.
故答案为:
41(z?y)
17x×100%.
⑥读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,
故答案为:偏小.
⑦甲烷的体积为(b-a)mL,物质的量为
(b?a)×10?3L
VmL/mol=[b?a
Vm×10-3mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为
1/3]×[b?a
Vm×10-3mol×144g/mol=
48(b?a)
Vm×10-3g,Al4C3的质量分数为
48(b?a)
Vm×10?3g/xg]×100%=
0.048(a?b)
Vmx×100%.
故答案为:
0.048(a?b)
Vmx×100%.1年前查看全部
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子、陶瓷工业等领域.在一定条件下,氮化铝可通过以下
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子、陶瓷工业等领域.在一定条件下,氮化铝可通过以下反应合成:Al2O3+N2+3C=2AlN+3CO,欲制得4.1t的氮化铝需要原料氧化铝多少吨?
 jocty1年前1
jocty1年前1 -
 415zengtao 共回答了24个问题
415zengtao 共回答了24个问题 |采纳率100%解题思路:根据参加反应的生成的氮化铝的质量,由反应的化学方程式计算出需要原料氧化铝的质量即可.设需要原料氧化铝的质量为x,
Al2O3+N2+3C=2AlN+3CO
102 82
x 4.1t
[102/82=
x
4.1t] x=5.1t.
答:需要原料氧化铝的质量为5.1t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.1年前查看全部
- 氮化铝中加入过量的NaOH浓溶液并蒸干,反映生成NaAlO2,并放出氨气.这个反应的化学方程式怎么写?
氮化铝中加入过量的NaOH浓溶液并蒸干,反映生成NaAlO2,并放出氨气.这个反应的化学方程式怎么写?
配平了的...可能还有其他生成物. LRnote1年前1
LRnote1年前1 -
 zhijianyuan 共回答了16个问题
zhijianyuan 共回答了16个问题 |采纳率93.8%小兄弟我帮你,分给我.哦哦.
AlN+NaOH+H2O=NaAlO2+NH3↑(不是氧化还原反应)
给机会.1年前查看全部
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C
2AlN+3CO.下列叙述正确的是( )高温 .
A. 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中每生成2 mol AlN,N2得到3 mol电子
C. 氮化铝中氮元素的化合价为-3
D. 氮化铝晶体属于分子晶体 cuitao11081年前1
cuitao11081年前1 -
 真的很爱你 共回答了15个问题
真的很爱你 共回答了15个问题 |采纳率100%解题思路:在一定条件下,合成氮化铝的反应为Al2O3+N2+3C
2AlN+3CO.反应中氮、碳元素化合价变化,Al、O元素的化合价不变,AlN中N的化合价为-3价.高温 .A.根据氧化还原反应的规律:(还原剂)升(化合价升高) 失(失去电子) 氧(发生氧化反应);(氧化剂)降(化合价降低) 得(得到电子) 还(发生还原反应)若说剂正相反.可以分析出,在氮化铝的合成反应中,N2的化合价由0→-3,发生改变,N2是氧化剂;Al2O3 中Al、O元素的化合价不变,既不是氧化剂也不是还原剂.故A错误;
B.在氮化铝的合成反应中,N2的化合价由0→-3,每生成2 mol AlN,N2得到的电子是3×2=6mol电子.故B错误;
C.氮化铝中Al的化合价为+3价,氮元素的化合价为-3价.故C正确;
D.氮化铝晶体是由Al3+和N3-构成的离子化合物.故D错误;
故选C.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算;晶体的类型与物质熔点、硬度、导电性等的关系.
考点点评: 本题考查了对氧化还原反应的理解、晶体类型的判断.氧化还原反应注意反应方程式中各元素前后化合价的变化,晶体类型判断应注意组成晶体的元素.1年前查看全部
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,被广泛用于大规模集成电路生产,陶瓷工业等领域。工业上从铝土矿中获
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,被广泛用于大规模集成电路生产,陶瓷工业等领域。工业上从铝土矿中获得物质X(X中含有两种元素),从空气中获得氮气,再将物质X、N 2 和碳在一定条件下反应制得AlN和CO。则:
(1)氮化铝陶瓷属于 。(填字母)A.金属材料 B.无机非金属材料
(2)通常情况下,空气中氮气的体积分数约为 ,将经过除尘净化、除去二氧化碳和水气的空气液化,通过控制温度将 (填“氧气”或“氮气”)从液态空气中先蒸发出来。
(3)物质X的化学式 ,制AlN的化学方程式
(4)铝在地壳中含量居所有元素的第 位。铝元素摄入过多对人体有害,请给大家提一条减少生活中铝元素摄入的合理化建议 惡魔吹着笛子來1年前1
惡魔吹着笛子來1年前1 -
 M男宠 共回答了19个问题
M男宠 共回答了19个问题 |采纳率94.7%(1)B
(2)78%;N 2
(3)Al 2 O 3 ;Al 2 O 3 +N 2 +3C==2AlN+3CO
(4)3;少用铝制餐具或少吃用铝制易拉罐装的饮料1年前查看全部
- 若要得到82kg的氮化铝,则需要纯度为99%的氧化铝粉末多少千克?
若要得到82kg的氮化铝,则需要纯度为99%的氧化铝粉末多少千克?
氮化铝(AIN)热膨胀系数小,是良好的耐热冲击材料,在一定条件下,氮化铝可通过如下反应制备:Al2O3+N2+3C===2AlN+3CO yujan1641年前1
yujan1641年前1 -
 chue674 共回答了16个问题
chue674 共回答了16个问题 |采纳率75%Al2O3+N2+3C=2AlN+3CO
102 2*41
X*99% 82 X=103.03Kg1年前查看全部
- (2013•通州区二模)氮化铝(AlN)被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应制得:A
(2013•通州区二模)氮化铝(AlN)被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应制得:Al2O3+N2+3C═2AlN+3CO,现欲制备12.3t氮化铝,需要参加反应的氧化铝(Al2O3)质量是多少?
 水深是海1年前1
水深是海1年前1 -
 鸿大哥大 共回答了17个问题
鸿大哥大 共回答了17个问题 |采纳率94.1%解题思路:根据反应的化学方程式,确定反应中氮化铝与氧化铝的质量关系,利用这一质量关系可由制得氮化铝的质量计算出参加反应氧化铝的质量.设需要参加反应的氧化铝(Al2O3)质量是X.
Al2O3+N2+3C=2AlN+3CO
10282
x 12.3t
根据:[102/82=
x
12.3t]解得x=15.3t.
答:需要参加反应的氧化铝(Al2O3)质量是15.3t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题为根据化学方程式的基础计算,在解答时需要注意计算过程的完整、正确的计算结果.1年前查看全部
- 氮化铝(AlN)水解化学方程式.
 yangk05211年前1
yangk05211年前1 -
 zll152 共回答了17个问题
zll152 共回答了17个问题 |采纳率88.2%所谓水解呢,就是指化合物与水发生的取代反应
化合物中显正电性的原子或原子团与氢氧根结合
而显负电的原子或原子团与氢离子结合
这很容易理解,因为异性电荷相吸引嘛
因此,氮化铝中的铝显正电,与氢氧根结合生成氢氧化铝
而显负电的氮与氢离子结合,生成氨气
所以,方程式应该是
AlN+3H20=Al(OH)3+NH31年前查看全部
- 氮化铝(AlN)是一种新型材料.某氮化铝样品中含有碳或氧化铝杂质
氮化铝(AlN)是一种新型材料.某氮化铝样品中含有碳或氧化铝杂质
若广口瓶内的液体没有装满(上方留有少量空间),则实验测得NH3体积将——————(选填偏大、偏小、不变、无影响)求详细的过程! zljinling1年前1
zljinling1年前1 -
 操满天飞 共回答了17个问题
操满天飞 共回答了17个问题 |采纳率82.4%A中NaOH溶液,B中是AlN固体,发生反应:AlN + NaOH + H2O = NaAlO2 + NH3↑NH3进入集气瓶中,X实际上就是一层隔离液,密度小于水且不溶于水,最常见的就是油类,当NH3充进来的时候,X液面下降,水被排进右边的量筒,并且冲进...1年前查看全部
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C
2AlN+3CO下列叙述正确的是( )高温 .
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2mol AlN,N失去6mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝是氧化产物 guo05051年前1
guo05051年前1 -
 dfcwjhg 共回答了15个问题
dfcwjhg 共回答了15个问题 |采纳率66.7%解题思路:Al2O3+N2+3C高温 .2AlN+3CO中,N元素化合价降低,N2为氧化剂,C元素化合价升高,C为氧化剂,结合元素化合价的变化判断电子转移的数目.A.在氮化铝的合成反应中,N2是氧化剂,Al2O3既不是氧化剂,也不是还原剂,故A错误;
B.上述反应中N元素化合价由0价降低到-3价,每生成2mol AlN,N2得到6mol电子,故B错误;
C.由化合价代数和为0可知,氮化铝中铝元素化合价为+3价,氮元素的化合价为-3,故C正确;
D.氮化铝是还原产物,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,注意把握元素化合价的判断,从化合价变化的角度分析,题目侧重于相关概念的考查.1年前查看全部
- (2011•石家庄二模)工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验
(2011•石家庄二模)工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中
AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).
实验原理:Al4C3与硫酸反应可生成CH4;AlN溶于强酸产生铵盐,溶于强碱生成氨气;
实验装置(如图所示)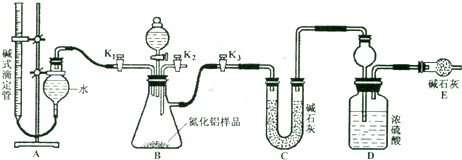
实验过程:
连接实验装置,检验装置的气密性.
称得D装置的质量为y g,滴定管的读数为amL.
盛取x g AlN样品置于锥形瓶中;塞好胶塞,①关闭活塞______,打开活塞______,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应.待反应进行完全后,②关闭活塞______,打开活塞______,通过分液漏斗加入过量③______(填化学式),与烧瓶内物质充分反应.④______(填入该步应进行的操作).
记录滴定管的读数为bmL,称得D装置的质量为z g.
数据分析:
⑤AlN的质量分数为
×100%41(z−y) 17x .
×100%41(z−y) 17x
⑥若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积______(填“偏大”、“偏小”或“无影响”).
⑦Al4C3的质量分数为
×100%0.048(a−b) Vmx .(该实验条件下的气体摩尔体积为Vm).
×100%0.048(a−b) Vmx  缥缈的忧伤1年前1
缥缈的忧伤1年前1 -
 thrust9999 共回答了18个问题
thrust9999 共回答了18个问题 |采纳率100%解题思路:实验过程:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数.
①、通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,故应关闭活塞K2、K3,打开活塞 K1.
②、③、用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,故应关闭活塞K1,打开活塞K3.
④装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收.
数据
⑤根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数.
⑥读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,
⑦根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,可求得Al4C3的质量分数.实验过程:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数.
①、通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,故应关闭活塞K2、K3,打开活塞 K1.
故答案为:K2、K3; K1.
②、用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数.故应关闭活塞K1,打开活塞K3
故答案为:K1;K3.
③、由②中分析可知,通过分液漏斗加入过量氢氧化钠溶液.
故答案为:NaOH.
④装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收,防止测定的氨气的质量偏小.
故答案为:打开K2,通入空气一段时间.
数据分析:
⑤氨气的质量为(z-y)g,物质的量为
(z−y)g
17g/mol=[z−y/17]mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为[z−y/17]mol×41g/mol=
41(z−y)
17g,故AlN的质量分数为
41(z−y)
17g
xg×100%=
41(z−y)
17x×100%.
故答案为:
41(z−y)
17x×100%.
⑥读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,
故答案为:偏小.
⑦甲烷的体积为(b-a)mL,物质的量为
(b−a)×10−3L
VmL/mol=[b−a
Vm×10-3mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为
1/3]×[b−a
Vm×10-3mol×144g/mol=
48(b−a)
Vm×10-3g,Al4C3的质量分数为
48(b−a)
Vm×10−3g/xg]×100%=
0.048(a−b)
Vmx×100%.
故答案为:
0.048(a−b)
Vmx×100%.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 考查对实验原理与操作步骤的理解、化学计算、物质组成的测定等,难度较大,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键.1年前查看全部
- 在一定条件下,氮化铝可通过反应AlO3+N2+3C=2AlN+3CO合成
 jatix1年前2
jatix1年前2 -
 newsky2005 共回答了16个问题
newsky2005 共回答了16个问题 |采纳率93.8%是用于电子陶瓷等工业领域 在高温条件下1年前查看全部
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C
2AlN+3CO.下列叙述正确的是( )高温 .
A. 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中每生成2 mol AlN,N2得到3 mol电子
C. 氮化铝中氮元素的化合价为-3
D. 氮化铝晶体属于分子晶体 ddddddddde1年前5
ddddddddde1年前5 -
 chenfeng214 共回答了19个问题
chenfeng214 共回答了19个问题 |采纳率73.7%解题思路:在一定条件下,合成氮化铝的反应为Al2O3+N2+3C
2AlN+3CO.反应中氮、碳元素化合价变化,Al、O元素的化合价不变,AlN中N的化合价为-3价.高温 .A.根据氧化还原反应的规律:(还原剂)升(化合价升高) 失(失去电子) 氧(发生氧化反应);(氧化剂)降(化合价降低) 得(得到电子) 还(发生还原反应)若说剂正相反.可以分析出,在氮化铝的合成反应中,N2的化合价由0→-3,发生改变,N2是氧化剂;Al2O3 中Al、O元素的化合价不变,既不是氧化剂也不是还原剂.故A错误;
B.在氮化铝的合成反应中,N2的化合价由0→-3,每生成2 mol AlN,N2得到的电子是3×2=6mol电子.故B错误;
C.氮化铝中Al的化合价为+3价,氮元素的化合价为-3价.故C正确;
D.氮化铝晶体是由Al3+和N3-构成的离子化合物.故D错误;
故选C.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算;晶体的类型与物质熔点、硬度、导电性等的关系.
考点点评: 本题考查了对氧化还原反应的理解、晶体类型的判断.氧化还原反应注意反应方程式中各元素前后化合价的变化,晶体类型判断应注意组成晶体的元素.1年前查看全部
- (2013•东城区二模)氮化铝( AlN )被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化
(2013•东城区二模)氮化铝( AlN )被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应制得:Al2O3+N2+3C=2AlN+3CO,现欲制备8.2t氮化铝,试计算需要的氮气质量.
 花也醉1年前1
花也醉1年前1 -
 凌子寒 共回答了17个问题
凌子寒 共回答了17个问题 |采纳率94.1%解题思路:根据反应的化学方程式,确定反应中氮化铝与氮气的质量关系,利用这一质量关系可由制得氮化铝的质量计算出参加反应氮气的质量.设消耗的氮气质量为x
Al2O3 +N2 +3C=2AlN+3CO
28 82
x8.2t
根据:[28/82=
x
8.2t]解得x=2.8t
答:制备8.2t氮化铝,消耗的氮气质量是2.8t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题为根据化学方程式的基础计算,在解答时需要注意计算过程的完整、正确的计算结果.1年前查看全部
- 氮化铝 (AlN)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应
氮化铝 (AlN)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应
Al2O3+N2+3C
2AlN+3CO合成.下列叙述正确的是( )高温 .
A.该反应中氧化剂与还原剂物质的量之比为3:1
B.AlN是还原产物
C.AlN的摩尔质量为41g
D.上述反应中,每生成lmolAlN需转移6mol电子 enshizhiqing1年前1
enshizhiqing1年前1 -
 nv9cofa 共回答了16个问题
nv9cofa 共回答了16个问题 |采纳率93.8%解题思路:该反应中N元素化合价由0价变为-3价,C元素化合价由0价变为+2价,
A.得电子的反应物是氧化剂,失电子的反应物是还原剂;
B.氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物;
C.摩尔质量的单位是g/mol;
D.根据AlN与转移电子之间的关系式计算.该反应中N元素化合价由0价变为-3价,C元素化合价由0价变为+2价,
A.氮气是氧化剂,碳是还原剂,所以氧化剂和还原剂的物质的量之比为1:3,故A错误;
B.氮气是氧化剂,对应的产物AlN属于还原产物,故B正确;
C.AlN的摩尔质量为41g/mol,故C错误;
D.每生成lmolAlN需转移电子的物质的量=1mol×[0-(-3)]=3mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,根据元素化合价变化结合基本概念来分析解答,注意质量和摩尔质量的区别,难度不大.1年前查看全部
- 氮化铝(AlN)因耐高温、抗冲击、导热性好,被广泛用于大规模集成电路生产、陶瓷工业等,工业上是用氧化铝、氮气、单质碳在一
氮化铝(AlN)因耐高温、抗冲击、导热性好,被广泛用于大规模集成电路生产、陶瓷工业等,工业上是用氧化铝、氮气、单质碳在一定条件下反应生成AlN和CO,该反应的化学方程式为:______.  无风亦无影1年前1
无风亦无影1年前1 -
 leohare 共回答了18个问题
leohare 共回答了18个问题 |采纳率100%反应物为氧化铝、氮气、单质碳,在一定条件下反应生成AlN和CO,故生成物是AlN和CO.
该反应的化学方程式为:Al 2 O 3 +N 2 +3C
一定条件
.
2AlN+3CO.
故答案为:Al 2 O 3 +N 2 +3C
一定条件
.
2AlN+3CO1年前查看全部
- 氮化铝生成热实验需要用到氮化铝的生成热,就是2Al+N2=2AlN的反应热,哪位知道麻烦告诉下,
 mhw187291年前1
mhw187291年前1 -
 里奥8868 共回答了17个问题
里奥8868 共回答了17个问题 |采纳率82.4%AlN的键能大约260,计算得出
2Al+N2=2AlN ΔG = 414.56 kJ/mol1年前查看全部
- (2010•泉州)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域.在一定条件
(2010•泉州)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应制备:Al2O3+N2+3C=2AlN+3CO
若要得到164kg的氮化铝,则需要参加反应的氧化铝(Al2O3)的质量为多少千克? errg1年前1
errg1年前1 -
 卓狼 共回答了19个问题
卓狼 共回答了19个问题 |采纳率89.5%解题思路:根据题意可以判断出发生反应的化学方程式,已知要得到的氮化铝的质量为164kg,故可以利用这一质量结合化学方程式计算出参加反应氧化铝的质量.设至少需要参加反应的氧化铝的质量为x
Al2O3+N2+3C═2AlN+3CO
102 82
x 164Kg
[102/x =
82
164kg]
解得:x=204kg
答:至少需要参加反应的氧化铝的质量为204kg.
故答案为:204kg.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题为根据化学方程式的基础计算,在解答时找准已知量和未知量,然后在正确的书写化学方程式的基础上来解答,需要注意计算过程的完整、正确的计算结果.1年前查看全部
- (2011•常州模拟)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于大规模集成电路生产、陶瓷工业等领
(2011•常州模拟)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于大规模集成电路生产、陶瓷工业等领域.工业上从铝土矿中获得氧化物X,从空气中获得氮气,再将物质X、N2和碳在一定条件下反应制得AlN和CO.则:
(1)制AlN的化学反应方程式Al2O3+N2+3C
2AlN+3COAl2O3+N2+3C一定条件 . .
2AlN+3CO.铝在地壳中的含量居所有元素的第三三位,氮化铝陶瓷属于无机非金属无机非金属材料一定条件 . .
(2)通常情况下,空气中氮气的体积分数为78%,将经过除尘净化、除去二氧化碳和水蒸气的空气液化,通过控制温度将氮气从液态空气中先蒸发出来.将燃着的Mg条伸入盛有氮气的集气瓶,Mg条会继续燃烧,生成氮化镁,化学反应方程式为3Mg+N2
Mg3N23Mg+N2点燃 .
Mg3N2.点燃 .  锋之芒1年前1
锋之芒1年前1 -
 elevenbaby 共回答了18个问题
elevenbaby 共回答了18个问题 |采纳率83.3%(1)根据氧化铝、氮气和碳在一定条件下反应制得A1N和CO,化学方程式为:Al2O3+N2+3C
一定条件
.
2AlN+3CO;
根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,铝在地壳中的含量居所有元素的第3位;
根据氮化铝陶瓷可断定其不属于金属材料,所以氮化铝陶瓷属于无机非金属材料;
(2)由题意知反应的化学方程式为3Mg+N2
点燃
.
Mg3N2.
故答案为:(1)Al2O3+N2+3C
一定条件
.
2AlN+3CO;三;无机非金属材料;
(2)3Mg+N2
点燃
.
Mg3N2.1年前查看全部
- 氮化铝(A1N)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于大规模集成电路生产、陶瓷工业等领域.工业上从铝土矿中
氮化铝(A1N)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于大规模集成电路生产、陶瓷工业等领域.工业上从铝土矿中获得物质X,从空气中获得氮气,再将物质X、N 2 和碳在一定条件下反应制得A1N和CO.则
(1)氮化铝陶瓷属于______.(填字母)
A.金属材料B.无机非金属材料
(2)通常情况下,空气中氮气的体积分数为______,将经过除尘净化、除去二氧化碳和水蒸气的空气液化,通过控制温度将______(填氧气或氮气)从液态空气中先蒸发出来.
(3)物质X的化学式______,制A1N的化学反应方程式______.
(4)铝在地壳中的含量居所有元素的第______位.铝元素摄人过多对人体有害,请给大家提一条减少生活中铝元素摄入的合理化建议______. 小优不哭1年前1
小优不哭1年前1 -
 思念旅行 共回答了12个问题
思念旅行 共回答了12个问题 |采纳率100%(1)金属材料是指金属单质或合金,最少需要有一种金属单质,而氮化铝陶瓷中没有金属单质,所以属于无机非金属材料;
(2)空气中各成分及体积分数为:氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳0.03%、水蒸气和杂质:0.03%.除去二氧化碳和水蒸气的空气主要是液态氧和液态氮,而液态氮的沸点比液态氧的沸点低,所以氮气先出来;
(3) 根据质量守恒定律可知反应前后元素种类不变,生成物为A1N和CO,而反应物中只有氮、碳元素,所以还缺少铝和氧,即氧化铝;
(4)地壳中含量最多的前五种元素是;氧、硅、铝、铁、钙.所以铝占第3位,不使用铝制的饮料瓶或餐具等.
故答案为:(1)B;
(2)78%;氮气;
(3)Al 2 O 3 ;Al 2 O 3 +N 2 +3C═2AlN+3CO;
(4)3;不用铝制易拉罐.1年前查看全部
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于大规模集成电路生产、陶瓷工业等领域.
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于大规模集成电路生产、陶瓷工业等领域.
(1)铝的原子结构示意图为: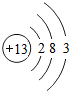 ,铝原子核内中子数比质子数多1,则铝原子的中子数为______;
,铝原子核内中子数比质子数多1,则铝原子的中子数为______;
(2)氮化铝陶瓷属于(选填序号)______;
①有机合成材料②金属材料③无机非金属材料
(3)工业上制氮化铝,是从铝土矿中获得氧化物X;通过净化、液化空气,控温蒸发得到N2;X与N2和碳在一定条件下反应制得AlN和CO.氧化物X的化学式为______,制AlN的化学方程为______. 只戴红发卡1年前1
只戴红发卡1年前1 -
 打着哈欠的猫 共回答了17个问题
打着哈欠的猫 共回答了17个问题 |采纳率82.4%解题思路:(1)依据铝的原子结构示意图可知其核内质子数,据此可判断核内中子数;
(2)依据材料的分类分析解答即可;
(3)根据反应物、生成物写出反应的方程式,根据质量守恒定律推断气体.(1)由铝的原子结构示意图可知其核内质子数是13,可知其核内中子数是14;
(2)由材料分类的知识可知,氮化铝陶瓷属于无机非金属材料,由于其成分中不含有机物和金属,所以不属于金属材料和有机合成材料;
(3)由于物质X、N2和碳在一定条件下反应制得AlN和CO,由质量守恒定律可知,物质X的化学式是 Al2O3;根据氧化铝、氮气和碳在一定条件下反应制得A1N和CO,化学方程式为:Al2O3+N2+3C═2AlN+3CO;
故答案为:(1)14;(2)③;(3)Al2O3;Al2O3+N2+3C═2AlN+3CO;点评:
本题考点: 原子结构示意图与离子结构示意图;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题将化学知识与生活紧密联系起来,体现了生活中处处有化学.解题时,认真审题,根据题意,将问题与有关的化学知识有机地联系起来,即可解答.1年前查看全部
- (2011•常州模拟)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于大规模集成电路生产、陶瓷工业等领
(2011•常州模拟)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于大规模集成电路生产、陶瓷工业等领域.工业上从铝土矿中获得氧化物X,从空气中获得氮气,再将物质X、N2和碳在一定条件下反应制得AlN和CO.则:
(1)制AlN的化学反应方程式Al2O3+N2+3C
2AlN+3CO一定条件 ..Al2O3+N2+3C.铝在地壳中的含量居所有元素的第______位,氮化铝陶瓷属于______材料
2AlN+3CO一定条件 ..
(2)通常情况下,空气中氮气的体积分数为78%,将经过除尘净化、除去二氧化碳和水蒸气的空气液化,通过控制温度将氮气从液态空气中先蒸发出来.将燃着的Mg条伸入盛有氮气的集气瓶,Mg条会继续燃烧,生成氮化镁,化学反应方程式为3Mg+N2
Mg3N2点燃 .3Mg+N2.
Mg3N2点燃 . 最爱明步1年前1
最爱明步1年前1 -
 huozhe2611 共回答了21个问题
huozhe2611 共回答了21个问题 |采纳率85.7%解题思路:(1)根据氧化铝、氮气和碳在一定条件下反应制得A1N和CO,写出化学方程式,注意:写,配,等,标;根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,进行解答;根据氮化铝陶瓷可断定其不属于金属材料,进行解答;
(2)根据题目提供的信息,书写化学方程式.(1)根据氧化铝、氮气和碳在一定条件下反应制得A1N和CO,化学方程式为:Al2O3+N2+3C
一定条件
.
2AlN+3CO;
根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,铝在地壳中的含量居所有元素的第3位;
根据氮化铝陶瓷可断定其不属于金属材料,所以氮化铝陶瓷属于无机非金属材料;
(2)由题意知反应的化学方程式为3Mg+N2
点燃
.
Mg3N2.
故答案为:(1)Al2O3+N2+3C
一定条件
.
2AlN+3CO;三;无机非金属材料;
(2)3Mg+N2
点燃
.
Mg3N2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;新材料的开发与社会发展的密切关系.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- (2013•山东模拟)氮化铝(AIN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组利用 制取
(2013•山东模拟)氮化铝(AIN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组利用 制取氮化铝,设计如图甲所示的实验装置.
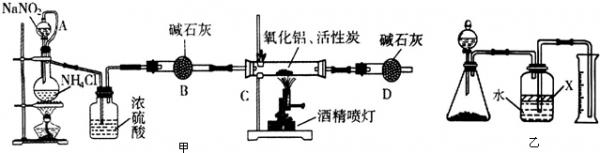
试回答:
(1)实验中用饱和NaNO2与NH4C溶液制取氧气的化学方程式为NaNO2+NH4Cl
NaCl+N2↑+2H2O△ .NaNO2+NH4Cl.
NaCl+N2↑+2H2O△ .
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是______(填写序号).
a.防止NaNO2饱和溶液蒸发b.保证实验装置不漏气 c.使NaNO2 饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是______.
(4)化学研究小组的装置存在严重问题,请说明改进的办法______.
(5)反应结束后,某同学用图乙所示装置进行实验来测定氮化铝样 品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气.
①广口瓶中的试剂X最好选用______(填写序号).
a.汽油b.酒精c.植物油d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将______(填“偏大”、“偏小”、“不变”).
③若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积为3.36L(标准状况),则样品中AlN的质量分数为______. jolhk91年前1
jolhk91年前1 -
 雪月画屏 共回答了17个问题
雪月画屏 共回答了17个问题 |采纳率82.4%解题思路:(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水;
(2)根据实验的需要结合大气压强原理来回答;
(3)只要先将装置密封再利用热胀冷缩原理进行气密性验证;
(4)实验必须对有毒气体进行尾气处理,防止空气污染;
(5)①根据广口瓶中的试剂X的作用考虑;
②根据反应前后广口瓶的上方留有的少量空间填充气体变化考虑;
③根据氨气的体积计算出物质的量,得出其中氮原子的物质的量,根据氮原子守恒,来计算氮化铝的百分含量.(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水,故答案为:NaNO2+NH4Cl
△
.
NaCl+N2↑+2H2O;
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A具有平衡气压的作用,这样可以保证NaNO2饱和溶液容易滴下,故选c;
(3)关闭分液漏斗开关,使装置处于密闭体系,将导管一端浸入水中,用手紧握锥形瓶外壁,由于热胀冷缩,锥形瓶内气体受热膨胀,如果导管口有气泡冒出,说明气密性良好,否则装置漏气,故答案为:在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,证明气密性良好;
(4)实验必须对有毒气体进行尾气处理,防止空气污染,故答案为:在干燥管D末端连接一个尾气处理装置;
(5)①广口瓶中的试剂X的作用是将氨气与水隔开,因为氨气极易溶于水,由于酒精能以任意比例与水互溶,所以不能用酒精,要用植物油将氨气与水隔开,水不溶于油,故选c;
②反应前广口瓶的上方留有的少量空间填充的是空气,反应后广口瓶的上方留有的少量空间填充的是氨气,氨气代替了开始的空气,把最后空间中冲入的氨气当成开始时的空气即可,所以对实验结果没有影响,故答案为:不变;
(5)氮化铝中含有碳或氧化铝杂质,氧化铝易溶于NaOH溶液,而实验结束后,若观察到锥形瓶中还有固体,说明固体不溶于氢氧化钠溶液,所以杂质是碳;
(6)氨气的体积为3.36L(标准状况),物质的量是0.15mol,所以氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以氮化铝的质量分数为
[6.15/10]×100%=61.5%,故答案为:61.5%.点评:
本题考点: 制备实验方案的设计;镁、铝的重要化合物.
考点点评: 解答本题要知道制取气体的一般步骤,知道用排水法测定气体体积的方法,由于氨气极易溶于水,要用植物油将氨气与水分开,综合性强,难度大.1年前查看全部
- (2008•南京二模)氮化铝(AlN)广泛用于电子工业、陶瓷工业等领域.可通过如下反应制取:Al2O3+N2+3C
(2008•南京二模)氮化铝(AlN)广泛用于电子工业、陶瓷工业等领域.可通过如下反应制取:Al2O3+N2+3C
2AlN+3CO,下列叙述正确的( )高温 .
A.该反应中,Al2O3是氧化剂
B.该反应中,N2是还原剂
C.该反应中,C是还原剂
D.该反应中每生成2molAlN,N2得到3mole- asdasg0g00h001年前1
asdasg0g00h001年前1 -
 AMY_10 共回答了17个问题
AMY_10 共回答了17个问题 |采纳率100%解题思路:反应Al2O3+N2+3C
2AlN+3CO中N元素化合价降低,被还原,N2为氧化剂,C元素化合价升高,被氧化,C为还原剂,Al和O元素的化合价没有变化,可根据化合价的变化计算转移的电子数目.高温 .反应Al2O3+N2+3C
高温
.
2AlN+3CO中N元素化合价降低,被还原,N2为氧化剂,C元素化合价升高,被氧化,C为还原剂,Al和O元素的化合价没有变化,该反应中每生成2molAlN,有1molN2参加反应,得到电子的物质的量为2×(3-0)mol=6mol,
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,解答本题的关键是能从化合价变化的角度判断.1年前查看全部
- 氮化铝是什么晶体?我老师说是离子晶体,我不是很确定……
 mirror12301年前1
mirror12301年前1 -
 月影寒幽 共回答了22个问题
月影寒幽 共回答了22个问题 |采纳率95.5%和AlCl3相似,氮化铝也是原子晶体 氮化铝是陶瓷的一种,其分子为变形四面体结构.
不要相信分子晶体和离子晶体的答案,高中书上没有,但大学教材里确实提到过
如果你们老师说...考试的话按她说的做...心里保持疑问就好了...1年前查看全部
- 氮化铝 在1300℃高温下,会发生怎样的变化?包括理化性质
氮化铝 在1300℃高温下,会发生怎样的变化?包括理化性质
如题,急用, mj78485551年前1
mj78485551年前1 -
 libradaisy 共回答了19个问题
libradaisy 共回答了19个问题 |采纳率89.5%AlN由高温条件下制的,高温下很稳定,属于原子晶体,高熔点,不发生理化变化1年前查看全部
- 氯化铝和氮化铝分别属于什么晶体,为什么
 maizi1年前2
maizi1年前2 -
 passcn 共回答了22个问题
passcn 共回答了22个问题 |采纳率86.4%氯化铝属于分子晶体,因为它有共价键而非离子键.
氮化铝属于原子晶体,因为它的熔点很高.1年前查看全部
- AlN 氮化铝之间是 共价键 还是 离子键 为什么?
 hchchc1年前4
hchchc1年前4 -
 wwwff 共回答了22个问题
wwwff 共回答了22个问题 |采纳率86.4%共价键啊.简单说是共用化合价.具体的是,氮化铝是原子晶体,构成原子晶体的微粒是原子,微粒间的作用力为共价键,因而原子晶体又可以称为共价晶体.分子间通过分子间作用力结合成的晶体,叫做分子晶体 绝大多数共价化合物都形成分子晶体,只有很少的一部分共价化合物形成原子晶体...1年前查看全部
- 请问氮化铝和水怎样反应?
 0o沫沫o01年前1
0o沫沫o01年前1 -
 镜双诚 共回答了15个问题
镜双诚 共回答了15个问题 |采纳率93.3%AlN + 3H2O== Al(OH)3+ NH31年前查看全部
- 请问氮化铝 中铝化合价是多少?
 不想上岸的小鱼1年前4
不想上岸的小鱼1年前4 -
 拔丝地瓜战烧鸭 共回答了25个问题
拔丝地瓜战烧鸭 共回答了25个问题 |采纳率76%+3价.因为氮是7号元素,它的核外电子为25,最外边电子数为5,超过了4,因为一般最外边电子为8才稳定,因此氮容易得3个电子,然而铝就刚好想反,为283,最外边电子数为3,若象氮一样得电子,那么就要得5个,而其最外边只有3个,因而失电子明显比得电子容易得多,所以铝会失去电子,显现+3的化合价!
希望你化学越来越棒!1年前查看全部
- 氮化铝和硝酸的反应式
 mk12451年前1
mk12451年前1 -
 ggwang 共回答了19个问题
ggwang 共回答了19个问题 |采纳率94.7%AlN+3HNO3=Al(NO3)3+NH31年前查看全部
- 氮化铝在常温下就遇水分解
 oza284781年前1
oza284781年前1 -
 4ouew 共回答了16个问题
4ouew 共回答了16个问题 |采纳率87.5%在水中可水解为氢氧化铝和氨气,但没有催化剂情况下水解速度较慢,而且通常氮化铝表面有氧化物薄层保护,参见http://zh.wikipedia.org/wiki/%E6%B0%AE%E5%8C%96%E9%8B%81.1年前查看全部
- 工业制得的氮化铝(AlN)产品中常含有少量、、等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和,的质量
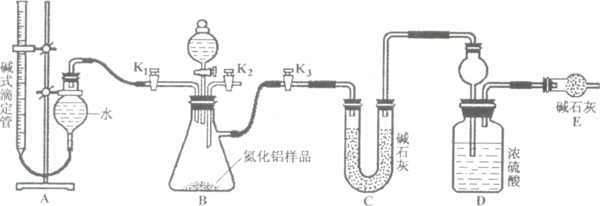
工业制得的氮化铝(AlN)产品中常含有少量、、等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和,的质量分数(忽略在强碱性溶液中的溶解).
(1)实验原理
①与硫酸反应可生成;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式
(2)实验装置(如图所示)
(3)实验过程
①连接实验装置,检验装置的气密性.称得D装置的质量为,滴定管的读数为mL.
②盛取AlN样品置于锥形瓶中;塞好胶塞,关闭活塞,打开活塞,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应.
③待反应进行完全后,关闭活塞,打开活塞,通过分液漏斗加入过量(填化学式),与烧瓶内物质充分反应.
④(填入该步应进行的操作)
⑤记录滴定管的读数为mL,称得D装置的质量为,
(4)数据分析
①AlN的质量分数为.
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积(填“偏大”、“偏小”或“无影响”).
③的质量分数为.(该实验条件下的气体摩尔体积为).
4小题,为什么偏小,并且请说出解决方案,小弟才疏学浅,请尽量讲的详细些, 谈笑多鸿儒1年前1
谈笑多鸿儒1年前1 -
 谁占了我的ss 共回答了13个问题
谁占了我的ss 共回答了13个问题 |采纳率100%读取滴定管中气体的体积时,液面左高右低,该气体也就是甲烷的压强大于大气压,气压大时气体体积会变小,所以测定气体甲烷的体积偏小.1年前查看全部
- 氧化铝 氮气 碳会在高温下反应生成氮化铝和一种有毒气体 求反应方程式
 龙笑笑1年前1
龙笑笑1年前1 -
 dakarll 共回答了20个问题
dakarll 共回答了20个问题 |采纳率80%Al2O3+N2+3C=2AlN+3CO 反应条件是高温1年前查看全部
- 氮化铝与氢氧化钠反应的化学方程式
 yumaoning1年前4
yumaoning1年前4 -
 zqhj 共回答了18个问题
zqhj 共回答了18个问题 |采纳率83.3%AlN+NaOH+H2O=NaAlO2+NH3↑1年前查看全部
- (1/2)氮化铝〔AlN,Al和N的相对原子质量分别为27和14〕广泛应用于电子、陶瓷等工业领域.在一定条件下...
(1/2)氮化铝〔AlN,Al和N的相对原子质量分别为27和14〕广泛应用于电子、陶瓷等工业领域.在一定条件下...
(1/2)氮化铝〔AlN,Al和N的相对原子质量分别为27和14〕广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2
 小小猪嘟嘟1年前1
小小猪嘟嘟1年前1 -
 wzs7168 共回答了19个问题
wzs7168 共回答了19个问题 |采纳率89.5%上述反应中每生成 2 mol AlN,N2 得到 3 mol 电子,所以题目的信息不全,但是建议楼主查看下电子的得失数,每转移3 mol 电子,就生成 2 mol AlN.1年前查看全部
- (2012•泉州模拟)氮化铝(AlN)是“LED”节能光源的制作材料之一.氮化铝中,Al的化合价为+3,则N的化合价是(
(2012•泉州模拟)氮化铝(AlN)是“LED”节能光源的制作材料之一.氮化铝中,Al的化合价为+3,则N的化合价是( )
A.+3
B.-3
C.+1
D.-1 没有zz的明治1年前1
没有zz的明治1年前1 -
 小路标 共回答了19个问题
小路标 共回答了19个问题 |采纳率73.7%解题思路:根据化合物中正负化合价代数和为零的原则进行解答本题.铝元素的化合价是+3价,根据在化合物中正负化合价代数和为零的原则,设氮化铝中氮元素的化合价为x,可得
(+3)+x=0
则x=-3,
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零进行计算化合物中指定元素的化合价的能力,难度不大.1年前查看全部
大家在问
- 1若对任意的实数a,函数 f(x)= 1 4 sin(kx+ π 3 )- 1 2 (k>0) , x∈[a- π 3 ,
- 2people will use money in100 yeas.改为一般疑问句
- 3LI LEI found that watching Beijing Opera was boring {同义句替换}
- 4甲乙两人参加数学竞赛,每做对一题得20分,每错一题倒扣12分,两人各做了10题,共得208分,其中甲比乙多得64分,甲乙
- 5解方程:1.8/0.3-x=2
- 6英语小问题根据句意及首字母补全单词1.I'm s_______ my money so I can buy a new
- 7A型、B型、C型三种普通平键各有什么特点?分别适合用于什么场合?轴上的键槽是如何加工的?
- 8我的五年计划初三作文
- 9复数范围内分解因式:x^3-x^2+2x=
- 10SiH4中硅元素的化合价是+4还是-4?
- 11解二元一次方程组:{3x+2y=13 {5x-3y=9
- 12fantastic baby怎么读
- 13--Do you know when it was that they got to know each other -
- 14英语翻译这样对吗---we have been a long time without conneting
- 15滑轮组的动滑轮上有n段绳子,则当总重力为G时,提升时可省 G的力