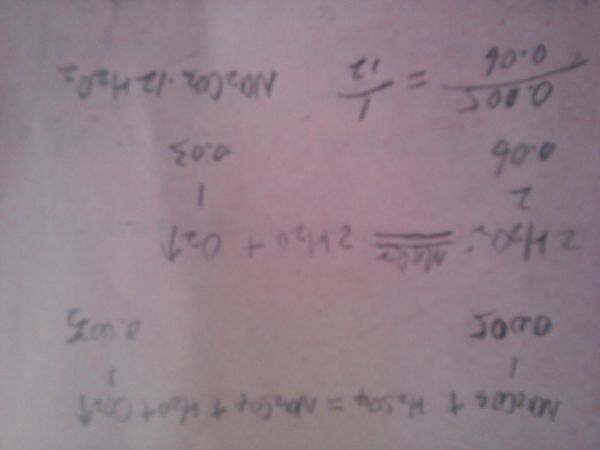过碳酸钠俗称固体双氧水,被大量应用于洗涤,印染,纺织,造纸,医药,卫生等领域中,它的制备原理和路线如下
 lengzy2022-10-04 11:39:541条回答
lengzy2022-10-04 11:39:541条回答2Na2CO3+3H2O2=2Na2CO3•3H2O2 ΔH<0
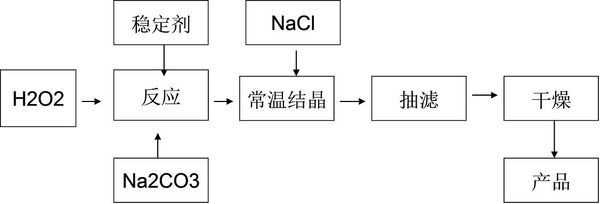
回答下列问题
(1)下列物质可以使过碳酸钠较快失效的是______
a.MNO2 b.H2S c.稀硫酸 d.NaHCO3
(2)加入NaCl的实验操作是——,作用是——
(3)工业纯碱中含有Fe3+生成稳定的配合物,Fe3+对反应的不良影响是——

已提交,审核后显示!提交回复
共1条回复
 未来木木 共回答了11个问题
未来木木 共回答了11个问题 |采纳率81.8%- 解析: (1)固碳酸钠2Na2CO3•3H2O2 ,具备Na2CO3,H2O2的化学性质 a.Mn02催化H2O2分解~ 方程式:2H2O2==MnO2==2H2O+O2↑,使过碳酸钠较快失效 b.H202的氧化性和H2S的还原性~方程式:H202+H2S=S↓+H20,使过碳酸钠较快失效 c.H2SO4与Na2C03反应~方程式:Na2CO3+H2SO4 = Na2SO4+H2O+CO2↑, 使过碳酸钠较快失效 d.不反应 (2)加入NaCl的实验操作是应为搅拌~加入的NaCl是固体,需要溶解 作用是降低2 Na2CO3·3H2O2的溶解度,以便析出更多晶体 (3)FeCl3会催化H2O2分解~ 方程式:2H2O2==FeCl3==2H2O+O2↑答案: (1)abc(2)降低2 Na2CO3·3H2O2的溶解度,析出更多晶体(3)催化双氧水的分解反应很高兴为你解答,祝你学习进步O(∩_∩)O 有不明白的可以追问!如果认可我的回答. 请点击下面的【选为满意回答】按钮,谢谢!
- 1年前
相关推荐
- 过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3•3H2O2,它具有Na2CO3和H2O2的双重
过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3•3H2O2,它具有Na2CO3和H2O2的双重性质.过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是( )
A. MnO2
B. KMnO4溶液
C. 稀盐酸
D. Na2SO3溶液 贼哥22581年前1
贼哥22581年前1 -
 ylp665 共回答了22个问题
ylp665 共回答了22个问题 |采纳率68.2%解题思路:Na2CO3•3H2O2具有Na2CO3和H2O2的双重性质,过碳酸钠只发生了氧化反应,表现为还原性;A.在MnO2作用下,过氧化氢自身发生氧化还原反应,既表现出氧化性又表现出还原性,故A不选;
B.KMnO4溶液与过碳酸钠发生氧化还原反应,被氧化,过碳酸钠表现出还原性,故B选;
C.盐酸和过碳酸钠反应生成二氧化碳气体,没有发生氧化还原反应,故C不选;
D.Na2SO3溶液与过碳酸钠发生氧化还原反应,过碳酸钠表现出氧化性,故D不选.
故选B;点评:
本题考点: 过氧化氢.
考点点评: 本题考查氧化还原反应,题目难度不大,注意把握相关物质的性质,特别是过氧化氢的性质,从元素化合价的认识氧化还原反应的相关概念和性质.1年前查看全部
- (2011•黄浦区二模)过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
 (2011•黄浦区二模)过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
(2011•黄浦区二模)过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
已知:过碳酸钠与硫酸溶液反应的化学方程式如下:
Na2CO4+H2SO4→Na2SO4+H2O2+CO2↑2H2O2→2H2O+O2↑
为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为-具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中.
(1)Q内发生反应生成的气体为______.在样品中加入少量二氧化锰的目的是______.导管a作用是______.
(2)为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭______(填K1、K2或K3,下同).打开______.
(3)当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是______,b中装的碱石灰的作用是______,为何要缓缓打开K1的理由是______.
(4)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是______(式量:Na2C2O4-122,Na2CO3-106).
(5)某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是______
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积. 多少楼台1年前1
多少楼台1年前1 -
 y909543997 共回答了13个问题
y909543997 共回答了13个问题 |采纳率92.3%解题思路:(1)根据复分解反应的条件和氧气的实验室制法可判断气体产物,实验时,为保证液体顺利流下,应平衡分液漏斗上、下的压强;
(2)利用进入量筒的水的体积等于气体的体积,关掉K1、K2,打开K3后,可以保证反应生成的气体全部进入集气瓶,然后迫使液体进入量筒,这样进入量筒的水的体积更接近反应生成气体的体积;
(3)根据碱石灰的性质和压强的变化即可判断;
(4)根据化学方程式计算出碳酸钠的质量并计算碳酸钠和双氧水的物质的量;
(5)过碳酸钠的比例偏大,就是说氧气的质量偏大,量筒I测的是总的气体的体积,量筒Ⅱ测的是氧气的体积,氧气的高低决定过碳酸钠的纯度高低,以此进行分析.(1)碳酸钠和稀硫酸反应生成气体二氧化碳,双氧水和二氧化锰反应生成氧气,实验时,为保证液体顺利流下,应平衡分液漏斗上、下的压强,保证气体体积测量准确,
故答案为:CO2、O2;使双氧水完全分解成氧气;平衡分液漏斗上、下的压强,使稀H2SO4顺利滴下;
(2)根据量筒中水的体积就是化学反应生成的气体的体积,关掉K1、K2,打开K3后,可以保证反应生成的气体全部进入集气瓶,然后迫使液体进入量筒,这样进入量筒的水的体积更接近反应生成气体的体积,故答案为:K1、K2;K3;
(3)这是一个压强的变化问题,打开K1后,由于气球内部压强大于外部压强,气体会逐渐进入导管和水槽;二氧化碳被碱石灰吸收,氧气进入水槽,
故答案为:气球Q慢慢缩小,左侧导管有气泡生成;吸收二氧化碳;控制气体流速,使CO2被充分吸收;
(4)设草酸钠的质量为m1,碳酸钠的质量为m2,根据题意可知,氧气的体积为yml,两个反应共生成气体xml,草酸钠上层二氧化碳为2yml,所以碳酸钠生成二氧化碳为(x-3y)ml,则可进行下面计算,
∵Na2CO4+H2SO4→Na2SO4+H2O2+CO2↑2H2O2→2H2O+O2↑
122g 1mol 2mol 1mol
m1
2y×10−3L
22.4L/mol
2y×10−3L
22.4L/mol
y×10−3L
22.4L/mol
m1=
2y×10−3
22.4moL ×122g/mol
又因为Na2CO3~CO2↑
106g 1mol
m2
(x−3y)×10−3L
22.4L/mol
m2=
(x−3y)×10−3
22.4mol ×106g/mol
则ω(过碳酸钠)=
2y×10−3
22.4moL ×122g/mol÷(
2y×10−3
22.4moL ×122g/mol+
(x−3y)×10−3
22.4mol ×106g/mol)×100%=[12200y/(53x-37y)]%
故答案为::[12200y/(53x-37y)]%;
(5)A、量筒Ⅱ测的体积小,即氧气的体积小,则过碳酸钠的纯度低,故A错误;
B、量筒Ⅱ读数时,量筒液面高于水槽液面,则量筒内气体的压强小,气体的偏大,结果偏大,故B正确;
C、总的气体体积减小,则样品的总质量相当于减小,因此算得过碳酸钠的纯度偏高,故C正确;
D、不影响.
故答案为:BC.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查较为综合,难度较大,本题易错点为草酸钠含量的计算,注意两个量筒的气体的成分以及与反应物质的量的关系.1年前查看全部
- 过碳酸钠俗称固体双氧水,是一种很好的消毒剂和供氧剂,化学式可表示为Na2CO3·xH2O2,它具有Na2CO
过碳酸钠俗称固体双氧水,是一种很好的消毒剂和供氧剂,化学式可表示为Na2CO3·xH2O2,它具有Na2CO3和H2O2的双重性质.现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量的MnO2粉末,充分反应后生成672 mL气体(标准状况).反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水准确配成500 mL溶液A.现向三份体积为50 mL、浓度为c的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:

请回答下列问题:
(1)配置溶液A用到的玻璃仪器有:_________________________ _________ _.(2)稀硫酸的物质的量浓度c=________ mol·L-1.
(3)通过计算可确定x的值为________________ .样品的质量为 (4)现将0.2 g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0 mL 1 mol·L-1硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1 mol·L-1 Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00 mL,计算该样品的纯度(要求写出计算过程).
(已知:2Na2S2O3+I2===Na2S4O6+2NaI)
只用回答第3小题过程,急 daoww1年前1
daoww1年前1 -
 zhouyou1979 共回答了21个问题
zhouyou1979 共回答了21个问题 |采纳率100%1年前查看全部
- 为贮存、运输、使用的方便,工业上常将H 2 O 2 转化为固态的过碳酸钠晶体(其化学式为2Na 2 CO 3 ?3H 2
为贮存、运输、使用的方便,工业上常将H 2 O 2 转化为固态的过碳酸钠晶体(其化学式为2Na 2 CO 3 ?3H 2 O 2 ),该晶体具有Na 2 CO 3 和H 2 O 2 的双重性质。下列物质不会使过碳酸钠晶体较快失效的是()
A.MnO 2 B.H 2 S C.稀硫酸 D.NaHCO 3  吃肥肉的猪1年前1
吃肥肉的猪1年前1 -
 _爱的是你_ 共回答了21个问题
_爱的是你_ 共回答了21个问题 |采纳率85.7%D
A能,二氧化锰可作为过氧化氢的催化剂;B能,硫化氢气体具有还原性,过氧化氢具有氧化性,两者会发生氧化还原反应;C能,碳酸钠能与稀硫酸发生反应;D不能;即正确选项为D;1年前查看全部
- 过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验.
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验.
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度.
【实验原理】2Na2CO4 + 4HCl ===== 4NaCl + 2CO2↑+ O2↑+ 2H2O
【实验装置】
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度.
(1)装置②的作用是:;
(2)装置③的作用是:;
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25 L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于 g;
Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7 g.则该样品的纯度为 .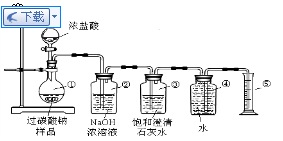
 rock妹妹1年前1
rock妹妹1年前1 -
 huoliboy 共回答了23个问题
huoliboy 共回答了23个问题 |采纳率82.6%1)2 的作用是 除掉CO2 CO2+2NaOH==Na2CO3 +H2O2) 3的作用是 检验CO2有没有除干净. 若没有除干净则石灰水变浑浊2Na2CO4 ~~~O22*122 32x 0.25*1.28x==2*122*0.25*1.28/32==2.44...1年前查看全部
- (2012•白下区二模)过氧化氢被称为“绿色氧化剂”,为了便于贮存和运输,工业上常将其转化为过碳酸钠晶体(2Na2CO3
(2012•白下区二模)过氧化氢被称为“绿色氧化剂”,为了便于贮存和运输,工业上常将其转化为过碳酸钠晶体(2Na2CO3•3H2O2),该晶体具有Na2CO3和H2O2的双重性质.下列物质不会使过碳酸钠晶体失效的是( )
A.二氧化锰
B.石灰水
C.盐酸
D.氯化钠 不会游泳的妮眸1年前1
不会游泳的妮眸1年前1 -
 痛快的感受 共回答了14个问题
痛快的感受 共回答了14个问题 |采纳率85.7%解题思路:本题考查的是盐的化学性质,考查了盐与碱、盐与酸的反应.根据题目给出的信息:该晶体具有Na2CO3和H2O2的双重性质,因此加入二氧化锰时,做了过氧化氢的催化剂;碳酸钠和石灰水反应生成碳酸钙白色沉淀和氢氧化钠,碳酸钠和盐酸反应生成氯化钠和水和二氧化碳;氯化钠与Na2CO3和H2O2都不反应.A、加入二氧化锰时,做了过氧化氢的催化剂,因此过碳酸钠晶体失效,故选项错误;
B、碳酸钠和石灰水反应生成碳酸钙白色沉淀和氢氧化钠,因此过碳酸钠晶体失效,故选项错误;
C、碳酸钠和盐酸反应生成氯化钠和水和二氧化碳,因此过碳酸钠晶体失效,故选项错误;
D、氯化钠与Na2CO3和H2O2都不反应.因此过碳酸钠晶体不失效,故选项正确;
故选D点评:
本题考点: 盐的化学性质;实验室制取氧气的反应原理.
考点点评: 本考点属于盐的化学性质和制氧气的原理,盐的化学性质有四个:盐与金属反应、盐与酸反应、盐与碱反应、盐与盐反应.解决本考点需要根据实验现象,综合分析,从而得出正确的结论.此考点主要出现在选择题、和实验题中.1年前查看全部
- 生活中用到各种漂白剂。化学课上,老师带来一种常用作氧系漂白剂的物质,可能是双氧水(H 2 O 2 )、过碳酸钠(2Na
生活中用到各种漂白剂。化学课上,老师带来一种常用作氧系漂白剂的物质,可能是双氧水(H 2 O 2 )、过碳酸钠(2Na 2 CO 3 ·3H 2 O 2 )和过氧化钙(CaO 2 )中的一种。同学们观察发现,该漂白剂为白色粉末(右图)。

【提出猜想】该漂白剂肯定不是 。
【查阅资料】①过碳酸钠是一种白色结晶颗粒,溶于水时,分解生成碳酸钠
和过氧化氢。
②过氧化氢常温下不稳定,实验室用过氧化氢制取氧气的化学方程式为 。
③过氧化钙,白色固体,难溶于水。与水反应缓慢释放氧气,同时生成一种碱,反应的化学方程式为 。
【实验验证】同学们设计了下列实验方案进行验证,请将方案的空格填写完整。
【交流反思】小刚认为根据步骤1可确定白色固体的成分,不需要后两步实验,理由是 。小强认为不行,小强反对的理由是 。实验步骤 实验操作 实验现象 结论 步骤1 取2g白色固体放入试管中,加入5ml水,充分振荡。 液体浑浊,
有持续的细小气泡冒出。步骤2 向步骤1的试管中继续滴加无色酚酞。 无色酚酞变红。 步骤3 。 。 该消毒剂的成分不是过碳酸钠。  椰子树上的鲁滨逊1年前1
椰子树上的鲁滨逊1年前1 -
 骑兵之礼 共回答了18个问题
骑兵之礼 共回答了18个问题 |采纳率100%实验现象2分,其他每空1分,其他合理答案得分
提出猜想:H 2 O 2
查阅资料:②2H 2 O 2 2H 2 O + O 2 ↑
2H 2 O + O 2 ↑
③ 2CaO 2 + 2H 2 O = 2Ca(OH) 2 + O 2 ↑
实验验证:操作——向试管中滴加稀盐酸,将产生的气体通入澄清石灰水
现象——溶液红色消失,有气泡产生,澄清石灰水不变浑浊
交流反思:小刚:溶液浑浊,说明该漂白剂难溶于水,而过氧化钙难溶于水,过碳酸钠能溶于水,说明该漂白剂是过氧化钙
小强:一定量的水中固体不完全溶解,可能是因为固体不溶,也可能是因为水量不足,溶解达到饱和,所以不能确定是过氧化钙。
分析:【提出猜想】根据双氧水是液态进行分析;
【查阅资料】②根据实验室过氧化氢制氧气的原理进行分析;
③根据题中的叙述找出反应物、生成物书写方程式;
【实验验证】根据结论分析添加的试剂和发生的现象进行分析;
【交流反思】根据过氧化钙、过碳酸钠和水会生成气体进行分析.
【提出猜想】该漂白剂为白色粉末,而双氧水是液态的,所以不是双氧水,故答案为:双氧水;
【查阅资料】②双氧水在二氧化锰的催化作用下生成水和氧气,故答案为:2H 2 O 2 2H 2 O+O 2 ↑;
2H 2 O+O 2 ↑;
根据质量守恒定律可知该碱是氢氧化钙,过氧化钙和水反应会生成氢氧化钙和氧气,故答案为:2CaO 2 +2H 2 O═2Ca(OH) 2 +O 2 ↑;
【实验验证】从结论中可以看出该步骤检验的是碳酸钠,检验碳酸盐常加入酸,
实验步骤
实验操作
实验现象1年前查看全部
- (2010•诸城市模拟)过碳酸钠(2Na2CO3•3H2O2)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特
(2010•诸城市模拟)过碳酸钠(2Na2CO3•3H2O2)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下.
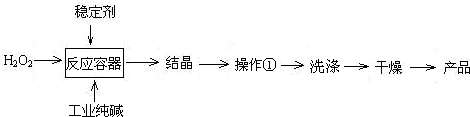
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液一定显______(“酸性”、“碱性”或“中性”).
(2)操作①需要的玻璃仪器有______(填写仪器名称).
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量.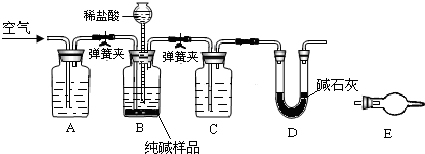
①要检验工业纯碱中杂质的存在,最好选用下列试剂中的______(选填序号).
A.氢氧化钡溶液B.稀硝酸C.硫氰化钾溶液D.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若______,说明装置不漏气.
③装置A的作用是______.装置C中的试剂为______.
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?______(选填“必要”或“不必要”),判断的理由是______. 欧阳夏子1年前1
欧阳夏子1年前1 -
 zi_ye700800 共回答了27个问题
zi_ye700800 共回答了27个问题 |采纳率85.2%解题思路:(1)过碳酸钠溶于水溶液中碳酸根离子水解显碱性;
(2)操作①是过滤操作,依据装置写出需要的玻璃仪器;
(3)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸;
②依据B中长颈漏斗和广口瓶中液面变化分析判断;
③装置A是为了吸收空气中二氧化碳避免影响碳酸钠含量的测定;装置C是浓硫酸干燥生成的二氧化碳气体,在D装置中吸收后称量至恒重;
(4)U性管是吸收二氧化碳气体称重来测定碳酸钠含量的方法,若与空气直接接通,会吸收空气中二氧化碳和水蒸气影响测定结果.(1)过碳酸钠溶于水后所得溶液,在水溶液中能解离成过氧化氢与碳酸钠,过氧化氢溶液是极弱的弱酸,而碳酸钠在水中由于水解会显示碱性,故答案为:碱性;
(2)操作①是过滤分离固体和溶液,过滤装置需要的玻璃仪器为漏斗、烧杯、玻璃棒,故答案为:普通漏斗、烧杯、玻璃棒;
(3)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸,
A.氢氧化钡溶液 不能检验氯离子存在,故A不选;
B.稀硝酸 验证生成的氯化银不溶,故B选;
C.硫氰化钾溶液是检验铁离子的存在,不能检验氯离子,故C不选;
D.硝酸银溶液和氯离子反应生成白色沉淀,加入稀硝酸不溶证明含有氯离子,故D选;
故答案为:BD;
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
故答案为:漏斗中与试剂瓶中的液面差保持不再变化或漏斗中的液面不再下降;
③装置A是为了吸收空气中二氧化碳,避免影响碳酸钠含量的测定;装置C是浓硫酸干燥生成的二氧化碳气体,在D装置中吸收后称量至恒重,
故答案为:除去空气中CO2,防止影响测量结果;浓硫酸;
④U性管是吸收二氧化碳气体称重来测定碳酸钠含量的方法,若与空气直接接通,会吸收空气中二氧化碳和水蒸气测定结果偏高,影响测定结果的准确性,
故答案为:必要;因为装置E会吸收空气中的二氧化碳和水蒸气,影响测量结果.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了制备物质的实验方案设计和含量测定实验,物质性质和测定过程中的干扰分析是解题关键,注意装置的连接和试剂的作用,题目难度中等.1年前查看全部
- 下列物质不会使过碳酸钠晶体失效的是?为什么?
下列物质不会使过碳酸钠晶体失效的是?为什么?
A.二氧化锰 B.H2S C.稀盐酸 D.碳酸氢钠
可以用同一原理解释的是?讲具体点谢谢
A.乙烯与二氧化硫都能使溴水褪色
B.氢氧化钠和纤维素都能与醋酸反应
C.烧碱和乙酸的溶液都能使酚酞试液变红
D.向乙醛和葡萄糖溶液中加入新制氢氧化铜,加热,都有砖红色沉淀产生
在已知25mL的酸式滴定管中盛入0.1mol/L HCL溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1mol/L NaOH溶液进行中和.则所需NaOH溶液的体积
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到4moL Fe(OH)3沉淀,此间共消耗的水的物质的量为
A.8mol B.10mol C.11mol D.12mol 灿烂心空1年前1
灿烂心空1年前1 -
 liushaGG 共回答了15个问题
liushaGG 共回答了15个问题 |采纳率100%1.D
过碳酸钠为Na2CO3.2H2O2,二氧化锰会催化H2O2分解生成水和氧气,H2S和H2O2发生氧化还原反应,稀盐酸和Na2CO3反应,故选D
2.D
A(加成、氧化还原)B(中和、取代)C(碱的通性、取代)D(氧化)
3.A
25ML的滴定管中可以盛放大于25ML的液体,25只是其最大刻度
4.B
在电解时.铁只能被氧化成+2价,所以消耗水8mol(电解时1mol水提供1mol电子)氢氧化亚铁氧化根据系数4214可知消耗水2mol,共10mol1年前查看全部
- 过碳酸钠(Na 2 CO 4 )和盐酸反应的化学方程式为2Na 2 CO 4 +4HCl═4NaCl+2CO 2 ↑+O
过碳酸钠(Na 2 CO 4 )和盐酸反应的化学方程式为2Na 2 CO 4 +4HCl═4NaCl+2CO 2 ↑+O 2 ↑+2H 2 O,商品过碳酸钠中往往含有少量的碳酸钠,为了测定其纯度,现称取0.9g样品进行实验.供实验选用的仪器、试剂如图所示. 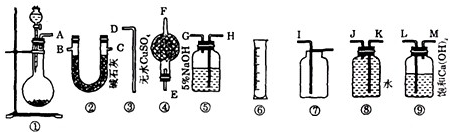
(1)为了使实验尽可能简单,应选用的装置是______(填编号①、②、…).
(2)所选用的装置的连接顺序是______(填字母,胶管已略去).
(3)为了能通过实验和计算求得样品的纯度.应通过排水量气装置测定出氧气的体积,若所测定的氧气的体积折算为质量表示,且为mg,则样品中Na 2 CO 4 的质量分数为______. chao9261年前1
chao9261年前1 -
 zsg36 共回答了17个问题
zsg36 共回答了17个问题 |采纳率94.1%(1)过碳酸钠和盐酸反应为固体和液体反应且不需要加热,故选择装置①.要测定生成氧气的量,需要先除去二氧化碳,可用氢氧化钠溶液吸收二氧化碳,再通入水中,F量筒中水的体积即为E装置中氧气排开水的体积,二者体积相等.则为了使实验尽可能简单,应选用的装置是 ①⑤⑧③⑥;
(2)由(1)分析,可知:所选用的装置的连接顺序是 AHGJKD;
(3)依据测定的氧气体积计算物质的量,结合化学方程式计算过碳酸钠物质的量计算得到质量分数,样品质量0.9g,测定的氧气的体积折算为质量表示,且为mg,依据其化学方程式为:
设反应的过碳酸钠的质量为x.
2Na 2 CO 4 +2H 2 SO 4 ═2Na 2 SO 4 +2CO 2 ↑+O 2 ↑+2H 2 O,
24432
x mg
则
244
x =
32
mg ,解得x=
61mg
8 ,故反应的过碳酸钠的质量
61mg
8 ,
则该样品中Na 2 CO 4 的质量分数=
61mg
8
0.9g ×100%=
305m
36 ×100%,
故答案为:
(1)①⑤⑧③⑥.(2)AHGJKD.(3)
305m
36 ×100%.1年前查看全部
- 过碳酸钠是一种有多用途的新型氧系固态漂白剂...
过碳酸钠是一种有多用途的新型氧系固态漂白剂...
过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3•3H2O2,它具有Na2CO3和H2O2的双重性质.过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是________
A.MnO2 x05B.KMnO4溶液 x05C.稀盐酸 x05D.Na2SO3溶液
为什么? senbiogy1年前2
senbiogy1年前2 -
 javon1987128 共回答了16个问题
javon1987128 共回答了16个问题 |采纳率100%答案是B
H2O2既有氧化性又有还原性
氧化性,例如
H2O2 + 2I- + 2H+ = I2 + 2H2O
还原性,例如
H2O2+H2S=S↓+2H2O
应为KMnO4的氧化性比H2O2强,故H2O2显示了还原性
5H2O2 + 2MnO4- + 6H+ = 2Mn2+ + 5O2↑ + 8H2O
而NaCO3不与KMnO4反应
故整体只体现了还原性,发生了氧化反应.
A项H2O2是还原反应,B项体现了碱性,因为NaCO3显碱性,D项也是发生了还原反应.1年前查看全部
- “过碳酸钠”(化学式可表示为2Na2CO3•3H2O2)俗称固体双氧水,极易分解,它既有碳酸盐的性质,又有双氧水的不稳定
“过碳酸钠”(化学式可表示为2Na2CO3•3H2O2)俗称固体双氧水,极易分解,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域.现将一定质量的过碳酸钠粉末溶于m克水中配成稀溶液,再向其中加入适量二氧化锰粉末,充分反应后生成4.8g气体.将反应后的混合物过滤,测得滤液的溶质质量分数为10.6%,求m.(不考虑损耗)
 idlee_nj1年前1
idlee_nj1年前1 -
 morgenlee 共回答了17个问题
morgenlee 共回答了17个问题 |采纳率88.2%解题思路:根据题意,“过碳酸钠”(化学式可表示为2Na2CO3•3H2O2)俗称固体双氧水,极易分解,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,则将一定质量的过碳酸钠粉末溶于m克水中配成稀溶液,再向其中加入适量二氧化锰粉末,反应后生成碳酸钠、水和氧气,由生成氧气的质量,计算出滤液中溶质的质量,进而由滤液的溶质质量分数为10.6%,求出m的数值即可.设生成碳酸钠的质量为x,生成水的质量为y,
2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑
424108 96
x y 4.8g
[424/96=
x
4.8g] x=21.2g
[108/96=
y
4.8g] y=5.4g
所得滤液中的溶质质量分数为
21.2g
21.2g+5.4g+m×100%=10.6% m=173.4g.
答:m的数值为173.4.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不大,掌握根据化学方程式与溶质质量分数的计算方法是正确解答本题的关键,解题时要注意解题的规范性.1年前查看全部
- (2008•洛阳模拟)过碳酸钠(Na2CO4)跟稀硫酸反应的化学方程式如下:
(2008•洛阳模拟)过碳酸钠(Na2CO4)跟稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4═2Na2SO4+2CO2↑+O2↑+2H2O
今有如图所示装置可供选择,请回答: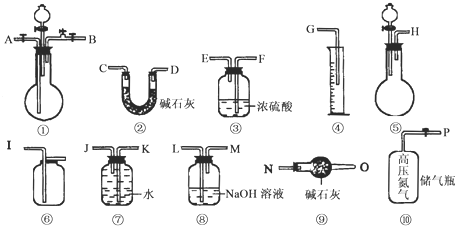
(1)若过碳酸钠中含有少量碳酸钠杂质,欲测定该样品中Na2CO4的质量分数:
①应选用的仪器是______(填代号),
②请叙述读取量筒数据的正确方法:______.
③若样品质量25g,测得气体体积为2.24L(标准状况),则该样品中Na2CO4的质量分数为______.
(2)若过碳酸钠中含有少量过氧化钠(2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O)杂质,欲测定该样品中Na2CO4的质量分数:
①仪器接口的连接顺序为P-A-B-______-______-______-______-______;
②高压氮气的作用是______;
③若相关装置反应前后的质量分别为w1g和w2g,样品质量为ng,则该样品中Na2CO4的质量分数为
×100%61(W2−W1) 22n .(用w1、w2、n表示)
×100%61(W2−W1) 22n  灌水者万水1年前1
灌水者万水1年前1 -
 狼啸ス癡訫 共回答了16个问题
狼啸ス癡訫 共回答了16个问题 |采纳率87.5%解题思路:(1)①测定Na2CO4的质量分数,样品和稀硫酸反应生成的气体中含有二氧化碳和氧气,需要吸收二氧化碳后测定氧气的体积进行计算得到过碳酸钠的质量分数,实验装置中的空气必须赶净后减小实验,据此选择装置和仪器;
②排水量气装置排出的水的条件即为生成氧气的体积,读数需要量筒和广口瓶中的液面相同时准确读取;
③依据测定的氧气体积计算物质的量,结合化学方程式计算过碳酸钠物质的量计算得到质量分数;
(2)①若过碳酸钠中含有少量过氧化钠,则需要测定和硫酸反应生成的二氧化碳气体体积进行计算测定,选择需要的实验装置,判断分析连接装置仪器接口顺序;
②氮气是把装置中的空气赶净,避免空气中的二氧化碳影响测定结果;
③依据装置增重为水蒸气和二氧化碳的质量结合化学方程式计算得到样品中过碳酸钠的质量分数.(1)①测定Na2CO4的质量分数,样品和稀硫酸反应生成的气体中含有二氧化碳和氧气,需要吸收二氧化碳后测定氧气的体积进行计算得到过碳酸钠的质量分数,实验装置中的空气必须赶净后减小实验,据此选择装置和仪器为,⑤制备二氧化碳气体通过①可以驱赶整套装置中的空气,①中发生过碳酸钠和硫酸反应生成二氧化碳和氧气,通过⑧氢氧化钠溶液吸收二氧化碳,通过⑦导气管短进长出,排水法测定氧气的体积,排出的水进入④量筒中读取生成氧气的体积;选择的装置为⑤①⑧⑦④,
故答案为:⑤①⑧⑦④;
②排水量气装置排出的水的条件即为生成氧气的体积,读数需要量筒和广口瓶中的液面相同时准确读取,正确的操作是:调整量筒液面高度与⑦为同一水平后,才能读数,眼睛平视,并与凹液面相切,
故答案为:调整量筒液面高度与⑦为同一水平后,才能读数,眼睛平视,并与凹液面相切;
③依据测定的氧气体积计算物质的量,结合化学方程式计算过碳酸钠物质的量计算得到质量分数,样品质量25g,测得气体氧气体积为2.24L(标准状况)物质的量为0.1mol,依据化学方程式,2Na2CO4+2H2SO4═2Na2SO4+2CO2↑+O2↑+2H2O,反应的过碳酸钠物质的量为0.2mol,则该样品中Na2CO4的质量分数=[0.2mol×122g/mol/25g]×100%=97.6%,故答案为:97.6%;
(2)①若过碳酸钠中含有少量过氧化钠,则需要测定和硫酸反应生成的二氧化碳气体体积进行计算测定,选择需要的实验装置,为⑩利用氮气赶净装置中的空气,利用③吸收反应生成的水,利用②吸收二氧化碳气体,利用⑨避免空气中的二氧化碳和水蒸气进入干燥管干扰测定结果,所以通过判断分析连接装置仪器接口顺序为P-A-B-F-E-C-D-N,故答案为:F;E;C;D;N;
②高压氮气的作用是排出装置中单位空气,避免空气中的二氧化碳干扰测定结果,故答案为:氮气是将反应生成的CO2全部赶入吸收装置中;
③依据装置增重为吸收二氧化碳的质量,结合化学方程式计算得到样品中过碳酸钠的质量分数,反应前后的质量分别为w1g和w2g,则反应生成的二氧化碳质量=(W2-W1)g,物质的量=
W2−W1
44mol,依据化学方程式计算得到过碳酸钠物质的量=
W2−W1
44mol,样品质量为ng,则该样品中Na2CO4的质量分数=
W2−W1
44×122
n×100%=
61(W2−W1)
22n×100%,故答案为:
61(W2−W1)
22n×100%.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查了物质性质的实验验证方法和实验设计分析判断,装置选择和产物验证方案的设计是解题个,注意实验测定的目的和验证产物判断,题目难度中等.1年前查看全部
- (2014•泰安模拟)小明同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上
(2014•泰安模拟)小明同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验.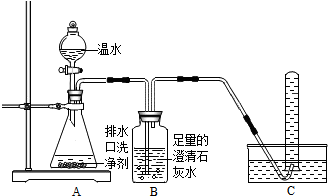
要保证实验的效果,实验装置要有良好的气密性,检查A装置气密性的方法是______.
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体分别是______、______(填化学式).
【探究二】
(1)实验过程:
教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究: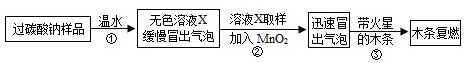
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是______;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种.
写出上述实验探究中②反应的化学方程式2H2O2
2H2O+O2↑MnO2 .2H2O2.
2H2O+O2↑MnO2 .
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3+CaCl2═CaCO3↓+2NaCl
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同.
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验.请将下列实验方案填写完整.
(6)实验反思:①根据资料,NaHCO3溶液能与石灰水反应生成白色沉淀.于是,同学们猜想:碳酸氢钠与氢氧化钠是否反应?______(如反应,请写出化学方程式,如不反应此空不填).②Na2CO3、NaHCO3两种物质性质上既有共性又有差异,其差异性可用于鉴别、______.实验操作 主要实验现象 结论 ① 证明溶液中有Na2CO3 ② 证明溶液中既无NaHCO3又无NaOH  布丁蛋塔1年前1
布丁蛋塔1年前1 -
 董庆森 共回答了19个问题
董庆森 共回答了19个问题 |采纳率100%解题思路:【探究一】
凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
二氧化碳能使澄清石灰水变浑浊,氧气能够支持燃烧,能使带火星的木条复燃;
【探究二】
通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
根据实验结论可以判断实验现象;
碳酸氢钠和氢氧化钠反应能生成碳酸钠和水;
根据物质的性质可以确定物质的用途.【探究一】
检查A装置气密性的方法是:关闭分液漏斗的活塞,将导气管一端浸没水中,手握锥形瓶的外壁,若导管口冒气泡,则气密性良好.
故填:关闭分液漏斗的活塞,将导气管一端浸没水中,手握锥形瓶的外壁,若导管口冒气泡则气密性良好.
B中的澄清石灰水变浑浊,说明有二氧化碳产生;C中收集到的气体能使燃着的木条燃烧更旺,说明有氧气产生;
由此得出结论:生成的两种气体分别是二氧化碳和氧气,化学式分别为CO2、O2.
故填:CO2;O2.
【探究二】
(3)根据以上实验现象,X溶液中一定存在的溶质是过氧化氢,过氧化氢在二氧化锰的催化作用下分解的化学方程式为:2H2O2
MnO2
.
2H2O+O2↑.
故填:过氧化氢;2H2O2
MnO2
.
2H2O+O2↑.
(5)实验操作、主要实验现象如下表所示:
实验操作 主要实验现象 结论
取溶液X适量于试管中,加入过量氯化钙溶液 出现白色沉淀 证明溶液中有碳酸钠
取①中反应后上层清液适量,加入酚酞试液 不变色 证明溶液中既无碳酸氢钠又无氢氧化钠(6)①碳酸氢钠能和氢氧化钠反应生成碳酸钠和水,反应的化学方程式为:NaHCO3+NaOH=Na2CO3+H2O.
故填:NaHCO3+NaOH=Na2CO3+H2O.
②Na2CO3、NaHCO3两种物质性质上既有共性又有差异,其差异性可用于鉴别、分离或除杂等.
故填:分离或除杂等.点评:
本题考点: 实验探究物质的性质或变化规律;检查装置的气密性;常见气体的检验与除杂方法;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.1年前查看全部
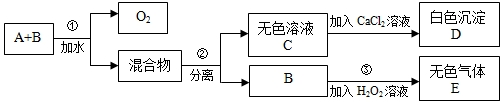
- (2012•合肥模拟)市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体A(化学式为2Na2CO3•3H
(2012•合肥模拟)市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体A(化学式为2Na2CO3•3H2O2)和灰黑色固体B(不溶于水)与水混合反应制得氧气.某同学对A、B两种物质进行探究,实验步骤及现象如下图所示.下列说法错误的是( )
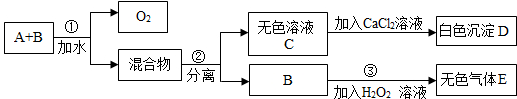
A.物质B在反应①中可能起催化作用
B.设计③的目的是制取氧气
C.第②步分离混合物的方法是过滤
D.白色沉淀D为CaCO3 logz1年前1
logz1年前1 -
 weiwei0027 共回答了17个问题
weiwei0027 共回答了17个问题 |采纳率94.1%解题思路:A和B的混合物加入水后,过碳酸钠分解生成氧气和混合物,分离得到无色溶液C和B,说明B没有参加反应,C和氯化钙反应生成白色沉淀D,根据元素守恒知,D是CaCO3,则C是Na2CO3,B加入双氧水中生成无色气体E,双氧水在催化剂条件下能立即分解生成氧气.A.分析步骤①和③可以知道,在反应①后B仍能使过氧化氢溶液分解产生气体C,所以可以判断B可能为催化剂,故A正确;
B.设计③的实验目的是为了验证B是否能够加快过氧化氢溶液的分解速率,从而对B的作用作出判断,故B错误;
C.分离溶液和不溶性的固体采用过滤的方法,B不溶于水,C易溶于水,所以分离混合物可以采用过滤的方法,故C正确;
D.根据元素守恒知,D为CaCO3,故D正确;
故选B.点评:
本题考点: 无机物的推断;钠的重要化合物.
考点点评: 本题考查了物质的推断,明确物质的性质是解本题关键,结合元素守恒来分析解答,同时考查学生知识综合运用能力,难度中等.1年前查看全部
- 过碳酸钠具有Na2CO3和H2O2的双重性质,在500C时分解为碳酸钠和过氧化氢.下列有关说法错误的是
过碳酸钠具有Na2CO3和H2O2的双重性质,在500C时分解为碳酸钠和过氧化氢.下列有关说法错误的是

求详解,
 meirentong1年前1
meirentong1年前1 -
 -雪凝- 共回答了17个问题
-雪凝- 共回答了17个问题 |采纳率94.1%产生两种气体,二氧化碳和氧气1年前查看全部
- 过碳酸钠(Na2CO4)是一种常见的漂白杀菌剂
过碳酸钠(Na2CO4)是一种常见的漂白杀菌剂


第二题答案为什么是BDEF,C为什么不用.氯化钙溶液不是能吸水的吗?氯化钙是不是能够干燥除NH3以外的气体?对了,CaCl2固体和CaCl2溶液干燥的范围用什么区别? leehei1年前4
leehei1年前4 -
 老实小猪 共回答了18个问题
老实小猪 共回答了18个问题 |采纳率94.4%O2 反应时会产生CO2与O2,因为CO2会微溶于水产生H2CO4,顾填O2BDEF 然而很多人会填BDCEF,很明显你忘了弱酸不能制强酸 即H2CO3+CaCl2=CaCO3↓+2HCl是错误的,并且吸水不吸水并不影响实验结果,D在这里就是无用得了在反应完后的溶液,取一些放入试管中,加几滴紫色石蕊试液,呈蓝色是未反应完,呈紫色则反应完毕. 题目是不会给没用的东西的,它都提示你Na2CO4水溶液时碱性的,且为你提供了紫色石蕊试液了1年前查看全部
- (2014•苏州二模)过碳酸钠(2Na2CO3•3H2O2)广泛用于洗涤、纺织、医疗、造纸等.某兴趣小组展开了深入的学习
(2014•苏州二模)过碳酸钠(2Na2CO3•3H2O2)广泛用于洗涤、纺织、医疗、造纸等.某兴趣小组展开了深入的学习:
【资料卡片】: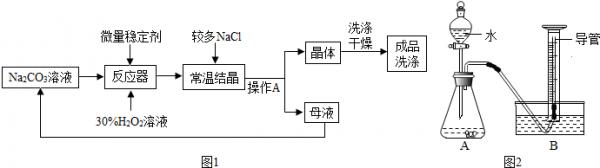
I、制备研究:如图1是制备过碳酸钠的工艺流程.
(1)过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热,遇水易分解;
(2)过碳酸钠分解的化学方程式为2(2Na2CO3•3H2O2)=4Na2CO3+6H2O+3O2↑
(3)H2O2分解放出热量,Na2CO3受热不分解;
请回答问题:
(1)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和______.
(2)生产中,反应及干燥均需在较低温度下进行,原因是______.
(3)加入较多的氯化钠的作用是______.
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3•3H2O2的质量分数.小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验.
【实验步骤】
①连接仪器,检查装置的气密性;
②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;
③连接仪器,打开分液漏斗活塞,缓缓滴入水;
④待装置A中不再产生气泡时,停止加水,并关闭活塞;
⑤待量筒中水面不再变化时,记录其中水面刻度;
⑥根据数据进行计算.
【实验分析及数据处理】
(4)实验中,______,则开始收集气体.
A.刚开始出现气泡时
B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(5)若量筒中收集到气体的体积是224mL(换算后质量约为0.32g),计算过碳酸钠样品中2Na2CO3•3H2O2的质量分数为多少?[已知:Mr(2Na2CO3•3H2O2)=314,保留到0.1%】
【反思】
(6)量筒中长导管的作用是______. fnwih1年前1
fnwih1年前1 -
 benzy 共回答了23个问题
benzy 共回答了23个问题 |采纳率87%解题思路:(1)根据过碳酸钠的溶解度大小考虑;
(2)根据不溶于液体的固体和液体分离的方法和过滤操作用到的仪器考虑;
(3)根据过碳酸钠的溶解度大小考虑;
(4)根据开始锥形瓶中有空气,最后锥形瓶中留有制取的气体考虑;
(5)先将氧气的体积换算成质量,再根据氧气的质量计算出过碳酸钠的质量,再除以样品的质量;
(6)根据如果使用短导管造成的后果考虑;(1)过碳酸钠在NaCl溶液中溶解度较小,所以生产过程中,加入较多的NaCl,以便过碳酸钠晶体析出;
(2)不溶于液体的固体和液体分离的方法是过滤,过滤时要用到铁架台、漏斗、烧杯、玻璃棒,所以需要的玻璃仪器是烧杯、漏斗、玻璃棒;
(3)过碳酸钠在NaCl溶液中溶解度较小,所以生产过程中,加入较多的NaCl,以便过碳酸钠晶体析出;
(4)开始锥形瓶中有空气,最后锥形瓶中留有制取的氧气,两者体积相同,所以一开始就应当收集,故选A;
(5)过碳酸钠分解产生氧气质量为224mL×10-3×1.43g•L-1=0.32g
2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑
628 96
X 0.32g
根据[628/96=
X
0.32g],解得X=2.09g
则样品中,2Na2CO3•3H2O2的质量分数为:[2.09g/2.20g]×100%=95.0%
(6)如果使用短导管由于温度降低后会使水沿着导管倒吸入锥形瓶内,所以量筒中长导管的作用是起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸).
故答案为:
(1)过滤;漏斗;(2)过碳酸钠受热易分解,从而影响产量和产率;
(3)过碳酸钠在NaCl溶液中溶解度较小,易析出晶体;(4)A;
(5)95.0%;(6)起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸).点评:
本题考点: 物质的相互转化和制备;实验探究物质的组成成分以及含量;过滤的原理、方法及其应用;结晶的原理、方法及其应用;常用气体的收集方法;根据化学反应方程式的计算.
考点点评: 本题考查了过碳酸钠、碳酸钠的化学性质及有关溶液及化学方程式的计算,注重考查学生的分析能力和基本计算能力.1年前查看全部
- (2014•镇江)“鱼浮灵”主要成分是过碳酸钠(xNa2CO3•yH2O2),俗称固体双氧水.兴趣小组对其进行以下探究:
(2014•镇江)“鱼浮灵”主要成分是过碳酸钠(xNa2CO3•yH2O2),俗称固体双氧水.兴趣小组对其进行以下探究:
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条______,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有______生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】(如图)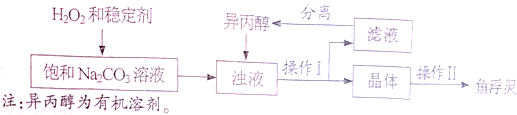
(3)稳定剂的作用是______;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为______.
(4)浊液中加入异丙醇的作用是______.
(5)操作Ⅱ中洗涤晶体的试剂最好选用______(填字母).
A.饱和NaCl溶液B、水C、异丙醇D、稀盐酸
(6)根据如表数据,你认为上述制备反应的最佳温度范围是______℃.
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数.温度范围/℃ 5~10 10~15 15~20 20~25 活性氧含量/% 13.94 14.02 15.05 14.46 “鱼浮灵”的产率/% 85.49 85.78 88.38 83.01
【组成测定】利用如图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).
【查阅资料】①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2.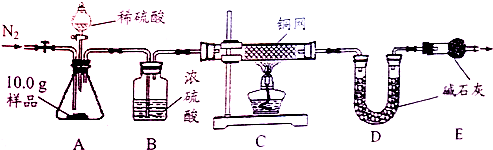
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是______.
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值______(填“偏大”或“偏小”).
(9)装置B的作用是______(填序号)
①除去气体中的水蒸气②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为______%;属于______(填“一等品”或“合格品”);x:y=______. 大街上的生命1年前1
大街上的生命1年前1 -
 骄傲的狼 共回答了15个问题
骄傲的狼 共回答了15个问题 |采纳率86.7%解题思路:(1)二氧化锰是过氧化氢分解的催化剂,氧气能使带火星的木条复燃;
(2)二氧化碳能使带澄清石灰水变浑浊,此反应可检验二氧化碳的存在;
(3)实验中加入稳定剂的作用是为防止过碳酸钠分解而失效;根据反应物、生成物,书写化学方程式;
(4)浊液中加入异丙醇的作用是降低过碳酸钠在溶液中的溶解度以提高产率;
(5)因过碳酸钠不溶于异丙醇,所以洗涤晶体最好选用异丙醇;
(6)根据表中数据可以看出,在15℃~20℃时,活性氧含量最高,鱼浮灵产率最高;
(7)实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收;
(8)若先滴入稀硫酸,后加热铜网,将使部分氧气散逸,计算时过氧化氢相对含量偏小,碳酸钠相对含量偏大,导致x:y的值偏大;
(9)装置B的作用是干燥气体,防止水分进入D装置使测定值偏大;同时便于观察和控制气流速度以使反应充分进行;
(10)C装置中铜网增重1.2g,则说明生成氧气的质量为1.2g,氧气质量占样品的百分数(活性氧含量)为12%大于10.5%而小于13%,属于合格品;由氧气质量可计算过氧化氢质量为2.55g;D装置增重2.2g说明生成二氧化碳2.2g,计算反应的碳酸钠质量为5.3g,则可得:106x:34y=5.3g:2.55g,故解得x:y=2:3.(1)由结论“说明有O2生成”,再根据:氧气能使带火星的木条复燃,则填复燃;(2)根据题目中信息“将产生的气体通入澄清石灰水中,出现浑浊现象”,再根据:二氧化碳能使带澄清石灰水变浑浊,则此题结论为有 CO2(...
点评:
本题考点: 实验探究物质的性质或变化规律;常见气体的检验与除杂方法;氧气的检验和验满;酸的化学性质;物质的相互转化和制备;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- (2013•朝阳模拟)小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上
 (2013•朝阳模拟)小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
(2013•朝阳模拟)小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验.
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体分别是:______(填化学式).B中有关反应的化学方程式是______.
【探究二】
(1)实验过程:
教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究: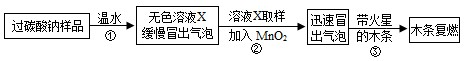
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是______;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种.
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3+CaCl2═CaCO3↓+2NaCl.
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同.
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验.请将下列实验方案填写完整.
(6)实验反思:根据资料,NaHCO3溶液能与石灰水反应生成白色沉淀.于是,同学们猜想:碳酸氢钠与氢氧化钠是否可以发生______(写方程式)这样的反应?于是,同学们进行了新的探究实验.实验操作 主要实验现象 结论 ① ______ 证明溶液中有Na2CO3 ② ______ 证明溶液中无NaHCO3 ③ ______ 证明溶液中无NaOH  tyz191年前1
tyz191年前1 -
 ee头3 共回答了20个问题
ee头3 共回答了20个问题 |采纳率85%解题思路:【探究一】根据氧气的助燃性及二氧化碳能使澄清的石灰水变浑浊分析判断,并据反应原理书写方程式;
【探究二】(3)因为无色溶液X中加入二氧化锰有氧气生成,因此无色溶液X中含有的一种溶质是过氧化氢;
(5)①根据氯化钙与碳酸氢钠不反应,可取上述无色液体X少量于试管中,加入足量的氯化钙溶液,产生白色沉淀,因此一定有碳酸钠;取步骤①所得上层清液少量,滴加盐酸,没有气泡产生,说明没有碳酸氢钠;③氯化钙、氯化钠溶液呈中性,所以取步骤①所得上层清液少量,加入酚酞试液,若不变色,说明没有氢氧化钠;
(6)据NaHCO3溶液能与石灰水反应生成白色沉淀,推测NaHCO3溶液与氢氧化钠反应方程式.【探究一】二氧化碳能使澄清石灰水变浑浊,这是二氧化碳的特性;氧气具有助燃性,因此能使燃着的木条燃烧更旺;二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,方程式是:CO2+Ca(OH)2=CaCO3↓+H2O;
【探究二】(3)因为无色溶液X中加入二氧化锰有氧气生成,因此无色溶液X中含有的一种溶质是过氧化氢;
(5)根据资料2可知:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀,碳酸钠也与石灰水反应生成白色沉淀,故不能取石灰水检验碳酸钠的存在;
根据资料1可知:氯化钙溶液与碳酸氢钠溶液混合不发生反应,氯化钙溶液与碳酸钠溶液反应生成沉淀,所以要证明溶液中有碳酸钠,可取上述无色液体X少量于试管中,至不再冒气泡为止,加入过量的氯化钙溶液,若产生白色沉淀,则一定有碳酸钠,加入过量的氯化钙溶液是防止碳酸钠有剩余,对碳酸氢钠、氢氧化钠的检验造成干扰;因为①中加入的是过量的氯化钙溶液,所以碳酸钠完全反应,要证明是否含有碳酸氢钠,可取步骤①所得上层清液少量,滴加盐酸,若没有气泡产生,则没有碳酸氢钠;③因为碳酸钠已完全反应,且氯化钙、氯化钠溶液呈中性,所以可取步骤①所得上层清液少量,加入酚酞试液,若不变色,则说明没有氢氧化钠;
(6)NaHCO3溶液能与石灰水反应生成白色沉淀,依据反应前后元素种类不变,说明生成的沉淀是碳酸钙,同时生成水;据此推测NaHCO3溶液与氢氧化钠反应生成碳酸钠和水,方程式是:NaHCO3+NaOH=Na2CO3+H2O;
故答案为:[探究一]O2、CO2;CO2+Ca(OH)2=CaCO3↓+H2O;
[探究二](3)H2O2;
(5)
实验操作主要实验现象
取溶液X适量于试管中,加入过量CaCl2溶液出现白色沉淀
取①中反应后上层清液适量,加入适量稀盐酸无气泡
取①中反应后上层清液适量,加入酚酞试液不变色(6)NaHCO3+NaOH=Na2CO3+H2O.点评:
本题考点: 实验探究物质的性质或变化规律.
考点点评: 本题是对实验方法和过程的探究,考查了学生对于常见气体--氧气、二氧化碳性质的掌握,及分析资料,设计实验,书写方程式的能力,要依据题意细心分析,才能得出正确的答案.1年前查看全部
- 粒粒氧是过碳酸钠吗?使用安全吗?能在鱼的运输过程中使用吗?
 非然2071年前3
非然2071年前3 -
 东方秋水 共回答了18个问题
东方秋水 共回答了18个问题 |采纳率100%粒粒氧即固粒氧.过碳酸钠能用于生产H2O2,过氧化氢(H2O2)俗名双氧水,常温下是一种无色的液体,它难电离,易分解.作为一种经典化工产品,工业上早在一百多年前便开始生产.随着社会需求的增长,尤其是生态环境保护的需要,过氧化氢近年来更受人们的青睐,并被称为“绿色氧化剂”.为了储存、运输、使用的方便,工业上采用醇析出将其转化成固态的过碳酸钠晶体(化学式为:2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性.醇析出的产生工艺过程如下:在0~5℃时,往饱和Na2CO3溶液中,先加入H2O2和稳定剂(MgCl2和Na2SiO3),经充分反应后,再加入异丙醇,过滤,分液,即得过碳酸钠晶体.经过处理可得到粒粒氧,即固粒氧,用于在鱼池中立体增氧,净化水质.洗涤剂的多功能化,即在洗涤去污的同时,兼有漂白、杀菌、消毒等作用,已成为洗涤剂的发展趋势,国外很多洗涤剂都加有起漂白作用的组分,国内也逐渐向这方面发展.由于过碳酸钠无味、无毒,冷水中易于溶解,去污力强,溶于水后能放出氧而起到漂白杀菌等多种功效,符合现代洗涤剂发展潮流.传统粉状洗涤剂多用过硼酸钠,但过硼酸钠存在溶解速度慢、价格较贵以及硼元素对农作物有影响等缺点.而过碳酸钠比过硼酸钠成本低,溶解性好,适宜寒冷地区和冬天使用,又不会对农作物产生危害,因此过碳酸钠在洗涤剂生产中应用日益增多,目前,过碳酸钠已广泛用作家用和工业用洗涤、漂白、杀菌剂,用于合成纤维、动物纤维、合成树脂纤维、纸浆脂等生产领域,漂白效果好,不损伤面料,不泛黄.1年前查看全部
- NaHCO3会不会使过碳酸钠晶体失效
 雪龙9991年前1
雪龙9991年前1 -
 junwang119 共回答了15个问题
junwang119 共回答了15个问题 |采纳率93.3%碳酸钠的钠离子基本上是不会反应的,碳酸根可以和比碳酸酸性强的酸根反应,所以HCO3是不会和他反应的,安啦.1年前查看全部
- 过碳酸钠与硫酸铜反应吗?
 chenruiqun1年前3
chenruiqun1年前3 -
 不胖也不瘦 共回答了18个问题
不胖也不瘦 共回答了18个问题 |采纳率100%过碳酸钠与硫酸铜能反应
过碳酸钠是碳酸钠和过氧化氢的加成复合物,
碳酸钠与硫酸铜能反应,硫酸铜又能催化分解过氧化氢
Na2CO3+CuSO4=Na2SO4+CuCO3(沉淀符号)
2H2O2=CuSO4=2H2O+O2(气体符号)
如帮到了你,
【你的10分满意,我们团队的无限动力】1年前查看全部
- 过碳酸钠和谁只发生氧化反应?二氧化锰,高锰酸钾,稀盐酸,Na2SO3?
 夜知1年前1
夜知1年前1 -
 男人也会流泪 共回答了16个问题
男人也会流泪 共回答了16个问题 |采纳率87.5%选择高锰酸钾,
过碳酸钠,实际上是Na2CO3 · 3 H2O2,碳酸钠的过氧化氢合物
A、H2O2分2 H2O2 ==MnO2== 2 H2O + O2↑
B、H2O2被氧化,发生氧化反应:2 MnO4- + 6 H+ + 5 H2O2 = 2 Mn2+ + 5 O2 + 8 H2O
C、Na2CO3反应:Na2CO3 + 2 HCl = 2 NaCl + CO2↑ + H2O
D、H2O2被还原,发生还原反应:H2O2 + Na2SO3 = H2O + Na2SO41年前查看全部
- (2006•南京)市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体(化学式为2Na2CO3•3H2O2
(2006•南京)市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体(化学式为2Na2CO3•3H2O2)和灰黑色固体B(不溶于水)与水混合反应制得氧气,某同学对A、B两种物质进行探究,实验步骤及现象如下图所示:
另做实验发现,B在①、③反应前后质量均不变,且可重复使用.
请回答下列问题:
(1)第②步分离混合物的方法是______.
(2)B在①、③反应中可能起______作用.
(3)写出D、E两种物质的化学式:D______;E______. 淮才1年前1
淮才1年前1 -
 今夜星辰昨夜雨 共回答了15个问题
今夜星辰昨夜雨 共回答了15个问题 |采纳率100%解题思路:B在①、③反应前后质量均不变,且可重复使用,说明B物质可能是催化剂,在反应中起催化作用.然后可以根据图中提供的信息和物质的性质等方面进行分析、判断,从而得出正确的结论.(1)由题意可知混合物应该是不溶于水的B和碳酸钠,可以用过滤的方法分离.故填:过滤.
(2)B在①、③反应前后质量均不变,且可重复使用,说明可能是催化剂.故填:催化.
(3)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,D是碳酸钙.过氧化氢在催化作用下能生成氧气,E是氧气.故填:CaCO3;O2.点评:
本题考点: 实验探究物质的性质或变化规律;过滤的原理、方法及其应用;催化剂的特点与催化作用;物质的鉴别、推断;化学式的书写及意义.
考点点评: 解答本题要充分理解图中提供的信息,只有理解了图中信息和物质的性质才能对问题做出正确的判断.1年前查看全部
- 生活中用到各种漂白剂.化学课上,老师带来一种常用作漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3•3H
 生活中用到各种漂白剂.化学课上,老师带来一种常用作漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3•3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(右图).
生活中用到各种漂白剂.化学课上,老师带来一种常用作漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3•3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(右图).
【提出猜想】该漂白剂肯定不是______.
【查阅资料】①过碳酸钠是一种白色结晶颗粒,溶于水时,分解生成碳酸钠和过氧化氢.
②过氧化氢常温下能缓慢分解,实验室用过氧化氢制取氧气的化学方程式为2H2O2
2H2 O+O2↑MnO2 .2H2O2.
2H2 O+O2↑MnO2 .
③过氧化钙,白色固体,难溶于水.与水反应缓慢释放氧气,同时生成一种碱,反应的化学方程式为______.
【实验验证】同学们设计了下列实验方案进行验证,请将方案的空格填写完整.
【交流反思】小刚认为根据步骤1可确定白色固体的成分,不需要后两步实验,理由是实验步骤 实验操作 实验现象 结论 步骤1 取2g白色固体放入试管中,加入5mL水,充分振荡. 液体浑浊,有持续的细小气泡冒出. 步骤2 向步骤1的试管中继续滴加无色酚酞. 无色酚酞变红. 步骤3 继续滴加______. ______. 该漂白剂的成分不是过碳酸钠.
______.小强认为不行,小强反对的理由是______. dfr88881年前1
dfr88881年前1 -
 faryad 共回答了28个问题
faryad 共回答了28个问题 |采纳率89.3%解题思路:【提出猜想】根据双氧水是液态进行分析;
【查阅资料】②根据实验室过氧化氢制氧气的原理进行分析;
③根据题中的叙述找出反应物、生成物书写方程式;
【实验验证】根据结论分析添加的试剂和发生的现象进行分析;
【交流反思】根据过氧化钙、过碳酸钠和水会生成气体进行分析.【提出猜想】该漂白剂为白色粉末,而双氧水是液态的,所以不是双氧水,故答案为:双氧水;
【查阅资料】②双氧水在二氧化锰的催化作用下生成水和氧气,故答案为:2H2O2
MnO2
.
2H2 O+O2↑;
根据质量守恒定律可知该碱是氢氧化钙,过氧化钙和水反应会生成氢氧化钙和氧气,故答案为:2CaO2+2H2O═2Ca(OH)2+O2↑;
【实验验证】从结论中可以看出该步骤检验的是碳酸钠,检验碳酸盐常加入酸,
实验步骤 实验操作 实验现象 实验结论
步骤1 取2g白色固体放入试管中,加入5mL水,充分振荡. 液体浑浊,有持续的细小气泡冒出.
步骤2 向步骤1的试管中继续滴加无色酚酞. 无色酚酞变红.
步骤3 继续滴加稀盐酸 无气泡产生,酚酞红色褪去 该漂白剂的成分不是过碳酸钠.【交流反思】过氧化钙和水反应生成氢氧化钙,氢氧化钙微溶于水,故答案为:过氧化钙与水反应有氧气产生,且生成的氢氧化钙微溶于水,
水的量较少,也不会将碳酸钠全部溶解,故答案为:过碳酸钠与水反应也有气体产生,且生成的碳酸钠可能不能完全溶解在5mL水中.点评:
本题考点: 酸、碱、盐的鉴别;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析题中考查的问题,然后结合题中所给的知识和学过的知识进行分析解答.1年前查看全部
- (2009•杭州)过碳酸钠(Na2CO4)是一种常见的漂白杀菌剂,其水溶液显碱性,能和盐酸发生下列反应:2Na2CO4+
(2009•杭州)过碳酸钠(Na2CO4)是一种常见的漂白杀菌剂,其水溶液显碱性,能和盐酸发生下列反应:2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O.工业用的过碳酸钠往往含有少量的碳酸钠.为了测定工业用的过碳酸钠的纯度,可以选择利用下列仪器(包括仪器中的药品)及石蕊试液进行实验,请回答下列问题:
(1)取适量过碳酸钠样品与足量的稀盐酸反应,只要测定反应过程中产生的
______(写化学式)体积,就可推算出过碳酸钠的纯度.
(2)请选取该实验需要的装置,并按正确连接顺序排列______(填字母,仪器中的试剂都是足量的).
(3)判定过碳酸钠试样是否完全反应的实验操作方法和现象是______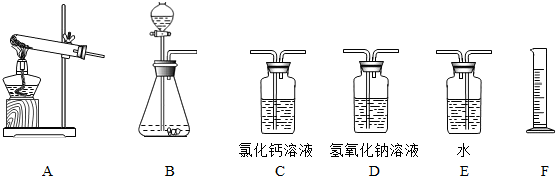
 香山一树1年前1
香山一树1年前1 -
 oppig 共回答了21个问题
oppig 共回答了21个问题 |采纳率85.7%解题思路:(1)由题给反应方程式可知,过碳酸钠和盐酸反应生成二氧化碳和氧气,碳酸钠和盐酸反应也有二氧化碳生成,所以只能通过测生成氧气的量求过碳酸钠的量;
(2)根据反应物的状态和反应条件选择反应发生装置;根据实验思路,要测生成氧气的量,可用排水法,必须先除去生成的二氧化碳,由此选择实验装置;
(3)由题意知,过碳酸钠显碱性,盐酸显酸性,可用酸碱指示剂检测是否完全反应.(1)过碳酸钠和盐酸反应生成二氧化碳和氧气,碳酸钠和盐酸反应也有二氧化碳生成,所以只能通过测生成氧气的量求过碳酸钠的量;
(2)过碳酸钠和盐酸反应为固体和液体反应且不需要加热,故选择装置B.要测定生成氧气的量,需要先除去二氧化碳,可用氢氧化钠溶液吸收二氧化碳,再通入水中,F量筒中水的体积即为E装置中氧气排开水的体积,二者体积相等.
(3)判断是否完全反应,应使用酸碱指示剂,若溶液变红,则酸过量,若溶液变蓝,则过碳酸钠过量.
故答案为:(1)O2;
(2)B→D→E→F;
(3)向反应后的B装置中滴入几滴石蕊试液,若锥形瓶内溶液变红色,则说明过碳酸钠完全反应,若溶液变蓝色,则过碳酸钠未完全反应.点评:
本题考点: 量气装置;仪器的装配或连接;证明碳酸盐.
考点点评: 本题考查化学实验的装置连接及判断反应物过量问题,解题时要注意反应发生装置的选取依据的原则是反应物状态和反应条件.(3)实验设计要注意语言描述的准确性.1年前查看全部
- 氯化铵,消石灰和过碳酸钠的化学式是什么?
 依依藤西1年前1
依依藤西1年前1 -
 婷猪猪 共回答了22个问题
婷猪猪 共回答了22个问题 |采纳率90.9%NH4CL
Ca(OH)2
Na2CO31年前查看全部
- 市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体(化学式为2Na2CO3•3H202)和灰黑色固体B(
市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体(化学式为2Na2CO3•3H202)和灰黑色固体B(不溶于水)与水混合反应制得氧气,某同学对A、B两种物质进行探究,实验步骤及现象如图所示:
另做实验发现,B在①、③反应前后质量均不变,且可重复使用.
请回答下列问题:
(1)第②步分离混合物的方法叫______.
(2)B在①、③反应是可能起______作用.
(3)白色沉淀D的化学式:______.
(4)写出③反应的化学方程式:2H2O2
2H2O+O2↑MnO2 .2H2O2.
2H2O+O2↑MnO2 . 暖酒回忆1年前1
暖酒回忆1年前1 -
 liaofan007 共回答了18个问题
liaofan007 共回答了18个问题 |采纳率88.9%解题思路:不溶于液体的固体和液体分离的方法是过滤;B在①、③反应前后质量均不变,且可重复使用,说明B物质可能是催化剂,在反应中起催化作用.然后可以根据图中提供的信息和物质的性质等方面进行分析、判断,从而得出正确的结论.(1)由题意可知混合物应该是不溶于水的B和碳酸钠,可以用过滤的方法分离.故填:过滤.
(2)B在①、③反应前后质量均不变,且可重复使用,说明可能是催化剂.故填:催化.
(3)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,D是碳酸钙,化学式是:CaCO3;
(4)反应物是过氧化氢,生成物是水,反应条件是二氧化锰做催化剂,氧气后面标上上升符号,所以方程式是:2H2O2
MnO2
.
2H2O+O2↑.
故答案为:(1)过滤;(2)催化;(3)CaCO3;(4)2H2O2
MnO2
.
2H2O+O2↑.点评:
本题考点: 物质的相互转化和制备.
考点点评: 解答本题要充分理解图中提供的信息,只有理解了图中信息和物质的性质才能对问题做出正确的判断.1年前查看全部
- MnO2和2Na2CO3*3H2O2(过碳酸钠)怎么反应?双氧水和二氧化锰谁的氧化性强?
 海底游泳de鱼1年前1
海底游泳de鱼1年前1 -
 风雨中的小男孩 共回答了18个问题
风雨中的小男孩 共回答了18个问题 |采纳率88.9%MnO2可以催化H2O2的分2Na2CO3*3H2O2=MnO2=2Na2CO3+6H2O+3O2,H2O2的氧化性比较MnO2,酸性条件是二氧化锰最强,中性和碱性条件是双氧水最强.酸性条件下,MnO2可以把HCl氧化为Cl2,H2O2不可以.1年前查看全部
- 过碳酸钠(2Na2CO3•3H2O2)是一种新型高效固体漂白杀菌剂,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中
过碳酸钠(2Na2CO3•3H2O2)是一种新型高效固体漂白杀菌剂,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中.依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如图1:
请回答下列问题:
(1)反应容器中加入稳定剂的作用是______.
(2)操作①需要的玻璃仪器有______(填写仪器名称),工业采用冰水洗涤晶体的目的有______.
(3)与Cl2相比,用过碳酸钠作为漂白杀菌剂具有的优点是______.
(4)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图2所示装置,测定工业纯碱中Na2CO3的含量.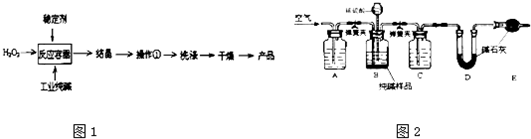
①要检验工业纯碱中杂质的存在,最好选用______试剂.
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹,往长颈漏斗中加水,______,说明装置不漏气.
③若纯碱样品的质量为m,反应前后C、D、E装置的质量分别增加ag、bg、cg,则纯碱中Na2CO3的含量为[106b/44m]×100%[106b/44m]×100%(用含m、a、b、c的代数式表示),若缺少装置E,Na2CO3的含量将______(填“偏大”“偏小”或“不变”). hyunceng1年前1
hyunceng1年前1 -
 fattyboy 共回答了17个问题
fattyboy 共回答了17个问题 |采纳率82.4%解题思路:(1)过碳酸钠溶于水后所得溶液,在水溶液中能解离成过氧化氢与碳酸钠,过氧化氢溶液是极弱的弱酸,而碳酸钠在水中由于水解会显示碱性,反应容器中加入稳定剂的作用是防止过氧化氢分解;
(2)操作①是过滤分离固体和溶液,过滤装置需要的玻璃仪器分析,工业采用冰水洗涤晶体的目的有洗涤去表面杂质,减少晶体损失;
(3)与Cl2相比,用过碳酸钠作为漂白杀菌剂具有的优点是无毒、环保、高效;
(4)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸,
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
③若纯碱样品的质量为m,反应前后C、D、E装置的质量分别增加ag、bg、cg,利用D装置吸收的二氧化碳计算碳酸钠质量分数,依据碳元素守恒计算得到碳酸钠质量分数;若缺少装置E,空气中的二氧化碳和水蒸气被装置D吸收,称量质量增大,Na2CO3的含量将偏高;(1)过碳酸钠溶于水后所得溶液,在水溶液中能解离成过氧化氢与碳酸钠,过氧化氢溶液是极弱的弱酸,而碳酸钠在水中由于水解会显示碱性,反应容器中加入稳定剂的作用是防止过氧化氢分解;
故答案为:防止过氧化氢分解;
(2)操作①是过滤分离固体和溶液,过滤装置需要的玻璃仪器为漏斗、烧杯、玻璃棒,工业采用冰水洗涤晶体的目的有洗涤去表面杂质,减少晶体损失;
故答案为:普通漏斗、烧杯、玻璃棒;除去晶体表面的杂质并减少晶体的损失;
(3)与Cl2相比,用过碳酸钠作为漂白杀菌剂具有的优点是无毒、环保、高效;
故答案为:无毒、环保、高效;
(4)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸,
故答案为:硝酸银和稀硝酸;
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
故答案为:至漏斗中液面高于洗气瓶液面,静置一段时间后,液面不下降;
③若纯碱样品的质量为m,反应前后C、D、E装置的质量分别增加ag、bg、cg,利用D装置吸收的二氧化碳计算碳酸钠质量分数,依据碳元素守恒计算得到碳酸钠质量分数=
bg
44g/mol×106g/mol
mg×100%=[106b/44m]×100%;若缺少装置E,空气中的二氧化碳和水蒸气被装置D吸收,称量质量增大,Na2CO3的含量将偏高;
故答案为:[106b/44m]×100%;偏大;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了物质组成的实验探究方法,实验工厂分析,物质性质和离子检验,掌握实验基础和过程分析方法是解题关键,题目难度中等.1年前查看全部
- (2010•启东市模拟)过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3•bH2O2.现将一定质量的
(2010•启东市模拟)过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3•bH2O2.现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况).反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A.现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
(1)计算稀硫酸的物质的量浓度.实验序号 Ⅰ Ⅱ Ⅲ 滴加溶液A的体积/mL 10.0 20.0 30.0 生成气体的体积/mL(标准状况) 89.6 179.2 224
(2)通过计算确定过碳酸钠的化学式.
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品.现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品.(已知:2Na2S2O3+I2→Na2S4O6+2NaI)16n(H2O2) m(样品)  zazhi1年前1
zazhi1年前1 -
 yzjjkfq 共回答了17个问题
yzjjkfq 共回答了17个问题 |采纳率82.4%解题思路:(1)由图表可知,第三份稀硫酸完全反应,根据碳酸钠和稀硫酸反应的化学方程式以及生成的气体的体积即可计算出稀硫酸的物质的量,然后求出稀硫酸的物质的量浓度;
(2)分别求出碳酸钠和双氧水的物质的量即可;
(3)根据2I-+H2O2+2H+=I2+2H2O,2Na2S2O3+I2→Na2S4O6+2NaI可知n(H2O2)=
.n(Na2S2O3) 2 (1)设稀硫酸的物质的量为x,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
1 22.4L/mol
x 0.224L
[1/X ]=[22.4L/mol/0.224L]
解之得:x=0.01mol,
稀硫酸的物质的量浓度为:C=[n/V]=[0.01mol/0.01L]=1 mol/L,
答:稀硫酸的物质的量浓度为1mol/L;
(2)n(O2)=[0.672L/22.4L/mol]=0.03mol,n(H2O2)=0.06mol,由实验Ⅰ中数据可知,10mLA溶液中:n(Na2CO3)=n(CO2)=0.004 mol,所以100mLA中含有0.04molNa2CO3,n(Na2CO3):n(H2O2)=0.04:0.06=2:3
所以化学式为2Na2CO3•3H2O2(用实验Ⅰ中数据也得分),
答:过碳酸钠的化学式为2Na2CO3•3H2O2;
(3)根据2I-+H2O2+2H+=I2+2H2O,2Na2S2O3+I2→Na2S4O6+2NaI可知:n(H2O2)=
n(Na2S2O3)
2=[0.1mol/L×0.030L/2]=1.5×10-3mol,
该过碳酸钠的活性氧的质量分数为:
1.5×10 −3×16
0.2=12%<13%,所以该样品不是优等品,
答:该样品不是优等品.点评:
本题考点: 复杂化学式的确定.
考点点评: 本题考查根据化学方程式的计算,难度较大,注意弄清楚方程式中各物质的量的关系是解题的关键.1年前查看全部
- 过碳酸钠是一种有多用途的新型氧系漂白剂
 智勇1年前1
智勇1年前1 -
 小猪爱生活 共回答了14个问题
小猪爱生活 共回答了14个问题 |采纳率92.9%主要用作漂白剂和氧化剂,以及化工、造纸、纺织、染整、食品、医药、卫生等部门的去污剂、清洗剂、杀菌剂.其他的用途与过硼酸钠似,可代替过硼酸钠以节约硼盐.1年前查看全部
- 汶川发生特大地震后,为防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等.过碳酸钠是一种有多用途的新型固态漂白剂,
汶川发生特大地震后,为防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等.过碳酸钠是一种有多用途的新型固态漂白剂,化学式可表示为Na2CO3•3H2O2,它具有Na2CO3和H2O2的双重性质.过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是______(填序号);
A.稀硫酸 B.KMnO4溶液C.稀盐酸D.Na2SO3溶液
漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,但亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平).当1mol HClO2发生分解反应时,转移的电子数是______. 650252081年前1
650252081年前1 -
 angglli 共回答了15个问题
angglli 共回答了15个问题 |采纳率86.7%解题思路:Na2CO3•3H2O2具有Na2CO3和H2O2的双重性质,过碳酸钠只发生了氧化反应,表现为还原性;
HClO2中Cl元素化合价为+3价,ClO2中Cl元素化合价为+4价,化合价升高1价,结合化合价变化计算转移电子数.A.稀硫酸与过碳酸钠反应生成二氧化碳气体,没有发生氧化还原反应,故A不选;
B.KMnO4溶液与过碳酸钠发生氧化还原反应,被氧化,过碳酸钠表现出还原性,故B选;
C.盐酸和过碳酸钠反应生成二氧化碳气体,没有发生氧化还原反应,故C不选;
D.Na2SO3溶液与过碳酸钠发生氧化还原反应,过碳酸钠表现出氧化性,故D不选.
HClO2中Cl元素化合价为+3价,ClO2中Cl元素化合价为+4价,化合价升高1价,变化为Cl-化合价降低4价,4HClO2~4ClO2~4e-,HClO2~Cl-~4e-,5molHClO2反应转移的电子为4mol,当1mol HClO2发生分解反应时,转移的电子为0.8mol,电子数为0.8NA,
故答案为:B;0.8NA.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析能力和氧化还原反应转移电子数的考查,题目难度不大.1年前查看全部
- (2011•顺义区一模)生活中用到各种漂白剂.化学课上,老师带来一种常用漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠
 (2011•顺义区一模)生活中用到各种漂白剂.化学课上,老师带来一种常用漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3•3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(如图).
(2011•顺义区一模)生活中用到各种漂白剂.化学课上,老师带来一种常用漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3•3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(如图).
【提出猜想】该漂白剂肯定不是H2O2H2O2.
【查阅资料】①过碳酸钠是一种白色结晶颗粒,溶于水时,分解生成碳酸钠和过氧化氢.
②过氧化氢常温下不稳定,实验室用过氧化氢制取氧气的化学方程式为2H2O2
2H2O+O2↑2H2O2MnO2 .
2H2O+O2↑.MnO2 .
③过氧化钙,白色固体,难溶于水.与水反应缓慢释放氧气,同时生成一种碱,反应的化学方程式为2CaO2+2H2O=2Ca(OH)2+O2↑2CaO2+2H2O=2Ca(OH)2+O2↑.
【实验验证】同学们设计了下列实验方案进行验证,请将方案的空格填写完整.
【交流反思】小刚认为根据步骤1可确定白色固体的成分,不需要后两步实验,理由是溶液浑浊,说明该漂白剂难溶于水,而过氧化钙难溶于水,过碳酸钠能溶于水,说明该漂白剂是过氧化钙溶液浑浊,说明该漂白剂难溶于水,而过氧化钙难溶于水,过碳酸钠能溶于水,说明该漂白剂是过氧化钙.小强认为不行,小强反对的理由是一定量的水中固体不完全溶解,可能是因为固体不溶,也可能是因为水量不足,溶解达到饱和,所以不能确定是过氧化钙.一定量的水中固体不完全溶解,可能是因为固体不溶,也可能是因为水量不足,溶解达到饱和,所以不能确定是过氧化钙..实验步骤 实验操作 实验现象 结论 步骤1 取2g白色固体放入试管中,加入5ml水,充分振荡. 液体浑浊,
有持续的细小气泡冒出.步骤2 向步骤1的试管中继续滴加无色酚酞. 无色酚酞变红. 步骤3 向试管中滴加稀盐酸,将产生的气体通入澄清石灰水向试管中滴加稀盐酸,将产生的气体通入澄清石灰水. 溶液红色消失,有气泡产生,澄清石灰水不变浑浊溶液红色消失,有气泡产生,澄清石灰水不变浑浊. 该消毒剂的成分不是过碳酸钠.  wswf10911年前1
wswf10911年前1 -
 张海清1986 共回答了15个问题
张海清1986 共回答了15个问题 |采纳率80%提出猜想:过氧化氢是液体,而所给的物质是固体,所以不可能是过氧化氢.故本题答案为:H2O2
查阅资料:②直接写出化学方程式 2H2O2
MnO2
.
2H2O+O2↑
③实验验证:根据实验结论该消毒剂不是碳酸钠,我们可以设计验证碳酸钠的实验及结论,
故本题答案为:
实验步骤 实验操作 实验现象 结论
步骤1 取2g白色固体放入试管中,加入5ml水,充分振荡. 液体浑浊,
有持续的细小气泡冒出.
步骤2 向步骤1的试管中继续滴加无色酚酞. 无色酚酞变红.
步骤3 向试管中滴加稀盐酸,将产生的气体通入澄清石灰水
. 溶液红色消失,有气泡产生,澄清石灰水不变浑浊
. 该消毒剂的成分不是过碳酸钠.交流反思:氧化钙难溶于水,过碳酸钠能溶于水,说明该漂白剂是过氧化钙,但是考虑到如果水的量不足固体液体也溶解不了,所以必须排除水的量不足的情况,故本题答案为:小刚:溶液浑浊,说明该漂白剂难溶于水,而过氧化钙难溶于水,过碳酸钠能溶于水,说明该漂白剂是过氧化钙.
小强:一定量的水中固体不完全溶解,可能是因为固体不溶,也可能是因为水量不足,溶解达到饱和,所以不能确定是过氧化钙.1年前查看全部
- 硫酸什么时候才会生成二氧化硫出自2011云南联合诊断的题,过碳酸钠2Na2CO3`3H2O2具有碳酸钠和过氧化氢的双重性
硫酸什么时候才会生成二氧化硫
出自2011云南联合诊断的题,过碳酸钠2Na2CO3`3H2O2具有碳酸钠和过氧化氢的双重性质,遇稀硫酸产生两种气体,正解是产生二氧化碳和氧气,那么为什么不可以产生二氧化硫呢?到底稀硫酸在什么情况下可以产生SO2 梦中天主141年前2
梦中天主141年前2 -
 sunka 共回答了14个问题
sunka 共回答了14个问题 |采纳率92.9%这里没有还原剂,而稀硫酸根几乎没有氧化性,所以不可以被还原到SO2.
稀硫酸的酸根太稳定了,一般条件下极难生成SO2,仅当浓硫酸时才可能遇还原剂时生成SO2.1年前查看全部
- 市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体(化学式为2Na2CO3•3H2O2)和灰黑色固体B(
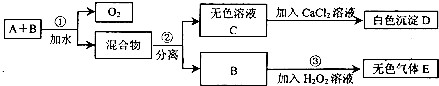
市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体(化学式为2Na2CO3•3H2O2)和灰黑色固体B(不溶于水)与水混合反应制得氧气,某同学对A、B两种物质进行探究,实验步骤及现象如下图所示:

另做实验发现,B在①、③反应前后质量均不变,且可重复使用.
请回答下列问题:
(1)第②步分离混合物的方法是______.
(2)B在①、③反应中可能起______作用.
(3)写出D、E两种物质的化学式:D______;E______. wch7771年前1
wch7771年前1 -
 不教花瘦 共回答了15个问题
不教花瘦 共回答了15个问题 |采纳率93.3%解题思路:B在①、③反应前后质量均不变,且可重复使用,说明B物质可能是催化剂,在反应中起催化作用.然后可以根据图中提供的信息和物质的性质等方面进行分析、判断,从而得出正确的结论.(1)由题意可知混合物应该是不溶于水的B和碳酸钠,可以用过滤的方法分离.故填:过滤.
(2)B在①、③反应前后质量均不变,且可重复使用,说明可能是催化剂.故填:催化.
(3)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,D是碳酸钙.过氧化氢在催化作用下能生成氧气,E是氧气.故填:CaCO3;O2.点评:
本题考点: 实验探究物质的性质或变化规律;过滤的原理、方法及其应用;催化剂的特点与催化作用;物质的鉴别、推断;化学式的书写及意义.
考点点评: 解答本题要充分理解图中提供的信息,只有理解了图中信息和物质的性质才能对问题做出正确的判断.1年前查看全部
- (2013•北京一模)“过碳酸钠”(化学式可表示为2Na2CO3•3H2O2)俗称固体双氧水,极易分解,它既有碳酸盐的性
(2013•北京一模)“过碳酸钠”(化学式可表示为2Na2CO3•3H2O2)俗称固体双氧水,极易分解,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域.现将一定质量的过碳酸钠粉末溶于m克水中配成稀溶液,再向其中加入适量二氧化锰粉末,充分反应后生成4.8g气体.将反应后的混合物过滤,测得滤液的溶质质量分数为10.6%,求m.(不考虑损耗)
 8zcf1年前1
8zcf1年前1 -
 zhengming1 共回答了17个问题
zhengming1 共回答了17个问题 |采纳率94.1%解题思路:根据题意,“过碳酸钠”(化学式可表示为2Na2CO3•3H2O2)俗称固体双氧水,极易分解,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,则将一定质量的过碳酸钠粉末溶于m克水中配成稀溶液,再向其中加入适量二氧化锰粉末,反应后生成碳酸钠、水和氧气,由生成氧气的质量,计算出滤液中溶质的质量,进而由滤液的溶质质量分数为10.6%,求出m的数值即可.设生成碳酸钠的质量为x,生成水的质量为y,
2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑
424108 96
x y 4.8g
[424/96=
x
4.8g] x=21.2g
[108/96=
y
4.8g] y=5.4g
所得滤液中的溶质质量分数为
21.2g
21.2g+5.4g+m×100%=10.6% m=173.4g.
答:m的数值为173.4.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不大,掌握根据化学方程式与溶质质量分数的计算方法是正确解答本题的关键,解题时要注意解题的规范性.1年前查看全部
- 某过碳酸钠中含有少量过氧化钠.已知:过碳酸钠(Na2CO4)、过氧化钠分别跟稀硫酸反应的化学方程式如下:2Na2CO4+
某过碳酸钠中含有少量过氧化钠.
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4→2Na2SO4+2CO2↑+O2↑+2H2O;2Na2O2+2H2SO4→2Na2SO4+O2↑+2H2O
甲同学称取一定质量的该样品,测得生成氧气的气体体积为V,计算是没有将V换算到标准状况,则他测得过碳酸钠的质量分数 (偏高.偏低)?
具体为什么 trqcsl12241年前1
trqcsl12241年前1 -
 春风拂面lly 共回答了12个问题
春风拂面lly 共回答了12个问题 |采纳率83.3%偏低
反应为放热反应,氧气体积会偏大,摩尔质量较小的过氧化钠就会偏多.1年前查看全部
- 请告诉我几个化学方程式过碳酸钠(Na2CO3.3H2O2)分别与二氧化锰、高锰酸钾溶液、稀盐酸、亚硫酸钠溶液的反应式 谢
请告诉我几个化学方程式
过碳酸钠(Na2CO3.3H2O2)分别与二氧化锰、高锰酸钾溶液、稀盐酸、亚硫酸钠溶液的反应式 谢谢! hdjn1987090111年前4
hdjn1987090111年前4 -
 路过ren间 共回答了17个问题
路过ren间 共回答了17个问题 |采纳率88.2%把碳酸钠与过氧化氢拆开分别考虑就OK啦!1年前查看全部
- 达人进,主要是第三题不懂……某过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取质量为m 克的该样品,并用如下图所示仪器测
达人进,主要是第三题不懂……
某过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取质量为m 克的该样品,并用如下图所示仪器测定样品的纯度.仪器的连接顺序,甲同学:⑤-⑧-③-⑦-④;乙同学:⑤-②
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4→2Na2SO4+2CO2↑+O2↑+2H2O;2Na2O2+2H2SO4→2Na2SO4+O2↑+2H2O
(1)甲同学想通过实验测得的数据是 ,他选用的装置 (填序号)是没有必要的.实验中甲同学测得气体体积为v L(20℃,1大气压),计算时他未将v L换算到标准状况,则甲同学得到的Na2CO4的质量分数 .(填“偏高”或“偏低”)
(2)乙同学想通过实验测得的数据是 .按他测得的数据计算出的实验结果有可能会偏高,原因是 、 ;按他测得的数据计算出的实验结果也有可能会偏低,原因是 .
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,可以不用):(填序号);按你的设计进行实验,若实验前后装置②的质量分别是w1克和w2克,则该样品中Na2CO4的质量分数为 .
 孤行一剑1年前1
孤行一剑1年前1 -
 michon96789 共回答了16个问题
michon96789 共回答了16个问题 |采纳率100%1、生成氧气的体积.③.根据PV=nRT,T变大了,那么等物质的量的气体,V就会变大,所以他得到的氧气的体积比标准状态下的体积要大,那么O2的物质的量就会偏大,所以过碳酸钠的质量分数就会偏小.可以设Na2CO4xmol,Na2O2ymol,氧气体积VL,则:122x+78y=m,x+y=V/22.4,V是偏大的,那么x就会偏小,所以过碳酸钠的质量分数就会偏小.
2、生成二氧化碳的质量.
偏高:生成的二氧化碳并未干燥,会带有水蒸气,并且都会被碱石灰吸收作为二氧化碳的质量;同时也会吸收空气中的二氧化碳与水蒸气,作为生成的二氧化碳计算.
偏低:二氧化碳并未完全被碱石灰吸收.可以用氢氧化钠吸收,这样更完全.还有就是气体并未完全排出.
3、10-1-3-8-9 对于乙的方案,可以在产气装置的左边连一个进气导管,实验前先通入一会氮气,把装置内的空气排尽;试验后再通入氮气,把产生的二氧化碳全部排出.这样实验误差就会变小了.个人认为吸收二氧化碳使用氢氧化钠效果会更好一点,答案似乎使用的是2,你也可以把8改成2.自己斟酌,或者问问老师.
过碳酸钠的质量是122(w2-w1)/44g,那么质量分数就是:6100(w2-w1)/22m%
摩尔质量可能计算的不准确,你自己再算一遍.1年前查看全部
- 过碳酸钠溶于水得到过氧化氢的溶液和碳酸钠溶液的化学方程式
 沧海客之老大1年前1
沧海客之老大1年前1 -
 qwe123v 共回答了17个问题
qwe123v 共回答了17个问题 |采纳率100%Na2CO4+H2O=Na2CO3+H2O21年前查看全部
- 将一定质量的过碳酸钠粉末溶于m克水中配成溶液,再向其中加入适量二氧化锰粉末,充分反应后生成4.8克气体
将一定质量的过碳酸钠粉末溶于m克水中配成溶液,再向其中加入适量二氧化锰粉末,充分反应后生成4.8克气体
将反应后的混合物过滤,测得溶液的溶质质量分数为10.6%,求m
 快下课了1年前1
快下课了1年前1 -
 baokin 共回答了17个问题
baokin 共回答了17个问题 |采纳率94.1%2Na2CO3•3H2O2 =MnO2(催化剂) 6H2O+2Na2CO3+3O2↑ 生成的氧气质量4.8g换成0.15mol 即溶质有10.6g 即溶液总质量为10.6g/10.6%=100g M=100-10.6=89.41年前查看全部
- 过碳酸钠是一种常见的漂白杀菌剂,往过碳酸钠中滴加稀盐酸,可产生两种气体,[提出问题]过碳酸钠与稀盐酸,产生两种什么气体?
过碳酸钠是一种常见的漂白杀菌剂,往过碳酸钠中滴加稀盐酸,可产生两种气体,[提出问题]过碳酸钠与稀盐酸,产生两种什么气体?
[作出猜想]生成的两种可能是:1、二氧化碳和水蒸气;2、二氧化碳和氯化氢;3、二氧化碳和氧气;4、氧气和水蒸气.
提出以上猜想的依据是什么? 找你好吗1年前3
找你好吗1年前3 -
 709436594 共回答了13个问题
709436594 共回答了13个问题 |采纳率69.2%应该是选3(CO2和O2),过碳酸钠其实就是Na2CO3和H2O2的复合物,化学式可以写成2Na2CO3·H2O2,接下来应该很清楚了.
产生CO2:Na2CO3 + 2HCl = 2NaCl + H2O + CO2(气)
产生O2(过氧化氢分解):2H2O2 = 2H2O + O2(气)
或者也可以这样考虑:由题意可知,过碳酸钠具有强氧化性(能漂白),因此很可能发生一个氧化还原反应,产物中会有元素的化合价发生了变化(氧).另一方面,实验用的是稀盐酸,它可以和碳酸根反应得到CO2.1年前查看全部
- 一份2Na2CO3·3H2O2(过碳酸钠)能和几份高锰酸钾反应?
 我爱薇晨畅1年前1
我爱薇晨畅1年前1 -
 周大少爷 共回答了21个问题
周大少爷 共回答了21个问题 |采纳率95.2%这里主要发生的反应时H2O2与MnO4-的反应二者根据电子守恒可得反应按5:2进行,写方程式的系数为5和2.一份过碳酸钠中含三分过氧化氢,所以需要高锰酸钾为1.2份1年前查看全部
- 过碳酸钠晶体(2Na)与二氧化锰的化学反应方程式
 kinux1年前1
kinux1年前1 -
 黢黑一片 共回答了25个问题
黢黑一片 共回答了25个问题 |采纳率92%2(2Na2CO3·3H2O2)=MnO2=4Na2CO3+6H2O+3O21年前查看全部
- 过碳酸钠的碱性比碳酸钠强吗
 楚苏的衣领1年前3
楚苏的衣领1年前3 -
 chalkz 共回答了15个问题
chalkz 共回答了15个问题 |采纳率100%没有碳酸钠强;
过碳酸钠的碱性弱一些;
有问题请追问!1年前查看全部
- 成分含有:碳酸钠、过碳酸钠的家用去污粉,洗涤了餐具、杯具,是否在餐具会留有毒成分,对人体是否有伤害
 念奴1年前2
念奴1年前2 -
 yzgll0 共回答了24个问题
yzgll0 共回答了24个问题 |采纳率91.7%碳酸钠就是纯碱,也叫食用碱,谈不上任何伤害,除非你大量吃.
过碳酸钠是一种带有氧化性的含氧漂白剂,分解出双氧水成分,也谈不上什么危害,前提就是在正常使用浓度范围内、漂洗干净.
总之都是比较安全的成分.
但是我对这种成分的去污效果稍稍感觉不够给力.1年前查看全部
大家在问
- 1几道词语搭配( )的气象 深邃的( ) 摇曳的( ) 妩媚的( )
- 2一座古朴典雅的“丝绸之路”巨型石雕,矗立在西安市玉祥门外。(缩写句子)
- 3宋代陆游临终写的“示儿”一诗中,我们懂得了诗人一生的遗憾是?
- 4一班同学买了310本练习本,如果分给每个同学相同数量的练习本后,还剩下37本,一班有多少学生?
- 5物体有气态、液态、固态之分,雪花是固态吗
- 6水星绕太阳旋转的速度是48千米每秒,比火星绕太阳旋转的速度快24有10分之7千米每秒.如果地球绕太阳旋转的速度比火星快6
- 7求图2-28所示电路中电压表的读书(设电压表内阻为无限大).写出具体过程和原因
- 8(最爱)的英文单词怎么写?
- 9某校六年级有三个班级,已知1班与2班人数之比是4:3 ,2班与3班人数之比是2:3,1、2班学生人数之和少30人,
- 101.We stay at home ( ) Sunday.A.on B.in 2.Look at the picture
- 11已知a+b+c=1,则a的平方+b的平方+c的平方+2ab+2ac=2bc的值是( )
- 12读东南亚政区图,分析回答下列问题:
- 13--I wonder how you have improved your spoken English so fast
- 14X一6=7.6的解方程是什么
- 15《黄冈竹楼记》中,作者盖竹楼的原因是什么?