(除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制
 davidyan72022-10-04 11:39:541条回答
davidyan72022-10-04 11:39:541条回答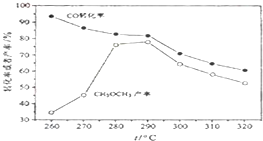 (除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:
(除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:(1)CO转化率随温度升高而降低的原因是______.
(2)在一定温度,容积不变的容器中进行该反应,则以下为达到平衡状态的标志是______(填编号)
a.V(CO)正:V(H2)逆=2:1
b.CO的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度
e.每断裂4molH-H键的同时形成2molH-O键
(3)二甲醚燃料电池具有启动快,效率高等优点,其能量密度高于甲醇直接燃烧利用的能量密度(5.93kW•h•kg-1),若燃料电池电解质为酸性,二甲醚燃料电池的负极反应为______. 一个二甲醚分子经过电化学氧化,可以转移______个电子;该电池理论输出电压1.20V,能量密度E=
1.2V×
| ||
|
1.2V×
| ||
|

已提交,审核后显示!提交回复
共1条回复
 Kiddy猪猪 共回答了21个问题
Kiddy猪猪 共回答了21个问题 |采纳率95.2%- 解题思路:(1)依据化学平衡移动原理分析;
(2)反应到达平衡状态时正逆反应速率相等,各物质的浓度保持不变,以及由此衍生的一些量保持不变,据此分析;
(3)燃料电池中燃料在负极上失电子发生氧化反应,书写电极反应,计算电子转移;依据能量密度=电池输出电能/燃料质量列式计算.(1)CO转化率随温度升高而降低,是因为反应是放热反应,升温平衡逆向进行,故答案为:反应放热,温度升高,平衡逆向移动;
(2)a.V(CO)正:V(H2)逆=2:1,之比不等于计量数之比,故不选;
b.CO的转化率不再增大,说明正逆反应速率相等,故选;
c.混合气体的平均相对分子质量不再改变,说明正逆反应速率相等,故选;
d.混合气体的密度,从反应开始一直不变,故不选;
e.每断裂4molH-H键的同时形成2molH-O键,从反应开始一直不变,故不选;
故选bc;
(3)若电解质为酸性,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+3H2O-12e-=2CO2+12H+;
一个二甲醚分子经过电化学氧化失去12个电子,能量密度=电池输出电能/燃料质量,该电池的理论输出电压为1.20V,能量密度E=
1.2V×
1000g
46g/mol×12×96500C/mol
1Kg
3.6×106J•kw−1•h−1=8.39KW•h•kg-1,
故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+;12;
1.2V×
1000g
46g/mol×12×96500C/mol
1Kg
3.6×106J•kw−1•h−1=8.39KW•h•kg-1.点评:
本题考点: 化学平衡状态的判断;化学电源新型电池;化学平衡的影响因素.
考点点评: 本题考查了化学平衡状态的判断,化学平衡移动原理的分析判断,原电池原理分析和电极书写,题目难度中等. - 1年前
相关推荐
- 成绩一般在年级前十五.但只有考进年级前十才能上零班.主要英语10几(别人都110)(别人指比我...
成绩一般在年级前十五.但只有考进年级前十才能上零班.主要英语10几(别人都110)(别人指比我...
成绩一般在年级前十五.但只有考进年级前十才能上零班.主要英语10几(别人都110)(别人指比我高一些的人).物理八十几、偶尔91.92的样子.想稳定到95.(英语满分120物理100) 水生天一1年前5
水生天一1年前5 -
 碎碎沉 共回答了19个问题
碎碎沉 共回答了19个问题 |采纳率89.5%建议在物理上花功夫,英语靠平时积累,你已经初三,时间不是很够,所以再短时间内应多学物理,多做题,然后在物理上把总分赶上来1年前查看全部
大家在问
- 1从微生物角度解释为何潮湿环境容易发霉
- 2【贞】以立志 故君子人多【树】之为庭实盐 ----《养竹记
- 32130302:the reason is that budget restraints have led many s
- 4It’s important for us to employ a word or a phrase according
- 5It was a difficult time, but we never ________ hope. A.put u
- 6在三角形abc中,AM是BC边上的中线,AB等于7,AC等于5.5 那么三角形AB与三角形ACM为周长的差为
- 7请帮忙翻译哈, If you don't work, you will fail to pass the exam是什么
- 8八年级上册语文古诗古文内容
- 9书的功劳大 作文
- 10阅读下面文段,回答文后问题。 ①我见过一个母亲,一个阳光下守望的母亲。母亲就站在七月炙热的阳光下翘首望着百米外的考场,
- 11嫦娥一号卫星发射时 兖州的情况是?
- 12用长8m的铝材,做一个日字形窗框,问高和宽各为多少米时窗户面积最大
- 13一片叶子阅读埋下一片树叶,固执地相信他总会长成一棵参天大树,这便是儿时最美丽的梦.我4岁那年的秋天,枯黄的叶子从高高的树
- 14_______ they ________ (watch) TV last night when I rang?
- 15I'm very busy every day .so i never fun A:some B:any C: a D:
