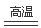
Si的气态氢化物在氧气中燃烧的化学方程式
 我是楼主dd05号2022-10-04 11:39:543条回答
我是楼主dd05号2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 吴宜 共回答了10个问题
吴宜 共回答了10个问题 |采纳率100%- SI跟C 同族 气态氢化物就是SIH4 俗名 硅烷 燃烧跟甲烷 CH4相似 SiH4+2O2=2H2O+SiO2
- 1年前
 武汉丫 共回答了1个问题
武汉丫 共回答了1个问题 |采纳率- SiH4+2O2=2H2O+SiO2
- 1年前
 Se7EnLL 共回答了17个问题
Se7EnLL 共回答了17个问题 |采纳率70.6%- SiH4 + 2O2 =点燃= SiO2 + 2H2O
- 1年前
相关推荐
- 气态氢化物稳定性逐渐增大,则金属性增强还是非金属性增强?
 yangyg3241年前3
yangyg3241年前3 -
 470556702 共回答了21个问题
470556702 共回答了21个问题 |采纳率95.2%非金属性越强气态氢化物稳定性越大.1年前查看全部
- 熔沸点怎样的物质容易升华或液化气态氢化物的稳定性是还原性的标志这句话什么意思,为什么啊
 xx西门庆1年前1
xx西门庆1年前1 -
 紫鹭仙踪 共回答了9个问题
紫鹭仙踪 共回答了9个问题 |采纳率88.9%熔沸点低就容易液化或升华
气态氢化物的稳定性是还原性的标志,意思是说越不稳定,还原性就越强(我从卤族元素得出的),这和最外层电子数有关.你想,你层数多了,失电子能力就强了,还原性就强了.1年前查看全部
- 某元素X的气态氢化物化学式为H2X,下面叙述正确的是 A该元素的原子最外层有6个电子 B该元素最高价氧化物的化学式为XO
某元素X的气态氢化物化学式为H2X,下面叙述正确的是 A该元素的原子最外层有6个电子 B该元素最高价氧化物的化学式为XO2 C该元素是非金属元素 D 该元素最高价氧化物对应水化物的化学式为H2XO4
 椰树下森木_tt1年前1
椰树下森木_tt1年前1 -
 会开车的鸡 共回答了13个问题
会开车的鸡 共回答了13个问题 |采纳率84.6%ACD 气态氢化物化学式为H2X 比较常见的就是硫化氢了
其实这一类的题都很好做的 就从最常见的想 比如H2XO4 常见的就是硫酸
h2x常见的就是硫化氢 就那么几种 带到选项里一对即可
你是中学生吧 我也是 最近有好多这种题呢1年前查看全部
- 某元素最高价氧化物的水化物的化学式为HXROY,气态氢化物的化学式为HXR
某元素最高价氧化物的水化物的化学式为HXROY,气态氢化物的化学式为HXR
已知1mol的HXROY比1mol的HXR质量多64g,又知道1mol的HXROY中R的原子核外电子总数比氢原子和氧原子核外电子总数少16mol,求R的原子序数. ffhc20031年前4
ffhc20031年前4 -
 wkkkl 共回答了15个问题
wkkkl 共回答了15个问题 |采纳率80%设 HxROy HxR中R的质子数为R,摩尔质量为MX+M+16Y=64+(X+M)————Y=4R+16=X+8Y-----------R-X=16 因为X》1 所以 Y》16,是Cl,原子序数17所以HClO4 不懂可以继续问我哦...1年前查看全部
- 请问为什么电子层数相同时,为什么核电荷数越多越难失电子?什么叫气态氢化物?
请问为什么电子层数相同时,为什么核电荷数越多越难失电子?什么叫气态氢化物?
元素周期表中,同一周期,从左往右非金属性增强,非金属性越强,元素对应的氢化物越稳定.氢化物越稳定,其溶于水后越难电离出H+,即酸性越弱.那为什么C N O F,对应的CH4 NH3 H2O HF溶于水是中性—碱性—中性—酸性,酸性反而增强了呢?
为什么电子层数相同时,核电荷数越多越难失电子?核电荷数越多,核外电子数也越多,不是一个正的吸一个负的吗,失电子能力不变才对 engravep1年前1
engravep1年前1 -
 绿光如水 共回答了15个问题
绿光如水 共回答了15个问题 |采纳率86.7%核电荷数越多,失电子所需能量越多,所以越难失电子.
气态氢化物就是气态的,氢的化合物,比如氯化氢,硫化氢,等
氢化物越稳定,但溶于水后,与酸碱电离程度有关,强酸电离程度强,电离出氢离子多,酸性强弱酸电离程度若,所以电离出的氢离子少,酸性弱.
电荷数越多.非金属性越明显,越容易得电子,越不易失电子,比如钠和硫,钠易失电子,硫易得电子1年前查看全部
- 某主族元素的气态氢化物的化学式为RH3,此元素最高价氧化物对应水化物的化学式可能为
某主族元素的气态氢化物的化学式为RH3,此元素最高价氧化物对应水化物的化学式可能为
A.H3RO3 B.HRO3 C.H2RO4 D.HRO4
要说明理由!
RH3为什么一定要H正一价?负一价也行啊! zhanshan1年前6
zhanshan1年前6 -
 8848120132 共回答了16个问题
8848120132 共回答了16个问题 |采纳率81.3%Q:RH3为什么一定要H正一价?负一价也行啊!
A:根据金属活动性顺序,H处于过渡态,那么当H和金属原子形成离子化合物时,H是负价,注意是离子化合物,根据题意所以H不可以为负1年前查看全部
- 某元素X的气态氢化物与该元素的最高价氧化物的水化物反应生成盐,则该元素是?
 sssg1年前1
sssg1年前1 -
 ycx198588 共回答了18个问题
ycx198588 共回答了18个问题 |采纳率88.9%氮元素
NH4NO31年前查看全部
- ABCD是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,
ABCD是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,
1mol该化合物含有42mol电子,B原子的最外层电子排布式为nsn,np2n,C、D两原子的最外层电子数分别是内层电子数的一半.C元素是植物生长的元素之一.
(1)A、B元素形成的酸酐的化学式是
(2)D元素的单质与水反应的化学方程式为
(3)A、C元素气态氢化物的稳定性大小:< (用分子式表示)
(4)A、B、C、D四种元素中电负性最大的是 (用元素符号表示,下同),第一电离能最小的是 板刀面1年前1
板刀面1年前1 -
 kimutaku 共回答了20个问题
kimutaku 共回答了20个问题 |采纳率95%A N
B O
C P
D Li
(1)N2O5 N2O3
(2)2Li+2H2O--->2LiOH+H2
(3)PH31年前查看全部
- 钠镁铝硅磷硫氯的最低价氧化物和气态氢化物分别是什么?
 guntion1年前1
guntion1年前1 -
 jiayoushang3 共回答了14个问题
jiayoushang3 共回答了14个问题 |采纳率92.9%最低价?氧化钠 氧化镁 氧化铝 三氧化二磷(六氧化四磷) 二氧化硫 一氧化二氯
氢化物是 磷化氢(膦) 硫化氢 氯化氢1年前查看全部
- 1到18号元素.能形成气态氢化物且最稳定的是什么
 ernialice1年前1
ernialice1年前1 -
 眯眼看选秀 共回答了20个问题
眯眼看选秀 共回答了20个问题 |采纳率90%HF酸1年前查看全部
- 氮的气态氢化物和最高价氧化物对应的水化物化合,生成盐,列举反应方程式
 agbnvx1年前1
agbnvx1年前1 -
 lovexiewei 共回答了22个问题
lovexiewei 共回答了22个问题 |采纳率100%HNO3+NH3==NH4NO3
望采纳1年前查看全部
- 气态氢化物的稳定性和最高价氧化物对应的水化物的酸性怎么判断
 dancy5211年前3
dancy5211年前3 -
 andysusu 共回答了18个问题
andysusu 共回答了18个问题 |采纳率94.4%这和元素周期律是有关的,应该说非金属性越强,原子与氢结合得越牢固(主要跟半径有关啦),氢化物越稳定.
根据非金属性判断 非金属性越强最高价氧化物对应水化物的 酸性越强(除F)
而F,由于非金属性太强,无法被其它元素氧化,自然也就没有最高价氧化物及其对应的水化物了1年前查看全部
- 为什么非金属性强,它气态氢化物酸性小?为什么最高价氧化物水化物酸性越强?
 繁华一场1年前1
繁华一场1年前1 -
 如山先生 共回答了24个问题
如山先生 共回答了24个问题 |采纳率95.8%因为非金属性强的元素对电子的吸引越强,所以与氢结合的更牢固,不容易电离出H+,它气态氢化物酸性小;其最高价氧化物水化物的结合方式为非金属在中心,被氧原子和羟基包围着,因为非金属性强的元素对电子的吸引越强,所以其最高价氧化物水化物在电离出H+形成负离子后,中心原子能对负电荷起稳定的作用,使其最高价氧化物水化物电离出H+越容易,故其酸性越强.
以上只是我的个人看法,有问题还是问老师吧,免得被我误导.1年前查看全部
- A、B、C、D四种元素处于同一短周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期
A、B、C、D四种元素处于同一短周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中的最强的,C的电负性介于A、B之间,D与B相邻.
我推出H2O的沸点最高,HNO3最酸,可是O和N之间没有元素就推不出来了,请高手看看我哪里推错了!
时同一短周期的!还有B要同主族中气态氢化物的沸点最高
而Cl在第三周期不可能有同主族中气态氢化物的沸点最高的物质! 日月雪1年前2
日月雪1年前2 -
 慢歌而行 共回答了13个问题
慢歌而行 共回答了13个问题 |采纳率84.6%如果是这样那应该是:A:F、B:N、C:O、D:C
A的气态氢化物的沸点最高为HF(H2O为液态,考虑相对分子质量和氢键为HF)
B的最高价氧化物对应的水化物的酸性在同周期中的最强的为HNO3
C的电负性介于F、N之间为O
D与N相邻为C1年前查看全部
- 元素R的气态氢化物化学式为HxR,在标准状况下,8.5gHxR气体的体积是5.6L.将5.1gHxR气体通入200ml0
元素R的气态氢化物化学式为HxR,在标准状况下,8.5gHxR气体的体积是5.6L.将5.1gHxR气体通入200ml0.75mol/L的CuCl2溶液中正好完全反应,并生成黑色沉淀.
(1)求HxR的性队分子质量
(2)推断x值,并确定R元素的名称 woailinglingyu1年前1
woailinglingyu1年前1 -
 ym770108 共回答了19个问题
ym770108 共回答了19个问题 |采纳率94.7%1.34
2.x=2 硫
生成黑色沉淀CuS1年前查看全部
- 某元素的气态氢化物.某元素的气态氢化物HxR在某温度下分解为氢气和固体物质,在相同条件下体积为原来的1.5倍,分解前后气
某元素的气态氢化物.
某元素的气态氢化物HxR在某温度下分解为氢气和固体物质,在相同条件下体积为原来的1.5倍,分解前后气体的密度比为17:1,该元素原子核内中子数于质子数之差为1.
问1.该元素的符号为?
2.R原子核内中子数为?,
3.R原子的电子排布式为?
4.R原子的最高氧化物的分子式为?
5.其溶于水后生成物为?(原因.TQ
那个。HxR,PH3不是反过来了么? 1964461年前2
1964461年前2 -
 新娱乐 共回答了16个问题
新娱乐 共回答了16个问题 |采纳率81.3%P
体积变为原来的1.5倍,反应后是H2,2个氢,那么之前该物质就3个氢了咯,那可H3R
密度比为17:1.之后是氢气,也就是2,那么该气体就是34,里面有3个氢了,那么R就是31,又中子和质子差1,所以,质子数可能是15.也许是16.但16的话,是硫,不符合,因为没有H3S的吧~如果是15,那么就是P,H3P(其实就是PH3)存在的,NH3是存在的吧,那么和它类似的PH3也是存在的哦,这点,同族的,性质是类似的~这点在解题的时候很有推断帮助,所以R的中子数16
电子式,我只写下外层电子,2 8 5
最高价氧化物:P2O5
溶于水:H3PO41年前查看全部
- X.Y.W为原子序数依次增加的短周期元素、XY同主族、YW的气态氢化物有相同电子数一般X的单质只有氧化性、实
 welcomelm1年前2
welcomelm1年前2 -
 muly2008 共回答了17个问题
muly2008 共回答了17个问题 |采纳率82.4%X-O 氧
Y-S 硫
W-Cl氯1年前查看全部
- 同一周期 从左到右 气态氢化物的稳定性越来越稳定吗
 haiyanghere1年前1
haiyanghere1年前1 -
 独孤雁2002 共回答了21个问题
独孤雁2002 共回答了21个问题 |采纳率76.2%是的,氟化氢最稳定1年前查看全部
- X元素的气态氢化物在高温下分解,生成固态物质和氢气.在相同条件下,测得其体积是原气体体积的1.5倍,又知分解前后气体密度
X元素的气态氢化物在高温下分解,生成固态物质和氢气.在相同条件下,测得其体积是原气体体积的1.5倍,又知分解前后气体密度比为17:1,X原子核内中子数比质子数多1个,求X元素的核电荷数?和思路
 海大侠1年前1
海大侠1年前1 -
 kronoskronos 共回答了16个问题
kronoskronos 共回答了16个问题 |采纳率100%气体密度比=摩尔质量比=M:2=17:1,故该氢化物摩尔质量为M=34g/mol,气体体积比=物质的量比=1:1.5,由此知1mol原氢化物中含3mol氢原子,设分子式为XH3,则X的摩尔质量为34-3=31g/mol,知X是P,P是15号元素,质子数为15,中子数16,核电荷数为31.1年前查看全部
- 为什么非金属氧化物与非酸性气态氢化物不是非电解质,而活泼金属氧化物是?8小时内急求
 junbozoutianya1年前1
junbozoutianya1年前1 -
 love1397a 共回答了17个问题
love1397a 共回答了17个问题 |采纳率94.1%电解质的定义是在水溶液或熔融状态下能够导电的化合物.非金属氧化物如CO2溶于水后导电的是发生了电离的碳酸,而不是CO2本身.而活泼金属氧化物,如氧化钠在高温熔融状态下能电离出金属阳离子和氧离子,所以是电解质.至于...1年前查看全部
- 同一元素的气态氢化物和气态氧化物反应生成该元素得单质和水,该元素可能是氮(N)?
 gy51515551年前3
gy51515551年前3 -
 n_feng 共回答了19个问题
n_feng 共回答了19个问题 |采纳率100%N、As、S、Se、Te、Cl、Br、I都是可以的.1年前查看全部
- XYZMG五种短周期元素,原子序数依次增大,在这五种元素中,Z的原子半径最大,X元素的气态氢化物水溶液呈碱性,YM同主族
XYZMG五种短周期元素,原子序数依次增大,在这五种元素中,Z的原子半径最大,X元素的气态氢化物水溶液呈碱性,YM同主族,可以形成MY2、MY3两种分子,Z和G可以形成原子个数比为1:1的离子化合物.
求XYZMG分别是什么? wjp10091年前1
wjp10091年前1 -
 rongshoutang 共回答了18个问题
rongshoutang 共回答了18个问题 |采纳率94.4%X元素的气态氢化物水溶液呈碱性→基本就是NH3了,X就是N
YM同主族,可以形成MY2、MY3两种分子→想到O、S
G比M大,只能是Cl
Z是氧到硫间的金属,Z和G可以形成原子个数比为1:1的离子化合物→Na1年前查看全部
- N的气态氢化物的VSEPR模型为 其中心杂化类型
 66253981年前1
66253981年前1 -
 乖乖丫头 共回答了13个问题
乖乖丫头 共回答了13个问题 |采纳率100%N的气态氢化物一般指的是NH3,AX3E型,A是中心原子,X是配位原子,E是孤电子对,其N原子杂化类型为sp31年前查看全部
- A B C D四种元素均为短周期,原子半径依次减小,他们的气态氢化物所含的电子数相同,c元素原子的K层电子数
A B C D四种元素均为短周期,原子半径依次减小,他们的气态氢化物所含的电子数相同,c元素原子的K层电子数
与M层电子数之和等于L层电子数,求A B C 四种元素 vv261年前2
vv261年前2 -
 YOYO我的爱 共回答了23个问题
YOYO我的爱 共回答了23个问题 |采纳率100%由题目得:C化合物中,K层电子数一定为2,L层电子数一定为8(K,L已排满),M层电子数为6,C为S,气态氢化物所含的电子数相同,即18电子体,易得D为Cl,A为Si,B为P.1年前查看全部
- 元素C的气态氢化物可与其最高氧化物的水化物发生非氧化还原反应生成盐,1MOL该盐含42个电子请问:元素C是什么元素?
元素C的气态氢化物可与其最高氧化物的水化物发生非氧化还原反应生成盐,1MOL该盐含42个电子请问:元素C是什么元素?
苦..... yanshiming1年前1
yanshiming1年前1 -
 hljclub 共回答了21个问题
hljclub 共回答了21个问题 |采纳率90.5%应该是“1MOL该盐含42×10^23个电子”吧.
抱歉,刚才有点晕了.忘记了铵根这个特殊离子.按照上面的顺推一遍:
若该反应生成盐,则其中至少有两种非氢非氧的元素,而题中只有一种元素C,所以按理说该题是无解的.但由于铵根离子是一个特殊离子,是一个由非金属构成的具有金属性质的离子团.因此,该元素C只可能是构成铵根离子的非氢元素N,而生成的盐便是硝酸铵[NH4NO3].1年前查看全部
- 氢与氮形成的气态氢化物水溶液呈碱性的原因
氢与氮形成的气态氢化物水溶液呈碱性的原因
方程式表达 认真寻找幸福1年前2
认真寻找幸福1年前2 -
 sxdtommy 共回答了18个问题
sxdtommy 共回答了18个问题 |采纳率83.3%氢与氮形成的气态氢化物是NH3,它的水溶液就是氨水,氨水溶液呈碱性.
NH3+ H2O NH3.H2ONH4+ + OH-
因为能电离出OH-,所以氢与氮形成的气态氢化物水溶液呈碱性.1年前查看全部
- 元素周期表的规律R的气态氢化物的水溶液呈酸性,可能是VIA族或VIIA族元素,为什么,这是怎么推出来的?
 qunyan15011年前3
qunyan15011年前3 -
 阿弥陀佛53534 共回答了19个问题
阿弥陀佛53534 共回答了19个问题 |采纳率94.7%换句话说 VIA族或VIIA族元素的气态氢化物的水溶液呈酸性.你就记住好了1年前查看全部
- 某主族元素R的最高正价与最低负化合价的代数和为4,为什么R气态氢化物化学式为H2R
 saxfngmsdfjh1年前2
saxfngmsdfjh1年前2 -
 lialiao001 共回答了9个问题
lialiao001 共回答了9个问题 |采纳率88.9%因为是主族元素,最外层电子最多能容纳8个.显最高正价是因为失去了全部的最外层电子,显最低负价是因为得到电子,变成外层8电子的离子(或化合物 ).设原来外层有X个电子,可以得到Y个.则有X+Y=8,X-Y=4 解得X=6,Y=2 于是呢形成化合物的时候H2R1年前查看全部
- 某元素X的气态氢化物可表示为XH4,其中氢的质量分数为百分之25
 e有心人1年前1
e有心人1年前1 -
 北海22 共回答了13个问题
北海22 共回答了13个问题 |采纳率100%C1年前查看全部
- [物质结构与性质](15分)已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型常见气态氢化物分子中既有σ键又
[物质结构与性质](15分)
已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型常见气态氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO 2 和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z 4 + 所占,体心位置为Ba 2 + 所占,所有棱心位置为O 2- 所占。
(1)Y在周期表中位于______________;Z 4 + 的核外电子排布式为______________;
(2)X的该种氢化物分子构型为___________,X在该氢化物中以___________方式杂化。X和Y形成的化合物的熔点应该_____(填“高于”或 “低于”)X的该氢化物的熔点。
(3)①制备M的化学反应方程式是________________________________________;
②在M晶体中,若将Z 4 + 置于立方体的体心,Ba 2 + 置于立方体的顶点,则O 2 - 处于立方体的______;
③在M晶体中,Z 4 + 的氧配位数为________; dqy5561年前1
dqy5561年前1 -
 yyy_14 共回答了28个问题
yyy_14 共回答了28个问题 |采纳率78.6%1年前查看全部
- 为什么同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱?
为什么同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱?
而同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强; 蠢就一个字1年前3
蠢就一个字1年前3 -
 bigger_369852 共回答了14个问题
bigger_369852 共回答了14个问题 |采纳率92.9%主要考虑和氢元素结合的能力,非金属性越强,和氢结合的越紧密,不容易电离出氢离子
这种表现以卤族元素最为典型
氟非金属性最强,氟化氢水溶液(氢氟酸)中电解出的氢离子少,其余是以氟化氢分子存在,所以是弱酸
氯的非金属性较氟弱的多,氯化氢水溶液中,基本没有氯化氢分子,几乎全部是氢离子和氯离子,所以它是强酸
类推到碘,碘的非金属性最差,和氢结合的松散,受热,光照均会分解,所以其水溶液中氢离子最多,酸性也最强.
不同主族,不符合此规律1年前查看全部
- R的最高价含氧酸的化学式为HnRO2n-2,则R元素气态氢化物的化学式为?
R的最高价含氧酸的化学式为HnRO2n-2,则R元素气态氢化物的化学式为?
有个答案为H3n-12R,是否正确呢?求详解 雪环1年前3
雪环1年前3 -
 素心千顷 共回答了16个问题
素心千顷 共回答了16个问题 |采纳率81.3%一般讲,非金属元素的最高价与最低价的绝对值之和为8.
所以HnRO2n-2中R为 + ( 3n - 4 ) 价,则其负价就是 - [ 8 - ( 3n - 4 ) ] = - ( 12 - 3n ) 价.在气态氢化物中氢为+1价,R是负价,所以写做:H(12-3n)R(括号中的12-3n写在H元素符号的右下角).
假设n=1,则其最高价含氧酸为HR,不合理.
假设n=2,则为H2RO2,R最高价为+2价,最低价为-6价,不合理.
假设n=3,则为其最高价含氧酸为H3RO4,气态氢化物为H3R,合理.(可能是P元素等)
假设n=4,则为H4RO6,R最高价为+8价,不合理.
看到你的补充了,不能是H(3n-12)R.1年前查看全部
- 化学熔沸点及稳定型判断NH3 PH3 AsH3的沸点大小是NH3大于AsH3大于PH3N P As 的气态氢化物的稳定性
化学熔沸点及稳定型判断
NH3 PH3 AsH3的沸点大小是NH3大于AsH3大于PH3
N P As 的气态氢化物的稳定性大小是什么
气态氢化物的稳定性和它的熔沸点大小排序是否一样? diana_wu1年前3
diana_wu1年前3 -
 者乃变 共回答了19个问题
者乃变 共回答了19个问题 |采纳率94.7%N P As 的气态氢化物的稳定性大小是 NH3 》 PH3 》 AsH3.同族元素,气态非金属氢化物的稳定性是降低的,氧族也是一样的.
熔沸点有点不一样,熔沸点 NH3 》AsH3 》PH3 ,H2O》H2Se》H2S,HF》HBr》HCl
因为N O F,元素氢化物含有氢键,使熔沸点出现了反常.
懂了吗?1年前查看全部
- 已知某主族元素R的气态氢化物中含氢17.65%,其中最高价氧化物中含氧74.1%(均指质量分数)求:
已知某主族元素R的气态氢化物中含氢17.65%,其中最高价氧化物中含氧74.1%(均指质量分数)求:
1.R的相对原子质量
2.写出R的气态氢化物电子式
3.写出R的最高价氧化物对应的水化物与其气态氢化物反应的化学方程式 ronaldo9du1年前1
ronaldo9du1年前1 -
 逍遥无酒 共回答了15个问题
逍遥无酒 共回答了15个问题 |采纳率86.7%根据题意来看,R的氢化物为气态,则为非金属.而且其最高价氧化物的水化物可以和其氢化物可以反应,则只可能是N或S,因为氨气与硝酸或者硫化氢与浓硫酸才反应.然后根据其气态氢化物中含氢17.65%,则可以确定R为N.然后下面...1年前查看全部
- 元素周期表从左到右气态氢化物的稳定性怎么变化
 晓荷裳1年前1
晓荷裳1年前1 -
 yytf 共回答了18个问题
yytf 共回答了18个问题 |采纳率94.4%变稳定1年前查看全部
- 如何判断化合物的碱性,酸性强弱.如何判断气态氢化物的稳定性.还原性,氧化性强弱.
 sxyjhsyq1年前2
sxyjhsyq1年前2 -
 努尔德 共回答了18个问题
努尔德 共回答了18个问题 |采纳率94.4%元素的金属性越强 那么 它的最高价氧化物的水化物的碱性越强,酸性越弱,单质的还原性越强
元素的非金属性越强 那么 它的最高价氧化物的水化物的碱性越弱,酸性越强 气态氢化物的稳定性越强 其单质的氧化性越强1年前查看全部
- 某元素的最高价含氧酸的阴离子符号是RO3-(是3个氧原子1个阴离子),则该元素的气态氢化物
某元素的最高价含氧酸的阴离子符号是RO3-(是3个氧原子1个阴离子),则该元素的气态氢化物
A.HR B.H2R C.RH3 D.不能确定
要有讲解 我叫GOD1年前4
我叫GOD1年前4 -
 天簌回音 共回答了15个问题
天簌回音 共回答了15个问题 |采纳率86.7%根据含氧酸根离子推断出R是正五价,而这时它的最高价,所以最低价应该是-3价,所以气态氢化物为C1年前查看全部
- 某元素最高价氧化物的水化物的化学式HxROy气态氢化物为HxR,已知1MOL的HxROy比1MOL的HxR的质量多64克
某元素最高价氧化物的水化物的化学式HxROy气态氢化物为HxR,已知1MOL的HxROy比1MOL的HxR的质量多64克,又知道1MOL的HxROy中的R的原子核外电子总数比氢原子和氧原子核外电子总数少16MOL 求R的原子序数
 athena2991年前2
athena2991年前2 -
 深蓝色衬衣 共回答了14个问题
深蓝色衬衣 共回答了14个问题 |采纳率71.4%设R的核外电子数为Z,
1mol*(x+R+16y)-1mol*(x+R)=64,得y=4
(X+8*4)-z=16解得Z=X+16
讨论:当X=1时,Z=17,这时为HCLO4和HCL
当X=2时,Z=18,这时为H2SO4和H2S
当X=3以后的不符合题意1年前查看全部
- 1到20号元素,气态氢化物最稳定的是?形成物质种类最多的元素是?
 kuaileouyang1年前1
kuaileouyang1年前1 -
 浒关 共回答了16个问题
浒关 共回答了16个问题 |采纳率93.8%HF,气态氢化物都是非金属氢化物,非金属氢化物的稳定性与非金属的非金属性有关,非金属性越强,所形成的气态氢化物越稳定.F是非金属性最强的元素,因此HF这个气态氢化物最稳定.
形成物质种类最多的元素是C,有机物中都含有碳元素,而有机物比无机物要多出很多很多.因此形成物质种类最多的元素是C.1年前查看全部
- 有X、Y、Z三种元素,已知: ①X 2- 、Y - 均与Y的气态氢化物分子具有相同的电子数; ②Z与Y可组成化合物ZY
有X、Y、Z三种元素,已知:
①X 2- 、Y - 均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY 3 ,ZY 3 溶液遇苯酚显紫色.
请回答:
(1)Y的最高价氧化物对应水化物的化学式是________.
(2)将ZY 3 溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________________.此液体具有的性质是________(填写序号字母).
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体.
①已知一定条件下,每1 mol该气体被O 2 氧化放热98.0 kJ.若2 mol该气体与2 mol O 2 在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为________.
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物.若有1.5×6.02×10 23 个电子转移时,该反应的化学方程式是________. 失落lose1年前0
失落lose1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 元素的气态氢化物稳定性和它的什么性质有关?在元素周期表上怎么变化?
 owen00181年前1
owen00181年前1 -
 诗人一夜 共回答了22个问题
诗人一夜 共回答了22个问题 |采纳率95.5%气态氢化物的稳定性与它的如下性质有关:
1、酸碱性:从左到右同周期酸性增强,从上到下同族酸性增强.
2、还原性:稳定性越高,还原性越弱;从左到右同周期还原性差弱,从上到下同族还原性增强.
3、反应性(活性):稳定性越高,反应活泼性越差;从上到下活泼性越强;从左到右活泼性越弱.1年前查看全部
- 某元素最高价氧化物的化学式是RO 2 ,已知其气态氢化物中含氢25%。
某元素最高价氧化物的化学式是RO 2 ,已知其气态氢化物中含氢25%。
(1)计算R的相对原子质量( 3分);
3分);
(2)写出R最高价氧化物对应的水化物的化学式(1分),并设计一个实验方案证明其酸性比盐酸弱。(3分) 女夭女尼1年前1
女夭女尼1年前1 -
 耶律不破 共回答了21个问题
耶律不破 共回答了21个问题 |采纳率90.5%1年前查看全部
- 一般来说,气态氢化物的化合价是该元素的最高正价么
一般来说,气态氢化物的化合价是该元素的最高正价么
rt 王大成1年前1
王大成1年前1 -
 z01832 共回答了20个问题
z01832 共回答了20个问题 |采纳率90%不是,是最低负价1年前查看全部
- 某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则Wg的气态氢化物中所含的电子的物质的量为(
某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则Wg的气态氢化物中所含的电子的物质的量为( ) A.
(A-N)molW A B.
(A-N+n)molW A+1 C.
(A-N+n)molW A+n D.
(A-N-n)molW A+n  最后的沙发1年前1
最后的沙发1年前1 -
 xiaobai417 共回答了16个问题
xiaobai417 共回答了16个问题 |采纳率87.5%元素R原子中含有电子数=质子数=质量数-中子数=A-N,形成氢化物是R得到n个电子,呈-n价,R离子中电子数为A-N+n,氢化物的相对分子质量为A+n,W g氢化物的物质的量为 W A+n mol,故氢化物中电子...1年前查看全部
- S与Br的气态氢化物水溶液的酸性哪个强?
S与Br的气态氢化物水溶液的酸性哪个强?
是不是比较H2SO4与HBrO4的酸性? 红头发1年前1
红头发1年前1 -
 看高人hh 共回答了18个问题
看高人hh 共回答了18个问题 |采纳率88.9%1.最高价氧化物对应水化物的酸性是与非金属性强弱是一致的,由于Br的非金属性比S强,因此HBrO4的酸性比H2SO4与的酸性强.
2.气态氢化物的稳定性也与非金属性是一致的,但气态氢化物的水溶液的酸性与非金属没有联系!按周期表,无论是从左到右,还是从上到下,气态氢化物水溶液的酸性都是逐渐增强的.
3.H2S是弱酸,HBr为强酸(比HCl还强),当然HBr的酸性比H2S强.
希望对你理解相关知识有帮助.1年前查看全部
- 某元素及其气态氢化物的化学式为H2R,其最高价氧化物中氧的质量分数是60%,求元素R的相对原子质量.
 hua_wch1年前1
hua_wch1年前1 -
 jumlaw 共回答了14个问题
jumlaw 共回答了14个问题 |采纳率92.9%你所提出的气态氢化物是H2S(硫化氢)R是硫,原子量是32(查元素周期表可以知道准确的原子量)1年前查看全部
- 下列大小顺序排列完全正确的组合是 [ ] ①气态氢化物的稳定性:HF>N
下列大小顺序排列完全正确的组合是 [ ]①气态氢化物的稳定性:HF>NH 3 >PH 3
②熔点:Na>C 3 H 8 >CH 3 OH
③离子半径:K + >Ca 2+ >S 2-
④相同温度、相同浓度的溶液中水的电离程度:NH 4 Cl>CH 3 COOH>HCl
A.①④
B.①②
C.②③
D.③④ sensebaby1年前1
sensebaby1年前1 -
 BIG_JHON 共回答了13个问题
BIG_JHON 共回答了13个问题 |采纳率100%A1年前查看全部
- A、B、C、D、E五种元素具有相同的电子层数,A和B的最高价氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物的
A、B、C、D、E五种元素具有相同的电子层数,A和B的最高价氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物的水溶液呈酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是( )
A. CDEAB
B. ECDAB
C. BAEDC
D. BADCE 珀色长空1年前3
珀色长空1年前3 -
 swisscottage 共回答了19个问题
swisscottage 共回答了19个问题 |采纳率89.5%解题思路:A和B的最高价氧化物对应的水化物呈碱性,且碱性B>A,则金属性:B>A,由同周期元素从左到右元素的金属性逐渐减弱判断原子序数大小;
C和D的气态氢化物的水溶液呈酸性,且酸性C>D,则C和D应为非金属性元素,同周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的酸性逐渐增强,据此判断原子序数;
五种元素形成的简单离子中,E的离子半径最小,E应为金属,A、B、C对应离子的核外电子排布相同,核电核数越大,半径越小,以此解答该题.A和B的最高价氧化物对应的水化物呈碱性,且碱性B>A,则金属性:B>A,由同周期元素从左到右元素的金属性逐渐减弱可知:原子序数A>B;
C和D的气态氢化物的水溶液呈酸性,且酸性C>D,则C和D应为非金属性元素,同周期元素从左到右,元素的非金属性逐渐增强,对应的氢化物的酸性逐渐增强,故原子序数C>D;
五种元素形成的简单离子中,E的离子半径最小,则E应为金属,A、B、C对应离子的核外电子排布相同,核电核数越大,半径越小,故原子序数B<A<E,
故有原子序数:C>D>E>A>B,
故选A.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查元素的位置性质结构关系应用,题目难度中等,掌握元素周期律的递变规律是解题关键,注意基础知识的理解掌握.1年前查看全部
- 写出氮的气态氢化物与硫的最高价氧化物对应水化物反应的化学方程式
 ccc6543211年前0
ccc6543211年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1乙二酸,丙二酸,丁二酸鉴别最好给说下为什么 XD~~
- 2硫的氢化物的化学式是什么
- 3吾尝终日而思矣,不如须臾之所学也.吾尝跂而望矣,不如登高之博见也.登高而招,臂非加长也,而见者远;
- 4“差”字加偏旁组词差字加偏旁组词,最主要的是组词
- 5弓字加部首在组词?急用!弓字加偏旁在组词至少两个以上,
- 6与“须臾”一词含义相近的文言词语还有哪些
- 7童话二分之一朱梓骁到底喜欢姐姐还是妹妹
- 8野餐这个英语怎么读?
- 9去野餐.英语怎么读?
- 10敏捷的近义词是什么
- 11姐姐有360元钱,妹妹有240元钱.他们为希望工程捐出了同样多的钱.姐姐剩下的钱数是妹妹剩下钱数的3倍.姐姐、妹妹捐了多
- 1260的20%等于40的(填分数)
- 13把10.20.30.40.50.60.70.80八个数分别填在小圆圈里,使每个大圆圈上五个数的和等于210
- 14氮的氢化物与氧化物如何反应
- 15敏捷的近义词是什么