溶度积常数受什么条件影响?具体影响是什么?如果向饱和的硫酸钡中加水,溶解度怎么变?溶度积常数怎么变?溶度积和溶解度之间有
 feitianAQZ2022-10-04 11:39:542条回答
feitianAQZ2022-10-04 11:39:542条回答具体影响是什么?如果向饱和的硫酸钡中加水,溶解度怎么变?溶度积常数怎么变?溶度积和溶解度之间有什么关系么?

已提交,审核后显示!提交回复
共2条回复
 希茜ofsun 共回答了20个问题
希茜ofsun 共回答了20个问题 |采纳率85%- 温度
比如BaSO4可逆符号Ba2+ + SO42-
他的 Ksp = [Ba2+][SO42-] []表示物质的浓度
温度不变 饱和硫酸钡中加水 溶液中Ba2+和SO42-浓度都不变 所以 Ksp不变
如果还有疑问 百度HI找我 详谈 - 1年前
 nnjjj 共回答了283个问题
nnjjj 共回答了283个问题 |采纳率- 只受温度影响。
- 1年前
相关推荐
- 已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10.在该温度下,向50mL 0.018mol/L的A
已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10.在该温度下,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀(混合后溶液的体积变化忽略不计).下列说法正确的是( )
A.AgCl的溶解性为难溶,则该物质不溶于水
B.沉淀生成后,溶液中Ag+的浓度1×10-5 mol/L
C.沉淀生成后,溶液的pH为2
D.沉淀生成后,溶液中NO3-的浓度1.8×10-2 mol/L naidongzhang1年前1
naidongzhang1年前1 -
 qgi6r 共回答了18个问题
qgi6r 共回答了18个问题 |采纳率88.9%解题思路:向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,n(AgNO3)<n(HCl),硝酸银完全反应生成沉淀,以此来解答.A.AgCl的溶解性为难溶,则该物质的溶解性很小,绝对不溶于水的物质不存在,故A错误;
B.c(Cl-)=0.01mol/L,c(Ag+)=0.009mol/L,反应后应c(Cl-)剩余0.001mol/L,溶液中c(Ag+)=
1×10−10
0.001=1×10-7mol/L,故B错误;
C.沉淀生成后,c(H+)=[0.05L×0.02mol/L/0.1L]=0.01mol/L,所以pH=2,故C正确;
D.沉淀生成后,溶液中NO3-的浓度为[0.05L×0.018mol/L/0.1L]=9×10-3mol/L,故D错误;
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查沉淀的生成,明确反应物的物质的量的关系及反应的实质是解答的关键,注意氢离子、硝酸根离子不参加反应,选项A为易错点.1年前查看全部
- 表是五种银盐的溶度积常数(25℃)。下列说法错误的是( )
表是五种银盐的溶度积常数(25℃)。下列说法错误的是( )
A.五种物质在常温下溶解度最大的是Ag 2 SO 4化学式 AgCl Ag 2 SO 4 Ag 2 S AgBr AgI 溶度积 1.8×10 -10 1.4×10 -5 6.3×10 -50 7.7×10 -13 8.5×10 -16
B.将AgCl溶解于水后,向其中加入Na 2 S则可以生成黑色沉淀
C.AgCl 、AgBr、AgI三种物质在常温下的溶解度按氯、溴、碘的顺序减小
D.向100ml0.1mol/LNa 2 SO 4 溶液中加入1mL0.1mol/L AgNO 3 溶液,有沉淀生成 sdgdfshf1年前1
sdgdfshf1年前1 -
 ze174 共回答了24个问题
ze174 共回答了24个问题 |采纳率91.7%D
1年前查看全部
- 一直Zn(OH)2的溶度积常数为1.2×10^-17mol/L,则其在水中溶解度为?
 常用邮箱11年前2
常用邮箱11年前2 -
 yobyob 共回答了13个问题
yobyob 共回答了13个问题 |采纳率76.9%设饱和Zn(OH)2中,[Zn2+]=a,忽略H2O的解离,则[OH-]=2a
a*(2a)^2=Ksp
即4a^3=1.2*10^-17
a=1.44*10^-6
显然此数值非常小,以至于H2O的解离不可忽略,上述假设有误
设[Zn2+]=a,[OH-]=b,则a*b^2=Ksp①,又易知[H+]=Kw/[OH-]=Kw/b
由电荷守恒,有2[Zn2+]+[H+]=[OH-],则2a+Kw/b=b②
由①可得a=Ksp/(b^2),代入②,则2Ksp/(b^2)+Kw/b=b③
以③用求根公式代入b=2.886*10^-6,则a=1.441*10^-6mol/L1年前查看全部
- 跪求~~~分析化学,关于溶度积常数和溶解度的问题
跪求~~~分析化学,关于溶度积常数和溶解度的问题
已知下列物质的溶度积常数,按下列要求计算溶解度
1.CaF2饱和溶液中各种离子浓度.(CaF2的溶度积常数=5.3*10^-9)
2.CaF2在0.1mol/LCaCl2溶液中的溶解度.(同上)
3.AgBr在0.1mol/L KBr溶液中的溶解度.(AgBr的溶度积常数=5.0*10^-13)
 残羽1231年前1
残羽1231年前1 -
 poplar213 共回答了18个问题
poplar213 共回答了18个问题 |采纳率83.3%1 c(Ca2+)*c^2(F-)=5.3*10^-9 因为CaF2为强电解质 所以c(Ca2+)=2c(F-)
2c^3(F-)=5.3*10^-9
c(F-)=
c(OH-)=c(H+)= 10^-71年前查看全部
- 已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2 溶液,加入一定量的烧碱溶液达到
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2 溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得PH=13,则下列说法不正确的( )
C 所加烧碱溶液的PH=13 tonyaniyah1年前4
tonyaniyah1年前4 -
 清风漫步者 共回答了15个问题
清风漫步者 共回答了15个问题 |采纳率93.3%加入的烧碱溶液的PH要大于13.因为原Mg(OH)2的酸碱度小于13所以加的碱性溶液PH要大于131年前查看全部
- 化学平衡常数(K)、弱酸的电离常数(Ka)、难溶物的溶度积常数(KSP)是判断物质性质或变化的重要的平衡常数.下列关于这
化学平衡常数(K)、弱酸的电离常数(Ka)、难溶物的溶度积常数(KSP)是判断物质性质或变化的重要的平衡常数.下列关于这些常数的说法中,正确的是( )
A. 平衡常数的大小与温度、浓度、压强、催化剂等有关
B. 当温度升高时,弱酸的电离常数Ka变小
C. KSP(AgCl)>KSP(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生
D. Ka(HCN)<Ka(CH3COOH),说明相同物质的量浓度时,氢氰酸的酸性比醋酸强 francicso1年前1
francicso1年前1 -
 tjx1984 共回答了23个问题
tjx1984 共回答了23个问题 |采纳率95.7%解题思路:A、平衡常数只与温度有关;
B、弱电解质电离平衡是吸热过程;
C、阴阳离子比相同的化合物的溶解性可以用Ksp进行比较,进行沉淀转化反应;
D、浓度相同时电离平衡常数越大酸性越强;A、平衡常数的大小与温度有关,与浓度、压强、催化剂等无关,故A错误;
B、弱电解质电离平衡是吸热过程;当温度升高时,弱酸的电离常数Ka变大,故B错误;
C、KSP(AgCl)>KSP(AgI),反应向更难溶的方向进行,AgCl(s)+I-=AgI(s)+Cl-能够发生,实现沉淀转化,故C正确;
D、Ka(HCN)<Ka(CH3COOH),说明相同物质的量浓度时,电离平衡常数越大酸性越强,所以氢氰酸的酸性比醋酸弱,故D错误;
故选C.点评:
本题考点: 化学平衡常数的含义;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了重要的各类平衡常数的影响因素和综合应用,主要考查弱电解质的电离平衡是些过程,沉淀转化的依据,电离平衡常数的应用.1年前查看全部
- 25度时,fe(oh)3溶度积常数为1.1*10^-36
25度时,fe(oh)3溶度积常数为1.1*10^-36
25度时,fe(oh)3溶度积常数为1.1*10^(-36)
下列能形成fe(oh)3悬浊液的是()
A.浓度均为1*10^(-5)mol/L的fecl3和氨水溶液等体积混合
B.2g Fe(oh)3放入1L的水中
C.0.1molFe2O3放入1mol/L的500ml盐酸中 bearcat_20061年前1
bearcat_20061年前1 -
 ruguo001 共回答了19个问题
ruguo001 共回答了19个问题 |采纳率89.5%A吧1年前查看全部
- 已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是( )
A.除去工业废水中的Cu2+可以选用FeS作沉淀剂
B.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
C.因为H2SO4是强酸,所以反应:CuSO4+H2S=CuS↓+H2SO4不能发生
D.将足量的CuSO4溶解在0.1mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L mlibinm1年前1
mlibinm1年前1 -
 bianyu16503 共回答了16个问题
bianyu16503 共回答了16个问题 |采纳率100%解题思路:A.根据溶度积大的沉淀可以转化为溶度积小的沉淀;
B.根据H2S与SO2反应生成单质硫和水;
C.CuS是不溶于酸的黑色物质,这是弱酸制备强酸的特例;
D.H2S是弱酸,硫离子的最大浓度为0.1 mol/L,根据CuS的溶度积常数(Ksp)为1.3×10-36即可求得.A.FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.FeS溶度积大于CuS溶度积,所以除去工业废水中的Cu2+可以选用FeS作沉淀剂,故A正确;
B.根据H2S与SO2反应生成单质硫和水,硫化氢被反应掉了,浓度减小,酸性减弱,故B错误;
C.CuS是不溶于酸的黑色物质,所以能发生反应:CuSO4+H2S═CuS↓+H2SO4,这是弱酸制备强酸的特例,故C错误;
D.H2S是弱酸,硫离子的最大浓度为0.1 mol/L,CuS的溶度积常数(Ksp)为1.3×10-36,所以溶液中Cu2+的最小浓度为1.3×10-35 mol/L,故D错误;
故选:A.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查了物质的性质、溶度积常数、反应原理等,难度不大,根据课本知识即可完成.1年前查看全部
- 25摄氏度时,MA沉淀的溶度积常数为1*10-20次方,为什么溶液的PH是7啊?
25摄氏度时,MA沉淀的溶度积常数为1*10-20次方,为什么溶液的PH是7啊?
按照常规算法应该是氢氧根离子浓度时10的负十次方吗?那么氢离子浓度应该是10的负4次方吗?PH=4?为什么这样理解不对? myungsil1年前1
myungsil1年前1 -
 ee布丁 共回答了18个问题
ee布丁 共回答了18个问题 |采纳率88.9%嘿嘿,不对.当酸碱稀到比水还稀(这个形容要听懂哈),溶液的氢离子和氢氧根离子是水提供的,25度时都是10^-71年前查看全部
- 难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ks
难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp).例如:Cu(OH)2
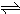 Cu2++2OH-,Ksp=c(Cu2+)•[c(OH-)]2=2×10-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
Cu2++2OH-,Ksp=c(Cu2+)•[c(OH-)]2=2×10-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于______.
(2)要使0.2mol•L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为______. Maravich1年前1
Maravich1年前1 -
 叶赟 共回答了22个问题
叶赟 共回答了22个问题 |采纳率81.8%解题思路:根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值.(1)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥
2×10−20
0.02mol/L=10-9mol/L,则c(H+)≤
1×10−14
10−9mol/L=10-5mol/L,
所以pH≥-lg(10-5)=5,故答案为:5;
(2)Cu2+沉淀较为完全是的浓度为[0.2mol/L/1000]=2×10-4mol/L,
则c(OH-)=
2×10−20
2×10−4mol/L═10-8mol/L,
则c(H+)=
1×10−14
10−8mol/L=10-6mol/L,
所以pH=-lg(10-6)=6,
故答案为:6.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查溶度积常数的计算,题目难度不大,注意把握计算公式的运用.1年前查看全部
- (2007•福田区模拟)已知卤化银的溶度积常数为:Ksp(AgCl)=1.8×10-10;Ksp(AgBr)=5.0×1
(2007•福田区模拟)已知卤化银的溶度积常数为:Ksp(AgCl)=1.8×10-10;Ksp(AgBr)=5.0×10-13;Ksp(AgI)=8.3×10-17.在1升含有Cl-、Br-、I-的混合溶液中,若[Cl-]=0.01mol/L,[Br-]=0.001mol/L,[I-]=1.0×10-4 mol/L,不断滴加AgNO3溶液共滴入AgNO30.051g,下列有关卤化银沉淀的说法正确的是( )
A.只有AgI沉淀析出
B.只有AgI和AgBr沉淀析出
C.有AgI、AgBr和AgCl三种沉淀析出
D.继续滴加AgNO3溶液还有沉淀析出 zhimahu1年前1
zhimahu1年前1 -
 锦衣卫小徐 共回答了14个问题
锦衣卫小徐 共回答了14个问题 |采纳率92.9%解题思路:根据溶度积常数和氯离子、溴离子和碘离子的浓度计算判断各沉淀生成时所需银离子的浓度,再根据加入的AgNO3,从而判断生成沉淀物质的先后顺序.AgCl、AgBr、AgI的浓度积(mol2/L2)分别为:1.8×10-10、5.0×10-13、8.3×10-17;
当生成AgCl沉淀时,所需银离子的浓度c(Ag+ )=[Ksp
C(Cl−)=
1.8×10−10/0.01]=1.8×10-8mol/l;
当生成AgBr沉淀时,所需银离子的浓度c(Ag+ )=[Ksp
C(Br−)=
5.0×10−13/0.001]=5.0×10-10mol/l;
当生成AgI沉淀时,所需银离子的浓度c(Ag+ )=
Ksp
C(I−)=
8.3×10−17
10−4=8.3×10-13mol/l;
1升含有Cl-、Br-、I-的混合溶液中,若[Cl-]=0.01mol/L,[Br-]=0.001mol/L,[I-]=1.0×10-4 mol/L,所以沉淀的先后顺序为:AgI、AgBr、AgCl,
已知n(Ag+)=3×10-4mol,生成AgI消耗Ag+为1.0×10-4 mol,Ag+与Br-反应时Br-过量,所以没有剩余的Ag+与Cl-反应即没有AgCl生成,所以只有AgI和AgBr沉淀析出;溶液中含有较多的Br-和Cl-,继续滴加AgNO3溶液还有沉淀析出,故BD正确.
故选BD.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了沉淀溶解平衡,根据溶度积常数计算溶液中离子的浓度,题目难度中等.1年前查看全部
- 已知Zn(OH)2的溶度积常数为1.2*10的负17次方,则Zn(OH)2的物质的量浓度为 如题,
已知Zn(OH)2的溶度积常数为1.2*10的负17次方,则Zn(OH)2的物质的量浓度为 如题,
这道题要怎样做? alasion1年前3
alasion1年前3 -
 遗忘的家园 共回答了16个问题
遗忘的家园 共回答了16个问题 |采纳率87.5%1.4*10^-6mol/L
解析:
Zn(OH)2=可逆=Zn2+ + 2OH-
设锌离子浓度为x,则氢氧根浓度为 2x
Ksp=[Zn2+]*[OH-]^2
=4x^3
=1.2*10^-17
解得:x=约={(1.2*10^-17)/4}^1/3=1.4*10^-6mol/L
这是大致的解法,忽略H2O的电离(氢氧根浓度为 2x=2.8*10^-6mol/L,比10^-7mol/L大了30倍可忽略)1年前查看全部
- 已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10 -18 、1.3×10 -36 。常温时下列说法
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10 -18 、1.3×10 -36 。常温时下列说法正确的是 [ ]
A.向H 2 S的饱和溶液中通入少量SO 2 气体,溶液的酸性增强
B.将足量的CuSO 4 溶解在0.1 mol/L的H 2 S溶液中,溶液中Cu 2+ 的最大浓度为1.3×10 -35 mol/L
C.因为H 2 SO 4 是强酸,所以反应CuSO 4 +H 2 S=CuS↓+H 2 SO 4 不能发生
D.除去工业废水中的Cu 2+ 可以选用FeS作沉淀剂 ハヤシ1年前1
ハヤシ1年前1 -
 meichuo 共回答了13个问题
meichuo 共回答了13个问题 |采纳率92.3%D1年前查看全部
- 下表是五种银盐的溶度积常数(25℃) 下列说法错误的是 [ ] A.五种
下表是五种银盐的溶度积常数(25℃) 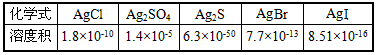
下列说法错误的是 [ ]A.五种物质在常温下溶解度最大的是Ag 2 SO 4
B.将氯化银溶解于水后,向其中加入Na 2 S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 心无所向1年前1
心无所向1年前1 -
 simon524199 共回答了14个问题
simon524199 共回答了14个问题 |采纳率78.6%C1年前查看全部
- 大学普化题目:利用电势求溶度积某学生为测定CuS的溶度积常数,设计如下原电池:正极为铜片浸在0.1mol/LCu2+的溶
大学普化题目:利用电势求溶度积
某学生为测定CuS的溶度积常数,设计如下原电池:正极为铜片浸在0.1mol/LCu2+的溶液中,再通入H2S气体使之达到饱和;负极为标准锌电极.测得电池电动势力0.670V.已知E0(Cu2+/Cu)=0.337V,E0(Zn2+/Zn)=-0.763V,H2S的K(a1)=1.3×10-7,K(a2)=7.1×10-15,求CuS的溶度积常数.
给分够多吧,要详细过程。
 rmggy1年前1
rmggy1年前1 -
 熊熊翠 共回答了19个问题
熊熊翠 共回答了19个问题 |采纳率94.7%这题目少了一个条件,就是饱和溶液硫化氢溶液的摩尔分数。
E负=E0(Zn2+/Zn)=-0.763V
E正=E0(Cu2+/Cu)=0.337V+0.0592/2 lg(Cu2+)
E正-E负=0.670V
这里可以求得沉淀后溶液铜离子浓度,为CuS溶度积乘积之一。
反应(Cu2+)+(H2S)=(CuS)+(2H+),
因为反应基本完全,所以氢离子浓度可认为等于原溶液铜离子浓度2倍即0.2mol/L,该反应的平衡常数K=[H]2/[H2S]*[Cu2+]
[S2-]=[Ka1]*[Ka2]*[H2S]/[H]2
所以知道饱和硫化氢浓度就能算了。1年前查看全部
- 物质在水溶液中的行为包括电离和溶解等,人们可以用电离常数和溶度积常数分别描述弱电解质的电离平衡和难
物质在水溶液中的行为包括电离和溶解等,人们可以用电离常数和溶度积常数分别描述弱电解质的电离平衡和难
溶电解质的溶解平衡。请用图示的方法总结物质在水溶液中的行为。 wbq6810121年前2
wbq6810121年前2 -
 tp15130 共回答了15个问题
tp15130 共回答了15个问题 |采纳率93.3%酸碱盐在溶液中都存在电离和溶解的问题.强酸碱及绝大部分的盐在水中几乎是完全电离的(HgCl2在水中虽然溶解度很大,但几乎是以分子形式存在,即电离非常弱),称为强电解质;而弱酸碱在溶液中则部分电离,即部分以阴、阳离子形式存在,部分以分子形式存在;弱酸强碱盐、弱碱强酸盐、弱酸弱碱盐在水中虽然完全电离,属于强电解质,但弱酸根、弱碱根却要发生部分水解(在分析化学中,采用共轭酸碱理论来划分酸碱,没有盐水解的概念,氯化铵的水溶液,铵根属于弱酸,不叫铵盐水解),部分电离或部分水解的电解质溶液,存在一个或多个酸碱平衡(指多元弱酸弱碱),平衡时的浓度商(严格讲称活度商)为一常数,这就是酸碱电离常数Ka、Kb,该常数的大小反映了酸碱盐电离或水解的程度.K值越大,反应越偏向右边,离解度越大(或水解度越大).
对于难溶电解质来说,在水中存在溶解-沉淀平衡,该平衡反映的是达到饱和溶液时,阴、阳离子平衡浓度(严格讲是活度)的幂的乘积为定值,即一常数Ksp,称为溶度积常数,它可用于判断同类沉淀在一定条件下溶解度的大小.利用Ksp值可以计算沉淀在水中的溶解度,当然,沉淀溶解度S随条件不同会有所变化,S受到酸效应、络合效应、同离子效应、盐效应、溶剂种类、温度等因素的影响,分析化学中的重量分析一章就要讲各种情况下的溶解度计算方法.
下图是几类平衡式及平衡常数与浓度的关系:
 1年前查看全部
1年前查看全部
- 氯化银在25度时溶解度为0.00192g求它的溶度积常数
 getstar1年前1
getstar1年前1 -
 newking19 共回答了21个问题
newking19 共回答了21个问题 |采纳率90.5%S=0.0192/(108+35.5)
Ksp=S^21年前查看全部
- (2014•山东模拟)25℃时,5种银盐的溶度积常数(Ksp)分别是:
(2014•山东模拟)25℃时,5种银盐的溶度积常数(Ksp)分别是:
下列说法正确的是( )AgCl Ag2SO4 Ag2S AgBr AgI 1.8×10-10 1.4×10-5 6.3×10-50 7.7×10-13 8.51×10-16
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C.在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol/L的AgNO3溶液,能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成 萤火虫二代1年前1
萤火虫二代1年前1 -
 jacksun0833 共回答了27个问题
jacksun0833 共回答了27个问题 |采纳率77.8%解题思路:A.结构相似的难溶性盐,溶度积越小,溶解度越小;
B.硫化银的溶度积比硫酸银小,从沉淀平衡移动的角度分析;
C.根据溶度积计算,当离子的浓度幂之积大于Ksp时,能生成沉淀,否则不生成沉淀;
D.当离子的浓度幂之积大于Ksp时,能生成沉淀.A.氯化银、溴化银和碘化银的溶度积依次减少,结构相似,溶度积越小,溶解度越小,故A错误;
B.硫化银的溶度积比硫酸银小,将硫酸银溶解于水后,向其中加入少量硫化钠溶液,可得到黑色沉淀,故B错误;
C.c(Cl-)=1.8×10-5mol/L×[5/5+0.05],c(Ag+)=1.0×10-3mol/L×[0.05/5+0.05],
则c(Cl-)×c(Ag+)=1.8×10-5mol/L×[5/5+0.05]×1.0×10-3mol/L×[0.05/5+0.05]<1.8×10-10(mol/L)2,不能析出沉淀,故C错误;
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,如满足c(Cl-)×c(Ag+)>1.8×10-10,则可生成沉淀,故D正确.
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度不大,本题注意根据溶度积计算,理解溶度积的意义,比较溶解度与溶度积之间的关系.1年前查看全部
- 高中化学溶度积常数:PbI2在水里的溶解度高还是在0.10M KI溶液里的高?
高中化学溶度积常数:PbI2在水里的溶解度高还是在0.10M KI溶液里的高?
PbI2在水里的溶解度高还是在0.10M KI溶液里的高?
有各种物质室温下Ksp的值.请问这种题的思路是什么?在线等谢谢! cowboyfeng1年前3
cowboyfeng1年前3 -
 我不需要爱 共回答了19个问题
我不需要爱 共回答了19个问题 |采纳率94.7%应该是在水里高,因为Ksp=[pb2+]·[I-]2,在KI溶液里的话,I-浓度比较大,因而其溶解度较小1年前查看全部
- 已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10 -18 、1.3×10 -36 。常温时下列说法
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10 -18 、1.3×10 -36 。常温时下列说法正确的是 [ ]A.向H 2 S的饱和溶液中通入少量SO 2 气体,溶液的酸性增强
B.将足量的CuSO 4 溶解在0.1 mol/L的H 2 S溶液中,溶液中Cu 2+ 的最大浓度为1.3×10 -35 mol/L
C.因为H 2 SO 4 是强酸,所以反应CuSO 4 +H 2 S=CuS↓+H 2 SO 4 不能发生
D.除去工业废水中的Cu 2+ 可以选用FeS作沉淀剂 ysf10041年前1
ysf10041年前1 -
 lilili55 共回答了24个问题
lilili55 共回答了24个问题 |采纳率87.5%D1年前查看全部
- (2012•太原三模)已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.
(2012•太原三模)已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是( )
A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应:CuSO4+H2S═CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 cjtx1年前1
cjtx1年前1 -
 ャ糖豆 共回答了17个问题
ャ糖豆 共回答了17个问题 |采纳率94.1%解题思路:A.根据H2S与SO2反应生成单质硫和水;
B.H2S是弱酸,硫离子的最大浓度为0.1 mol/L,根据CuS的溶度积常数(Ksp)为1.3×10-36即可求得;
C.CuS是不溶于酸的黑色物质,这是弱酸制备强酸的特例,
D.根据溶度积大的沉淀可以转化为溶度积小的沉淀;A.根据H2S与SO2反应生成单质硫和水,硫化氢被反应掉了,浓度减小,酸性减弱,故A错误;
B.H2S是弱酸,硫离子的最大浓度为0.1 mol/L,CuS的溶度积常数(Ksp)为1.3×10-36,所以溶液中Cu2+的最小浓度为1.3×10-35 mol/L,故B错误;
C.CuS是不溶于酸的黑色物质,所以能发生反应:CuSO4+H2S═CuS↓+H2SO4,这是弱酸制备强酸的特例,故C错误;
D.FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.FeS溶度积大于CuS溶度积,所以除去工业废水中的Cu2+可以选用FeS作沉淀剂,故D正确;
故选:D;点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查了物质的性质、溶度积常数、反应原理等,难度不大,根据课本知识即可完成.1年前查看全部
- 下表是五种银盐的溶度积常数(25℃):
下表是五种银盐的溶度积常数(25℃):
下列说法错误的是( )化学式 AgCl Ag2SO4 Ag2S AgBr AgI 溶度积 1.8×10-10 1.4×10-5 6.3×10-50 7.7×10-13 8.51×10-16
A. 五种物质在常温下溶解度最大的是Ag2SO4
B. 将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C. 对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D. 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 夏欣欣1年前4
夏欣欣1年前4 -
 ahqy148 共回答了14个问题
ahqy148 共回答了14个问题 |采纳率92.9%解题思路:A.Ag2SO4的Ksp最大,所以其溶解度最大;
B.硫化银的溶度积比硫酸银小,从沉淀平衡移动的角度分析;
C.结构相似的难溶性盐,溶度积越小,溶解度越小;
D.难溶电解质的溶解平衡是一定条件下的动态平衡.A.由表中数据可知溶度积最大的是Ag2SO4,Ag2SO4微溶于水,其它物质难溶,所以Ag2SO4溶解度最大,故A正确;
B.Ag2S溶度积远小于AgCl,Ag2S难溶于水,在AgCl的饱和溶液中加入Na2S,则可以生成黑色的Ag2S沉淀,故B正确;
C.结构相似的难溶性盐,溶度积越小,溶解度越小,由表格中的数据可知AgCl、AgBr、AgI的溶解度依次减小,所以对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小,故C错误.
D.难溶电解质的溶解平衡是一定条件下的动态平衡,当条件改变,平衡要发生移动,故D正确;
故选:C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度中等,本题注意比较表中数据,把握溶解平衡的特征以及影响因素.1年前查看全部
- 20摄氏度时 硫酸钡的溶度积常数为十的负十二次方 求硫酸钡在纯水中的溶解度
 笨苯的小鸟1年前0
笨苯的小鸟1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某温度下HF的电离常数Ka=3.3×10-4 mol•L-1,CaF2的溶度积常数Ksp=1.46×10-1
某温度下HF的电离常数Ka=3.3×10-4 mol•L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol•L-1)3.在该温度下将浓度为0.31mol•L-1的HF溶液与浓度为0.0O2 mol•L-1的CaCl2溶液等体积混合.下列说法正确的是( )
C.两溶液混合后不会产生沉淀
某温度下浓度为0.31mol•L-1的HF溶液中c(H+)=c(F-)=1×10-2mol/L,在该温度下将浓度为0.31mol•L-1的HF溶液与浓度为0.0O2 mol•L-1的CaCl2溶液等体积混合,c(F-)=0.5×10-2mol/L,c(Ca2+)=1×10-3mol/L,c2(F-)×c(Ca2+)=0.25×10-4×1×10-3=2.5×10-8>1.46×10-10,该体系中有CaF2沉淀产生,故C错误;
我想问的是为什么c(F-)=0.5×10-2mol/L?不应该是1×10-2mol/L吗?
 20011280411年前1
20011280411年前1 -
 花也愁 共回答了23个问题
花也愁 共回答了23个问题 |采纳率87%原来溶液中c(F-)=1×10-2mol/L,等体积混合,溶液体积增大一倍,则溶液减少一倍,
所以c(F-)=0.5×10-2mol/L1年前查看全部
- (2014•九江三模)已知常温下,Cu(OH)2的溶度积常数为Ksp=2×10-20.又知常温下某CuSO4溶液里Cu2
(2014•九江三模)已知常温下,Cu(OH)2的溶度积常数为Ksp=2×10-20.又知常温下某CuSO4溶液里Cu2+浓度为0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于______.
 常疯1年前1
常疯1年前1 -
 Vinica 共回答了16个问题
Vinica 共回答了16个问题 |采纳率75%解题思路:根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值.某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥
2×10−20
0.02mol/L=10-9mol/L,则c(H+)≤
1×10−14
10−9mol/L=10-5mol/L,所以pH≥-lg(10-5)=5,即应调整溶液pH大于5;
故答案为:5.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了Ksp的有关计算、pH的计算,侧重于公式的应用的考查,题目难度不大,考查了学生解决问题的能力和计算能力.1年前查看全部
- P89.已知AgCl AgBr AgI 的溶度积常数分别是1.8×10-10、5.0×10-13、8.3×10-17,下
P89.
已知AgCl AgBr AgI 的溶度积常数分别是1.8×10-10、5.0×10-13、8.3×10-17,下列转化可以实现的是
A、AgBr+NaCl=AgCl+NaBr
B、AgI+NaCl=AgCl+NaI
C、AgI+KBr=AgBr=KI
D、AgCl+KBr=AgBr=KCl答案是D 我想知道做这种题应该从哪里入手,怎么分析,请将的详细点, 草草和小鱼1年前2
草草和小鱼1年前2 -
 魔芋粉hh 共回答了13个问题
魔芋粉hh 共回答了13个问题 |采纳率92.3%难溶于水的物质反应只会产生更难溶于水的物质,由题中可知AgCl AgBr AgI 一个比一个难溶解,可以推出只能由前面物质反应生成后面物质,显然A,B,C均错误1年前查看全部
- (2014•安徽模拟)已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定
(2014•安徽模拟)已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=12.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-12 mol•L-1
B.所加的烧碱溶液pH=12.0
C.所得溶液中由水电离产生的c(OH-)=1.0×10-12mol•L-1
D.所得溶液中的c(Mg2+)=5.6×10-8 mol•L-1 edmondchem1年前1
edmondchem1年前1 -
 czf_10 共回答了19个问题
czf_10 共回答了19个问题 |采纳率100%解题思路:A.根据c (H+)=10-PHmol•L-1计算;
B.根据烧碱与MgCl2溶液反应生成沉淀,消耗了NaOH溶液;
C.溶液中由水电离产生的c(OH-)水=c (H+)水=10-PHmol•L-1;
D.先根据水的离子积常数求出c(OH-),然后再溶度积计算.A.pH=12的溶液中,c (H+)=10-12mol/L,故A正确;
B.烧碱与MgCl2溶液反应生成沉淀,消耗了NaOH溶液,向MgCl2溶液中加NaOH溶液后混合溶液的pH=12,则所加NaOH溶液pH>12,故B错误;
C.溶液中由水电离产生的c(OH-)水=c (H+)水=10-12mol/L,故C正确;
D.溶液中c(OH-)=
1×10 −14
1.0×10 −12 =10-2mol/L,溶液中的c (Mg2+)=
5.6×10 −12
10−2×10 −2=5.6×10-8 mol•L-1,故D正确;
故选:B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;pH的简单计算.
考点点评: 本题考查难溶电解质的溶解平衡的相关计算和判断,题目难度中等,本题注意溶度积常数的利用.1年前查看全部
- 碘化铅溶度积常数怎么测定
 挥手zz1年前1
挥手zz1年前1 -
 月影寒星 共回答了18个问题
月影寒星 共回答了18个问题 |采纳率100%对于物质PbI2(s)== 铅离子(aq)+ 2碘离子(aq),
溶度积(Ksp)= 溶液中铅离子的浓度*碘离子浓度的平方
另外,因为是常数,所以是可以查表知道的1年前查看全部
- 化学平衡常数(K)、弱酸的电离平衡常数(K a )、难溶物的溶度积常数(K sp )是判断物质性质或变化的重要的平衡常数
化学平衡常数(K)、弱酸的电离平衡常数(K a )、难溶物的溶度积常数(K sp )是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关 B.当温度升高时,弱酸的电离平衡常数K a 变小 C.K sp (AgCl)>K sp (AgI),由此可以判断AgCl(s)+I - (aq)=AgI(s)+Cl - (aq)能够发生 D.K a (HCN) a (CH 3 COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强  shui_he1年前1
shui_he1年前1 -
 小木船1 共回答了17个问题
小木船1 共回答了17个问题 |采纳率88.2%C
平衡常数的大小只与温度有关,A项错误;弱酸的电离平衡为吸热反应,升高温度,电离平衡常数增大,B项错误;电离平衡常数越大,其电离能力越强,酸性越强,D项错误1年前查看全部
- 根据下表相关物质的溶度积常数,回答有关问题:
根据下表相关物质的溶度积常数,回答有关问题:
(1)MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,可加入过量难溶的MnS生成金属硫化物沉淀而除去.据此可知CdS的溶度积比MnS______(填“大”或“小”),写出用MnS除去Cd2+时反应的离子方程式______.物质 Cu(OH)2 Fe(OH)3 CuS PbS MnS Ksp 2.2×10-20 2.6×10-39 6.3×10-36 8×10-28 2×10-10
(2)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入______,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=______.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(3)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是(用化学方程式表示)2CuCl2•2H2O
Cu(OH)2•CuCl2+2HCl+2H2O△ .2CuCl2•2H2O;由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是______.
Cu(OH)2•CuCl2+2HCl+2H2O△ . SMSOULZY1年前1
SMSOULZY1年前1 -
 ingyoot 共回答了19个问题
ingyoot 共回答了19个问题 |采纳率89.5%解题思路:(1)相同类型的离子化合物中,溶解度大的物质向溶解度小的物质转化;
(2)加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质,先根据溶液的pH计算氢离子浓度,再结合水的离子积常数计算氢氧根离子浓度,最后根据c(Fe3+)=
计算铁离子浓度;Kw[Fe(OH)3] C3(OH−)
(3)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;(1)MnS和CdS的类型相同,都是金属硫化物,溶解度大的物质能向溶解度小的物质转化,所以CdS的溶度积比MnS小,则其离子方程式为Cd2++MnS=Mn2++CdS,
故答案为:小,Cd2++MnS=Mn2++CdS;
(2)为得到纯净的CuCl2•2H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为氯化铜,所以应该加入含铜元素和氢氧根离子的物质,可以是氢氧化铜或碱式碳酸铜;
溶液的pH=4,所以溶液中氢离子浓度为10-4 mol/L,则氢氧根离子浓度为10-10 mol/L,c(Fe3+)=
Kw[Fe(OH)3]
C3(OH−)=
2.6×10−39
(1×10−10)3mol/L=2.6×10-9mol/L;
故答案为:Cu(OH)2或Cu2(OH)2CO3 ;2.6×10-9mol/L;
(3)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体,而不是CuCl2,2CuCl2•2H2O
△
.
Cu(OH)2•CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl2•2H2O晶体在干燥的HCl气流中加热脱水,
故答案为:2CuCl2•2H2O
△
.
Cu(OH)2•CuCl2+2HCl+2H2O,在干燥的HCl气流中加热脱水.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查Ksp计算和物质制备,难点是分析(3)题中得到纯的无水CuCl2的合理方法,明确水解原理是解本题的关键,难度较大.1年前查看全部
- 常温下 Cu(oH)2 溶度积常数Ksp=2* 10 ^-20
常温下 Cu(oH)2 溶度积常数Ksp=2* 10 ^-20
要使C (Cu2+)=0.2 mol/l 的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的千分之一) 则应向溶液中加入 氢氧化钠溶液,使溶液PH为
多少?
6 还是 8 fenzu1年前1
fenzu1年前1 -
 huanzhidao 共回答了17个问题
huanzhidao 共回答了17个问题 |采纳率64.7%[Cu2+] = 0.2/1000 = 2*10^-4
ksp公式:[Cu2+]*[OH-]^2 = ksp
--> [OH-] = (ksp/[Cu2+])的平方根 = 10^-8
--> [H+] = 10^-14/[OH-] = 10^-6
--> pH = -log[H+] = 61年前查看全部
- 难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各种离子的浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各种离子的浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。例如:Cu(OH) 2 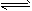 Cu 2+ +2OH - ,Ksp=c(Cu 2+ )·[c(OH - )] 2 =
Cu 2+ +2OH - ,Ksp=c(Cu 2+ )·[c(OH - )] 2 =
2×10 -20 。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO 4 溶液里c(Cu 2+ )=0.02 mol/L,如要生成Cu(OH) 2 沉淀,应调整溶液的pH,使之大于__________________。(请列出必要的计算过程)
(2)要使0.2 mol·L -1 CuSO 4 溶液中Cu 2+ 沉淀较为完全(使Cu 2+ 浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,溶液的pH为__________________。(请列出必要的计算过程) twinkle_z1年前1
twinkle_z1年前1 -
 打火机没气了 共回答了14个问题
打火机没气了 共回答了14个问题 |采纳率85.7%(1)5
(2)61年前查看全部
- 氢氧化铜、氢氧化铁、氢氧化亚铁的溶度积常数分别是多少?
 -不收现金的女人1年前2
-不收现金的女人1年前2 -
 岛正巳 共回答了12个问题
岛正巳 共回答了12个问题 |采纳率91.7%1.Cu(OH)2 :2.2*10^-20 (18 --25 摄氏度)
2.Fe(OH)2:1.64*10^ -14 (18摄氏度)
3.Fe(OH)3:1.1*10^-36 (18摄氏度)
注意:1.的数据来自课本 ; 2,3的数据来自教早的化学手册.共参考1年前查看全部
- 难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(K
难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(K sp ).例如:Cu(OH) 2 
Cu 2+ +2OH - ,K sp =c(Cu 2+ )•[c(OH - )] 2 =2×10 -20 .当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO 4 溶液里c(Cu 2+ )=0.02mol/L,如果生成Cu(OH) 2 沉淀,应调整溶液pH,使之大于______.
(2)要使0.2mol•L -1 CuSO 4 溶液中Cu 2+ 沉淀较为完全(使Cu 2+ 浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为______. 黑寂!1年前1
黑寂!1年前1 -
 qius 共回答了21个问题
qius 共回答了21个问题 |采纳率100%(1)某CuSO 4 溶液里c(Cu 2+ )=0.02mol/L,如果生成Cu(OH) 2 沉淀,则应有c(OH - )≥
2× 10 -20
0.02 mol/L=10 -9 mol/L,则c(H + )≤
1× 10 -14
10 -9 mol/L=10 -5 mol/L,
所以pH≥-lg(10 -5 )=5,故答案为:5;
(2)Cu 2+ 沉淀较为完全是的浓度为
0.2mol/L
1000 =2×10 -4 mol/L,
则c(OH - )=
2× 10 -20
2× 10 -4 mol/L═10 8 mol/L,
则c(H + )=
1× 10 -14
10 -8 mol/L=10 -6 mol/L,
所以pH=-lg(10 -6 )=6,
故答案为:6.1年前查看全部
- 下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是 [ ] A.
下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是  [ ]
[ ]A.五种物质在常温下溶解度最大的是Ag 2 SO 4
B.将AgCl溶解于水后,向其中加入Na 2 S,则可以生成黑色的Ag 2 S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度随着氯、溴、碘的顺序逐渐增大 小晓晓111年前1
小晓晓111年前1 -
 紫色野草莓 共回答了20个问题
紫色野草莓 共回答了20个问题 |采纳率95%D1年前查看全部
- 急求钨酸的溶度积常数防止钨酸沉淀形成,PH值应控制为多少?
 H雨LAN1年前1
H雨LAN1年前1 -
 minihouse1 共回答了23个问题
minihouse1 共回答了23个问题 |采纳率100%钨酸
名称 钨酸
英文名 Tungstic acid;Wolframic acid
分子式 H2WO4
产品用途 主要用于制金属钨、钨丝、硬质合金、钨酸盐类;也可用作印染助剂
CAS号 7783-03-1
物化性质
黄色粉末.
相对密度5.5
沸点1473℃
加热至100℃时失去1分子水变成钨酸酐
微溶于热水,溶于碱、氢氟酸和氨水,几乎不溶于酸.
分子量 249.86
消耗定额 钨酸钙-盐酸分解法 仲钨酸铵-盐酸分解法1年前查看全部
- 氢氧化铝和碳酸铝的溶度积常数分别是多少?pH等于多少时三价铁沉淀完全?
 zuochaoyong1年前3
zuochaoyong1年前3 -
 流言有一千分贝 共回答了12个问题
流言有一千分贝 共回答了12个问题 |采纳率100%无水 氢氧化铝 Al(OH) 3 20°C 1.9×10 –33 L 无水 氢氧化铝 Al(OH) 3 25°C 3×10 –34 w 1 三水合 氢氧化铝 Al(OH) 3 20°C 4×10 –13 C 三水合 氧化铝 Al(OH) 3 25°C 3.7×10 –13 C PH=1.91年前查看全部
- 一定的温度下,难溶化合物的溶度积常数取决于
 fanzidan1年前3
fanzidan1年前3 -
 zlyzhuliyong 共回答了27个问题
zlyzhuliyong 共回答了27个问题 |采纳率96.3%一定的温度下,难溶化合物的溶度积常数取决于 饱和溶液中离子的浓度1年前查看全部
- 常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5 mol3•
常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5 mol3•L-3、Ksp(AgCl)=1.8×10-10 mol2•L-2、Ksp (AgI)=8.3×10-17 mol2•L-2.下列有关说法中,错误的是( )
A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减小
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出 aliice1年前1
aliice1年前1 -
 MUMUPI 共回答了21个问题
MUMUPI 共回答了21个问题 |采纳率95.2%解题思路:因为硫酸银、氯化银、碘化银的化学式不类似,故需要根据其浓度积常数计算出银离子的浓度,不难判断出A、B正确,C错误;在Ag2SO4饱和溶液中加入Na2SO4固体,[SO42-]增大,
Qc>Ksp,故有Ag2SO4沉淀析出.A、在Ag2SO4饱和溶液中,Ksp(Ag2SO4)=7.7×10-5 mol3•L-3=4c3(Ag+),因此c(Ag+)≈8.78×10-2mol/L,
在AgCl饱和溶液中,Ksp(AgCl)=1.8×10-10 mol2•L-2=c(Ag+)•c(Cl-)=c2(Ag+),因此c(Ag+)≈1.34×10-5mol/L
在AgI饱和溶液中,Ksp(AgI)=8.3×10-17mol2/L-2=c(Ag+)•c(I-)=c2(Ag+),因此c(Ag+)≈9×10-8mol/L.
所以常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减小,故A正确;
B、AgCl比AgI的溶度积常数大,说明AgI难溶,在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成,故B正确;
C、AgCl和AgI满足,但Ag2SO4不满足,Ksp(Ag2SO4)=[Ag+]2[SO42-],由于含有[Ag+]2项,因此它与另外两种的溶度积之比中含有[Ag+],故C错误:
D、在Ag2SO4饱和溶液中加入Na2SO4固体,[SO42-]增大,Qc>Ksp,故有Ag2SO4沉淀析出,故D正确.
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡,本题难度中等,注意平衡常数的理解和运用.1年前查看全部
- 【溶度积常数】求AgCl与Ag2S的溶度积常数(Ksp)值,20℃,18℃,25℃均可
 雨雨雨儿1年前0
雨雨雨儿1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下表是五种银盐的溶度积常数K3p(25°),下列说法不正确的是( )
下表是五种银盐的溶度积常数K3p(25°),下列说法不正确的是( )
化学式 AgCl Ag2SO4 Ag2S AgBr Agl 溶度积 1.4×10-10 1.4×10-5 6.4×10-50 7.7×-13 8.51×10-16
A.25℃时五种银盐的饱和溶液中,c(Ag+)最小的是Ag2S溶液
B.25℃时,将Ag2S固体溶解到浓度为0.001mol•L-1的Na2S溶液中达到饱和,此时c(Ag+)=8.0×10-24mol•L-1
C.25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同
D.AgBr沉淀可以转化成Agl沉淀,而Agl沉淀在一定条件下也可以转化成AgBr沉淀 easylifetobe1年前1
easylifetobe1年前1 -
 咿呀咿呀哦 共回答了18个问题
咿呀咿呀哦 共回答了18个问题 |采纳率88.9%解题思路:由表中数据可知溶度积最大的是Ag2SO4,最小的是Ag2S,AgCl、AgBr、AgI的溶解度依次减小.反应向更难溶的方向进行;沉淀溶解平衡中溶度积是常数.
A、由表中数据可知溶度积最小的是Ag2S,其溶解度也最小,则c(Ag+)最小;
B、根据 Ksp(Ag2S)=c2(Na+)•c(S2-)=6.4×10-50,c(S2-)=0.001mol•L-1,计算c(Ag+)=8.0×10-24mol•L-1;
C、在等物质的量浓度的NaCl、CaCl2两溶液中氯离子的浓度为1:2,根据 Ksp(AgCl)=c(Ag+)•c(Cl-),则两溶液中AgCl的溶度积相同,c(Ag+)不相同;
D、AgI的溶度积小于AgBr的溶度积,AgBr的溶度积小于AgCl的,反应向更难溶的方向进行.A、由表中数据可知溶度积最小的是Ag2S,其溶解度也最小,则c(Ag+)最小,故A正确;
B、根据 Ksp(Ag2S)=c2(Na+)•c(S2-)=6.4×10-50,计算c(Ag+)=8.0×10-24mol•L-1,故B正确;
C、在等物质的量浓度的NaCl、CaCl2两溶液中氯离子的浓度为1:2,根据 Ksp(AgCl)=c(Ag+)•c(Cl-),则两溶液中AgCl的溶度积相同,c(Ag+)不相同,故C错误;
D、AgI的溶度积小于AgBr的溶度积,AgBr的溶度积小于AgCl的,反应向更难溶的方向进行,故可以转化,故D正确;
故选:C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度不大,本题注意根据溶度积计算,理解溶度积的意义,比较溶解度与溶度积之间的关系.1年前查看全部
- 某温度下HF的电离常数Ka=3.3×10-4 mol/L,CaF2的溶度积常数Ksp=1.46×10-10(m
某温度下HF的电离常数Ka=3.3×10-4 mol/L,CaF2的溶度积常数Ksp=1.46×10-10(mol/L)3.在该温度下取浓度为0.31mol/L的HF与浓度为0.002mol/L的CaCl2溶液等体积混合.下列说法正确的是( )
A.该温度下,0.31 mol•L HF溶液的pH=2
B.升高温度或增大浓度,HF的电离平衡常数都将增大
C.两溶液混合后不会产生沉淀
D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小 米花饭团ux1年前1
米花饭团ux1年前1 -
 荡漾de花 共回答了19个问题
荡漾de花 共回答了19个问题 |采纳率94.7%解题思路:A.HF为弱电解质,不能完全电离,根据HF的电离常数Ka求算;B.溶度积只受温度的影响;C.根据溶度积计算是否有沉淀生成;加入CaCl2溶液促进HF的电离;D.根据饱和的CaF2溶液加水后变成不饱和溶液.A.电离常数Ka(HF)=3.3×10-4 ,HF为弱电解质,不能完全电离,某温度下,0.1mol•L-1HF溶液中c(H+)=
Ka×c(F−)=
3.3×10−4×0.31mol/L=1×10-2mol/L,所以溶液的pH=2,故A正确;
B.溶度积只受温度的影响,不随浓度的变化而变化,故B错误;
C.某温度下浓度为0.31mol•L-1的HF溶液中c(H+)=c(F-)=1×10-2mol/L,在该温度下将浓度为0.31mol•L-1的HF溶液与浓度为0.0O2 mol•L-1的CaCl2溶液等体积混合,c(F-)=0.5×10-2mol/L,c(Ca2+)=1×10-3mol/L,c2(F-)×c(Ca2+)=0.25×10-4×1×10-3=2.5×10-8>1.46×10-10,该体系中有CaF2沉淀产生,故C错误;
D.饱和的CaF2溶液加水后变成不饱和溶液,所以c(Ca2+)一定比加水前小,故D正确;
故选AD.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质电离平衡常数的应用,难溶电解质的溶解平衡的计算和判断,题目难度中等,本题注意把握溶度积常数的计算公式的运用.1年前查看全部
- 已知AgCl的溶度积常数为Ksp,[Ag(NH3)2]+的稳定常数为Ks,则反应
已知AgCl的溶度积常数为Ksp,[Ag(NH3)2]+的稳定常数为Ks,则反应
AgCl(s) + 2 NH3 = [Ag(NH3)2]+ + Cl-的平衡常数 K为
A.KsKsp
B.1/ KsKsp
C.Ks/Ksp
D.Ksp/Ks abgod1年前1
abgod1年前1 -
 coolcatzm 共回答了15个问题
coolcatzm 共回答了15个问题 |采纳率86.7%AgCl(s) + 2 NH3 = [Ag(NH3)2]+ + Cl-的平衡常数K=c([Ag(NH3)2]+) *c(Cl-) /c(NH3)^2=c([Ag(NH3)2]+) *c(Cl-)*c(Ag+) /c(NH3)^2*c(Ag+)=c(Cl-)*c(Ag+) *[ c([Ag(NH3)2]+) /c(NH3)^2*c(Ag+)]=Ksp*Ks因此选择A...1年前查看全部
- 氢氧化铝的溶度积常数应该为5承以10的负33次方吧
 xff_c1年前1
xff_c1年前1 -
 白云千载空悠悠45 共回答了14个问题
白云千载空悠悠45 共回答了14个问题 |采纳率85.7%不是5承以10的负33次方
是1.3承以10的负33次方(常数是不会变的)---方法会了,什么数都能处理1年前查看全部
- 已知相关物质的溶度积常数见下表:
已知相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入______,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=______.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.物质 Cu(OH)2 Fe(OH)3 CuCl CuI Ksp 2.2×10-20 2.6×10-39 1.7×10-7 1.3×10-12
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O
Cu(OH)2•CuCl2+2HCl+2H2O△ .2CuCl2•2H2O(用方程式表示).由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在HCl气流中加热蒸发.用文字叙述其原理:______.
Cu(OH)2•CuCl2+2HCl+2H2O△ .
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI).用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(所发生的离子反应:I2+2S2O32-═2I-+S4O62-).
①可选用______作滴定指示剂,滴定终点的现象是______.
②CuCl2溶液与KI反应的离子方程式为______.
③该试样中CuCl2•2H2O的纯度为______. 千万别当cc1年前1
千万别当cc1年前1 -
 fv1iav 共回答了20个问题
fv1iav 共回答了20个问题 |采纳率95%解题思路:(1)加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质,先根据溶液的pH计算氢离子浓度,再结合水的离子积常数计算氢氧根离子浓度,最后根据c(Fe3+)=
计算c(Fe3+);KW[Fe(OH)3] C3(OH−)
(2)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;
(3)依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀,和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,根据物质间的关系式进行计算.(1)为得到纯净的CuCl2•2H2O晶体要除去氯化铁,则溶液中的Fe3+转化为Fe(OH)3沉淀,加入物质能与酸反应能转化为氯化铜,且不能引进杂质,可以是Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3;
溶液的pH=4,所以溶液中氢氧根离子浓度为10-4 mol/L,则氢氧根离子浓度为10-10 mol/L,c(Fe3+)=
KW[Fe(OH)3]
C3(OH−)=
2.6×10−39
(1×10−10)3=2.6×10-9mol/L,
故答案为:Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3;2.6×10-9mol/L;
(2)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体,而不是CuCl2,反应方程式为:2CuCl2•2H2O
△
.
Cu(OH)2•CuCl2+2HCl+2H2O,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解,并带走水蒸气,
故答案为:2CuCl2•2H2O
△
.
Cu(OH)2•CuCl2+2HCl+2H2O;抑制水解,带走水蒸气;
(3)测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL;反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,
①硫代硫酸钠滴定碘单质,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点时溶液蓝色褪去,且半分钟内不变色,
故答案为:淀粉溶液;溶液蓝色褪去,且半分钟内不变色;
②CuCl2溶液与KI反应的离子方程式为为:2Cu2++4I-═2CuI↓+I2,
故答案为:2Cu2++4I-═2CuI↓+I2;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-═2CuI↓+I2;
得到 2Na2S2O3 ~2Cu2+
22
0.1000mol/L×0.0200L0.002mol
则CuCl2•2H2O的物质的量为:0.002mol,
试样中CuCl2•2H2O的质量百分数为[0.002mol/L×171g/mol/0.36g]×100%=95%,
故答案为:95%.点评:
本题考点: 铜金属及其重要化合物的主要性质;难溶电解质的溶解平衡及沉淀转化的本质;探究物质的组成或测量物质的含量.
考点点评: 本题考查Ksp计算和物质制备,利用平衡移动原理、氧化还原滴定分析解答,明确滴定过程的反应原理和计算方法是解本题的关键,注意加热灼烧CuCl2溶液和CuSO4溶液得到固体的区别,为易错点.1年前查看全部
- 为什么用溶度积常数算Baso4+Naco3=Baco3+Naso4可以反应?以前高中不是说难溶制更难溶么?Baso4比B
为什么用溶度积常数算Baso4+Naco3=Baco3+Naso4可以反应?以前高中不是说难溶制更难溶么?Baso4比Baco3难啊
 诉离愁1年前3
诉离愁1年前3 -
 989093269 共回答了21个问题
989093269 共回答了21个问题 |采纳率90.5%当2种沉淀组成一样(AB型),KSp接近的时候.更难溶的可以转化为难溶的.不过这个转化要经过很多次加入Na2CO3溶液.1年前查看全部
- 氢氧化铜的溶度积常数
 狐汉三1年前1
狐汉三1年前1 -
 等待是一种美丽 共回答了22个问题
等待是一种美丽 共回答了22个问题 |采纳率86.4%答:是1.0×10-141年前查看全部
- 25℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为:Ksp(FeS)=6.3×10-18 mol2•
25℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为:Ksp(FeS)=6.3×10-18 mol2•L-2;Ksp(CuS)=1.3×10-36 mol2•L-2;Ksp(ZnS)=1.6×10-24 mol2•L-2.下列关于常温时的有关叙述正确的是( )
A.硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B.除去工业废水中含有的Cu2+,可采用FeS 固体作为沉淀剂
C.将足量的ZnSO4晶体加入到0.1 mol•L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-2 3 mol•L-1
D.向饱和的FeS 溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,但Ksp(FeS)变大 vate20071年前1
vate20071年前1 -
 秋风疾 共回答了13个问题
秋风疾 共回答了13个问题 |采纳率84.6%解题思路:A、根据溶度积大小进行比较,溶度积越大,溶解度越大;
B、根据硫化铜与硫化亚铁的溶度积进行判断;
C、根据溶液中硫离子的增大浓度及Ksp(ZnS)=1.6×10-24 mol2•L-2计算出锌离子的浓度;
D、根据溶度积只受温度影响,与离子浓度大小无关进行分析.解;A、由于Ksp(CuS)=1.3×10-36<Ksp(ZnS)=1.6×10-24<Ksp(FeS)=6.3×10-18,所以溶解度CuS<ZnS<FeS,故A错误;
B、由于Ksp(CuS)=1.3×10-36<Ksp(FeS)=6.3×10-18,硫化铜的溶解度小于硫化亚铁的,所以除去工业废水中含有的Cu2+,可采用FeS 固体作为沉淀剂,故b正确;
C、原硫化钠溶液中硫离子增大浓度为:c(S2-)=0.1 mol•L-1,所以锌离子最小浓度为:c(Zn2+)=
1.6×1024
0.1mol/L=1.6×10-2 3 mol•L-1,故C错误;
D、向饱和的FeS 溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,温度不变,所以Ksp(FeS)不变,故D错误;
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度不大,注意对溶度积常数的利用和理解.1年前查看全部
- (2013•河南模拟)已知298K时Mg(OH)2的溶度积常数Ksp=5.6×10-12,MgCO3的溶度积常数Ksp=
(2013•河南模拟)已知298K时Mg(OH)2的溶度积常数Ksp=5.6×10-12,MgCO3的溶度积常数Ksp=6.8×10-6.取适量的MgCl2溶液加入一定量的烧碱溶液达到沉淀溶解平衡状态测得溶液的pH=13.0.则下列说法中不正确的是( )
A.Mg(OH)2是水垢的成分之一
B.MgCO3悬浊液中加入适量的烧碱溶液可以生成Mg(OH)2沉淀
C.沉淀溶解平衡时溶液中的c(Mg2+)=5.6×10-10 mol/L
D.298 K时饱和Mg(OH)2溶液与饱和MgCO3溶液相比前者的c(Mg2+)大 frgthy111年前1
frgthy111年前1 -
 lzr328 共回答了12个问题
lzr328 共回答了12个问题 |采纳率83.3%解题思路:A、氢氧化镁溶解度小于碳酸镁,生成的碳酸镁加热会转化为氢氧化镁;
B、氢氧化镁溶解度小于碳酸镁,MgCO3悬浊液中加入适量的烧碱会发生沉淀转化;
C、依据氢氧化镁的溶度积常数结合溶液PH计算氢氧根离子浓度,计算得到镁离子浓度;
D、依据溶度积常数计算分析.A、水中的碳酸氢镁受热分解生成碳酸镁会继续反应生成更难溶的氢氧化镁沉淀,所以Mg(OH)2是水垢的成分之一,故A正确;
B、氢氧化镁溶解度小于碳酸镁,MgCO3悬浊液中加入适量的烧碱会发生沉淀转化,生成Mg(OH)2沉淀,故B正确;
C、取适量的MgCl2溶液加入一定量的烧碱溶液达到沉淀溶解平衡状态测得溶液的pH=13.0,溶液中c(OH-)=0.1mol/L,由氢氧化镁溶度积常数计算镁离子浓度,Ksp=c(Mg2+)c2(OH-)=5.6×10-12 ,代入计算得到c(Mg2+)=5.6×10-10 mol/L,故C正确;
D、298K时Mg(OH)2的溶度积常数Ksp=5.6×10-12,Ksp=c(Mg2+)c2(OH-)=5.6×10-12,c(Mg2+)=1.1×10-4mol/L;MgCO3的溶度积常数Ksp=6.8×10-6.Ksp=c(Mg2+)c(CO32-)=6.8×10-6,得到c(Mg2+)=2.6×10-3mol/L,则298 K时饱和Mg(OH)2溶液与饱和MgCO3溶液相比前者的c(Mg2+)小,故D错误;
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡的相关计算和判断,题目难度中等,本题注意溶度积常数的利用.1年前查看全部
大家在问
- 11P空调中的1P是啥意思?
- 2已知数列{xn}中,x1,x5是方程log22x-8log2x+12=0的两根,等差数列{yn}满足yn=log2xn,
- 3构成生命的基础物质
- 4吸热反应标准焓变等于16.2千焦每摩尔,400开标准平衡常数等于10”问500开时标准平衡常数
- 5英语翻译Pls kindly note that the project is serious basing on th
- 6Hello,this is my peach juice.I like it.
- 7英语翻译我们来这个学校已有两个月了
- 8这对我来说很重要 英文
- 9坐公共汽车花费大约半个小时 英语怎么说
- 10(选修模块3-4)(1)下列说法中正确的是______A.拍摄玻璃橱窗内的物品时,往往在镜头前加一个偏振片以减弱反射光的
- 11如图,点C、E分别为△ABD的边BD、AB上两点,且AE=AD,CE=CD,∠D=70゜,
- 12今有四数,取其三个而相加,其和分别为22,24,27,20,求此四数个几何.
- 13如图所示,光滑水平面上放一足够长的木板A,质量M="2" kg,小铁块B质量为m="1" kg,木板A和小铁块B之间的动
- 14跪求一篇十月围城的英文观后感,急!
- 15这是五年级下册数学基训第29页的题,
