D元素的正三价离子的3d能级为半充满,则D的元素符号是什么?
 neidu2022-10-04 11:39:541条回答
neidu2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 杏子1973 共回答了15个问题
杏子1973 共回答了15个问题 |采纳率86.7%- 价电子是3d64s2
- 1年前
相关推荐
- D元素的一种单质是日常生活中饮水机常用的消毒剂,那这种单质是什么,为什么?
D元素的一种单质是日常生活中饮水机常用的消毒剂,那这种单质是什么,为什么?
臭氧行么?为什么? mal21年前1
mal21年前1 -
 asctomoon 共回答了19个问题
asctomoon 共回答了19个问题 |采纳率68.4%氯气
因为Cl2+H2O =HCl+HClO,HClO具有强氧化性,起到杀菌、消毒的作用1年前查看全部
- A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含 量最多的金属元素;D元素和E元素
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含
 量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的
量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的 转化关系如图所示:请回答下列问题:
转化关系如图所示:请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 _____________________________________ 。
(7)已知F 的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式____________________________________________
的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式____________________________________________ 世纪荒芜1年前1
世纪荒芜1年前1 -
 songpx123 共回答了20个问题
songpx123 共回答了20个问题 |采纳率95%1年前查看全部
- A、B、C、D、E五种前四周期元素,原子序数依次增大。已知D元素原子核外的M层上有3个单电子存在。在周期表中,B、E与D
A、B、C、D、E五种前四周期元素,原子序数依次增大。已知D元素原子核外的M层上有3个单电子存在。在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置。回答下列问题:
(1)元素E的元素符号为________,最高正价为_________,最外层电子构型为_____________;
(2)C的常见氯化物中,C元素的杂化类型为_____________,A元素在其含氧酸根离子中的杂化类型为
__________,A、C两元素所形成化合物的晶体类型是____________;
(3)D的氢化物的立体结构呈________型,该氢化物比元素B的氢化物沸点低的原因是____________。
(4)元素B的离子(B 3- )与某金属离子(X + )形成化合物的晶胞结构如图所示。则晶胞中顶点上的小球应代表________(填“B 3- ”或“X + ”)。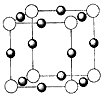
 艺蒙1年前1
艺蒙1年前1 -
 狼想参军 共回答了11个问题
狼想参军 共回答了11个问题 |采纳率100%(1)As;+5;4s 2 4p 3
(2)sp 3 ;sp 2 ;原子晶体
(3)三角锥;B元素的氢化物之间存在有氢键
(4)B 3-1年前查看全部
- 假定溴元素为D元素,而C元素原子则比D元素原子少了一个电子层,但是最外层电子数相同.
假定溴元素为D元素,而C元素原子则比D元素原子少了一个电子层,但是最外层电子数相同.
答案给的是第十七号元素氯元素,而我则认为少了一个电子层应该是第二十七号元素钴元素.虽然我知道氟氯溴碘砹是一个竖行的,但谁能给我解释一下为什么是氯元素而不是钴元素? 我用ff不服吗1年前2
我用ff不服吗1年前2 -
 掌心里的痣 共回答了23个问题
掌心里的痣 共回答了23个问题 |采纳率91.3%电子层是按2 8 8 18 18 32 来排列的溴为35但在第四层所以按照规律要减去18所以为氯1年前查看全部
- D元素的+2价阳离子的3d亚层半充满,则D的元素符号为(),D原子的外围电子排布式为?D元素的外围电子排布式为
D元素的+2价阳离子的3d亚层半充满,则D的元素符号为(),D原子的外围电子排布式为?D元素的外围电子排布式为
外围电子排布式不是3d74s2吗?3d轨道比4s轨道能量高 不是应该先失能量高得轨道的电子吗 6543zhang1年前2
6543zhang1年前2 -
 xiaoqing117 共回答了21个问题
xiaoqing117 共回答了21个问题 |采纳率95.2%D应该是Mn,Mn原子的价电子3d5 4s2,Mn2+离子的价电子3d5
排布电子按照最低能量原理进行,先4s后3d,所以Mn原子的价电子3d5 4s2,
但失电子按电子层进行,最外层电子先失去.
因此Mn失电子先失4s,Mn2+价电子为3d5
实际情况就是这样,记住就好啦.虽然也能通过计算说明,但这已经超出高中化学的要求了.
化学系的结构化学课程中才会学到1年前查看全部
- A元素原子核内无中子,B元素的原子失去三个电子,C元素的原子第三层比第二层少一个电子D元素是地壳中含...
A元素原子核内无中子,B元素的原子失去三个电子,C元素的原子第三层比第二层少一个电子D元素是地壳中含...
A元素原子核内无中子,B元素的原子失去三个电子,C元素的原子第三层比第二层少一个电子D元素是地壳中含量最多的非金属元素E元素原子失去一个电子,所得微粒都具有氖原子相同的电子结构,求ABCDE各是什么元素? xiaoyun8246211年前3
xiaoyun8246211年前3 -
 lrrtql 共回答了22个问题
lrrtql 共回答了22个问题 |采纳率86.4%A元素原子核内无中子,是H
B元素的原子失去三个电子,是Al
C元素的原子第三层比第二层少一个电子,电子构成为2-8-7,是Cl
D元素是地壳中含量最多的非金属元素,是O
E元素原子失去一个电子,是Na1年前查看全部
- D元素的粒子具有2个电子层且带2个单位正电荷,那么D粒子的符号是
 终结者9991年前4
终结者9991年前4 -
 我的誓言如旋 共回答了28个问题
我的誓言如旋 共回答了28个问题 |采纳率85.7%Mg2+1年前查看全部
- 短周期元素A、B、C在周期表中所处的位置如表所示.A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次
短周期元素A、B、C在周期表中所处的位置如表所示.A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
A C B A.元素D形成的气态氢化物的分子构型一定是正四面体 B.A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同 C.在DB 2 、BC 6 、DC 4 的分子中,每个原子都满足8电子稳定结构 D.四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高  陋室铭记1年前1
陋室铭记1年前1 -
 012311112121 共回答了18个问题
012311112121 共回答了18个问题 |采纳率94.4%由短周期元素A、B、C在周期表中所处的位置关系可知,A、C处于第二周期、B处于第三周期,A、B、C三种元素原子的质子数之和为32,令A的原子序数为x,则B的原子序数为x+8,C的原子序数为x+2,则:x+x+9+x+2=32,解得x=7,故A为氮元素、B为硫元素、C为氟元素;D元素原子的最外层电子数为次外层电子数的2倍,则D元素原子有2个电子层,最外层电子数为4,故D为碳元素,
A.碳元素形成的乙烯为平面结构、乙炔为直线结构,故A错误;
B.氨气与硝酸反应生成硝酸铵,硫化氢被浓硫酸氧化生成二氧化硫与水,二者反应类型不同,故B错误;
C.在CO 2 、CF 4 的分子中每个原子都满足8电子稳定结构,SF 6 分子中S原子周围有12个电子,故C错误;
D.C为氟元素,F元素非金属性最强,氢化物最稳定,故D正确;
故选D.1年前查看全部
- A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在
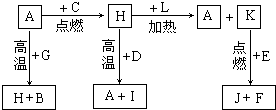 A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示:
请回答下列问题:
(1)元素A的核外电子排布式为1s22s22p63s23p63d64s21s22s22p63s23p63d64s2.
(2)D能与氢氧化钠溶液反应,请写出该反应的离子方程式2Al+2OH-+2H2O=2A1O2-+3H2↑2Al+2OH-+2H2O=2A1O2-+3H2↑.
(3)写出A与G反应的化学方程式3Fe+4H2O(g)
Fe3O4+4H2 3Fe+4H2O(g)高温 .
Fe3O4+4H2 .高温 .
(4)写出H和D反应的化学方程式3Fe3O4+8Al
4A12O3+9Fe3Fe3O4+8Al高温 .
4A12O3+9Fe.高温 .
(5)写出K与E反应的化学方程式2Mg+CO2
2MgO+C2Mg+CO2点燃 .
2MgO+C.点燃 .  medusa_051年前1
medusa_051年前1 -
 sheng_8875600 共回答了15个问题
sheng_8875600 共回答了15个问题 |采纳率86.7%A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属判断为Fe;元素 D 是地壳中含量最多的金属元素判断为Al:G、H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体判断为H2O,H 是黑色晶体结合转化关系判断为Fe3O4,说明C为O2,A(Fe)+G(H2O)=H(Fe3O4)+B(H2),所以G为H2O,H为Fe3O4,B为H2,H(Fe3O4)+D(Al)=A(Fe)+I(Al2O3);依据H+L=A+K可知,L为为CO,K为CO2,D 元素和 E 元素在周期表中相邻,结合K+E=J+F推断E为Mg;J为MgO,F为C;
( l )元素 A 为Fe,在元素周期表中的位置为:第四周期,VIII族,核外电子排布式为1s22s22p63s23p63d64s2;
故答案为:1s22s22p63s23p63d64s2;
( 2 ) D 能与氢氧化钠溶液反应,请写出该反应的离子方程式:2Al+2OH-+2H2O=2A1O2-+3H2↑,故答案为:2Al+2OH-+2H2O=2A1O2-+3H2↑;
(3)A (Fe)与 G(H2O) 反应的化学方程式为3Fe+4H2O(g)
高温
.
Fe3O4+4H2 ,故答案为:3Fe+4H2O(g)
高温
.
Fe3O4+4H2 ;
(4)H (Fe3O4)和 D (Al)反应的化学方程式:3Fe3O4+8Al
高温
.
4A12O3+9Fe,故答案为:3Fe3O4+8Al
高温
.
4A12O3+9Fe;
( 5 )K(CO2) 与 E(Mg) 反应时产生的现象为:镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒,反应的化学方程式为2Mg+CO2
点燃
.
2MgO+C,
故答案为:2Mg+CO2
点燃
.
2MgO+C.1年前查看全部
- 有A、B、C、D四种元素,人体缺少A元素易贫血;B元素的原子结构示意图如下图所示;C元素的单质是最清洁的燃料;D元素是地
有A、B、C、D四种元素,人体缺少A元素易贫血;B元素的原子结构示意图如下图所示;C元素的单质是最清洁的燃料;D元素是地壳中含量最多的金属元素。 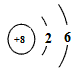
则:A元素是______;B的离子符号是_______;C的单质是_______; B、C、D三种元素组成的化合物是_________。  为婕沉伦1年前1
为婕沉伦1年前1 -
 动画编剧小燕 共回答了18个问题
动画编剧小燕 共回答了18个问题 |采纳率100%铁;O 2- ;氢气;Al(OH) 31年前查看全部
- D元素的正三价离子的3d亚层为半充满,D是?
 黑麦核桃20061年前1
黑麦核桃20061年前1 -
 茉优高高 共回答了20个问题
茉优高高 共回答了20个问题 |采纳率95%Fe
Fe原子的电子排布式是:1s2 2s2 2p6 3s2 3p6 3d6 4s2
Fe3+的电子排布式是:1s2 2s2 2p6 3s2 3p6 3d51年前查看全部
- D元素的+2价阳离子的3d亚层半充满,则D的元素符号为(),D原子的外围电子排布式为()
D元素的+2价阳离子的3d亚层半充满,则D的元素符号为(),D原子的外围电子排布式为()
是正2价,不是正3价 apple_R1年前1
apple_R1年前1 -
 yang002468 共回答了20个问题
yang002468 共回答了20个问题 |采纳率80%D的元素符号为(Mn),D原子的外围电子排布式为(3d^5 4s^2 )
希望我的回答能对你的学习有帮助!1年前查看全部
- D元素的原子核外有4个电子层,K层与L曾电子数之和等于M层和N层电子数之和,D元素的符号是
 oneled1年前1
oneled1年前1 -
 yaling5410 共回答了19个问题
yaling5410 共回答了19个问题 |采纳率89.5%KL的和肯定为10那么 MN也为10所以该元素是Ca1年前查看全部
- 化学反应前后一定改变的是 A分子的种类和数目B原子的种类和数目C反应物与生成物的质量D元素的种类和质量
化学反应前后一定改变的是 A分子的种类和数目B原子的种类和数目C反应物与生成物的质量D元素的种类和质量
老师说C对?不是不变么 骑单车的男孩1年前1
骑单车的男孩1年前1 -
 nn544 共回答了25个问题
nn544 共回答了25个问题 |采纳率100%老师说的是反应物质量减少,生成物质量增加,而不是强调总质量.(很多题目出的并不是很严密,会产生歧义,毕竟化学老师和语文老师还是有很大区别的,就像A选项,分子按不同标准可分为很多种,按构成分子的原子数可将分子分为单原子分子和多原子分子,按极性大小可分为极性分子和非极性分子等等)
很多问题要看它侧重考察哪方面.真理只有一个,只是人们对其的描述不同,就像物理中常常忽略次要矛盾,我们平时做地球绕太阳转题目时可将地球近似看做质点,但在天文科研中这部分是不能忽略的.1年前查看全部
大家在问
- 11.Louis and I visited Shanghai Science&Technology Museum
- 2文言文和现代文,各有什么特点作文500字
- 3下列句子组成意思完整、前后衔接的一段话,填在空格处,排序最恰当的一项是 [
- 4比较火柴折断 和燃烧前后有那些不同,从而说物理变化和化学变化的区别,物理性质和化学性质的区别
- 5《一个小村庄的故事》最后一段破折号的作用
- 6为什么有些话只有高智商的人可以听懂我说什么,其实我说的很明白了,智商低听不懂.除非我一个一个字解释真心跟人交流很难.
- 7简便计算:65x3/26 101x7/25 25/63x62+25/63
- 8求问辞海中对“以德报怨”“以直报怨”“以怨抱怨”的定义是什么呢?
- 9得电子形成稳定结构放出的能量越多,说明元素原子越易得电子,元素的非金属性越强
- 101.23456789翻译成英文
- 11已知函数y=sinωx在[−π3 , π3]上是减函数,则实数ω的取值范围是______.
- 122012上海浦东新区一模作文父亲带儿子爬山,到达山顶后,父亲指着山下说:“看,那里多美!”儿子说:“既然如此,还爬上来做
- 13列方程解文字题:比一个数的5倍多64得数是86,求这个数
- 141)London is in ( ).Pople there speak ( ) 2) New York is in(
- 15平年有多少天?闰年有多少天?它们是从什么时候起始的?有什么寓意


