原子核的密度很大吗?听说足球大的一块原子核能压沉一艘航空母舰,这是真的吗?
 rzy572022-10-04 11:39:543条回答
rzy572022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 光线鸟1217 共回答了20个问题
光线鸟1217 共回答了20个问题 |采纳率90%- 这是真的,原子核密度确实很大!
我查的资料上说,那相当于把珠穆朗玛峰团成一个小球然后放在我们的口袋里!
由于文章很长,并且不全是关于原子核密度的.所以,进入网页后,按ctrl+f查找“原子核”.
在文章的后面你会找到答案! - 1年前
 剑客书生 共回答了2个问题
剑客书生 共回答了2个问题 |采纳率- 的确是有可能的,虽然原子核质量轻,但体积很小,密度就很大
- 1年前
 yueb 共回答了1个问题
yueb 共回答了1个问题 |采纳率- 根据人教版全日制普通高中教科书(化学)P89的资料
假如在1cm^3的容器中装满原子核,则他的质量是1.2*10^8t
密度=(1.2*10^11kg)/(1*10^-6m^3)=(1.2*10^17kg/m^3)
根据人教版全日制普通高中教科书(物理)P110的黑洞资料
质量和太阳相近,半径只有10km的中子星,太阳的质量是2.0*10^30kg
- 1年前
相关推荐
- X元素原子的L层比Y元素的L层少3个电子,X元素原子核外电子总数比Y元素原子核外电子总数少5个,则X和Y可能形成的化合物
X元素原子的L层比Y元素的L层少3个电子,X元素原子核外电子总数比Y元素原子核外电子总数少5个,则X和Y可能形成的化合物是
A.离子化合物Y(XO 4 ) 2 B.离子化合物Y 2 X 3 C.离子化合物Y 3 X 2 D.共价化合物XY 2  zhgzcc1年前1
zhgzcc1年前1 -
 兰色小砖块 共回答了20个问题
兰色小砖块 共回答了20个问题 |采纳率80%C
考查原子核外电子的排布规律。根据题意可判断,X是N,Y是Mg,化合价分别是-3价和+2价,所以形成的化合物是选项C。答案选C。1年前查看全部
- 下列叙述中正确的是( ) A.原子核由质子和电子组成 B.煤、天然气、石油等属于不可再生能源 C.电磁波的传播需要介质
下列叙述中正确的是( ) A.原子核由质子和电子组成 B.煤、天然气、石油等属于不可再生能源 C.电磁波的传播需要介质 D.波长越长的电磁波,频率越高  ymerej1年前1
ymerej1年前1 -
 zxb1202 共回答了13个问题
zxb1202 共回答了13个问题 |采纳率84.6%A、原子核由质子和中子组成,集中了原子的大部分质量及全部正电荷,故A错误;
B、煤、天然气、石油等能源被人开发利用后,在相当长的时间内不能再生,故为不可再生能源;故B正确;
C、电磁波的传播不需要介质,可以在真空中传播,故C错误
D、由C=λf得:波长越长的电磁波,频率越低,故D错误.
故选B.1年前查看全部
- 分子、原子、原子核、电子、质子、中子、夸克,按从小到大排列的正确的是( )
分子、原子、原子核、电子、质子、中子、夸克,按从小到大排列的正确的是( )
A. 分子、原子、原子核、质子、夸克
B. 原子核、原子、中子、质子、分子
C. 夸克、质子、原子核、原子、分子
D. 夸克、中子、原子、原子核、分子 猫鱼catfish1年前1
猫鱼catfish1年前1 -
 Fan_Wei 共回答了23个问题
Fan_Wei 共回答了23个问题 |采纳率100%解题思路:物体由物质组成的,物质由分子组成的;分子由原子组成,原子由位于中心的原子核和核外电子组成;原子核由质子和中子组成,质子由夸克组成.根据质量的大小,微粒由小到大依次为:夸克、质子、原子核、原子、分子.
故选C.点评:
本题考点: 物理常识.
考点点评: 此题考查分子、原子等微粒的质量大小及组成关系,属基本的物理常识.1年前查看全部
- 在“分子、原子、原子核、质子、中子、电子”等粒子中,找出符合下列条件的粒子:
在“分子、原子、原子核、质子、中子、电子”等粒子中,找出符合下列条件的粒子:
质量和氢原子质量相等的是_______,质量最小的是__________.
2、一个水分子由2个氢原子和1个氧原子构成,氧原子有8个质子,氢原子的构成最简单.那么1个水分子种的之子总数为:
A、1 B、3 C、8 D、10 miss_fantastic1年前1
miss_fantastic1年前1 -
 zjbjzhc 共回答了27个问题
zjbjzhc 共回答了27个问题 |采纳率92.6%1.第1个空有2个答案 ( 质子,中子); 因为质子质量等于中子的质量
第2个空:(电子)
2.( D )
氧原子8个+2个氢原子=10个1年前查看全部
- 判断一句话正误,并说明理由核电荷数在1到18的元素中,原子核外各电子数相等的元素一定是金属元素,请说明理由,
 xuhuloverfid1年前1
xuhuloverfid1年前1 -
 dengcc2004 共回答了26个问题
dengcc2004 共回答了26个问题 |采纳率88.5%不对
上一周期的非金属元素于下周起的非金属元素原子核外的电子数相等但并不都是金属元素,比如氟离子与钠镁离子等1年前查看全部
- 某微粒的结构示意图为: 下列有关该离子的说法,其中错误的是( ) A.该粒子为阳离子 B.该粒子的原子核内有16个
某微粒的结构示意图为: 
下列有关该离子的说法,其中错误的是( )A.该粒子为阳离子 B.该粒子的原子核内有16个质子 C.该粒子已经达到相对稳定结构 D.该粒子核外有三个电子层  lkllm1年前1
lkllm1年前1 -
 鱼儿不相信眼泪 共回答了24个问题
鱼儿不相信眼泪 共回答了24个问题 |采纳率87.5%A、该核内质子数为16,核外电子数为18,即:质子数<核外电子数,所以该粒子为阴离子,故B说法错误;B、根据原子结构示意图可以知道,该原子的核内为16个质子,故B说法正确;C、最外层电子数为8(只有一个电子层...1年前查看全部
- 不显电性的一组微粒是( )A.原子、中子、电子B.原子核、原子、分子C.中子、电子、原子D.中子、分子、原子
 wjt001年前1
wjt001年前1 -
 benny1230 共回答了19个问题
benny1230 共回答了19个问题 |采纳率94.7%解题思路:分子和原子对外不显电性,原子是由原子核和核外电子组成的,原子核带正电,电子带负电,原子核是由质子和中子组成的,质子带正电,中子不带电.分子和原子都不显电性,但是组成原子的原子核带正电,其中原子核是由带正电的质子和不带电的中子组成的.
故选D.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;原子的定义与构成.
考点点评: 本题考查了学生对物质内部结构以及带电情况的了解,是一道基础性的题目,相对比较简单.1年前查看全部
- 原子核外电子是分层排布吗,原因是什么
 haishen83761年前2
haishen83761年前2 -
 沧海一粟520 共回答了21个问题
沧海一粟520 共回答了21个问题 |采纳率85.7%处于稳定状态(基态)的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守最低能量原理,泡利不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况.1年前查看全部
- 在①分子 ②原子 ③质子 ④电子 ⑤离子 ⑥原子核 ⑦中子 ⑧元素中,选择合适的概念填空:
在①分子 ②原子 ③质子 ④电子 ⑤离子 ⑥原子核 ⑦中子 ⑧元素中,选择合适的概念填空:
(1)构成物质的基本粒子是______、______、______,______是化学变化中的最小微粒,它是由______和______构成的;
(2)元素的种类由______数决定;质量很小,可以忽略的粒子是______;原子的质量由______数和______数决定;
(3)钠原子和钠离子因具有相同的______数,故属于同种______;
(4)氯化钠是由钠______和氯______构成的;
(5)带电的基本粒子是______. 变冷的咖啡1年前1
变冷的咖啡1年前1 -
 大大富翁 共回答了17个问题
大大富翁 共回答了17个问题 |采纳率94.1%解题思路:(1)根据构成物质的微粒有分子、原子、离子以及原子的结构进行解答;
(2)根据元素的种类由质子数决定以及电子的质量很小进行解答;
(3)根据钠原子和钠离子因具有相同的质子数进行解答;
(4)根据氯化钠是由钠离子和氯离子构成进行解答;
(5)根据微粒的带电情况进行解答.(1)构成物质的微粒有分子、原子、离子;原子是化学变化中的最小微粒,它是由核外电子和原子核构成的;
(2)元素的种类由质子数决定,电子的质量很小,所以原子的质量由质子数和中子数决定;
(3)钠原子和钠离子因具有相同的质子数,故属于同种元素;
(4)氯化钠是由钠离子和氯离子构成;
(5)分子、原子、中子不带电,而质子和原子核带正电,电子带负电,离子也带有电荷.
故答案为:(1)分子;原子;离子;原子;原子核;核外电子;
(2)质子;电子;质子;中子;
(3)质子;元素;
(4)离子;离子;
(5)质子、电子、离子、原子核.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;原子的定义与构成;元素的概念.
考点点评: 本题难度不大,主要考查了构成物质的微观粒子方面的知识,掌握常见物质的粒子构成、原子的概念、构成等是正确解答本题的关键.1年前查看全部
- 氯化钠是由钠离子和氯离子构成的已知钠离子的原子核中质子数11,中子数为12下列有关钠离子的说法正确的是( )
氯化钠是由钠离子和氯离子构成的已知钠离子的原子核中质子数11,中子数为12下列有关钠离子的说法正确的是( )
A. 原子核外电子数为11
B. 它的相对原子质量和钠原子的相同
C. 原子核内的正电荷数为+10
D. 原子核外电子数为12 linagca1年前3
linagca1年前3 -
 wuway 共回答了27个问题
wuway 共回答了27个问题 |采纳率92.6%解题思路:A、根据钠离子是钠原子失去1个电子后形成的进行解答;
B、根据相对原子质量=质子数+中子数进行解答;
C、根据原子核内的正电荷数与质子数相同进行解答;
D、根据钠离子是钠原子失去1个电子后形成的进行解答.A、钠离子是钠原子失去1个电子后形成的,钠原子的核外电子数为11,所以钠离子核外电子数为10,故A错误;
B、相对原子质量=质子数+中子数,钠原子和钠离子中质子数和中子数相同,所以钠离子的相对原子质量和钠原子的相同,故B正确;
C、原子核内的正电荷数与质子数相同,所以钠离子中原子核内的正电荷数为+11,故C错误;
D、钠离子是钠原子失去1个电子后形成的,钠原子的核外电子数为11,所以钠离子核外电子数为10,故D错误.
故选:B.点评:
本题考点: 原子和离子的相互转化.
考点点评: 本题难度不大,解题的关键是掌握原子中核电荷数=质子数=电子数、相对原子质量=质子数+中子数.1年前查看全部
- 无机推断题X、Y均为短周期元素,X原子核外各电子层的电子数之比为1∶4∶1,X比Y原子多3个电子.下列叙述中正确的是 (
无机推断题
X、Y均为短周期元素,X原子核外各电子层的电子数之比为1∶4∶1,X比Y原子多3个电子.下列叙述中正确的是 ( )
A.X元素的最高氧化物对应的水化物是强碱
B.Y元素的最高氧化物对应的水化物的分子式可表示为HYO4
C.电解Y的钠盐溶液可制备Y的单质?
D.Y的单质与H2O反应在同类元素中最剧烈
我觉得选B,为什么? 资深书棍1年前1
资深书棍1年前1 -
 trtrtrtrtr 共回答了21个问题
trtrtrtrtr 共回答了21个问题 |采纳率85.7%由题目可知,X为Mg,Y为F.
选择答案D.
A:元素的最高氧化物对应的水化物是中强碱(或者是弱碱)
B:的氧化性比O还强,不可能形成HFO4
C:能由NaF制备单质F2
D:F能从水中迅速发生不可逆置换出氧气,而其他的则是发生可逆的歧化反应1年前查看全部
- 在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,并填在相应的横线上.
在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,并填在相应的横线上.
⑴ 有些物质由()构成,如氧气等,有些物质则由()构成如铁等
⑵ 能保持氧气的化学性质的是氧(),能保持铁的化学性质的是铁()
⑶ 化学变化中最小的粒子是()
⑷ 带正电荷的是(),带负电荷的是(),不显电性的是()
⑸ 质量与一个氢原子质量约相等的是()
⑹ 在同一个原子中数目一定相等的是() 醉亦醒1年前4
醉亦醒1年前4 -
 wishmerill 共回答了14个问题
wishmerill 共回答了14个问题 |采纳率92.9%1、 有些物质由(分子)构成,如氧气等,
有些物质则由(原子)构成如铁等
2、 能保持氧气的化学性质的是氧(分子),
能保持铁的化学性质的是铁(原子)
3、 化学变化中最小的粒子是(原子)
4、 带正电荷的是(质子、原子核),
带负电荷的是(电子),
不显电性的是(原子、分子、中子).
5、 质量与一个氢原子质量约相等的是(质子)
6、 在同一个原子中数目一定相等的是(质子与电子)1年前查看全部
- 在分子,原子,质子,中子,电子,原子核中 能直接构成物质微粒; 能保持物质化学性质;
 不可能不爱你1年前1
不可能不爱你1年前1 -
 c122039 共回答了23个问题
c122039 共回答了23个问题 |采纳率95.7%分子,原子能直接构成物质,离子也行
分子,原子能保持物质的化学性质,后面的不行,因为原子是保持物质化学性质的最小粒子1年前查看全部
- 原子核显不显电性是原子核不是原子
 6701604831年前4
6701604831年前4 -
 xdc1013 共回答了21个问题
xdc1013 共回答了21个问题 |采纳率90.5%原子核由质子和中子组成,质子带的正电荷和电子带的负电荷电量相等,电性相反,中子不带电,所以原子核显电性.1年前查看全部
- 下列有关化学用语表示正确的是 A. 的结构示意图: B.原子核内有10个中子,8个质子的原子: C. 离子的电离方程式:
下列有关化学用语表示正确的是
A.  的结构示意图:
的结构示意图:
B.原子核内有10个中子,8个质子的原子: 
C. 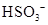 离子的电离方程式:
离子的电离方程式:
D.2g  在25℃ 101kpa下燃烧,生成液态的水放出285.8
在25℃ 101kpa下燃烧,生成液态的水放出285.8 U的热量,则该反应的热化学方程式为:
U的热量,则该反应的热化学方程式为:
 yoyoyan_198301061年前1
yoyoyan_198301061年前1 -
 gtdx 共回答了15个问题
gtdx 共回答了15个问题 |采纳率86.7%1年前查看全部
- 钠离子Na+原子核中质子数11,中子数12,那下面那个是对的 A原子核外电子数为11 B它的相对原
钠离子Na+原子核中质子数11,中子数12,那下面那个是对的 A原子核外电子数为11 B它的相对原
钠离子Na+原子核中质子数11,中子数12,那下面那个是对的
A原子核外电子数为11
B它的相对原子质量与钠原子相同
C原子核内正电荷数为+10
D原子核外电子数为12
说出原因, KingKong01年前2
KingKong01年前2 -
 01016 共回答了22个问题
01016 共回答了22个问题 |采纳率86.4%选B
对于原子质子数=核电荷数=核外电子数,对于Na+离子核外电子数比钠原子少一即为10个,AD不对;对于原子核的正电荷数不变还是11,C不对;B项相对原子质量都是11+12=231年前查看全部
- 核能正广泛地被全世界开发和使用中核电站中核燃料和在中子的撞击下原子核发生 23题!
 晓云儿1年前1
晓云儿1年前1 -
 包包背着洋娃娃 共回答了25个问题
包包背着洋娃娃 共回答了25个问题 |采纳率88%准确点说:
核变化是原子核在变化,核反应将产生新的原子核(并非产生原子).
化学变化是原子与分子在变化,它们将形成新的原子或者分子,整个过程中原子核不变化.
好吧,貌似这答案有点长,所以概况起来我认为可以这样写:化学变化会生成新的化学分子或者原子,而核变化则会生成新的原子核(或新元素).
从严谨的角度来看再强调一次,是生成新的原子核,而不是新的原子.因为核反应的产物都是不带电子的裸原子核和高能γ射线(能量),整个过程也不需要电子的“任何帮助”,完全是由原子核内的质子与中子在执行核反应的过程.1年前查看全部
- 131.元素X和Y在周期表中处于相邻周期,这两种元素的离子所含质子数之和为21,Y元素的原子核外电子数比X的原子核外电子
13
1.元素X和Y在周期表中处于相邻周期,这两种元素的离子所含质子数之和为21,Y元素的原子核外电子数比X的原子核外电子数多5个,下列叙述正确的是
A.Y元素的原子可通过共价键构成固体单质
B.x和硫元素可组成两种不同的化合物
C.x形成的单质属于金属单质
D.x和Y构成一种阴离子与过量盐酸反应可转化成Y的阴离子
我觉得氟化镁似乎符合题意,可答案给的是B.D 谁能给逐一分析一下啊?
2.判断正误
错误的请举个反例,
(1).只含共价键的化合物,就一定是共价化合物
(2).凡是第一主族和第六主族的原子化合时,一定形成离子键
(3).在氧化还原反应中,非金属单质一定是氧化剂
(4).金属阳离子被还原不一定得到金属单质
3.在标准状况下1体积水可溶解448体积氨气,在相同条件下,100g水能溶解多少克氨气? zxccvv1年前2
zxccvv1年前2 -
 4816985 共回答了22个问题
4816985 共回答了22个问题 |采纳率86.4%1.
Y是铝,X是氧.
因为 假设二者的电荷数是 a,b
a+b=21
b-a=5 所以b=13,a=8
B选项是二氧化硫和三氧化硫.
D选项是三氧化二铝与盐酸反应可以生成 四羟基和铝酸
2.
(1)错 过氧化钠 其中既有共价键,又有离子键.
(2)错 水分子中只有共价键
(3)错 C+O2=CO2 其中的C就是还原剂,而氧化剂是O2
(4).对,比如三价的铁就是这样
3.
100克水就是100毫升,可以溶解44800毫升的氨气,而44800毫升转化成物质的量是44800/2.4l/mol= 2mol,所以溶解的氨气的质量是2*17=34克
小气鬼,出了这么多题,都不舍得悬赏,要是不懂怎么做的话,给我留言吧1年前查看全部
- 有X、Y两种元素,X原子核外M层电子数是Y原子核外M层电子数的三分之一,
有X、Y两种元素,X原子核外M层电子数是Y原子核外M层电子数的三分之一,
Y原子核外L层电子数是M层电子数的九分之四,也是N层电子数的4倍.则两种元素的原子结构示意图分别为:X--------------;Y--------------. 纤纤小手_1年前2
纤纤小手_1年前2 -
 移动ee不吐骨头 共回答了14个问题
移动ee不吐骨头 共回答了14个问题 |采纳率92.9%一看到 4/9这个数字楼主就应该想到18这个数字,它是M层所能容纳的最多电子数.
核外电子层排布顺序为: K L M N
根据题意: Y的核外电子排布为 2 8 18 2
而X原子核外M层电子数是Y原子核外M层电子数的三分之一
所以,X的核外电子排布为 2 8 61年前查看全部
- 一些中子和质子结合在一起(原子核)为何要放出能量?
一些中子和质子结合在一起(原子核)为何要放出能量?
那为什么有些原子核(也是一堆质子中子)有足够能量靠近后不做功放出能量?
三楼答者,我再问一步,为啥有质量亏损
如果是因为强相互作用使核子放出能量,那如果有两个在铁后的原子核,让它们靠近为啥不放出能量?(强相互作用哪去了?) 千叶百合子1年前4
千叶百合子1年前4 -
 haojie83 共回答了19个问题
haojie83 共回答了19个问题 |采纳率89.5%用经典的图像来看:结合在一起后强相互作用做功,其势能转化为核的动能,然后通过辐射(放出光子)或者与其他粒子碰撞放出能量,使得核稳定存在.
用量子图像来看:结合在一起后强相互作用做功,使得核处于激发态(不是最稳定的),然后然后通过辐射(放出光子)或者与其他粒子碰撞放出能量跃迁到基态,根据质能关系从而有质量亏损.
关于问题补充:从因果关系来说应该是因为直接合成的核不稳定的激发态,需要放出能量,从而有质量亏损.
当然我们也可以反过来通过质量亏损来计算所放出的能量.
除了强相互作用外,还有电磁相互作用.而核都带正电,所以把核靠近是要提供相当大的能量来实现的.只有强相互作用放出的能量大于需要的能量才有实用价值,比如在实验室也可以实现让铁核与其他核融合形成金子,真正的点石成金,不过估计会入不敷出:).而铁核估计就是能量收支平衡点.具体还是那句话,需要强相互作用理论计算.这个就不是我所了解的了.btw,把质子结合到一起同样要先提供能量抵抗电场斥力再放出能量,比如氢弹.1年前查看全部
- A、B、C三种元素的原子核里都有几个质子,中子数分别为n-1,n,n+1,下列说法正确的是( )(说理由)
A、B、C三种元素的原子核里都有几个质子,中子数分别为n-1,n,n+1,下列说法正确的是( )(说理由)
A、它们属于同种元素
B、它们是同一种原子
C、它们是不同元素的微粒
D、它们是不同种分子 joogger1年前1
joogger1年前1 -
 sevening 共回答了15个问题
sevening 共回答了15个问题 |采纳率100%应该是都有一样的质子数吧?
首先质子数相同就表示他们是同一种元素的原子,元素的分类就是按原子核里的质子数分,A是对的
B不对,同一种原子必须质子数和中子数一样
C,不对,他们是同一元素的微粒
D,这个,错的啦……
所以选A1年前查看全部
- 氦原子核和质子带电量和质量之比分别是多少?
氦原子核和质子带电量和质量之比分别是多少?
是1:1和2:1么? lo5341年前2
lo5341年前2 -
 zaiqi 共回答了18个问题
zaiqi 共回答了18个问题 |采纳率88.9%氦原和和质子带电量:2::1
质量比:4:11年前查看全部
- 下列说法中正确的是( ) A.β衰变说明原子核里有电子 B.某原子核经过一次α衰变和两次β衰变后,核内中子数减少4个
下列说法中正确的是( ) A.β衰变说明原子核里有电子 B.某原子核经过一次α衰变和两次β衰变后,核内中子数减少4个 C.放射性物质的温度升高,其半衰期将缩短 D. 238 92 U→ 90 234 Th+ 2 4 He是核裂变反应方程  一翦秋泓1年前1
一翦秋泓1年前1 -
 wcdsy 共回答了21个问题
wcdsy 共回答了21个问题 |采纳率95.2%A、原子核里虽然没有电子,但是核内的中子可以转化成质子和电子,产生的电子从核内发射出来,这就是β衰变,故A错误.
B、某原子核经过一次α衰变电荷数减小2,质量数减小4,再经过两次β衰变后,质量数不变,电荷数要增加2,所以整个过程质量数减小4,电荷数不变,所以核内中子数减少4个.故B正确.
C、半衰期的长短是由原子核内部本身的因素决定的,与原子所处的物理、化学状态无关,放射性物质的温度升高,其半衰期将不变.故C错误.
D、 238 92 U→ 90 234 Th+ 2 4 He是α衰变,故D错误.
故选B.1年前查看全部
- 某化合物的一个分子中有3个原子核和22个核外电子的是(选择题)
某化合物的一个分子中有3个原子核和22个核外电子的是(选择题)
A SO2 B H20 C NH3 D CO2 够咬够1年前1
够咬够1年前1 -
 aa88bb88 共回答了18个问题
aa88bb88 共回答了18个问题 |采纳率100%D1年前查看全部
- 下列说法正确的是( )A.1897年汤姆逊发现了原子核B.1919年卢瑟福用α粒子从氮原子核中打出了电子C.1932年
下列说法正确的是( )
A.1897年汤姆逊发现了原子核
B.1919年卢瑟福用α粒子从氮原子核中打出了电子
C.1932年查德威克发现了中子
D.1961年盖尔曼提出了层子的设想 岚惜1年前1
岚惜1年前1 -
 lusd1314 共回答了22个问题
lusd1314 共回答了22个问题 |采纳率77.3%解题思路:根据卢瑟福、汤姆逊、查德威克、盖尔曼在物理上的主要贡献进行分析.A、1879年,英国物理学家汤姆逊首先发现了电子,从而揭开了人们对原子内部的认识.故A错误;
B、1919年,卢瑟福从氮原子中打出了质子,故B错误.
C、1932年,查德威克发现了中子,故C正确;
D、1961年,盖尔曼提出质子和中子是由层子组成的设想.故D正确.
故选CD.点评:
本题考点: 人类探究微观世界的历程.
考点点评: 了解物理的发展史和重大成就,有利于激发学生学习物理的兴趣,培养社会责任感,符合新课程标准三维目标的要求.1年前查看全部
- 有几个化学题1 科学家发现一种新元素,它的原子核内有111个质子161个中子则该元素原子核外电子数是2 空气中含量最多的
有几个化学题
1 科学家发现一种新元素,它的原子核内有111个质子161个中子则该元素原子核外电子数是
2 空气中含量最多的元素 用元素符号表示
3 人体中含量最多的元素 用元素符号表示
4 地壳中含量最多的元素
5 计算硝酸铵中各元素的质量比 湘非州1年前5
湘非州1年前5 -
 hrjyz 共回答了25个问题
hrjyz 共回答了25个问题 |采纳率92%1、核外电子数=质子数=111
2、空气中含量最多的是氮元素,元素符号 N
3、人体中含量最多的是氧元素,元素符号 O
4、地壳中含量最多的是氧元素,元素符号 O
5、硝酸铵化学式:NH4NO3
氮元素:氧元素:氢元素=14×2:16×3:1×4=7:12:11年前查看全部
- 下列说法中正确的是( ) A.原子是由位于中心的原子核和核外的电子组成的,原子核占据了原子的大部分空间 B.纳米技术是
下列说法中正确的是( ) A.原子是由位于中心的原子核和核外的电子组成的,原子核占据了原子的大部分空间 B.纳米技术是纳米尺度内的科学技术,研究对象是一小堆分子或单个的原子、分子 C.气体容易压缩,具有流动性是因为气体分子间的距离很小,分子间引力大的缘故 D.1kg的铁锤所含的物质比1kg的塑料锤所含的物质要多得多  ellopod1年前1
ellopod1年前1 -
 灰灰_王 共回答了21个问题
灰灰_王 共回答了21个问题 |采纳率90.5%A、原子是由位于中心的原子核和核外的电子组成的,原子核在原子中所占体积极小,其半径为原子半径的几万分之一;
B、是纳米尺度内的科学技术,研究对象是一小堆分子或单个的原子、分子;
C、气体容易压缩,具有流动性是因为气体分子间的距离很大,分子间作用力小的缘故;
D、1kg的铁锤所含的物质和1kg的塑料锤所含的物质相等;
故选B.1年前查看全部
- 下列说法正确的是( )A.核子结合成原子核一定吸收能量B.电子电荷的精确测定是密立根通过油滴实验测出的C.查德威克发现
下列说法正确的是( )
A.核子结合成原子核一定吸收能量
B.电子电荷的精确测定是密立根通过油滴实验测出的
C.查德威克发现了质子,预言了中子
D.用不可见光照射金属,一定比用可见光照射同种金属产生的光电子的最大初动能大 旷野星云1年前1
旷野星云1年前1 -
 单翼天使II 共回答了14个问题
单翼天使II 共回答了14个问题 |采纳率100%A、核子结合成原子核,出现质量亏损,一定释放能量,故A错误.
B、电子电荷的精确测定是密立根通过油滴实验测出的,故B正确.
三、卢瑟福发现m质子,预言m中子,故三错误.
D、不可见光的频率可能比可见光的频率低,比如红外线,所以根据爱因斯坦光电效应方程,可知用不可见光照射金属,可能比用可见光照射同种金属产生的光电子的最大初动能小,故D错误.
故选:B.1年前查看全部
- 用程序,原子核,遥控,联合,哲理写一段话
 yema1231年前2
yema1231年前2 -
 只会付出 共回答了10个问题
只会付出 共回答了10个问题 |采纳率30%利用程序遥控电脑造出原子核,联合起来打败敌国,里面蕴含无穷哲理。1年前查看全部
- 原子核外的电子轨道中通常有2个电子,也就是说原子核中至少2个质子,有小于2个存在吗?举个例子?
原子核外的电子轨道中通常有2个电子,也就是说原子核中至少2个质子,有小于2个存在吗?举个例子?
写错了。是最内层的轨道上通常有两个电子 维有顶你1年前3
维有顶你1年前3 -
 dengchen971127 共回答了19个问题
dengchen971127 共回答了19个问题 |采纳率94.7%氢能算一个吧!不过电子数大于2的,原子核内质子数也应该与其相等!否则就不平衡了!也就不稳定了!1年前查看全部
- 原子核发生某种变化时,放出射线,说明
 爱oo1351年前3
爱oo1351年前3 -
 chenchen1313 共回答了30个问题
chenchen1313 共回答了30个问题 |采纳率90%此元素具有放射性,1年前查看全部
- 氦原子核内的质子数为2,中子数为1,而相对原子质量为4?
氦原子核内的质子数为2,中子数为1,而相对原子质量为4?
周期表上为4,但相对原子质量=质子数+中子数, wang_1978狼1年前2
wang_1978狼1年前2 -
 wjdb0222 共回答了21个问题
wjdb0222 共回答了21个问题 |采纳率76.2%氦在自然界中存在两种同位素,氦3和氦4,氦3如你所说,相对原子质量为3,氦4质子2中子2相对原子质量为4.
周期表上的相对原子质量数为自然界各种同位素按含量求平均数.而自然界氦4含量远高于氦3,所以为4.
你看到的原子核内的质子数为2,中子数为1,应该是氦31年前查看全部
- 凸透镜聚光是否与原子核外电子的跃迁有关
 故人卡卡1年前1
故人卡卡1年前1 -
 xiaoqiuqiu920 共回答了20个问题
xiaoqiuqiu920 共回答了20个问题 |采纳率90%没有…一毛钱关系都没有…
凸透镜聚焦是光的折射,是几何光学,跟原子光子等微观粒子没有关系.
跃迁是指原子的能量发生变化,伴随着光的吸收与释放.
还有,电子是不谈“跃迁”的,只有原子才谈跃迁的事,电子那个是轨道,两码事.1年前查看全部
- 科学实验表明,原子中的原子核与电子所带的电荷是两种相反的电荷物理学规定,原子核所带的电荷为正电荷.氢原子中的原子核与电子
科学实验表明,原子中的原子核与电子所带的电荷是两种相反的电荷物理学规定,原子核所带的电荷为正电荷.氢原子中的原子核与电子个带一个电荷,把它们所带电荷用正数与负数表示出来
 Yatx1年前1
Yatx1年前1 -
 paulyu07 共回答了10个问题
paulyu07 共回答了10个问题 |采纳率80%带一个单位的正电荷用+1表示 一个单位的负电荷用-1 通常1省略不写 氢原子带一个单位的正电荷和一个单位的负电荷 所以氢原子显电中性1年前查看全部
- α粒子散射实验结果能不能表明原子核由带正电的质子和不带电的中子组成?
 xiaoding20031年前1
xiaoding20031年前1 -
 edisonrei13 共回答了16个问题
edisonrei13 共回答了16个问题 |采纳率100%因为α粒子散射后,有小部分被反射了,所以可以证明原子中有一个质量很大、体积很小的带正电的粒子(即质子).就命名为原子核.中子是不带电的,后面知道的,但不能证明.1年前查看全部
- R元素的氧化物相对分子质量 142,其中氧原子相对原子质量和 80,R原子核16粒子不带电,儿核电荷数为15 求
R元素的氧化物相对分子质量 142,其中氧原子相对原子质量和 80,R原子核16粒子不带电,儿核电荷数为15 求
2.R元素化合价 babylady111年前3
babylady111年前3 -
 贫血的蚂蚁 共回答了19个问题
贫血的蚂蚁 共回答了19个问题 |采纳率94.7%P2O5
化合价为-3,+5 ,在P2O5中显示+5价1年前查看全部
- 有A、B、C、D四种粒子,A整体不带电,原子核内只有一个质子;B带有两个单位正电荷的离子核外有两个电子层,其原子的第二层
有A、B、C、D四种粒子,A整体不带电,原子核内只有一个质子;B带有两个单位正电荷的离子核外有两个电子层,其原子的第二层电子数为第一层电子数的四倍;C带有一个负电荷的离子比B的离子多8个电子;D∧-离子具有与氩原子相同的核外电子排布.
(1)A、B、C、D的名称;
(2)A的原子中有一个中子,它的相对原子质量为______;
(3)B的相对原子质量为24,其中子数为______. kkvvcccc1年前0
kkvvcccc1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某+2价金属元素的氯化物汇中含氯64%,又知其原子核内质子数等于中子数,求该金属元素的相对原子质量及其氯化物的化学式
 羊咩咩20031年前1
羊咩咩20031年前1 -
 消失的鼠子 共回答了18个问题
消失的鼠子 共回答了18个问题 |采纳率83.3%M/71=36/64 解M=40 20号元素-CaCl21年前查看全部
- 原子核为什么带正电?为什么不带电子的物体会带正电呢?
 gfnt1年前2
gfnt1年前2 -
 焦虑大少 共回答了21个问题
焦虑大少 共回答了21个问题 |采纳率95.2%因为电子带负电,而他们在一起的时候是呈现不带电特性,所以失去电子后,剩下的会带正电.1年前查看全部
- 电子在原子核周围是怎样运动的?为什么说原子核带正电?
 开心鬼77581年前2
开心鬼77581年前2 -
 av789456 共回答了17个问题
av789456 共回答了17个问题 |采纳率88.2%圆周运动.但不是像行星那样.电子位置具有 不确定性,.它(们)会在 原子“内部”一定范围内 以某个 概率地出现.电子带负电,这是规定的.原子核与电子电性相反,这是事实1年前查看全部
- 原子核与电子之间作用力是什么?原子核与电子之间是由什么力量作用着、为什么他们之间不接触又不分离呢?能否让物体像原子核与电
原子核与电子之间作用力是什么?
原子核与电子之间是由什么力量作用着、为什么他们之间不接触又不分离呢?能否让物体像原子核与电子之间一样启用到隔空控制的技术? asdgfiluawgkrth1年前2
asdgfiluawgkrth1年前2 -
 娃哈哈c11 共回答了16个问题
娃哈哈c11 共回答了16个问题 |采纳率100%首先呢,纠正一下,原子核和电子是一个整体,并没有分离.
原子核和电子之间的作用力有静电力和核力两种.
近代物理学之所以认为电子是单独于核存在的主要是因为单独的分离出来了电子,但是后来科学家发现这并不能说明电子的单独存在.我们可以将电子云理解为原子中密度较小,可以使光透过的部分,而原子核是密度较大,不透光的部分.1年前查看全部
- 原子的原子核大小决定于原子中的什么
 司风司雨1年前1
司风司雨1年前1 -
 papapyxun 共回答了17个问题
papapyxun 共回答了17个问题 |采纳率88.2%质子和中子的个数1年前查看全部
- 各种粒子与质子的关系例如,氚核的质量是质子的三倍,电荷量为一个元电荷.a粒子即氦原子核,质量约为质子的四倍,带正电荷,电
各种粒子与质子的关系
例如,氚核的质量是质子的三倍,电荷量为一个元电荷.a粒子即氦原子核,质量约为质子的四倍,带正电荷,电荷量是元电荷的两倍.那么氕,氘,氚,电子,氢核的类似关系是什么呢? fdgsht1年前1
fdgsht1年前1 -
 xujiake 共回答了17个问题
xujiake 共回答了17个问题 |采纳率94.1%氕核就是质子,带一个元电荷;
氘核是由一个质子加一个中子组成,由于只含有一个质子,而中子又是不带电的,所以氘核也是带一个元电荷;
氚核是由一个质子加两个中子组成,带一个元电荷,氚核具有贝塔衰变性.1年前查看全部
- 锆(Zr)的一种氧化物是耐高温的新型陶瓷材料,经测定,锆原子核内有51个中子,核外有40个电子,其氯化物的相对分子质量为
锆(Zr)的一种氧化物是耐高温的新型陶瓷材料,经测定,锆原子核内有51个中子,核外有40个电子,其氯化物的相对分子质量为233,若锆的氯化物和氧化物中锆的化合价相同.则氧化物的化学式为( )
A. Zr2O
B. ZrO
C. Zr2O3
D. ZrO2 溪里鱼1年前1
溪里鱼1年前1 -
 安眠花宝 共回答了20个问题
安眠花宝 共回答了20个问题 |采纳率90%解题思路:就原子来说,质子数=原子序数=核外电子数,质子数+中子数=相对原子质量.首先计算出锆原子的相对原子质量,然后根据氯化物的相对分子质量为233,可以算出锆元素的化合价,最后写出氧化物的化学式.就原子来说,质子数=原子序数=核外电子数,质子数+中子数=相对原子质量.根据题目信息可知,锆原子核内有51个中子,核外有40个电子,所以质子有40个,相对原子质量=51+40=91.
设锆元素的化合价为+X,其氯化物的化学式为:ZrClx,
∵锆的氯化物的相对分子质量为233.
∴91+35.5X=233
得:X=4
∵在锆的氧化物中锆的化合价是+4价,氧元素的化合价是-2价.
∴氧化物的化学式为:ZrO2,故选D.点评:
本题考点: 有关化学式的计算和推断;常见元素与常见原子团的化合价;化合价规律和原则.
考点点评: 掌握相对原子质量和质子、中子之间的关系式,学会根据化合价书写物质的化学式.1年前查看全部
- 1,原子核与核外电子所占空间的相对大小和质量大小?
1,原子核与核外电子所占空间的相对大小和质量大小?
2,已知氢分子有1H,2H,3H三种院子,氧元素有16H,17H,18H三种原子,则她们组成的氢分子有()种,他们分别是( );他们构成的水分子有()种,式量最大的是( )
3、1999年新发现的114号元素的一种院子 其种子数为184,该院子的质量为【这题我想知道的是114号的这个“114”是指什么意思 是质子数吗?】
4、
元素 资料 名称 符号
A 核电荷数为6 ( ) ( )
B 原子核内有11个质子 ( ) ( )
C 其核外有17个电子 ( ) ( )
【不懂这道题的意思
只要回答1,3就可以了=3= datoukai1年前1
datoukai1年前1 -
 fly_rr 共回答了20个问题
fly_rr 共回答了20个问题 |采纳率90%1
原子核的直径约为为10的-15次方米,电子的直径现今没有准确值(粗略值也没有,只知道它一定小于10的-18次方m,这是人类目前可以测量的最小长度,电子很可能比这个值还要小得多,以致无法测出).有一种通俗的比喻原子像个地球,电子就是其中一粒沙子(实际上比沙子可能还要小得多).
电子的质量是可以准确测定的:静止质量为9.109×10^-31kg.
原子核的质量随核的种类不同而不同,其中每个质子质量为1.6726231 × 10-27 kg,大约是电子质量的1836.5倍.中子的质量比质子略大1.6749286 ×10-27千克.
3
“114”是指原子序数(序号),原子序号是根据质子数排列的,所以114也代表原子中的质子数.1年前查看全部
- 试说明分子原子原子核质子中子电子正离子负离子
试说明分子原子原子核质子中子电子正离子负离子
其中哪几种带电粒子能参与导电形成电流?它们的运动方向和规定的电流方向有什么关系? F12TT1年前2
F12TT1年前2 -
 杨敏君 共回答了18个问题
杨敏君 共回答了18个问题 |采纳率94.4%1、通常所说的导线中的电流是由电子参与形成的.其方向与电子运动方向相反.
2、阴阳离子也可以形成电流,不过这主要发生在电池中.在电池中阴阳离子在正负极之间发生对流,电流方向为阳离子的流向,也是阴离子流动方向的相反方向.
3、若用电解液导电,则电流流向同2中情况.1年前查看全部
- 原子核,电子,元电荷的关系
 l_xuan3809501年前1
l_xuan3809501年前1 -
 冷若冰-- 共回答了16个问题
冷若冰-- 共回答了16个问题 |采纳率100%物体都是由分子(当然也有离子,就物体课来说,你可以这样理解)组成的.而分子是由原子构成的 原子是原子核和围绕在核外的电子组成的(好比太阳系,太阳比作原子核,电子比作九大行星,这样类比不科学,但是,有一定相似处,要有量子力学的知识才能很好的解释) 电子带负电,而原子核带正电,它们电量相等,所以分子对外不表现带电性.电量的最小值就是一个电子所带的电量,所以称为元电荷 原子核是由质子和中子组成,中子不带电,质子带正电,可见,原子核表现出来的带正电是由质子决定的.所以,质子带电总电量和电子总电量等量.一个质子和一个电子带电量也是相同的.所以,也可以说质子带电为元电荷.由此,一个分子的电子的个数应该和质子数相同.原子是化学反应的最小单位,也就是说,在化学反应中,原子是不发生变化的,发生变化的只有分子.元电荷是单个电子或质子的带电量,大小为e,是电量的最小单位; 规定:电子带1个单位的负电荷,质子带1个单位的正电荷; 元电荷、正电荷、负电荷之间的关系,就好比数学中的绝对值、正数、负数的关系.因为1个电子和1个质子所带的电量相同,但电性相反,所以就规定了一个正,一个负.也就是说,如果当初科学家把电子所带的电量规定为正电荷,质子所带电量为负电荷,也是可以的.只是既然以前就规定了质子带正电,电子带负电,就一直沿用下来了,不再改变了.1年前查看全部
- 磷元素在空气中自燃,其原子核中的质子数和中子数怎么变化
 zhou_3ss1年前3
zhou_3ss1年前3 -
 我也来一泡 共回答了22个问题
我也来一泡 共回答了22个问题 |采纳率86.4%化学变化中,是分子分成了原子,原子没有再分,而是重新组合形成新的分子,所以在化学变化中,原子没有变化,所以原子核里的中子和质子也不可能发生变化.磷在空气中燃烧时与空气中的氧气发生反应,磷原子与氧原子通过公用电子对,重新组合成五氧化二磷分子,原子核里的质子和中子都没有变化.
4P +5O2 点燃 2P2O51年前查看全部
- 核外运动的电子是否时刻在发射电磁波?电子会不会因为发射电磁波导致能量减少从而跌入原子核上?为何电子不
 f1101101年前1
f1101101年前1 -
 信而义 共回答了15个问题
信而义 共回答了15个问题 |采纳率93.3%这是当年卢瑟福提出原子结构模型后大家都很头大的问题,依照经典理论的确会发射电磁波,然后就无法自圆其说了,后来让玻尔想通了,可以自己百度下1年前查看全部
大家在问
- 1图中 A,B,C,D 四点中,位于西半球的是_______
- 2在数列{an}中,已知an=(2n-1)4^n-1,求数列的前n项和Sn
- 3根号3a是整式吗
- 4元宵节用英语怎么表达?
- 5根号3a是什么式是根号3乘a
- 6尽管波通过介质传播,但波并没有携带介质本身与它一起传播怎么理解?我们不是都说声源的振动引起空气振动吗
- 79/37+2/12+3/12-9/37简便方法怎么做?
- 8Na2SO3与NaHSO3反应的方程式?(在一定条件下反应要产生气泡的方程式)
- 9求二次函数的概念.越多越好
- 10二次函数知识点 3Q
- 11呼吸氧化酶 不是蛋白质,不由核糖体合成吗?
- 12在磁场运动中,粒子在什么情况的运动中粒子轨迹出现对称性?、
- 13'粒子的波动性是指粒子在其活动的范围中的某一点出现的概率’这一句话怎么理解
- 14判断海水的流向要考虑哪些因素?比如菠萝的海到大西洋```是考虑密度流还是看大西洋暖流```如果两者都看``似乎正好相反`
- 152.15小时=______小时______分 6000平方米=______公顷.






