离域能,成键能,电子结合能的区别
 NetI_22232022-10-04 11:39:541条回答
NetI_22232022-10-04 11:39:541条回答物化HMO部分的一个概念问题:Distinguish between delocalization energy,π-electron binding energy,
and π-bond formation energy.离域能我大概知道是什么,也知道怎么算,可是另外两个我就搞不清楚也不知道怎么算了……求高人解答!

已提交,审核后显示!提交回复
共1条回复
 ccw83 共回答了20个问题
ccw83 共回答了20个问题 |采纳率85%- These are all terms originally associated with the
Hückel approximation used in the treatment of conjugated π‐electron molecules,in
which the π‐electrons are considered independent of the σ‐electrons.π‐electron
binding energy is the sum of the energies of each π‐electron in the molecule.The
delocalization energy is the difference in energy between the conjugated molecule with
n double bonds and the energy of n ethene molecules,each of which has one double
bond.The π‐bond formation energy is the energy released when a π‐bond is formed.It
is obtained from the total π‐electron binding energy by subtracting the contribution
from the Coulomb integrals,α. - 1年前
相关推荐
- 为什么CH2=CH2中双键键能大于CH3—CH3中单键的键能,CH2=CH2却比CH3—CH3活泼
 高山云海1年前1
高山云海1年前1 -
 zisugugu 共回答了15个问题
zisugugu 共回答了15个问题 |采纳率100%你想简单一点 CH2=CH2有两个键 而CH3—CH3是单键 自然双键键能大于单键的键能,而双键中有一个键和单键一样 另一个键与单键不同 这个键相对单键活泼(即更加容易断裂) 化学反应有这样一个特点 即易发生更加易发生的反应 故CH2=CH2却比CH3—CH3活泼的原因1年前查看全部
- 拆开或形成1mol化学键吸收或放出的能量叫做化学键的键能,已知H-H键键能为436kJ•mol-1,H-N键键能为391
拆开或形成1mol化学键吸收或放出的能量叫做化学键的键能,已知H-H键键能为436kJ•mol-1,H-N键键能为391kJ•mol-1.根据热化学方程式3H2(g)+N2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,则N≡N键的键能约为( )
A.431 kJ•mol-1
B.946 kJ•mol-1
C.649 kJ•mol-1
D.896 kJ•mol-1 ljz4131年前1
ljz4131年前1 -
 dahua_221 共回答了15个问题
dahua_221 共回答了15个问题 |采纳率93.3%解题思路:焓变利用键能求算时,△H=反应物键能和-生成物键能和,据此分析.设N≡N键的键能为x,
△H=反应物键能和-生成物键能和=3×436kJ•mol-1+x-2×3×391kJ•mol-1=-92.4KJ/mol,x=946KJ/mol,故选:B.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查通过反应物和生成物的键能大小求算焓变的方法,题目难度不大,注意单位和数据计算的准确性.1年前查看全部
- 下列粒子所含的化学键的键长和键能完全相同的是
下列粒子所含的化学键的键长和键能完全相同的是
A.NH4+ B.Na2O2 C.HCO3- D.H2SO4
为什么答案是A?
答案确实是A kftom1年前4
kftom1年前4 -
 mifan 共回答了19个问题
mifan 共回答了19个问题 |采纳率100%B虽然是对称的,但一个是离子键,一对是共价键,且键长不等
答案是A,因为NH4+中有一个原子提供空轨道(一般为H)一个原子提供孤对电子而形成的配位键,N为sp3杂化,所以四个键的键长和键能完全相同.1年前查看全部
- Ⅰ 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的
Ⅰ 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。 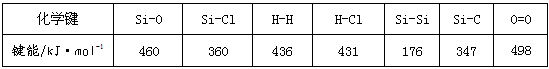
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”):SiC________Si;SiCl 4 ________SiO 2 。
(2)工业上用高纯硅可通过下列反应制取:SiCl 4 (g)+2H 2 (g) Si(s)+4HCl(g)该反应的反应热ΔH=
Si(s)+4HCl(g)该反应的反应热ΔH=
__________kJ·mol -1 。
(3)请把下图表示固体Si在O 2 中完全燃烧生成SiO 2 固体的能量变化图补充完整。
Ⅱ 某实验小组设计下列实验
A 分别配制250mL 1.0 mol/L盐酸跟和250mL 1.1 mol/L氢氧化钠溶液。
B 每次分别取用上述配制的盐酸50 mL跟和氢氧化钠50 mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热。
试回答下列问题:
(4)为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、250mL容量瓶(2个),还缺少的仪器有_____________ 进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有_____________
(5)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H
___________(填“偏大”、“偏小”或“无影响”);
(6)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
已知盐酸、NaOH溶液密度近似为1.00g/cm 3 ,中和后混合液的比热容C=4.18×10 -3 kJ/(g·℃),则该反应的热化学反应方程式为____________________________。  yanfang071年前1
yanfang071年前1 -
 allmaker 共回答了24个问题
allmaker 共回答了24个问题 |采纳率91.7%1年前查看全部
- S4N4中 S-N 键能是多少?
S4N4中 S-N 键能是多少?
The enthalpy of formation of the compound is estimated to be 480kj/mol .H0f of S(g) is 222.8kj/mol .Estimate the average bond enthalpy in the compound. zhaomin19841年前1
zhaomin19841年前1 -
 ee数码技术 共回答了23个问题
ee数码技术 共回答了23个问题 |采纳率91.3%287.8
查N 为472.7
4*(222.8+472.7)-480=2302
2302/8=287.75
你是密院的.1年前查看全部
- 有机化合物化学键键能的计算如何计算一些复杂的有机化合物某些化学键的键能.能不能判断出Iopromide三个C-I键的键能
有机化合物化学键键能的计算
如何计算一些复杂的有机化合物某些化学键的键能.能不能判断出Iopromide三个C-I键的键能顺序,或者最好可以估算出键能大小.
如果其中的一个I 被H取代了,通过哪些实验手段可以确定是哪个位置上的I被H取代了?我们现在只能通过测定溶液中的I离子,知道有一个I 被取代了,但是是哪个位置上的I无法判段. dsagqrgqw1年前1
dsagqrgqw1年前1 -
 zhoupeng520 共回答了18个问题
zhoupeng520 共回答了18个问题 |采纳率94.4%那就得通过你得学习了,上了大学你自然就知道了,现在你还没有学吧.有得题目中替换时一样的.键能得有题目的提示了1年前查看全部
- 已知某些化学键键能的数据如表所示
已知某些化学键键能的数据如表所示
(1)下列物质最不稳定的是______化学键 Cl-Cl Br-Br I-I H-Cl H-Br H-I H-H 键能(kJ/mol) 243 193 151 432 366 298 436
A.HClB.HBrC.HI
(2)氢气与氯气反应生成氯化氢气体的热化学方程式为:______,
该反应是______(选填“吸热反应”或“放热反应”).
相同条件下,1molCl2和1molH2的总能量______2molHCl的总能量(选填:大于、小于或等于)
(3)I2(g)+H2(g)=2HI(g)△H1
I2(s)+H2(g)=2HI(g)△H2
I2(s)=I2(g)△H3
则△H1△H2△H3之间的关系为:△H1=______ (用△H2△H3代数式表示)
(4)H2和O2反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+[1/2]O2(g)=H2O(g)△H=-241.8kJ/molH2(g)+[1/2]O2(g)=H2O(g)△H=-241.8kJ/mol.若1g水蒸气转化成液态水时放热akJ热量,则反应H2(g)+1/2O2(g)═H2O(l)的△H=______;4g H2完全燃烧生成水蒸气时放出的热量为:______
(可能用上的相对原子质量:H 1O 16) 罗彼1年前1
罗彼1年前1 -
 qiandujjk 共回答了15个问题
qiandujjk 共回答了15个问题 |采纳率86.7%解题思路:(1)键能越大,化学键越强,物质越稳定;
(2)根据反应热=反应物的总键能-生成物的总键能计算该反应的反应热,再根据热化学方程式书写原则进行书写;
反应热△H>0,为吸热反应,△H<0,为放热反应,结合该反应的反应热判断;
反应物的总能量>生成物的总能量,反应为放热反应,反应物的总能量<生成物的总能量,反应为吸热反应,根据该反应的反应热判断;
(3)根据盖斯定律,由已知热化学方程式常用合适的系数进行相应的加减构造目标热化学方程式,反应热也乘以相应的系数,进行相应的加减,据此推断反应热关系;
(4)根据热化学方程式书写原则进行书写H2和O2反应生成1mol水蒸气的热化学方程式;
计算18g水蒸气转化成液态水时放热的热量,结合生成气态水的反应热计算△H;
根据n=[m/M]计算4g氢气的物质的量,结合H2完全燃烧生成水蒸气的热化学方程式计算氢气燃烧放出的热量.(1)键能越大,化学键越强,物质越稳定,由表中数据可知,HI的键能相对更小,故HI相对不稳定,
故选C;
(2)对于H2(g)+Cl2(g)=2HCl(g)的反应热△H=436kJ/mol+243kJ/mol-2×432kJ/mol=-185kJ/mol,故氢气与氯气反应生成氯化氢气体的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-185kJ/mol,该反应的反应热△H<0,为放热反应,故反应物的总能量大于生成物的总能量,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-185kJ/mol,放热反应,大于;
(3)已知:①、I2(g)+H2(g)=2HI(g)△H1
②、I2(s)+H2(g)=2HI(g)△H2
③、I2(s)=I2(g)△H3
根据盖斯定律,②-③得①,故△H1=△H2-△H3,
故答案为△H1=△H2-△H3;
(4)H2和O2反应生成1mol水蒸气放热241.8kJ,故该反应的热化学方程式为:H2(g)+[1/2]O2(g)=H2O(g)△H=-241.8 kJ/mol,
1g水蒸气转化成液态水时放热akJ热量,故18g水蒸气转化成液态水时放热出热量为akJ×[18g/1g]=18akJ,故生成1molH2O(l)的反应热△H=-(241.8+18a)kJ/mol,
4gH2的物质的量为[4g/2g/mol]=2mol,故4g氢气完全燃烧生成水蒸气时放出的热量为2mol×241.8 kJ/mol=483.6kJ,
故答案为:H2(g)+[1/2]O2(g)=H2O(g)△H=-241.8 kJ/mol,-(241.8+18a)kJ/mol,483.6 kJ.点评:
本题考点: 有关反应热的计算;用盖斯定律进行有关反应热的计算.
考点点评: 考查键能与物质性质、热化学方程式的生成、反应热的有关计算等,难度中等,注意反应热与键能、物质能量的关系,掌握热化学方程式的书写.1年前查看全部
- 乙烯和乙烷的键能,键长,键角是多少?
乙烯和乙烷的键能,键长,键角是多少?
乙烯和乙烷的键能,键长(CH和CC),键角是多少?
 calvinchao1年前1
calvinchao1年前1 -
 把ff的说成活的 共回答了13个问题
把ff的说成活的 共回答了13个问题 |采纳率100%乙烷键能410KJ/mol,键角109.5°,CC键长0.154
乙烯CC键长0.1341年前查看全部
- 化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol - 1 ,S—S:266 kJ·mol - 1 ,S===O:522 kJ·mol - 1 ,
H—O:464 kJ·mol - 1 。
(1)试根据这些数据计算下面这个反应的反应热:
2H 2 S(g)+SO 2 (g)=3S(s)+2H 2 O(l) Δ H =- Q kJ·mol - 1 ,反应产物中的S实为S 8 ,实际分子是8元环状分子( 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则 Q =_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则 Q =_________。
(2)标准状况下,将 a L H 2 S与 b L SO 2 混合进行上述反应,当 a >2 b 时,反应放热____________kJ·mol - 1 ;当 a <2 b 时,反应放热____________kJ·mol - 1 。
(3)又已知H 2 O(l)=H 2 O(g) Δ H =+44 kJ·mol - 1 请写出(1)中反应若生成气态水时的热化学方程式 。 jxl_laowu1年前1
jxl_laowu1年前1 -
 w_jean118 共回答了15个问题
w_jean118 共回答了15个问题 |采纳率86.7%(1) 154 (2) 154b/22.4154a/44.8
(3) 2H 2 S(g)+SO 2 (g)=3S(s)+2H 2 O(g) Δ H =-66 kJ·mol - 1
反应热ΔH=反应物的键能之和—产物的键能之和
(1)ΔH=2×2×364+2×522—3×266—2×2×464=—Q,可知Q=154
(2)2H 2 S(g)+SO 2 (g)=3S(s)+2H 2 O(l)
当 a >2 b 时,H 2 S过量,以SO 2 的量进行计算,反应放热为: kJ·mol - 1 ;
kJ·mol - 1 ;
当 a <2 b 时,SO 2 过量,以H 2 S的量进行计算,反应放热为: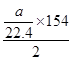 =154a/44.8kJ·mol - 1 ;
=154a/44.8kJ·mol - 1 ;
(3)反应①2H 2 S(g)+SO 2 (g)=3S(s)+2H 2 O(l) Δ H =- 154 kJ·mol - 1
反应②H 2 O(l)=H 2 O(g) Δ H =+44 kJ·mol - 1
由盖斯定律①+2×②可知:2H 2 S(g)+SO 2 (g)=3S(s)+2H 2 O(g) Δ H =-66 kJ·mol - 11年前
61年前查看全部
- 物质的键能 物质所含能量物质本身能量越低,那么就越稳定,原因是破坏其化学键所需能量高.物质本身能量是指什么呢?化学键与“
物质的键能 物质所含能量
物质本身能量越低,那么就越稳定,原因是破坏其化学键所需能量高.
物质本身能量是指什么呢?化学键与“物质本身能量”有什么关系? j_thomi1年前1
j_thomi1年前1 -
 goricki 共回答了16个问题
goricki 共回答了16个问题 |采纳率81.3%只给你个小提示,这里应该是缩写,本意应该是物质本身活跃的化学能.1年前查看全部
- 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C 键能/kJ·mol -1 460 360 436 431 176 347
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC____________Si;SiCl 4 ____________SiO 2 。
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。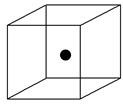
(3)工业上高纯硅可通过下列反应制取:SiCl 4 (g)+2H 2 (g) Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol -1 。
Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol -1 。 holland_1381年前1
holland_1381年前1 -
 数我小美 共回答了16个问题
数我小美 共回答了16个问题 |采纳率93.8%(1)> <
(2)如下图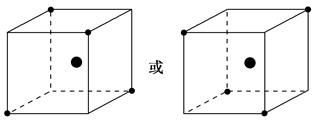
(3)236
(1)SiC和晶体Si皆为原子晶体,由于碳化硅晶体中的Si—C键的键能大于硅晶体中Si—Si键的键能,故SiC的熔点比Si高;SiCl 4 为分子晶体,SiO 2 为原子晶体,故SiCl 4 的熔点比SiO 2 低。
(2)晶体硅的结构与金刚石相似,每个硅原子都被相邻的4个硅原子包围,这4个硅原子位于四面体的四个顶点上,被包围的硅原子处于正四面体的中心。
(3)根据题目所给反应式,需要断裂的旧化学键键能之和为4×360 kJ·mol -1 +2×436 kJ·mol -1 =2 312 kJ·mol -1 ,形成的新化学键键能之和为4×431 kJ·mol -1 +2×176 kJ·mol -1 =2 076 kJ·mol -1 ,所以ΔH=236 kJ·mol -1 。1年前查看全部
- 关于共价键的键能……在解释下列物质性质的变化规律与物质结构间的因果关系,与键能无关的变化规律是 ( )A.HF、HCl、
关于共价键的键能……
在解释下列物质性质的变化规律与物质结构间的因果关系,与键能无关的变化规律是 ( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次减低
C.F2、Cl2、Br2、I2的熔沸点逐渐升高
D.H2S 的熔沸点小于H2O的熔沸点
B项肯定不对,他是离子键
C项和D项应该也不对啊,键能与分子的稳定性有关,与熔沸点不是无关么?
化学不选3项的说…… dengdaiduibian1年前1
dengdaiduibian1年前1 -
 出家人1 共回答了18个问题
出家人1 共回答了18个问题 |采纳率100%答案是D,D是由于氢键的原因.B是对的,离子晶体的键能越大,融化时需要的能量越多,温度也就越高.C说的有些勉强,主要是跟分子量有关.1年前查看全部
- 键能是指断开1mol共价键吸收的能量或形成1mol共价键放出的能量,已知H-H键能为436kJ/mol,H-Cl键能为4
键能是指断开1mol共价键吸收的能量或形成1mol共价键放出的能量,已知H-H键能为436kJ/mol,H-Cl键能为431kJ/mol,
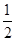 H 2 (g)+
H 2 (g)+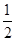 Cl 2 (g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为
Cl 2 (g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为A.(2a-426)kJ/mol B.(426-a)kJ/mol C.(426-2a)kJ/mol D.(426+a)kJ/mol  hybvsll1年前1
hybvsll1年前1 -
 qwsaaswq 共回答了21个问题
qwsaaswq 共回答了21个问题 |采纳率76.2%C
1年前查看全部
- 下列数据有些明显不符合事实。其中不可信的是( ) A.H—Cl的键能为43
下列数据有些明显不符合事实。其中不可信的是()
A.H—Cl的键能为432 kJ/mol,H—F的键能明显高于432 kJ/mol B.0.1 mol/L氨水中NH 3 ·H 2 O部分电离,一定温度下该氨水的电离度为55% C.某Ca(OH) 2 溶液的浓度为0.5 mol/L D.十六烷的裂化产物中不饱和烃的分子数超过50%  没毛的鹦鹉1年前1
没毛的鹦鹉1年前1 -
 一滴沙子 共回答了17个问题
一滴沙子 共回答了17个问题 |采纳率88.2%BC
非金属性越强,形成的共价键越稳定,A正确。一水合氨的电离程度,很小,不可能达到55%,B不正确。氢氧化钙是微溶性物质,其浓度达不到0.5mol/,C不正确。十六烷的裂化产物是辛烯和辛烷,D正确。答案选BC。1年前查看全部
- 下列说法正确的是( )A. 焓变等于反应物的总能量减去生成物的总能量B. 焓变等于反应物的键能总和减去生成物的键能总和
下列说法正确的是( )
A. 焓变等于反应物的总能量减去生成物的总能量
B. 焓变等于反应物的键能总和减去生成物的键能总和
C. 断裂化学键是放热过程
D. 形成新的化学键是吸热过程 pupt1年前1
pupt1年前1 -
 良少侠 共回答了18个问题
良少侠 共回答了18个问题 |采纳率83.3%解题思路:化学反应的实质是旧键的断裂和新键的生成,旧键断裂吸收能量,形成新键放出能量,焓变等于生成物的总能量减去反应物的总能量或反应物的键能总和减去生成物的键能总和.A.焓变等于生成物的总能量减去反应物的总能量,故A错误;
B.焓变等于反应物的键能总和减去生成物的键能总和,如吸收能量少,放出能量多,则为放热反应,故B正确;
C.断裂化学键是吸热过程,故C错误;
D.形成新的化学键是放热过程,故D错误.
故选B.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查化学反应与能量变化,侧重于焓变与反应热的理解,题目较为基础,注意相关知识的学习.1年前查看全部
- 化学反应的热效应(反应热)和键能的关系:△H=E1(反应物的键能总和)-E2(生成物的键能总和) 这一定律为什么只适用于
化学反应的热效应(反应热)和键能的关系:△H=E1(反应物的键能总和)-E2(生成物的键能总和) 这一定律为什么只适用于反应物和生成物都是气态的反应
 linrong1年前3
linrong1年前3 -
 dennilee2k 共回答了14个问题
dennilee2k 共回答了14个问题 |采纳率92.9%如果是液态的或者固态的,可能会有额外的能量参与进来.
比如,液态的水分子之间有氢键,氢键也是具有能量的.
而固体化合物,则普遍存在晶格能,大概意思就是形成晶体,也会释放出能量.
总之,只有在气态时,分子间的距离较远,相互作用很弱,分子间作用而带来的额外能量也就可以忽略不计了.但非气态时,分子间的作用会释放能量.这部分能量会改变热效应.
大致就这么回事吧~1年前查看全部
- 碳碳键的键能为何大于碳硅键能大于硅硅键能
 爱上了酸奶1年前1
爱上了酸奶1年前1 -
 南mm深秋之恋 共回答了28个问题
南mm深秋之恋 共回答了28个问题 |采纳率89.3%要是问具体原因,因为C原子半径小,键程短,相对C-SI和SI-SI来说键能就大1年前查看全部
- Cl-CL的键能大于Br-Br的键能 为什么不能说明Cl2比Br2稳定?
Cl-CL的键能大于Br-Br的键能 为什么不能说明Cl2比Br2稳定?
RT 燕飞过了无痕1年前2
燕飞过了无痕1年前2 -
 樱桃子82 共回答了16个问题
樱桃子82 共回答了16个问题 |采纳率100%键能大只能说明热稳定性好,反应性不仅和反应物稳定性有关,还和产物有关.Cl-Cl键能比Br-Br键能大,只能说明Cl2受热分解成2个Cl原子所需的最低温度比Br2分解成2个Br原子所需的最低温度要高,即Cl2对热较稳定,这和它们的氧化还原活性没有必然联系.1年前查看全部
- H2O2 与 O2的O-O键键能 哪个大,为什么?
 ihuangse231年前1
ihuangse231年前1 -
 8度C 共回答了19个问题
8度C 共回答了19个问题 |采纳率94.7%当然是O-O啦 因为H2O2不稳定啊 容易分解
而氧气空气中 就有 你说哪个稳定?
稳定的见能不就大吗?1年前查看全部
- 碳碳单键的键能是多少,碳碳双键的键能是多少.
 浪迹____gg1年前1
浪迹____gg1年前1 -
 yy宪之路 共回答了17个问题
yy宪之路 共回答了17个问题 |采纳率94.1%C-C 345.6KJ/mol
C=C 610KJ / mol1年前查看全部
- 键离解能和键离解焓有什么区别书上说键离解能即键能,键离解焓是标况下将理想气体分子AB拆开成为理想气态的A原子和B原子.这
键离解能和键离解焓有什么区别
书上说键离解能即键能,键离解焓是标况下将理想气体分子AB拆开成为理想气态的A原子和B原子.这样有什么区别?什么时候会相等? tryci1年前1
tryci1年前1 -
 karen_yujing 共回答了15个问题
karen_yujing 共回答了15个问题 |采纳率86.7%对离解越有利,就原子吸收光谱分析而言,解高能小于3.5eV的分子,容易被解离,当大于5eV时,解离就比较困难 再说有用的,就是解离能和键能的区别,他们最大1年前查看全部
- 化学键的键能,键角,键长都分别能判定物质的什么性质?
 青色小巫1年前2
青色小巫1年前2 -
 xxzzhh 共回答了18个问题
xxzzhh 共回答了18个问题 |采纳率88.9%键能:键的能量,能判断键的牢固成都,进而判断分子的稳定性.
键角:键之间的角度,可以判断键之间的位置关系,进而判断分子的空间构型.
键长:键的长度,与键能之间有一定的关系,键越长,则越容易断裂,键能就越小,键就越不牢固,所以,也可以判断分子的稳定性.
另外,与分子的形状之间也有一定的联系,如CH4与CCl4,后者的键长大一些,则后者分子半径大一些.1年前查看全部
- 2个N-N键能之和小于N=N的键能,所以N=N更稳定.而2个C-C键能小于C=C,所以倾向于形成单键.
2个N-N键能之和小于N=N的键能,所以N=N更稳定.而2个C-C键能小于C=C,所以倾向于形成单键.
为什么是2个? 茸茸1121年前1
茸茸1121年前1 -
 林聚忠 共回答了20个问题
林聚忠 共回答了20个问题 |采纳率90%你抄错了吧,2个单键之和>1个双键.1个单键1年前查看全部
- 2个元素比较非金属性 单质分子中的键能 和 两单子在自然界中的存在为什么不能作为验证的证据?
 n当家的1年前1
n当家的1年前1 -
 天上星星地上人 共回答了27个问题
天上星星地上人 共回答了27个问题 |采纳率81.5%单质在自然界存在只能说明组成单质的原子之间能相互之间形成共价键,一个原子轨道能与另一个原子的轨道配合;单质分子中的键能是指组成单质分子所有键能的总和,有的单质形成只有一个键,有的有两个键,有的有三个键.所以不能.1年前查看全部
- 晶体熔沸点比较分子晶体的熔沸点是不是比较分子量?它们的稳定性是不是看键能?也就是通过比较键长来比较?离子晶体呢?原子晶体
晶体熔沸点比较
分子晶体的熔沸点是不是比较分子量?它们的稳定性是不是看键能?也就是通过比较键长来比较?
离子晶体呢?
原子晶体呢?
是不是凡是涉及熔沸点都与分子量有关?稳定性都与键有关? 酷爱BT1年前1
酷爱BT1年前1 -
 suckdog 共回答了14个问题
suckdog 共回答了14个问题 |采纳率100%分子晶体熔化破坏分子间作用力----范德华力{取向力,诱导力,色散力}
其中,色散力与分子量有关.分子量越大,色散力越大
原子晶体仅由共价键决定.与键的强弱有关与键长无关.非金属性相差大不大.
离子晶体仅由离子键决定.与晶体的堆积方式,离子的电荷量,离子的半径决定.可以用静电力公式记忆.与电荷量成正比,与半径成反比.1年前查看全部
- 焓变=( ) A.生成物能量-反应物能量 B.生成物键能-反应物键能
 michael0081年前1
michael0081年前1 -
 爱听敏佳的歌 共回答了15个问题
爱听敏佳的歌 共回答了15个问题 |采纳率100%焓变(enthalpy)即物体焓的变化量.焓变是生成物与反应物的焓值差.是焓变与反应物键能生成物键能的关系.
选B
http://baike.baidu.com/view/355408.htm1年前查看全部
- 化学中为什么金属半径越小键长就越短 键能_page_type=1
 紫夜深秋处1年前1
紫夜深秋处1年前1 -
 花花天子 共回答了13个问题
花花天子 共回答了13个问题 |采纳率84.6%键长=两个原子的半径之和-电子云交盖的部分
半径小当然键长就会短阿.1年前查看全部
- 氮气中π键和σ键哪个键能大?答案是π键,根据键能的计算可知道.但是从结构上看,σ键明明比π键的连接方式更稳定啊?
氮气中π键和σ键哪个键能大?答案是π键,根据键能的计算可知道.但是从结构上看,σ键明明比π键的连接方式更稳定啊?
拒绝抄录网页,拒绝灌水, 坐月宝贝1年前1
坐月宝贝1年前1 -
 A20011827 共回答了18个问题
A20011827 共回答了18个问题 |采纳率88.9%因为氮气分子中的π键不是普通的π键,是两中心三电子的大π键.1年前查看全部
- 为什么乙烯使溴水褪色比乙炔快?乙炔断裂一个pai键需要的键能比乙烯少呀,为什么更慢呢?
 fjr78911851年前2
fjr78911851年前2 -
 ywz413 共回答了17个问题
ywz413 共回答了17个问题 |采纳率88.2%因为这个反应实际上是乙烯和乙炔的亲电加成反应,由于双键的电子云密度大于三键,更易于被亲电,
so:乙烯使溴水褪色比乙炔快1年前查看全部
- 为什么1mol石墨总键能>1mol金刚石总键能
 liuqian3051年前4
liuqian3051年前4 -
 ty_真麻烦 共回答了23个问题
ty_真麻烦 共回答了23个问题 |采纳率87%因为石墨中的碳碳键键长短,键更牢固,所以键能大.1年前查看全部
- 气态硫液态硫固态硫的键能一样大吗?
气态硫液态硫固态硫的键能一样大吗?
怎样用焓描述内能? belzony1年前1
belzony1年前1 -
 远山佳人 共回答了18个问题
远山佳人 共回答了18个问题 |采纳率83.3%一样,化学性质一样,所以化学键一样
物态应该和分子间作用力有关1年前查看全部
- Br—Br(g)和Br—Br(s)的键能一样吗?
 文猜猜1年前1
文猜猜1年前1 -
 豪猪屁特 共回答了21个问题
豪猪屁特 共回答了21个问题 |采纳率100%首先明确一点:Br—Br(g) = 2Br(g) 是键能,即气态到气态,断一摩尔键所需要的能量;
Br—Br(s) 键不是键能,因为状态不同,肯定和Br—Br(g)键能不一样了.1年前查看全部
- 化学键的键能,断1mol化学键吸收的能量,形成1mol化学键放出的能量 这三者有什么关系?
 潜水员f1年前3
潜水员f1年前3 -
 很遥远 共回答了25个问题
很遥远 共回答了25个问题 |采纳率80%断1mol化学键吸收的能量,形成1mol化学键这两个过程是互逆的,所以破坏1mol化学键吸收的能量和形成1mol放出的能量完全相等1年前查看全部
- 第二周期元素A与氢形成的如下化合物中的A-A键的键能(kJ/mol):
第二周期元素A与氢形成的如下化合物中的A-A键的键能(kJ/mol):
CH3-CH3 346, H2N—NH2 247, HO-OH 207
试问:它们的键能为什么依次下降?
为什么孤对电子越多,键能越小? 13w芝麻nn1年前2
13w芝麻nn1年前2 -
 如狼似狗 共回答了18个问题
如狼似狗 共回答了18个问题 |采纳率100%原子形成共价键,其化合键键能受原子核间作用力影响,从C到O,原子所带的正电荷(质子数)逐渐增加,所以原子核之间的排斥作用增强,键长增长,故键能减小.
从分子杂化轨道角度来说,C-C、N-N、O-O单键形成SP3杂化,有用NN键中有一个SP3杂化轨道是未成键电子,这样在H原子的作用下,H2N-NH2中化合键的键角为108°(此时形成空间稳定结构),而CH3-CH3中有用4个SP3杂化轨道相互对称,所以形成空间正四面体,键角为109.5°,这样的结构使分子中个原子间作用力较小,空间结构更稳定,所以化合键作用更强,键能更高.同理,HO-OH中键角为104.5°,所以键能更小.
两种左右分别从原子吸引和电子成键方向分别对键能造成影响,个人觉得前者是主要原因.1年前查看全部
- 化学键的极性对键能、键长有影响吗
化学键的极性对键能、键长有影响吗
在乙炔中,由于C呈sp杂化,电负性比较大,导致碳氢键极性大,从而使得端位氢容易异裂, 巴哈鱼1501年前3
巴哈鱼1501年前3 -
 trsss 共回答了15个问题
trsss 共回答了15个问题 |采纳率93.3%额,怎么说呢,这个问题其实没有谁影响谁的,因为一个化学键产生的同时,他的极性,键能,健长都是确定的,不存在谁影响谁.1年前查看全部
- 算硅和氧气燃烧时的反应热,题目给了我键能
算硅和氧气燃烧时的反应热,题目给了我键能
请问Si要算几个Si-Si呢? chenxiaowei11211年前1
chenxiaowei11211年前1 -
 juan_jian 共回答了21个问题
juan_jian 共回答了21个问题 |采纳率81%2个.
Si是正四面体结构,每个Si 原子与4个Si 原子相邻连接,每个Si-Si 键被2个Si 原子共用,4/2=2..1年前查看全部
- N2的键能是指拆1molN2分子所需的能量还是指拆1mol的N-N键所需的能量?
 缘本无悔1年前1
缘本无悔1年前1 -
 xxmmmm 共回答了18个问题
xxmmmm 共回答了18个问题 |采纳率94.4%N2的键能是指拆1molN2分子所需的能量.1年前查看全部
- 1.若氮氮三键的键能为941.3kJ/mol,H-H的键能为436.4kJ/mol,则N-H的键能为多少?
1.若氮氮三键的键能为941.3kJ/mol,H-H的键能为436.4kJ/mol,则N-H的键能为多少?
2.2N2+Cl2==2NH3 △H=-92.2kJ/mol
当下列物理量保持不变时,表明该反应一定处于化学平衡状态的是:
A.容器内氮气和氢气的浓度比
B.容器内气体密度
C.恒温下容器压强
D.氢气的物质的量
充分反应后恢复到原来温度,反应过程中放出的热量__________92.2kJ(填>、 奇怪哦1年前1
奇怪哦1年前1 -
 夕阳以西 共回答了15个问题
夕阳以西 共回答了15个问题 |采纳率93.3%1.若氮氮三键的键能为941.3kJ/mol,H-H的键能为436.4kJ/mol,则N-H的键能为多少?
2.2N2+3H2==2NH3 △H=-92.2kJ/mol
放出的热量等于形成化学键的放出的能量-断开化学键的能量
即:92.2=2*3*a-2*941.3 - 436.4*3(你问的问题的热化学方程式错了)
注:形成化学键为N-H有6个!断开化学键有3个H-H键和2两个N和N之间的三键!
求a即可!
当下列物理量保持不变时,表明该反应一定处于化学平衡状态的是:
A.容器内氮气和氢气的浓度比:可以说明平衡
B.容器内气体密度:你的题目一定是体积不变,因此无任是否平衡,其密度不变
C.恒温下容器压强:可以说明平衡,因为反应开始后,气体的分子个数在变化,那么压强也在变化,当达到平衡时,气体分子个数不变,则压强就不变,因此压强不改变的时候,说明达到平衡了!
D.氢气的物质的量:也可以说明平衡,因为在没有平衡以前,氢气的质量是在不断减少的!1年前查看全部
- 已知断裂1molO2中的化学键需要吸收496kj的能量,H―O键的键能为463kj/mol,则H2中H―H键的键能为?
 zuomeng0081年前1
zuomeng0081年前1 -
 英伦上空的鹰 共回答了2个问题
英伦上空的鹰 共回答了2个问题 |采纳率50%系统消息: 您问的问题有些难,您可以及时的点击右上角的采纳,然后输入#召唤学霸#即可将您的问题反馈给管理员,然后把你的问题推送给学霸解答(3分钟内回复有效)1年前查看全部
- 一道关于键能的高中化学题1mol石墨和1mol金刚石那个键能大?谢谢!注:两者均是1mol;要有具体的理由;我没学选修3
一道关于键能的高中化学题
1mol石墨和1mol金刚石那个键能大?谢谢!
注:两者均是1mol;要有具体的理由;我没学选修3(原子结构),所以尽量不要用结构讲,从能的角度讲(学了选修4,但没学选修5) efkss1年前3
efkss1年前3 -
 遇到ni 共回答了16个问题
遇到ni 共回答了16个问题 |采纳率87.5%物质的化学键能越大,则能量越小低,越稳定
因为石墨比金刚石稳定 所以石墨的键能大1年前查看全部
- 有机化学中用杂化来解释键长键能的问题
有机化学中用杂化来解释键长键能的问题
小弟大学有机化学坐的飞机 不好意思啊
1.用杂化理论解释为什么 甲烷 乙炔 乙烯的 C-H键键长不同,
这个这么说?
根据我的理解杂化之后形成的电子云重叠 sp3最大 sp最小那么 重叠面积达就表示键长最小,
2.关于解离键能为什么这个会是甲烷最大
因为我看来sp结合应该是s的成分最多啊,那么sp结合应该离原子核更近,那么键能应该最大啊,但事实却是相反的这是为什么
真的非常不好意思 gpower19841年前4
gpower19841年前4 -
 风流客林敦 共回答了27个问题
风流客林敦 共回答了27个问题 |采纳率85.2%这样吧,因为我只是高中的化学,说出给你听听我的理解.
首先甲烷乙炔乙烯这些都是 碳氢化合物 这个没有问题吧
要理解这个化学键的长度 需要知道原子核和电子之间的关系 还有原子核的重量
一个碳原子 原子核只有这么大的(体积和重量) 最外层电子有4个 那么在对于这个碳原子来说它只能够有那么大的力量来吸引电子 或者说其它原子的化合
就拿甲烷来说 它的碳氢键是比较近的 这是相对于乙炔 来说为什么呢 是因为原子核的体积和重量还有“力”来说的.你可以发挥想象力 希望你能够很好的理解化学键
对了未来的科技——— 物理---->化学---->生物科技1年前查看全部
- 应该从哪几个方面判断键能的大小?
 navyhan1年前2
navyhan1年前2 -
 n3ggeve 共回答了20个问题
n3ggeve 共回答了20个问题 |采纳率85%离子键:离子半径和电荷数
共价键:原子半径1年前查看全部
- 根据焓变=反应产物的焓减去反应物的焓和 焓变=反应中断裂旧化学键的键能减去形成新化学的键能
根据焓变=反应产物的焓减去反应物的焓和 焓变=反应中断裂旧化学键的键能减去形成新化学的键能
一个是生成物减反应物一个是反应物减生成物.怎么用啊 猪有饭1年前2
猪有饭1年前2 -
 yangchengwen 共回答了21个问题
yangchengwen 共回答了21个问题 |采纳率95.2%第一个就是生成物的总能量减去反应物的总能量 (把焓变理解成总能量)
第二个就是反应物的每个原子之间的键能减去生成物之间的键能
这个键能指的是断开这个键需要的能量,就好像把每个原子全拆开再重新组合1年前查看全部
- 如何比较物质的稳定性什么时候用元素周期率.什么时候根据键能.什么时候根据相对分子量的大小比如Cl2和Br2的稳定性
 傻才的悲伤1年前1
傻才的悲伤1年前1 -
 莙紫 共回答了19个问题
莙紫 共回答了19个问题 |采纳率89.5%稳定性和分子量关系不大
周期律和键能实际上是一样的.由于某些结构相似的物质,其键能与周期律有相似处,为方便中学生记忆,才有了所谓用周期律判断的方法.
Cl2比Br2稳定,因为Cl-Cl键的键能比Br-Br键大:
BE(Cl-Cl)=+243kJ/mol
BE(Br-Br)=+193kJ/mol1年前查看全部
- 物质稳定性在书上看到:1.能量越低越稳定2.共价化合物键能越大,分子的热稳定性越强这两句话是不是有点矛盾?能量和键能是不
物质稳定性
在书上看到:1.能量越低越稳定
2.共价化合物键能越大,分子的热稳定性越强
这两句话是不是有点矛盾?
能量和键能是不是一样的?
“能量越低越稳定”是不是适用与所有物质?
那能量越低是不是键能越大? class9yinjie1年前1
class9yinjie1年前1 -
 z6a1 共回答了15个问题
z6a1 共回答了15个问题 |采纳率100%不矛盾呀.
能量是物质本身具有的,而键能是拆开化学键用的
能量越低越稳定适用所有物质.
但是你看,不稳定就是容易变其他物质.
也就是先要拆开化学键.
键能大拆起来难,分子的热稳定性越强~
问题补充:那能量越低是不是键能越大?
理解键能的概念,键能是指断开一摩尔(或形成一摩尔)该键所需要(放出)的能量,而不是物质本身所具有的能量-----键能越大,键越难断,也就是越稳定.
键能和能量不是一概念~
你硬要这么认为也没什么大错,勉强~1年前查看全部
- 键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量.化学反应就是旧键的断裂和新键形成的过程.现查得:H-H、Cl
键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量.化学反应就是旧键的断裂和新键形成的过程.现查得:H-H、Cl-Cl和H-Cl的键能分别为436KJ/mol、243KJ/mol和431KJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应( )
A. 放热183KJ
B. 放热91.5KJ
C. 吸热183KJ
D. 吸热91.5KJ meizia1年前1
meizia1年前1 -
 neifa 共回答了17个问题
neifa 共回答了17个问题 |采纳率88.2%解题思路:化学反应中,旧键断裂吸收能量,形成新键放出能量,根据反应Cl2+H2=2HCl键能计算反应热.化学反应中,旧键断裂吸收能量,形成新键放出能量,反应Cl2+H2=2HCl中,形成1molHCl时,
需要断裂0.5molCl-Cl键和0.5molH-H键,则吸收能量:0.5mol×436KJ/mol+0.5mol×243KJ/mol=339.5KJ,
生成1molHCl时需生成1molH-Cl键,放出1mol×431KJ/mol=431KJ能量,
则放出的能量为431KJ-339.5KJ=91.5KJ,
故选B.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查反应热及焓变,题目难度不大,本题注意化学键的断裂与形成与反应热的关系,注意根据化学方程式计算.1年前查看全部
- 化学反应与热量的关系?1.破坏1mol物质中化学键所消耗能量越大,物质能量越小,物质越稳定这句话对吗?与键能的关系?2.
化学反应与热量的关系?
1.破坏1mol物质中化学键所消耗能量越大,物质能量越小,物质越稳定这句话对吗?与键能的关系?
2.缓慢氧化是不是都产生热量?请举例
3.氨的催化氧化实验? redwolf25275001年前1
redwolf25275001年前1 -
 王方远 共回答了24个问题
王方远 共回答了24个问题 |采纳率83.3%你上大学在大一大二会学到你提的所有问题,如果你是大学生,第一个问题在物理化学这本书的上册.2,3都在基础化学这一块,好好看书就会有答案,氨有一个完整的章节在讲.1年前查看全部
- 关于键能 比如拆开Cl-Cl 需吸收的能量和 形成Cl-Cl 所释放的能量会相等吗?
关于键能 比如拆开Cl-Cl 需吸收的能量和 形成Cl-Cl 所释放的能量会相等吗?
我的问题是
拆开某一化学键需吸收的能量与形成该化学键所释放的能量会相等吗(理想状态下) ?
···
RT 权威点的解答有没? uo7d1年前2
uo7d1年前2 -
 万岁万岁万万岁 共回答了17个问题
万岁万岁万万岁 共回答了17个问题 |采纳率82.4%相等.为什么呢?
能量其实玩的就是相对位置的游戏.对于相同的体系(比如CI-CI),由于产生影响的物质产生的影响相同(因为是相同的体系),并且同一个键的拆开与形成时,体系中产生影响的物质之间的相对位置的变化量是一个定值(有一个相对确定的量).
因此,相等.1年前查看全部
- 一般说来键长越短键能越长,但氟气的键能是157,氯气的键能是242.7,氟气的键长是141,氯气的键长是198请问为什么
一般说来键长越短键能越长,但
氟气的键能是157,氯气的键能是242.7,
氟气的键长是141,氯气的键长是198
请问为什么氟气的键能比滤器小但键长比氯气短? hycbat1年前1
hycbat1年前1 -
 蔚昊峰清湖B6 共回答了16个问题
蔚昊峰清湖B6 共回答了16个问题 |采纳率93.8%两个F原子离得太近 其电子对之间有了斥力冲抵了部分键能所以实测键能反而小1年前查看全部
大家在问
- 1爸爸去年给安安存了5000元的教育储蓄,今年到期后得到本金和利息共5270元.求这种教育储蓄的年利率.
- 2求一个以3和-4为实数根的一元二次方程
- 3英语翻译1 一辆轿车正在高速公路上逆行2 我不会相信他的任何话3 我才不会上你的当4 一辆轿车撞倒一位老人后,向北面逃窜
- 4(2014•崇明县一模)物质的用途主要由物理性质决定的是( )
- 5--Do you mind if I ___the mistakes in your composition?
- 6智填成语:有这样一个4*4的正方形,在他的一条对角线的位置上,有四个字都是“乐”,帮我!
- 7如何测固体的密度?方法越多越好
- 8七年级上册英语Unit6Grammar Focus
- 9如果一个棱柱一共有12个顶点,底边长是侧棱长的一半,并且所有的棱长的和是120cm,那么每条侧棱长是______cm.
- 10pedestrain和pedestrian有什么区别
- 11焊接时,产生电弧和维持电弧燃烧的必要条件是什么
- 12英语翻译读史使人明智,读诗使人灵秀,数学使人周密,科学使人深刻,伦理使人庄重,逻辑修辞使人善变.
- 13It's getting dark . I have to go home.---Don't be____to go h
- 14设实数集S是满足下面条件的集合①1∈S,②若a∈S,则(1-a)/1
- 15求文档: 因式分解 x²-6xy+9y²-5xz+15yz+6z&

