难溶制更难难溶.难挥发制易挥发.强酸制弱酸.之类的还有什么?帮总结下
 cuiguijiang2022-10-04 11:39:544条回答
cuiguijiang2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 uknow 共回答了15个问题
uknow 共回答了15个问题 |采纳率93.3%- 复分解反应,想必上过初中的人都学过吧,其遵循强制弱的原则,即强酸制弱酸、易溶物制难溶物、难挥发物制易挥发物等等原则,但没有正确的反映事物反应真正的内在规律,如:2CuSO4+2NaHS==Na2SO4+2CuS↓+H2SO4,像这个就要运用到化学热力学的知识,即反应的内在实质.
- 1年前
 东游西逛 共回答了1个问题
东游西逛 共回答了1个问题 |采纳率- 高沸点制取低沸点
- 1年前
 SYlumang 共回答了195个问题
SYlumang 共回答了195个问题 |采纳率- 共两种:
1、复分有沉淀、气体、弱电解质
2、氧化还原反应 - 1年前
 gordon995 共回答了2个问题
gordon995 共回答了2个问题 |采纳率- 上一篇:两个MM整理了一个...
下一篇:这些水果怎么洗
|返回日志列表
[转] 高中化学知识 分享 转载 复制地址 日志地址:
请用Ctrl+C复制后贴给好友。
转发到微博
转载自 一段香 2010年01月14日 16:52 阅读(14) 评论(5) 分类:个人日记
举报 字体:大▼ 小 中 大
1.颜色的规律
... - 1年前
相关推荐
- (2010•南京三模)白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
 (2010•南京三模)白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
(2010•南京三模)白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
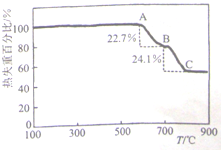
(1)甲同学利用加热法测定白云石中MgCO3的含量,实验曲线如图(MgCO3的分解温度比CaCO3低)
①700℃(即B点)对剩余固体的主要成分为______(填化学式).
②该白云石中MgCO3的质量分数为______(保留3位有效数字).
(2)乙同学利用滴定法测定白云石中MgCO3的含量.已知:①滴定时,EDTA分别有Ca2+或Mg2+以物质的量之比1:1进行反应,可用K-B指示剂作为该滴定反应的指示剂;②实验条件下.Mg2+开始沉淀时的pH为10,沉淀完全时的pH为11.2,Ca2+开始沉淀时的pH为12.
步骤1:准确称取白云石试样m g,在烧杯中用适量稀盐酸完全溶解;
步骤2:冷却后全部转移到250mL容量瓶中定容,
步骤3:从容量瓶中移取试液25.00mL,用NaOH溶液调节溶液pH约为9.5;
步骤4:加入2滴K-B指示剂,以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V1mL;
步骤5:再从容量瓶中移取试液25.00mL,______;
步骤6:加入2滴K-B指示剂,继续以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V2mL.
①根据上述分析数据,测得该白云石试样中MgCO3的质量分数为
%84c(V1−V2) m (用含字母的代数式表示).
%84c(V1−V2) m
②配制100mL c mol/L EDTA标准溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒,______. 带劲妞1年前1
带劲妞1年前1 -
 irenelyl1 共回答了22个问题
irenelyl1 共回答了22个问题 |采纳率90.9%解题思路:(1)①根据信息,碳酸镁分解温度比碳酸钙的低,白云石中先分解的是碳酸镁,分析图象曲线变化特征,图象中A到B过程是碳酸镁分解,BC段是碳酸钙分解;
②设混合物为100g,热失重比22.7%,则碳酸镁分解失重22.7g为碳酸镁分解生成的二氧化碳,依据化学方程式计算出碳酸镁恰好分解时的质量,得到碳酸镁的含量;
(2)①从容量瓶中移取试液25.00mL,用NaOH溶液调节溶液pH约为9.5;镁离子和钙离子全部和c mol/L的EDTA标准溶液反应消耗EDTA溶液V2mL,再从容量瓶中移取试液25.00mL,用NaOH溶液调节pH至11.2~12之间,镁离子全部沉淀,加入2滴K-B指示剂,继续以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V2mL,是钙离子和c mol/L的EDTA标准溶液反应消耗的溶液体积,依据两次滴定数据可以计算镁离子和c mol/L的EDTA标准溶液反应的体积为(V1-V2)ml,依据滴定时,EDTA分别有Ca2+或Mg2+以物质的量之比1:1进行反应计算碳酸镁质量分数;
②依据溶液配制过程和操作选择所需玻璃仪器.(1)①根据信息,碳酸镁分解温度比碳酸钙的低,白云石中先分解的是碳酸镁,分析图象曲线变化特征,图象中A到B过程是碳酸镁分解,MgCO3
△
.
MgO+CO2↑,BC段是碳酸钙分解,所以B点得到固体为MgO和CaCO3,故答案为:MgO和CaCO3;
②B点是碳酸镁恰好分解时的质量变化,设混合物为100g,热失重比22.7%,则碳酸镁分解失重22.7g为碳酸镁分解生成的二氧化碳,
MgCO3
△
.
MgO+CO2↑,
84 44
m 22.7g
m=43.3g
则碳酸镁质量分数为43.3%或0.433,
故答案为:43.3%或0.433;
(2)从容量瓶中移取试液25.00mL,用NaOH溶液调节溶液pH约为9.5;镁离子和钙离子全部和c mol/L的EDTA标准溶液反应消耗EDTA溶液V2mL,再从容量瓶中移取试液25.00mL,用NaOH溶液调节pH至11.2~12之间,镁离子全部沉淀,加入2滴K-B指示剂,继续以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V2mL,是钙离子和c mol/L的EDTA标准溶液反应消耗的溶液体积,依据两次滴定数据可以计算镁离子和c mol/L的EDTA标准溶液反应的体积为(V1-V2)ml,依据滴定时,EDTA分别有Ca2+或Mg2+以物质的量之比1:1进行反应计算碳酸镁质量分数,
故答案为:用NaOH溶液调节pH至11.2~12之间;
①250ml溶液中碳酸镁的质量分数=
(V1−V2)×10−3L×cmol/L×84g/mol
mg×10×100%=
84c(V1−V2)
m%,故答案为:
84c(V1−V2)
m%;
②依据配制溶液的步骤是计算、量取用量筒,溶解用烧杯和玻璃棒,转移玻璃棒,洗涤一并转移到100ml的容量瓶,最后用胶头滴管定容,配制100mL c mol/L EDTA标准溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了实验探究物质组成实验过程和计算分析应用,滴定实验的原理应用,图象理解判断是解题关键,题目难度较大.1年前查看全部
大家在问
- 1英语翻译按照美国的惯例,每当新当选的总统上任之后,都会选择一只小狗跟他一起入住白宫,因此这只狗也在美国人称为白宫第一狗,
- 2动物的奇特本领发明的新事物
- 3如图为叶片横切面结构图,请据图回答问题,在[]中填序号,在______上填文字:
- 4有人说,有元朝才有如今的内蒙古自治区.你认为对吗?并说明理由.
- 5一道证明题 详细内容在下面,△ABC的边AB=8cm,AC=4cm,∠A的平分线与BC的垂直平分线交宇D点
- 6已知△ABC ∽ △DEF,若△ABC与△DEF的相似比为3:4,则△ABC与△DEF的面积比为( )
- 7将数字1,2,3,4填入标号为1,2,3,4的四个方格里,每格填一个数字,则每个方格的标号与所填的数字均不相同的填法有(
- 8已知函数f(x)=sinxcosx+cos∧2x(x属于r),(1)求函数f(x)的单调区间(2)当x∈l0,2分之πl
- 9将四个数a,b,c,d排成两行、两列,两边各加一条竖直线,记成∣abcd∣,定义
- 10已知二次函数,当X=2时,Y有最大值5,且其图象经过点 (8,-22),求函数关系式
- 11This cellphone is a lemon 为什么是翻译成“这手机真次”呢?有什么意思没?
- 12山地车齿轮转动比和 齿数 有关系,那和齿轮的大小有关系吗?
- 13500公顷等于多少平方千米?3公顷等于多少平方米
- 14下列成语所描述的事件是必然发生的是( )
- 15读了跨越百年的美丽以后,你想对居里夫人说些什么?
