三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体,无色.无臭,在潮湿空气中泄露会产生白雾.红棕色气体等现象,反应
 caitaozeng2022-10-04 11:39:541条回答
caitaozeng2022-10-04 11:39:541条回答A.反应方程式横线处物质为NO,且a=3,b=5,c=2,d=1,e=9
B.反应中被氧化与被还原的原子物质的量之比为2:1
C.若反应中生成0.2molHNO3,则反应共转移0.2mole-
D.反应中NF3是氧化剂,H2O是还原剂

已提交,审核后显示!提交回复
共1条回复
 kenkenk 共回答了21个问题
kenkenk 共回答了21个问题 |采纳率85.7%- 解题思路:由电子、电荷守恒可知反应3NF3+5H2O═2NO+HNO3+9HF中,只有N元素的化合价发生变化,自身发生氧化还原反应,当有3molNF3参加反应,生成2molNO,1molHNO3,反应中氧化剂与还原剂的物质的量之比为2:1,结合方程式以及对应物质的性质解答该题.
A.由电子、电荷守恒可知反应3NF3+5H2O═2NO+HNO3+9HF,横线处物质为NO,且a=3,b=5,c=2,d=1,e=9,故A正确;
B.当有3molNF3参加反应,生成2molNO,1molHNO3,反应中被氧化与被还原的原子的物质的量之比为1:2,故B错误;
C.若反应中生成0.2molHNO3,N元素化合价由+3价升高到+5价,则反应共转移0.4mole-,故C错误;
D.只有N元素的化合价发生变化,NF3是氧化剂,也是还原剂,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应知识,侧重于氧化还原反应反应的概念和计算的考查,题目难度不大,注意反应中元素化合价的变化为解答该类题目的关键. - 1年前
相关推荐
- 选修《物质结构》三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用
选修《物质结构》
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF 3 是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F 2 和过量NH 3 反应得到.
(1)写出制备 NF 3 的化学反应方程式:______.
(2)NF 3 的沸点比NH 3 的沸点(-33℃)低得多的主要原因是______.
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为______.
(4)理论上HF、NaAlO 2 和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H 2 O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为______其中心离子是______,配位数为______.
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol -1 ),回答下面各题:
①在周期表中,最可能处于同一族的是______和______.元素代号 I 1 I 2 I 3 I 4 Q 2080 4000 6100 9400 R 500 4600 6900 9500 S 740 1500 7700 10500 T 580 1800 2700 11600 U 420 3100 4400 5900
②T元素最可能是______区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为______,其中心原子的杂化方式为______. xk-cocoa1年前1
xk-cocoa1年前1 -
 纯nn1号 共回答了22个问题
纯nn1号 共回答了22个问题 |采纳率90.9%(1)根据反应物和生成物以及质量守恒定律可知反应还应有NH 4 F生成,故答案为:4NH 3 +3F 2 =NF 3 +3NH 4 F;
(2)NH 3 存在氢键,而NF 3 只存在分子间作用力,两种作用力前者较强,物质的沸点较高,故答案为:NH 3 能形成氢键,NF 3 只有范德华力;
(3)与铜在同一周期,且未成对价电子数最多,可推知外层价电子排布为3d 5 4s 1 ,应为Cr,原子序数为24,根据能量最低原理、构造原理、洪特规则可写出电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 ,故答案为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 (或[Ar]3d 5 4s 1 );
(4)有题意可知该反应的化学方程式应为:6HF+NaAl0 2 +2NaCl═2HCl+2H 2 O+Na 3 AlF 6 ,该微溶物为:Na 3 AlF 6 ,中心离子为Al,配位数为6,故答案为:Na 3 AlF 6 ;Al;6;
(5)①根据电离能的跳跃确定最外层有几个电子,表中R和U的第一电离能较小,但跳跃至第二电离能时突然变大,说明失去一个电子后变为稳定结构,最外层有一个电子,故R和U处于同族,故答案为:R;U;
②由T元素电离能的变化可知T最外层有三个电子,位于周期表中第ⅢA族,在P区,若T为第二周期元素,应为B元素,E是第三周期元素中原子半径最小的元素,应为Cl元素,二者形成的化合物为BCl 3 ,根据价层电子对模型可知应为平面正三角形结构,中心原子的杂化方式为 sp 2 杂化,故答案为:P;平面正三角形;sp 2 .1年前查看全部
- 三氟化氮(NF 3 )是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF 3 +5H 2 O=2NO
三氟化氮(NF 3 )是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF 3 +5H 2 O=2NO+HNO 3 +9HF,下列有关该反应的说法正确的是
A.NF 3 是氧化剂,H 2 O是还原剂 B.HF是还原产物 C.还原剂和氧化剂的物质的量之比是2:1 D.NF 3 在潮湿的空气中泄漏会产生红棕色气体  fjy1101年前1
fjy1101年前1 -
 ltygo 共回答了23个问题
ltygo 共回答了23个问题 |采纳率91.3%D
1年前查看全部
- (2010•安徽)科学家发现,在液晶电视等制造过程中使的三氟化氮(NF3)的温室效应是二氧化碳的1.7万倍.NF3中氟元
(2010•安徽)科学家发现,在液晶电视等制造过程中使的三氟化氮(NF3)的温室效应是二氧化碳的1.7万倍.NF3中氟元素为-1价,则氮元素的化合价是( )
A. -3
B. 0
C. +1
D. +3 春天的韭菜1年前21
春天的韭菜1年前21 -
 lolitajessica 共回答了18个问题
lolitajessica 共回答了18个问题 |采纳率100%解题思路:根据在化合物中正负化合价代数和为零计算指定元素化合价进行分析解答本题.根据在化合物中正负化合价代数和为零,可知:NF3中氟元素为-1价,则氮元素的化合价为:x+(-1)×3=0,
则x=+3,故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.下列有关说法正确的是( )
A. 反应中NF3是氧化剂,H2O是还原剂
B. 反应中被氧化与被还原的原子的物质的量之比为2:1
C. 若反应中生成0.2mol HNO3,则反应共转移0.2mol e-
D. NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 春发11年前1
春发11年前1 -
 无挂碍乎无有恐怖 共回答了17个问题
无挂碍乎无有恐怖 共回答了17个问题 |采纳率100%解题思路:反应3NF3+5H2O═2NO+HNO3+9HF中,只有N元素的化合价发生变化,自身发生氧化还原反应,当有3molNF3参加反应,生成2molNO,1molHNO3,反应中氧化剂与还原剂的物质的量之比为2:1,结合方程式以及对应物质的性质解答该题.A.只有N元素的化合价发生变化,自身发生氧化还原反应,故A错误;
B.当有3molNF3参加反应,生成2molNO,1molHNO3,反应中被氧化与被还原的原子的物质的量之比为1:2,故B错误;
C.若反应中生成0.2molHNO3,N元素化合价由+3价升高到+5价,则反应共转移0.4mole-,故C错误;
D.反应中生成NO,与氧气反应生成红棕色的NO2,同时生成硝酸,易与空气中的水蒸气结合形成白雾,故D正确.
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应知识,侧重于氧化还原反应反应的概念和计算的考查,题目难度不大,注意反应中元素化合价的变化,为解答该类题目的关键.1年前查看全部
- 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关说法正确的是( )
A.反应中NF3是氧化剂,H2O是还原剂
B.NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象
C.若反应中生成0.2molHNO3,则反应共转移0.2mole-
D.反应中被氧化与被还原的原子物质的量之比为2:1 tjly20051年前1
tjly20051年前1 -
 叶长香花 共回答了17个问题
叶长香花 共回答了17个问题 |采纳率82.4%解题思路:反应3NF3+5H2O═2NO+HNO3+9HF中,只有N元素的化合价发生变化,自身发生氧化还原反应,当有3molNF3参加反应,生成2molNO,1molHNO3,反应中氧化剂与还原剂的物质的量之比为2:1,结合方程式以及对应物质的性质解答该题.A.只有N元素的化合价发生变化,自身发生氧化还原反应,故A错误;
B.反应中生成NO,与氧气反应生成红棕色的NO2,同时生成硝酸,易与空气中的水蒸气结合形成白雾,故B正确;
C.若反应中生成0.2molHNO3,N元素化合价由+3价升高到+5价,则反应共转移0.4mole-,故C错误;
D.当有3molNF3参加反应,生成2molNO,1molHNO3,反应中被氧化与被还原的原子的物质的量之比为1:2,故D错误.
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应知识,侧重于氧化还原反应反应的概念和计算的考查,题目难度不大,注意反应中元素化合价的变化,为解答该类题目的关键.1年前查看全部
- (10分)三氟化氮(NF 3 )是一种新型电子材料,它在潮湿的空气中与水蒸汽能发生氧化还原反应,其反应产物有:HF、NO
(10分)三氟化氮(NF 3 )是一种新型电子材料,它在潮湿的空气中与水蒸汽能发生氧化还原反应,其反应产物有:HF、NO、HNO 3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)写出该反应的化学方程式 。
若反应中生成0.2 mol HNO 3 ,转移的电子数目为 个。
(3)NF 3 是一种无色、无臭的气体,但一旦NF 3 在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
(4)一旦NF 3 泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO 2 、NaF 、H 2 O外,还肯定有 (填化学式)。 隆_ss1年前1
隆_ss1年前1 -
 荣为 共回答了17个问题
荣为 共回答了17个问题 |采纳率88.2%(11分, 方程式3分,其余每空2分)
(1)1:2
(2)3NF 3 + 5H 2 O==="2NO+" HNO 3 +9HF 0.4N A 或是2.408×10 23
(3)产生红棕色气体、产生刺激性气味气体、产生白雾
(4)NaNO 3
略1年前查看全部
- 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.下列有关说法正确的是( )
A. 反应中NF3是氧化剂,H2O是还原剂
B. 反应中被氧化与被还原的原子的物质的量之比为2:1
C. 若反应中生成0.2mol HNO3,则反应共转移0.2mol e-
D. NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 ykdyjkhhcghgc1年前1
ykdyjkhhcghgc1年前1 -
 ljj247763949 共回答了14个问题
ljj247763949 共回答了14个问题 |采纳率92.9%解题思路:反应3NF3+5H2O═2NO+HNO3+9HF中,只有N元素的化合价发生变化,自身发生氧化还原反应,当有3molNF3参加反应,生成2molNO,1molHNO3,反应中氧化剂与还原剂的物质的量之比为2:1,结合方程式以及对应物质的性质解答该题.A.只有N元素的化合价发生变化,自身发生氧化还原反应,故A错误;
B.当有3molNF3参加反应,生成2molNO,1molHNO3,反应中被氧化与被还原的原子的物质的量之比为1:2,故B错误;
C.若反应中生成0.2molHNO3,N元素化合价由+3价升高到+5价,则反应共转移0.4mole-,故C错误;
D.反应中生成NO,与氧气反应生成红棕色的NO2,同时生成硝酸,易与空气中的水蒸气结合形成白雾,故D正确.
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应知识,侧重于氧化还原反应反应的概念和计算的考查,题目难度不大,注意反应中元素化合价的变化,为解答该类题目的关键.1年前查看全部
- (2012•丹东模拟)三氟化氮(NF3)是微电子工业中优良的刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2
(2012•丹东模拟)三氟化氮(NF3)是微电子工业中优良的刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
A.NF3在潮湿的空气中泄漏时容易被发现
B.NF3是氧化剂,H2O是还原剂
C.氧化产物与还原产物的物质的量之比为2:1
D.若转移0.2mol电子时,生成NO气体4.48L 剑风流1年前1
剑风流1年前1 -
 一点感觉 共回答了13个问题
一点感觉 共回答了13个问题 |采纳率84.6%解题思路:3NF3+5H2O=2NO+HNO3+9HF中,N元素的化合价由+3价降低为+2价,N元素的化合价由+3价升高为+5价,以此来解答.A.NF3在潮湿的空气中泄漏时,发生3NF3+5H2O=2NO+HNO3+9HF,出现白雾,则容易被发现,故A正确;
B.只有N元素的化合价变化,则NF3是氧化剂和还原剂,故B错误;
C.HNO3为氧化产物,NO为还原产物,氧化产物与还原产物的物质的量之比为1:2,故C错误;
D.由反应可知,转移2mol电子生成2molNO,则若转移0.2mol电子时,生成NO为0.2mol,但温度、压强未知,不能计算体积,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念的考查,选项D为解答的易错点,题目难度不大.1年前查看全部
- (2分)(2012•红河州)在液晶电视制造过程中常使用三氟化氮(NF 3 ),三氟化氮中氮元素的化合价为﹣1价,则氮元素
(2分)(2012•红河州)在液晶电视制造过程中常使用三氟化氮(NF 3 ),三氟化氮中氮元素的化合价为﹣1价,则氮元素的化合价是( )
A.-3 B.0 C.+1 D.+3  peter10021年前1
peter10021年前1 -
 红羽 共回答了14个问题
红羽 共回答了14个问题 |采纳率85.7%D
根据在化合物中正负化合价代数和为零,氟元素显﹣1价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(﹣1)×3=0,则x=+3。1年前查看全部
- (2013•宜春一模)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:
(2013•宜春一模)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和 HNO3.则下列说法错误的是( )
A.反应过程中,被氧化与被还原的元素的物质的量之比为1:2
B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染
D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023 anyoum1年前1
anyoum1年前1 -
 俾斯麦的梦 共回答了14个问题
俾斯麦的梦 共回答了14个问题 |采纳率78.6%解题思路:由信息可知,发生NF3+H2O→HF+NO+HNO3,N元素的化合价由+3价降低为+2价,N元素的化合价由+3价升高为+5价,以此来解答.由信息可知,发生3NF3+5H2O═9HF+2NO+HNO3,
A.N元素的化合价升高被氧化,降低被还原,反应过程中,被氧化与被还原的元素的物质的量之比为1:2,故A正确;
B.NF3是一种无色、无臭的气体,但NF3在空气中泄漏时生成NO和硝酸,回观察到白雾和NO被氧化后生成红棕色气体,则易被察觉,故B错误;
C.一旦NF3泄漏,生成物均可与碱反应,则可以用NaOH溶液喷淋的方法减少污染,故C正确;
D.若反应中生成1.0mol NO,转移电子为1mol×(3-2)=1mol,转移的电子数目为6.02×1023,故D正确;
故选B.点评:
本题考点: 氧化还原反应;氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及转移电子数目的考查,注意与环境保护的联系及物质的性质,题目难度不大.1年前查看全部
- 1.三氟化氮(NF3)可与空气中的水蒸气反应生成HF、NO、HNO3,请写出该反应的化学方程式(最好能大致讲一下过程)
1.三氟化氮(NF3)可与空气中的水蒸气反应生成HF、NO、HNO3,请写出该反应的化学方程式(最好能大致讲一下过程)
2.氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3- + 4H+ + 3e- = NO↑+ 2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生.请写出并配平该氧化还原反应的方程式 jie71631年前1
jie71631年前1 -
 marcomm 共回答了28个问题
marcomm 共回答了28个问题 |采纳率82.1%3NF3+5H2O=9HF+2NO↑+HNO3
用化合价升降相等来配
方程式中只有N元素的化合价在变
NF3到HNO3一个氮原子升2价 NF3到NO降一价
3Cu2O+14HNO3=7H2O+2NO↑+6Cu(NO3)21年前查看全部
- 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为______.
(2)写出该反应的化学方程式______.
(3)NF3是一种无色.无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是______.
(4)一旦NF3泄漏,可以用______溶液喷淋的方法减少污染. 最初梦想1年前1
最初梦想1年前1 -
 喜欢是爱吗 共回答了16个问题
喜欢是爱吗 共回答了16个问题 |采纳率93.8%解题思路:由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,反应中只有N元素的化合价发生变化,则氧化剂和还原剂都是NF3,NO易与空气中氧气反应生成红棕色的NO2气体,反应物可用碱液吸收.(1)NF3→NO,化合价降低1价,被还原,NF3→HNO3,化合价升高2价,被氧化,氧化还原反应中氧化剂和还原剂得失电子数目相等,则被氧化与被还原的元素的物质的量之比为1:2,故答案为:1:2;
(2)由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,
故答案为:3NF3+5H2O=2NO+HNO3+9HF;
(3)NO易与空气中氧气反应生成红棕色的NO2气体,同时生成的HF和HNO3易结合空气中的水蒸气形成酸雾,有刺激性气味,
故答案为:产生红棕色气体,产生刺激性气味气体,产生白雾;
(4)反应有生成的NO2、HNO3、HF都可和碱溶液反应,可用碱溶液吸收,
故答案为:NaOH或KOH.点评:
本题考点: 含氮物质的综合应用;氧化还原反应的计算;氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查含氮化合物的性质以及氧化还原反应,题目难度中等,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.1年前查看全部
- (2009•淮安二模)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广
(2009•淮安二模)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式:______.
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是______.
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为______.
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则其中心离子是______,配位数为______.
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是______和______.元素代号 I1 I2 I3 I4 Q 2080 4000 6100 9400 R 500 4600 6900 9500 S 740 1500 7700 10500 T 580 1800 2700 11600 U 420 3100 4400 5900
②T元素最可能是______区元素.若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为______,其中心原子的杂化方式为______. hwy96131年前1
hwy96131年前1 -
 bhuang 共回答了14个问题
bhuang 共回答了14个问题 |采纳率100%解题思路:(1)根据反应物和生成物以及质量守恒定律可写出反应的化学方程式;
(2)NH3存在氢键,而NF3只存在分子间作用力,二者中NH3沸点较高;
(3)根据与铜在同一周期,且未成对价电子数最多,可推知外层价电子排布为3d54s1,应为Cr;
(4)根据题意可写出反应的化学方程式:6HF+NaAl02+2NaCl═2HCl+2H2O+Na3AlF6,Na3AlF6中心离子为Al,配位数为6;
(5)根据电离能的跳跃确定最外层有几个电子,然后根据得失电子规律,同一主族从上到下电离能依次递减,同一周期从左到右电离能依次递增,以此来确定在周期表中的位置.(1)根据反应物和生成物以及质量守恒定律可知反应还应有NH4F生成,故答案为:4NH3+3F2=NF3+3NH4F;
(2)NH3存在氢键,而NF3只存在分子间作用力,两种作用力前者较强,物质的沸点较高,故答案为:NH3能形成氢键,NF3只有范德华力;
(3)与铜在同一周期,且未成对价电子数最多,可推知外层价电子排布为3d54s1,应为Cr,原子序数为24,根据能量最低原理、构造原理、洪特规则可写出电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1(或[Ar]3d54s1);
(4)有题意可知该反应的化学方程式应为:6HF+NaAl02+2NaCl═2HCl+2H2O+Na3AlF6,该微溶物为:Na3AlF6,中心离子为Al,配位数为6,
故答案为:Al;6;
(5)①根据电离能的跳跃确定最外层有几个电子,表中R和U的第一电离能较小,但跳跃至第二电离能时突然变大,说明失去一个电子后变为稳定结构,最外层有一个电子,故R和U处于同族,故答案为:R;U;
②由T元素电离能的变化可知T最外层有三个电子,位于周期表中第ⅢA族,在P区,若T为第二周期元素,应为B元素,E是第三周期元素中原子半径最小的元素,应为Cl元素,二者形成的化合物为BCl3,根据价层电子对模型可知应为平面正三角形结构,中心原子的杂化方式为 sp2杂化,故答案为:P;平面正三角形;sp2.点评:
本题考点: 含有氢键的物质;原子核外电子排布;配合物的成键情况;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查物质结构与性质知识,涉及到电子排布式的书写、电离能等问题,做题时注意抓住题目提供的信息,以及利用电离能的跳跃值判断最外层电子数等问题;本题难度较大.1年前查看全部
- (2012•红河州)在液晶电视制造过程中常使用三氟化氮(NF3),三氟化氮中氮元素的化合价为-1价,则氮元素的化合价是(
(2012•红河州)在液晶电视制造过程中常使用三氟化氮(NF3),三氟化氮中氮元素的化合价为-1价,则氮元素的化合价是( )
A.-3
B.0
C.+1
D.+3 imsure1年前1
imsure1年前1 -
 泪宜城浪人 共回答了22个问题
泪宜城浪人 共回答了22个问题 |采纳率100%解题思路:根据在化合物中正负化合价代数和为零,结合三氟化氮的化学式进行解答本题.氟元素显-1价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-1)×3=0,则x=+3.
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答.1年前查看全部
- 三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
A. NF3是氧化剂,H2O是还原剂
B. 还原剂与氧化剂的物质的量之比为2:1
C. 若生成0.2 mol HNO3,则转移0.2 mol电子
D. NF3在潮湿的空气中泄漏会产生红棕色气体 曜宇1年前1
曜宇1年前1 -
 狂野天天 共回答了19个问题
狂野天天 共回答了19个问题 |采纳率78.9%解题思路:3NF3+5H2O=2NO+HNO3+9HF反应中,只有N元素的化合价发生变化,NF3既是氧化剂又是还原剂,从化合价的变化的角度分析氧化还原反应.A.只有N元素的化合价发生变化,NF3既是氧化剂又是还原剂,故A错误;
B.NF3生成NO,被还原,NF3生成HNO3,被氧化,还原剂与氧化剂的物质的量之比为1:2,故B错误;
C.生成0.2molHNO3,转移的电子的物质的量为0.2mol×(5-3)=0.4mol,故C错误;
D.生成的NO易与空气中氧气反应生成红棕色气体二氧化氮,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度中等,注意化合价的升降为氧化还原反应的特征,注意从化合价的角度分析.1年前查看全部
- 三氟化氮(NF3)是一种无色无味的气体,它由氨(NH3)和氟(F2)在一定条件下直接反应得到,4NH3+
三氟化氮(NF3)是一种无色无味的气体,它由氨(NH3)和氟(F2)在一定条件下直接反应得到,4NH3+
实验室为了简便制取干燥的氨气,下列方法中适合的是( )
A.加热氯化铵固体,产生的气体用碱石灰干燥
B.在N2和H2混合气中加入铁触媒并加热至500℃
C.在浓氨水中加入NaOH固体并加热,气体用固体NaOH干燥
D.加热NH4HCO3,气体用P2O5干燥
答案是C,D为什么不对啊?
C为什么要加NaOH固体 lpc_1171年前1
lpc_1171年前1 -
 雪绒花1276 共回答了27个问题
雪绒花1276 共回答了27个问题 |采纳率96.3%分解生成的CO2无法除去
并且氨气显碱性,不能用呈酸性的五氧化二磷进行干燥
NH3+H2O≈NH3·H2O≈NH4++OH-
一是NaOH溶于水放热,而NH3受热易挥发;二是NaOH溶于水使溶液中的c(OH-)增大,使上述平衡向左移动,产生氨气.
第二次加是为了干燥1年前查看全部
- 三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF 3 是一种
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF 3 是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F 2 和过量
NH 3 反应得到。
(1)写出制备NF 3 的化学反应方程式:____________________。
(2)NF 3 的沸点比NH 3 的沸点(-33°C)低得多的主要原因是_____________________。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为________________。
(4)理论上HF、NaAlO 2 和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H 2 O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是________,配位数为__________________。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol -1 ),回答下面各题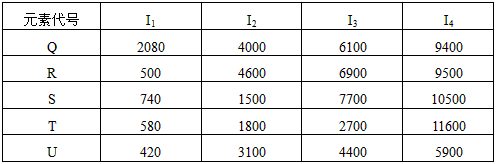
在周期表中,最可能处于同一族的是_______________和______________。
T元素最可能是__________(填“s”、“p”、“d”、“ds”等)区元素,位于_________族。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为____________,其中心原子的杂化方式为____________________。 手冢龙马1年前1
手冢龙马1年前1 -
 wf19790627 共回答了27个问题
wf19790627 共回答了27个问题 |采纳率85.2%(1)4NH 3 +3F 2 =NF 3 +3NH 4 F
(2)NH 3 分子间的形成氢键
(3)[Al]3s 5 4s 1
(4)Al 3+ ;6
(5)R;U;P;ⅢA;平面三角形;SP 21年前查看全部
- 硅烷(SiH4)和三氟化氮(NF3)的反应产物是什么?
 y10g101年前1
y10g101年前1 -
 201-NZ 共回答了16个问题
201-NZ 共回答了16个问题 |采纳率87.5%有水参加反应:
8 NF3 + SiH4 + 11 H2O = 24 HF + 8 NO + H2SiO3
无水参加反应:
8 NF3 + 3 SiH4 = 4 N2 + 3 SiF4 + 12 HF1年前查看全部
- (2013•密云县二模)液晶电视制造过程中会用到三氟化氮(NF3),已知NF3中氮元素为+3价,则氟元素的化合价是(
(2013•密云县二模)液晶电视制造过程中会用到三氟化氮(NF3),已知NF3中氮元素为+3价,则氟元素的化合价是( )
A.-3
B.-1
C.0
D.+1 aestgqergsdfs1年前1
aestgqergsdfs1年前1 -
 张岩松第二 共回答了18个问题
张岩松第二 共回答了18个问题 |采纳率77.8%解题思路:根据在化合物中正负化合价代数和为零,结合三氟化氮(NF3)的化学式进行解答本题.氮元素为+3价,设氟元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+3)+3x=0,则x=-1价.
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- (三选一)【物质结构与性质】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中
(三选一)【物质结构与性质】
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。NF 3 是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F 2 和过量NH 3 反应得到。
(1)写出制备NF 3 的化学反应方程式:__________。
(2)NF 3 的沸点比NH 3 的沸点(-33℃)低得多的主要原因是_______________
(3)与铜属于同一周期的过渡元素,且各电子层均无未成对电子,该元素的基态原子核外电子排布式为____________;若该元素的硫化物具有如图甲所示的晶胞结构,则该晶胞中S 2- 的配位数为__________。若该金属单质的晶体在不同温度下有两种不同的堆积方式,其晶胞结构分别如图乙所示,则两晶胞中实际含有的原子个数之比为____________。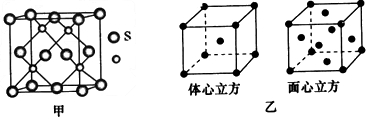
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题 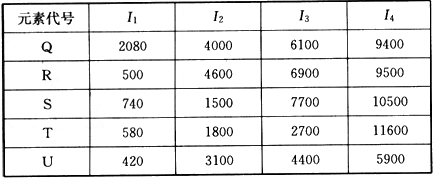
①在周期表中,最可能处于同一族的是______和_______。
②T元素最可能是_____区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为_______,其中心原子的杂化方式为______。 平时候13车1年前1
平时候13车1年前1 -
 hszgjp 共回答了24个问题
hszgjp 共回答了24个问题 |采纳率95.8%(1)4NH 3 +3F 2 =NF 3 +3NH 4 F
(2)NH 3 分子间能形成氢键,NF 3 分子间只有范德华力
(3)1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 {或[Ar]3d 10 4s 2 );4;1:2
(4)①R;U;②p;平面正三角形;sp 2 杂化1年前查看全部
- 三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下 反应:NF3+H
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:NF3+H2O→NO+HNO3+HF.下列有关该反应的说法正确的是( )
A.NF3是氧化剂,H2O是还原剂
B.NF3是极性分子,在干燥空气中泄漏会看到红棕色气体
C.若生成1mol HNO3,转移2NA个电子
D.每消耗0.02mol氧化剂,可收集到2.24L气体 xsuicaidongw1年前1
xsuicaidongw1年前1 -
 hwjddt 共回答了18个问题
hwjddt 共回答了18个问题 |采纳率94.4%解题思路:NF3+H2O→NO+HNO3+HF中,N元素的化合价由+3价降低为+2价,由+3价升高为+5价,以此来解答.A.在反应NF3+H2O→NO+HNO3+HF中,只有N元素的化合价变化,NF3既是氧化剂又是还原剂,H2O既不是氧化剂也不是还原剂,故A错误;
B.NF3在干燥空气中不反应,无明显现象,B故B错误;
C.若生成1mol HNO3,转移电子为1mol×(5-3)=2mol电子,即转移2NA个电子,故C正确;
D.2.24 L气体未注明条件,不一定为标准状况,不能计算,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从元素化合价角度分析,侧重氧化还原反应基本概念及转移电子数的考查,题目难度不大.1年前查看全部
- 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体,无色.无臭,在潮湿空气中泄露会产生白雾.红棕色气体等现象,反应
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体,无色.无臭,在潮湿空气中泄露会产生白雾.红棕色气体等现象,反应方程式为:aNF3+bH2O=c+dHNO3+eHF.下列说法正确的是( )
A. 反应方程式横线处物质为NO,且a=3,b=5,c=2,d=1,e=9
B. 反应中被氧化与被还原的原子物质的量之比为2:1
C. 若反应中生成0.2molHNO3,则反应共转移0.2mole-
D. 反应中NF3是氧化剂,H2O是还原剂 黑豆果冻1年前1
黑豆果冻1年前1 -
 沙漠中的竹林 共回答了16个问题
沙漠中的竹林 共回答了16个问题 |采纳率81.3%解题思路:由电子、电荷守恒可知反应3NF3+5H2O═2NO+HNO3+9HF中,只有N元素的化合价发生变化,自身发生氧化还原反应,当有3molNF3参加反应,生成2molNO,1molHNO3,反应中氧化剂与还原剂的物质的量之比为2:1,结合方程式以及对应物质的性质解答该题.A.由电子、电荷守恒可知反应3NF3+5H2O═2NO+HNO3+9HF,横线处物质为NO,且a=3,b=5,c=2,d=1,e=9,故A正确;
B.当有3molNF3参加反应,生成2molNO,1molHNO3,反应中被氧化与被还原的原子的物质的量之比为1:2,故B错误;
C.若反应中生成0.2molHNO3,N元素化合价由+3价升高到+5价,则反应共转移0.4mole-,故C错误;
D.只有N元素的化合价发生变化,NF3是氧化剂,也是还原剂,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应知识,侧重于氧化还原反应反应的概念和计算的考查,题目难度不大,注意反应中元素化合价的变化为解答该类题目的关键.1年前查看全部
- 三氟化氮,五氟化磷,氟化钠,氟化钾,四氟化硅在无水氟化氢中的反应和电离方程式
 neolab1年前1
neolab1年前1 -
 zzin28 共回答了19个问题
zzin28 共回答了19个问题 |采纳率94.7%NF3 + HF = X
PF5 + HF = H[PF6]
NaF + HF = NaHF2
KF + HF = KHF2
SiF4 + 2HF = H2[SiF6]
H[PF6] + HF = H2F(+) + [PF6](-)
H2[SiF6] + 2HF = 2H2F(+) + [SiF6](2-)
MHF2 = M(+) + HF2(-) M = Na,K1年前查看全部
- (2010•安徽)科学家发现,在液晶电视等制造过程中使的三氟化氮(NF3)的温室效应是二氧化碳的1.7万倍.NF3中氟元
(2010•安徽)科学家发现,在液晶电视等制造过程中使的三氟化氮(NF3)的温室效应是二氧化碳的1.7万倍.NF3中氟元素为-1价,则氮元素的化合价是( )
A. -3
B. 0
C. +1
D. +3 城市中的油菜花1年前1
城市中的油菜花1年前1 -
 kfella 共回答了21个问题
kfella 共回答了21个问题 |采纳率90.5%解题思路:根据在化合物中正负化合价代数和为零计算指定元素化合价进行分析解答本题.根据在化合物中正负化合价代数和为零,可知:NF3中氟元素为-1价,则氮元素的化合价为:x+(-1)×3=0,
则x=+3,故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 三氟化氮(NF3)是共价化合物还是离子化合物?
三氟化氮(NF3)是共价化合物还是离子化合物?
如果是共价化合物,怎么百度里又有说NF3的N是+3价的? 狄荻1年前3
狄荻1年前3 -
 CatKing_GEN 共回答了17个问题
CatKing_GEN 共回答了17个问题 |采纳率88.2%共价化合物.
共价化合物中也有电子的偏离,所以也有化合价.
比如水是共价化合物,但是水中的氢是+1价,氧是-2价.1年前查看全部
- (10分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF
(10分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF 3 可在铜的催化作用下由F 2 和过量NH 3 反应得到。
(1)氟元素基态原子的价电子排布图为 ;NF 3 中心原子轨道的杂化类型为 。
(2)写出制备NF 3 的化学方程式: 。
(3)理论上HF、NaAlO 2 和NaCl按6 : 1 : 2的物质的量之比恰好反应生成HCl、H 2 O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。该化合物焰色反应火焰呈现___________色。很多金属盐都可以发生焰色反应,其原因是________________________________________________________。 doyouwants1年前0
doyouwants1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 用杂化轨道理论说明三氟化硼是平面三角形,而三氟化氮却是三角锥形?
 jszxbgs1年前1
jszxbgs1年前1 -
 苹果太郎 共回答了19个问题
苹果太郎 共回答了19个问题 |采纳率100%B的最外层一共有三个电子,所以BF3中,B采取sp2杂化,三个轨道都参与成键,所以为了使排斥力最小,成平面三角形,而N原子最外层有五个电子,所以NF3中,N原子采取不等性的sp3杂化,所形成的四个杂化轨道参与F成键,而剩余的一...1年前查看全部
- 三氟化氮的偶极矩远小于氨气的偶极矩,但前者的电负性差远大于后者,如何解释这一矛盾现象?
 Aibirun1年前1
Aibirun1年前1 -
 丫丫5201314 共回答了17个问题
丫丫5201314 共回答了17个问题 |采纳率94.1%F的电负性大,在NF3中,F-N偶极矩与N-孤对电子偶极矩方向不一致,总得效果使分子的偶极矩较小;而NH3中,N-H偶极矩与N-孤对电子偶极矩方向一致,总的效果使分子偶极矩增大.所以NF3的偶极矩远小于NH3的偶极矩1年前查看全部
- 三氟化氮的电子式怎么写
 就象雨水1年前1
就象雨水1年前1 -
 烂漫的天使 共回答了18个问题
烂漫的天使 共回答了18个问题 |采纳率94.4%是这样这样子的:
F
.*
. .
.N *F
.*
F
就是N的五个电子拿出两个自己组队,其他分三下结合!ok?还有F的其他电子自己写上.1年前查看全部
- (2014•宿迁模拟)三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2
(2014•宿迁模拟)三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体 hme2gxd61年前1
hme2gxd61年前1 -
 lililiyong 共回答了24个问题
lililiyong 共回答了24个问题 |采纳率91.7%解题思路:3NF3+5H2O=2NO+HNO3+9HF反应中,只有N元素的化合价发生变化,NF3既是氧化剂又是还原剂,从化合价的变化的角度分析氧化还原反应.A.只有N元素的化合价发生变化,NF3既是氧化剂又是还原剂,故A错误;
B.NF3生成NO,被还原,NF3生成HNO3,被氧化,还原剂与氧化剂的物质的量之比为1:2,故B错误;
C.生成0.2molHNO3,转移的电子的物质的量为0.2mol×(5-3)=0.4mol,故C错误;
D.生成的NO易与空气中氧气反应生成红棕色气体二氧化氮,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度中等,注意化合价的升降为氧化还原反应的特征,注意从化合价的角度分析.1年前查看全部
- 化学大侠看过来.三氟化氮(NF3)是一种无色无味的气体,它可由氨和氟在一定条件下直接反应得到:4NH3+3F2=NF3+
化学大侠看过来.
三氟化氮(NF3)是一种无色无味的气体,它可由氨和氟在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关叙述正确的是
A.氧化产物和还原产物的物质的量的比为1:3
B.NF3的还原性比NH3强
C.反映中氧化剂与还原剂的物质的量之比为3:4
D.NF3分子空间构型为三角锥
D为什么对? jiaozizxs1年前5
jiaozizxs1年前5 -
 pandaguigui 共回答了18个问题
pandaguigui 共回答了18个问题 |采纳率88.9%4NH3+3F2=NF3+3NH4F
这个反应中,N有两种用途
NH3+3F2=NF3+3HF
3HF+3NH3=3NH4F
由以上两个方程式叠加而成
所以实际上作还原记的NH3只是1/4,所以氧化剂和还原剂物质的量之比为3:1
所以C错
NF3的分子构型可以类比NH3,得到是三角锥形,D对1年前查看全部
- 三氟化氮和铜离子为什么不能构成络合物
 xunxunwu1年前2
xunxunwu1年前2 -
 假面千金 共回答了17个问题
假面千金 共回答了17个问题 |采纳率64.7%NF3中N的电负性比F差很多,导致N原子上电子云密度很低,带正电荷,难以再把孤对电子提供给Cu2+,和NH3有所区别.1年前查看全部
- 氨气和氟气反应制取三氟化氮中,氨气发生还原反应吗
 967781年前2
967781年前2 -
 凡间女孩 共回答了20个问题
凡间女孩 共回答了20个问题 |采纳率95%虽然不了解NF3这个物质 但是F一定没有正价 这就能推出来NF3中的N是正价 而原来的NH3中N是-3价 所以反应过程中 化合价升高 被氧化 发生氧化反应1年前查看全部
- (2013•马鞍山三模)三氟化氮(NF3)在微电子工业中有重要用途,它在潮湿的空气中与水蒸气反应的产物有:HF、NO和H
(2013•马鞍山三模)三氟化氮(NF3)在微电子工业中有重要用途,它在潮湿的空气中与水蒸气反应的产物有:HF、NO和HNO3.则下列说法正确的是( )
A.NF3分子中含有非极性共价键
B.NF3在空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染
D.反应过程中,被氧化与被还原的元素的物质的量之比为2:1 hashiru198cc071年前1
hashiru198cc071年前1 -
 vmm7ht7 共回答了17个问题
vmm7ht7 共回答了17个问题 |采纳率94.1%解题思路:A、NF3分子中只含有极性共价键N-F;
B、NF3在空气中泄漏生成NO,NO与空气反应生成红棕色气体;
C、若NF3泄漏,与水反应产物均与碱反应;
D、NF3与H2O的反应的方程式为3NF3+5H2O(g)=9HF+2NO+HNO3该反应中氧化剂、还原剂都是NF3,氧化产物是NO,结合元素化合价的变化与得失电子的关系解答.A、NF3分子中只含有N-F,N-F属于极性共价键,故A错误;
B、NF3在空气中泄漏生成NO,NO与空气反应生成红棕色气体,易被察觉,故B错误;
C、若NF3泄漏,与水反应产物均与碱反应,可用石灰水溶液喷淋的方法减少污染,故C正确;
D、在潮湿空气中反应,发生3NF3+5H2O(g)=9HF+2NO+HNO3,反应中氧化剂、还原剂都是NF3,氧化剂与还原剂的物质的量之比为2:1,被氧化与被还原的元素的物质的量之比为1:2,故D错误;
故选C.点评:
本题考点: 不同晶体的结构微粒及微粒间作用力的区别;氧化还原反应;氯、溴、碘及其化合物的综合应用.
考点点评: 本题综合考查氧化还原反应知识,侧重于氧化剂、氧化剂的判断、电子转移的数目的计算等问题,题目难度中等,注意从化合价变化的角度分析氧化还原反应.1年前查看全部
- 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3.
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3.(A)若反应中转移的电子数目为6.02X10^23,生成22.4L NO.这句话哪里错了?
 小林45801年前1
小林45801年前1 -
 wangzhenhua521 共回答了24个问题
wangzhenhua521 共回答了24个问题 |采纳率91.7%22.4L/mol这个数据一般只适用于标准状况下的气体,该题未指明条件,那就是通常状况,在通常状况下22.4L/mol这个数据是不能用的.1年前查看全部
- (2011•武汉模拟)三氟化氮(NF3)是一种无色、无味、不可燃但能助燃的气体.尽管与二氧化碳相比,它在大气中的含量微不
(2011•武汉模拟)三氟化氮(NF3)是一种无色、无味、不可燃但能助燃的气体.尽管与二氧化碳相比,它在大气中的含量微不足道,但它能产生很强的温室效应.已知NF3中氟为-1价,则氮元素的化合价是( )
A.+3
B.+1
C.0
D.-3 stop你1年前1
stop你1年前1 -
 岭南夜猫 共回答了12个问题
岭南夜猫 共回答了12个问题 |采纳率91.7%解题思路:根据在化合物中正负化合价代数和为零,根据三氟化氮的化学式进行解答本题.根据在化合物中正负化合价代数和为零,已知NF3中氟为-1价,设氮元素的化合价是x,可知三氟化氮(NF3)中氮元素的化合价:x+(-1)×3=0,则x=+3.
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.1年前查看全部
大家在问
- 1一辆汽车质量为2000kg的汽车,由静止开始,在公路上行驶了50m,速度增加到36km/h,
- 2下列表示物质结构的化学用语正确的是( ) A.乙炔的结构简式:CHCH B.NaCl的电子式:
- 3高中英语问题fortunehe went to Shenzhen to _____ (找出路)用上带有fortune或者
- 4大车一天900元 限乘40人 小车一天500元 限乘25人 1900人怎样租车省钱?
- 5甲醛与亚硫酸氢钠的反应方程式为HCHO+NaHSO 3 HO-CH 2 -SO 3 Na,反应产物俗称“吊白块”。关于“
- 6如图,已知直线 y= 1 2 x 与双曲线 y= k x (k>0)交于A、B两点,且点A的横坐标为4.
- 7如图,已知点D,B在线段AE上,AD=BE,AC=DF,AC∥DF.△ABC和△DEF全等吗?请说明理由
- 8(2012•思明区质检)如图所示是生活中常用的夹子,当用手张开夹子时,夹子是______杠杆(选填“省力”、“费力”或“
- 9类人猿与现代人的不同
- 10I miss side by side with you till the end 我不懂英语
- 11给市长的一封信 作文
- 12用一台功率为4.9kW,机械效率为80%的水泵抽水,能在10min里把一个距水面20m高的水池装满,这水池的容积是
- 13如图,在三角形ABC中,cd垂直ab于点d,be垂直ac于e,cd与be,相交于h,且ch=ab,则ae=ce-bh.请
- 14圆周率是准确值吗?判断题:圆周率是准确值.
- 15读图回答: (1)甲乙丙三图中,按“上北下南,左西右东”来判别方向的图是______,其理由是______.(2)乙图中
