吸热反应一定贮存能量吗化学反应会自发地向能量降低方向进行,如果吸热反应一定贮存能量,能量增加,那岂不是所有吸热反应都不能
 lvxinxin002022-10-04 11:39:542条回答
lvxinxin002022-10-04 11:39:542条回答化学反应会自发地向能量降低方向进行,如果吸热反应一定贮存能量,能量增加,那岂不是所有吸热反应都不能自发进行了?

已提交,审核后显示!提交回复
共2条回复
 jy_aribian 共回答了14个问题
jy_aribian 共回答了14个问题 |采纳率85.7%- 吸热反应往往都是外界提供能量供他反应.但是化学反应的自发性指的是 能量趋于低,状态趋于散乱.G=H-TS,G0非自发
所以受很多因素的影响 不是说吸热反应就一定不能自发进行 的0.0 还有状态 是一个综合影响的过程 - 1年前
 rtt6yu 共回答了6个问题
rtt6yu 共回答了6个问题 |采纳率- 不,当反应物温度等于或低于外界温度时,反应往往会停止。
楼上的用焓变解释也有道理。 - 1年前
相关推荐
- 下列说法正确的是( ) A.反应热就是反应中放出的热量 B.放热反应的△H>0,吸热反应的△H<0 C.一个化学反应中
下列说法正确的是()
A.反应热就是反应中放出的热量 B.放热反应的△H>0,吸热反应的△H<0 C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,△H为“—” D.一个化学反应中,生成物的总键能大于反应物的总键能时,反应吸热,△H为“+”  高原牦牛1年前1
高原牦牛1年前1 -
 wf666 共回答了15个问题
wf666 共回答了15个问题 |采纳率86.7%C
1年前查看全部
- 下列反应中,属于吸热反应的是( )
下列反应中,属于吸热反应的是( )
A.钠与水的反应
B.氢气在氯气中燃烧
C.氢氧化钠溶液和盐酸溶液反应
D.氢氧化钡晶体和氯化铵晶体反应 san6601年前1
san6601年前1 -
 为你我受冷风吹 共回答了26个问题
为你我受冷风吹 共回答了26个问题 |采纳率92.3%解题思路:解答此类题时,首先根据化学反应类型进行能量吸热或放热的判断,从4个选项中选出符合条件的选项即可,可以逐一排除进行筛选,常见的放热反应有:所有的物质燃烧、所有金属与酸、所有中和反应、绝大多数化合反应、置换反应、少数分解及复分解反应.A、金属钠和水的反应是放热反应,故A错误;
B、物质的燃烧反应属于放热反应,故B错误;
C、中和反应是放热反应,故C错误;
D、Ba(OH)2•8H2O晶体与NH4Cl晶体的反应属于吸热反应,故D正确.
故选D.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题主要考查化学反应的热量变化,应注重归纳中学化学中常见的吸热或放热的反应,对于常见的吸热过程和放热过程不是化学变化.1年前查看全部
- 下列反应是吸热反应的是( )A.铝片与稀盐酸反应B.NH4Cl与Ba(OH)2•8H2O的反应C.灼热的碳在足量O2中
下列反应是吸热反应的是( )
A.铝片与稀盐酸反应
B.NH4Cl与Ba(OH)2•8H2O的反应
C.灼热的碳在足量O2中燃烧
D.酸碱中和反应 你们大笑1年前1
你们大笑1年前1 -
 yuvee 共回答了19个问题
yuvee 共回答了19个问题 |采纳率78.9%解题思路:常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、少数分解、置换以及某些复分解反应(如铵盐和强碱).A.铝片与稀盐酸反应制取H2属于放热反应,故A错误;
B.Ba(OH)2•8H2O与NH4Cl反应属于吸热反应,故B正确;
C.灼热的碳在足量O2中燃烧,燃烧是氧化反应,属于放热反应,故C错误;
D.酸碱中和反应,属于放热反应,故D错误,
故选B.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题考查吸热反应,难度不大.抓住中学化学中常见的吸热或放热的反应是解题的关键.1年前查看全部
- 所有加热反应都属于吸热反应吗` 最好举个例子``
 wanyuchi06241年前2
wanyuchi06241年前2 -
 栀萌 共回答了19个问题
栀萌 共回答了19个问题 |采纳率94.7%不是,如铝与氧化铁的反应条件是高温,但放热1年前查看全部
- 下列反应属于吸热反应的是( )
下列反应属于吸热反应的是( )
A.氯化铵晶体与氢氧化钡晶体充分混合
B.酸碱中和反应
C.锌片放入稀硫酸中
D.生石灰放入水中 傻敏1年前1
傻敏1年前1 -
 yhynsync 共回答了20个问题
yhynsync 共回答了20个问题 |采纳率95%解题思路:根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).A.氯化铵晶体与氢氧化钡晶体反应是吸热反应,故A正确;
B.酸碱中和反应是放热反应,故B错误;
C.活泼金属与酸的反应是放热反应,故C错误;
D.生石灰与水反应是放热反应,故D错误.
故选A.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.1年前查看全部
- 自发进行的反应一定是( )A. 吸热反应B. 放热反应C. 熵增加反应D. 熵增加或者放热反应
 未激活1641年前2
未激活1641年前2 -
 zengsean 共回答了16个问题
zengsean 共回答了16个问题 |采纳率93.8%解题思路:自发进行的反应符合△H-T△S<0,依据判断依据分析选项;反应自发进行需要焓变、熵变、温度共同决定.A、吸热反应△H>0,若△S<0,反应一定是非自发进行的反应,故A不符合;
B、放热反应△H<0,若△S>0,高温可能非自发反应,故B不符合;
C、熵增加反应,放热反应△H<0,若△S>0,高温可能非自发反应,故C不符合;
D、熵增加或者放热反应,△S>0,△H<0,△H-T△S<0,故D符合;
故选:D.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的判断依据,反应焓变、熵变、温度共同决定反应是否自发进行,题目较简单.1年前查看全部
- 吸热反应比放热反应好在哪里?辩论要用,可以从很多角度来,不一定局限于化学方面,经济生活也可以
 jy029174201年前2
jy029174201年前2 -
 爱吃豆腐 共回答了25个问题
爱吃豆腐 共回答了25个问题 |采纳率92%吸热反应容易控制反应速度.1年前查看全部
- 对于CO2(g) + C(s) ≈ 2CO(g)正反应是吸热反应,下列各组条件变化中,两项均能使平衡向右移动的是
对于CO2(g) + C(s) ≈ 2CO(g)正反应是吸热反应,下列各组条件变化中,两项均能使平衡向右移动的是
A.加压、升温
B.加压、降温
C.减压、升温
D.减压、降温 aim44441年前4
aim44441年前4 -
 meigui88888 共回答了21个问题
meigui88888 共回答了21个问题 |采纳率90.5%C
根据方程式,气体体积增大,因此在容积一定的情况下,减压会使平衡右移.1年前查看全部
- 碳与二氧化碳的反应既是吸热反应,又是化合反应
碳与二氧化碳的反应既是吸热反应,又是化合反应
这句话是对的还是错的、为什么 wangyf04111年前5
wangyf04111年前5 -
 pest 共回答了14个问题
pest 共回答了14个问题 |采纳率78.6%是对的
C+CO2==高温===2CO
是吸热反应,又是化合反应1年前查看全部
- 中学化学里唯一一个吸热反应的反应物是什么如题
中学化学里唯一一个吸热反应的反应物是什么如题
记得是反应物混合搅拌后烧杯粘住下面的玻璃板了 wxpht1年前2
wxpht1年前2 -
 sungoodzjh 共回答了14个问题
sungoodzjh 共回答了14个问题 |采纳率92.9%这个实验挺有意思的.搅着搅着就结冰了.反应如下:BaOH)2 + 2NH4Cl = BaCl2 + 2NH3.H2O为并不是中学阶段唯一的吸热反应,像碳酸氢钠、碳酸钙、高锰酸钾的分解反应都是吸热反应.不过这确实是为数不多的在常温下就可以发生的吸热反应.欢迎到化学团队的团队之家作客(进入团队后在成员列表中找到),这里可以相互交流和共享一些资料,多提宝贵意见哦.查看原帖1年前查看全部
- 吸热反应是否包括复分解反应
 tlhl19851年前1
tlhl19851年前1 -
 laiu 共回答了16个问题
laiu 共回答了16个问题 |采纳率87.5%复分解反应吸热放热不一定...不过多数都是放热 但是也有吸热的例如铵盐的反应多数都是吸热 至于为什么呢 就是因为反应物和生成物的总能量不同1年前查看全部
- 在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol~125KJ/mol的热量,但1,3—环己二烯失
在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol~125KJ/mol的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,△H=-23.4kJ/mol,以上事实表明( )
A.1,3—环己二烯加氢是吸热反应
B.1,3—环己二烯比苯稳定
C.苯加氢生成环己烷是吸热反应
D.苯比1,3—环己二烯稳定
由题可知:因为苯的能量比环己二烯能量低,故苯比环己二烯稳定,故C错;环己二烯加氢是放热过程,A错;苯加氢到环己烷由上图可知是放热过程,B错。 fauupl1年前4
fauupl1年前4 -
 qq290382735 共回答了25个问题
qq290382735 共回答了25个问题 |采纳率92%D 这道题我们老师讲过
1,3—环己二烯先失去2个氢原子 吸热 变成一种物质 而这种物质变成苯是放热的 且放热比之前吸收的热量多 所以总体是放热
综上A错 题设的条件 即不论什么烃分子中去掉2个氢原子形成一个双键都是吸热反应 题中迷惑人
B错 D对能量越低越稳定 放热后生成的物质 稳定
C选项中是 环己烷 说明原有的两个双键也打开了 苯变成1,3—环己二烯是吸热 在加氢原子打开双键 是放热反应 放热和吸热的量未知 所以不能确定 到底是吸热还是放热1年前查看全部
- CaCO3 + 2HCl == CaCl2 + H2O + CO2↑吸热反应还是放热反应?为什么?
 kangchuang1年前2
kangchuang1年前2 -
 gmgh294548 共回答了19个问题
gmgh294548 共回答了19个问题 |采纳率84.2%反应物的总能量>生成物的总能量 化学反应放出热量
反应物的总能量1年前查看全部
- NaSO4+4H2=(可逆)=Na2S+4H2O为吸热反应,若降低温度,混合气体的平均相对分子质量将?
 我愿意陪你吃榴莲1年前2
我愿意陪你吃榴莲1年前2 -
 shendm85 共回答了21个问题
shendm85 共回答了21个问题 |采纳率85.7%降低温度,平衡向逆向移动,根据公式:M=m/n,逆向移动过程中,气体质量m减小,而气体物质的量保持不变,故M将变小.1年前查看全部
- 一个很普通最基础的化学方程式.例如铁和盐酸反应.如何知道是不是放热还是吸热反应
 乐水的1年前7
乐水的1年前7 -
 地虎 共回答了18个问题
地虎 共回答了18个问题 |采纳率100%①活泼金属置换水或酸中氢的反应②酸碱中和反应.
③含碳燃料燃烧的反应,
④易爆物质的爆炸反应.
⑤多数的化合反应,
吸热反应:
②多数的分解反应,
③一些物质的溶解,如硝酸铵溶解等.1年前查看全部
- 氢氧化亚铁与水和氧气反应是吸热反应还是放热
 许嵩1年前1
许嵩1年前1 -
 蓉儿54 共回答了20个问题
蓉儿54 共回答了20个问题 |采纳率95%这个问题回答很简单——放热!
如果要解释有点麻烦——需要从Fe(OH)2、H2O、O2、Fe(IH)3的生成热去计算.1年前查看全部
- 过氧化氢和二氧化碳反应生成氧气是放热反应还是吸热反应啊?
 玲兴1年前4
玲兴1年前4 -
 行云_如水 共回答了19个问题
行云_如水 共回答了19个问题 |采纳率94.7%过氧化氢,是一种氧化物,在医院有.不过反应生成氢气,与二氧化碳无关.仅仅是自身被,催化而已.催化剂作用下,有氧生成1年前查看全部
- 如何判断反应是否为吸热反应还是放热反应?
如何判断反应是否为吸热反应还是放热反应?
如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出热量,这是放热反应.
如果反应物所具有的总能量小于生成物所具有的总能量,反映物就需要吸收热量才能转化为生成物,这是吸热反应.
但是如何才能判断出 反应物的总能量大于或小于生成物的总能量呢?请举例 cdzcs1年前1
cdzcs1年前1 -
 6d453cb41e0921a7 共回答了14个问题
6d453cb41e0921a7 共回答了14个问题 |采纳率92.9%查表
每个物质都有它的融化热、汽化热与比热容
①从绝对零度开始,到它的现在温度所吸收的热量就是固体的内能
②从绝对零度开始,到它的熔点所吸收的热量+熔化热+上升到现在温度所需要的热量=液体的内能
③从绝对零度开始,到它的熔点所吸收的热量+熔化热+从熔点到沸点需要的热量+汽化热+上升到现在温度所需要的热量=气体的内能
用前后内能比较久可以知道是吸热还是放热了1年前查看全部
- 水结冰是吸热反应还是放热反应
 jr3691年前3
jr3691年前3 -
 zeruelni 共回答了13个问题
zeruelni 共回答了13个问题 |采纳率84.6%凝固,放热反应.1年前查看全部
- 高一化学反应中的热量的表达符号吸热反应和放热反应的符号,再举一些例子说明哪些是放热反应哪些是吸热反应 还有化学反应速率与
高一化学反应中的热量的表达符号
吸热反应和放热反应的符号,再举一些例子说明哪些是放热反应哪些是吸热反应 还有化学反应速率与反应限度的一些重要概念 Relationship1年前4
Relationship1年前4 -
 AJTDMW06 共回答了17个问题
AJTDMW06 共回答了17个问题 |采纳率82.4%Q可以表示放出的热量
△H放热时是吸热反应
如: C(固)+H2O(气)=CO(气)+H2(气)-131.3kJ
当吸热 v逆 正向 v正.< v逆 逆向
浓度: 其他条件不变, 增大反应物浓度或减小生成物浓度, 正向移动 反之
压强: 其他条件不变,对于反应前后气体,总体积发生变化的反应,增大压强,平衡向气体体积缩小的方向移动, 反之…
温度: 其他条件不变,温度升高,平衡向吸热方向移动 反之…
催化剂: 缩短到达平衡的时间,但平衡的移动无影响
勒沙特列原理:如果改变影响化学平衡的一个条件,平衡将向着减弱这种改变的方向发生移动
化学反应限度:
1、概念:化学反应限度就是研究可逆反应所能达到的最大程度.
2、可逆反应:在同一反应条件下,既能向正反应方向进行,又能向逆反应方向进行的化学反应.
3、说明:
(1)绝大多数反应都有一定的可逆性.一个反应是可逆反应的必需条件:在同一反应条件下进行.
(2)可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物与生成物的浓度不再发生变化,反应达到化学平衡状态.
(3)化学平衡时一种动态平衡.在化学平衡状态下化学反应仍进行,但是反应混合物的组成保持一致,当反应条件改变时,原化学平衡状态被破坏,一段时间后会达到新的平衡.1年前查看全部
- 吸热反应需要加热才能进行?放热反应在常温下就能进行?
 whisper771年前1
whisper771年前1 -
 ii的快乐 共回答了16个问题
ii的快乐 共回答了16个问题 |采纳率56.3%不是,溶于水吸热就不要条件,放热反应也要条件,如C的燃烧就要加热,这是一个整体过程1年前查看全部
- CaCO3在常温下不分解,是因为其分解反应为吸热反应;在高温(T>1114K)下分解,是因为此时分解放热.
 redgirl_281年前2
redgirl_281年前2 -
 冰吻王子 共回答了22个问题
冰吻王子 共回答了22个问题 |采纳率86.4%高温(T>1114K)下分解,仍是吸热反应.
高温提供了热量,大于其反应时放出的热量,总体还是吸热的反应.
化学反应中反应物断键是吸热的,成键是放热的.
CaCO3在任何温度下,断键是吸热的热量总大于成键是放出的热量.1年前查看全部
- 盐类水解为什么是吸热反应呀?
 butonespring1年前1
butonespring1年前1 -
 w54dj 共回答了21个问题
w54dj 共回答了21个问题 |采纳率90.5%这主要是看能量的变化,水解后能量变小放热,变大则是吸热.1年前查看全部
- 这个图该怎么看,比如是否是吸热反应方向,x,y分别表示什么
 woshilanyingren11年前1
woshilanyingren11年前1 -
 一处闲愁 共回答了18个问题
一处闲愁 共回答了18个问题 |采纳率94.4%x是断键吸收的能量,y是成键放出的能量,从图中看x小于y,所以放热反应1年前查看全部
- 请问谁知道初中所有的化学方程式吸热反应优先
 龙虾屁特1年前1
龙虾屁特1年前1 -
 机器猫1021 共回答了15个问题
机器猫1021 共回答了15个问题 |采纳率93.3%初中化学方程式汇总
一、 氧气的性质:
(1)单质与氧气的反应:(化合反应)
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
(3)氧气的来源:
13.玻义耳研究空气的成分实验 2HgO 加热 Hg+ O2 ↑
14.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)
15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)
二、自然界中的水:
16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑
17.生石灰溶于水:CaO + H2O == Ca(OH)2
18.二氧化碳可溶于水: H2O + CO2==H2CO3
三、质量守恒定律:
19.镁在空气中燃烧:2Mg + O2 点燃 2MgO
20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO
四、碳和碳的氧化物:
(1)碳的化学性质
23. 碳在氧气中充分燃烧:C + O2 点燃 CO2
24.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
26.煤炉的底层:C + O2 点燃 CO2
27.煤炉的中层:CO2 + C 高温 2CO
28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2
(3)二氧化碳的制法与性质:
29.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
30.碳酸不稳定而分H2CO3 == H2O + CO2↑
31.二氧化碳可溶于水: H2O + CO2== H2CO3
32.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温 CaO + CO2↑
33.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2 + CO2 === CaCO3 ↓+ H2O
(4)一氧化碳的性质:
34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
35.一氧化碳的可燃性:2CO + O2 点燃 2CO2
其它反应:
36.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
五、燃料及其利用:
37.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
38.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
39. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
六、金属
(1)金属与氧气反应:
40. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
41. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
42. 铜在空气中受热:2Cu + O2 加热 2CuO
43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3
(2)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑
48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑
49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑
50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑
51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑
(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐
52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu
54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg
(3)金属铁的治炼原理:
55.3CO+ 2Fe2O3 高温 4Fe + 3CO2↑
七、酸、碱、盐
1、酸的化学性质
(1)酸 + 金属 -------- 盐 + 氢气(见上)
(2)酸 + 金属氧化物-------- 盐 + 水
56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O
57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O
59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O
(3)酸 + 碱 -------- 盐 + 水(中和反应)
60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O
61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O
62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O
63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O
(4)酸 + 盐 -------- 另一种酸 + 另一种盐
64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl
2、碱的化学性质
(1) 碱 + 非金属氧化物 -------- 盐 + 水
68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O
69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O
70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O
71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O
72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O
(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)
(3)碱 + 盐 -------- 另一种碱 + 另一种盐
73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
3、盐的化学性质
(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐
74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
(2)盐 + 酸-------- 另一种酸 + 另一种盐
75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
(3)盐 + 碱 -------- 另一种碱 + 另一种盐
76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
(4)盐 + 盐 ----- 两种新盐
77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3
78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl1年前查看全部
- 该图像为什么表示吸热反应?图像中不是生成物的能量高于反应物么?生成物要放热,反应物要吸热,所以放出的热量比所吸收的要多啊
该图像为什么表示吸热反应?
 图像中不是生成物的能量高于反应物么?生成物要放热,反应物要吸热,所以放出的热量比所吸收的要多啊,所以应该是放热反应啊.为什么会是吸热反应?
图像中不是生成物的能量高于反应物么?生成物要放热,反应物要吸热,所以放出的热量比所吸收的要多啊,所以应该是放热反应啊.为什么会是吸热反应?  梦凡8181年前0
梦凡8181年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如何从宏观角度判断一个反应是吸热反应还是放热反应
 水央央1年前2
水央央1年前2 -
 世上最丑 共回答了15个问题
世上最丑 共回答了15个问题 |采纳率86.7%1 从常识判断反应后温度是否变高,变高则为放热;
2 一般的,如果生产物多于反应物的,那么为放热;
3 如果反应中发光或发出声响,则为放热.1年前查看全部
- 中学常见的吸热反应有哪些?
 郑浩男1年前1
郑浩男1年前1 -
 richerwit 共回答了21个问题
richerwit 共回答了21个问题 |采纳率90.5%吸热反应
①几个常见的反应,如:
2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
C+H2O(g) CO+H2
②多数的分解反应,如:
CaCO3 CaO+CO2↑
CuSO4·5H2O CuSO4+5H2O
③一些物质的溶解,如硝酸铵溶解等.1年前查看全部
- 化学反应小常识若一个反应需要加热才能进行,那么它是否是吸热反应?!不明白,
 hklinlin1年前7
hklinlin1年前7 -
 快乐成份 共回答了21个问题
快乐成份 共回答了21个问题 |采纳率81%加热只是为了让它们达到能互相反应的温度.而根据他们反应开始了以后是放出还是吸收热量来判断是吸|放热反应.等在往上学的时候你就能知道,以后的化学式中会给你加上热量的吸|放1年前查看全部
- 如果一个化学反应是吸热反应 是不是就说明反应物比生成物更稳定?反应物的键能就比生成物的键能大?
 小蚂蚁皮皮1年前1
小蚂蚁皮皮1年前1 -
 孤独的阿木 共回答了22个问题
孤独的阿木 共回答了22个问题 |采纳率90.9%首先要明白一个知识点,能量越高越不稳定,吸热反应当时能量变高,所以生成物没有反应物稳定.那个 △H =反应物的键能-生成物的键能 △H 小于0时反应放热 ,所以,吸热反应时反应物键能比生成物键能大,好好研究化学吧,很有趣的,我当年拿过高中化学奥赛一等奖!1年前查看全部
- 下列变化过程中,属于吸热反应的是(1)液氨汽化(2)将胆矾加热变为白色粉末(3)浓硫酸稀释 放不下拉
下列变化过程中,属于吸热反应的是(1)液氨汽化(2)将胆矾加热变为白色粉末(3)浓硫酸稀释 放不下拉
(4)氨催化氧化成一氧化氮(5)酸碱中和生成水(6)三氯化铁溶于水显酸性
A(1)(2)(6) B 1、2、4、6 C2、6 D2、4、6
说明一下原因 超人小召1年前4
超人小召1年前4 -
 hzc916 共回答了19个问题
hzc916 共回答了19个问题 |采纳率89.5%选d
原因:1是物理变化(吸热反应是针对化学反应而言的)
2硫酸铜脱水,由于是不同物质,所以是化学反应,将其中结晶水赶跑,所以吸热
3常识:浓硫酸稀释放大量热
4催化氧化成一氧化氮:吸热(我们老师讲的,从化学键上解释的)
5常识啦~~放热
6死知识,记住即可1年前查看全部
- 哪些有氧气参加的化合反应是吸热反应
 好q男1年前2
好q男1年前2 -
 Joe12345 共回答了21个问题
Joe12345 共回答了21个问题 |采纳率95.2%氮气与氧气放电时生成一氧化氮是吸热的,貌似只有这一个吧!1年前查看全部
- 下列反应既是氧化还原反应,又是吸热反应的是 [ ] A.铝片
下列反应既是氧化还原反应,又是吸热反应的是 [ ]A.铝片与稀硫酸的反应
B.Ba(OH) 2 ·8H 2 O与NH 4 Cl的反应
C.灼热的碳与二氧化碳的反应
D.甲烷在氧气中的燃烧反应 yslfchen1年前1
yslfchen1年前1 -
 yuiop0070 共回答了24个问题
yuiop0070 共回答了24个问题 |采纳率95.8%C1年前查看全部
- 下列说法正确的是( )A. 需要加热的化学反应都是吸热反应B. 中和反应都是放热反应C. 原电池是将电能转化为化学能的
下列说法正确的是( )
A. 需要加热的化学反应都是吸热反应
B. 中和反应都是放热反应
C. 原电池是将电能转化为化学能的一种装置
D. 水力发电是将化学能转化为电能的过程 巨风大侠1年前1
巨风大侠1年前1 -
 sy1681 共回答了17个问题
sy1681 共回答了17个问题 |采纳率100%解题思路:A.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B.中和反应都是放热反应;
C.原电池是将化学能转化为电能的一种装置;
D.水力发电是将重力势能转化为电能的过程.A.放热反应有的需加热,有的不需加热.如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点.再如铝热反应也是,故A错误;
B.所有的中和反应都是放热反应,故B正确;
C.原电池是将化学能转化为电能的装置,故C错误;
D.水力发电是将重力势能转化为电能的过程,故D错误.
故选B.点评:
本题考点: 吸热反应和放热反应;常见的能量转化形式.
考点点评: 该题考查了吸热反应与放热反应,能量变化的原因.需正确理解放热吸热的本质,是解题的关键.1年前查看全部
- 升高温度,化学平衡会向着吸热反应的方向移动,此时放热反应的反应速率会减小吗?
 小香1591年前2
小香1591年前2 -
 欧阳淼 共回答了23个问题
欧阳淼 共回答了23个问题 |采纳率95.7%温度升到,化学反应速率增加 因此放热反应的反应速率也是增加的1年前查看全部
- 盐类的水解反应有放热的吗老师讲的是大多数的盐类的水解反应是吸热反应,那么谁知道有哪些盐类的水解反应是放热反应.我们有一道
盐类的水解反应有放热的吗
老师讲的是大多数的盐类的水解反应是吸热反应,那么谁知道有哪些盐类的水解反应是放热反应.我们有一道判断题说“中和反应都是放热反应,盐类的水解反应都是吸热反应”老师说这个是错的,谁知道错在哪里了?
 边城白云1年前1
边城白云1年前1 -
 daniel_liu911 共回答了24个问题
daniel_liu911 共回答了24个问题 |采纳率83.3%你的老师说错了.
中和反应一定包含H+ OH-=H2O的过程,该反应放热,即使是弱酸或者弱碱电离需要吸收能量,也不会有H+和OH-结合时放出的能量多.
盐的水解是中和反应的逆反应,中和反应放热,水解反应一定吸热.1年前查看全部
- 下列说法正确的是( )A.化学键的断裂和形成是化学反应的实质,化学反应前后能量不变B.凡是放热反应都是自发的,吸热反应
下列说法正确的是( )
A.化学键的断裂和形成是化学反应的实质,化学反应前后能量不变
B.凡是放热反应都是自发的,吸热反应都是非自发的
C.若一个反应的平衡常数越大,则表示该反应速率也越大
D.升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 朵朵_monica1年前1
朵朵_monica1年前1 -
 okyxf 共回答了16个问题
okyxf 共回答了16个问题 |采纳率87.5%解题思路:A、任何化学反应前后都有能量变化;
B、反应自发与否决定于焓变和熵变两方面;
C、平衡常数可以表示反应正向进行程度,与反应速率无关;
D、升高温度,分子能量增大,活化分子数目增多.A、任何化学反应的反应物和生成物所含能量都不相同,故A错误;
B、反应自发与否决定于焓变和熵变两方面,看△H-T△S的大小,故B错误;
C、平衡常数越大反应正向进行的程度越大,反应速率不一定快,故C错误;
D、升高温度,分子能量增大,活化分子数目增多,所以活化分子百分数增大,故D正确;
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了化学反应中能量变化的原因、反应自发与否的条件、化学平衡常数、活化分子的相关知识,题目难度不大.1年前查看全部
- 下列叙述正确的是( )A.吸热反应一定是反应物总能量大于生成物的总能量B.明矾和漂白粉常用于自来水的净化和杀菌消毒,两
下列叙述正确的是( )
A.吸热反应一定是反应物总能量大于生成物的总能量
B.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 懒惰的V1年前1
懒惰的V1年前1 -
 绕世界流浪 共回答了10个问题
绕世界流浪 共回答了10个问题 |采纳率100%解题思路:A.反应物总能量大于生成物总能量为放热反应;
B.明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性;
C.电解质的导电能力和离子浓度有关;
D.根据原电池原理分析.A.反应物总能量大于生成物总能量为放热反应,生成物总能量大于反应物总能量为吸热反应,故A错误;
B.明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性,两者的作用原理不相同,故B错误;
C.电解质的导电能力和离子浓度有关,离子浓度大,导电能力强,若强电解质离子浓度很小,则导电性很弱,如硫酸钡为强电解质,但离子浓度很小,导电性很弱,故C错误;
D.在海轮外壳上镶入锌块,写出原电池,锌作负极失电子,轮船外壳铁作正极被保护,可减缓船体的腐蚀速率,故D正确;
故选D.点评:
本题考点: 反应热和焓变;金属的电化学腐蚀与防护;强电解质和弱电解质的概念;盐类水解的应用;氯、溴、碘及其化合物的综合应用.
考点点评: 本题易错点为C项,要明确导电性和离子浓度有关,相同浓度下,强电解质导电能力大于弱电解质导电能力.1年前查看全部
- 灼热的炭与CO2反应为什么是既属于氧化还原反应同时又是吸热反应?
 天晴11年前3
天晴11年前3 -
 qq123654 共回答了18个问题
qq123654 共回答了18个问题 |采纳率77.8%因为存在化合价的升降(电子得失),因此为氧化还原反应.因为反应的进行需要吸收能量来断开一个氧氧键和两个碳氧双键,而结合成两个碳氧三键所释放的能量比前者低,因此要吸收能量维持反应进行.1年前查看全部
- 下列说法正确的是( )A.需要加热才能发生的反应一定是吸热反应B.任何放热反应在常温条件下一定能发生反应C.反应物和生
下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物具有的总能量的相对大小决定了反应是放热还是吸热
D.吸热反应一定要加热才能发生 WANGNEI1年前1
WANGNEI1年前1 -
 zhang0312 共回答了14个问题
zhang0312 共回答了14个问题 |采纳率100%解题思路:A.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B.一个化学反应发生的条件与反应的热效应无关;
C.化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
D.吸热反应在不加热的条件下也能发生.A.需要加热才能发生的反应不一定是吸热反应,如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,故A错误;
B.放热的反应在常温下不一定很容易发生.如:铝热反应2 Al+Fe2O3
高温
.
Al2O3+2Fe是放热反应,但需在高热条件下以保证足够的热量引发氧化铁和铝粉反应,故B错误;
C.放热反应是指:反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,反之,就是吸热反应,故C正确;
D.吸热反应在不加热的条件下也能发生,如Ba(OH)2•8H2O与NH4Cl反应常温下就能发生,故D错误.
故选C.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题考查化学反应的条件与化学反应的热效应间的关系,难度不大,需正确理解放热吸热的本质是解题的关键.1年前查看全部
- 在其他条件一定时,图中曲线表示2NO(g)+O2(g)==2NO2(g),正反应为吸热反应,达到平衡时NO的转化率与温度
在其他条件一定时,图中曲线表示2NO(g)+O2(g)==2NO2(g),正反应为吸热反应,达到平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且 V正>V逆的点是:
A.A点或E点
B.B.点
C.C点
D.D点
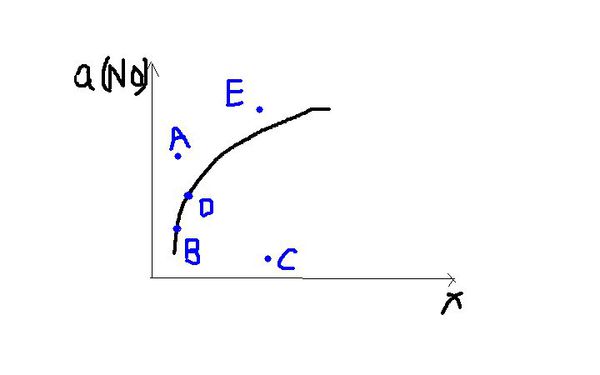
 小可ss莉莉1年前2
小可ss莉莉1年前2 -
 tiantian0211 共回答了13个问题
tiantian0211 共回答了13个问题 |采纳率84.6%在曲线上的点B、D都是对应温度下的平衡点,所以点A、C、E均未达到平衡.
点A、E的转化率比该温度时平衡状态的NO转化率大,平衡向逆反应方向移动才能使得NO的转化率恢复到平衡状态.
点C比该温度时NO的转化率小,要恢复平衡状态,平衡必须向正反应方向移动,所以选择C.1年前查看全部
- 木碳还原氧化铜的反应是不是吸热反应
 游客6171年前1
游客6171年前1 -
 倾ww之美 共回答了17个问题
倾ww之美 共回答了17个问题 |采纳率88.2%这个化学反应是放热的,它刚开始是需要加热那是为了达到反应所需的温度之后就不用再加热了!1年前查看全部
- 下列反应中,属于吸热反应的是( )
下列反应中,属于吸热反应的是( )
A. 乙醇燃烧
B. 氧化钙溶于水
C. 碳酸钙受热分解
D. 盐酸和氢氧化钠反应 错了又错1年前1
错了又错1年前1 -
 800410 共回答了22个问题
800410 共回答了22个问题 |采纳率81.8%解题思路:根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).A.乙醇燃烧是氧化反应,是常见放热反应,故A错误;
B.氧化钙与水反应放出大量的热,则属于放热反应,故B错误;
C.石灰石在高温下的分解反应是吸热反应,故C正确;
D.盐酸与氢氧化钠溶液是中和反应,是放热反应,故D错误.
故选C.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题考查吸热反应,难度不大,掌握中学化学中常见的吸热或放热的反应是解题的关键.1年前查看全部
- 初中化学中的吸热反应有哪些
 博球1年前2
博球1年前2 -
 BIGBOSS 共回答了24个问题
BIGBOSS 共回答了24个问题 |采纳率83.3%一.初中要求知道的放热反应主要有 1.所有的燃烧反应(必须掌握) 2.酸与金属的反应(必须掌握) 3.C与金属氧化物的反应(了解) 4.所有的缓慢氧化,如铁生锈、酿酒、食品腐烂、人和动植物的呼吸等. 5.CaO+H2O==Ca(OH)2 二.初中需要知道的吸热反应 1.C+CO2==高温==2C0(掌握) 2.CaCO3==高温==CaO+CO2↑(了解) 三.初中需要知道的溶解过程中的热效应 1.NaOH、浓硫酸溶解于水后,溶液的温度升高 2.NH4NO3等铵盐溶解后,溶液的温度降低.1年前查看全部
- 常见的放热反应与吸热反应有哪些
 瑞011年前1
瑞011年前1 -
 风过已无痕O 共回答了22个问题
风过已无痕O 共回答了22个问题 |采纳率86.4%常见的放热反应:x0d1.一切燃烧,以及部分氧化(如氨气氧化)x0d2.中和、沉淀(不全是)x0d3.多数化和,如SO3+H2O,NH3+HCl(但H2+I2,合成NH3吸热)x0d4.特别剧烈的反应,如电石和水x0d常见的吸热反应:x0d1.高温下碳还原金属氧化物x0d2.电离,水解x0d3.多数化和,如KClO3,KMnO4,CaCO3x0d4.必须持续加热的反应,如石油裂化放热反应:酸碱中和、大多数的化合反应(C+CO2=2CO除外,条件是加热)、大部分的氧化还原反应 (C+CO2=2CO、C+H2O=CO+H2除外,条件都是加热)(包括金属和酸的反应)吸热反应:所有条件是高温的反应、C+CO2=2CO、C+H2O=CO+H2、1年前查看全部
- 为什么对于正反应时吸热反应的可逆反应 升高温度,平衡右移 K值变大
为什么对于正反应时吸热反应的可逆反应 升高温度,平衡右移 K值变大
这是书上的原话 不可能死记硬背吧 漆黑夜空1年前1
漆黑夜空1年前1 -
 yukyhu 共回答了20个问题
yukyhu 共回答了20个问题 |采纳率85%可逆反应会向减弱外界条件的方向进行
外界升温 反应向吸热方向进行
也就是平衡右移咯、1年前查看全部
- 哪些吸热反应是熵减反应?(类型)
 明熔居士1年前1
明熔居士1年前1 -
 静听的花 共回答了19个问题
静听的花 共回答了19个问题 |采纳率78.9%反应吸热与否(焓H) 跟熵增减(熵 S)无必然联系.
熵减反应是指反应物反应后熵降低的反应.
一般而言,熵的大小顺序如下(前一条比后一条优先级高):
①物质状态:气体>液体>固体
②原子个数:多>少
③相对分子质量:大>小
④对称性:低>高1年前查看全部
- 吸热反应和吸热过程有什么区别?
 2517438111年前1
2517438111年前1 -
 我的xct 共回答了16个问题
我的xct 共回答了16个问题 |采纳率81.3%任何一个反应都包括 和
由于吸放热不一样多,所以表现出来的热效应不同.
硝酸铵溶于水,离子扩散是吸热过程,离子水合是放热过程.
但吸热>放热,所以净表现为吸热反应.
吸热反应是一个完整地反映,吸热过程是反应中的某个阶段.1年前查看全部
大家在问
- 1求医抛物线y^2=-16x的顶点为对称中心,焦点为做焦点,且渐近线为y=±√3x的双曲线的方程
- 2碘单质和氧气,氧化性谁强?
- 3把20gCO和CO2的混合气体通过足量灼热的氧化铜,完全反应后,气体质量为28g,求原气体中CO2的质量.
- 4各位亲、下列英语怎么写?选择填空.最好说一下原因、、7.I think it's better______some re
- 5写出下列诗词的描述的月相 月落乌啼霜满天,江风渔火对愁眠.姑苏城外寒山寺,夜半钟声到客船.
- 6it is not surprising that _such_ little worms eat _so_ littl
- 7三年级有256名学生,每两人共一张课桌,需要多少张课桌?如果把这些课桌平均放在4间教室里,每间教室放多少张?
- 8二十四点二加二乘三点四x等于八十七点二一用方程怎么解
- 9请教几题高二的数学题,最好有详细的过程。
- 10英语翻译高中英语阅读翻译Butterflies come in every color imaginable,and t
- 11什么选自《诗经,周南》
- 12这些句子用了什么表达方式?载人航天工程,是中国航天史上规模最大、技术最复杂、安全性和可靠性要求最高的跨世纪重点工程.为了
- 13人跑步所收到的摩擦力是静摩擦力吗?
- 14修改病句.(1)我断定他今天大概不来了.(2)无论谁违反了纪律,就要受到批评.
- 15先化简,在求值(x+1-x-1分之3)/x-1分之x的平方-4x+4其中x满足方程x的平方+x-6=0
