基态原子有3个未成对电子 可能是哪些元素
 barton20082022-10-04 11:39:541条回答
barton20082022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 205390 共回答了23个问题
205390 共回答了23个问题 |采纳率95.7%- 1-36号元素中有:N、P、V、Co、As
- 1年前
相关推荐
- 激光是电磁波吗关于光的问题的补充:1.如果所有光都是电磁波,是不是光源可以产生电场和磁场?2.原子从激发态跃迁到基态放出
激光是电磁波吗
关于光的问题的补充:
1.如果所有光都是电磁波,是不是光源可以产生电场和磁场?
2.原子从激发态跃迁到基态放出光子,也是由于电场和磁场的共同作用吗? 八分头不要脸1年前1
八分头不要脸1年前1 -
 重量级男人4 共回答了18个问题
重量级男人4 共回答了18个问题 |采纳率100%是的,只要是光就是电磁波,只不过它由原子内层电子受激发越迁产生,本质上还是电磁波的一种1年前查看全部
- 简单的量子物理问题:基态的氢原子能否吸收10eV的光子
 悠远的爱1年前1
悠远的爱1年前1 -
 zzye 共回答了19个问题
zzye 共回答了19个问题 |采纳率94.7%不能吸收,只能吸收恰好使电子发生跃迁的能量的光子,但是可以吸收10eV的电子1年前查看全部
- 如果一个基态原子,1S上2个电子,2S上2个电子,2P上2个电子 那么2P上的2个电子能否都跃迁到3S上呢?
 5195951年前1
5195951年前1 -
 张子月 共回答了22个问题
张子月 共回答了22个问题 |采纳率95.5%不能吧,有选择定则限制.
原子能级之间辐射跃迁所遵从的规则.通常是指电偶极辐射跃迁的选择定则[1],电四极矩辐射、磁偶极辐射以及更高级的辐射都比电偶极辐射要弱得多.选择定则表明并非任何两能级之间的辐射跃迁都是可能的,只有遵从选择定则的能级之间的辐射跃迁才是可能的.选择定则是确定原子光谱结构的重要规律.选择定则可以从量子力学推导出来,它是角动量守恒定律和宇称守恒定律的结果.单价原子的选择定则是量子数满足Δi=±1,ΔJ=0,±1;多电子原子(LS耦合)的选择定则是为奇性态为偶性态,以及量子数满足ΔS=0,ΔL=0,±1 ,ΔJ=0,±1(除去J=0→J=0);塞曼效应的选择定则还应加上磁量子数的限制.
详见百度百科——选择定则1年前查看全部
- 汞原子的能级如图所示,现让光子能量为的一束光照射到大量处于基态(量子数)的汞原
汞原子的能级如图所示,现让光子能量为的一束光照射到大量处于基态(量子数)的汞原
3. 汞原子的能级如图所示,现让光子能量为8.8 eV的一束光照射到大量处于基态(量子数n= 1)的汞原子上,汞原子能发出6种不同频率(波长)的光.下列说法中正确的是( )
A.波长最长的光的光子能量为1.1 eV
B.波长最长的光的光子能量为2.8 eV
C.频率最高的光的光子能量为4.9 eV
D.频率最高的光的光子能量为7.7 eV n E/eV
4 —————————— -1.6
3 —————————— -2.7
2 —————————— -5.5
1 —————————— -10.4
要解析 我们是炝饼1年前3
我们是炝饼1年前3 -
 格格巫1982 共回答了11个问题
格格巫1982 共回答了11个问题 |采纳率90.9%能发出6种频率的能级一定是4能级.
波长最长一定是能量最小的,那就是能级差最小的,应该是4、3能级间的差,ABS(-2.7-(-1.6))=1.1eV
频率最高一定是能级差最大的,就是1、4能级差,ABS(-1.6-(-10.4))=8.8eV
所以答案选A.1年前查看全部
- 能层中电子从3d跃迁到4s,能量增多还是减少?再比如说Cr的基态是3d5 4s1,它的激发态3d4 4s2能量是比基态高
能层中电子从3d跃迁到4s,能量增多还是减少?再比如说Cr的基态是3d5 4s1,它的激发态3d4 4s2能量是比基态高吗?
 LINYAJING9007131年前1
LINYAJING9007131年前1 -
 爱很简单520 共回答了18个问题
爱很简单520 共回答了18个问题 |采纳率88.9%一般来讲,原子外层电子从3d跃迁到4S,能量是增加的.因为,它从4S回到3D时,要放出光子,释放能量.
我查了课本,Cr的能级高低完全由n决定,不由L决定,所以,激发态3d4 4s2比基态3d5 4s1 能量高.
也有一些个别的原子,能级由n和L共同决定,比如K,最外层电子态不是3d1而是4s1,虽然四能级比三能级高,但是4s1比3d1能量低,所以最外层电子在4s1上
可以参阅《原子物理》1年前查看全部
- 没事做点化学对错题吧!1在一个基态多电子的原子中,不可能有两个能量完全相同的电子2在一个基态多电子的原子中,也可以有两个
没事做点化学对错题吧!
1在一个基态多电子的原子中,不可能有两个能量完全相同的电子
2在一个基态多电子的原子中,也可以有两个运动状态完全相同的电子
请说明理由 三马青尘1年前4
三马青尘1年前4 -
 帽子姑娘啊 共回答了21个问题
帽子姑娘啊 共回答了21个问题 |采纳率76.2%1在一个基态多电子的原子中,不可能有两个能量完全相同的电子
对,电子的状态不同,能量也不同.
2在一个基态多电子的原子中,也可以有两个运动状态完全相同的电子
错,在一个基态多电子的原子中,不可能有两个运动状态完全相同的电子 .1年前查看全部
- (1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______.
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______.
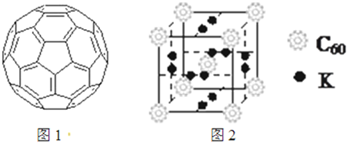
(2)富勒烯衍生物由于具有良好的光电性能.富勒烯(C60)的结构如图1,分子中碳原子轨道的杂化类型为______;1mol C60分子中σ键的数目为______.科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示.该化合物中的K原子和C60分子的个数比为______.
(3)砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似.
①GaAs晶体中,每个As与______个Ga相连.
②第一电离能:As______ Se(填“>”、“<”或“=”).
(4)Na3AsO4可作杀虫剂.AsO43-的空间构型为______,与其互为等电子体的一种分子为______. 你们都还好1年前1
你们都还好1年前1 -
 exlude2335 共回答了12个问题
exlude2335 共回答了12个问题 |采纳率91.7%解题思路:(1)镍是28号元素,根据原子核外电子排布规律可以写出核外电子排布式;
(2)根据价层电子对互斥理论确定杂化方式,利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中σ键的数目,利用均摊法确定K原子和C60分子的个数比;
(3)①晶体结构与金刚石相似,则为原子晶体,以共价键形成空间网状结构;
②同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素;
(4)AsO43-中,成键数为4,孤对电子数为(5+3-2×4)×[1/2]=0,为sp3杂化;等电子体的原子数和价电子数相同;(1)镍是28号元素,根据原子核外电子排布规律可以写出核外电子排布式为:[Ar]3d84s2,故答案为:[Ar]3d84s2;
(2)每个碳原子含有的σ键个数且不含孤电子对,所以采用sp2 杂化,每个碳原子含有的σ键个数为[3/2],所以1mol C60分子中σ键的数目=[3/2]×60NA=90NA,该晶胞中C60个数=1+8×[1/8]=2,6×2×[1/2]=6,所以K原子和C60分子的个数比为6:2=3:1,故答案为:sp2,90NA,3:1;
(3)①金刚石形成的晶体属于原子晶体,碳原子可以形成4个碳碳单键,所以每个As应与4个Ga相连,故答案为:4;
②同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,所以As、Se两种元素的第一电离能:As>Se,故答案为:>;
(4)AsO43-中含有的孤电子对数是0,中心原子有4个共价键,所以其构型是正四面体形.原子总数相同.价电子总数相同的分子称为等电子体.AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为四氯化碳,故答案为:正四面体形;CCl4;点评:
本题考点: 晶胞的计算;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题考查了核外电子排布、原子轨道杂化、晶体的结构及等电子体等知识,中等难度.1年前查看全部
- 基态氢原子核外电子的能量具有确定值,但它核外电子的位置不确定。这句话哪里错了?
 gchhx_0011年前1
gchhx_0011年前1 -
 pigeon_1982 共回答了20个问题
pigeon_1982 共回答了20个问题 |采纳率80%基态氢原子核外电子的能量-----没有确定值!1年前查看全部
- 什么叫气态基态原子这里的“基态”的划分标准是什么
 sokidon1年前1
sokidon1年前1 -
 被放逐的神 共回答了17个问题
被放逐的神 共回答了17个问题 |采纳率100%现代物质结构理论证实原子的电子排布遵循构造原理,能使整个原子的能量处于最低状态,简称能量最低原理.处于最低能量的原子叫做基态原子. 基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子,例如电子会...1年前查看全部
- (1)元素的第一电离能Al Si(填“>”或“<”)。(2)基态Mn 2+ 的核外电子排布式为
(1)元素的第一电离能Al Si(填“>”或“<”)。(2)基态Mn 2+ 的核外电子排布式为(1)元素的第一电离能Al Si(填“>”或“<”)。
(2)基态Mn 2+ 的核外电子排布式为 。
(3)硅烷(Si n H 2n+2 )的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子X m- (含B、O、H三种元素)的球棍模型如图所示:
①在X m- 中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由Na + 、X m- 和H 2 O构成,它们之间存在的作用力有 (填序号)。
A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键
 柳承敏1年前1
柳承敏1年前1 -
 womendezuguo2008 共回答了16个问题
womendezuguo2008 共回答了16个问题 |采纳率93.8%(1)<
(2)1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 ([Ar]3d 5 )
(3)硅烷的相对分子质量越大,分子间作用力越强
(4)①sp 2 、sp 3 ;4、5(或5,4) ;2②ADE
(1)同一周期元素自左向右第一电离能有增大趋势,故第一电离能Al<Si
(2)Mn是25号元素,其电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 ,故Mn 2+ 的电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 。
(3)硅烷形成的晶体是分子晶体,相对分子质量越大,分子间作用力越强,沸点越高。
(4)①由球棍模型可以看出,黑球为B原子,灰球为O原子,小黑球为H原子。2号B原子形成3个键,采取sp 2 杂化,4号B原子形成4个键,采取sp 3 杂化;4号B原子三个sp 3 杂化轨道与除5号外三个O原子形成σ键后还有一个空轨道,而5号O原子能提供孤电子对而形成配位键;由图示可以看出该结构可以表示为[B 4 H 4 O 9 ] m - ,其中B为+3价,O为-2价,H为+1价,根据化合价可知m=2。
②在晶体中Na + 与X m+ 之间为离子键,H 2 O分子间存在范德华力,而该阴离子能与水分子形成氢键。1年前查看全部
- (2r12•咸安区模拟)已知氢原子基态的轨道半径为Rr,基态能量为-Er,将该原子置于静电场中使其电离,已知静电力常量为
(2r12•咸安区模拟)已知氢原子基态的轨道半径为Rr,基态能量为-Er,将该原子置于静电场中使其电离,已知静电力常量为r,电子电量大小为q.则( )
A.静电场提供的能量至少为E0
B.静电场提供的能量至少为2E0
C.静电场场强大小至少为Kq R 20
D.静电场场强大小至少为2Kq R 20 栋茂1年前1
栋茂1年前1 -
 流泪的鱼1985 共回答了25个问题
流泪的鱼1985 共回答了25个问题 |采纳率92%解题思路:要使原子发生电离,吸收的能量大于等于基态能量的绝对值,该原子置于静电场中使其电离,其临界状态是电场力等于库仑引力.结合该关系求出静电场的场强最小值.因为基态能量为-E0,要使氢原子电离,吸收4能量大于等于E0.
处于静电场中使其电离,则临界状态是电场力等于库仑引力.有:qE=z
q2
R02
解得场强4最小值:E=z
q
R20.故A、C正确,B、D错误.
故选AC点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键知道原子电离所满足的规律,以及知道通过静电场使原子电离时的临界状态.1年前查看全部
- 用波长为λ=50nm的紫外线能否使处于基态的氢原子电离?电离后的电子速率将是多大?(氢原子的基态能量为-13.6eV,电
用波长为λ=50nm的紫外线能否使处于基态的氢原子电离?电离后的电子速率将是多大?(氢原子的基态能量为-13.6eV,电子质量为0.91×10-30kg)
 ImCute21年前1
ImCute21年前1 -
 钏钏宝宝 共回答了20个问题
钏钏宝宝 共回答了20个问题 |采纳率80%解题思路:要使处于基态的氢原子电离,照射光光子的能量应能使电子从基态跃迁到无限远处,最小频率的电磁波的光子能量应为:hγ=0-E1氢原子在基态时所具有的能量为一13.6eV,将其电离变是使电子跃迁到无穷远,
根据玻尔理论所需的能量为13.6eV的能量.
hν=0-E1
所以:ν=3.26×1015Hz
波长为λ=50nm的紫外线频率γ′=[C/λ]=6×1015Hz>ν
所以能使处于基态的氢原子电离.
波长为λ=50nm的紫外线能量E=h[C/λ]
电离后的电子动能Ek=E-13.6eV=[1/2]mv2
解得:v=2.0×106m/s
答:能使处于基态的氢原子电离,电离后的电子速率是2.0×106m/s点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 本题考查了氢原子的跃迁公式和波长与频率的关系.1年前查看全部
- (6分)氢原子能级如图17所示,则要使一个处于基态的氢原子释放出一个电子而变成为氢离子,该氢原子需要吸收的能量至少是__
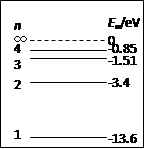
(6分)氢原子能级如图17所示,则要使一个处于基态的氢原子释放出一个电子而变成为氢离子,该氢原子需要吸收的能量至少是___________eV;一群处于 n =4能级的氢原子跃迁到 n =2的状态过程中,可能辐射___________种不同频率的光子。
 youyoufeifen1年前1
youyoufeifen1年前1 -
 zh-987 共回答了20个问题
zh-987 共回答了20个问题 |采纳率95%13.6eV,3(各3分,共6分)
要使一个处于基态的氢原子释放出一个电子而变成为氢离子,该氢原子需要吸收的能量至少等于氢原子的电离能13.6eV。一群处于 n =4能级的氢原子跃迁到 n =2的状态过程中,可能辐射2+1=3种不同频率的光子。1年前查看全部
- 基态原子的每个原子轨道都有电子填充 但只有一个未成对电子
基态原子的每个原子轨道都有电子填充 但只有一个未成对电子
把这几个元素都推断出来

 倒霉的摩的1年前1
倒霉的摩的1年前1 -
 xivkaja 共回答了22个问题
xivkaja 共回答了22个问题 |采纳率95.5%X是碳元素,Y是氟元素,Z是钠元素,W是氯元素1年前查看全部
- 氢原子的能级如图,一群处于基态的氢原子,被激光A照射后观察其光谱线,只能看到一条光谱线,但被激光B照射后观察其光谱线,可
 氢原子的能级如图,一群处于基态的氢原子,被激光a照射后观察其光谱线,只能看到一条光谱线,但被激光b照射后观察其光谱线,可以看到六条光谱线,有关a、b两激光下列说法正确的是( )
氢原子的能级如图,一群处于基态的氢原子,被激光a照射后观察其光谱线,只能看到一条光谱线,但被激光b照射后观察其光谱线,可以看到六条光谱线,有关a、b两激光下列说法正确的是( )
a.激光b的功率一定比激光a的功率大
b.激光b每秒钟产生的光子数一定比激光a产生的光子数多
c.激光b光子的能量一定是激光a光子能量的6倍
d.激光b光子的能量是12.75ev yanhm9451年前1
yanhm9451年前1 -
 403275887 共回答了17个问题
403275887 共回答了17个问题 |采纳率94.1%解题思路:能级间发生跃迁时吸收或辐射的光子能量等于两能级间的能级差,根据数学组合公式
和玻尔理论分析求解C 2nA、一群处于基态的氢原子,被激光A照射后观察其光谱线,只能看到一条光谱线,说明氢原子跃迁到n=2能级,
被激光B照射后观察其光谱线,可以看到六条光谱线,说明氢原子跃迁到n=4能级,
能级间发生跃迁时吸收或辐射的光子能量等于两能级间的能级差,所以激光B的能量大于激光A的能量,但是功率关系不确定,每秒钟产生的光子数不确定,故AB错误
C、激光B光子的能量是12.75eV,激光B光子的能量是10.2eV,故C错误,D正确
故选D.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键知道能级间跃迁所满足的规律,即Em-En=hv.1年前查看全部
- 一群处于n=4的激发态的氢原子,(1)跃迁时可能发出的谱线有 条? (2)已知氢原子基态的能级为E 1 ,在
一群处于n=4的激发态的氢原子,(1)跃迁时可能发出的谱线有 条? (2)已知氢原子基态的能级为E 1 ,在这些光谱中写出最长的波长表达式λ= 。
 雕塑自我1年前1
雕塑自我1年前1 -
 gp11301111 共回答了19个问题
gp11301111 共回答了19个问题 |采纳率84.2%(1)6 (2)-144hc/7E 1
略1年前查看全部
- 已知氢原子基态能量为-13.6Ev,第二能级E2=-3.4eV,如果氢原子吸收______eV能量,可由基态跃迁到第二能
已知氢原子基态能量为-13.6Ev,第二能级E2=-3.4eV,如果氢原子吸收______eV能量,可由基态跃迁到第二能级.如果再吸收1.89eV能量,还可由第二能级跃迁到第三能级,则氢原子的第三能级E3=______eV.
 趣味涂鸦1年前1
趣味涂鸦1年前1 -
 zhangfg 共回答了19个问题
zhangfg 共回答了19个问题 |采纳率84.2%解题思路:根据初末能级的差值等于辐射光子或吸收光子能量求解.已知氢原子基态能量为-13.6Ev,第二能级E2=-3.4eV,
所以由基态跃迁到第二能级氢原子吸收的能量是E2-E1=10.2eV
如果再吸收1.89eV能量,还可由第二能级跃迁到第三能级,
E3=E2+1.89eV=-1.51eV
故答案为:10.2,-1.51点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键掌握辐射光子或吸收光子能量与能级差的关系,即Em-En=hv.1年前查看全部
- 钙离子的基态电子排布式?为什麽是1s22s22p63s23p64s2而不是1s22s22p63s23p6?不是离子吗?
 jbjlove661年前2
jbjlove661年前2 -
 YOYO晴 共回答了12个问题
YOYO晴 共回答了12个问题 |采纳率100%离子是下面一个1年前查看全部
- 元素xyzw位于元素周期表前四周期,原子序数依次增大 x基态原子核外有三个能级,每个能级的电子数都相同
元素xyzw位于元素周期表前四周期,原子序数依次增大 x基态原子核外有三个能级,每个能级的电子数都相同
元素xyzw位于元素周期表前四周期,原子序数依次增大
x 基态原子核外有三个能级,每个能级的电子数都相同
y y与z不在同一周期,其原子核外未成对电子比电子层数多1
z 可与w形成两种化合物,且水溶液均显酸性
w 是地壳中含量第二的金属
问:一定条件下,z与y可形成zy3 ,zy3与水反应可形成一种弱酸和一种弱碱写出反应方程式! 在这样就晕了1年前2
在这样就晕了1年前2 -
 阅微堂王 共回答了22个问题
阅微堂王 共回答了22个问题 |采纳率95.5%NCl3+3H2O=NH3+3HClO
x 基态原子核外有三个能级,每个能级的电子数都相.【说明是1s2 2s2 2p2,X是C.】
y与z不在同一周期,其原子核外未成对电子比电子层数多1.【说明是N.】
z可与w形成两种化合物,且水溶液均显酸性.【根据w可以知道,z是Cl】
w是地壳中含量第二的金属,可以得出是Fe.【地壳中元素含量前四位:O、Si、Al、Fe】
z与y可形成zy3是NCl3,NCl3+3H2O=NH3+3HClO1年前查看全部
- 量子物理基础已知基态氢原子的能量为-13.6eV,当基态氢原子被-12.09eV的光子激发后,其电子的轨道半径将增加到玻
量子物理基础
已知基态氢原子的能量为-13.6eV,当基态氢原子被-12.09eV的光子激发后,其电子的轨道半径将增加到玻尔半径的
是 9倍 还是 3倍 为什么? 小gg哥1年前2
小gg哥1年前2 -
 千年回一帖 共回答了18个问题
千年回一帖 共回答了18个问题 |采纳率83.3%9倍
光子能量是12.09eV,不是-12.09eV,你写错了.
被光子激发后,氢原子能量
E1=-13.6+12.09=-1.51=E0/9
而波尔能级是
En=E0/n^2
所以处于第3个能级,n=3
轨道半径
rn=n^2r0=9r0
r0是基态半径.
所以是9倍1年前查看全部
- 根据氢原子的能级图,现让一束单色光照射到大量处于基态(量子数n=1)的氢原子上,受激的氢原子能自发地发出3种不同频率的光
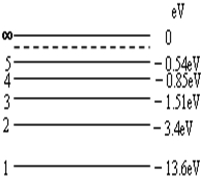
根据氢原子的能级图,现让一束单色光照射到大量处于基态(量子数n=1)的氢原子上,受激的氢原子能自发地发出3种不同频率的光,则照射氢原子的单色光的光子能量为( )
 A. 13.6eV
A. 13.6eV
B. 3.4eV
C. 10.2eV
D. 12.09eV liw5111年前2
liw5111年前2 -
 annny 共回答了19个问题
annny 共回答了19个问题 |采纳率84.2%解题思路:能级间跃迁吸收或辐射的能量等于两能级间的能级差,受激的氢原子能自发地发出3种不同频率的光,可知跃迁到第3能级,从而根据能级差求出照射的光子能量.受激的氢原子能自发地发出3种不同频率的光,知跃迁到第3能级,则吸收的光子能量为△E=-1.51+13.6eV=12.09eV.故D正确,A、B、C错误.
故选:D.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键知道能级间跃迁所满足的规律,即Em-En=hv.1年前查看全部
- 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 为什么错?
 netdonkey1年前5
netdonkey1年前5 -
 cuiweiming 共回答了19个问题
cuiweiming 共回答了19个问题 |采纳率89.5%在原子内部,电子填充在不同的层,层下有亚层,亚层下有原子轨道
常见的原子轨道有4种,s、p、d、f
这四种轨道中,s只有一个轨道,p有三个等价轨道,d有5个,f有7个
根据保里不相容原理,每个轨道中最多可以填充两个电子,自旋相反
这两个电子的能量完全相同,另外在等价轨道上填充的电子能量也相同1年前查看全部
- (2008•广东模拟)(供选学3-5模块的考生做)氦原子被电离一个核外电子,形成类氢结构的氦离子.已知基态的氦离子能量为
 (2008•广东模拟)(供选学3-5模块的考生做)氦原子被电离一个核外电子,形成类氢结构的氦离子.已知基态的氦离子能量为E1=-54.4eV,氦离子的能级示意图如图所示.在具有下列能量的光子或者电子中,不能被基态氦离子吸收而发生跃迁的是( )
(2008•广东模拟)(供选学3-5模块的考生做)氦原子被电离一个核外电子,形成类氢结构的氦离子.已知基态的氦离子能量为E1=-54.4eV,氦离子的能级示意图如图所示.在具有下列能量的光子或者电子中,不能被基态氦离子吸收而发生跃迁的是( )
A.42.8eV (光子)
B.43.2eV(电子)
C.41.0eV(电子)
D.54.4eV (光子) selove1年前1
selove1年前1 -
 benddd 共回答了17个问题
benddd 共回答了17个问题 |采纳率76.5%解题思路:氦离子吸收光子发生跃迁,光子能量需等于两能级间的能级差,否则不会被吸收.电子能量可以部分被吸收,发生跃迁.A、基态的氦离子吸收42.8eV的能量,能量为-54.4+42.8eV=-11.6eV.不能跃迁.故A正确.
B、基态的氦离子吸收43.2eV的电子能量,部分被吸收,能跃迁到第二能级.故B错误.
C、基态的氦离子吸收41.0eV的电子能量,部分被吸收,能跃迁到第二能级.故B错误.
C、基态的氦离子吸收54.4eV的能量,能量为-54.4+54.4=0eV,跃迁到无穷远.故D错误.
故选A.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键知道能级间跃迁吸收和辐射光子的能量等于两能级间的能级差,对于电子,能量可以部分被吸收.1年前查看全部
- 在基态氢原子被外来单色光激发后发出的巴尔末系中,仅观察到三条普线,求外来光的波长
 arkijiang1年前1
arkijiang1年前1 -
 纨绔凯 共回答了18个问题
纨绔凯 共回答了18个问题 |采纳率94.4%hc/λ = -13.6(1/4^2 - 1/1^2)* 1.6*10^(-19)
λ = 9.744*10^(-8) m1年前查看全部
- 处于基态的一群氢原子受某种单色光照射时,只发射波长为λ1、λ2、λ3的三种单色光,且λ1>λ2>λ3,则照射光的波长为(
处于基态的一群氢原子受某种单色光照射时,只发射波长为λ1、λ2、λ3的三种单色光,且λ1>λ2>λ3,则照射光的波长为( )
A. λ3
B. λ1+λ2+λ3
C.λ1λ3 λ1+λ3
D.λ1λ2 λ1+λ2  一把花儿1年前2
一把花儿1年前2 -
 最里边 共回答了19个问题
最里边 共回答了19个问题 |采纳率89.5%解题思路:解题思路:根据氢原子能放出三种频率光,判断此时氢原子处在第几能级,然后计算从基态跃迁到该能级需要多少能量,计算能量时根据能级之简能量差和放出光子能量之间的关系计算.同时明确频率、波长、光速之间关系.能放出三种光,说明此时氢原子处在第3能级,从第三能级跃迁到基态时放出光子能量为:
E=
hc
λ3,或者E=
hc
λ1+
hc
λ2.
能使处于基态氢原子跃迁的光子能量和第三能级与基态之间能级差相等.故有:
hc
λ =
hc
λ3,λ=λ3,
或者
hc
λ =
hc
λ1+
hc
λ2,此时λ=
λ1λ2
λ1+λ2,故BC错误,AD正确.
故选AD.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 本题考查知识比较全面,即考查了有关能级差、光子种类的计算,又考查了光子能量、波长、频率关系,在学习中要加强练习,不可混淆.1年前查看全部
- 一群基态氢原子吸收光子后发射波长为人1 人2 人3 的三种单色光光子且人1>人2>人3则被氢原子吸收的光子波长为
一群基态氢原子吸收光子后发射波长为人1 人2 人3 的三种单色光光子且人1>人2>人3则被氢原子吸收的光子波长为
答案是人3和 人1人2/(人1+人2)后者是怎么算出来的啊 朴风1年前1
朴风1年前1 -
 随曦 共回答了18个问题
随曦 共回答了18个问题 |采纳率94.4%光子能量E=hv=hc/λ
所以有hc/λ1+hc/λ2=hc/λ3
解得λ3=λ1λ2/(λ1+λ2)1年前查看全部
- 1、写出25元素基态原子的电子排布式指出它属于第几周期、第几族?主族还是副族?核外有多少个成单电子?
1、写出25元素基态原子的电子排布式指出它属于第几周期、第几族?主族还是副族?核外有多少个成单电子?
2、应用Le Chatelier原理预测下列平衡在改变平衡条件时,反应(该反应位吸热反应)的移动方向.
AgCl(s)+2CN-(aq)≈[Ag (CN)2] -(aq)+Cl(aq)△Hm=+21kl•mol-1
(1)加入NaCN(s)时,反应的移动方向.
(2)降低体系温度时,反应的移动方向.
3、判断下列各组分子之间存在何种形式的分子间的作用力,如有氢键请指出是分子间氢键还是分子内氢键.
(1)CO2和CCl4;
(2)NH3与N2;
(3)H2O与H2O.
4、HAc—NaAc为例说明缓冲溶液的缓冲作用机理.
5、根据杂化轨道理论指出下列分子的空间构型及杂化类型.
CH3Cl
NH3
BBR3
能回答几题都可以, 只想活到三十岁1年前2
只想活到三十岁1年前2 -
 黄朝斌 共回答了15个问题
黄朝斌 共回答了15个问题 |采纳率100%1、锰Mn 1s2 2s2 2p6 3s2 3p6 3d5 4s2
属于第四周期,第四副族
核外有25个成单电子
2、1)加入了CN-,则反应向正反应方向移动
2)降低体系温度时,反应向逆反应方向移动
3、1)范德华力
2)范德华力
3)氢键 水是分子间氢键
4、在缓冲溶液中的质子转移平衡及其大量Ac-(来自NaAc)存在而引起平衡移动的总结果可用下式表示
HAc+H2O H3O+ + Ac-
NaAc Na+ + Ac-
由上式可知,在HAc-NaAc缓冲溶液中,存在大量的HAc和Ac-,且二者是以质子转移平衡互相联系存在于溶液中,当在该溶液中加入少量强酸时,Ac-(抗酸成分)与H3O+结合生成HAc,使上述平衡向左移动.当在该溶液中加入少量强碱时,H3O+(由抗碱成分HAc解离)与OH-结合生成H2O,使上述平衡向右移动.当该溶液稍加稀释时,HAc解离度增大,上述平衡向右移动.因此,缓冲溶液中的pH值不至于因外加少量强酸、强碱,或稍加稀释而发生明显的改变.
5、1)正四面体 不等性杂化
不等性,因为Cl原子和H原子不一样,所以使得中心原子的4个sp3杂化轨道中有一个和其它3个有差异.只有CH4、CCl3、BF3等价层电子对完全等效的分子才是等性杂化.等性与否不是只看有没有孤对电子.即使都是成键电子对,如CH3Cl中,由于这4对成键电子对的性质不完全一样,有一个即Cl的那个和其他3个不同,也是不等性的.
2)三角锥 由上,等性杂化
3)平面 等性杂化1年前查看全部
- 有一些氢原子处于n=4的激发态 当它们跃迁到基态时最多能发出多少种光?说明白点,
 豆子的挪挪1年前1
豆子的挪挪1年前1 -
 王王木木 共回答了26个问题
王王木木 共回答了26个问题 |采纳率92.3%n=4的激发态:4‐1 4‐2 4‐3 3‐2 3‐1 2‐1
能发出6种光1年前查看全部
- 高中物质结构与性质题现有短周期元素A、B、C、D、E、F,其原子序数依次增大.A、B、D、的基态原子电子的排布中未成对电
高中物质结构与性质题
现有短周期元素A、B、C、D、E、F,其原子序数依次增大.A、B、D、的基态原子电子的排布中未成对电子数均与其周期数相等,且B得基态原子核外3个能级上的电子数相等,E在同周期的主族元素中原子半径最大,元素F所在主族序数与所在周期序数之差为4.
(1)E位于元素周期表第——周期第——族,E的最高价氧化物对应的水化物的碱性比KOH——(填“强”或“弱”)
(2)C的基态原子核外电子排布式是——.C的第一电离能比D——(大或小),元素A、B形成的化合物B2A4固体的晶体类型是——.
(3)A2和C2的反应在工业上有着重要的应用.已知键能:A2为436KJ/mol,C2为946KJ/mol,请写出C2核A2反应的热化学方程式(用化学式表示)——————. wakien1年前1
wakien1年前1 -
 冷血动物5678 共回答了16个问题
冷血动物5678 共回答了16个问题 |采纳率87.5%先来推断元素,由于A~F原子序数依次增大,ABD基态原子的未成对电子与周期数相等,易得A在第一周期,B在第二周期,D在第二或三周期.已经可判断A为H.又因为B基态原子核外3个能级(1s,2s,2p)电子数相等,均等于2,可判断B为C,D为O或P.又因为E在同周期元素中半径最大,又在短周期内,E为Na.E的原子序数大于D,故D为O.F主族序数和周期序数差值为4,可得F为Cl.C处于BD之间,故C为N 至此,推断完毕,简单整理:A:HB:CC:ND:OE:NaF:Cl E(Na)位于第三周期ⅠA族,比KOH碱性要弱.C(N)1s2 2s2 2p3 C的第一电离能比D(O)要大,C2H4为分子晶体.反应为:N2+3H2==2NH3 题中你好像少写了C-A的键能,因此这个热化学方程式无法计算了.如果设C-A键能为X,上述反应的△H=436×3+946-6X希望能够帮助到你~如有疑惑,欢迎追问1年前查看全部
- 能级跃迁发光的问题汞原子的能级如图所示,现让光子能量为8.8eV的一束光照射到大量处于基态的汞原子上,汞原子能发出6种不
能级跃迁发光的问题
汞原子的能级如图所示,现让光子能量为8.8eV的一束光照射到大量处于基态的汞原子上,汞原子能发出6种不同频率的光,正确的是
A波长最长的光的光子能量为1.1eV
B波长最长的光的光子能量为2.8eV
C频率最大的光的光子能量为4.9eV
D频率最大的光的光子能量为7.7eV
n E/eV
4---------- -1.6
3---------- -2.7
2---------- -5.5
1---------- -10.4 爱在荒原1年前2
爱在荒原1年前2 -
 宝贝儿别哭 共回答了18个问题
宝贝儿别哭 共回答了18个问题 |采纳率94.4%能量越高代表频率越高,波长越短.
能量越低代表频率越低,波长越长.
很明显能量最高的光子应该是能级4落到能级1的电子所发出的光子.(刚好为8.8eV.也正是因此,8.8eV的光子才可能把电子从基态送到能级4的轨道上)此时的光子频率最大,波长最短.
而能量最低的光子应该是能级4落到能级3的电子所发出的光子.只有1.1eV.此时光子频率最低,波长最长.
检查4个答案,只有A符合要求.1年前查看全部
- 关于相对论和原子物理激发态原子能量比基态高【ΔE】,该原子运动时发射一个光子并归于基态,且静止,其静质量【m0】,求发射
关于相对论和原子物理
激发态原子能量比基态高【ΔE】,该原子运动时发射一个光子并归于基态,且静止,其静质量【m0】,求发射光子能量【E'】? yyhhxn1年前1
yyhhxn1年前1 -
 彦25 共回答了19个问题
彦25 共回答了19个问题 |采纳率94.7%反过来看这个过程,一个光子撞一个静止质量为m0的原子然后把它正好撞到激发态
光子能量E',动量P'=E'/C,撞击完后也是粒子动量
被撞后的粒子静止质量为M0'=M0+ ΔE/C^2(激发态与基态能量差从外部看可以看成静止质量不同,这一步不是很容易理解,暂且只能说这是对的),体系总能量为M0C^2+E',在撞击完后就是粒子的能量E,解方程
E^2=M0'^2C^4+P0'^2C^2即可.
验证答案及上述括号是正确的做法:
求 出E'后你就可以反解出零动量系(质心系),你只要验证在这个参照系里的总能量为M0C^2+ΔE即可1年前查看全部
- 原子基态的电子组态怎么写的能不能举个例子,譬如O或P
 你来自哪颗星971年前1
你来自哪颗星971年前1 -
 杰克布朗 共回答了17个问题
杰克布朗 共回答了17个问题 |采纳率94.1%原子的基态电子组态一般是根据电子填充的三原则写的,即能量最低原理,洪特规则,保里不相容原理.但是对于轨道的能量高低顺序比较复杂,目前的光谱实验数据应该是最好的依据.通常也有些规则,比如用得较多的“构造原理”
根据构造原理:(1s) ( 2s 2p) ( 3s 3p) ( 4s 3d 4p)……
比如O:8e ,基态电子组态为 :1s2 2s2 2p41年前查看全部
- 现有1200个氢原子被激发到量子数为4的能级上,若这些受激氢原子最后都回到基态,已知金属钾的逸出功为2.22eV。在这些
现有1200个氢原子被激发到量子数为4的能级上,若这些受激氢原子最后都回到基态,已知金属钾的逸出功为2.22eV。在这些光波中,能够从金属钾的表面打出光电子的光子总数为_____________。假定处在量子数为n的激发态的氢原子跃迁到各较低能级的原子数都是处在该激发态能级上的原子总数的1/(n-1)  我是牙膏1年前1
我是牙膏1年前1 -
 无所谓n 共回答了14个问题
无所谓n 共回答了14个问题 |采纳率78.6%16001年前查看全部
- (2007•汕尾模拟)(1)氢原子第n能级的能量为En=E1n2,其中E1是基态能量.而n=1,2,….若一氢原子发射能
 (2007•汕尾模拟)(1)氢原子第n能级的能量为En=
(2007•汕尾模拟)(1)氢原子第n能级的能量为En=
,其中E1是基态能量.而n=1,2,….若一氢原子发射能量为−E1 n2
E1的光子后处于比基态能量高出−3 16
E1的激发态,则氢原子发射光子前后分别处于第几能级?3 4
(2)如图所示,竖直平行直线为匀强电场的电场线,电场方向未知,A,B是电场中的两点,AB两点的连线长为l且与电场线所夹的锐角为θ.一个质量为m,电荷量为-q的带电粒子以初速度v0从A点垂直进入电场,该带电粒子恰好能经过B点.不考虑带电粒子的重力大小.
根据你学过的物理学规律和题中所给的信息,对反映电场本身性质的物理量(例如电场强度),你能作出哪些定性判断和求得哪些定量结果? 执子之手04061年前1
执子之手04061年前1 -
 培土生金 共回答了22个问题
培土生金 共回答了22个问题 |采纳率95.5%解题思路:(1)根据能级间跃迁辐射的光子能量等于两能级间的能级差,以及处于激发态的能量和基态能量的关系求出氢原子发射光子前后分别处于的能级.
(2)粒子在电场中做类平抛运动,结合带电粒子在水平方向和竖直方向上的运动规律求出AB两点的电场强度,以及根据匀强电场的电势差的公式求出A、B两点的电势差.通过粒子的电性判断电场强度的方向,从而确定A、B两点电势的高低.(1)设氢原子发射光子前后分别位于第l与第m能级,依题意有:
E1
l2−
E1
m2=−
3
16E1
E1
m2−E1=−
3
4E1
解得:m=2
l=4
答:氢原子发射光子前后分别处于第4能级和第2能级.
(2)因粒子带负电且向下偏转,故电场力方向向下,所以电场方向竖直向上.
水平方向匀速运动,有:lsinθ=v0t
竖直方向做初速度为零的匀加速运动,有lcosθ=
1
2at2
则加速度:a=
2
v20cosθ
lsin2θ
由qE=ma,得电场强度大小:E=[ma/q=
2m
v20cosθ
qlsin2θ]
B点的电势高于A点的电势,有A、B两点间的电势差为:
UAB=-Elcosθ=−
2m
v20cos2θ
qsin2θ=−
2m
v20
qcot2θ
答:B点的电势高于A点的电势,有A、B两点间的电势差为−
2m
v20
qcot2θ.点评:
本题考点: 氢原子的能级公式和跃迁;匀强电场中电势差和电场强度的关系.
考点点评: 本题考查了能级的跃迁以及带电粒子在电场中的运动.第二问是道开放题,关键抓住粒子的运动规律进行求解.1年前查看全部
- 某基态原子的3d能级中有一个电子,其第四电子层中的电子数为( )
某基态原子的3d能级中有一个电子,其第四电子层中的电子数为( )
A. 0
B. 2
C. 3
D. 4 旧时想念1年前3
旧时想念1年前3 -
 月下晒书 共回答了23个问题
月下晒书 共回答了23个问题 |采纳率91.3%解题思路:根据构造原理,核外电子排满4s再排3d,3d能级中有一个电子,不存在洪特规则特例情况,因此4s上的电子数为2.根据构造原理,核外电子排满4s再排3d,3d能级中有一个电子,不存在洪特规则特例情况,s能级最多容纳2个电子,因此4s上的电子数为2,
故选B.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查了原子核外电子排布,难度不大,解题时注意洪特规则特例的情况,掌握构造原理是解题的关键.1年前查看全部
- 氢原子从n=3的能级跃迁到n=2的能级放出光子的频率为ν,则它从基态跃迁到n=4的能级吸收的光子频率为多少?
 我就这样看这你1年前0
我就这样看这你1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知氢原子基态能量为-13.6eV,下列说法中正确的有( )
已知氢原子基态能量为-13.6eV,下列说法中正确的有( )
A. 用波长为600nm的光照射时,可使稳定的氢原子电离
B. 用光子能量为10.2eV的光照射时,可能使处于基态的氢原子电离
C. 氢原子可能向外辐射出11eV的光子
D. 氢原子可能吸收能量为1.89eV的光子 iori57231年前1
iori57231年前1 -
 niaohensao 共回答了16个问题
niaohensao 共回答了16个问题 |采纳率93.8%解题思路:要使处于基态的氢原子电离,照射光光子的能量应能使电子从基态跃迁到无限远处,最小频率的电磁波的光子能量应为:hγ=0-E1A、氢原子在基态时所具有的能量为-13.6eV,将其电离变是使电子跃迁到无穷远,根据玻尔理论所需的能量为13.6eV的能量.
hν=0-E1
所以:ν=3.26×1015Hz,根据λ=[c/v]
代入解得:λ=9.2×10-8m
所以波长为600nm的光照射时,不可使稳定的氢原子电离,故A错误,B错误
C、氢原子处于激发态,激发态不稳定,会向基态跃迁,放出的光子能量hγ=Em-En.故C错误
D、氢原子可能吸收能量为1.89eV的光子从2能级跃迁到3能级,故D正确
故选D.点评:
本题考点: 氢原子的能级公式和跃迁;氢原子光谱.
考点点评: 本题考查了氢原子的跃迁公式和波长与频率的关系.1年前查看全部
- 氢原子跃迁光谱问题,一个氢原子由基态跃迁到n=4的激发态时,此氢原子的光谱中为什么只消失一条明线?我想:从4跃到1是放出
氢原子跃迁光谱问题,
一个氢原子由基态跃迁到n=4的激发态时,此氢原子的光谱中为什么只消失一条明线?我想:从4跃到1是放出六种不同光啊反过来不就是消失六条吗?怎么不对呢? bardun1年前1
bardun1年前1 -
 老弟飞 共回答了22个问题
老弟飞 共回答了22个问题 |采纳率90.9%从n=4向n=1跃迁并不一定直接4-1 可能情况有
4-1 4-2 4-3 3-1 3-2 2-1 共6种
而从n=1到n=4只能一次跃迁完 故只有一条亮线1年前查看全部
- 设氢原子的基态能量为E 1 。某激发态的能量为E,则当氢原子从这一激发态跃迁到基态时,所________________
设氢原子的基态能量为E 1 。某激发态的能量为E,则当氢原子从这一激发态跃迁到基态时,所________________-(填“辐射”或“吸收”)的光子在真空中的波长为________。
 haha99991年前0
haha99991年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- E1为氢原子基态能量的绝对值,h为普朗克恒量,c是真空中的光速,当氢原子在最低的三个能级之间跃迁时,氢原子发射光子的波长
E1为氢原子基态能量的绝对值,h为普朗克恒量,c是真空中的光速,当氢原子在最低的三个能级之间跃迁时,氢原子发射光子的波长可能值是( )
A.[hcE1  石柱山上山柱石1年前0
石柱山上山柱石1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 处于n=3激发态的大量氢原子向基态跃迁时所放出的光子中,只有一种光子不能使金属A产生光电效应,则下列说法中正确的是(
处于n=3激发态的大量氢原子向基态跃迁时所放出的光子中,只有一种光子不能使金属A产生光电效应,则下列说法中正确的是( )
A.这种不能使金属A产生光电效应的光子一定是从n=3激发态跃迁到n=2激发态时放出的
B.这种不能使金属A产生光电效应的光子一定是从n=3激发态直接跃迁到基态时放出的
C.若从n=4激发态跃迁到n=3激发态,所放出的光子有可能使金属A产生光电效应
D.若从n=4激发态跃迁到n=2激发态,所放出的光子一定能使金属A产生光电效应 zhzx_lynn1年前1
zhzx_lynn1年前1 -
 8鈅1號 共回答了16个问题
8鈅1號 共回答了16个问题 |采纳率87.5%解题思路:处于n=3激发态的大量氢原子向基态跃迁时所放出光子有3种,不能使金属A产生光电效应的是能量最小的一种.A、处于n=3激发态的大量氢原子向基态跃迁时所放出光子,能量最小的是从能级3到能级2跃迁时放出的,它不能使某金属产生光电效应.故A正确,B错误.
C、从n=4激发态跃迁到n=3激发态放出的光子能量小于从n=3跃迁到n=2所放出的光子能量,所以该光子一定不能使该金属发生光电效应.故C错误.
D、从n=4激发态跃迁到n=2激发态所放出的光子能量大于从n=3跃迁到n=2所放出的光子能量,所以该光子可能使金属A发生光电效应.故D错误.
故选:A.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键掌握光电效应的条件,当光子能量大于金属的逸出功时,可发生光电效应.1年前查看全部
- (1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有______种.
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有______种.
(2)第 IIIA、VA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为______.在GaN晶体中,每个Ga原子与______个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为______.在四大晶体类型中,GaN属于______晶体.
(3)在极性分子NCl3中,N原子的化合物为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是______(填化学式). lchuyl1年前1
lchuyl1年前1 -
 跳加oo后 共回答了20个问题
跳加oo后 共回答了20个问题 |采纳率100%解题思路:(1)前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种;
(2)Ga是31号元素,其基态原子核外有31个电子,根据构造原理书写其原子核外电子排布式;
单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为与但晶硅中Si的结构相似;
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,和水发生水解反应生成氨气和次氯酸.(1)前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种,分别为H、C、O、P、Fe,故答案为:5;
(2)Ga原子是31号元素,Ga原子的电子排布式为1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);GaN晶体结构与单晶硅相似,GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体;
故答案为:1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);4;正四面体;原子;
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,NCl3发生水解反应生成氨气和次氯酸,所以其产物是HClO、NH3,故答案为:HClO、NH3.点评:
本题考点: 判断简单分子或离子的构型;金刚石、二氧化硅等原子晶体的结构与性质的关系.
考点点评: 本题考查了核外电子排布式的书写、分子空间构型、水解反应等知识点,难度较大,注意掌握知识的迁移,由已知推测未知.1年前查看全部
- (2013•河南模拟)氦原子的一个核外电子被电离,会形成类似氢原子结构的氦离子.已知基态的氦离子量为E1=-54.4eV
 (2013•河南模拟)氦原子的一个核外电子被电离,会形成类似氢原子结构的氦离子.已知基态的氦离子量为E1=-54.4eV,氦离子能级的示意图如图所示.可以推知,在具有下列能量的光子中,不能被基态氦离子吸收而发生跃迁的是( )
(2013•河南模拟)氦原子的一个核外电子被电离,会形成类似氢原子结构的氦离子.已知基态的氦离子量为E1=-54.4eV,氦离子能级的示意图如图所示.可以推知,在具有下列能量的光子中,不能被基态氦离子吸收而发生跃迁的是( )
A.40.8 eV
B.43.2 eV
C.51.0 eV
D.54.4 eV zhou0ll1年前1
zhou0ll1年前1 -
 lbhshanghai 共回答了29个问题
lbhshanghai 共回答了29个问题 |采纳率86.2%解题思路:氦离子吸收光子能量发生跃迁,吸收的光子能量需等于两能级间的能级差,或吸收光子能量后,总能量大于等于0,发生电离.A、基态氦离子吸收40.8eV能量,能量变为-54.4+40.8eV=-13.6eV,跃迁到第二能级.故A正确.
B、基态氦离子吸收43.2eV能量,能量变为-54.4+43.2eV=-11.2eV,不能跃迁.故B错误.
C、基态氦离子吸收51.0eV能量,能量变为-54.4+51.0eV=-3.4eV,跃迁到第四能级.故C正确.
D、基态氦离子吸收54.4eV能量,能量变为-54.4+54.4eV=0eV,氦离子发生电离,该光子能被吸收.故D正确.
本题选不能被吸收的,故选B.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键知道能级差与吸收或辐射光子能量的关系,即Em-En=hv.1年前查看全部
- 有七个电子轨道为什么是铝有个问题是:某基态原子有7个电子轨道.结果是铝.为什么不是硅呢?电子排布式最后面一个为什么是3p
有七个电子轨道为什么是铝
有个问题是:某基态原子有7个电子轨道.结果是铝.为什么不是硅呢?电子排布式最后面一个为什么是3p1而不是3p2? 热face爱蹭冷臀部1年前1
热face爱蹭冷臀部1年前1 -
 sinlas 共回答了19个问题
sinlas 共回答了19个问题 |采纳率94.7%铝为1s22s22p63s23p1 ,硅的话为1s22s22p63s23p2,根据泡利不相容原理电子尽量占不同轨道且自旋相同,所以3p占了两个轨道,共八轨道1年前查看全部
- 地面附近一颗质量为m的人造卫星,其德布罗意波长为___;一个处于基态的氢原子核外电子的德布罗意波长为___.(地球半径R
地面附近一颗质量为m的人造卫星,其德布罗意波长为___;一个处于基态的氢原子核外电子的德布罗意波长为___.(地球半径R,重力加速度g,基态电子轨道半径r,电子质量m)
 静静的蝉1年前1
静静的蝉1年前1 -
 拒捕的野猫 共回答了15个问题
拒捕的野猫 共回答了15个问题 |采纳率93.3%解题思路:根据德布罗意波长的公式,结合求动量公式即可求解.德布罗意波长为λ=[h/P],地面附近一颗质量为m的人造卫星:p=mv,v=
gR,所以:λ=
h
m
gR;
处于基态的氢原子核外电子:
ke2
r2=m
V′2
r,所以λ=
h
e
km
r
故答案为:
h
m
gR,
h
e
km点评:
本题考点: 光的波粒二象性
考点点评: 注意近地面卫星的速度公式和电子的绕核运动的公式应用.1年前查看全部
- 下列说法正确的是( )A.氢原子从第二能级跃迁到基态时,要吸收能量B.氢原子光谱是分立的谱线,说明氢原子能量是不连续的
下列说法正确的是( )
A.氢原子从第二能级跃迁到基态时,要吸收能量
B.氢原子光谱是分立的谱线,说明氢原子能量是不连续的
C.用一束光照射铅板没有发生光电效应,若增加光的强度铅板一定会发生光电效应
D.光电效应有力地说明了光具有波动性 单打独斗的懒猪1年前1
单打独斗的懒猪1年前1 -
 xiaomaox 共回答了12个问题
xiaomaox 共回答了12个问题 |采纳率100%解题思路:氢原子从高能级跃迁到基态时,要释放能量,氢原子光谱说明辐射的光子能量是量子化的,则氢原子能级是分立的.
发生光电效应的条件是入射光的频率大于金属的极限频率,极限频率越大的金属逸出功越大,且极限频率与波长成反比.A、氢原子从第二能级跃迁到基态时,要释放能量,故A错误;
B、氢原子光谱是分立的谱线,说明氢原子能量是不连续的,故B正确;
C、用一束光照射铅板没有发生光电效应,发生光电效应的条件是入射光的频率大于金属的极限频率,若增加光的强度铅板一定不会发生光电效应,故C错误;
D、光电效应有力地说明了光具有粒子性,故D错误;
故选:B.点评:
本题考点: 原子核衰变及半衰期、衰变速度;光电效应.
考点点评: 本题考查了玻尔理论、能级跃迁、光电效应的条件,难度不大,关键要熟悉教材,加强训练.1年前查看全部
- 原子能级的原子在激发态,发光 怎么箭头是有基态 指向上面啊 ,那不是原子有低级向高级跃迁吗? 波尔不是说 原子由高级向低
原子能级的
原子在激发态,发光 怎么箭头是有基态 指向上面啊 ,那不是原子有低级向高级跃迁吗? 波尔不是说 原子由高级向低级跃迁吗? 邹瑜1年前2
邹瑜1年前2 -
 瞬-沈阳 共回答了18个问题
瞬-沈阳 共回答了18个问题 |采纳率94.4%如果吸收能量就由低向高,如果放出能量就由高向低1年前查看全部
- (2011•南昌模拟)氢原子能级如图所示,氢原子基态能量E1=-13.6eV,氢的核外电子的第一条可能轨道的半径为r1=
 (2011•南昌模拟)氢原子能级如图所示,氢原子基态能量E1=-13.6eV,氢的核外电子的第一条可能轨道的半径为r1=0.53×10-10m..氢的核外电子的第n条可能轨道的半径为rn=n2r1求氢原子处于n=4激发态时:(电子的质量m=0.9×10-30kg)1)电子在轨道上运动的动能;2)电子具有的电势能;(以上各问题结果均保留两位有效数字,能量值以电子伏为单位)
(2011•南昌模拟)氢原子能级如图所示,氢原子基态能量E1=-13.6eV,氢的核外电子的第一条可能轨道的半径为r1=0.53×10-10m..氢的核外电子的第n条可能轨道的半径为rn=n2r1求氢原子处于n=4激发态时:(电子的质量m=0.9×10-30kg)1)电子在轨道上运动的动能;2)电子具有的电势能;(以上各问题结果均保留两位有效数字,能量值以电子伏为单位)  我认识体胖子1年前1
我认识体胖子1年前1 -
 吴有利 共回答了19个问题
吴有利 共回答了19个问题 |采纳率78.9%解题思路:(1)根据库仑引力提供电子做圆周运动的向心力,求出电子在轨道上的动能.
(2)原子的能量等于电势能和电子动能之和,求出原子在n=4激发态的能量,从而求出电子具有的电势能.(1)由k
e2
r42=m
v2
r4得,
EK4=
1
2mv2=
1
2
ke2
r4.
又r4=16r1
所以EK4=
ke2
32r1=
9×109×(1.6×10−19)2
32×0.53×10−10J=0.85eV.
(2)E4=
E1
n2=
−13.6eV
16=−0.85eV
所以电子具有的电势能E′=E-EK4=-0.85-0.85eV=-1.7eV.
答:(1)电子在轨道上的动能为0.85eV.
(2)电子具有的电势能为-1.7eV.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键知道原子的能量等于电势能与电子动能之和,会通过库仑引力提供向心力求出电子的动能.1年前查看全部
- 元素X的基态原子最外层电子排布为nsn-1npn+2,则X元素的原子序数为( )
元素X的基态原子最外层电子排布为nsn-1npn+2,则X元素的原子序数为( )
A. 9
B. 10
C. 17
D. 18 舒亦纤尘1年前1
舒亦纤尘1年前1 -
 匠人爱芳直 共回答了14个问题
匠人爱芳直 共回答了14个问题 |采纳率85.7%解题思路:根据排布规律可知nsn-1应排满,为2个电子,故n=3,元素X的基态原子最外层电子排布为3s2np5.nsn-1应排满,为2个电子,故n=3,元素X的基态原子最外层电子排布为3s2np5,为Cl元素,故选C.
点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查原子结构与元素的性质,难度不大,注意根据构造原理,先排能量低的再排能量高的.1年前查看全部
大家在问
- 1如图所示,有一n匝矩形线圈abcd放置在水平面内,磁场方向与水平方向成α角,已知sinα=0.8,回路面积为S,磁感应强
- 2梨树、阳光、细菌分别属于生态系统中的哪种成分?它们在生态系统中的作用分别是什么?请你通过连线来表示.
- 3海洋表层盐度、温度随纬度的变化规律是什么?
- 4同义句,The students in our school are in school uniforma,与The s
- 5一个分子的动能包括这个分子的动能和势能,对还是错?为什么?
- 6现有四种说法:①-a表示负数;②若|x|=-x,则x<0;③绝对值最小的有理数是0;④3×102x2y是5次单项式;其中
- 7(2013•云南)如图所示是某同学“测定小灯泡电功率”时连接的电路,小灯泡额定电压为2.5V,所用电源电压恒为3V.
- 8已知abc=1,算式:2a+2b+2c+1+1+1=?
- 9下列函数中,既是奇函数又是减函数的是( )
- 10明明喝一瓶果汁,分四次喝完,第一次喝了一瓶果汁的1/5...
- 11证明当x趋于0时,函数y=(1+x∧2)/x是无穷大
- 12谁知道reaction和effect的区别
- 13如图,在四边形ABCD中,AB‖CD,∠B=∠C=90°,AB=2,BC=7,CD=6能否在BC上找到一点P,使图中阴影
- 14钢结构除锈中怎样把重量换算成平方呀?
- 15如图,△ABC的三条中线AD,BE,CF的长分别是5,12,13.求△ABC的面积
