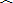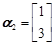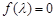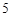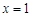选修2-2的目录
 巫塔塔2022-10-04 11:39:541条回答
巫塔塔2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 特别能战斗1 共回答了22个问题
特别能战斗1 共回答了22个问题 |采纳率100%- 数学选修2-2》
第一章 推理与证明
§1 归纳与类比
1.1归纳推理
2.2类比推理
§2 综合法与分析法
2.1综合法
2.2分析法
§3 反证法
§4 数学归纳法
本章小结建议
复习题一
第二章 变化率与导数
§1 变化率的快慢与变化率
§2 导数的概念及其几何意义
2.1导数的概念
2.2导数的几何意义
§3 计算导数
§4 导数的四则运算法则
4.1导数的加法与减法法则
4.2导数的乘法与除法法则
§5 复合函数的求导法则
本章小结建议
复习题二
第三章 导数的应用
§1 函数的单调性与极值
1.1导数与函数的单调性
1.2函数的极值
§2 导数在实际问题中的应用
2.1实际问题中导数的意义
2.2最大值、最小值问题
本章小结建议
复习题三
第四章 定积分
§1 定积分的概念
1.1定积分的背景——面积和路程问题
1.2定积分
§2 微积分基本定理
§3 定积分的简单应用
3.1平面图形的面积
3.2简单几何体的体积
阅读材料 数学史上的丰碑——微积分
本章小结建议
复习题四
第五章 数系的扩充与复数的引入
§1 数系的扩充与复数的引入
1.1数系概念的扩展
1.2复数的有关概念
§2 复数的四则运算
2.1复数的加法与减法
2.2复数的乘法与除法
阅读材料 数的扩充
本章小结建议
复习题五 - 1年前
相关推荐
- 4位同学每人从甲、乙、丙3门课程中选修1门,则恰有2人选修课程甲的不同选法有多少种?
4位同学每人从甲、乙、丙3门课程中选修1门,则恰有2人选修课程甲的不同选法有多少种?
如4个选一个是C(4,2)=6,接着又因该怎么解释,为会要6*4?4是怎么来的?有没有公式?根据是什么(有没有其它多种根据)
为什么要6*4,前面不是已经从4个中选了两个出来了吗,为何还要乘以另外两个没选甲的? zx849642171年前1
zx849642171年前1 -
 D-steven 共回答了18个问题
D-steven 共回答了18个问题 |采纳率94.4%是这样的 这个是排列组合的题目,分两步
第一步:先找出选择甲课程的那两个同学,于是C(4,2)=6;
第二步:剩下了两个同学和两门课,只考虑他们的课程的情况.当然是2*2=4;
综合起来当然就是6*4=24了1年前查看全部
- 高二选修2-1数学圆锥曲线一章椭圆与直线交于两点A、B,弦AB的长可以用 根号(1-k的平方)绝对值(x1-x2) 计算
高二选修2-1数学圆锥曲线一章
椭圆与直线交于两点A、B,弦AB的长可以用
根号(1-k的平方)绝对值(x1-x2) 计算(那公式不能粘贴!对不起了!百度需要改进啊!)
这个弦长公式怎么来的?大概讲下,或者哪有,把地址粘贴过来,
√(1+k^2)|x1-x2| loveinmyheart1年前3
loveinmyheart1年前3 -
 PollyJ 共回答了14个问题
PollyJ 共回答了14个问题 |采纳率85.7%http://hi.baidu.com/xiangzi%5F4444/blog/item/e030283ef8901deb54e723bc.html
这是我的博客 我这里给出了说明1年前查看全部
- (2012•河南二模)选修4-5:不等式选讲
(2012•河南二模)选修4-5:不等式选讲
设f(x)=2|x|-|x+3|.
(1)求不等式f(x)≤7的解集S;
(2)若关于x的不等式f(x)+|2t-3|≤0有解,求参数t的取值范围. 读月童子1年前0
读月童子1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 人教版化学选修4知识点总结 笔记形式
 巡弋平1年前1
巡弋平1年前1 -
 故事1986 共回答了21个问题
故事1986 共回答了21个问题 |采纳率90.5%高中化学选修4知识点总结
第1章、化学反应与能量转化
化学反应的实质是反应物化学键的断裂和生成物化学键的形成,化学反应过程中伴随着能量的释放或吸收.
一、化学反应的热效应
1、化学反应的反应热
(1)反应热的概念:
当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热.用符号Q表示.
(2)反应热与吸热反应、放热反应的关系.
Q>0时,反应为吸热反应;Q<0时,反应为放热反应.
(3)反应热的测定
测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下:
Q=-C(T2-T1)
式中C表示体系的热容,T1、T2分别表示反应前和反应后体系的温度.实验室经常测定中和反应的反应热.
2、化学反应的焓变
(1)反应焓变
物质所具有的能量是物质固有的性质,可以用称为“焓”的物理量来描述,符号为H,单位为kJ·mol-1.
反应产物的总焓与反应物的总焓之差称为反应焓变,用ΔH表示.
(2)反应焓变ΔH与反应热Q的关系.
对于等压条件下进行的化学反应,若反应中物质的能量变化全部转化为热能,则该反应的反应热等于反应焓变,其数学表达式为:Qp=ΔH=H(反应产物)-H(反应物).
(3)反应焓变与吸热反应,放热反应的关系:
ΔH>0,反应吸收能量,为吸热反应.
ΔH<0,反应释放能量,为放热反应.
(4)反应焓变与热化学方程式:
把一个化学反应中物质的变化和反应焓变同时表示出来的化学方程式称为热化学方程式,如:H2(g)+O2(g)=H2O(l);ΔH(298K)=-285.8kJ·mol-1
书写热化学方程式应注意以下几点:
①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq).
②化学方程式后面写上反应焓变ΔH,ΔH的单位是J·mol-1或 kJ·mol-1,且ΔH后注明反应温度.
③热化学方程式中物质的系数加倍,ΔH的数值也相应加倍.
3、反应焓变的计算
(1)盖斯定律
对于一个化学反应,无论是一步完成,还是分几步完成,其反应焓变一样,这一规律称为盖斯定律.
(2)利用盖斯定律进行反应焓变的计算.
常见题型是给出几个热化学方程式,合并出题目所求的热化学方程式,根据盖斯定律可知,该方程式的ΔH为上述各热化学方程式的ΔH的代数和.
(3)根据标准摩尔生成焓,ΔfHmθ计算反应焓变ΔH.
对任意反应:aA+bB=cC+dD
ΔH=[cΔfHmθ(C)+dΔfHmθ(D)]-[aΔfHmθ(A)+bΔfHmθ(B)]
二、电能转化为化学能——电解
1、电解的原理
(1)电解的概念:
在直流电作用下,电解质在两上电极上分别发生氧化反应和还原反应的过程叫做电解.电能转化为化学能的装置叫做电解池.
(2)电极反应:以电解熔融的NaCl为例:
阳极:与电源正极相连的电极称为阳极,阳极发生氧化反应:2Cl-→Cl2↑+2e-.
阴极:与电源负极相连的电极称为阴极,阴极发生还原反应:Na++e-→Na.
总方程式:2NaCl(熔)2Na+Cl2↑
2、电解原理的应用
(1)电解食盐水制备烧碱、氯气和氢气.
阳极:2Cl-→Cl2+2e-
阴极:2H++e-→H2↑
总反应:2NaCl+2H2O2NaOH+H2↑+Cl2↑
(2)铜的电解精炼.
粗铜(含Zn、Ni、Fe、Ag、Au、Pt)为阳极,精铜为阴极,CuSO4溶液为电解质溶液.
阳极反应:Cu→Cu2++2e-,还发生几个副反应
Zn→Zn2++2e-;Ni→Ni2++2e-
Fe→Fe2++2e-
Au、Ag、Pt等不反应,沉积在电解池底部形成阳极泥.
阴极反应:Cu2++2e-→Cu
(3)电镀:以铁表面镀铜为例
待镀金属Fe为阴极,镀层金属Cu为阳极,CuSO4溶液为电解质溶液.
阳极反应:Cu→Cu2++2e-
阴极反应: Cu2++2e-→Cu
三、化学能转化为电能——电池
1、原电池的工作原理
(1)原电池的概念:
把化学能转变为电能的装置称为原电池.
(2)Cu-Zn原电池的工作原理:
如图为Cu-Zn原电池,其中Zn为负极,Cu为正极,构成闭合回路后的现象是:Zn片逐渐溶解,Cu片上有气泡产生,电流计指针发生偏转.该原电池反应原理为:Zn失电子,负极反应为:Zn→Zn2++2e-;Cu得电子,正极反应为:2H++2e-→H2.电子定向移动形成电流.总反应为:Zn+CuSO4=ZnSO4+Cu.
(3)原电池的电能
若两种金属做电极,活泼金属为负极,不活泼金属为正极;若一种金属和一种非金属做电极,金属为负极,非金属为正极.
2、化学电源
(1)锌锰干电池
负极反应:Zn→Zn2++2e-;
正极反应:2NH4++2e-→2NH3+H2;
(2)铅蓄电池
负极反应:Pb+SO42-PbSO4+2e-
正极反应:PbO2+4H++SO42-+2e-PbSO4+2H2O
放电时总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O.
充电时总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4.
(3)氢氧燃料电池
负极反应:2H2+4OH-→4H2O+4e-
正极反应:O2+2H2O+4e-→4OH-
电池总反应:2H2+O2=2H2O
3、金属的腐蚀与防护
(1)金属腐蚀
金属表面与周围物质发生化学反应或因电化学作用而遭到破坏的过程称为金属腐蚀.
(2)金属腐蚀的电化学原理.
生铁中含有碳,遇有雨水可形成原电池,铁为负极,电极反应为:Fe→Fe2++2e-.水膜中溶解的氧气被还原,正极反应为:O2+2H2O+4e-→4OH-,该腐蚀为“吸氧腐蚀”,总反应为:2Fe+O2+2H2O=2Fe(OH)2,Fe(OH)2又立即被氧化:4Fe(OH)2+2H2O+O2=4Fe(OH)3,Fe(OH)3分解转化为铁锈.若水膜在酸度较高的环境下,正极反应为:2H++2e-→H2↑,该腐蚀称为“析氢腐蚀”.
(3)金属的防护
金属处于干燥的环境下,或在金属表面刷油漆、陶瓷、沥青、塑料及电镀一层耐腐蚀性强的金属防护层,破坏原电池形成的条件.从而达到对金属的防护;也可以利用原电池原理,采用牺牲阳极保护法.也可以利用电解原理,采用外加电流阴极保护法.
第2章、化学反应的方向、限度与速率(1、2节)
原电池的反应都是自发进行的反应,电解池的反应很多不是自发进行的,如何判定反应是否自发进行呢?
一、化学反应的方向
1、反应焓变与反应方向
放热反应多数能自发进行,即ΔH<0的反应大多能自发进行.有些吸热反应也能自发进行.如NH4HCO3与CH3COOH的反应.有些吸热反应室温下不能进行,但在较高温度下能自发进行,如CaCO3高温下分解生成CaO、CO2.
2、反应熵变与反应方向
熵是描述体系混乱度的概念,熵值越大,体系混乱度越大.反应的熵变ΔS为反应产物总熵与反应物总熵之差.产生气体的反应为熵增加反应,熵增加有利于反应的自发进行.
3、焓变与熵变对反应方向的共同影响
ΔH-TΔS<0反应能自发进行.
ΔH-TΔS=0反应达到平衡状态.
ΔH-TΔS>0反应不能自发进行.
在温度、压强一定的条件下,自发反应总是向ΔH-TΔS<0的方向进行,直至平衡状态.
二、化学反应的限度
1、化学平衡常数
(1)对达到平衡的可逆反应,生成物浓度的系数次方的乘积与反应物浓度的系数次方的乘积之比为一常数,该常数称为化学平衡常数,用符号K表示 .
(2)平衡常数K的大小反映了化学反应可能进行的程度(即反应限度),平衡常数越大,说明反应可以进行得越完全.
(3)平衡常数表达式与化学方程式的书写方式有关.对于给定的可逆反应,正逆反应的平衡常数互为倒数.
(4)借助平衡常数,可以判断反应是否到平衡状态:当反应的浓度商Qc与平衡常数Kc相等时,说明反应达到平衡状态.
2、反应的平衡转化率
(1)平衡转化率是用转化的反应物的浓度与该反应物初始浓度的比值来表示.如反应物A的平衡转化率的表达式为:
α(A)=
(2)平衡正向移动不一定使反应物的平衡转化率提高.提高一种反应物的浓度,可使另一反应物的平衡转化率提高.
(3)平衡常数与反应物的平衡转化率之间可以相互计算.
3、反应条件对化学平衡的影响
(1)温度的影响
升高温度使化学平衡向吸热方向移动;降低温度使化学平衡向放热方向移动.温度对化学平衡的影响是通过改变平衡常数实现的.
(2)浓度的影响
增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动;增大反应物浓度或减小生成物浓度,平衡向正反应方向移动.
温度一定时,改变浓度能引起平衡移动,但平衡常数不变.化工生产中,常通过增加某一价廉易得的反应物浓度,来提高另一昂贵的反应物的转化率.
(3)压强的影响
ΔVg=0的反应,改变压强,化学平衡状态不变.
ΔVg≠0的反应,增大压强,化学平衡向气态物质体积减小的方向移动.
(4)勒夏特列原理
由温度、浓度、压强对平衡移动的影响可得出勒夏特列原理:如果改变影响平衡的一个条件(浓度、压强、温度等)平衡向能够减弱这种改变的方向移动.
【例题分析】
例1、已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol
(3)Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式 .
解析:依据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的.我们可从题目中所给的有关方程式进行分析:从方程式(3)与方程式(1)可以看出有我们需要的有关物质,但方程式(3)必须通过方程式(2)有关物质才能和方程式(1)结合在一起.
将方程式(3)×2+方程式(2);可表示为(3)×2+(2)
得:2Fe3O4(s)+2CO(g)+3Fe2O3(s)+CO(g)=6FeO(s)+2CO2(g)+2Fe3O4(s)+CO2(g);ΔH=+19kJ/mol×2+(-47kJ/mol)
整理得方程式(4):Fe2O3(s)+CO(g)=2FeO(s)+CO2(g);ΔH=-3kJ/mol
将(1)-(4)得2CO(g)=2Fe(s)+3CO2(g)-2FeO(s)-CO2(g);ΔH=-25kJ/mol-(-3kJ/mol)
整理得:FeO(s)+CO(s)=Fe(s)+CO2(g);ΔH=-11kJ/mol
答案:FeO(s)+CO(s)=Fe(s)+CO2(g);ΔH=-11kJ/mol
例2、熔融盐燃料电池具有高的发电效率,因而得到重视,可用Li2CO3和Na2CO3的熔融盐混合物作用电解质,CO为阳极燃气,空气与CO2的混合气体为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
阳极反应式:2CO+2CO32-→4CO2+4e-
阴极反应式: ;
总电池反应式: .
解析: 作为燃料电池,总的效果就是把燃料进行燃烧.本题中CO为还原剂,空气中O2为氧化剂,电池总反应式为:2CO+O2=2CO2.用总反应式减去电池负极(即题目指的阳极)反应式,就可得到电池正极(即题目指的阴极)反应式:O2+2CO2+4e-=2CO32- .
答案:O2+2CO2+4e-=2CO32-;2CO+O2=2CO2
例3、下列有关反应的方向说法中正确的是( )
A、放热的自发过程都是熵值减小的过程.
B、吸热的自发过程常常是熵值增加的过程.
C、水自发地从高处流向低处,是趋向能量最低状态的倾向.
D、只根据焓变来判断化学反应的方向是可以的.
解析:放热的自发过程可能使熵值减小、增加或无明显变化,故A错误.只根据焓变来判断反应进行的方向是片面的,要用能量判据、熵判据组成的复合判据来判断,D错误.水自发地从高处流向低处,是趋向能量最低状态的倾向是正确的.有些吸热反应也可以自发进行.如在25℃和1.01×105Pa时,2N2O5(g)=4NO2(g)+O2(g);ΔH=56.7kJ/mol,(NH4)2CO3(s)=NH4HCO3(s)+NH3(g);ΔH=74.9kJ/mol,上述两个反应都是吸热反应,又都是熵增的反应,所以B也正确.
答案:BC.
化学反应原理复习(二)
【知识讲解】
第2章、第3、4节
一、化学反应的速率
1、化学反应是怎样进行的
(1)基元反应:能够一步完成的反应称为基元反应,大多数化学反应都是分几步完成的.
(2)反应历程:平时写的化学方程式是由几个基元反应组成的总反应.总反应中用基元反应构成的反应序列称为反应历程,又称反应机理.
(3)不同反应的反应历程不同.同一反应在不同条件下的反应历程也可能不同,反应历程的差别又造成了反应速率的不同.
2、化学反应速率
(1)概念:
单位时间内反应物的减小量或生成物的增加量可以表示反应的快慢,即反应的速率,用符号v表示.
(2)表达式:
(3)特点
对某一具体反应,用不同物质表示化学反应速率时所得的数值可能不同,但各物质表示的化学反应速率之比等于化学方程式中各物质的系数之比.
3、浓度对反应速率的影响
(1)反应速率常数(K)
反应速率常数(K)表示单位浓度下的化学反应速率,通常,反应速率常数越大,反应进行得越快.反应速率常数与浓度无关,受温度、催化剂、固体表面性质等因素的影响.
(2)浓度对反应速率的影响
增大反应物浓度,正反应速率增大,减小反应物浓度,正反应速率减小.
增大生成物浓度,逆反应速率增大,减小生成物浓度,逆反应速率减小.
(3)压强对反应速率的影响
压强只影响气体,对只涉及固体、液体的反应,压强的改变对反应速率几乎无影响.
压强对反应速率的影响,实际上是浓度对反应速率的影响,因为压强的改变是通过改变容器容积引起的.压缩容器容积,气体压强增大,气体物质的浓度都增大,正、逆反应速率都增加;增大容器容积,气体压强减小;气体物质的浓度都减小,正、逆反应速率都减小.
4、温度对化学反应速率的影响
(1)经验公式
阿伦尼乌斯总结出了反应速率常数与温度之间关系的经验公式:
式中A为比例系数,e为自然对数的底,R为摩尔气体常数量,Ea为活化能.
由公式知,当Ea>0时,升高温度,反应速率常数增大,化学反应速率也随之增大.可知,温度对化学反应速率的影响与活化能有关.
(2)活化能Ea.
活化能Ea是活化分子的平均能量与反应物分子平均能量之差.不同反应的活化能不同,有的相差很大.活化能 Ea值越大,改变温度对反应速率的影响越大.
5、催化剂对化学反应速率的影响
(1)催化剂对化学反应速率影响的规律:
催化剂大多能加快反应速率,原因是催化剂能通过参加反应,改变反应历程,降低反应的活化能来有效提高反应速率.
(2)催化剂的特点:
催化剂能加快反应速率而在反应前后本身的质量和化学性质不变.
催化剂具有选择性.
催化剂不能改变化学反应的平衡常数,不引起化学平衡的移动,不能改变平衡转化率.
二、化学反应条件的优化——工业合成氨
1、合成氨反应的限度
合成氨反应是一个放热反应,同时也是气体物质的量减小的熵减反应,故降低温度、增大压强将有利于化学平衡向生成氨的方向移动.
2、合成氨反应的速率
(1)高压既有利于平衡向生成氨的方向移动,又使反应速率加快,但高压对设备的要求也高,故压强不能特别大.
(2)反应过程中将氨从混合气中分离出去,能保持较高的反应速率.
(3)温度越高,反应速率进行得越快,但温度过高,平衡向氨分解的方向移动,不利于氨的合成.
(4)加入催化剂能大幅度加快反应速率.
3、合成氨的适宜条件
在合成氨生产中,达到高转化率与高反应速率所需要的条件有时是矛盾的,故应该寻找以较高反应速率并获得适当平衡转化率的反应条件:一般用铁做催化剂 ,制反应温度在700K左右,压强范围大致在1×107Pa~1×108Pa 之间,并采用N2与H2分压为1∶2.8的投料比.
第3章、物质在水溶液中的行为
一、水溶液
1、水的电离
H2OH++OH-
水的离子积常数KW=[H+][OH-],25℃时,KW=1.0×10-14mol2·L-2.温度升高,有利于水的电离, KW增大.
2、溶液的酸碱度
室温下,中性溶液:[H+]=[OH-]=1.0×10-7mol·L-1,pH=7
酸性溶液:[H+]>[OH-],[ H+]>1.0×10-7mol·L-1,pH<7
碱性溶液:[H+]<[OH-],[OH-]>1.0×10-7mol·L-1,pH>7
3、电解质在水溶液中的存在形态
(1)强电解质
强电解质是在稀的水溶液中完全电离的电解质,强电解质在溶液中以离子形式存在,主要包括强酸、强碱和绝大多数盐,书写电离方程式时用“=”表示.
(2)弱电解质
在水溶液中部分电离的电解质,在水溶液中主要以分子形态存在,少部分以离子形态存在,存在电离平衡,主要包括弱酸、弱碱、水及极少数盐,书写电离方程式时用“ ”表示.
二、弱电解质的电离及盐类水解
1、弱电解质的电离平衡.
(1)电离平衡常数
在一定条件下达到电离平衡时,弱电解质电离形成的各种离子浓度的乘积与溶液中未电离的分子浓度之比为一常数,叫电离平衡常数.
弱酸的电离平衡常数越大,达到电离平衡时,电离出的H+越多.多元弱酸分步电离,且每步电离都有各自的电离平衡常数,以第一步电离为主.
(2)影响电离平衡的因素,以CH3COOHCH3COO-+H+为例.
加水、加冰醋酸,加碱、升温,使CH3COOH的电离平衡正向移动,加入CH3COONa固体,加入浓盐酸,降温使CH3COOH电离平衡逆向移动.
2、盐类水解
(1)水解实质
盐溶于水后电离出的离子与水电离的H+或OH-结合生成弱酸或弱碱,从而打破水的电离平衡,使水继续电离,称为盐类水解.
(2)水解类型及规律
①强酸弱碱盐水解显酸性.
NH4Cl+H2ONH3·H2O+HCl
②强碱弱酸盐水解显碱性.
CH3COONa+H2OCH3COOH+NaOH
③强酸强碱盐不水解.
④弱酸弱碱盐双水解.
Al2S3+6H2O=2Al(OH)3↓+3H2S↑
(3)水解平衡的移动
加热、加水可以促进盐的水解,加入酸或碱能抑止盐的水解,另外,弱酸根阴离子与弱碱阳离子相混合时相互促进水解.
三、沉淀溶解平衡
1、沉淀溶解平衡与溶度积
(1)概念
当固体溶于水时,固体溶于水的速率和离子结合为固体的速率相等时,固体的溶解与沉淀的生成达到平衡状态,称为沉淀溶解平衡.其平衡常数叫做溶度积常数,简称溶度积,用Ksp表示.
PbI2(s)Pb2+(aq)+2I-(aq)
Ksp=[Pb2+][I-]2=7.1×10-9mol3·L-3
(2)溶度积Ksp的特点
Ksp只与难溶电解质的性质和温度有关,与沉淀的量无关,且溶液中离子浓度的变化能引起平衡移动,但并不改变溶度积.
Ksp反映了难溶电解质在水中的溶解能力.
2、沉淀溶解平衡的应用
(1)沉淀的溶解与生成
根据浓度商Qc与溶度积Ksp的大小比较,规则如下:
Qc=Ksp时,处于沉淀溶解平衡状态.
Qc>Ksp时,溶液中的离子结合为沉淀至平衡.
Qc<Ksp时,体系中若有足量固体,固体溶解至平衡.
(2)沉淀的转化
根据溶度积的大小,可以将溶度积大的沉淀可转化为溶度积更小的沉淀,这叫做沉淀的转化.沉淀转化实质为沉淀溶解平衡的移动.
四、离子反应
1、离子反应发生的条件
(1)生成沉淀
既有溶液中的离子直接结合为沉淀,又有沉淀的转化.
(2)生成弱电解质
主要是H+与弱酸根生成弱酸,或OH-与弱碱阳离子生成弱碱,或H+与OH-生成H2O.
(3)生成气体
生成弱酸时,很多弱酸能分解生成气体.
(4)发生氧化还原反应
强氧化性的离子与强还原性离子易发生氧化还原反应,且大多在酸性条件下发生.
2、离子反应能否进行的理论判据
(1)根据焓变与熵变判据
对ΔH-TΔS<0的离子反应,室温下都能自发进行.
(2)根据平衡常数判据
离子反应的平衡常数很大时,表明反应的趋势很大.
3、离子反应的应用
(1)判断溶液中离子能否大量共存
相互间能发生反应的离子不能大量共存,注意题目中的隐含条件.
(2)用于物质的定性检验
根据离子的特性反应,主要是沉淀的颜色或气体的生成,定性检验特征性离子.
(3)用于离子的定量计算
常见的有酸碱中和滴定法、氧化还原滴定法.
(4)生活中常见的离子反应.
硬水的形成及软化涉及到的离子反应较多,主要有:
Ca2+、Mg2+的形成.
CaCO3+CO2+H2O=Ca2++2HCO3-
MgCO3+CO2+H2O=Mg2++2HCO3-
加热煮沸法降低水的硬度:
Ca2++2HCO3-CaCO3↓+CO2↑+H2O
Mg2++2HCO3-MgCO3↓+CO2↑+H2O
或加入Na2CO3软化硬水:
Ca2++CO32-=CaCO3↓,Mg2++CO32-=MgCO3↓1年前查看全部
- 的翻译普通高中课程标准实验教科书 语文 选修2 唐宋散文选读 第六课 六一居士传的翻译,谢谢!
 纳木措畔1年前1
纳木措畔1年前1 -
 诸子百家 共回答了19个问题
诸子百家 共回答了19个问题 |采纳率100%普通高中课程标准实验教科书
(语文版)选修2 唐宋散文选读 第六课 六一居士传
仔细看1年前查看全部
- 数学选修2-1第30页题目,最好有答案.忘记把书带回家了.作业是30页的题.求助啊求助!越快越好啊,仅限今晚啊!
数学选修2-1第30页题目,最好有答案.忘记把书带回家了.作业是30页的题.求助啊求助!越快越好啊,仅限今晚啊!
救命啊!有没有人啊!!作业多啊!数学无法啊!没有书没有题没法做啊!!好心人出来吧!明早前告诉我就好啊 gpf2147151年前0
gpf2147151年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 重难点手册选修3-1 ,139页 第二章 恒定电流 5(3),小量程的电流表G(表头) 5(3)
重难点手册选修3-1 ,139页 第二章 恒定电流 5(3),小量程的电流表G(表头) 5(3)
(3) 指针偏转到最大刻度时的电流Ig叫做满偏电流;满偏电压Ug=IgRg.
关于5(3)“指针偏转到最大刻度的电流”请直接告诉我指针偏转到啥子叫最大刻度的电流,我晓得这是定义,但后半句话,我不晓得指针偏转到最大时的电流.怎么求满偏电压.我晓得欧姆定律,但我不晓得为什么在这个电流时电阻是这么多. wdhkd1年前1
wdhkd1年前1 -
 whufanz 共回答了17个问题
whufanz 共回答了17个问题 |采纳率76.5%电流表你总该用过吧 小量程电流表也是电流表 ,也是通过指针所指的刻度来读数的 .
小量程电流表指针偏转到最大刻度的电流 —— 也就是当电流表的指针偏转到刻度盘上的数字最大的刻度线位置时 ,流过小量程电流表的电流 .
满偏电压 就是电流最大(即满偏电流)时小量程电流表两端的电压 ,因为此时电流为 Ig ,而小量程电流表的内阻用 Rg表示 ,所以 ,此时电压为 IgRg (用符号 Ug表示 ,所以有 Ug=IgRg ).1年前查看全部
- 化学选修五红对勾期末测试选择题答案
 woshiacool1年前1
woshiacool1年前1 -
 vivian_blue1104 共回答了22个问题
vivian_blue1104 共回答了22个问题 |采纳率90.9%http://wenku.baidu.com/view/7cbf763743323968011c9255.html
希望可以帮助你1年前查看全部
- 数学选修2—1 62页A组第六题
 cici配1年前3
cici配1年前3 -
 seulyleon 共回答了16个问题
seulyleon 共回答了16个问题 |采纳率81.3%由题意知设双曲线的方程为
x^2/a^2-y^2/a^2=1(a>0)
又过A(3,-1)
∴a^2=8
得 x^2/8-y^2/8=1
即x^2-y^2=8
在网上找了好久才找到你们的教材,若不懂,1年前查看全部
- 关于化学竞赛本人情况如下,高中化学基础还不错.现在高二,在学选修2化学与技术.选修4化学反应原理还未讲.化学考试100/
关于化学竞赛
本人情况如下,高中化学基础还不错.现在高二,在学选修2化学与技术.选修4化学反应原理还未讲.化学考试100/108吧.总分 500/750 因为英语,语文偏科.所以想学一学化学奥赛.我对化学非常有兴趣,想大学读化学专业.比如高分子材料什么的.
问题:1、现在高二学奥赛还来得及吗?
2、怎么学?时间问题怎么解决?(比如上课的时候干嘛?)
3、需要些什么书?
4、重庆市奥赛的***是什么?
 whyx01年前1
whyx01年前1 -
 allen_zhang 共回答了19个问题
allen_zhang 共回答了19个问题 |采纳率84.2%看大学教材,大学里有四大基础课,无机化学 有机化学 分析化学 物理化学,主要是无机化学和有机化学好好看,再做竞赛题.高中的东西还是学的很浅的,大学那两本教材是必须自学的.祝你好运!1年前查看全部
- (选修3-3选做题)已知潜水员在岸上和海底吸入空气的密度分别为1.3kg/m 3 和2.1kg/m 3 ,空气的摩尔质量
(选修3-3选做题)
已知潜水员在岸上和海底吸入空气的密度分别为1.3kg/m 3 和2.1kg/m 3 ,空气的摩尔质量为0.029kg/mol,阿伏伽德罗常数N A =6.02×10 23 mol -1 。若潜水员呼吸一次吸入2L空气,试估算潜水员在海底比在岸上每呼吸一次多吸入空气的分子数。(结果保留一位有效数字) 得与岚为伴1年前0
得与岚为伴1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 物理选修3-1的一道题把试探电荷Q放到电场中的A点,测得它所受的静电力为F,再把它放到B 点,测得它所受的静电力为NF,
物理选修3-1的一道题
把试探电荷Q放到电场中的A点,测得它所受的静电力为F,再把它放到B 点,测得它所受的静电力为NF,A点和B点的场强之比EA/EB是多少?再把另一电荷量为NQ的试探电荷放到另一点C,测得它所受的静电力也是F.A点和C 点的场强之比EA/EC是多少? bing147bing1年前1
bing147bing1年前1 -
 cc燃烧的cc 共回答了18个问题
cc燃烧的cc 共回答了18个问题 |采纳率94.4%由F=EQ得:
EA:EB=F/Q:NF/Q=1:N
EA:EC=F/Q:F/NQ=N:11年前查看全部
- 高中物理选修3-1,静电场,针对做题的知识点总结
高中物理选修3-1,静电场,针对做题的知识点总结
物理原来学的也挺好的,可是现在突然觉得不太会了,这一章老师课上光讲概念,结果做题大多数都做错。
大家给个比较有效的应对做题的知识点总结。老师说让我们背知识点,可是知识点他上课说的确实不少,而且有些东西做题不一定能用到,所以来求个针对做题的有效的知识点总结,还有应对的什么公式,性质比较什么的。
 净土掩风流1年前3
净土掩风流1年前3 -
 cotton0215 共回答了16个问题
cotton0215 共回答了16个问题 |采纳率93.8%光背知识点是没有用的!我不是在说教,我高中物理开始30分,后来接近满分。物理不同与其他理科,它更需要理解,你把书重头到尾好好看一便,(这是在你上课好好听课的前提下),好好听老师讲,买一本全解,仔细研究,使自己达到一定高度,这样就差不多啦,这样做题也就好做啦,不能因为要做题对得多而背知识点,应该先会知识,你把因果关系弄错啦!1年前查看全部
- 高中物理选修3-1练习题急~~~~~~~~~~~有加分!
高中物理选修3-1练习题急~~~~~~~~~~~有加分!
真空中,A,B两点上分别设置异种点电荷Q1,Q2,已知两点电荷间引力为10N,Q1=-1.0×10^-2C,Q2=2.0×10^-2C.则Q2在A处产生的场强大小是_______N/C,方向是____.则Q1在B处产生的场强大小是______N/C,方向是____.请写出解题过程,给加分. Shuier水二1年前1
Shuier水二1年前1 -
 honglh66 共回答了21个问题
honglh66 共回答了21个问题 |采纳率95.2%首先要知道公式.两真空点电荷间引(斥)力F=KQ1Q2/R^2,某真空点电荷在与其距离为处产生的电场大小E=KQ/R^2.其中R为两点间距,k=9.0×10^9为静电力常量.你把数往里一代就出来了.方向判断:负电荷产生的电场方向指向负电荷,正电荷产生的电场方向向外,即于负电荷相反1年前查看全部
- 物理选修静电场部分的,电势能和电势的题目.火急!
 娃娃171年前1
娃娃171年前1 -
 珂娜 共回答了20个问题
珂娜 共回答了20个问题 |采纳率95%从a到b用动能定理,Wab=q*(φ-2φ/3)=qφ/3=mv^2/2
从a到c用动能定理:Wac=q*(φ-φ/4)=q*3φ/4=mv'^2/2
两式相比,(v'/v)^2=9/4,所以v'=3v/21年前查看全部
- 【选修3-5】大量氢原子处于不同能量激发态,发生跃迁时放出三种不同能量的光子,其能量值分别是:1.89eV、10.2eV
【选修3-5】
大量氢原子处于不同能量激发态,发生跃迁时放出三种不同能量的光子,其能量值分别是:1.89eV、10.2eV、12.09eV.跃迁发生前这些原子分布在______个激发态能级上,其中最高能级的能量值是______ eV(基态能量为-13.6eV). 痛的单行道1年前1
痛的单行道1年前1 -
 仔细确认 共回答了21个问题
仔细确认 共回答了21个问题 |采纳率95.2%解题思路:根据向低能级跃迁时,可以发出3种不同频率的光子,求解问题.最高能级的能量值对应放出最大的能量光子.根据向低能级跃迁时,可以发出3种不同频率的光子,
跃迁发生前这些原子分布在2个激发态能级上.
处于基态氢原子能量为-13.6eV,
最高能级的能量值是-13.6eV+12.09eV=-1.51eV.
故答案为:①2,②-1.51eV点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 正确根据氢原子的能级公式和跃迁进行有关问题的计算,是原子物理部分的重点知识,要注意加强训练.1年前查看全部
- 物理-选修3-5模块(1)氢原子的部分能级如图所示.已知可见光的光子能量在1.62eV到3.11eV之间.由此可推知,氢
 物理-选修3-5模块
物理-选修3-5模块
(1)氢原子的部分能级如图所示.已知可见光的光子能量在1.62eV到3.11eV之间.由此可推知,氢原子______
A.从高能级向n=1能级跃迁时发出的光的波长比可见光的短
B.从高能级向n=2能级跃迁时发出的光均为可见光
C.从高能级向n=3能级跃迁时发出的光的频率比可见光的高
D.从n=3能级向n=2能级跃迁时发出的光为可见光
(2)一个锂核(73Li)受到一个质子的轰击,变成2个α粒子,写出这一过程的核反应方程,已知一个氢核的质量是1.6736×10-27kg,一个锂核的质量是11.6505×10-27kg,一个氦核的质量是6.6466×10-27kg,上述核反应所释放的能量等于多少J(最后结果取三位有效数字). 素炒冬瓜1年前1
素炒冬瓜1年前1 -
 elite20000 共回答了21个问题
elite20000 共回答了21个问题 |采纳率90.5%(1)A、从高能级向n=1能级跃迁时辐射的最小光子能量为13.6-3.40eV=10.2eV,大于3.11eV,可知所有光子能量都大于3.11eV,则波长比可见光的波长短.故A正确.
B、从高能级向n=2能级跃迁时发出的光子能量可能大于3.11eV,可能不是可见光.故B错误.
C、从高能级向n=3能级跃迁时发出的光子能量小于1.51eV,频率比可见光频率小.故C错误.
D、从n=3能级向n=2能级跃迁时发出的光子能量为3.40-1.51eV=1.89eV.在可见光子能量范围内,是可见光.故D正确.
故选AD.
(2)一个锂核(73Li)受到一个质子的轰击,变成2个α粒子的方程式为: 37Li+ 11H→2 24He
根据△E=△mc2得,△E=(1.6736+11.6505-6.6466×2)×10-27×(3×108)2=2.78×10-12 J.
故答案为:(1)AD
(2) 37Li+ 11H→2 24He,2.78×10-12 J1年前查看全部
- 高中语文选修(中国古代诗歌散文欣赏)中需要背诵的篇目
高中语文选修(中国古代诗歌散文欣赏)中需要背诵的篇目
我的课本是河南省人教版新课标的语文课本 蓝色的枫夜1年前1
蓝色的枫夜1年前1 -
 xb222222 共回答了14个问题
xb222222 共回答了14个问题 |采纳率92.9%《长恨歌》、《书愤》、《杂诗十二首》、《一剪梅》、《春江花月夜》、《梦游天姥吟留别》
《菩萨蛮》、《旅客书怀》、《将进酒》、《虞美人》、《苏幕遮》、《项脊轩志》1年前查看全部
- 高中化学选修5各类有机物的代表物
 镀秋池1年前1
镀秋池1年前1 -
 纵横剑客 共回答了13个问题
纵横剑客 共回答了13个问题 |采纳率92.3%烷烃 甲烷
烯烃乙烯
炔烃乙炔
芳香烃 苯
醇类1年前查看全部
- 高中物理选修3-2该怎么学
 alang_1011年前1
alang_1011年前1 -
 daoliu1 共回答了18个问题
daoliu1 共回答了18个问题 |采纳率83.3%选修3-2的内容是电磁学部分,其中最重要的是电场和磁场这两单元,场的概念要理解好,结合动力学出的综合题较常见.复合场问题,带电粒子在电场中的加速和偏转,带电粒子在匀强磁场中的圆周运动,另外电路实验很重要.1年前查看全部
- (2014•江苏一模)选修4-1:几何证明选讲
 (2014•江苏一模)选修4-1:几何证明选讲
(2014•江苏一模)选修4-1:几何证明选讲
如图,已知⊙O的半径为1,MN是⊙O的直径,过M点作⊙O的切线AM,C是AM的中点,AN交⊙O于B点,若四边形BCON是平行四边形;
(Ⅰ)求AM的长;
(Ⅱ)求sin∠ANC. 1524121年前0
1524121年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 化学选修5,53页6题,见补充 C项为什么不选,请分析清楚,
 Y411001年前1
Y411001年前1 -
 jlzhenghui 共回答了12个问题
jlzhenghui 共回答了12个问题 |采纳率83.3%C5H10可能是环戊烷,或者是 含有5个C的烯烃.
如果是环戊烷,就不是丁烯的同系物.
C2H4一定是乙烯.
所以只能选 BD.1年前查看全部
- 选修4化学平衡移动问题用蓝色标的就是问题.另外一个问题是:容积就是体积吗?
选修4化学平衡移动问题



用蓝色标的就是问题.另外一个问题是:容积就是体积吗? 秋雨撩人1年前1
秋雨撩人1年前1 -
 李骏 共回答了12个问题
李骏 共回答了12个问题 |采纳率91.7%我看了一下题目,我觉得答案解析上那句话的意思是给出了一个能够判断反应平衡的方法:对于反应前后气体体积不同的可逆反应,如果反应在某一时刻后始终保持压强不变,则说明反应达到平衡.
就这个反应‘而言,它说的“反应前后体积”,指的是反应物系数为2,生成物系数和为3,二者不相等.1年前查看全部
- 请问,高中文科数学都要学哪几本,选修1-1、1-2选修4-4、4-4、4-5是什么意思,我是唐山的,
 万色返空1年前1
万色返空1年前1 -
 HC囡囡 共回答了20个问题
HC囡囡 共回答了20个问题 |采纳率90%选修1-1 1-2时都要学习的,而4-4 4-5 4-6是高考中的三道题,你只要从其中选作一道就可以了这三到分别是,平面几何证明,参数方程,不等式1年前查看全部
- 高中化学选修3需要掌握的分子模型图有哪些?
 qxw04251年前2
qxw04251年前2 -
 rosnlin 共回答了25个问题
rosnlin 共回答了25个问题 |采纳率92%最基本的sp、sp2、sp3杂化类型的基本模型都得掌握,如:sp(有机物中的炔烃,无机物有CO2、BeCl2),sp2(有机物中的烯烃、苯,无机物有BF3),sp3有CH4、NH3、H2O,这是最基本的,还有这些元素同主族的一些衍生物.1年前查看全部
- 选修4-1:几何证明选讲如图所示,已知PA与⊙O相切,A为切点,过点P的割线交圆于B、C两点,弦CD ∥ AP,AD、B
选修4-1:几何证明选讲
如图所示,已知PA与⊙O相切,A为切点,过点P的割线交圆于B、C两点,弦CD ∥ AP,AD、BC相交于点E,F为CE上一点,且DE 2 =EF•EC.
(1)求证:CE•EB=EF•EP;
(2)若CE:BE=3:2,DE=3,EF=2,求PA的长.
 suibianyuanze1年前1
suibianyuanze1年前1 -
 爱凑热闹的幽灵 共回答了17个问题
爱凑热闹的幽灵 共回答了17个问题 |采纳率94.1%(I)证明:∵DE 2 =EF•EC,∠DEF公用,
∴△DEF ∽ △CED,
∴∠EDF=∠C.
又∵弦CD ∥ AP,∴∠P=∠C,
∴∠EDF=∠P,∠DEF=∠PEA
∴△EDF ∽ △EPA.
∴
EA
EF =
EP
ED ,∴EA•ED=EF•EP.
又∵EA•ED=CE•EB,
∴CE•EB=EF•EP;
(II)∵DE 2 =EF•EC,DE=3,EF=2.
∴3 2 =2EC,∴ CE=
9
2 .
∵CE:BE=3:2,∴BE=3.
由(I)可知:CE•EB=EF•EP,∴
9
2 ×3=2EP ,解得EP=
27
4 ,
∴BP=EP-EB=
27
4 -3=
15
4 .
∵PA是⊙O的切线,∴PA 2 =PB•PC,
∴ P A 2 =
15
4 ×(
27
4 +
9
2 ) ,解得 PA=
15
3
4 .1年前查看全部
- 我们是必修2和选修5一起学的,我们老师不是按顺序讲的,什么苯.醇.还有什么聚合我都不会啊,那些书上给的很少,而且练习册上
我们是必修2和选修5一起学的,我们老师不是按顺序讲的,什么苯.醇.还有什么聚合我都不会啊,那些书上给的很少,而且练习册上出的题又少又简单,考试却出的特别难,我每次测试也就能考个60分,如果这个假期要自己练的话,看什么教辅,在哪找题做啊,我希望这个假期我的成绩能提高到70分左右.(抱歉我没有分了,真的希望有高手帮帮忙)
 suixin33481年前1
suixin33481年前1 -
 zhangqiulian 共回答了21个问题
zhangqiulian 共回答了21个问题 |采纳率85.7%首先先把必修2学好.当然,你既然学了两本课本了,那对两本课本上的知识还是有点印象的吧.那么看的时候就要穿插着看了.练习的话,个人觉得应该先买一本必修二的练习题做,然后再做一本选修5的.至于哪本辅导书,由于我已经不是高中生了,对现在高中的资料也不是很了解.重要的还是你喜欢哪种类型的吧.看你的情况应该还是在读高一吧,那可以买本《题典》,里面涵盖了整个高中的内容,而且是按课本分类的,比较划算,另外它里面的题目也还不错.学习重要的还是给自己信心,找到动力.希望对你有帮助.1年前查看全部
- namger必修6选修7 Unit 1 Living well-Reading MARTY’S STORY Hi, my
namger必修6
选修7 Unit 1 Living well-Reading
MARTY’S STORY
Hi, my name is Marry Fielding and I guess you could say that I am "one in a million". In other words, there are not many people like me. You see, I have a muscle disease which makes me very weak, so I can't run or climb stairs as quickly as other people. In addition, sometimes I am very clumsy and drop things or bump into furniture. Unfortunately, the doctors don't know how to make me better, but I am very outgoing and have learned to adapt to my disability. My motto is: live One day at a time. xiediqin1年前1
xiediqin1年前1 -
 徐霞客 共回答了14个问题
徐霞客 共回答了14个问题 |采纳率78.6%Until I was ten years old I was the same as everyone else. I used to climb trees, swim and play football. In fact, I used to dream about playing professional football and possibly representing my coun...1年前查看全部
- 物理选修3-1中那个导体分开后两端带的还是同种电荷吗?还有那个金属箔,是不是带电就分开 不带就不分?
 pangmao1年前1
pangmao1年前1 -
 善倦新佑卫门 共回答了16个问题
善倦新佑卫门 共回答了16个问题 |采纳率87.5%题意不明.你说的是不是第一章的第一节的实验啊.如果是将一带电(如正电荷)的物体接近一导体,此时靠近端带A异种电荷(-),远离端带B同种电荷(+).若将导体分开,A带负电,B带正电.至于金属箔张开是应用了同种电荷互相排斥的原理的.可以说,带电分开,不带不分.1年前查看全部
- 帮忙讲一道高二选修2-2复数的数学题
帮忙讲一道高二选修2-2复数的数学题
已知关于X的方程x^2+(1-2i)x+(3m-i)=0有实根,求m的值 yamever1年前1
yamever1年前1 -
 aomeiking 共回答了13个问题
aomeiking 共回答了13个问题 |采纳率84.6%设方程实根为x=a(a∈R)
∴a²+(1-2i)a+3m-i=0整理实部虚部,得(a²+a+3m)-(2a+1)i=0
∴a²+a+3m=0且2a+1=0
所以实根a=-1/2,实数m=1/121年前查看全部
- 【化学--选修2:化学与技术】Ⅰ.硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用
【化学--选修2:化学与技术】Ⅰ.硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用
【化学--选修2:化学与技术】
Ⅰ.硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如图1所示: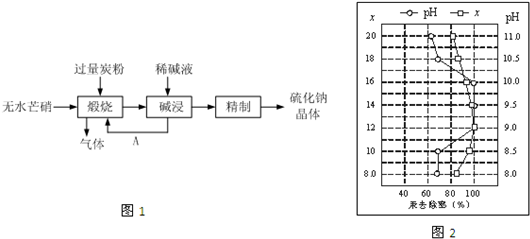
(1)上述流程中若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为3Na2SO4+8C
3Na2S+4CO2↑+4CO↑高温 .3Na2SO4+8C.
3Na2S+4CO2↑+4CO↑高温 .
(2)上述流程中采用稀碱液比用热水更好,理由是______.
(3)皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x 代表硫化钠的实际用量与理论用量的比值)有关(如图2所示).为使除汞效果最佳,应控制的条件是______、______.
(4)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌.若反应后测得溶液的pH=4,则此时溶液中c( S2-)=______.(保留两位有效数字)(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
Ⅱ.纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等.
其中电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备.
(5)电化学法制备Cu2O时,铜棒做______极,阴极生成Cu2O的电极反应式为______.
 青青果香1年前1
青青果香1年前1 -
 shalerbi1 共回答了22个问题
shalerbi1 共回答了22个问题 |采纳率95.5%制备硫化钠晶体的流程为:无水芒硝(Na2SO4)与碳在高温煅烧反应:3Na2SO4+8C
高温
.
3Na2S+4CO2↑+4CO↑,由于硫离子水解,则用稀碱溶液浸泡煅烧产物得硫化钠溶液,通过精制获得硫化钠晶体,
(1)根据题干信息,硫酸钠与碳反应生成等物质的量的CO和CO2,C元素化合价从0价被氧化成+4、+2价,化合价升高至少为:(4-0)+(2-0)=6,硫酸钠中+6价S元素被还原为-2价,化合价降低了8价,则化合价变化的最小公倍数为24,则硫酸钠的系数为3,一氧化碳、二氧化碳的系数为4,然后根据质量守恒定律配平,配平后的化学方程式为:3Na2SO4+8C
高温
.
3Na2S+4CO2↑+4CO↑,
故答案为:3Na2SO4+8C
高温
.
3Na2S+4CO2↑+4CO↑;
(2)上述流程中采用稀碱液比用热水更好,硫化钠溶液中硫离子水解显碱性,水解过程是吸热反应,加热促进水解进行,稀碱溶液能起到抑制水解的作用,
故答案为:热水会促进Na2S水解,而稀碱液能抑制Na2S水解;
(3)依据图象中曲线分析,汞去除率最佳PH和x的取值是x=12 pH介于9~10之间时汞的去除率最大,接近100%,
故答案为:x=12; pH介于9~10之间;
(4)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌,若反应后测得溶液的pH=4,c(OH-)=10-10mol/L,
常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20,
根据氢氧化铜的溶度积可得:Ksp=c(Cu2+)×c2(OH-)=2.2×10-20,解得:c(Cu2+)=
2.2×10?20
(10?10)2mol/L=2.2mol/L,
根据硫化铜的溶度积可得:Ksp=c(Cu2+)c(S2-)=8.8×10-36,
则此时溶液中c( S2-)=
8.8×10?36
2.2mol/L=4.0×10-36mol/L,
故答案为:4.0×10-36mol/L;
(5)电解Cu(NO3)2稀溶液制备Cu2O时,阴极生成Cu2O,铜离子化合价降低被还原,电极方程式为:2Cu2++2e-+H2O═Cu2O+2H+,溶液中铜离子浓度减小,则阳极应该为铜,以补充消耗的铜离子,
故答案为:阳;2Cu2++2e-+H2O═Cu2O+2H+.1年前查看全部
- (2011•南通一模) 选修4-1:几何证明选讲
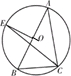 (2011•南通一模) 选修4-1:几何证明选讲
(2011•南通一模) 选修4-1:几何证明选讲
锐角三角形ABC内接于⊙O,∠ABC=60°,∠BAC=40°.作OE⊥AB交劣弧
于点E,连接EC,求∠OEC.
AB  seagullfeng1年前1
seagullfeng1年前1 -
 悠闲野狐 共回答了20个问题
悠闲野狐 共回答了20个问题 |采纳率90%解题思路:连接OC.如图所示.由∠ABC=60°,∠BAC=40°,利用三角形的内角和定理可得∠ACB=80°.由OE⊥AB,利用垂径定理及其推论可得E为
的中点,AB
和BE
的度数均为80°.进而得到∠EOC=80°+80°=160°.利用等腰三角形即可得出∠OEC=10°.BC 连接OC.如图所示,

∵∠ABC=60°,∠BAC=40°,∴∠ACB=80°.
∵OE⊥AB,
∴E为
AB的中点,∴
BE和
BC的度数均为80°.
∴∠EOC=80°+80°=160°.
∴∠OEC=10°.点评:
本题考点: 与圆有关的比例线段.
考点点评: 熟练掌握三角形的内角和定理、垂径定理及其推论、等腰三角形的性质是解题的关键.1年前查看全部
- (2009•大连二模)选修4-5:不等式选讲
(2009•大连二模)选修4-5:不等式选讲
已知函数f(x)=ax2+x-a(-1≤x≤1),且|a|≤1.
求证:|f(x)|≤
.5 4  lsxq1年前1
lsxq1年前1 -
 南昌小丫头 共回答了15个问题
南昌小丫头 共回答了15个问题 |采纳率73.3%解题思路:直接利用函数表达式以及绝对值三角不等式化简,通过二次函数的配方利用最大值推出结果.证明:∵-1≤x≤1,∴|x|≤1,
又∵|a|≤1,
∴|f(x)|=|a(x2-1)+x|
≤|a(x2-1)|+|x|
≤|(x2-1)|+|x|
=1-|x|2+|x|
=-(|x|-[1/2])2+[5/4]≤[5/4].
所以:|f(x)|≤
5
4.点评:
本题考点: 绝对值三角不等式;不等式的证明.
考点点评: 本题考查绝对值三角不等式的应用,二次函数配方法的应用,考查分析问题解决问题的能力.1年前查看全部
- 【选修3-3】一定质量的理想气体由状态A变到状态B的P-T图线如图所示,可知在由A到B的过程中正确的是( )A.气体分
 【选修3-3】
【选修3-3】
一定质量的理想气体由状态A变到状态B的P-T图线如图所示,可知在由A到B的过程中正确的是( )
A.气体分子的平均动能增大
B.气体分子间的平均距离增大
C.气体的压强增大,体积减小
D.气体一定吸收热量 david12241年前1
david12241年前1 -
 柴进 共回答了20个问题
柴进 共回答了20个问题 |采纳率90%解题思路:温度是气体分子平均动能的标志,温度升高分子平均动能增大.根据理想气体状态方程,分析气体的体积变化来确定气体分子间的平均距离的变化.气体体积增大,对外界做功,温度升高,内能增大,根据热力学第一定律分析吸放热情况.A、由题:气体的温度升高,气体分子的平均动能增大.故A正确.
B、C如图,连接AO,BO,由数学知识可知:
PA
TA>
PB
TB,根据理想气体状态方程分析得知
PV
T=C,气体的体积VA<VB,即气体的体积增大,分子间的平均距离增大.故B正确,C错误.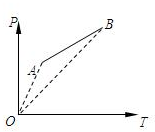
D、气体的温度升高,内能增大,体积增大,对外做功,根据热力学第一定律可知,气体一定吸收热量.故D正确.
故选:ABD.点评:
本题考点: 理想气体的状态方程.
考点点评: 本题考查理解气体状态变化图象的能力,方法是添置辅助线:设想O到A是一个等容过程,O到B也是一个等容过程,斜率大,此过程气体的体积小.1年前查看全部
- 高中数学选修4-4坐标系与参数方程中,在讲简单曲线的极坐标方程中有这么一句话,没看懂,
高中数学选修4-4坐标系与参数方程中,在讲简单曲线的极坐标方程中有这么一句话,没看懂,
在平面直角坐标系中,平面曲线C可以用方程f(x,y)=0来表示,曲线与方程满足如下关系:(1)曲线C上的点都是方程f(x,y)=0的解
(2)以方程f(x,y)=0的解为坐标的点都在曲线C上
重点是那个f(x, 散发扁舟追风逐月1年前1
散发扁舟追风逐月1年前1 -
 彷徨又郁闷的人_rr 共回答了20个问题
彷徨又郁闷的人_rr 共回答了20个问题 |采纳率100%就是把方程的项都移到左边,使得右边=0,比如x+y+1=0,x^2+y^2=0,f(x,y)就是函数只含有x,y两个未知数1年前查看全部
- 选修4-2:矩阵与变换(本小题满分10分)
选修4-2:矩阵与变换(本小题满分10分)
已知矩阵M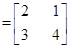
(1) 求矩阵M的逆矩阵;
(2) 求矩阵M的特征值及特征向量; 富富有余1年前1
富富有余1年前1 -
 雨打秋窗1 共回答了14个问题
雨打秋窗1 共回答了14个问题 |采纳率85.7%1年前查看全部
- 真的感觉生物选修3(现代生物科技专题)很难该怎么办
 sohoo1681年前3
sohoo1681年前3 -
 maple04 共回答了17个问题
maple04 共回答了17个问题 |采纳率94.1%我当初学的时候觉得还可以,比必修简单多了,无论你能否理解,只要能背熟就一定能考不错的分数1年前查看全部
- 化学选修5,58页17题,关于有机物,见补充
化学选修5,58页17题,关于有机物,见补充

怎么分析,怎么做,请详细解释,谢谢
 xintao591年前1
xintao591年前1 -
 403413886 共回答了20个问题
403413886 共回答了20个问题 |采纳率85%有机物除杂原则:除杂试剂只与杂质反应,然后根据反应后的生成物与被提纯物的性质选择合理的分离方法.
溴水,洗气.
饱和CuSO4溶液,洗气.
水,分液.
NaOH溶液,分液.1年前查看全部
- 人教版化学选修4第14页第六题怎么做
 小云朵朵儿1年前1
小云朵朵儿1年前1 -
 猪笑七 共回答了25个问题
猪笑七 共回答了25个问题 |采纳率88%3式减一式减二式即可1年前查看全部
- 高二选修1-1椭圆方程A(2,0) B(-1,2) 点C在直线2X+Y-3=0 上移动 求△ABC的重心轨迹方程
 忘忧仙1年前1
忘忧仙1年前1 -
 芳猫猫 共回答了19个问题
芳猫猫 共回答了19个问题 |采纳率84.2%设C(u,v),△ABC的重心M(m,n)
根据三角形重心的性质,有:m=(u+1)/3,n=(v+2)/3
于是,u=3m-1,v=3n-2
因为(u,v)满足2x+y-3=0
所以(m,n)满足2(3m-1)+(3n-2)-3=0即6m+3n-7=0
所以△ABC的重心轨迹方程为6x+3y-7=01年前查看全部
- 化学选修五基础有机化学总结.
 巴西7号1年前1
巴西7号1年前1 -
 xiehuixingyu 共回答了22个问题
xiehuixingyu 共回答了22个问题 |采纳率90.9%讲清楚1年前查看全部
- 哪个省学化学选修3,全国新课标卷在2013年的理综里在选修模块当中是否能出化学选修3的题?
 来看浪人1年前1
来看浪人1年前1 -
 百川 共回答了18个问题
百川 共回答了18个问题 |采纳率83.3%辽宁省是出的,新课标卷在2012是选修3和选修3和选修2都有的,你可以去选.1年前查看全部
- 人教版化学选修四第二章学的什么?是关于哪方面的?还是其他的)
 滴说1年前1
滴说1年前1 -
 sibuliao 共回答了18个问题
sibuliao 共回答了18个问题 |采纳率88.9%第二章 化学反应速率和化学平衡
第一节 化学反应速率
第二节 影响化学反应速率的因素
第三节 化学平衡
第四节 化学反应进行的方向1年前查看全部
- 强酸制弱酸原理,强酸制弱酸的原理为什么都从降低能量的角度来解释?谁能用什么常用的高中原理说一说?本人化学基础较差,但选修
强酸制弱酸原理,
强酸制弱酸的原理为什么都从降低能量的角度来解释?谁能用什么常用的高中原理说一说?本人化学基础较差,但选修4的化学原理还可以,新课标二卷的考生, huayuqian1年前1
huayuqian1年前1 -
 milaure111 共回答了19个问题
milaure111 共回答了19个问题 |采纳率100%强酸制弱酸,氢离子浓度减小,混乱度减小,生成的弱酸中的共价键,对外释放能量.所以能量降低.换句话说,逆向过程,由于弱酸电离是吸热的,同浓度的强酸溶液和稀酸溶液,要想稀酸溶液中氢离子浓度接近强酸的,通过加热途径可以实现,实际上就是供给能量,使体系能量升高1年前查看全部
- 化学N三N为什么在选修四第一课练习册就有
 XIAOPI111年前1
XIAOPI111年前1 -
 恐怖精神骑士 共回答了24个问题
恐怖精神骑士 共回答了24个问题 |采纳率79.2%其实平时老师一般讲基本要求,按考试范围讲.其实只要能理解,什么时间学习都可以.1年前查看全部
- 有关生物选修三生态系统+必修二基因的表达的问题
有关生物选修三生态系统+必修二基因的表达的问题
华南虎处于“能量金字塔”的顶层,与其它营养级相比,华南虎同化的能量最小,这些能量的去向包括:未被利用的能量、_________的能量和_________的能量.
答案是:呼吸作用消耗;被分解者利用
我想问的是:为什么不可以答呼吸作用消耗;传递给下一营养级
是不是因为题中给出华南虎是能量金字塔的顶层,没有下一营养级了?
若在mRNA中插入一个碱基,则可能导致肽链的长度和_______发生改变.
答案是:氨基酸的序列
那可不可以答种类的改变或者是氨基酸排列次序的改变,我自己的答案是根据蛋白质分子的多样性这个方面答的,不知靠谱不?
请专家指点!OrZ ……答好了会加分!我是高三的,需要细致的回答! 橘子与树1年前5
橘子与树1年前5 -
 dadaxiong1978 共回答了19个问题
dadaxiong1978 共回答了19个问题 |采纳率89.5%嗯,因为题目已经告诉你 华南虎处于“能量金字塔”的顶层 所以没有下一个营养级
氨基酸排列次序的改变 这个比较靠谱;答种类的改变则太广泛了
而变为蛋白质分子的多样性,个人认为不太好,因为加入碱基后会不会形成蛋白质都是个问题1年前查看全部
- 化学选修五p12第二题为什么是3种?
 山水痕迹1年前1
山水痕迹1年前1 -
 分手那天 共回答了20个问题
分手那天 共回答了20个问题 |采纳率90%第一种、第四种是同一种烷烃:戊烷CH3CH2CH2CH2CH3
第二种、第三种是同一种烷烃:2-甲基丁烷CH3CHCH2CH3
CH3
第五种、第六种是同一种烷烃:2,3-二甲基丁烷CH3CH CHCH3;
CH3CH31年前查看全部
- 人教版)新课标高中英语必修1人教版英语选修7Unit1单词mp3 还有选修6的U3,4,5的单词请直接发给我的邮箱,pr
人教版)新课标高中英语必修1
人教版英语选修7Unit1单词mp3 还有选修6的U3,4,5的单词请直接发给我的邮箱,prodigelove@live.cn 19gg20a1年前1
19gg20a1年前1 -
 linjiayuan 共回答了18个问题
linjiayuan 共回答了18个问题 |采纳率88.9%百度一下,网上有1年前查看全部
- 高三物理校内公开课 (选修3-1 恒定电流和磁场部分 一轮复习)讲什么效果好
高三物理校内公开课 (选修3-1 恒定电流和磁场部分 一轮复习)讲什么效果好
高中教师校内公开课,内容恒定电流相关知识。 yzydiy20021年前2
yzydiy20021年前2 -
 清风小宇 共回答了19个问题
清风小宇 共回答了19个问题 |采纳率89.5%当然实验是重点!
分压法限流法,内接外接,电表的选择,误差分析...够你讲的了
知识点方面,电功率也是个重难点1年前查看全部
大家在问
- 1人体血液循环的动力来自于()天灵灵.地灵灵.知道的出来告诉啊,天啊.保佑我能完成把!~~~~~~~~~~~~!~!
- 2(1/2)已知圆X的平方+Y的平方等于8定点(4,0)求点P的直线的条件的斜率在什么范围内取值(1)相切(2)...
- 3已知数a—2与2a—3互为相反数,则a的倒数是多少
- 4已知线段A,B,C用尺规作一条线段,使它等于3A-B加2C要详细作法,最好有图
- 5To do for youBaby and meSt. Benedicts Family Medical Center’
- 6] 里的词用所给(单词)适当[填空] 7.Last year they [ built ] ( build ) many
- 7小华参加数学竞赛培训,第一、二次考试成绩平均60分,由于努力,第三次考试后,第一、二、三次的平均分为70分,那么第三次考
- 8英语,提建议的具体说法,最好全面一点
- 9图中实验现象揭示的物理原理或规律与应用技术相对应,其中不正确的一组是 [
- 10宋人或得玉,献诸子罕.子罕弗受.献玉者曰:“以示玉人,玉人以为宝也,故敢献之.”子罕曰:“我以不贪为宝,尔以玉为宝.若以
- 11i hear the news two weeks
- 12从前,有一个农夫养了17只羊,在他去世时,农夫把这17只羊分给他的三个儿子,大儿子说他要分得总数的 1 2 ,二儿子说他
- 13人生若只如初见,那么似水流年会不会繁华一些……
- 14按实际情况回答问题.1.Did you grow flowers before?2.Does your mother g
- 15举列说明什么叫参照物