溶液配制:蒸馏水含250mmol.L-1蔗糖,1mol.L-1 EDTA,1mmol.L-1 EGTA,10 mmol.
 enderboy2022-10-04 11:39:543条回答
enderboy2022-10-04 11:39:543条回答我配完溶液后发现,EDTA不能溶解,该怎么办啊?

已提交,审核后显示!提交回复
共3条回复
 demonknight 共回答了17个问题
demonknight 共回答了17个问题 |采纳率88.2%- 加浓NaOH后就可以溶解了,因为EDTA是乙二胺四乙酸,要用强碱来调pH,要是提前就加NaOH,很快就会溶解,效果很好
- 1年前
 寻寻觅觅oo路 共回答了22个问题
寻寻觅觅oo路 共回答了22个问题 |采纳率- EDTA在水中溶解度确实不高,这样一方面可加强搅拌促进溶解,另一方面可适度加热,可增大溶解度。
- 1年前
 gigglelv 共回答了21个问题
gigglelv 共回答了21个问题 |采纳率- 调PH到8左右
- 1年前
相关推荐
- 化学溶液配制及分析注意事项 等等所有东西讲一下 感激万分啊!
 778899wy1年前1
778899wy1年前1 -
 fyyswj74 共回答了29个问题
fyyswj74 共回答了29个问题 |采纳率82.8%全过程有计算,称量,溶解,冷却,转移,洗涤,定容,摇匀/装瓶八个步骤
八字方针:计,量,溶,冷,转,洗,定,摇
以0.1mol/LNaCO3溶液500ml为例说明溶液的配制过程
1.计算:NaCO3物质的量=0.1mol/L×0.5L=0.05mol,由NaCO3摩尔质量106g/mol,则NaCO3质量=0.05mol×106g/mol=5.3g
2.称量:用分析天平称量5.300g,注意分析天平的使用.
3.在烧杯中用100ml蒸馏水使之完全溶解,并用玻璃棒搅拌(注意:应冷却,不可在容量瓶中溶解)
4.转移,洗涤:把溶解好的溶液移入500ml容量瓶,用于容量瓶瓶口较细,为避免溶液洒出,同时不要让溶液在刻度线上面沿瓶壁流下,用玻璃棒引流.为保证溶质尽可能全部转移到容量瓶中,应该用蒸馏水洗涤烧杯和玻璃棒二、三次,并将每次洗涤后的溶液都注入到容量瓶中.轻轻振荡容量瓶,使溶液充分混合.(用玻璃棒引流)
5.定容:加水到接近刻度2-3厘米时,改用胶头滴管加蒸馏水到刻度,这个操作叫定容.定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视或仰视,否则都会造成误差
6.摇匀:定容后的溶液浓度不均匀,要把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次,使溶液混合均匀.这个操作叫做摇匀.
7.把定容后的Na2CO3溶液摇匀.把配制好的溶液倒入试剂瓶中,盖上瓶塞,贴上标签.
注意事项
1.容量瓶是刻度精密的玻璃仪器,不能用来溶解
2.溶解完溶质后溶液要放置冷却到常温再转移
3.溶解用烧杯和搅拌引流用玻璃棒都需要在转移后洗涤两三次
4.把小烧杯中的溶液往容量瓶中转移,由于容量瓶的瓶口较细,为避免溶液洒出,同时不要让溶液在刻度线上面沿瓶壁流下,用玻璃棒引流.
5.定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视或仰视,否则都会造成误差,俯视使溶液体积偏小,使溶液浓度偏大.仰视使溶液体积偏大,使溶液浓度偏小.
6.定容一旦加入水过多,则配制过程失败,不能用吸管再将溶液从容量瓶中吸出到刻度.
7.摇匀后,发现液面低于刻线,不能再补加再补加蒸馏水,因为用胶头滴管加入蒸馏水定容到液面正好与刻线相切时,溶液体积恰好为容量瓶的标定容量.摇匀后,竖直容量瓶时会出现液面低于刻线,这是因为有极少量的液体沾在瓶塞或磨口处.所以摇匀以后不需要再补加蒸馏水,否则所配溶液浓度偏低.1年前查看全部
- 实验室需要配制1.0mol/L硫酸溶液500mL,根据溶液配制情况回答下列问题:
实验室需要配制1.0mol/L硫酸溶液500mL,根据溶液配制情况回答下列问题:
(1)实验中除了烧杯、量筒、玻璃棒外还需要的其它仪器有:______.
(2)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸体积为______ mL.(计算结果保留一位小数)
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作:
A.量取浓硫酸的量筒内有少量水;
B.浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中;
C.住容量瓶转移时,有少量液体溅出
D.将量筒洗涤后洗涤液一并转入容量瓶
E.定容时仰视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
对配制的溶液物质的量浓度可能造成偏大的有______(填写字母);无影响有______. 人生在于折腾1年前1
人生在于折腾1年前1 -
 一ff 共回答了12个问题
一ff 共回答了12个问题 |采纳率91.7%解题思路:(1)根据配制溶液的实验操作过程选择仪器;
(2)根据c=[1000ρω/M]计算浓硫酸的物质的量浓度,根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸的体积;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=[n/V]分析判断操作对溶液浓度的影响.(1)配制500ml1.0mol/L稀硫酸,操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以需要的仪器为:烧杯、筒量、玻璃棒、500mL容量瓶、胶头滴管.
所以还需要的仪器是:500mL容量瓶、胶头滴管,故答案为:500mL容量瓶、胶头滴管;
(2)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为[1000×1.84×98%/98]mol/L=18.4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×1.0mol/L,解得:x≈27.2,故答案为:27.2;
(3)A.量取浓硫酸的量筒内有少量水,量取浓硫酸的体积偏小,所配溶液浓度偏小;
B.浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中进行定容,溶液冷却后导致所配溶液的体积偏小,溶液浓度偏大;
C.住容量瓶转移时,有少量液体溅出,移入容量瓶内的硫酸减少,所配溶液浓度偏小;
D.量筒为流量式仪器,将量筒洗涤后洗涤液一并转入容量瓶,移入容量瓶内硫酸增大,所配溶液浓度偏大;
E.定容时仰视刻度线,导致所配溶液的体积偏大,溶液浓度偏小;
F.溶液配制需加水定容,容量瓶未干燥即用来配制溶液,对所配溶液浓度无影响;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,所配溶液的体积偏大,溶液浓度偏小.
对配制的溶液物质的量浓度可能造成偏大的有BD;无影响有F.
故答案为:BD;F.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查一定物质的量浓度溶液配制、对物质的量浓度理解与计算等,难度不大,注意根据c=[n/V]理解溶液的配制.1年前查看全部
- 分别用等浓度的NaCl,MgCl2,AlCl3三种溶液配制等体积Cl﹣浓度相等的三种溶液,则需NaCl,MgCl2,Al
分别用等浓度的NaCl,MgCl2,AlCl3三种溶液配制等体积Cl﹣浓度相等的三种溶液,则需NaCl,MgCl2,AlCl3三种溶液的体积比为?
 danielhe1年前3
danielhe1年前3 -
 红红的 共回答了18个问题
红红的 共回答了18个问题 |采纳率94.4%不要紧,多加练习一看就知道答案了,那我们就按部就班,一步一个脚印的来吧.题目说用等浓度的溶液,那么我们不妨假设三种溶液的浓度都为1mol/L,要配制的溶液Cl-浓度也是1mol/L,并且都配制一升,那么NaCl不用配制直接取一升,而MgCl2、AlCl3溶液则就要分别取0.5L和1/3L.所以有V(NaCl):V(MgCl2):V(AlCl3)=1:1/2:1/3=6:3:1年前查看全部
- 利用100mL0.50mol•L-1 Na2CO3溶液配制Na+浓度为0.20mol•L-1的溶液,下列操作正
利用100mL0.50mol•L-1 Na2CO3溶液配制Na+浓度为0.20mol•L-1的溶液,下列操作正确的是( )
A.将该Na2CO3溶液转移至250mL容量瓶中,加蒸馏水稀释至刻度线,摇匀
B.将该Na2CO3溶液转移至250mL烧杯中,用量筒量取150mL蒸馏水加入,搅拌
C.将该Na2CO3溶液转移至500mL烧杯中,用量筒量取400mL蒸馏水加入,搅拌
D.将该Na2CO3溶液转移至500mL容量瓶中,加蒸馏水稀释至刻度线,摇匀 mm不能侵权1年前1
mm不能侵权1年前1 -
 civilian2008 共回答了23个问题
civilian2008 共回答了23个问题 |采纳率91.3%解题思路:A、容量瓶不能作为稀释仪器;
B、配制一定体积一定浓度的溶液要使用容量瓶;
C、配制一定体积一定浓度的溶液要使用容量瓶;
D、根据稀释前后溶质的物质的量不变计算配制后的溶液的体积,再根据配制步骤进行即可.A、容量瓶不能作为稀释仪器,是一种定容仪器,故A错误;
B、根据稀释前后,钠离子的物质的量保持不变,计算需要溶液的体积为:[100×0.5×2/0.2]mL=500mL,故B错误;
C、配制一定体积一定浓度的溶液要使用容量瓶来定容,不能在烧杯中进行,且100mL的碳酸钠溶液加上400mL水之后所得溶液的体积不一定是500mL,故C错误;
D、根据稀释前后,钠离子的物质的量保持不变,计算需要溶液的体积为:[100×0.5×2/0.2]mL=500mL,要使用500mL的容量瓶,故D正确.
故选D.点评:
本题考点: 配制一定溶质质量分数、物质的量浓度溶液的方法.
考点点评: 本题考查一定体积一定浓度的溶液的配制,注意容量瓶的使用原则以及配置的方法和有关的计算知识,难度不大.1年前查看全部
- 利用100mL0.50 mol·L -1 Na 2 CO 3 溶液配制Na + 浓度为0.20 mol·L -1 的溶液
利用100mL0.50 mol·L -1 Na 2 CO 3 溶液配制Na + 浓度为0.20 mol·L -1 的溶液,下列操作正确的是
A.将该Na 2 CO 3 溶液转移至250mL容量瓶中,加蒸馏水稀释至刻度线,摇匀 B.将该Na 2 CO 3 溶液转移至250mL烧杯中,用量筒量取150mL蒸馏水加入,搅拌 C.将该Na 2 CO 3 溶液转移至500mL烧杯中,用量筒量取400mL蒸馏水加入,搅拌 D.将该Na 2 CO 3 溶液转移至500mL容量瓶中,加蒸馏水稀释至刻度线,摇匀  星云锁恋1年前0
星云锁恋1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一道初二的理工物理学知识的填空题(溶液配制)
一道初二的理工物理学知识的填空题(溶液配制)
现有20摄氏度时10%的食盐水50克,已知20摄氏度时食盐的溶解度为36克,如果在原溶液中再加入15克食盐,能得到溶液_____克. yuanjianca1年前1
yuanjianca1年前1 -
 yfy6537 共回答了14个问题
yfy6537 共回答了14个问题 |采纳率85.7%50g食盐水,含盐5g,含水45g
溶解度是每一百克水溶解的物质的质量,所以45g水可以溶解16.2g食盐
已经溶解了5g食盐,再加入15g食盐,超过溶解度的不会溶解.
所以有溶液45+16.2=61.2g1年前查看全部
- 铝矾土的溶液配制与测定步骤是怎么样的
 lulu_catherine1年前1
lulu_catherine1年前1 -
 G空瓶子G 共回答了18个问题
G空瓶子G 共回答了18个问题 |采纳率88.9%1、铝矾土样品120~150℃干燥
2、Na2CO3-NaOH高温熔样、酸化、定容;
3、pH=5.5 NH3-NH4Cl缓冲溶液,指示剂XO,EDTA滴定.也可加过量EDTA,以ZnSO4反滴定.1年前查看全部
- 一定物质的量浓度的溶液配制需要哪些仪器
 d大蟀哥1年前3
d大蟀哥1年前3 -
 F1_sky 共回答了23个问题
F1_sky 共回答了23个问题 |采纳率95.7%天平(量筒)、烧杯、玻璃棒、容量瓶、胶头滴管1年前查看全部
- 关于溶液配制,下列说法正确的是( )
关于溶液配制,下列说法正确的是( )
A.配制480mL0.1mol/LCuSO4溶液,需要CuSO4•5H2O晶体12.0g
B.用浓硫酸配制稀硫酸时,将浓硫酸稀释后立即转入容量瓶中
C.称量5.3g碳酸钠固体时,若将物质和砝码放反,将会使称量结果偏小
D.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出 常路漫漫1年前1
常路漫漫1年前1 -
 番外724 共回答了22个问题
番外724 共回答了22个问题 |采纳率90.9%解题思路:A、没有480mL的容量瓶,实际应配制500mL溶液,根据m=nM=cVM计算硫酸铜晶体的质量;
B、浓硫酸溶解放出大量的热,不冷却立即转移定容,溶液冷却后所配溶液的体积偏小;
C、根据天平平衡原理:左盘质量=右盘质量=游码读数,据此计算判断;
D、溶液高于刻度线,所配溶液的体积偏大,溶液的浓度偏小.A、没有480mL的容量瓶,实际应配制500mL溶液,需要硫酸铜晶体的质量为0.5L×0.1mol/L×250g/mol=12.5g,故A错误;
B、浓硫酸溶解放出大量的热,不冷却立即转移定容,溶液冷却后所配溶液的体积偏小,所配溶液的浓度偏高,应冷却至室温后再转移溶液,故B错误;
C、称量5.3g碳酸钠固体时,若将物质和砝码放反,实际称量的碳酸钠的质量为5g-0.3g=4.7g,故C正确;
D、溶液高于刻度线,所配溶液的体积偏大,溶液的浓度偏小,溶液是均匀的,即使吸出多余的溶液,剩余溶液浓度等于原溶液的浓度,应重新配制,故D错误;
故选C.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查一定物质的量浓度溶液的配制,难度中等,注意D选项中需要重新配制.1年前查看全部
- 某学生进行实验需要90mL 2.00mol•L-1的NaOH溶液,该生利用中学实验室条件进行溶液配制,试回答下
某学生进行实验需要90mL 2.00mol•L-1的NaOH溶液,该生利用中学实验室条件进行溶液配制,试回答下列各题:
(1)下列仪器中,必须用到的是______
A.锥形瓶 B.200mL容量瓶C.量筒D.胶头滴管
E.100mL容量瓶F.天平
(2)该生需要称量的Na0H固体质量为______;若要实施配制,除上述仪器外,还缺少的仪器是______.
(3)容量瓶上除有刻度线和规格(或容积)外还应标有______,在使用前必须的操作是______.
(4)如图所示,下列实验操作与方法正确的是:______
(5)配制完毕后,教师指出有部分同学进行了下列某一项错误操作,你认为这些操作会导致所得溶液浓度偏高的是______
A.容量瓶使用前经蒸馏水清洗后没有干燥
B.将溶解后的溶液立即转入容量瓶
C.洗涤烧杯和玻璃棒的溶液倒入水槽中
D.反复倒转摇匀后,液面低于刻度线,再加蒸馏水至刻度线
E.定容时俯视容量瓶刻度线
F.定容时仰视容量瓶刻度线. guanzhong_daoke1年前1
guanzhong_daoke1年前1 -
 流年暄寂 共回答了14个问题
流年暄寂 共回答了14个问题 |采纳率100%解题思路:(1)配制90mL溶液,需要选用100mL容量瓶,根据配制100mL 2.00mol•L-1的NaOH溶液步骤选择使用的仪器;
(2)根据100mL 2.00mol•L-1的NaOH溶液中含有溶质氢氧化钠的物质的量计算出质量;根据已有的仪器选择分析还缺少的仪器;
(3)根据容量瓶的构造进行解答;根据容量瓶的构造分析所以前必须的操作;
(4)根据摇匀溶液方法、给试管中液体加热、胶头滴管使用方法、过滤操作方法进行判断;
(5)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化,若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)实验室没有90mL容量瓶,所以应该选用100mL容量瓶配制溶液,配制100mL 2.00mol•L-1的NaOH溶液使用的仪器有:托盘天平、药匙、玻璃棒、烧杯、100mL容量瓶、胶头滴管等,所以使用的仪器有:D.胶头滴管E.100mL容量瓶 F.天平,
故答案为:DEF;
(2)100mL 2.00mol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:2.00mol•L-1×0.1L=0.2mol,需要氢氧化钠的质量为:40g/mol×0.2mol=8.0g;以上仪器中还缺少的仪器为:玻璃棒、烧杯,
故答案为:8.0g;玻璃棒、烧杯;
(3)容量瓶上标有容积、刻度线、温度;容量瓶上有瓶塞,使用容量瓶时必须检查是否漏水,
故答案为:温度; 检漏;
(4)A.分液漏斗使用前需检验是否漏水,检查时一手托住瓶底,另一只手摁住瓶塞,倒转检查,故A正确;
B.用试管加热液体时,液体不能超过试管容积的[1/3],且用拇指顶住试管夹短柄,故B错误;
C.用胶头滴管滴加液体时不能将胶头滴管插入到试管内部,故C错误;
D.过滤时漏斗下端应紧贴烧杯内壁,故D错误;
故选A.
(5)A.容量瓶使用前经蒸馏水清洗后没有干燥,对配制的溶液体积和溶质的物质的量都没有影响,根据c=[n/V]可得,不影响配制结果,故A错误;
B.将溶解后的溶液立即转入容量瓶,热的溶液体积偏大,冷却后体积变小,导致配制的溶液体积偏小,根据c=[n/V]可得,溶液浓度偏高,故B正确;
C.洗涤烧杯和玻璃棒的溶液倒入水槽中,导致配制的溶液中溶质的物质的量减小,根据c=[n/V]可得,配制的溶液浓度偏低,故C错误;
D.反复倒转摇匀后,液面低于刻度线,再加蒸馏水至刻度线,导致加入的蒸馏水体积偏大,根据c=[n/V]可得,配制的溶液浓度偏低,故D错误;
E.定容时俯视容量瓶刻度线,导致加入的蒸馏水体积偏小,根据c=[n/V]可得,配制的溶液浓度偏高,故E正确;
F.定容时仰视容量瓶刻度线,导致加入的蒸馏水体积偏大,根据c=[n/V]可得,配制的溶液体积偏低,故F错误;
故选BE.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意掌握误差分析的方法和技巧.1年前查看全部
- 大学中的一般生物或化学要背哪些类型的知识,实验详细步骤(包括溶液配制等)要不要背
 爱蕾1年前5
爱蕾1年前5 -
 杨湘粤 共回答了13个问题
杨湘粤 共回答了13个问题 |采纳率100%大学中 实验步骤一般不要求强行记忆,而重点是要理解,知道为什么这样做,以及怎样做才会出需要的结果.最后的目的是理解实验原理,学会设计实验,自行解决实验问题1年前查看全部
- 实验室需要450mL 1mol•L-1 NaOH溶液,根据溶液配制情况回答下列问题:
实验室需要450mL 1mol•L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有______.
(2)如图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是______(填操作序号).
(3)称取NaOH固体时,所需砝码的质量为______(填写字母)
A.18gB.20gC.18g~20gD.大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的代号)______
①称量②溶解③转移④洗涤⑤定容⑥摇匀
(5)若定容摇匀后有少量溶液外流,则所配溶液的物质的量浓度______(填偏高、偏低或无影响). lena14121年前1
lena14121年前1 -
 芝道64 共回答了20个问题
芝道64 共回答了20个问题 |采纳率100%解题思路:(1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)依据配置一定物质的量浓度溶液的正确操作步骤和仪器的正确使用方法解答;
(3)根据n=cV、m=nM计算出500mL1.0mol/L 的NaOH溶液中含有溶质氢氧化钠的质量,然后根据氢氧化钠的称量要放到小烧杯里称量来分析;
(4)根据实验操作的方法分析;
(5)根据c=[n/V]并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;(1)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管.
根据提供的仪器可知,还需仪器有500ml容量瓶、胶头滴管,
故答案为:胶头滴管、500mL容量瓶;
(2)①量筒为量取仪器,不能用来溶解物质,故①错误;
②用玻璃杯搅拌加速固体的溶解,故②正确;
③玻璃棒引流操作时,玻璃棒下端应靠在容量瓶刻度线下方,故③错误;
④加水至刻度线的下方,操作正确,故④正确;
⑤定容时,眼睛应平视刻度线,故⑤错误;
⑥加盖摇匀,使溶液混合均匀,操作正确,故⑥正确;
故答案为:①③⑤;
(3)由于无450mL的容量瓶,故选用500mL的容量瓶,配制出500mL的1.0mol/L的溶液,500mL 1.0mol/L的氢氧化钠溶液中含有溶质的质量为:m=1.0mol/L×0.5L×40g/mol=20g,需要称量的氢氧化钠的质量为20.0g,而称量氢氧化钠固体时,要放到小烧杯里称量,故选用的砝码的质量大于20.0g,故选D;
(4)①称量时先称空烧杯的质量再称烧杯和药品的质量,故错误;
②固体在烧杯中溶解,冷却后转移到500mL容量瓶中,只有1次,故正确;
③转移时除了将溶液转移到容量瓶中还要将洗涤液转移到容量瓶中,故错误;
④洗涤时要洗涤烧杯及玻璃棒2-3次,故错误;
⑤定容时,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,只有1次,故正确;
⑥摇匀要在移液后摇匀一次,在定容后再摇匀一次,故错误;
故选:②⑤;
(5)若定容摇匀后有少量溶液外流,此时溶液的浓度已经均一而且确定,故对所配溶液的浓度无影响,故答案为:无影响.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度的配制.要注意溶质的性质、同时要记住操作步骤,规范操作.1年前查看全部
- 化学 溶液配制如何用80g溶质质量分数为百分之5的蔗糖溶液,配制100g溶质的质量分数为百分之10的蔗糖溶液.
 zhongmenren1年前1
zhongmenren1年前1 -
 若幻 共回答了19个问题
若幻 共回答了19个问题 |采纳率94.7%80g溶质质量分数为百分之5的蔗糖溶液含糖:80 * 5% = 4g
100g溶质的质量分数为百分之10的蔗糖溶液含糖:100 * 10% = 10g
需加糖:10 - 4 = 6g
加水:100 -80 -6 = 14g1年前查看全部
- 我想问一下关于溶液配制的计算,比如0.01mol/l的硫酸溶液.
 紫藤桔子1年前5
紫藤桔子1年前5 -
 襟怀也坦白 共回答了23个问题
襟怀也坦白 共回答了23个问题 |采纳率91.3%你先要知道要配多少体积的溶液,然后算出所需溶质的物质的量,再换算成质量(液体要算成体积),然后用容量瓶完成配制.
例:用98%(物质的量浓度为18.4mol/L)浓硫酸配制1L0.1mol/l的硫酸溶液
需要浓硫酸的体积=1*0.1/18.4=5.4ml,具体步骤为:量取5.4ml浓硫酸,溶于烧杯中的少量水中,待溶液冷却后转移到1L的容量瓶中,洗涤烧杯和玻璃棒2~3次,将每次洗涤液也转移到容量瓶中,容量瓶中加水至离刻度线1~2ml处,改用滴管定容,摇匀.1年前查看全部
- 初三化学溶液配制配制50g 11%的氯化钠溶液,需氯化钠()g ,水()g,近似地看做()ml,
 gmkm1年前1
gmkm1年前1 -
 xuhuiwa820616 共回答了20个问题
xuhuiwa820616 共回答了20个问题 |采纳率95%50克11%的氯化钠溶液含有溶质为:
50*11%=5.5克.所以需要氯化钠为【5.5】克.
50可溶液,去掉溶质,就是需要的溶剂---水:50-5.5=【44.5】克.
因为氯化钠溶于水溶液体积不会变化很大,近似的看做【44.5】ml1年前查看全部
- 实验室需要配制0.5mol•L-1的烧碱溶液500mL,根据溶液配制的过程,回答下列问题:
实验室需要配制0.5mol•L-1的烧碱溶液500mL,根据溶液配制的过程,回答下列问题:
(1)实验中除了托盘天平(带砝码)、药匙、量筒和玻璃棒外,还需要的其他玻璃仪器有:______;
(2)根据计算得知,所需NaOH固体的质量为______g;
(3)配制溶液的过程中,有以下操作.其中正确的是______(填代号).
A.将氢氧化钠固体放在纸片上称量
B.在烧杯中溶解氢氧化钠固体后,立即将溶液倒入容量瓶中
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中. 蛤蟆姑娘1年前1
蛤蟆姑娘1年前1 -
 爱_直至成伤 共回答了28个问题
爱_直至成伤 共回答了28个问题 |采纳率92.9%解题思路:(1)根据实验操作步骤以及玻璃仪器的作用选取仪器;
(2)依据m=cVM计算需要的氢氧化钠的质量;
(3)A.氢氧化钠具有腐蚀性,应放在小烧杯称量;
B.容量瓶为精密仪器不能盛放过热、过冷的液体;
C.配置过程应将全部溶质都转移到容量瓶.(1)配置0.5mol•L-1的烧碱溶液500mL,用500mL容量瓶配制溶液,用烧杯稀释浓硫酸,用胶头滴管定容,
故答案为:500ml容量瓶、烧杯、胶头滴管;
(2)配置0.5mol•L-1的烧碱溶液500mL,需要氢氧化钠的质量m=0.5mol•L-1×0.5L×40g/mol=10.0g;
故答案为:10.0;
(3)A.氢氧化钠具有腐蚀性,应用小烧杯称量,故A错误;
B.在烧杯中溶解氢氧化钠固体后,冷却到室温后将溶液倒入容量瓶中,故B错误;
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中,保证溶质全部转移的容量瓶,避免产生误差,故C正确;
故选:C.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制步骤以及用到的仪器,难度不大,注意实验的基本操作方法和注意事项.1年前查看全部
- be quick!怎样用含氯化钠质量分数为10%的食盐溶液配制质量分数是0.9%的盐水?
be quick!怎样用含氯化钠质量分数为10%的食盐溶液配制质量分数是0.9%的盐水?
同上 最美是你1年前1
最美是你1年前1 -
 艾汐 共回答了19个问题
艾汐 共回答了19个问题 |采纳率89.5%设加水Xg 列方程 质量除以总质量1年前查看全部
- 求讲解就是一个关于溶液配制的公式溶液密度 为P(是密度的那个符号)(g/ml)溶质的质量分数 w溶质的摩尔质量 M溶质的
求讲解
就是一个关于溶液配制的公式
溶液密度 为P(是密度的那个符号)(g/ml)
溶质的质量分数 w
溶质的摩尔质量 M
溶质的量的浓度 C
C=n/v=(1000vPw/M)/V
C=(1000PW)/M
其他都好理解 就是那个1000是怎么来的啊? 龙腾四海19761年前1
龙腾四海19761年前1 -
 我是小林林 共回答了16个问题
我是小林林 共回答了16个问题 |采纳率81.3%单位不同 物质的量浓度单位是摩尔每升(mol/L)
质量百分比浓度的单位是克每毫升g/ml
毫升和升的进制是10001年前查看全部
- 溶液配制题需配制400mL质量分数为10%的硫酸溶液,需质量分数为90%的浓硫酸和水各多少毫升?(20℃时,10%的硫酸
溶液配制题
需配制400mL质量分数为10%的硫酸溶液,需质量分数为90%的浓硫酸和水各多少毫升?(20℃时,10%的硫酸溶液的密度为1.07g每立方厘米,90%的浓硫酸的密度为1.81g每立方厘米)
请给我完整的科学步骤.谢 bingsihuo1年前1
bingsihuo1年前1 -
 dfgewrhre 共回答了16个问题
dfgewrhre 共回答了16个问题 |采纳率93.8%400ml 10%H2SO4质量为400*1.07=428g
其中含有H2SO4 428*10%=42.8g
H2O 428-42.8=385.2g
因此需要90%H2SO4溶液
42.8/90%=47.56g
需要90%H2SO4溶液体积为47.56/1.81=26.27ml
需要H2O的质量为385.2-47.56*10%=380.44g
也就是需要H2O体积为380.44/1=380.44ml1年前查看全部
- 溶液配制问题.如何让用一瓶500克含量90%的碳酸氢钠粉末配制出22.4%碳酸氢钠溶液?每克要加多少纯净水?
溶液配制问题.如何让用一瓶500克含量90%的碳酸氢钠粉末配制出22.4%碳酸氢钠溶液?每克要加多少纯净水?
想要具体的计算方法, lyr85101年前1
lyr85101年前1 -
 苯海拉鸣 共回答了17个问题
苯海拉鸣 共回答了17个问题 |采纳率88.2%500*90%=X*22.4% X=2009g 其它10%含的是水
需要加水的量=2009-450-50=1509g1年前查看全部
- 化学有关溶质质量分数,溶液配制和稀释的计算题怎么做?
 为你亡命dd1年前1
为你亡命dd1年前1 -
 libin_681 共回答了15个问题
libin_681 共回答了15个问题 |采纳率93.3%第一点:要记住基本公式溶质质量分数=溶质质量/溶液质量*100%
第二点:要找出题中质量不变的溶质或溶剂
第三点:要注意质量与体积之间的换算1年前查看全部
- 配制人英文怎么说制作表格的时候用到的 比如说一个溶液配制记录表格中的一个 配制人是谁谁谁
 cpy15731年前2
cpy15731年前2 -
 LeeCY 共回答了9个问题
LeeCY 共回答了9个问题 |采纳率88.9%最好把句子全部写上来,否则翻译可能不对.具体情况要看“配置人”是作名词,还是作动宾短语.如果是动宾短语可以用personnel allocation1年前查看全部
- 溶液配制计算题 配制一定浓度的溶液时一项重要的实验操作 实验室中提供100g15%的食盐溶液.足量的食盐固体和蒸馏水 要
溶液配制计算题 配制一定浓度的溶液时一项重要的实验操作 实验室中提供100g15%的食盐溶液.足量的食盐固体和蒸馏水 要求配制50g10%的食盐溶液 请你选用上述化学试剂 设计两种配置方案.
谢谢大家,这么晚也请见谅.到现在也没写完作业,请大家帮帮忙.
实在是不会这种题. 啊呐1年前1
啊呐1年前1 -
 lovefox 共回答了19个问题
lovefox 共回答了19个问题 |采纳率89.5%这种题目要求是溶液质量为50g 其中溶质质量为50g*10%=5g
15%的食盐溶液 食盐固体 蒸馏水
1 0 5g 45g
2 20g 2g 28g
3 10g 3.5g 36.5g
4 30 0.5g 19.5g1年前查看全部
- 你好.你曾回答的溶液配制的题目的第2题,我不太明白,可以再解释一遍吗,非常感谢
你好.你曾回答的溶液配制的题目的第2题,我不太明白,可以再解释一遍吗,非常感谢
http://zhidao.baidu.com/link?url=1Ud-CMGRCaC3v2clVDy-qTHG3NvAYmDIukyyNI6eP0uEtDJ37hL8J7Jep69Q7iCierpHClejNYrXbYGTaLRE_LpLB4Dfe5vGXbGIZ43_t8u cttoaap1年前1
cttoaap1年前1 -
 水美旮旯 共回答了18个问题
水美旮旯 共回答了18个问题 |采纳率94.4%铁铵矾的摩尔质量为482.18.按要求1.00μg/mL×500mL=500μg铁,换算成铁铵矾500×482.18/55.85=4316μg=4.316mg,质量太小,称量误差太大.可放大100倍称量,即用分析天平准确称量0.4316g,溶解后(控制溶液为酸性,即加入适量酸防止铁水解),定量移入500mL容量瓶中,稀至刻度摇匀,用精密刻度移液管准确移取5.00mL溶液于另外一个500mL容量瓶中,控制酸度,稀至刻度摇匀定容.所得溶液就是要求1.00μg的铁溶液.先配的溶液可作为母液保存,需要时再稀释成工作液(1.00μg的铁溶液).1年前查看全部
- 关于溶液配制,下列说法正确的是( ) A.配制480mL0.1mol/LCuSO 4 溶液,需要CuSO 4 •5H
关于溶液配制,下列说法正确的是( ) A.配制480mL0.1mol/LCuSO 4 溶液,需要CuSO 4 •5H 2 O晶体12.0g B.用浓硫酸配制稀硫酸时,将浓硫酸稀释后立即转入容量瓶中 C.称量5.3g碳酸钠固体时,若将物质和砝码放反,将会使称量结果偏小 D.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出  周子真1年前1
周子真1年前1 -
 lk1662 共回答了19个问题
lk1662 共回答了19个问题 |采纳率84.2%A、没有480mL的容量瓶,实际应配制500mL溶液,需要硫酸铜晶体的质量为0.5L×0.1mol/L×250g/mol=12.5g,故A错误;
B、浓硫酸溶解放出大量的热,不冷却立即转移定容,溶液冷却后所配溶液的体积偏小,所配溶液的浓度偏高,应冷却至室温后再转移溶液,故B错误;
C、称量5.3g碳酸钠固体时,若将物质和砝码放反,实际称量的碳酸钠的质量为5g-0.3g=4.7g,故C正确;
D、溶液高于刻度线,所配溶液的体积偏大,溶液的浓度偏小,溶液是均匀的,即使吸出多余的溶液,剩余溶液浓度等于原溶液的浓度,应重新配制,故D错误;
故选C.1年前查看全部
- 水可以部分电离出氧离子,氢氧根离子.为什么MgCl2溶液配制中没有沉淀?
 rhpwdbnbg1年前4
rhpwdbnbg1年前4 -
 feitianwushi 共回答了18个问题
feitianwushi 共回答了18个问题 |采纳率94.4%这个问题很简单,
方法一:本身因为水中电离出的就是一部分的氢氧根离子,而沉淀反生,要达到粒子的半径大于10^-7次方,而这里的氢氧根离子达不到这个要求.假设要是生成了,也就是说生成了氢氧化镁沉淀和盐酸,试想想,这个时候,盐酸干什么去了.所以,虽然镁离子会和氢氧根离子结合,但是这个时候体系刚好达到了一种氢离子和镁离子竞争的一个稳定点.所以氯化镁成酸性也是这个原因.
方法二:氯化镁可以说是盐酸和氢氧化镁的生成物.这时候,就在常温的状态下,忽然生成物有变成了反应物,而且还有沉淀跑出,这不是很纠结的吗.(这个反应可以理解为正反应大大大于逆反应的可以反应)1年前查看全部
- 八年级科学一道溶液配制题过程,实验室需要配制10%的盐酸500克,需要38%的盐酸多少毫升(38%盐酸的密度是1.19/
八年级科学一道溶液配制题过程,
实验室需要配制10%的盐酸500克,需要38%的盐酸多少毫升(38%盐酸的密度是1.19/立方厘米),***? amin69111年前1
amin69111年前1 -
 轻轻松松2007 共回答了12个问题
轻轻松松2007 共回答了12个问题 |采纳率91.7%需要38%的盐酸110.58毫升,具体是这样计算的
500g百分之十的盐酸里面含有氯化氢50g,50/0.38可得131.58g百分之三十八的盐酸才含有50g氯化氢,而它的密度是1.19.用131.58除以1.19就得到需要38%的盐酸为110.58毫升
配制方法为取110.58毫升38%的盐酸,再加入(500-131.58)克的水就行了1年前查看全部
- 为什么物质的量浓度的溶液配制时加水超过刻度线,应立即用滴管取出多的水,这话为什么是错的?
 franz_2231年前1
franz_2231年前1 -
 娃哈哈c315 共回答了13个问题
娃哈哈c315 共回答了13个问题 |采纳率69.2%必须要重新配置.用滴管吸取出了溶质,而且不知道到底是多少溶质.1年前查看全部
- 溶液配制的步骤(固体溶质)
 hhkj31年前2
hhkj31年前2 -
 十八年前的花 共回答了18个问题
十八年前的花 共回答了18个问题 |采纳率94.4%1.理论:
c=n/v (mol/L)
2.专用仪器:
容量瓶,天平,移液管,烧杯,玻璃棒和胶头滴管.
3.操作步骤:
1.计算:n=m/M , c=n/v , p=m/v
例:实验室用密度为1.18g/moL,质量分数为36.5%,浓盐酸配制250ml,0.3mol/L的盐酸溶液.
v=m/p=(0.25*0.3*36.5)/(36.5%*1.18)
2.称量或量取:固体试剂用托盘天平或电子天平称量,液体试剂用量筒.
3.溶应在烧杯中溶解,待冷却后转入容量瓶中.
4.转移:由于容量瓶的颈较细,为了避免液体洒在外面,用玻璃棒引流.
5.洗涤:用少量蒸馏水洗涤2到3次,洗涤液全部转入到容量瓶中.
6.定容:向容量瓶中加入蒸馏水,在距离刻度2到3cm时,改用胶头滴管加之刻度线.
4.影响配制溶液:
1.称量时引起误差.
2.未将烧杯洗涤,使溶液的物质量减少,导致溶液浓度偏低.
3.转移时不小心溅出溶液,导致浓度偏低.
http://baike.baidu.com/view/1655437.html?wtp=tt
这是百科里现成的 不过已经很详细1年前查看全部
- 配置0.9%的NaCl溶液,将称量的NaCl放入烧杯中加计量的水搅拌溶解.想问,溶液配制不是要用到容量瓶吗?
配置0.9%的NaCl溶液,将称量的NaCl放入烧杯中加计量的水搅拌溶解.想问,溶液配制不是要用到容量瓶吗?
为什么这个配制溶液不要用到容量瓶? sdwf91年前1
sdwf91年前1 -
 趴趴鸭KKK 共回答了11个问题
趴趴鸭KKK 共回答了11个问题 |采纳率90.9%非常精确的配置需要用到容量瓶,更精确的还需要标定
对于比较不精确的用移液管,量筒,烧杯也可以1年前查看全部
- 一道化学误差讨论题,要求有解析高中化学必修一现在我一轮复习遇到这样一个问题,溶液配制,溶液从烧杯转移至容量瓶中时没有恢复
一道化学误差讨论题,要求有解析
高中化学必修一现在我一轮复习遇到这样一个问题,溶液配制,溶液从烧杯转移至容量瓶中时没有恢复室温就转移,造成的结果是测量浓度偏大,原因是什么 华立方1年前2
华立方1年前2 -
 abb514 共回答了20个问题
abb514 共回答了20个问题 |采纳率95%水的密度,水的密度在温度高时要变小,高温定容后待降到室温时体积变小导致溶液浓度增大1年前查看全部
- 物质的量的浓度溶液配制为什么不用称水?以前初中的溶液配制不是要称水的吗?
 离伤1年前3
离伤1年前3 -
 望能如愿 共回答了16个问题
望能如愿 共回答了16个问题 |采纳率93.8%因为物质的量浓度 比(除)的是溶液体积,容量瓶有标准的刻线.根据计算放入一定体积浓溶液后加水至刻线即可 不需要称水
初中的溶液配制的浓度 比(除)的是溶液质量.必须要算出加水的体积来量取进行混合配制1年前查看全部
- 实验室需要0.1 mol·L-1NaOH溶液450 mL,根据溶液配制情况回答下列问题: (1)实验中除了托盘天平、量筒
实验室需要0.1 mol·L-
1NaOH溶液450 mL,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平、量筒、烧杯、容量瓶、药匙外还需要的其他仪器有:_______________ (2)根据计算得知,所需NaOH的质量为________g.
(3)下列操作使所配溶液浓度偏大的有________(选填字母,下同);偏小的有________;无影响的有________.A.称量时用生锈的砝码 B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 D.往容量瓶转移溶液时,有少量液体溅出 E.未洗涤溶解NaOH的烧杯 F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
(4)下图是某同学在实验室配制该NaOH溶液的过程示意图,据此回答下列问题:观察配制NaOH溶液的过程示意图,指出其中有错误的是________(填操作序号).
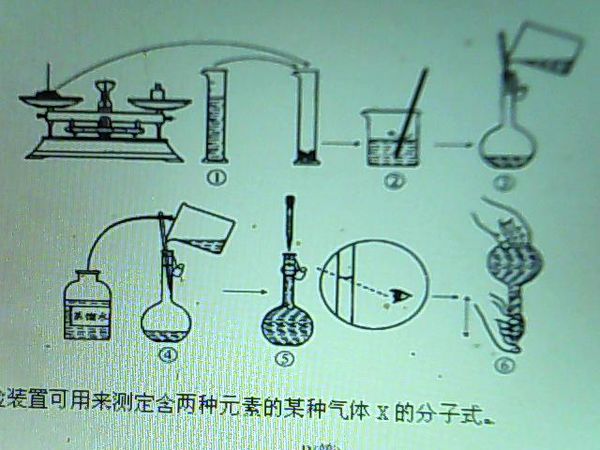
 放不开你的爱1年前4
放不开你的爱1年前4 -
 好男大逃杀倒计时 共回答了13个问题
好男大逃杀倒计时 共回答了13个问题 |采纳率84.6%1年前查看全部
- 实验室需要配制1.0mol/L硫酸溶液500mL,根据溶液配制情况回答下列问题:
实验室需要配制1.0mol/L硫酸溶液500mL,根据溶液配制情况回答下列问题:
(1)实验中除了烧杯、量筒、玻璃棒外还需要的其它仪器有:______.
(2)根据计算得知,所需质量分数为98%、密度为1.84g/cm 3 的浓硫酸体积为______mL.(计算结果保留一位小数)
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作:
A.量取浓硫酸的量筒内有少量水;
B.浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中;
C.住容量瓶转移时,有少量液体溅出
D.将量筒洗涤后洗涤液一并转入容量瓶
E.定容时仰视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
对配制的溶液物质的量浓度可能造成偏大的有______(填写字母);无影响有______. 超越是一种美1年前1
超越是一种美1年前1 -
 陌上优花 共回答了16个问题
陌上优花 共回答了16个问题 |采纳率93.8%(1)配制500ml1.0mol/L稀硫酸,操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以需要的仪器为:烧杯、筒量、玻璃棒、500mL容量瓶、胶头滴管.
所以还需要的仪器是:500mL容量瓶、胶头滴管,故答案为:500mL容量瓶、胶头滴管;
(2)质量分数为98%、密度为1.84g/cm 3 的浓硫酸的物质的量浓度为
1000×1.84×98%
98 mol/L=18.4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×1.0mol/L,解得:x≈27.2,故答案为:27.2;
(3)A.量取浓硫酸的量筒内有少量水,量取浓硫酸的体积偏小,所配溶液浓度偏小;
B.浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中进行定容,溶液冷却后导致所配溶液的体积偏小,溶液浓度偏大;
C.住容量瓶转移时,有少量液体溅出,移入容量瓶内的硫酸减少,所配溶液浓度偏小;
D.量筒为流量式仪器,将量筒洗涤后洗涤液一并转入容量瓶,移入容量瓶内硫酸增大,所配溶液浓度偏大;
E.定容时仰视刻度线,导致所配溶液的体积偏大,溶液浓度偏小;
F.溶液配制需加水定容,容量瓶未干燥即用来配制溶液,对所配溶液浓度无影响;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,所配溶液的体积偏大,溶液浓度偏小.
对配制的溶液物质的量浓度可能造成偏大的有BD;无影响有F.
故答案为:BD;F.1年前查看全部
- 化学溶液配制的计算问题要配置490g质量分数为20%的硫酸.需质量分数为98%的硫酸多少克?需水多少克?
 仙棕榈1年前1
仙棕榈1年前1 -
 junjun0403 共回答了13个问题
junjun0403 共回答了13个问题 |采纳率76.9%稀释前后溶质的质量不变
设需质量分数为98%的硫酸x克,则有
490g*20%=98%x
x=100g
需水的质量=490g-100g=390g1年前查看全部
大家在问
- 1英语翻译那就是说其中的 u 读:就读汉语拼音的 还是“额”的音呢?
- 2用 154.2cm的绳子围成一个半圆形,求它的直径
- 3企业名称中的字号可以是一个汉字吗?
- 4麻烦英语老师做这题初中英语习题:
- 5拥挤用英语怎么说
- 6以my view computer为题写一篇英语作文不少于80个字母
- 7求一篇英语作文 题目是I want to do something meaningful 最好200字左右 要具体的事
- 8请教一个汉字的读音及其意思.(护,去掉“言”字旁换成"虫"字旁)组成的词汇尺濩什么意思?
- 9污水处理PAM絮凝剂如何解决溶解慢的问题
- 10按图中数字规律,问号处的数字是______.
- 11连词成句 i,how,get,can,there?
- 121.The soldier was wounded,____ he pushed on.
- 13please tell me when you ___ tomorrow. i will meet you at the
- 14令人快乐的一本书作文怎么乌
- 15已知某行星半径为R,以其第一宇宙速度运行的卫星的绕行周期为T,该行星上发射的同步卫星的运行速度为v.求

