硫铁矿烧渣主要成分有Fe2O3、FeO、CaO、SiO2等,工业上常用于制备氧化铁红(Fe2O3)、硫铁矿经过褐煤还原焙
 Flora_Dad2022-10-04 11:39:541条回答
Flora_Dad2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 虫虫不虫虫 共回答了18个问题
虫虫不虫虫 共回答了18个问题 |采纳率88.9%- Fe2O3、FeO
不是sio2 - 1年前
相关推荐
- 硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质).用该
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:

(1)在“还原焙烧”中产生的有毒气体可能有______.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是______(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于______,常温下,当pH=5时,溶液中c(Al3+)=______mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是______. free的pig1年前1
free的pig1年前1 -
 路过蜻蜓80 共回答了18个问题
路过蜻蜓80 共回答了18个问题 |采纳率94.4%解题思路:工业废渣主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质,加煤燃烧可生成CO、SO2等有毒气体,加硫酸后只有二氧化硅不反应,酸浸时间过长,溶液中Fe2+含量将下降,被氧化生成Fe3+,过滤除去二氧化硅,然后除杂时结合生成沉淀的pH可知,pH大于4.77,小于7.11时Fe3+和Al3+完全转化为沉淀,而亚铁离子没有转化为沉淀,“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,过滤得到A为碳酸亚铁,需要洗涤、干燥,然后加热得到氧化铁,以此来解答.工业废渣主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质,加煤燃烧可生成CO、SO2等有毒气体,加硫酸后只有二氧化硅不反应,酸浸时间过长,溶液中Fe2+含量将下降,被氧化生成Fe3+,过滤除去二氧化硅,然后除杂时结合生成沉淀的pH可知,pH大于4.77,小于7.11时Fe3+和Al3+完全转化为沉淀,而亚铁离子没有转化为沉淀,“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,过滤得到A为碳酸亚铁,需要洗涤、干燥,然后加热得到氧化铁,
(1)由上述分析可知,“还原焙烧”中产生的有毒气体可能有CO、SO2等,故答案为:CO、SO2等;
(2)在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是4Fe2++O2+4H+=4Fe3++2H2O,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(3)由生成沉淀的pH可知,pH大于4.77,小于7.11时Fe3+和Al3+完全转化为沉淀,而亚铁离子没有转化为沉淀,则除去Fe3+和Al3+,溶液的pH最大值应小于7.11;当pH=5时,溶液中c(Al3+)=
2.0×10−33
(10−9)3=2.0×10-6mol/L,故答案为:7.11;2.0×10-6;
(4)A为碳酸亚铁,需要洗涤、干燥,然后加热得到氧化铁,故答案为:洗涤、干燥.点评:
本题考点: 制备实验方案的设计;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查制备实验方案的设计,为高频考点,把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验、计算能力的综合考查,题目难度不大.1年前查看全部
- (2012•梅州一模)工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3
(2012•梅州一模)工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3 ),具体生产流程如下:

试回答下列问题:
(1)滤液X中含有的金属阳离子是______(填离子符号).
(2)步骤Ⅲ中可选用______试剂调节溶液的pH(填字母).
A.稀硝酸B.氨水 C.氢氧化钠溶液D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3 达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol•L-1.试判断所得FeCO3 中是否混有Fe(OH)2______(填“是”或“否”),请通过简单计算说明理由______ (已知:Ksp[Fe(OH)2]=4.9×10-17).
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是______.
(5)在空气中煅烧FeCO3 生成产品氧化铁的化学方程式为4FeCO3+O2
2Fe2O3+4CO2高温 .4FeCO3+O2.
2Fe2O3+4CO2高温 . 糊塌子1年前1
糊塌子1年前1 -
 jy02536131 共回答了15个问题
jy02536131 共回答了15个问题 |采纳率93.3%解题思路:(1)硫铁矿烧渣主要成分为Fe2O3、FeO、SiO2等,依据酸浸后铁的氧化物和酸反应溶解,二氧化硅不与酸反应分析判断;
(2)依据步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液PH至5-6.5,试剂不能氧化亚铁离子,不能是碱性强的溶液;
(3)依据浓度商和溶度积常数比较分析判断,Q<Ksp沉淀溶解,Q>Ksp沉淀溶解,Q=Ksp沉淀溶解达到平衡;
(4)温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,原子守恒配平写出;(1)硫铁矿烧渣主要成分为Fe2O3、FeO、SiO2等,酸浸后铁的氧化物和酸反应溶解,二氧化硅不与酸反应,氧化铁溶解后生成铁离子,氧化亚铁溶解后生成亚铁离子,故答案为:Fe2+、Fe3+;
(2)由步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液pH至5-6.5,试剂不能氧化亚铁离子,强碱性溶液会沉淀亚铁离子,
A.稀硝酸具有氢氧化性能氧化亚铁离子,故A不符合;
B.氨水是弱碱,可以调节溶液PH,故B符合;
C.氢氧化钠溶液 是强碱溶液,加入会沉淀亚铁离子,故C不符合;
D.高锰酸钾溶液具有氢氧化性,能氧化亚铁离子,故D不符合;
故选B;
(3)由浓度商和溶度积常数比较分析判断,Q<Ksp沉淀溶解,Q>Ksp沉淀溶解,Q=Ksp沉淀溶解达到平衡,溶液中c(Fe2+)•c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成,
故答案为:否;溶液中c(Fe2+)•c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成;
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解,故答案为:防止NH4HCO3分解,减少Fe2+的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,由原子守恒配平后反应的化学方程式为4FeCO3+O2
高温
.
2Fe2O3+4CO2,
故答案为:4FeCO3+O2
高温
.
2Fe2O3+4CO2.点评:
本题考点: 铁的氧化物和氢氧化物;难溶电解质的溶解平衡及沉淀转化的本质;制备实验方案的设计.
考点点评: 本题考查了铁及其化合物性质的分析应用,主要是流程分析理解和反应过程的判断,题目难度中等.1年前查看全部
- (2011•江苏模拟)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2)等是工业生产硫酸的废渣,利用硫铁矿烧
(2011•江苏模拟)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2)等是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如图所示:

(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是______.(填字母)
A、铝 B、锌 C、碳
(2)酸浸、过滤后滤液中的主要成分是______.
(3)反应Ⅰ的反应温度一般需控制在35℃以下,其目的是______.
(4)空气中煅烧FeCO3生成产品b的化学反应方程式为4FeCO3 +O2
2Fe2O3 +4CO2高温 .4FeCO3 +O2.
2Fe2O3 +4CO2高温 .
(5)检验产品a中是否含有氯化物杂质的实验操作时:取少量产品a于试管中配成溶液,______. 82feng1年前1
82feng1年前1 -
 jia860522 共回答了21个问题
jia860522 共回答了21个问题 |采纳率95.2%解题思路:硫铁矿烧渣在灼烧时加入碳,发生氧化还原反应生成铁,加入硫酸后生成硫酸亚铁,过滤后得到的滤渣为二氧化硅,滤液中加入碳酸氢铵溶液,可生成碳酸亚铁固体,经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成铁红,反应Ⅰ过滤后所得溶液为硫酸铵和碳酸氢铵的混合物,加入硫酸得到硫酸铵,加入氯化钾可得到氯化铵和硫酸钾,以此解答该题.(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是碳,如加入铝、锌,可引入新杂质,而加入碳被氧化生成CO2气体,不会引入新杂质,故答案为:C;
(2)焙烧后的固体为铁和二氧化硅的混合物,加入硫酸生成硫酸亚铁,如硫酸过量,则滤液中还含有硫酸,故答案为:FeSO4 (或H2SO4和FeSO4);
(3)为防止NH4HCO3分解(或减少Fe2+的水解),反应Ⅰ的反应温度一般需控制在35℃以下,故答案为:防止NH4HCO3分解(或减少Fe2+的水解);
(4)空气中煅烧FeCO3生成铁红,反应的方程式为4FeCO3 +O2
高温
.
2Fe2O3 +4CO2,故答案为:4FeCO3 +O2
高温
.
2Fe2O3 +4CO2;
(5)产品a主要为硫酸钾,为检验是否含有氯化物杂质,应加入硝酸银,但在加入硝酸银之前应加入过量的硝酸钡溶液,以除去硫酸根离子,过滤后再加入硝酸银溶液,故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液.点评:
本题考点: 制备实验方案的设计;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查物质的制备,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握实验的流程和制备原理,难度中等.1年前查看全部
- (2013•南京二模)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧
(2013•南京二模)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(氧化铁)等产品的部分流程如下图所示:

(1)硫铁矿是______物(填“纯净”或“混合”).
(2)写出碳与Fe3O4反应的化学方程式2C+Fe3O4
3Fe+2CO2↑高温 .2C+Fe3O4.
3Fe+2CO2↑高温 .
(3)酸浸过滤后滤液中的溶质主要是______.
(4)反应Ⅰ的反应温度一般需控制在35℃以下,其目的是______.
(5)实验探究:产品a的主要成分是K2SO4,试设计实验探究产品a中是否含有氯化物(Cl-)杂质.
实验过程:
操作 现象 结论 ①取产品a的溶液少许,加入______
______目的是除尽产品中的K2SO4,避免干扰 Cl-的检验 ②过滤,向滤液中加 AgNO3溶液
______原样品中含有氯化物(Cl-)杂质  991年前1
991年前1 -
 shudong_liao 共回答了23个问题
shudong_liao 共回答了23个问题 |采纳率82.6%解题思路:(1)根据硫铁矿的组成考虑;(2)根据方程式的书写考虑;(3)根据酸浸后发生的反应考虑生成物;(4)根据碳酸氢铵受热易分解考虑;(5)根据氯离子的检验方法考虑.(1)根据硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)可知硫铁矿中含有很多物质,属于混合物;
(2)C与Fe3O4反应的反应物是碳与四氧化三铁写在等号的左边,生成物是铁和二氧化碳写在等号的右边,用观察法配平,反应条件是高温,所以方程式是:2C+Fe3O4
高温
.
3Fe+2CO2↑;
(3)酸浸后发生的反应是铁与硫酸反应生成硫酸亚铁和氢气,所以酸浸、过滤后滤液中的溶质主要是硫酸亚铁;
(4)因为碳酸氢铵受热分解为氨气、水、二氧化碳,所以反应I的反应温度一般需控制在35℃以下,其目的是防止碳酸氢铵受热分解;
(5)产品a主要为硫酸钾,为检验是否含有氯化物杂质,应加入硝酸银,但在加入硝酸银之前应加入过量的硝酸钡溶液,以除去硫酸根离子,过滤后再加入硝酸银溶液,故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液.
故答案为:(1)混合;(2)2C+Fe3O4
高温
.
3Fe+2CO2↑;(3)FeSO4 (或H2SO4和FeSO4);(4)防止NH4HCO3分解;(5)
操作 现象 结论
①取产品a的溶液少许,加入 加足量(或过量)Ba(NO3)2溶液
产生白色沉淀 目的是除尽产品中的K2SO4,避免干扰 Cl-的检验
②过滤,向滤液中加 AgNO3溶液
产生白色沉淀 原样品中含有氯化物(Cl-)杂质点评:
本题考点: 物质的相互转化和制备.
考点点评: 解答本题关键是要知道方程式的书写注意事项,知道纯净物与混合物的区别是:是否由一种物质组成;知道碳酸氢铵受热易分解.1年前查看全部
- (2014•镇江二模)兴趣小组分析了用硫铁矿烧渣(主要成份Fe203、Fe304、FeO等)制备铁红(Fe2O3)
(2014•镇江二模)兴趣小组分析了用硫铁矿烧渣(主要成份Fe203、Fe304、FeO等)制备铁红(Fe2O3) 的流程图并进行了铁红性质实验.
(一)铁红制备的流程图分析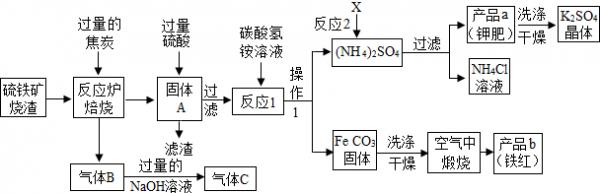
(1)写出焙烧中CO与Fe203反应的化学方程式Fe203+3C0
2Fe+3C02高温 .Fe203+3C0.
2Fe+3C02高温 .
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和______(填仪器名称)
(3)你认为对气体C最佳的处理方法是______.
A.冷却后排入空气B.燃烧后排放C.再通入反应炉
(4)反应1的反应温度一般需控制在35℃以下,其目的是______.
(5)反应2中相关物质的溶解度如表.你认为该反应在常温下能实现的原因是______.
洗涤干燥得到K2S04晶体时,可选用下列______(填字母)洗涤剂;物质 X K2SO4 NH4Cl (NH4)2SO4 溶解度g(25℃) 34.0 11.1 37.2 19.5
A.KCl的饱和溶液B.水C.K2S04的饱和溶液
为检验K2S04晶体是否洗涤干净,可取最后一次洗涤液,先加入______(选填序号,下同),振荡、静置,再向上层清液中滴加______,观察现象即可判断.
A.AgN03溶液B.过量的BaCl2溶液C.过量的Ba(N03)2溶液
(二)铁红的性质实验
【问题讨论】
【资料1】草酸晶体(H2C204•3H20)在浓H2S04作用下受热分解,化学方程式为:
H2C2O4•3H2O
C02↑+C0↑+4H20△ .
(6)实验前应先______.
(7)进入E中的气体是纯净、干燥的CO,则B、D中的试剂依次是______、______(填字母编号).
A.浓硫酸 B.澄清的石灰水C.氢氧化钠溶液
(8)C装置的作用是______.
【数据分析与计算】
用SDTQ600热分析仪对氧化铁(Fe2O3)和CO进行热反应分析,获得相关数据,绘制成管内剩余固体质量〜反应温度的关系如图2.
【资料2】已知铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁.
(9)800℃以上时,管内固体成分的化学式为______;
(10)写出管内固体质量由48g变为46.4g时反应的化学方程式3Fe203+C0
2Fe304+C02高温 .3Fe203+C0.
2Fe304+C02高温 .
【实验评价】
请指出【问题讨论】中实验装置的一个明显缺陷. 未语殇1年前1
未语殇1年前1 -
 lisongyf 共回答了16个问题
lisongyf 共回答了16个问题 |采纳率81.3%解题思路:(一)(1)根据方程式的写法进行回答;(2)根据过滤时用到的玻璃仪器考虑;(3)根据一氧化碳过量及一氧化碳的化学性质及用途分析;(4)根据碳酸氢铵受热易分解考虑;(5)根据生成物的溶解度大小分析反应能否发生;根据实验的目的分析可知,检验氯离子时需要排除硫酸根离子的干扰.(二)(6)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,实验前应先检查装置的气密性;(7)二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,二氧化碳可以用浓硫酸干燥;(8)澄清石灰水是验证气体中是否含有二氧化碳的;(9)通过分析资料确定,800℃时氧化铁和一氧化碳进行反应的产物;(10)根据质量变化分析生成物,再写出化学方程式;【实验评价】没有参加反应的一氧化碳污染空气(一)(1)反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,反应条件是高温,用观察法配平即可,所以方程式是:Fe203+3C0
高温
.
2Fe+3C02;
(2)把不溶于液体的固体和液体分离方法是过滤,过滤用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
(3)反应炉中一氧化碳还原氧化铁生成铁和二氧化碳,过量的一氧化碳会随二氧化碳逸出,因此气体B为一氧化碳和二氧化碳的混合气体,通过足量的氢氧化钠溶液后,二氧化碳与氢氧化钠反应生成碳酸钠和水,因此气体C主要成分是一氧化碳,一氧化碳可作为还原剂重复利用
(4)因为碳酸氢铵受热分解为氨气、水、二氧化碳,所以反应I的反应温度一般需控制在35℃以下,其目的是防止碳酸氢铵受热分解;
(5)根据复分解反应发生的条件,反应2中没有不溶物,但常温下硫酸钾的溶解度很小,在生成物中会以沉淀形式出现,所以反应可以发生,所以反应2在常温下能实现的原因是:常温下K2SO4的溶解度小,用硫酸钾饱和溶液清洗硫酸钾晶体,硫酸钾晶体不会减少,如果用水或其它溶液都会溶解一部分硫酸钾晶体;
因为硫酸根离子和银离子也会生成白色的硫酸银沉淀,所以需要先检验硫酸根离子,然后再检验氯离子,检验硫酸根离子可以加入硝酸钡溶液,加入氯化钡溶液,会引入氯离子,对氯离子的检验后造成干扰,所以为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入c,振荡、静置,再向上层清液中滴加a,观察现象即可判断.
(二)(6)实验前应先检查装置的气密性,否则会由于漏气使实验失败;
(7)二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,一氧化碳可以用浓硫酸干燥;所以A中盛放的是氢氧化钠溶液,吸收二氧化碳,氢氧化钙是验证二氧化碳是否被除净,C中盛放的是浓硫酸,吸收水分;
(8)C装置是检验二氧化碳是否除尽,故答案为:验证二氧化碳已除尽
(9)由铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁,可知在800℃以上时,管内固体质量不再减少,说明只有铁了;
(10)根据固体质量的减少量可知开始一氧化碳与氧化铁反应生成四氧化三铁,随着温度升高再生成氧化亚铁,最后生成铁,所以在管内固体质量由48g变为46.4g时反应物是一氧化碳和氧化铁,生成物是四氧化三铁和二氧化碳,用观察法配平即可,所以方程式是:3Fe203+C0
高温
.
2Fe304+C02.
【实验评价】没有参加反应的一氧化碳污染空气,所以缺点是缺少尾气处理装置.
故答案为:(1)Fe203+3C0
高温
.
2Fe+3C02
(2)漏斗
(3)C
(4)防止碳酸氢铵受热分解
(5)常温下K2S04的溶解度小(意思相近均给分)C、C、A
(6)检查装置气密性
(7)C、A
(8)检验二氧化碳是否被除尽(意思相近均给分)
(9)Fe
(10)3Fe203+C0
高温
.
2Fe304+C02
【实验评价】
缺少尾气处理装置(意思相近均给分).点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;结晶的原理、方法及其应用;常见气体的检验与除杂方法;证明硫酸和可溶性硫酸盐;铁的冶炼;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要知道从题目中提取有用信息,熟悉化学方程式的书写步骤,锻炼了学生分析问题解决问题的能力.1年前查看全部
- 查阅资料:42O、M口O在高温下与4难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2Ow及少量SiO2、2
查阅资料:42O、M口O在高温下与4难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2Ow及少量SiO2、242Ow、42O、M口O等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:

(的)焙烧时产生的主要有害气体是______.
(2)为测定过滤所得滤液中Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,写出该反应的离子方程式:______;实验中所用酸性高锰酸钾溶液浓度为0.的0mo4/4,滤液用______滴定管量取20.00m4,用酸性高锰酸钾溶液滴定到终点时消耗了标准的酸性高锰酸钾溶液的2.04m4,滤液中4(Fe2+)=______.
(w)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:______(用离子方程式表示).
(4)根据下表数据:
在“除杂”步骤中,为除去Few+和24w+,溶液的p口最大值应小于______,检验Few+已经除尽的试剂是______(除KS4N外).氢氧化物 24(O口)w Fe(O口)w Fe(O口)2 开始沉淀的p口 w.的0 2.0的 7.的的 万全沉淀的p口 4.77 w.50 9.5的
(5)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则2的操作是______. 微波上的舞1年前1
微波上的舞1年前1 -
 尚家qq委 共回答了12个问题
尚家qq委 共回答了12个问题 |采纳率91.7%解题思路:(1)硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),依据流程分析,加入碳还原会和二氧化硅反应生成硅和一氧化碳,硫铁矿燃烧会生成二氧化硫;
(2)依据高锰酸钾溶液氧化亚铁离子为铁离子,本身被还原为锰离子,依据电荷 守恒,电子守恒,原子守恒配平书写离子方程式,滤液呈酸性需要用酸性滴定管取用,依据离子方程式计算得到滤液中亚铁离子物质的量得到亚铁离子的浓度;
(3)在空气中“酸浸”时间过长,溶液中Fe2+含量将下降的原因是亚铁离子在酸性溶液中被氧气氧化为铁离子;
(4)除去Fe3+和Al3+,依据图表中沉淀所需PH分析判断,检验铁离子除KSCN外,可以加入苯酚出现紫色证明铁离子的存在;
(5)将溶液中Fe2+转变为碳酸亚铁沉淀,防止混入杂质,需要对沉淀继续洗涤干燥;(1)硫铁矿烧渣是一种工业废渣(含F01O3及少量SiO1、Al1O3、6aO、MpO等杂质),依据流程分析,加入碳还原会和二氧化硅反应生成硅和一氧化碳,硫铁矿燃烧会生成二氧化硫,生成的污染性气体为一氧化碳和二氧化硫,
故答案为:6O、SO1;
(1)依据高锰酸钾溶液氧化亚铁离子为铁离子,本身被还原为锰离子,依据电荷 守恒,电子守恒,原子守恒配平书写离子方程式为:MnOe-+5F01++8H+═Mn1++5F03++eH1O,滤液呈酸性需要用酸性滴定管取用,依据离子方程式计算5到滤液2亚铁离子物质的量,
MnOe-+5F01++8H+═Mn1++5F03++eH1O,
1 5
0.10mol/L×0.011.0el n(F01+)
n(F01+)=0.00601mol
5到亚铁离子的浓度为[0.00601mol/0.01L]=0.0301mol/L,
故答案为:酸式,0.0301mol/L;
(3)在空气2“酸浸”时间过长,溶液2F01+含量将下降的原因是亚铁离子在酸性溶液2被氧气氧化为铁离子,反应的离子方程式为:eF01++O1+eH+═eF03++1H1O,
故答案为:eF01++O1+eH+═eF03++1H1O;
(e)除去F03+和Al3+,依据图表2沉淀所需PH分析,溶液PH小于7.11时,亚铁离子不沉淀,铁离子和铝离子完全沉淀,检验铁离子除KS6N外,可以加入苯酚出现紫色证明铁离子的存在,
故答案为:7.11,苯酚;
(5)将溶液2F01+转变为碳酸亚铁沉淀,防止混入杂质,需要对沉淀继续洗涤干燥,
故答案为:洗涤或洗涤、干燥;点评:
本题考点: 铁的氧化物和氢氧化物;物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查了流程分析判断满屋子性质的分析和反应实验的现象和步骤是解题关键,滴定实验的掌握,除杂的分析应用是解题关键,题目难度中等.1年前查看全部
- (2013•仪征市二模)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁
(2013•仪征市二模)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(氧化铁)等产品的部分流程如下图所示:

(1)硫铁矿烧渣是______物(填“纯净”或“混合”).
(2)请写出反应炉中CO与Fe3O4反应的化学方程式4CO+Fe3O4
3Fe+4CO2高温 .4CO+Fe3O4;
3Fe+4CO2高温 .
(3)溶液D中的溶质主要是______(填化学式);
(4)实验室完成操作①,用到的玻璃仪器有烧杯、玻璃棒和______(填仪器名称)
(5)气体C的主要成分是______; 你认为对气体C最佳的处理方法是______.
A.冷却后排入空气B.燃烧后排放C.再通入反应炉
(6)为了检验FeCO3固体是否洗涤干净,可以向最后的洗出液中加入______
A.硝酸钾溶液B.氯化钡溶液C.氯化钠溶液
(7)在空气中煅烧FeCO3生成Fe2O3与CO2,该反应的化学反应方程式为4FeCO3+O2
2Fe2O3+4CO2高温 .4FeCO3+O2.
2Fe2O3+4CO2高温 . terrykoy1年前1
terrykoy1年前1 -
 胖十斤 共回答了18个问题
胖十斤 共回答了18个问题 |采纳率88.9%解题思路:(1)根据硫铁矿烧渣的成分分析类别;
(2)根据在高温下CO与Fe3O4的反应写出反应的方程式;
(3)在高温条件下,一氧化碳与Fe2O3、Fe3O4、FeO反应生成的固体是铁,根据铁与过量的硫酸反应分析溶液D中的溶质;
(4)根据过滤的操作过程分析应选择的仪器;
(5)根据在高温下反应炉内发生的反应,分析气体B、C的成分,C的合理的处理方法;
(6)根据硫酸根离子的检验方法分析FeCO3固体是否洗涤干净;
(7)根据在空气中煅烧FeCO3生成了Fe2O3与CO2,写出反应的方程式.(1)由于硫铁矿烧渣是由Fe2O3、Fe3O4、FeO等多种物质组成的,属于混合物;
(2)在高温条件下,CO与Fe3O4的反应生成了铁和二氧化碳,反应的方程式是:4CO+Fe3O4
高温
.
3Fe+4CO2;
(3)由题意可知,在高温条件下,一氧化碳与Fe2O3、Fe3O4、FeO反应生成的固体是铁,铁与过量的硫酸反应生成了硫酸亚铁和氢气,所以,溶液D中的溶质是硫酸亚铁和剩余的硫酸;
(4)由于硫酸亚铁与碳酸氢铵反应,生成了碳酸亚铁沉淀和硫酸铵,应通过过滤的操作分离,过滤时应用到的玻璃仪器有烧杯、玻璃棒和漏斗;
(5)反应炉内,在高温下过量的焦炭与氧气、与碳反应一氧化碳与铁的氧化物反应,得到的气体B的主要成分是二氧化碳和一氧化碳的混合物,再通过足量的氢氧化钠溶液得到的气体C是一氧化碳,由于一氧化碳有还原性,能还原铁的氧化物.所以,最好的处理方法是再通入反应炉中;
(6)由于硫酸根离子与钡离子结合生成了硫酸钡沉淀.所以,可以用氯化钡溶液来检验FeCO3固体是否洗涤干净,如向最后的洗出液中加入氯化钡溶液,不产生白色沉淀,则证明洗涤干净了;
(7)在空气中煅烧FeCO3生成Fe2O3与CO2,该反应的方程式是:4FeCO3+O2
高温
.
2Fe2O3+4CO2.
故答为:(1)混合;(2)4CO+Fe3O4
高温
.
3Fe+4CO2;(3)FeSO4和H2SO4;(4)漏斗;(5)CO,C;(6)B;(7)4FeCO3+O2
高温
.
2Fe2O3+4CO2.点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题的综合性较强,涉及的知识点较多,只有全面地掌握有关物质的组成、化学方程式的书写、离子的检验、一氧化碳的还原性、毒性等知识才能较好地完成本题.1年前查看全部
- (2013•惠山区一模)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁
(2013•惠山区一模)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(氧化铁)等产品的部分流程如图所示:
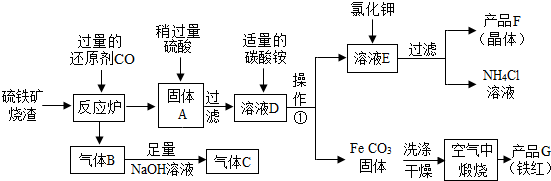
(1)请你写出还原剂CO与Fe3O4反应的化学方程式4CO+Fe3O4
3Fe+4CO2高温 .4CO+Fe3O4;
3Fe+4CO2高温 .
(2)溶液D中的溶质主要是______(填化学式);
(3)操作①的名称是______;
(4)气体C的主要成分是______(填化学式);你认为对气体C最佳的处理方法是______. 孤鹰王1年前1
孤鹰王1年前1 -
 hansjob 共回答了15个问题
hansjob 共回答了15个问题 |采纳率100%解题思路:(1)根据方程式的书写考虑
(2)根据流程图以及反应过程分析物质
(3)根据分离混合物的方法分析
(4)根据一氧化碳过量及一氧化碳的化学性质及用途分析(1)一氧化碳与四氧化三铁反应生成铁和二氧化碳,化学方程式为
(2)根据流程图反应炉中一氧化碳还原四氧化三铁生成铁和二氧化碳,固体A为铁,加入稍过量的硫酸,铁和硫酸反应生成硫酸亚铁和氢气,溶液D中含有硫酸亚铁和过量的硫酸,化学式为FeSO4、H2SO4
(3)操作①是将固体碳酸亚铁和液体分开,因此采用过滤方法.
(4)反应炉中一氧化碳还原四氧化三铁生成铁和二氧化碳,过量的一氧化碳会随二氧化碳逸出,因此气体B为一氧化碳和二氧化碳的混合气体,通过足量的氢氧化钠溶液后,二氧化碳与氢氧化钠反应生成碳酸钠和水,因此气体C主要成分是一氧化碳,一氧化碳可作为还原剂重复利用
故答案为:(1)4CO+Fe3O4
高温
.
3Fe+4CO2;
(2)FeSO4、H2SO4
(3)过滤;
(4)CO 作为还原剂重复利用点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题考查一氧化碳的还原性及分离混合物的方法,一氧化碳可用来还原金属氧化物.1年前查看全部
- 一道高考化学题 求学霸老师解答为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以
一道高考化学题 求学霸老师解答
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的工业原料FeSO4(反应条件略)
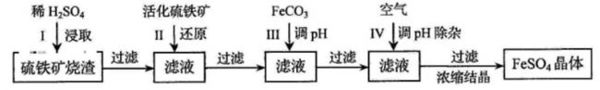
活化硫铁矿还原Fe2+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4
请问本题流程图中最后通空气不会把亚铁离子氧化成铁离子?还有碳酸铁调pH是怎么搞的?
 红黄蓝1231年前1
红黄蓝1231年前1 -
 yjw2046 共回答了21个问题
yjw2046 共回答了21个问题 |采纳率95.2%最后通入空气应该不会把亚铁离子氧化成铁离子,理由很简单的,就是硫酸亚铁溶液在空气中可以存在。这一步通入空气的作用,推测应该是:把前一步溶解在液体中的CO2驱除掉。
那个是碳酸亚铁,调pH的过程很简单,就是用碳酸根中和硫酸。(生成的碳酸不会全部分解成CO2和H2O,会有一部分CO2溶解在水中,这也是下一步通入空气的原因。在温度、气压一定时水中溶解气体的物质的量也是确定的,通入空气可以减少水中的CO2的溶解量。)
以上是推测,仅供参考。1年前查看全部
大家在问
- 1一个数的40%和它的四分之一的和是130,这个数是多少?
- 2指数加减法就比如.x^1/2+x^3/2=?怎么算
- 3这个句子怎么翻译,觉得很难:当你把裤子抢救出来时,你有没有发现那张纸币已经变得比白纸还白?
- 4(2013•广州三模)在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:
- 5一个人要拉起比他体重大的重物用定滑轮行吗
- 6a<0,b<0,c>0.化简√a²-√(a+b)²+|b+c|+|a-c|.
- 7德语问题德语填空1. Je älter der Wagen wird, umso___ muss er zur
- 8population怎么读
- 9第十一题,在下面各音上按要求向上构成和弦,并注明调性(限自然大调).我主要是不懂图片上的V7或V34的意思.(乐理音乐)
- 10小双对不起我辜负了你 用英语怎么说
- 11五年级上册语文生字表2多音字如题
- 12用物理学来解释为什么火焰总是向上的?
- 13I like summer holiday 、 I am from China、 That is a plane、I c
- 14在一段双轨铁道上两辆火车同时驶过,一车速度是20米每秒一车速度24米每秒,车长分别是180米160米,求两...
- 15many kinds of clothes后面谓语动词用复数还是单数?
