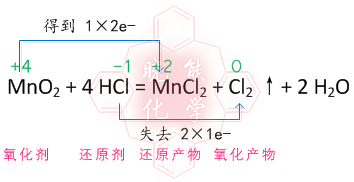
MnO2+4HCl(浓)=====MnCl2+Cl2(上升)+2H2O 氧化剂和还原剂的物质量之比是多少
 donald82872022-10-04 11:39:542条回答
donald82872022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 又是一个黎明 共回答了19个问题
又是一个黎明 共回答了19个问题 |采纳率73.7%- 氧化剂为MnO2 还原剂为HCl
氧化剂和还原剂之比为1:2 因为只有两个氯离子被氧化 一个锰被还原 - 1年前
 freshlemon 共回答了27个问题
freshlemon 共回答了27个问题 |采纳率- 在该反映中,MN的化合价降低,被还原,所以它是氧化剂,CL的化合价甚高,被氧化,所以它是还原剂.故 氧化剂和还原剂的物质量为1:4
- 1年前
相关推荐
- 已知:MnO2+4HCL(浓)=MnCl2+Cl2(上升)+2H2O.一定质量的二氧化锰溶解在100ml过量的浓盐酸中,
已知:MnO2+4HCL(浓)=MnCl2+Cl2(上升)+2H2O.一定质量的二氧化锰溶解在100ml过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).计算:
1.反应耗用MnO2的质量.
2.被氧化的HCl物质的量.
3.原浓盐酸的物质的量浓度.
取1.43gNaCO3.XH2O溶于水配成10ml溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0ml,并收集到112mlCO2(标况).
求:1.稀盐酸物质的量浓度
2.Na2CO3.XH2O的摩尔质量
3.X的值
希望回答者能把过程写详细,非常感谢你的帮忙~~~~~ 想要逃避1年前1
想要逃避1年前1 -
 无水偏行舟 共回答了19个问题
无水偏行舟 共回答了19个问题 |采纳率78.9%1.m(MnO2)=87*4.48/22.4=17.4g
2.n(HCl)=2*4.48/22.4=0.4mol
3.c(HCl)=(0.1+0.8)/0.1=9mol/L
1.c(HCl)=2*112/22400*0.002=5mol/L
2.M(Na2CO3.XH2O)=1.43/0.005=286g/mol
3.x=101年前查看全部
- 求一道化学计算题已知实验室制取氯气的化学方程式如下:MnO2+4HCl(浓)=MnCl2+Cl2+2H2O现将8.7g
求一道化学计算题
已知实验室制取氯气的化学方程式如下:
MnO2+4HCl(浓)=MnCl2+Cl2+2H2O
现将8.7g MnO2溶于含1.2mol HCl的盐酸中,加热充分反应后,求:
(1)产生多少升Cl2(S.T.P)?
(2)取出反应后溶液体积的1/10,加入足量AgNO3溶液,能产生多少克沉淀? terry_zgq1年前1
terry_zgq1年前1 -
 雨烦LIN 共回答了18个问题
雨烦LIN 共回答了18个问题 |采纳率83.3%(1)nMnO2=8.7/(55+16*2)=0.1 (mol) nHCl=1.2 (mol)
所以HCl过量,所以计算时用nMnO2=0.1 (mol)
nCl2=0.1 (mol) VCl2=0.1*22.4=2.24 (L)
(2)反应方程式:Cl- + Ag+ = AgCl↓
n(剩HCl)=1.2-0.1*4=0.8 (mol) nMnCl2=0.1 (mol)
n(1/10剩Cl-)=1/10=0.1(mol)
nAgCl=0.1 (mol) mAgCl=0.1*143.5=14.35 (g)1年前查看全部
- 已知实验室制氯气的化学方程式为:MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O,其中:
已知实验室制氯气的化学方程式为:MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O,其中:
(1)MnO2中Mn元素被______.
(2)HCl中氯原子______(填“得到”或“失去”)电子.
(3)反应中还原剂与氧化剂的物质的量之比为______.
(4)若参加反应的HCl是146g,则被氧化的HCl是______mol.
(5)用单线桥法表示此反应中电子转移情况.MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O. ourlives1年前0
ourlives1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- mn02+4hcl(浓)=mncl2+cl2↑+2h2o,当制取1molcl2时,所需氧化剂与还原剂物质的量之比
 smail_gong1年前2
smail_gong1年前2 -
 涟漪1 共回答了23个问题
涟漪1 共回答了23个问题 |采纳率91.3%盐酸既是氧化剂又是还原剂
当制取1molCl2需要4mol的盐酸,2mol电子转移,实际用来氧化的Cl-是2mol,所以氧化剂与还原剂物质的量之比1:11年前查看全部
- 实验室里常利用反应:MnO2+4HCL(浓)==MnCL2+CL2↑+2H2o来制取氯气,当有8.7gMnO2参加反应时
实验室里常利用反应:MnO2+4HCL(浓)==MnCL2+CL2↑+2H2o来制取氯气,当有8.7gMnO2参加反应时,计算:
 yangsuchen11281年前4
yangsuchen11281年前4 -
 還可以叫什么 共回答了19个问题
還可以叫什么 共回答了19个问题 |采纳率94.7%消耗MnO2的量为0.1 mol
1、根据化学方程式,产生的氯气的量为0.1 mol,则质量为7.1 g
2:根据化学方程式,消耗的HCl的质量为0.4 mol,则质量为 14.6 g
3:Cl从-1价到0价为被氧化,所以只有2 HCl被氧化,即参加反应的HCl的一半
另一半Cl-进入MnCl2中,没有被氧化
所以被氧化的质量为14.6/2 = 7.3 g1年前查看全部
- 已知实验室制氯气的化学方程式为MnO2+4Hcl(浓)=MnCl2+Cl2+2H2O,
已知实验室制氯气的化学方程式为MnO2+4Hcl(浓)=MnCl2+Cl2+2H2O,
用8.7克二氧化锰与足量浓盐酸反应,消耗盐酸的物质的量是多少?产生氯气在标准状况下的体积是多少? wuqiong11231年前1
wuqiong11231年前1 -
 rejh 共回答了16个问题
rejh 共回答了16个问题 |采纳率100%8.7g MnO2的物质的量是n=m/M=8.7/87=0.1mol
MnO2+4HCl=△=MnCl2+H2O+Cl2↑
1 4 1
0.1mol n(HCl) n(Cl2)
n(Cl2)=0.1mol,体积是V=n*Vm=0.1*22.4=2.24L
n(HCl)=0.4mol
在上面的反应中4个HCl有2个被氧化形成Cl2,2个未被氧化形成MnCl2.
被氧化的盐酸占盐酸物质的量的一半,所以被氧化的浓盐酸是0.4*1/2=0.2mol,消耗0.4MOL1年前查看全部
- 在298k时,用MnO2(二氧化锰)和HCl反应制取Cl2(氯气)反应式;MnO2+4HC→MnCl2+Cl2+ 2 H
在298k时,用MnO2(二氧化锰)和HCl反应制取Cl2(氯气)反应式;MnO2+4HC→MnCl2+Cl2+ 2 H2O。(1)在标准状态下,能否制取氯气?(2)当Mn离子浓度为1.0 mol/L,Cl2分压为100Kpa,HCl浓度至少达到多大时,才能利用上述的反应制取氯气?请说明。{φ(MnO2/Mn2+)=1.23V,φ(Cl2/Cl-)=1.36V} 请把具体的步骤做出来,很急,而且写出公式 ,在线等。能做完拍个图上来最好了
 依仗听江声1年前0
依仗听江声1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 实验室里常利用反应:MnO2+4HCL(浓)==MnCL2+CL2↑+2H2o来制取氯气,当有8.7gMnO2参加反应时
实验室里常利用反应:MnO2+4HCL(浓)==MnCL2+CL2↑+2H2o来制取氯气,当有8.7gMnO2参加反应时,计算:
实验室里常利用反应:MnO2+4HCL(浓)==MnCL2+CL2↑+2H2o来制取氯气,当有8.7gMnO2参加反应时,计算:
1.能生成多少克氯气?
2.消耗多少克HCL?
3.被氧化的HCL有多少克? 哑巴一声吼_ww1年前1
哑巴一声吼_ww1年前1 -
 白云依旧是我 共回答了17个问题
白云依旧是我 共回答了17个问题 |采纳率88.2%消耗NnO2的量为0.1mo1 即1:生产的氯气的量为0.1mol 则质量为7.1g2:消耗的HCl的质量为0.4mol 则质量为 14.6g3:Cl从-1价到0价为被氧化,所以的有2个氯原子则被氧化量是HCl的1/2 所以被氧化的质量为7.3gMnO2+4HCL(浓)==MnCL2+CL2↑+2H2o78 36.5 71 7.81年前查看全部
- 已知实验室制氯气的化学方程式为MnO2+4Hcl(浓)=MnCl2+Cl2+2H2O,取13.05g二氧化锰跟100mL
已知实验室制氯气的化学方程式为MnO2+4Hcl(浓)=MnCl2+Cl2+2H2O,取13.05g二氧化锰跟100mL 12mol/L浓盐酸充分反应,试计算:
1.生成氯气的体积(标准状况)
2.反应后溶液中H+的物质的量浓度 咚咚丁丁当1年前2
咚咚丁丁当1年前2 -
 守候的人 共回答了16个问题
守候的人 共回答了16个问题 |采纳率87.5%13.05g二氧化锰(0.15mol)跟100mL 12mol/L(1.2mol)浓盐酸充分反应,生成氯气0.15mol,即3.36升.消耗盐酸0.6摩尔,所以溶液中有氢离子0.6摩尔,所以反应后溶液中H+的物质的量浓度为6mol/L1年前查看全部
- MnO2+4HCl(浓)=加热=MnCl2+Cl2+2H2O 能改写成离子方程式吗,
MnO2+4HCl(浓)=加热=MnCl2+Cl2+2H2O 能改写成离子方程式吗,
Al2O3能与非金属或金属单质反应吗 calleon1年前1
calleon1年前1 -
 阳光明媚F_ 共回答了19个问题
阳光明媚F_ 共回答了19个问题 |采纳率78.9%能写成离子式1年前查看全部
- 实验室常用以下方法制取氯气:MnO2+4HCl(浓) △ .MnCl2+Cl2↑+2H2O用双线桥
实验室常用以下方法制取氯气:MnO2+4HCl(浓) △ .MnCl2+Cl2↑+2H2O用双线桥
在标准状况下生成Cl2为11.2L时,参加反应的HCl的物质的量为_____,被氧化HCl的质量为_____________ onerainbow1年前1
onerainbow1年前1 -
 CQKDLUCY 共回答了31个问题
CQKDLUCY 共回答了31个问题 |采纳率93.5%1年前查看全部
- KMnO4+ FeCl2+ HCl= KCl+ MnCl2+ FeCl3+ H2O的配平
 kesiver1年前1
kesiver1年前1 -
 yuqing107 共回答了22个问题
yuqing107 共回答了22个问题 |采纳率86.4%KMnO4+ 5FeCl2+ 8HCl= KCl+ MnCl2+ 5FeCl3+ 4H2O1年前查看全部
- 高一MnO2+4HCI(浓)===MnCL2+CL2↑+2H2O[加热] 在标况下···
高一MnO2+4HCI(浓)===MnCL2+CL2↑+2H2O[加热] 在标况下···
MnO2+4HCI(浓)===MnCL2+CL2↑+2H2O[加热] 在标况下生成CL2 ( 0.56L)
1.在反应中转移电子物质的量为多少?
2.要多少MnO2 (克)
3.被氧化的HCL 的物质的量是? 回到ii1年前2
回到ii1年前2 -
 sanzhai_216 共回答了13个问题
sanzhai_216 共回答了13个问题 |采纳率100%(1)生成Cl 0.65L即0.025mol
在这个反应中 化合价降低的是0.025mol的Mn 从+4降低到+2价 作为还原剂
化合价升高的是0.05mol的Cl 从-1升高到0价 作为氧化剂
则有0.05mol的电子转移
(2)生成0.025mol的Cl
根据方程式即可看出有0.025mol的MnO2反应 即2.175g
(3)氧化剂是HCl,被氧化的HCl有0.5mol.
这道题只要分析出氧化剂和还原剂和它们反应分别所需的摩尔数即可1年前查看全部
- 关于反应:MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O说法不正确的是( )
关于反应:MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O说法不正确的是( )
A.反应中氧化剂与还原剂物质的量之比为1:2
B.要使8.7g MnO2完全反应,需投入含0.4molHCl的浓盐酸
C.每生成标准状况下2.24L Cl2,就有7.3gHCl被氧化
D.若有0.4molHCl被氧化,反应中转移的电子数为0.4×6.02×1023个 21507281年前1
21507281年前1 -
 sgfbkgtm 共回答了19个问题
sgfbkgtm 共回答了19个问题 |采纳率84.2%解题思路:A.所含元素化合价降低的反应物是氧化剂,所含元素化合价升高的反应物是还原剂,结合方程式解答;
B.二氧化锰与浓盐酸反应,随反应进行浓盐酸变稀,稀盐酸不与二氧化锰反应;
C.被氧化的HCl生成氯气,根据n=
计算氯气的物质的量,根据原子守恒计算被氧化的HCl,再根据m=nM计算;V Vm
D.反应中Cl元素化合价由-1价升高为0价,计算转移电子物质的量,再根据N=nNA计算.A.二氧化锰中Mn元素化合价降低,是氧化剂,HCl中Cl元素化合价升高,是还原剂,同时HCl其酸的作用,各占一半,故氧化剂与还原剂的物质的量之比=1:2,故A正确;
B.8.7g MnO2的物质的量=[8.7g/87g/mol]=0.1mol,完全反应需要0.4molHCl,由于二氧化锰与浓盐酸反应,随反应进行浓盐酸变稀,而稀盐酸不与二氧化锰反应,故B错误;
C.被氧化的HCl生成氯气,氯气的物质的量=[2.24L/22.4L/mol]=0.1mol,根据原子守恒,被氧化的HCl为0.2mol,则被氧化的HCl的质量=0.2mol×36.5g/mol=7.3g,故C正确;
D.反应中Cl元素化合价由-1价升高为0价,0.4molHCl被氧化,反应中转移的电子数为0.4mol×6.02×1023mol-1=0.4×6.02×1023,故D正确,
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应计算,难度中等,A选项为易错点,学生容易忽略反应中HCl其酸与氧化剂作用.1年前查看全部
- MnO2+HCL浓—MnCl2+CL2+2H2o.,中生成的MnCl2中的Mn为什么是+2价?
 笑笑转过身1年前4
笑笑转过身1年前4 -
 七夜forever 共回答了14个问题
七夜forever 共回答了14个问题 |采纳率100%这是一个氧化还原反应,锰降低两价、氯升高一价,生成氯气.
MnO2四价,要生成氯气Mn只能降价,又不能生成Mn单质,所以零价四价之间,氯化锰中锰只能二价1年前查看全部
- 关于高一化学中的氯离子守恒已知:实验室制氯气的反应为:MnO2+4HCl—加热—MnCl2+Cl2↑+2H2O,将足量的
关于高一化学中的氯离子守恒
已知:实验室制氯气的反应为:MnO2+4HCl—加热—MnCl2+Cl2↑+2H2O,将足量的MnO2与含0.4mol溶质的浓盐酸加热并充分反应(设气体产物已完全逸出,且不考虑浓盐酸挥发对反应造成的影响),在反应后的溶液中加入足量的硝酸银溶液,生成沉淀的质量可能是()克 A.14.35 B.21.25 C.28.7 D.43.05
我的老师说用氯离子守恒,我不懂的点在于,浓盐酸会被稀释成稀盐酸,那生成出来的MnCl2会小于0.1mol,为什么老师算出来氯离子的区间是(0.2,0.4)呢?氯气不是逸出了吗?对离子守恒解简单计算刚上课还是有些模糊,希望得到帮助, 黄昏的乌苏里船歌1年前1
黄昏的乌苏里船歌1年前1 -
 GIRL 共回答了20个问题
GIRL 共回答了20个问题 |采纳率95%浓盐酸总的CL-的物质的量为0.4mol,如果完全反应最后剩下的就是0.1mol(考虑完全反应Cl2完全逸出)
但是因为浓盐酸变成稀盐酸,题目中不考虑盐酸挥发,所以生成的CL2的物质的量就一定会小于0.1mol
也就是说剩下的Cl-的物质的量会大于0.2 但是小于0.41年前查看全部
- 实验室制氯气4HCl(浓)+MnO2==△==MnCl2+Cl2↑+2H2O 离子方程式怎么写?
 子西湖1年前3
子西湖1年前3 -
 yzz120110 共回答了24个问题
yzz120110 共回答了24个问题 |采纳率87.5%在反应4HCl(浓)+MnO2=△= Cl2↑+MnCl2+2H2O中,
Mn元素的化合价由+4价降低为+2价,则MnO2为氧化剂,
Cl元素的化合价由-1价升高到0,则HCl为还原剂,该反应是氧化还原反应,
盐酸和氯化锰在溶液中完全电离,不溶物、气体、水在离子方程式中保留化学式,
则离子反应为4H++2Cl-+MnO2=△=Cl2↑+Mn2++2H2O1年前查看全部
- MnO2+4HCL=(加热)MnCl2+Cl2+2H2O(写成离子方程?)
MnO2+4HCL=(加热)MnCl2+Cl2+2H2O(写成离子方程?)
(1)首先该反应是离子反应吗?
(2)离子方程式? sddsjc1年前2
sddsjc1年前2 -
 可意聚贤 共回答了12个问题
可意聚贤 共回答了12个问题 |采纳率83.3%是离子反应,
MnO2+4H+2CL=Mn+Cl2+2H2O
其中锰离子是+2价1年前查看全部
- 已知二氧化锰固体与浓盐酸在加热的条件下反应:MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O,现把8.
已知二氧化锰固体与浓盐酸在加热的条件下反应:MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O,现把8.7克MNO2
已知二氧化锰固体与浓盐酸在加热的条件下反应:MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O,现把8.7克MNO2加入到足量的浓盐酸溶液中,充分反应后:
试求出多少克HCL被氧化?
————
希望能写出详细的解题过程以及思路 bianhuiquan1年前1
bianhuiquan1年前1 -
 zuoran 共回答了19个问题
zuoran 共回答了19个问题 |采纳率100%MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O
其中1/2的HCl做还原剂(被氧化),1/2做酸.
MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O
87------146
8.7g------X
X=8.7*146/87=14.6g
1/2X=7.3g
所以7.3克HCL被氧化
不懂问我!立刻!在线!1年前查看全部
- 实验室里常利用反应:MnO2+4HCl(浓) △ . MnCl2+
实验室里常利用反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O来制取氯气,当有8.7gMnO2参加反应时,计算:△ .
(1)能生成多少克氯气?
(2)消耗多少克溶质HCl?
(3)被氧化的溶质HCl有多少克? 冬日海螺1年前2
冬日海螺1年前2 -
 秋雨听荷_ 共回答了26个问题
秋雨听荷_ 共回答了26个问题 |采纳率88.5%解题思路:根据方程式计算生成氯气的质量、消耗HCl的质量,被氧化的HCl生成氯气,反应中当有4molHCl参加反应时,由化合价的变化可知有2molHCl被氧化,据此解答.设生成氯气的质量为m,消耗HCl质量为n,则:
MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+H2O
87 4×36.5 71
8.7g n m
故m=[8.7g×71/87]=7.1g
n=[8.7g×4×36.5/87]=14.6g
反应中当有4molHCl参加反应,由化合价的变化可知有2molHCl被氧化,故被氧化HCl为14.6g×[1/2]=7.3g,
答:(1)能生成7.1克氯气;
(2)消耗14.6h溶质HCl;
(3)被氧化的溶质HCl为7.3克.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式计算、氧化还原反应计算,难度不大,侧重对基础知识的巩固.1年前查看全部
- MnO2+HCl==mncl2+cl2+2h2o,当转移1.2mol电子时,生成cl多少L?被氧化hcl多少mol?未被
MnO2+HCl==mncl2+cl2+2h2o,当转移1.2mol电子时,生成cl多少L?被氧化hcl多少mol?未被氧化hcl多少mol?
参加反应mno2多少克 zhangyoufu20061年前4
zhangyoufu20061年前4 -
 floating2004 共回答了18个问题
floating2004 共回答了18个问题 |采纳率83.3%配平方程式:MnO2+4HCl浓=加热=MnCl2+Cl2+2H2O其中4HCl中被氧化的HCl(化合价升高从-1升到0)只有2个占一半(2HCl--Cl2氯原子守恒),转移电子数2e-MnO2+4HCl浓=加热=MnCl2+Cl2+2H2O 转移2e-87 4 22.4 2z y x 1.2mol解...1年前查看全部
- MnO2+4HCl(浓)=MnCl2+Cl2(上箭)+2H2O求氧化剂和还原剂的质量之比,氧化产物和还原产物的物质的量之
MnO2+4HCl(浓)=MnCl2+Cl2(上箭)+2H2O求氧化剂和还原剂的质量之比,氧化产物和还原产物的物质的量之比,氧化产物和还原产物粒子个数之比.被氧化的盐酸占参加反应完全总分子数的几分之几?
 金华妮1年前1
金华妮1年前1 -
 阑干拍遍 共回答了19个问题
阑干拍遍 共回答了19个问题 |采纳率94.7%氧化剂是氧化锰,还原剂是氯化氢,做还原剂的氯化氢只有一半,另一半用作酸性,氧化产物是氯气,还原产物为氯化锰
M(氧化剂):M(氯化氢)==87:73
M(氧化产物):M(还原产物)==71:126 粒子之比为1:3
被氧化的占1/2,未被氧化即用作酸性的就是用酸根的只有1/21年前查看全部
- 实验室常用反应:MnO2+4HCl(浓)=MnCl2+Cl2+H2O来制取氯气.用400g36.5%的浓盐酸与二氧化锰反
实验室常用反应:MnO2+4HCl(浓)=MnCl2+Cl2+H2O来制取氯气.用400g36.5%的浓盐酸与二氧化锰反应,现制得标准状况下的氯气4.48L,是回答下列问题:
(1)理论上需要多少克二氧化锰?
(2)将反应后剩余的溶液用水稀释至500mL,则稀释后溶液Cl-的物质的量浓度是多少? 工4511年前2
工4511年前2 -
 chrisyu 共回答了22个问题
chrisyu 共回答了22个问题 |采纳率90.9%MnO2+4HCl(浓)=MnCl2+Cl2+H2O
1 1
y=17.4g 0.2mol
理论需17.4g二氧化锰
Cl只在Cl2中消耗,0.2mol含0.4molCl
400x36.5%=146 146/36.5=4mol
4-0.4=3.6mol 3.6/0.5=7.2mol/L
及Cl-的物质的量浓度是7.2mol/L1年前查看全部
- 检查化学反应方程式1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H
检查化学反应方程式
1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_
离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
2.钠在氯气中燃烧:2Na+Cl2 2NaCl
铁在氯气中燃烧:2Fe+3Cl2 2FeCl3
铜在氯气中燃烧:Cu + Cl2 CuCl2
氢气在氯气中燃烧:H2 + Cl2 2HCl
3.氯气和水反应:Cl2 + H2O = HCl + HClO
离子方程式:Cl2 + H2O = H++Cl- + HClO
4.次氯酸光照分解:2HClO 2HCl + O2↑
5.氯水中通二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl
6.氯气与氢氧化钠:Cl2+2NaOH=NaCl+NaClO+H2O
离子式:Cl2+2OH-=Cl-+ClO-+H2O
7.工业生产漂白粉:2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 + 2H2O
8.漂白粉漂白原理:Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO
9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 + 2HClO
10.氯气通入溴化钾溶液:Cl2+2KBr=Br2+2KCl
离子方程式:Cl2+2Br- = Br2 + 2Cl-
氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl
离子方程式:Cl2 + 2I- = I2 + 2Cl-
溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr
离子方程式:Br2 +2I- = I2+2Br-
11.氯化钠和硝酸银:AgNO3+NaCl=AgCl↓+NaNO3
离子方程式:Ag++Cl-=AgCl↓
溴化钠和硝酸银:AgNO3+NaBr=AgBr↓+NaNO3
离子方程式:Ag++Br-=AgBr↓_
碘化钠和硝酸银溶液:AgNO3+NaI=AgI↓+NaNO3
离子方程式:Ag++I-=AgI↓_
1.硫在空气中燃烧:S+O2SO2 硫与氢气加热:S+H2H2S
2.二氧化硫与水:SO2+H2OH2SO3 二氧化硫与氧化钙:SO2+CaO=CaSO
3、少量SO2与氢氧化钠:2NaOH+SO2=Na2SO3+H2O
离子式:2OH-+SO2= SO32-+H2O
过量SO2与氢氧化钠:NaOH+SO2=NaHSO3
离子方程式:OH-+SO2= HSO3-
3.SO2通入过量的澄清石灰水:Ca(OH)2+SO2=CaSO3↓+H2O
过量的SO2通入澄清石灰水:Ca(OH)2+2SO2=Ca(HSO3)2
4.二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O
5.SO2的催化氧化:2SO2 + O2 2SO3
6.亚硫酸钠和硫酸反应:Na2SO3+H2SO4=Na2SO4 +SO2↑+H2O
7.Na2SO3与氧气反应:2Na2SO3+O2=2Na2SO4
8.三氧化硫和水反应:SO3+H2O=H2SO4
9.三氧化硫与氧化钙:SO3+CaO= CaSO4
10.三氧化硫与氢氧化钙:Ca(OH)2+SO3=CaSO4↓+H2O
11.铜与浓硫酸反应:Cu + 2H2SO4 (浓) CuSO4 + 2H2O+SO2 ↑
12.碳与浓硫酸反应:C + 2H2SO4(浓) 2H2O+CO2↑+2SO2↑
1.氮气和氧气反应:N2 + O2 2NO
2.工业合成氨:N2 + 3H2 2NH3
3.一氧化氮与氧气反应:2NO + O2 =2NO2
4.NO2溶于水:3NO2 + H2O = 2HNO3 + NO
5.氨气溶于水:NH3+H2ONH3·H2O氨水显弱碱性(电离式):NH3·H2ONH4++OH-
6.浓氨水受热分解_ NH3·H2O NH3↑+H2O
7.氨气和氯化氢:HCl + NH3 = NH4Cl
8.氨的催化氧化4NH3 +5O2 4NO +6H2O
9.氯化铵受热分解:NH4ClNH3+HCl
10.碳酸氢铵受热分解:NH4HCO3 NH3 ↑+ H2O↑ + CO2 ↑
11.硝酸铵和NaOH:NH4NO3+NaOHNaNO3 + NH3↑+H2O
离子式:NH4++ OH-NH3↑+H2O
12.实验室制氨气:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑ + 2H2O
13.浓硝酸与铜反应:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O
离子方程式:4H++2NO3-+Cu Cu2++2NO2↑+2H2O
14.稀硝酸与铜反应:8HNO3(稀)+3Cu 3Cu(NO3) 2+2NO↑+4H2O
离子方程式:8H++2NO3-+3Cu 3Cu2++2NO↑+4H2O
15.硝酸见光分解:4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)
16.NH4+的检验离子方程式:NH4++ OH-NH3↑+H2O
17.NO2、O2混合气通入水中无剩余气体:4NO2 + O2 + 2H2O = 4HNO3
18.NO、O2混合通入水中无剩余气体:4NO + 3O2 + 2H2O = 4HNO3 ztzn021年前1
ztzn021年前1 -
 yejiayuan1984 共回答了22个问题
yejiayuan1984 共回答了22个问题 |采纳率86.4%2.二氧化硫与水:SO2+H2OH2SO3 二氧化硫与氧化钙: SO2+CaO=CaSO,最后这个少了3,其他的一些少了气体符号,沉淀符号的有几个,反应条件基本没有写的,这些药注意,其他应该没有问题1年前查看全部
- 用下列反应制取氯气:MnO2+4HCl(浓) △ . MnCl2+Cl2↑+H2O该反应的氧化剂是______,还原剂是
用下列反应制取氯气:MnO2+4HCl(浓) △ . MnCl2+Cl2↑+H2O该反应的氧化剂是______,还原剂是__...
用下列反应制取氯气:MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O△ .
该反应的氧化剂是______,还原剂是______;在标准状况下,收集到2.24L Cl2时,消耗氧化剂______mol,被氧化的还原剂的质量______g.
 不定指标1年前1
不定指标1年前1 -
 新用户注册已存在 共回答了20个问题
新用户注册已存在 共回答了20个问题 |采纳率95%MnO2+4HCl=MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,MnO2作氧化剂,Cl元素的化合价升高,HCl作还原剂,
产生的氯气在标况下的体积为2.24L,其物质的量为[2.24L/22.4L/mol]=0.1mol,
MnO2+4HCl=MnCl2+Cl2↑+2H2O中,由MnO2~Cl2↑可知,MnO2物质的量为0.1mol,
Cl元素的化合价升高,则HCl为还原剂,由2HCl~Cl2↑可知,还原剂的物质的量为0.1mol×2=0.2mol,其质量为0.2mol×36.5g/mol=7.3g
故答案为:MnO2;HCl;0.1;7.3.1年前查看全部
- 1.实验室制氯气的反应为4HCL+MnO2=(加热)MnCL2+CL2+2H2O,下类说法错误的是().A.每生成1摩尔
1.实验室制氯气的反应为4HCL+MnO2=(加热)MnCL2+CL2+2H2O,下类说法错误的是().A.每生成1摩尔氯气,转移电子的物质的量为2摩尔 B.每消耗1摩尔二氧化锰,起还原剂作用的稀盐酸消耗4摩尔(请解释为什么)
2.已知氧化还原反应2Cu(IO3)2+24KI+12H2SO4=2CuI+13I2+12K2SO4+12H2O,其中1摩尔氧化剂在反应中得到的电子为().A.10摩尔 B.11摩尔 C.12摩尔 D.13摩尔(请告诉我怎么计算)
3.某溶液中有铵根离子,镁离子,亚铁离子,加入过量氢氧化钠,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是()A.铵根离子 B.镁离子 C.亚铁离子 D.) 我是你de谁1年前4
我是你de谁1年前4 -
 蓝月123 共回答了23个问题
蓝月123 共回答了23个问题 |采纳率91.3%一 B 4mol的HCL参加反应,被氧化的只有2mol,电子转移的也只有2mol,还有2molHCL只起到酸的作用.
二 B 先看化学方程式,找到还原剂和氧化剂,H2SO4在式中起酸的作用,KI是还原剂,2Cu(IO3)2是氧化剂
2Cu(IO3)2+
↓2*1 ↓4*5
24KI+12H2SO4=2CuI+13I2+12K2SO4+12H2O
↑22*1
式中的下降的化合价总数也是得到或失去的电子,1molCu(IO3)2应得到11mol的电子
三 A铵根离子
溶液中加入过量氢氧化钠,微热并搅拌镁离子,亚铁离子,变成Mg(OH)2和Fe(OH)2沉淀.
微热过程中NH4++OH-===NH3↑+H2O
加入过量的HCL,Mg(OH)2和Fe(OH)2又转化回去了,Mg2+和Fe2+.(如果还有问题的话就是Fe(OH)2,它不稳定,容易被氧化转变成Fe(OH)3这样Fe2+也有一定的减少,题中说大量那就应该就是A.铵根离子)1年前查看全部
- 氧化还原反应中电子的得失怎么计算氧化还原反应中电子的得失?比如MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2
氧化还原反应中电子的得失
怎么计算氧化还原反应中电子的得失?
比如MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2O
其中Cl由-1价变为0价那为什么说Cl是失去了两个电子呢?
怎么不是一个电子? kaka_1011年前7
kaka_1011年前7 -
 reverser 共回答了10个问题
reverser 共回答了10个问题 |采纳率100%首先,你要搞清氧化还原反应的本质:氧化剂得电子,被还原,价态降低,变为低氧化态物种;还原剂是电子,被氧化,价态升高,变为高氧化态物种.
其次,计算电子得失,你要理解一点:氧化剂得多少电子,对应的还原剂就失去多少电子,因为,氧化剂是从还原剂手中夺得的电子,故得、失电子数守恒.
下面以你的这道题为例来讲一下:
从化合价上可知,Mn:由+4(MnO2)降低到+2价(MnCl2),失电子;Cl:由-1(HCl)价升高到0价(Cl2),得电子.这里要特别注意一点,HCl在反应中兵分两路,一部分作还原剂,生成Cl2,一部分作酸用,与Mn成盐,而只有作还原剂的部分价态发生了改变,存在得失电子
配合反应式,你可以看出,式中变价的有一个Mn与两个Cl,一个Mn原子降两价,而一个Cl升一价,故两个Cl升两价,对应失去两个电子(一个Cl2分子是由两个Cl原子组成,每个Cl原子都是由一个-1价的Cl离子失一个电子而来)
从其中,也可以看出,Mn的变价数与Cl的总变价数是相等的,即得失电子数相等.1年前查看全部
- 实验室里通常用MnO2+4HCl(浓)=MnCl2+Cl2+2H2O
实验室里通常用MnO2+4HCl(浓)=MnCl2+Cl2+2H2O
为进行有关氯气的性质实验,需要4瓶容积为100ml的氯气.(室温下,氯气的密度为2.19g/L)
(1)制取4瓶氯气,理论上需要MnO2固体的质量是多少?(浓盐酸过量,并可以补充.)
(2)实际称量的MnO2固体的质量必须适当多于理论量,主要原因是什么? 时光旋风1年前1
时光旋风1年前1 -
 钻石兜兜 共回答了33个问题
钻石兜兜 共回答了33个问题 |采纳率97%MnO2+4HCL(浓)======MnCl2+Cl2↑+2H2O
87gMnO2~71g CL2
XgMnO2~0.4L*2.91g/L CL2
X=87*(0.4*2.91)/71≈1.43(g)
(2)要过量称取是因为你要保证得到4瓶容积为100ML的氯气,而浓盐酸加热后又不断挥发稀释,1年前查看全部
- 实验室制氯气的反映如下:4HCl+MnO2加热生成MnCl2+Cl2+2H2O能否使用制氯化氢的装置来制氯气?为什么?
 huleijie1年前2
huleijie1年前2 -
 L莎 共回答了16个问题
L莎 共回答了16个问题 |采纳率100%不能,因为虽然它们发生装置一样,都是固液反应,但除杂装置不一样
制氯化氢不需要除杂,只需要干燥
制氯气因为浓盐酸易挥发,所以气体中会有HCl.因此应先通过饱和的NaCl溶液,再用浓硫酸干燥脱水,用饱和的NaCl溶液可以使HCl溶于水中,而Cl2由于溶解度比HCl小很多,还由于NaCl溶液的同离子效应而几乎不溶于水.1年前查看全部
- MnO2和浓盐酸反应生成氯气:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
MnO2和浓盐酸反应生成氯气:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
(1)氧化剂是______,还原产物是______.
(2)若有71g氯气生成,则转移的电子的物质的量为______mol,有______mol HCl被氧化.
(3)下列物质能使干燥的蓝色石蕊试纸先变红再褪色的是______(填序号)
①氯气②液氯③新制氯水④敞口放置的久置氯水⑤盐酸⑥加了醋酸的漂白粉溶液. lushuiping1年前1
lushuiping1年前1 -
 WJHL 共回答了15个问题
WJHL 共回答了15个问题 |采纳率100%解题思路:反应MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,盐酸同时起到酸性的作用,结合元素化合物的变化解答该题.(1)Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,生成物中Cl2为氧化产物,MnCl2为还原产物,故答案为:MnO2;MnCl2;(2)n(Cl2)=71g71g/mol=1mol,由Cl元素化合价可知转移...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力以及氯气的性质的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.1年前查看全部
- 实验室里常利用反应:MnO2+4HCl(浓) △ . MnCl2+
实验室里常利用反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O来制取氯气,当有8.7gMnO2参加反应时,计算:△ .
(1)能生成多少克氯气?
(2)消耗多少克溶质HCl?
(3)被氧化的溶质HCl有多少克? 风吹白桦林1年前3
风吹白桦林1年前3 -
 dkuj 共回答了24个问题
dkuj 共回答了24个问题 |采纳率100%解题思路:根据方程式计算生成氯气的质量、消耗HCl的质量,被氧化的HCl生成氯气,反应中当有4molHCl参加反应时,由化合价的变化可知有2molHCl被氧化,据此解答.设生成氯气的质量为m,消耗HCl质量为n,则:
MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+H2O
87 4×36.5 71
8.7g n m
故m=[8.7g×71/87]=7.1g
n=[8.7g×4×36.5/87]=14.6g
反应中当有4molHCl参加反应,由化合价的变化可知有2molHCl被氧化,故被氧化HCl为14.6g×[1/2]=7.3g,
答:(1)能生成7.1克氯气;
(2)消耗14.6h溶质HCl;
(3)被氧化的溶质HCl为7.3克.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式计算、氧化还原反应计算,难度不大,侧重对基础知识的巩固.1年前查看全部
- 实验室制取氯气的反应为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O,回答下列问题:
实验室制取氯气的反应为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O,回答下列问题:
(1)在上述方程式中表示电子转移的方向和数目______;
(2)该反应中的氧化剂是______(填写物质的化学式);
(3)8.7g的二氧化锰和足量的浓盐酸反应,制得的氯气在标准状况下的体积为______L.
(4)用200mL 8moL/L的浓盐酸与足量的二氧化锰加热时反应,得到氯气的量______0.4mol(填写“>”、“=”或“<”). luo_n1年前0
luo_n1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知二氧化锰固体与浓盐酸在加热的条件下反应:MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O,现把8.
已知二氧化锰固体与浓盐酸在加热的条件下反应:MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O,现把8.7克MNO2加入到足量的浓盐酸溶液中,充分反应后:
试求出多少克HCL被氧化?
————
希望能写出详细的解题过程以及思路 大嘴11年前3
大嘴11年前3 -
 Vanloo 共回答了18个问题
Vanloo 共回答了18个问题 |采纳率77.8%MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O
其中1/2的HCl做还原剂(被氧化),1/2做酸.
MnO2+4HCL(浓)==加热==MnCL2+CL2↑+2H2O
87------146
8.7g------X
X=8.7*146/87=14.6g
1/2X=7.3g
所以7.3克HCL被氧化
不懂问我!立刻!在线!1年前查看全部
- 已知:MnO2+4HCl(浓) △ . MnCl2+C
已知:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:△ .
(1)反应耗用MnO2的质量
(2)被氧化的HCl物质的量
(3)原浓盐酸的物质的量浓度. hyacinth_xiao1年前1
hyacinth_xiao1年前1 -
 陈豪华 共回答了19个问题
陈豪华 共回答了19个问题 |采纳率84.2%解题思路:利用氯气在标况下的体积来计算其物质的量,然后利用化学反应方程式计算MnO2的质量、参加反应的HCl的物质的量,再利用剩余的盐酸进一步计算盐酸的浓度,由方程式可知盐酸有一半被氧化.氯气的物质的量为[4.48L/22.4L/mol]=0.2mol,
设耗用二氧化锰xmol,参加反应的盐酸ymol,则
MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
14 1
xy 0.2mol
[1/1=
x
0.2mol]、[4/1=
y
0.2mol],
解得x=0.2mol,y=0.8mol,
(1)反应耗用MnO2的质量为0.2mol×87g/mol=17.4g,
答:反应耗用MnO2的质量为17.4g;
(2)被氧化的HCl物质的量为0.8mol×[1/2]=0.4mol,
答:被氧化的HCl物质的量为0.4mol;
(3)原溶液中HCl的物质的量为0.8mol+0.1L×1mol/L=0.9mol,
原浓盐酸的物质的量浓度为c(HCl)=[0.9mol/0.1L]=9mol/L,
答:原浓盐酸的物质的量浓度为9mol/L.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算.
考点点评: 本题考查学生利用化学反应方程式的计算,难度不大,明确氯气的物质的量代入化学反应方程式来计算是解答的关键.1年前查看全部
- 一些酸在反应中可以表现出多重性质,如MnO2+4HCl(浓)=△=MnCl2+Cl2+2H2O,在反应中既表现酸性,又表
一些酸在反应中可以表现出多重性质,如MnO2+4HCl(浓)=△=MnCl2+Cl2+2H2O,在反应中既表现酸性,又表现还原性
为什么既表现酸性,又表现还原性 gentlebaby_fei1年前4
gentlebaby_fei1年前4 -
 robinred1 共回答了23个问题
robinred1 共回答了23个问题 |采纳率91.3%和金属氧化物反应表现出酸性
参加氧还反应,化合价升高,表现出还原性.1年前查看全部
- 已知反应:MnO2+4HCl(浓)==(加热)MnCl2+Cl2+2H2O,将30克MnO2的质量分数为76.6%的软锰
已知反应:MnO2+4HCl(浓)==(加热)MnCl2+Cl2+2H2O,将30克MnO2的质量分数为76.6%的软锰矿石(主要成分为MnO2)与足量12mol/L浓盐酸完全反应 (1)计算参加反应的浓盐酸的体积 (2)生成的CI2的体积?
 地狱天堂皆在人间1年前1
地狱天堂皆在人间1年前1 -
 西班牙海玫瑰 共回答了18个问题
西班牙海玫瑰 共回答了18个问题 |采纳率100%设参加反应的浓盐酸的体积为X,生成氯气的体积为Y
二氧化锰的质量=30g*76.6%=22.98g
MnO2+4HCl(浓)=△=MnCl2+Cl2↑+2H2O
87 4 22.4
22.98g 12mol/L*X Y
X=0.088L=88ml
Y=5.92L
答:(1)计算参加反应的浓盐酸的体积88毫升 (2)生成的CI2的体积5.92升.1年前查看全部
- MnO2+HCL浓—MnCl2+CL2+2H2o怎么配平,为什么
 xmthor1年前3
xmthor1年前3 -
 一宿三次郎 共回答了25个问题
一宿三次郎 共回答了25个问题 |采纳率92%MnO2+4HCL—MnCl2+CL2+2H2O1年前查看全部
- 实验室制取Cl2通常利用下面的反应原理:MnO2+4HCl(浓) △ . MnCl2+Cl2↑+2H2O、在如图的装置中
实验室制取Cl2通常利用下面的反应原理:MnO2+4HCl(浓) △ . MnCl2+Cl2↑+2H2O、在如图的装置中,A..
实验室制取Cl2通常利用下面的反应原理:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O、在如图的装置中,A是Cl2发生装置,C、D为气体的净化装置,C中装有饱和食盐水,D中装有浓H2SO4,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.△ .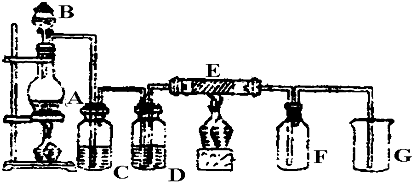
试回答:
(1)A、B、G中各装有什么药品:A______;B______;G______.(写化学式)
(2)分析A中生成的Cl2中可能含有那些杂质气体?______.
(3)写出G中和E中反应的化学方程式______.
 肥德流油1年前1
肥德流油1年前1 -
 阿枫 共回答了16个问题
阿枫 共回答了16个问题 |采纳率87.5%实验室制取Cl2通常利用下面的反应原理:MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O、在如图的装置中,A是Cl2发生装置,B中是浓盐酸,A中是MnO2,C、D为气体的净化装置,C中装有饱和食盐水除去氯气中的氯化氢,D中装有浓H2SO4,是吸收氯气中的水蒸气,E是硬质玻璃管中装有细铁丝网,氯气通过会发生反应生成氯化铁,F为干燥的广口瓶是用来收集氯气的集气瓶,烧杯G为尾气吸收装置,氢氧化钠溶液吸收防止氯气污染空气;
(1)A、B、G中各装有什么药品为:A为MnO2,B为浓盐酸,化学式HCl,G为氢氧化钠溶液,化学式为NaOH;
故答案为:MnO2;HCl;NaOH;
(2)依据反应过程分析可知氯气中含有氯化氢、水蒸气,故答案为:HCl、H2O;
(3)G中是氯气和氢氧化钠溶液的反应,反应化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,E中的反应是氯气和铁加热反应生成氯化铁,反应的化学方程式为:2Fe+3Cl2
点燃
.
2FeCl3;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O,2Fe+3Cl2
点燃
.
2FeCl3.1年前查看全部
- 一道化学问题1.在反应4HCl+MnO2△===MnCl2+Cl2↑+2H2O中,若有87gMnO2被还原,则被氧化的H
一道化学问题
1.在反应4HCl+MnO2△===MnCl2+Cl2↑+2H2O中,若有87gMnO2被还原,则被氧化的HCl的质量为( ).
A.36.5g.
B.73g.
C.109.5g.
D.146g.
请写出计算过程和结果并说明理由好吗? DMM4171年前4
DMM4171年前4 -
 ymjuly_7 共回答了16个问题
ymjuly_7 共回答了16个问题 |采纳率87.5%87g二氧化锰被还原,就是还原成水了也就是1摩尔的二氧化锰全被还原了,被氧化的盐酸是生成氯气了,也就是有2摩尔的盐酸被氧化,所以是选B1年前查看全部
- 实验室制备Cl2的反应原理为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O(1)当标准状况下生成11.2L氯
实验室制备Cl2的反应原理为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O(1)当标准状况下生成11.2L氯气时转移电
实验室制备Cl2的反应原理为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
(1)当标准状况下生成11.2L氯气时转移电子的物质的量为______.
(2)在此反应中氧化产物是______,氧化剂与还原剂的物质的量的比为______.
(3)比较氧化性Cl2______MnO2(填>、<或=)
 ppp2341年前1
ppp2341年前1 -
 藏一手43 共回答了23个问题
藏一手43 共回答了23个问题 |采纳率91.3%(1)MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O反应中氯元素化合价由-1价升高为0价,生成氯气n=[v
vm=
11.2L/22.4L/mol]=0.5mol,故转移电子物质的量为0.5mol×2=1mol,
故答案为:1mol;
(2)MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O因HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,对应产物Cl2是氧化产物,Mn元素化合价降低,所以MnO2 是氧化剂,当有1molMnO2反应时,有2molHCl被氧化,氧化剂与还原剂物质的量关系为1:2,
故答案为:Cl2;1:2;
(3)MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O中MnO2为氧化剂,HCl为还原剂,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性MnO2>Cl2,
故答案为:<.1年前查看全部
- 二氧化锰和浓盐酸共热制取氯气,反应的化学方程式为:MnO2+4HCl(浓)==MnCl2+Cl2上升+2H2O,该反应(
二氧化锰和浓盐酸共热制取氯气,反应的化学方程式为:MnO2+4HCl(浓)==MnCl2+Cl2上升+2H2O,该反应(是或不
)氧化还原反应,判断依据是? 容易出品1年前4
容易出品1年前4 -
 gracevin 共回答了14个问题
gracevin 共回答了14个问题 |采纳率71.4%是氧化还原反应,从有化学价升降可判断.
MnO2——MnCl2,Mn从+4价降为+2价;HCl——Cl2,Cl从-1价升为0价1年前查看全部
- 为什么这个方程式不是复分解反应?Mn(OH)2+MgCl2=MnCl2+Mg(OH)2↓
为什么这个方程式不是复分解反应?Mn(OH)2+MgCl2=MnCl2+Mg(OH)2↓
为什么这个方程式不是复分解反应?
Mn(OH)2+MgCl2=MnCl2+Mg(OH)2↓ Jay_07111年前1
Jay_07111年前1 -
 120028 共回答了20个问题
120028 共回答了20个问题 |采纳率85%要求两种反应物均可溶,生产物中有沉淀或气体才能发生,属于复分解反应
复分解反应发生的条件:
生成物起码具备下列三个条件之一:① 有沉淀析出;② 有气体放出;③ 有水生成.1年前查看全部
- 用浓盐酸和二氧化锰反应来制取少量氯气,化学方程式为Mon2+4Hcl(浓)=Mncl2+Cl2↑+2H2o 取8.7g的
用浓盐酸和二氧化锰反应来制取少量氯气,化学方程式为Mon2+4Hcl(浓)=Mncl2+Cl2↑+2H2o 取8.7g的Mno2
与足量的浓盐酸发生反应制取氯气,若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,计算原浓盐酸中所含HCL物质的量 舒热佳1年前1
舒热佳1年前1 -
 瓜子2142 共回答了28个问题
瓜子2142 共回答了28个问题 |采纳率89.3%设被氧化的HCl的物质的量是xMnO2+2HCl(浓)+2HCl(浓)═MnCl2+Cl2↑+2H2O87g 2mol8.7g x 所以x=0.2mol所以参加氧化还原反应的盐酸的物质的量是0.2mol又设没参加氧化还原反应的氯离子的物质的量是yCl-+Ag+=AgCl↓1m...1年前查看全部
- 去如何用化合价配平KMnO4+HCL---KCL+MnCL2+CL2+H2O
 dd5281年前3
dd5281年前3 -
 02084401 共回答了12个问题
02084401 共回答了12个问题 |采纳率83.3%2kmno4 +2hcl=kmno2+mon2+h2o+o21年前查看全部
- 比较方程式MnO2+4Hcl(浓)=Mncl2+cl2+2H2O和2Nacl(固)+H2SO4(浓)=Na2SO4+2H
比较方程式MnO2+4Hcl(浓)=Mncl2+cl2+2H2O和2Nacl(固)+H2SO4(浓)=Na2SO4+2HCl.(两者反应均加热)
为什么可以得出氧化性MnO2大于浓H2SO4? 越多的1年前4
越多的1年前4 -
 sdfsdgdfhdfh 共回答了13个问题
sdfsdgdfhdfh 共回答了13个问题 |采纳率84.6%氧化性是这种物质得电子能力的衡量,二氧化锰与负一价氯反应产生0价氯(氯气),得电子能力强,而浓硫酸与负一价氯反应产生的含氯物质只有负一价氯,不能在负一价氯那里得到电子,得电子能力弱1年前查看全部
- 在实验室用反应Mno2+4hcl(浓)=Mncl2+cl2↑+2h2o制少量氯气
在实验室用反应Mno2+4hcl(浓)=Mncl2+cl2↑+2h2o制少量氯气
当有4mol水生成时,在标准状况下生成氯气的体积 叶静思1年前1
叶静思1年前1 -
 冷文天成 共回答了12个问题
冷文天成 共回答了12个问题 |采纳率91.7%Cl2~2H2O
有 4 mol 水,则 有 4/2==2 mol Cl2 生成
2mol Cl2 标况体积==2*22.4==44.8 L1年前查看全部
- 氧化反应中的电子转移怎样才能求出电子转移的数目?举个例子:4HCl+MnO2→MnCl2+Cl2+2H2O那个Cl是怎么
氧化反应中的电子转移
怎样才能求出电子转移的数目?
举个例子:
4HCl+MnO2→MnCl2+Cl2+2H2O
那个Cl是怎么转的啊? dzh16681年前1
dzh16681年前1 -
 心是沙 共回答了13个问题
心是沙 共回答了13个问题 |采纳率100%分析反应前后各个元素化合价的变化
再乘以各个元素的数量
举个例子
C+O2==CO2
C化合价从0变为+4 失去4*1=4e
O化合价从0变为-2 得到2*2=4e
4HCl+MnO2→MnCl2+Cl2+2H2O
2个Cl从-1价变为0价 2个不变 所以失去1*2=2e
Mn从+4价变为+2价 得到2*1=2e1年前查看全部
- HCl+MnO2═MnCl2+ Cl2↑+2 H2O写出氧化性大小和还原性大小
HCl+MnO2═MnCl2+ Cl2↑+2 H2O写出氧化性大小和还原性大小
写出上式氧化剂和还原剂 并比较还原性和氧化性大小 33212001年前1
33212001年前1 -
 dacula123 共回答了23个问题
dacula123 共回答了23个问题 |采纳率82.6%4HCl(浓)+MnO2═MnCl2+ Cl2↑+2 H2O 记牢化合价的升降为低氧高还.反应中Mn从+4价变为+2价所以 MnO2为氧化剂,那么MnCl2为还原产物,又因为反应中HCl从-1价变为0价所以HCl为还原剂,Cl2为氧化产物.氧化性MnO2>Cl2还原性HCl>MnCl21年前查看全部
- 实验室通常用Mn2O2与浓盐酸反应制取氯气,化学方程式为Mn2O2+4HCL(浓)=MnCl2+Cl2+2H2O
实验室通常用Mn2O2与浓盐酸反应制取氯气,化学方程式为Mn2O2+4HCL(浓)=MnCl2+Cl2+2H2O
为进行有关氯气的性质实验,需要4瓶容积为100ML的氯气(室温下氯气的密度为2.91g/L)
(1)制取4瓶氯气,理论上需要MnO2固体质量是多少?
(2)实验室称量的二氧化锰固体的质量适量多于理论量,主要原因是? penghao191年前2
penghao191年前2 -
 honghao23 共回答了15个问题
honghao23 共回答了15个问题 |采纳率100%你的化学方程式,写错了,你看Mn都没平衡.是二氧化锰,不是二氧化二锰.(1)
应该是MnO2+4HCL(浓)======MnCl2+Cl2↑+2H2O
87gMnO2~71g CL2
XgMnO2~ 0.4L*2.91g/L CL2
X=87*(0.4*2.91)/71≈1.43(g)
(2)要过量称取是因为你要保证得到4瓶容积为100ML的氯气,而浓盐酸加热后又不断挥发稀释,1年前查看全部
大家在问
- 1为什么限流接法耗能低,分压接法耗能高?
- 2小王两年前存了一笔钱,年利率为3%,到期后共支取本息和4192元(扣除20%的利息税后),求两年前小王存了多
- 3计算机硬容量,KB,MB,GB;1MB=2的10次方KB,1GB=2的十次方MB 那么1GB为多少KB?
- 4简要说明作为中学生我们应该怎样保护生物圈?
- 5已知函数y=1/2cosx*cosx+√3/2sinx*cosx+1.当函数y取得最大值时,求自变量x的集合
- 6请问学英语如何分配时间最科学?比如上午是先练听力还是先背单词?我知道这都因人而异,给我一个标准吧!
- 7急求描写春天的诗句、段落、句子
- 8长方形被两条线段分成四个长方形其中三个分别是30,18,12平方米问第四个长方形面积
- 9未来20年人类有可能在月球上居住吗?
- 10在平面直角坐标系xoy中,已知点B(1,0)圆A:(x+1)2+y2=16,动点P在圆A上,线段BP的垂直平分线AP相交
- 11氧气用掉一半后(前提在一个瓶子里)密度有什么变化
- 12用一块长30厘米,宽20厘米的长方形铁皮(如图)做一个高为5厘米的无盖盒子.
- 13英语语法A great white stillness had taken over and with it, biti
- 14某同学为了研究化学实验室中某块白色固体的性质,进行了如下实验,其中你认为不正确的实验方案是( )
- 15看图列式计算(1)小明要买一盒水彩笔和一本笔记本,一共需要多少元?(2)笔记本比水彩笔便宜多少元?