海水提镁海水提取镁中不能用氢氧化钠代替氢氧化钙的原因
 fslee2022-10-04 11:39:543条回答
fslee2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 愿赌服输sp 共回答了13个问题
愿赌服输sp 共回答了13个问题 |采纳率76.9%- 从经济角度考虑,氢氧化钠的成本较高.
- 1年前
 e17日三三 共回答了32个问题
e17日三三 共回答了32个问题 |采纳率- 海水提镁海水是含有多种离子的混合溶液,其中阳离子有钠离子、钾离子和镁离子等。海水提镁,就是要把镁离子跟其他阳离子分离开来。利用离子反应生成难溶物质
- 1年前
 ZZKT001245 共回答了2个问题
ZZKT001245 共回答了2个问题 |采纳率- 不知
- 1年前
相关推荐
- 下列有关工业生产的叙述中,正确的是( ) A.海水提镁:
下列有关工业生产的叙述中,正确的是( ) A.海水提镁: 
B.海水提溴: 
C.工业制硫酸: 
D.工业合成氨: 
 mmkkok1年前1
mmkkok1年前1 -
 1ighting 共回答了20个问题
1ighting 共回答了20个问题 |采纳率90%A、生产流程中酸化结晶得到氯化镁晶体,电解氯化镁得到镁,故A正确;
B、空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是在预先经过酸化的浓缩海水中,用氯气置换溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集的目的,也就是得到富集溴.然后,再用氯气将其氧化得到产品溴,过程中溴蒸气被碱吸收不存在溴单质,故B错误;
C、工业制硫酸生成的三氧化硫用98.3%的浓硫酸吸收,用水吸收易形成酸雾,故C错误;
D、工业合成氨的原料气氢气不是电解水得到,电解消耗能源效益低;原料气是用碳和水蒸气高温反应生成氢气,故D错误;
故选A.1年前查看全部
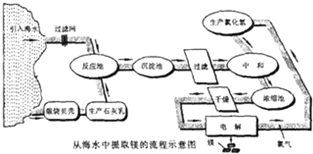
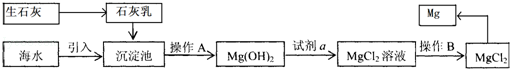
- 目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:
目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:

提示:①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是______,操作②的名称是______、______、过滤.
(2)试剂a的名称是______.
(3)用氯化镁电解生产金属镁的化学方程式为:MgCl2(熔融)
Mg+Cl2↑通电 .MgCl2(熔融).
Mg+Cl2↑通电 .
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是______. 白云与蓝天间1年前1
白云与蓝天间1年前1 -
 cd-diandian 共回答了16个问题
cd-diandian 共回答了16个问题 |采纳率81.3%解题思路:生石灰溶于水得到氢氧化钙溶液加入沉淀池,沉淀镁离子过滤,得到氢氧化镁固体,加入稀盐酸后溶解得到氯化镁溶液,通过蒸发浓缩、冷却结晶,过滤洗涤得到氯化镁晶体,熔融电解得到金属镁;
(1)分析流程操作①为过滤,操作②为溶液中得到溶质晶体的方法为蒸发浓缩,冷却结晶,过滤洗涤得到;
(2)试剂a为溶解氢氧化镁得到氯化镁溶液,结合提纯目的得到需要加入盐酸;
(3)电解熔融氯化镁得到金属镁和氯气;
(4)氧化镁熔点为2852℃,无水MgCl2的熔点为714℃,MgO熔点很高,熔融时耗费大量的能量而增加生产成本.生石灰溶于水得到氢氧化钙溶液加入沉淀池,沉淀镁离子过滤,得到氢氧化镁固体,加入稀盐酸后溶解得到氯化镁溶液,通过蒸发浓缩、冷却结晶,过滤洗涤得到氯化镁晶体,熔融电解得到金属镁;
(1)分析流程操作①是溶液中分离出固体的方法,操作为过滤,操作②为溶液中得到溶质晶体的方法为蒸发浓缩,冷却结晶,过滤洗涤得到;
故答案为:过滤;蒸发浓缩;冷却结晶;
(2)试剂a为溶解氢氧化镁得到氯化镁溶液,结合提纯目的得到需要加入盐酸,故答案为:盐酸;
(3)电解熔融氯化镁得到金属镁和氯气,MgCl2(熔融)
通电
.
Mg+Cl2↑,故答案为:MgCl2(熔融)
通电
.
Mg+Cl2↑;
(4)氧化镁熔点为2852℃,无水MgCl2的熔点为714℃,MgO熔点很高,熔融时耗费大量的能量而增加生产成本,
故答案为:MgO熔点很高,熔融时耗费大量的能量而增加生产成本.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查了物质分离的方法和流程判断,物质性质和实验基本操作是解题关键,题目较简单.1年前查看全部
- 目前,世界上生产的镁有60%来自海水.海水提镁,最基本的方法就是往海水里加碱使镁沉淀出来,然后经过一系列处理,最终得到单
目前,世界上生产的镁有60%来自海水.海水提镁,最基本的方法就是往海水里加碱使镁沉淀出来,然后经过一系列处理,最终得到单质镁.试判断:在海水提镁的过程中,不可能发生的反应有( )
A.2MgO
2Mg+O2↑电解 .
B.MgCl2
Mg+Cl2↑电解 .
C.Mg(OH)2+2HCl═MgCl2+2H2O
D.Mg2++2OH-═Mg(OH)2↓ 青崖碧岸1年前1
青崖碧岸1年前1 -
 亚明画 共回答了24个问题
亚明画 共回答了24个问题 |采纳率83.3%解题思路:海水中含有镁离子,首先将镁离子转化为氢氧化镁沉淀,然后将氢氧化镁溶于盐酸中得到氯化镁溶液,用氯化镁溶液制取无水氯化镁,最后利用电解熔融氯化镁的方法冶炼镁.海水中含有镁离子,首先将镁离子转化为氢氧化镁沉淀,反应方程式为:Mg2++2OH-=Mg(OH)2↓,然后将氢氧化镁溶于盐酸中得到氯化镁溶液,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,用氯化镁溶液在氯化氢氛围中制取无水氯化镁,活泼金属采用电解其熔融盐的方法冶炼,镁是活泼金属,所以最后利用电解熔融氯化镁的方法冶炼镁,反应方程式为:MgCl2
电解
.
Mg+Cl2↑,所以没有涉及的方程式是氧化镁的电解,
故选A.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了镁的提取,明确物质发生的变化及物质间的反应是解本题关键,难度不大.1年前查看全部
- (10分)(2011·锦州高一检测)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
(10分)(2011·锦州高一检测)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池发生反应的离子方程式 ________________________________________________________.
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________________________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl 2 在熔融状态下,通电后会产生Mg和Cl 2 ,该反应的化学方程式为______________________________________________________________________。
从考虑成本和废物循环利用的角度,副产物氯气可以用于
__________________________________________________________________。 mouse_19951年前1
mouse_19951年前1 -
 keeeyyo 共回答了13个问题
keeeyyo 共回答了13个问题 |采纳率92.3%(1)沉淀Mg 2 + [或使Mg 2 + 形成Mg(OH) 2 沉淀] Mg 2 + +2OH - ===Mg(OH) 2 ↓
(2)贝壳(或牡蛎壳等) (3)过滤 加热浓缩(或蒸发结晶)
(4)HCl (5)MgCl 2 (熔融) Mg+Cl 2 ↑ 制盐酸,循环使用
Mg+Cl 2 ↑ 制盐酸,循环使用
(1)石灰乳中含有OH - ,能结合镁离子生成氢氧化镁沉淀,方程式为Mg 2 + +2OH - ===Mg(OH) 2 ↓。
(2)由于贝壳的主要成分就是碳酸钙,因此可以利用海洋中的贝壳等。
(3)要得到沉淀,应该通过过滤;氯化镁易溶于水,因此要得到氯化镁晶体,应该是加热浓缩(或蒸发结晶)。
(4)氢氧化镁要转化为氯化镁,需要加入盐酸。
(5)镁是活泼的金属,通过电解法冶炼,方程式为MgCl 2 (熔融) Mg+Cl 2 ↑;氯气可以制取盐酸,循环使用。
1年前查看全部
Mg+Cl 2 ↑;氯气可以制取盐酸,循环使用。
1年前查看全部
- 海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变成氯化镁?
 古铜色阳光1年前1
古铜色阳光1年前1 -
 神呐_救救我吧 共回答了20个问题
神呐_救救我吧 共回答了20个问题 |采纳率90%提纯,浓缩
除去杂质1年前查看全部
- 目前世界上60%的镁是从海水中提取的.某校化学兴趣小组对这个课题展开了探究.已知海水提镁的主要步骤如下:
目前世界上60%的镁是从海水中提取的.某校化学兴趣小组对这个课题展开了探究.已知海水提镁的主要步骤如下:

兴趣小组就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?
甲、乙、丙三位同学提出了自己的观点.
甲:直接往海水中加入沉淀剂.
乙:高温加热蒸发海水后,再加入沉淀剂.
丙:利用晒盐后的苦卤水,再加入沉淀剂.
通过分析比较,丙同学观点更为合理、科学,请你简述理由:______.
(二)在海水提镁的过程中如何实现镁离子的分离?
(1)操作1是______
(2)试剂②是______(填化学式).
(3)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:MgCl2(熔融)
Mg+Cl2↑电解 .MgCl2(熔融).
Mg+Cl2↑电解 . 梦之海水手1年前1
梦之海水手1年前1 -
 瑞美尔特 共回答了16个问题
瑞美尔特 共回答了16个问题 |采纳率81.3%解题思路:海水提镁:Ca(OH)2加入海水溶液中,得到氢氧化镁沉淀,操作①为过滤得到Mg(OH)2↓,加入盐酸,得到氯化镁,电解得到镁和氯气.(一)可以比较三个观点的优点和缺点,综合分析;(二)(1)向太阳光蒸发浓缩后的海水中,加入碱可生成氢氧化镁,分离固体和液体用过滤;(2)氢氧化镁转化为氯化镁,可加入盐酸生成氯化镁;(3)电解熔融的氯化镁可得到镁.从海水(富含Na+、Mg2+、SO42-、Cl-等)中提取镁:贝壳高温分CaCO3
高温
.
CaO+CO2↑加入海水溶液中,CaO+H2O═Ca(OH)2,MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,通过操作①过滤得到滤渣Mg(OH)2↓,加入盐酸2HCl+Mg(OH)2═MgCl2+2H2O,溶液浓缩得到氯化镁的浓溶液,脱水得到无水氯化镁,电解得到镁和氯气,
(一)学生甲与其他观点相比,海水中镁离子浓度小,使用的沉淀剂的量较大,且不利于收集氢氧化镁,因此学生甲的观点不合理、科学;
学生乙与其他观点相比,高温蒸发海水,消耗的能源多,成本太高.因此学生乙的观点不合理、科学;
学生丙与学生乙相比,利用晒盐后的苦卤,节约能源,成本低;与学生甲相比镁离子浓度高,有利于镁元素的富集.因此学生丙的观点合理、科学;
故答案为:镁离子富集浓度高,能源消耗小,成本低;
(二)(1)在海水提镁的过程中应先浓缩海水,然后加入沉淀剂,沉降后需过滤分离不溶于水的固体和液体,所以操作1为过滤,
故答案为:过滤;
(2)要使氢氧化镁转化为氯化镁,则需要加入盐酸反应,Mg(OH)2+2HCl=MgCl2+2H2O,即试剂②是盐酸,
故答案为:HCl;
(3)工业上由无水MgCl2制取镁,常用电解的方法,方程式为:MgCl2(熔融)
电解
.
Mg+Cl2↑,
故答案为:MgCl2(熔融)
电解
.
Mg+Cl2↑.点评:
本题考点: 海水资源及其综合利用;金属冶炼的一般原理;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查镁的制备以及物质的分离与提纯,注意从题目物质转化、化学反应、方法的优劣等来分考问题,通过本题要学会怎样评价不同方法的优劣,从而选择出最佳方法.明确海水中镁的制备的流程及试剂的选择来分析是解答关键,注意制备镁利用电解法,题目难度中等.1年前查看全部
- 海水提镁3个化学方程式反应基本类型分别是什么?
 sanmarino1年前2
sanmarino1年前2 -
 lanyu_84 共回答了16个问题
lanyu_84 共回答了16个问题 |采纳率100%MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 复分解反应
Mg(OH)2+2HCl=MgCl2+2H2O 复分解反应
MgCl2=电解=Mg+Cl2↑ 分解反应1年前查看全部
- 镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国
镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国际上的主要趋势,工业流程图如下; 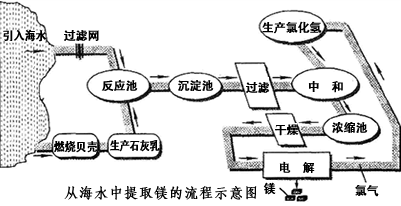
其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO 3 )煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH) 2 沉淀
Ⅲ.在Mg(OH) 2 沉淀中加入盐酸中和得到MgCl 2 溶液,再经蒸发结晶得到MgCl 2 ·6H 2 O Ⅳ.将MgCl 2 ·6H 2 O在一定条件下加热得到无水MgCl 2
V.电解熔融的无水MgCl 2 可得到Mg
(1)请根据上述步骤回答问题:
①写出步骤Ⅰ、Ⅲ的有关化学方程式:
Ⅰ.贝壳煅烧成生石灰________________________________
Ⅲ.Mg(OH) 2 沉淀中加入盐酸中和________________________________
(2)步骤Ⅰ~Ⅴ中有分解反应的是(填写步骤序号):_______________
(3)步骤Ⅲ中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有____________、_____________、酒精灯、带铁圈的铁架台、坩埚钳等。
(4)上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点: ___________________________________________
(5)回答下列问题;
①右图为镁元素的某种粒子结构示意图 ,该图表示(填序号)___________。
,该图表示(填序号)___________。
A.分子 B.原子 C.阳离子 D.阴离子
②镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或“不活泼”)__________金属,除了能与氧气反应,还可以与氮气,二氧化碳等反应。
(6)为测定约含镁30%的镁铝合金(不含其它元素)中镁的质量分数。
①第一小组设计下列实验方案:称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。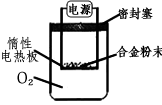
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是____________。
讨论二:若用空气代替O 2 进行实验,对测定结果_________(填“有”或“无”)影响。
②第二小组设计下列实验方案:称取bg镁铝合金,与足量的稀盐酸完全反应。欲计算镁的质量分数,该实验中还需测定的一种数据是________________ 匡威正品鞋子1年前1
匡威正品鞋子1年前1 -
 banbanyaojing 共回答了20个问题
banbanyaojing 共回答了20个问题 |采纳率85%1年前查看全部
- 海水提镁中第一次的氯化镁与第二次有何不同
 test22581年前1
test22581年前1 -
 小吴xiao 共回答了17个问题
小吴xiao 共回答了17个问题 |采纳率94.1%第一次的氯化镁为海水中的其中一种溶质,而第二次的氯化镁则为从氯化镁的溶液中分离出的纯净的氯化镁.1年前查看全部
- 海水提镁方程式中为什么只能用盐酸
海水提镁方程式中为什么只能用盐酸
CA(oH)2 +MGCL2=MG(OH)2+CACL2
MG(OH)2+2HCL=MGCL2+2H2O
MGCL2(熔熔)=点解 MG+CL2
当中只能用hcl 为什么 Hamasaky1年前4
Hamasaky1年前4 -
 6647753 共回答了20个问题
6647753 共回答了20个问题 |采纳率90%因为,假如用硫酸或者硝酸之类氧化性比盐酸强的酸会和海水中其他化学物质发生反应并且生成影响提镁反应的物质1年前查看全部
- 目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:
目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是______,写出在沉淀池的离子方程式______.
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的______.
(3)操作A是______,操作B是______.
(4)加入的足量试剂a是______(填化学式).
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为MgCl2(熔融)
Mg+Cl2↑通电 .MgCl2(熔融).从考虑成本和废物循环利用的角度,副产物氯气可以用于______.
Mg+Cl2↑通电 .
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?______.
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你______(填“同意”或“不同意”)该同学的想法,理由是______. 画条狗咬你1年前1
画条狗咬你1年前1 -
 麻花小辫18 共回答了16个问题
麻花小辫18 共回答了16个问题 |采纳率100%解题思路:(1)根据镁离子能与氢氧根离子反应生成沉淀解答;
(2)根据海洋产品中与石灰石相同的物质进行解答;
(3)根据过滤的原理和六水合氯化镁晶体的特点解答;
(4)根据反应流程图前后推解;
(5)根据电解的原理解答,根据流程图推测副产物氯气的用途;
(6)从盐的纯净的程度和耗能角度解答;
(7)根据氧化镁和氯化镁的熔点解答;(1)镁离子能与氢氧根离子反应生成氢氧化镁沉淀:Mg2++2OH-=Mg(OH)2↓,写离子方程式时氢氧化镁沉淀写化学式,
故答案为:沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀);Mg2++2OH-═Mg(OH)2↓;
(2)贝壳或牡蛎壳的主要成分为碳酸钙,
故答案为:贝壳(或牡蛎壳等)
(3)分离不溶于水的固体和液体,可用过滤的方法,从沉淀池中得到氢氧化镁用过滤的方法,从氯化镁溶液中得到六水合氯化镁,防结晶水损失,通过加热浓缩或蒸发结晶的方法获得六水合氯化镁,
故答案为:过滤; 加热浓缩(或蒸发结晶);
(4)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,加入的足量试剂a是HCl,
故答案为:HCl;
(5)无水MgCl2在熔融状态下,通电后阳极氯离子失去电子生成氯气,阴极镁离子得到电子生成镁单质,所以氯化镁电解会产生Mg和Cl2,副产物氯气和氢气反应生成氯化氢,能循环使用,
故答案为:MgCl2(熔融)
通电
.
Mg+Cl2↑,制盐酸,循环使用;
(6)将海水中的氯化镁含量大,由于未富集,镁离子浓度很低,直接加热浓缩提取须消耗大量的电能,成本高,且提取的氯化镁盐中混有大量的其它氯化钠盐等离子,所以须将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁,
故答案为:海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低.
(7)MgO熔点为3105℃,MgCl2熔点714℃,熔融MgO时耗费大量的能量,而增加生产成本,
故答案为:不同意;MgO熔点很高,熔融时耗费大量的能量而增加生产成本;点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度中等.1年前查看全部
- 目前世界上60%的镁是从海水中提取的.海水提镁的主要流程如下:
目前世界上60%的镁是从海水中提取的.海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,向海水中加入石灰乳的作用是______,写出在沉淀池中反应的离子方程式______.
(2)石灰乳是生石灰与水形成的混合物,从充分利用海洋化学资源、提高经济效益的角度,生产生石灰的主要原料来源于海洋中的______.
(3)操作A是______,操作B是______.
(4)加入的足量试剂a是______(填化学式).
(5)无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,该反应的化学方程式是MgCl2(熔融)
Mg+Cl2↑通电 .MgCl2(熔融).从考虑成本和废物循环利用的角度,副产物氯气可以用于______.
Mg+Cl2↑通电 .
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?______. jingmayi1年前1
jingmayi1年前1 -
 yyj0709 共回答了14个问题
yyj0709 共回答了14个问题 |采纳率78.6%解题思路:(1)根据镁离子能与氢氧根离子反应生成沉淀来确定氢氧化钙的作用;
(2)根据海洋产品中与石灰石相同的物质进行解答;
(3)根据过滤的原理和六水合氯化镁晶体的特点解答;
(4)根据反应流程图前后推解;
(5)根据电解的原理解答,根据流程图推测副产物氯气的用途;
(6)从盐的纯净的程度和耗能角度解答.(1)镁离子能与氢氧根离子反应生成氢氧化镁沉淀:Mg2++Ca(OH)2═Mg(OH)2+Ca2+,写离子方程式时氢氧化镁沉淀写化学式,
故答案为:沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀);Mg2++Ca(OH)2═Mg(OH)2+Ca2+;
(2)贝壳或牡蛎壳的主要成分为碳酸钙,故答案为:贝壳(或牡蛎壳等);
(3)分离不溶于水的固体和液体,可用过滤的方法,从沉淀池中得到氢氧化镁用过滤的方法,从氯化镁溶液中得到六水合氯化镁,防结晶水损失,通过加热浓缩或蒸发结晶的方法获得六水合氯化镁,
故答案为:过滤; 加热浓缩(或蒸发结晶);
(4)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,加入的足量试剂a是HCl,
故答案为:HCl;
(5)无水MgCl2在熔融状态下,通电后阳极氯离子失去电子生成氯气,阴极镁离子得到电子生成镁单质,所以氯化镁电解会产生Mg和Cl2,副产物氯气和氢气反应生成氯化氢,能循环使用,
故答案为:MgCl2(熔融)
通电
.
Mg+Cl2↑;制盐酸,循环使用;
(6)将海水中的氯化镁含量大,由于未富集,镁离子浓度很低,直接加热浓缩提取须消耗大量的电能,成本高,且提取的氯化镁盐中混有大量的其它氯化钠盐等离子,所以须将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁,
故答案为:海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度中等.1年前查看全部
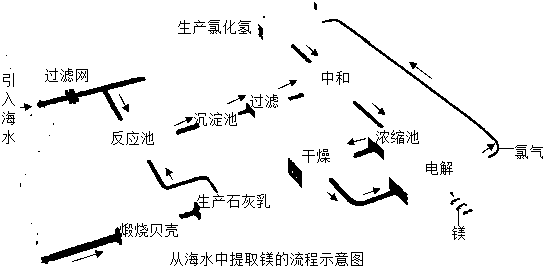
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程图如下;
其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O
Ⅳ.将MgCl2•6H2O在一定条件下加热得到无水MgCl2
V.电解熔融的无水MgCl2可得到Mg
(1)请根据上述步骤回答问题:
①写出步骤Ⅰ、Ⅱ、Ⅲ、Ⅳ的有关化学方程式,并注明基本反应类型:
Ⅰ、CaCO3
CaO+CO2↑、CaO+H2O═Ca(OH)2高温 .CaCO3、反应类型:______
CaO+CO2↑、CaO+H2O═Ca(OH)2高温 .
Ⅱ、______、反应类型:______
Ⅲ、______、反应类型:______
Ⅳ、MgCl2•6H2O
MgCl2+6H2O△ .MgCl2•6H2O、反应类型:______
MgCl2+6H2O△ .
②步骤Ⅳ在实验室中进行蒸发结晶得到MgCl2需要的主要仪器有______、______、酒精灯、带铁圈的铁架台、坩埚钳等. z3153151年前1
z3153151年前1 -
 loui何 共回答了21个问题
loui何 共回答了21个问题 |采纳率95.2%解题思路:根据反应物和生成物及其质量守恒定律可以书写化学方程式;根据化学方程式可以判断反应类型;在实验室中进行蒸发操作需要的主要仪器有蒸发皿、玻璃棒、酒精灯、带铁圈的铁架台、坩埚钳等(1)①Ⅰ贝壳煅烧成生石灰的化学方程式为:CaCO3
高温
.
CaO+CO2↑是一种变多种,属于分解反应.生石灰溶于水制成石灰乳,方程式为:CaO+H2O═Ca(OH)2反应物是两种,生成物是一种,属于化合反应;
Ⅱ、将石灰乳加入到海水反应池中,与氯化镁反应生成氢氧化镁沉淀,经过沉降、过滤得到Mg(OH)2,方程式为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O.反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O.属于复分解反应;
Ⅳ.将MgCl2•6H2O在一定条件下加热得到无水MgCl2方程式为:MgCl2•6H2O
△
.
MgCl2+6H2O 属于分解反应;
②.在实验室中进行蒸发操作需要的主要仪器有蒸发皿、玻璃棒、酒精灯、带铁圈的铁架台、坩埚钳等.
故答案为Ⅰ、
CaCO3
高温
.
CaO+CO2↑、CaO+H2O═Ca(OH)2 分解反应、化合反应
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
复分解反应
Ⅲ、Mg(OH)2+2HCl=MgCl2+2H2O
复分解反应
Ⅳ、MgCl2•6H2O
△
.
MgCl2+6H2O 分解反应
②蒸发皿玻璃棒点评:
本题考点: 物质的相互转化和制备;碳酸钙、生石灰、熟石灰之间的转化;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要掌握化学方程式的书写方法和反应类型的判断方法1年前查看全部
- 海水提镁,海水提溴,海水提碘的工艺流程和主要化学方程式
海水提镁,海水提溴,海水提碘的工艺流程和主要化学方程式
紧急 Z978Y271年前1
Z978Y271年前1 -
 glfreddie 共回答了13个问题
glfreddie 共回答了13个问题 |采纳率92.3%镁在海水中的含量仅次于氯和钠,总储量约为1.8×1015吨,主要以氯化镁和硫酸镁的形式存在.从海水中提取镁并不复杂,只要将石灰乳液加入海水中,沉淀出氢氧化镁,注入盐酸,再转换成无水氯化镁就可以了.电解海水也可以得到金属镁.海水-(结晶)-母液-(石灰乳)-Mg(OH)2-(加盐酸,浓缩,结晶)-MgCl2晶体-(脱水)-MgCl2-(电解)-Mg
Mg离子+2OH离子(生石灰+水)=Mg(OH)2沉淀
Mg(OH)2+2HCl=MgCl2+2水
MgCl2(电解)=Mg+Cl2
在海水中,溴总是以溴化镁和溴化钠的形式存在.提取溴的方法常用空气吹出法,即用硫酸将海水酸化,通入氯气氧化,使溴呈气体状态,然后通入空气或水蒸气,将溴吹出来
1.3CO32- +3Br2=5Br- +BrO3- +3CO2↑
2.BrO3- +5Br- +6H+ =3Br2+3H2O
直接从海水中提取碘.利用晒盐后的卤水也可制取碘,所采用的方法有活性炭吸附法、淀粉吸附法、硝酸银或硫酸铜沉淀法、离子交换树脂法等.某些海藻具有吸附碘的能力,如干海带中碘的含量一般为0.3%~0.5%,比海水中碘的浓度高10万倍.因此,利用浸泡液浸泡海带亦可制取碘.1年前查看全部
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国
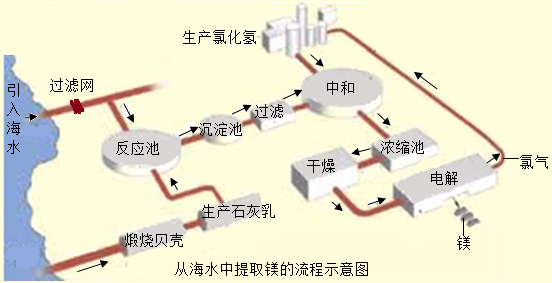
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程图如下:
其步骤为:
I.将海边大量存在的贝壳(主要成分为CaCO3煅烧成生石灰,并将生石灰制成石灰乳;
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀;
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O;
Ⅳ.将MgCl2•6H2O在一定条件下加热得到无水MgCl2.
V.电解熔融的无水MgCl2可得到Mg(1)请根据上述步骤回答问题:
①写出步骤I、Ⅲ的有关化学方程式:
I.贝壳煅烧成生石灰CaCO3
CaO+CO2↑高温 .CaCO3;
CaO+CO2↑高温 .
Ⅲ.Mg(OH)2沉淀中加入盐酸中和______.
②步骤I~V中有分解反应的是(填写步骤序号):______.
③步骤11中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发需要的主要仪器有______、______、酒精灯、带铁圈的铁架台、坩埚钳等.
④上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点:
______.
(2)回答下列问题:
①图为镁元素的某种粒子结构示意图,该图表示(填序号)______
A、分子B、原子C、阳离子D、阴离子.
②镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或”不活泼”)______金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应.
(3)为测定约含镁30%的镁铝合金(不含其它元素)中镁的质量分数.
①第一小组设计下列实验方案:称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧.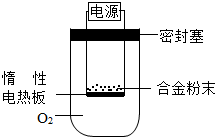
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是______.
讨论二:若用空气代替O2进行实验,对测定结果(填“有”或“无”)______影响.
②第二小组设计下列实验方案:称取b g镁铝合金,与足量的稀盐酸完全反应.
欲计算镁的质量分数,该实验中还需测定的一种数据是______. youyouvivi1年前1
youyouvivi1年前1 -
 klwos 共回答了28个问题
klwos 共回答了28个问题 |采纳率100%解题思路:(1)主要从化学方程式的书写和基本反应类型的判断回答:①书写化学方程式要按步骤进行,首先正确写出反应物和生成物的化学式,再进行配平,最后注明反应条件.②判断反应类型要根据反应的特点,分解反应是特点是一种物质变多种物质.③熟记蒸发操作要用的仪器.④降低成本、减少污染的措施要从产物的充分利用,节约能源方面考虑.
(2)原子的结构示意图中最外层电子数以及核内质子数和核外电子数的关系决定粒子的性质和种类.
(3)①已知镁铝合金为a克,镁铝合金燃烧后生成氧化镁与氧化铝,称出反应后固体的质量为b克,我们就可以设镁铝合金中镁的质量为x,则铝的质量为(a-x)g;设生成固体中氧化镁的质量为y,则氧化铝的质量为(b-y)g;然后根据化学方程式列出比例式,解方程组求解即可.
②已知镁铝合金为a克,镁铝合金与酸后会生成氢气,称出反应后生成氢气的质量为c克,我们就可以设镁铝合金中镁的质量为m,则铝的质量为(a-m)g;设镁与酸反应生成氢气的质量为n,则铝与酸反应生成氢气的质量为(c-n)g;然后根据化学方程式列出比例式,解方程组求解即可.(1)①I.贝壳煅烧成生石灰的化学方程式为 CaCO3
高温
.
CaO+CO2↑;
Ⅲ.Mg(OH)2沉淀中加入盐酸中和反应的化学方程式为 Mg(OH)2+2HCl=MgCl2+2H2O.
②分解反应是特点是一种物质变多种物质.其中煅烧贝壳,加热六水氯化镁,电解无水氯化镁都是分解反应.
③蒸发操作要用的主要仪器有蒸发皿、玻璃棒、酒精灯、带铁圈的铁架台、坩埚钳等.
④降低成本、减少污染的措施要从产物的充分利用,节约能源方面考虑.如电解产生的氯气用于生产HCl
(2)①从结构示意图中看出核内质子数比核外电子数多,故粒子带正电荷,是阳离子;②镁原子的结构示意图中,最外层有两个电子,易失去,故化学性质活泼.
(3)①测定镁铝合金中镁的质量分数要根据镁铝与氧气反应生成的氧化物质量不同测定,在空气中测定,因为镁还能与氮气、二氧化碳等气体反应,会影响结果的准确性.
②镁铝合金与足量的酸反应根据生成的氢气质量不同测定来测定镁的质量分数.
答案:(1)①CaCO3
高温
.
CaO+CO2↑ Mg(OH)2+2HCl=MgCl2+2H2O
②I、Ⅳ、V
③蒸发皿 玻璃樟
④电解产生的氯气用于生产HCl (2)①C ②活泼
(3)①完全反应后生成的固体的质量 有
②充分反应后生成的氢气的质量(体积)点评:
本题考点: 对海洋资源的合理开发与利用;蒸发与蒸馏操作;常用仪器的名称和选用;金属的化学性质;原子结构示意图与离子结构示意图;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题综合了物质的制备,化学方程式的书写,基本实验操作,原子结构示意图,混合物中成分的测定等多个考点,难度较大.1年前查看全部
- (12分).目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
(12分).目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,写出在沉淀池的离子方程式 。
(2)操作A是 ,操作B是 。
(3)加入的足量试剂a是 (填化学式)。
(4)无水MgCl 2 在熔融状态下,通电后会产生Mg和Cl 2 ,该反应的化学方程式为 。
(5)有同学认为:可直接加热Mg(OH) 2 得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你 (填“同意”或“不同意”)此观点。 魂思1年前1
魂思1年前1 -
 teayeah 共回答了20个问题
teayeah 共回答了20个问题 |采纳率85%1年前查看全部
- 目前世界上60%的镁是从海水中提取的.学生就这个课题展开了讨论.已知海水提镁的主要步骤如下:
目前世界上60%的镁是从海水中提取的.学生就这个课题展开了讨论.已知海水提镁的主要步骤如下:

(1)关于加入试剂①作沉淀剂,同学们提出了不同方法.请你参与他们的讨论:
(一)______;方法 是否正确 简述理由 方法1:直接往海水中加入沉淀剂 不正确 (一) 方法2:高温加热蒸发海水后,再加入沉淀剂 (二) (三) 你认为最合理的其他方法是:(四)
(二)______;
(三)______;
(四)______.
(2)框中加入的试剂①应该是______(填“化学式”);加入的试剂②是______(填“化学式”);工业上由无水MgCl2制取镁的化学方程式为:MgCl2(融溶)
Mg+Cl2↑通电 .MgCl2(融溶).
Mg+Cl2↑通电 . 2714101年前1
2714101年前1 -
 jing_png 共回答了13个问题
jing_png 共回答了13个问题 |采纳率100%解题思路:(1)根据海水中镁离子的浓度以及海水处理的成本进行对比分析,可得出结论;
(2)在浓缩后的海水中加入碱可生成氢氧化镁,然后加入盐酸生成氯化镁,电解熔融的氯化镁可得到镁.(1)方法1与其他方法相比,海水中镁离子浓度小,使用的沉淀剂的量较大,且不利于收集氢氧化镁,因此学生方法1不正确,原因是:海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀;
方法2与其他方法相比,高温蒸发海水,消耗的能源多,成本太高.因此方法2的方法不正确,原因是:能源消耗大,海水的综合利用低,成本高;
应先浓缩海水,然后加入沉淀剂,
故答案为:(一)海水中镁离子浓度小,沉淀剂的用量大,不经济;
(二)不正确;
(三)能源消耗大,不经济;
(四)向太阳光蒸发浓缩后的海水中,加入沉淀剂;
(2)氯化镁生成氢氧化镁,应加入Ca(OH)2或CaO;要使氢氧化镁转化为氯化镁,则需要加入盐酸反应;工业上由无水MgCl2制取镁,常用电解的方法,方程式为MgCl2(融溶)
通电
.
Mg+Cl2↑,
故答案为:Ca(OH)2;HCl;MgCl2(融溶)
通电
.
Mg+Cl2↑.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;海水资源及其综合利用.
考点点评: 本题以海水的综合应用为载体综合考查物质的分离与提纯,侧重于考查学生化学知识的综合运用能力和评价能力,答题时注意从题目物质转化、化学反应、方法的优劣等来分考问题,通过本题要学会怎样评价不同方法的优劣,从而选择出最佳方法.1年前查看全部
- 海水提镁的历程(只要3个方程式)
 tracyai1年前1
tracyai1年前1 -
 beck_sh 共回答了14个问题
beck_sh 共回答了14个问题 |采纳率78.6%沉淀:Ca(OH)2 + MgCl2 == CaCl2 + Mg(OH)2↓
Mg(OH)2 + 2 HCl = MgCl2 + 2 H2O
MgCl2(熔融) ==通电== Mg + Cl2↑1年前查看全部
- 目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,写出在沉淀池中发生反应的离子方程式 。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
(3)操作A是 ,操作B是 。
(4)加入的足量试剂a是 (填化学式)。
(5)无水MgCl 2 在熔融状态下,通电后会产生Mg和Cl 2 ,该反应的化学方程式为 。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
_____________________________________________ 25把刀1年前1
25把刀1年前1 -
 lp_stm01 共回答了17个问题
lp_stm01 共回答了17个问题 |采纳率94.1%(1)沉淀Mg 2+ [或使Mg 2+ 形成Mg(OH) 2 沉淀](1分)Mg 2+ +2OH - Mg(OH) 2 ↓(1分)(2)贝壳(或牡蛎壳等)(1分)(3)过滤 蒸发结晶(或加热浓缩)(每空0.5分)(4)盐酸(1分)(5)MgCl 2 (熔融) Mg+Cl 2 ↑(2分) 制盐酸...1年前查看全部
- 目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:
目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是:______.
(2)石灰乳是生石灰与水形成的混合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的______.
(3)操作A是______,操作B是______.
(4)无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,该反应的化学方程式是MgCl2(熔融)
Mg+Cl2↑电解 .MgCl2(熔融).从考虑成本和废物循环利用的角度,副产物氯气可以用于______.
Mg+Cl2↑电解 .
(5)从海水提取镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?______. leon_xnjd1年前1
leon_xnjd1年前1 -
 珍惜H 共回答了20个问题
珍惜H 共回答了20个问题 |采纳率95%解题思路:(1)石灰乳的溶解性大于氢氧化镁,所以石灰乳和镁离子反应生成Mg(OH)2沉淀;
(2)贝壳的主要成分是CaCO3,从充分利用海洋化学资源,提高经济效益的角度,应该用贝壳制取生石灰;
(3)分离难溶性固体和溶液采用过滤的方法分离;从MgCl2溶液中制取MgCl2.6H2O采用蒸发结晶的方法;
(4)无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,据此书写电解方程式;
氯气和氢气反应生成HCl而制备稀盐酸;
(5)海水中镁离子量很大但浓度较低.(1)石灰乳的溶解性大于氢氧化镁,所以石灰乳和镁离子反应生成Mg(OH)2沉淀,则石灰乳的作用是沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀),故答案为:沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀);
(2)贝壳的主要成分是CaCO3,从充分利用海洋化学资源,提高经济效益的角度,应该用贝壳制取生石灰,
故答案为:贝壳;
(3)分离难溶性固体和溶液采用过滤的方法分离,氢氧化镁难溶于水,其它物质易溶于水,所以操作A为过滤;从MgCl2溶液中制取MgCl2.6H2O采用蒸发结晶的方法,所以操作B为蒸发结晶,
故答案为:过滤;蒸发结晶;
(4)无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,电解方程式为MgCl2(熔融)
电解
.
Mg+Cl2↑,氯气和氢气反应生成HCl而制备稀盐酸,从而达到循环利用的目的,
故答案为:MgCl2(熔融)
电解
.
Mg+Cl2↑;制备盐酸;
氯气和氢氧化钙反应生成次氯酸钙,从考虑成本和废物循环利用的角度,副产物氯气可以用于制备漂白粉;
(5)海水中镁离子量很大但浓度较低,如果单纯运用海水制取镁成本大,为降低成本,所以先将镁离子富集,故答案为:海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查海水资源的综合利用,明确海水中的成分及物质的性质是解本题关键,会分析流程图中各步发生的反应及操作方法,能从经济效益方面考虑,同时考查学生学以致用能力.1年前查看全部
- 下列说法或做法正确的是( )A.工业上电解熔融AlCl3制取金属铝B.镁在空气中燃烧的产物只有MgOC.海水提镁和海水
下列说法或做法正确的是( )
A.工业上电解熔融AlCl3制取金属铝
B.镁在空气中燃烧的产物只有MgO
C.海水提镁和海水提取溴所涉及的化学反应全部是氧化还原反应
D.铜表面形成的铜绿的主要成分为Cu2(OH)2CO3 gykazy1年前1
gykazy1年前1 -
 jiqzlzq 共回答了26个问题
jiqzlzq 共回答了26个问题 |采纳率88.5%解题思路:A.氯化铝为共价化合物,工业上金属铝是用电解氧化铝来冶炼;
B.金属镁条在空气中燃烧后生成的固体产物有:MgO、Mg3N2、C;
C.海水提溴是先氧化溴离子为溴单质,再用还原剂还原溴单质为溴离子,再用氧化剂氧化溴离子为溴单质,为氧化还原反应,从海水中提取镁的步骤为:把贝壳制成石灰乳;在引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将产物电解得到金属镁,多数反应为非氧化还原反应;
D.铜表面形成的铜绿的主要成分为碱式碳酸铜;A.氯化铝为共价化合物,工业上电解熔融的氧化铝制铝,反应的化学方程式为:2Al2O3
电解
.
4Al+3O2↑,故A错误;
B.镁在空气中燃烧时,发生如下反应:3Mg+N2
点燃
.
Mg3N2,2Mg+O2
点燃
.
2MgO,2Mg+CO2
点燃
.
2MgO+C,故B错误;
C.海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,最后萃取,从海水中提取镁涉及反应有:CaCO3
高温
.
CaO+CO2↑、CaO+H2O═Ca(OH)2,MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2•6H2O
△
.
MgCl2+6H2O
MgCl2
电解
.
Mg+Cl2↑,只有电解氯化镁涉及氧化还原反应,故C错误;
D.铜表面形成的铜绿的主要成分为碱式碳酸铜,[主要成分Cu2(OH)2CO3],故D正确;
故选D.点评:
本题考点: 金属冶炼的一般原理;海水资源及其综合利用;镁的化学性质;铜金属及其重要化合物的主要性质.
考点点评: 本题重要考查了元素化合物知识,侧重考查了卤素氯、溴以及金属铝、铜、镁的性质,注意海水提镁和海水提取溴的原理,题目难度中等.1年前查看全部
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程图如图;
其步骤为:
I、将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ、将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ、在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O
Ⅳ、将MgCl2•6H2O在一定条件下加热得到无水MgCl2
V、电解熔融的无水MgCl2可得到Mg
(1)请根据上述步骤回答问题:①写出步骤I、Ⅲ的有关化学方程式:
I、贝壳煅烧成生石灰CaCO3
CaO+CO2↑高温 .CaCO3
CaO+CO2↑高温 .
Ⅲ.Mg(OH)2沉淀中加入盐酸中和______
②步骤I~V中有分解反应的是(填写步骤序号):______.
③上述海水提镁的流程中,采取了循环、回收利用的物质是:______. 该设计的优点是降低成本、减少污染. wgcw5371年前1
wgcw5371年前1 -
 jessie_yuorng 共回答了11个问题
jessie_yuorng 共回答了11个问题 |采纳率100%解题思路:①根据锻烧贝壳的原理分析即可;
②根据分解反应的概念分析即可;
③根据工艺流程图来分析.①贝壳的主要成分是碳酸钙,锻烧碳酸钙生成氧化钙和二氧化碳,反应的原理是:CaCO3
高温
.
CaO+CO2↑;向Mg(OH)2沉淀中加入盐酸所发生的反应是:Mg(OH)2+2HCl=MgCl2+2H2O,
②分解反应的概念:由一种物质生成两种或两种以上的物质的反应,
I、Ⅳ、V所涉及到的方程式分别为:CaCO3
高温
.
CaO+CO2↑; MgCl2•6H2O
△
.
MgCl2+6H2O; MgCl2
通电
.
Mg+Cl2↑;
故答案为:I、Ⅳ、V;
③电解产生的Cl2用于制取HCl气体,实现盐酸循环利用,减少了环境污染.故填:氯气.点评:
本题考点: 对海洋资源的合理开发与利用;碳酸钙、生石灰、熟石灰之间的转化;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题以从海水中提取镁为背景,考查物质的分离、提纯,节能减排等知识,培养了学生运用知识的能力.1年前查看全部
- 就是沉淀Mg2+时不是已经有MgCl2,为什么不直接电解产生Mg,而要加Ca(OH)2试剂反应?海水提镁已经有MgCl2
 maxtv_cn1年前2
maxtv_cn1年前2 -
 泣血苍狼 共回答了24个问题
泣血苍狼 共回答了24个问题 |采纳率91.7%MgCl2 溶液电离时:
正极:2H+ +2e ====H2 因为H+的放电能力强过Mg2+所以先放电
负极:2Cl- -2e === Cl2
总反应式:MgCl2 + 2H2O ===Mg(OH)2沉淀 +H2气体符号 +Cl2气体符号
所以得不到Mg
要加Ca(OH)2试剂 实际上是使Mg2+富集起来生成Mg(OH)2
然后Mg(OH)2 +2HCl ===MgCl2 + 2H2O
得到MgCl2溶液后,将溶液蒸干得到无水MgCl2
MgCl2(熔融)====通电====Mg + Cl2
这样就可以制得Mg1年前查看全部
- 目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:
目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下: 
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是______,写出在沉淀池的离子方程式______.
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的______.
(3)操作A是______,操作B是______.
(4)加入的足量试剂a是______(填化学式).
(5)无水MgCl 2 在熔融状态下,通电后会产生Mg和Cl 2 ,该反应的化学方程式为______.从考虑成本和废物循环利用的角度,副产物氯气可以用于______.
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?______.
(7)有同学认为:可直接加热Mg(OH) 2 得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你______(填“同意”或“不同意”)该同学的想法,理由是______. 色东1年前1
色东1年前1 -
 njwmd 共回答了22个问题
njwmd 共回答了22个问题 |采纳率72.7%(1)镁离子能与氢氧根离子反应生成氢氧化镁沉淀:Mg 2+ +2OH - =Mg(OH) 2 ↓,写离子方程式时氢氧化镁沉淀写化学式,
故答案为:沉淀Mg 2+ (或使Mg 2+ 形成Mg(OH) 2 沉淀);Mg 2+ +2OH - ═Mg(OH) 2 ↓;
(2)贝壳或牡蛎壳的主要成分为碳酸钙,
故答案为:贝壳(或牡蛎壳等)
(3)分离不溶于水的固体和液体,可用过滤的方法,从沉淀池中得到氢氧化镁用过滤的方法,从氯化镁溶液中得到六水合氯化镁,防结晶水损失,通过加热浓缩或蒸发结晶的方法获得六水合氯化镁,
故答案为:过滤; 加热浓缩(或蒸发结晶);
(4)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH) 2 +2HCl=MgCl 2 +2H 2 O,加入的足量试剂a是HCl,
故答案为:HCl;
(5)无水MgCl 2 在熔融状态下,通电后阳极氯离子失去电子生成氯气,阴极镁离子得到电子生成镁单质,所以氯化镁电解会产生Mg和Cl 2 ,副产物氯气和氢气反应生成氯化氢,能循环使用,
故答案为:MgCl 2 (熔融)
通电
.
Mg+Cl 2 ↑,制盐酸,循环使用;
(6)将海水中的氯化镁含量大,由于未富集,镁离子浓度很低,直接加热浓缩提取须消耗大量的电能,成本高,且提取的氯化镁盐中混有大量的其它氯化钠盐等离子,所以须将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁,
故答案为:海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低.
(7)MgO熔点为3105℃,MgCl 2 熔点714℃,熔融MgO时耗费大量的能量,而增加生产成本,
故答案为:不同意;MgO熔点很高,熔融时耗费大量的能量而增加生产成本;1年前查看全部
- 目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下 请回答下列问题:
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下 
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是_______________________,写出在沉淀池的离子方程式_____________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的_________________。
(3)操作A是_______________, 操作B是__________________。
(4)加入的足量试剂a是__________________(填化学式)。
(5)无水MgCl 2 在熔融状态下,通电后会产生Mg和Cl 2 ,该反应的化学方程式为___________________。从考虑成本和废物循环利用的角度,副产物氯气可以用于_________________。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
_________________________。
(7)有同学认为:可直接加热Mg(OH) 2 得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你______________(填“同意”或“不同意”)该同学的想法,理由是
_______________________。 是不是老板1年前1
是不是老板1年前1 -
 一直爱 共回答了19个问题
一直爱 共回答了19个问题 |采纳率100%1年前查看全部
- 海水提镁的制取Mg这一步中,为什么要电解熔融的氯化镁?
 路边一郎1年前2
路边一郎1年前2 -
 superclaus 共回答了11个问题
superclaus 共回答了11个问题 |采纳率100%获得纯度高的MG1年前查看全部
- 目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下 请回答下列问题:
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下 
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是______________________,写出在沉淀池的离子方程式_____________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的______________________。
(3)操作A是___________, 操作B是___________。
(4)加入的足量试剂a是___________(填化学式)。
(5)无水MgCl 2 在熔融状态下,通电后会产生Mg和Cl 2 ,该反应的化学方程式为___________________。从考虑成本和废物循环利用的角度,副产物氯气可以用于______________________。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?_________________________________。
(7)有同学认为:可直接加热Mg(OH) 2 得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你___________(填“同意”或“不同意”)该同学的想法,理由是_________________________________。 aigu11年前1
aigu11年前1 -
 云龙王 共回答了25个问题
云龙王 共回答了25个问题 |采纳率84%1年前查看全部
- 目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:

请回答下列问题:
⑴从离子反应的角度思考,在海水中加入石灰乳的作用是 。
⑵石灰乳是生石灰与水形成的混合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
⑶操作A是 , 操作B是 。
⑷无水MgCl 2 在熔融状态下,通电后会生成Mg和Cl 2 ,该反应的化学方程式是 。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
⑸海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
。 凡尘中一叶1年前1
凡尘中一叶1年前1 -
 渴望vv的黑猫 共回答了23个问题
渴望vv的黑猫 共回答了23个问题 |采纳率87%1年前查看全部
- 目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下 请回答下列问题:
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下 
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是_______________________,写出在沉淀池的离子方程式_____________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的_________________。
(3)操作A是_______________, 操作B是__________________。
(4)加入的足量试剂a是__________________(填化学式)。
(5)无水MgCl 2 在熔融状态下,通电后会产生Mg和Cl 2 ,该反应的化学方程式为___________________。从考虑成本和废物循环利用的角度,副产物氯气可以用于_________________。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
_________________________。 风城落寞1年前1
风城落寞1年前1 -
 58250211 共回答了16个问题
58250211 共回答了16个问题 |采纳率81.3%1年前查看全部
- 目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:
目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,写出在沉淀池的离子方程式______.
(2)操作A是______,操作B是______.
(3)加入的足量试剂a是______ (填化学式).
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为MgCl2(熔融)
Mg+Cl2↑通电 .MgCl2(熔融).
Mg+Cl2↑通电 .
(5)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你______(填“同意”或“不同意”)此观点. wh11881年前1
wh11881年前1 -
 sishibuhuo 共回答了11个问题
sishibuhuo 共回答了11个问题 |采纳率90.9%解题思路:流程分析生石灰氧化钙溶于水生成氢氧化钙,加入海水中沉淀镁离子生成氢氧化镁沉淀,过滤后加入盐酸溶解得到氯化镁溶液,蒸发浓缩冷却结晶得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到氯化镁固体,熔融电解得到金属镁;
(1)根据镁离子能与氢氧根离子反应生成沉淀解答;
(2)根据过滤的原理和溶液中得到溶质晶体六水合氯化镁晶体的方法解答;
(3)根据反应流程图前后推解,试剂a是弱碱氢氧化镁沉淀,富集镁离子的反应;
(4)根据电解的原理电解熔融氯化镁生成镁和氯气;
(5)根据氧化镁和氯化镁的熔点不同,氧化镁熔点高不易熔融解答;(1)镁离子能与氢氧根离子反应生成氢氧化镁沉淀:Mg2++2OH-=Mg(OH)2↓,写离子方程式时氢氧化镁沉淀写化学式,
故答案为:Mg2++2OH-═Mg(OH)2↓;
(2)分离不溶于水的固体和液体,可用过滤的方法,从沉淀池中得到氢氧化镁用过滤的方法,从氯化镁溶液中得到六水合氯化镁,防结晶水损失,通过加热浓缩或蒸发结晶的方法获得六水合氯化镁,
故答案为:过滤; 加热浓缩(或蒸发结晶);
(3)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,加入的足量试剂a是盐酸H;
故答案为:盐酸;
(4)无水MgCl2在熔融状态下,通电后阳极氯离子失去电子生成氯气,阴极镁离子得到电子生成镁单质,所以氯化镁电解会产生Mg和Cl2;
故答案为:MgCl2(熔融)
通电
.
Mg+Cl2↑;
(5)MgO熔点为3105℃,MgCl2熔点714℃,熔融MgO时耗费大量的能量,而增加生产成本,
故答案为:不同意;点评:
本题考点: 海水资源及其综合利用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度中等.1年前查看全部
- 下列化学变化过程中,说法不正确的是 A.苯和液溴在铁屑作催化剂条件下能够反应,反应类型为取代反应 B.海水提镁的主要步骤
下列化学变化过程中,说法不正确的是
A.苯和液溴在铁屑作催化剂条件下能够反应,反应类型为取代反应 B.海水提镁的主要步骤为 
C.对于反应2H 2 O 2 =2H 2 O+O 2 ↑,加入MnO 2 或升高温度都能加快O 2 的生成速率 D.乙酸乙酯的水解 
 leeoeeo1年前1
leeoeeo1年前1 -
 高一的北极熊 共回答了18个问题
高一的北极熊 共回答了18个问题 |采纳率94.4%1年前查看全部
- (6分)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
(6分)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,写出在沉淀池的离子方程式 。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
(3)操作A是 ,操作B是 。
(4)加入的足量试剂a是 (填化学式)。 山居小小1年前1
山居小小1年前1 -
 孑然123 共回答了20个问题
孑然123 共回答了20个问题 |采纳率85%(1)使镁离子以氢氧化镁沉淀,Mg 2+ +Ca(OH) 2 =Mg(OH) 2 +Ca 2+ 。
(2)贝壳类(3)过滤,结晶(4)HCl(每空1分)
(1)石灰乳中含有OH - 能和镁离子结合生成氢氧化镁沉淀,方程式为
Mg 2+ +Ca(OH) 2 =Mg(OH) 2 +Ca 2+ 。
(2)海洋中的贝壳类的主要成分是碳酸钙,可用制取生石灰。
(3)氢氧化镁难溶于水,过滤即可。氯化镁易溶于水,要得到氯化镁晶体,需要结晶。
(4)氢氧化镁转化为氯化镁需要盐酸。1年前查看全部
- 目前世界上60%的镁是从海水中提取的。学生就这个课题展开了讨论的。已知海水提镁的主要步骤如下 学生就这个课题提出了以下问
目前世界上60%的镁是从海水中提取的。学生就这个课题展开了讨论的。已知海水提镁的主要步骤如下 
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?有三个学生提出自己的观点。
学生1的观点:直接往海水中加入沉淀剂。
学生2的观点:高温加热蒸发海水后,再加入沉淀剂。
学生3的观点:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否正确(填是或否),并简述理由。
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是_______________(填化学式)。
(2)加入的足量试剂②是_____________(填化学式)。
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是_________________。
A.
B.
C.
D.
 ywsy22111年前1
ywsy22111年前1 -
 没有白天黑夜 共回答了16个问题
没有白天黑夜 共回答了16个问题 |采纳率81.3%1年前查看全部
- 下列说法错误的是( )A.制取肥皂时,常常加入少量乙醇,目的是加快皂化反应B.海水提镁的主要步骤为:C.工业上将二氧化
下列说法错误的是( )
A.制取肥皂时,常常加入少量乙醇,目的是加快皂化反应
B.海水提镁的主要步骤为: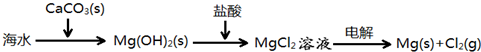
C.工业上将二氧化碳和氨气通入食盐水中制的碳酸氢钠,再煅烧碳酸氢钠使其转化为碳酸钠
D.用蒸馏法便可分离苯和溴苯 Johny_R1年前1
Johny_R1年前1 -
 被遗弃的我 共回答了16个问题
被遗弃的我 共回答了16个问题 |采纳率93.8%解题思路:A.用乙醇溶解NaOH和油脂,使其充分接触;
B.碳酸钙与镁离子不反应;
C.将二氧化碳和氨气通入饱和食盐水中,控制一定温度,制得碳酸氢钠,再煅烧碳酸氢钠使其转化为碳酸钠;
D.苯和溴苯的沸点不同.A.用乙醇溶解NaOH和油脂,使其充分接触,使皂化反应更快,更充分,故A正确;
B.应加入氢氧化钙,Ca(OH)我加入海水溶液中,得到氢氧化镁沉淀,故B错误;
C.工业上制取碳酸钠m方法是:将二氧化碳和氨气通入饱和食盐水中,控制一定温度,制得碳酸氢钠,再煅烧碳酸氢钠使其转化为碳酸钠,故C正确;
D.苯和溴苯m沸点不同,可用蒸馏分离,故D正确.
故选B.点评:
本题考点: 油脂的性质、组成与结构;纯碱工业(侯氏制碱法);海水资源及其综合利用;蒸馏与分馏.
考点点评: 本题考查物质的制取以及分离、提纯,侧重于学生的分析能力、实验能力和评价能力的考查,难度不大,注意把握物质的性质的异同,注意除杂时不能引入新的杂质.1年前查看全部
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国
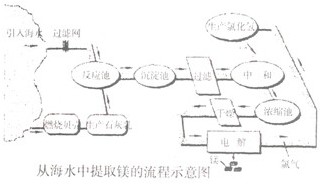 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程如图:
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程如图:
其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳;
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀;
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液.再经蒸发结晶得到MgCl2•6H2O;
Ⅳ.将MgCl2•6H2O在一定条件下加热得到无水MgCl2;
Ⅴ.电解熔融的无水MgCl2可得到Mg.
(1)请根据上述步骤回答问题:
①写出步骤Ⅰ、Ⅲ的有关化学方程式______、______.
Ⅰ.贝壳煅烧成生石灰CaCO3
CaO+CO2↑、高温 .CaCO3;
CaO+CO2↑、高温 .
Ⅲ.Mg(OH)2沉淀中加入盐酸中______;
(2)步骤Ⅰ-Ⅴ中有化合反应的是(填写步骤序号 ):______
(3)步骤Ⅲ中的蒸发式利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有______、______、蒸发皿、带铁圈的铁架台、坩埚钳等.
(4)海水中本身就含有氯化镁、则步骤Ⅱ、Ⅲ的作用是______.
(5)上述流程中,采取了那些措施来降低成本、减少污染的?请写出其中一点:______. 庆倒斑ii821年前1
庆倒斑ii821年前1 -
 开心tt 共回答了20个问题
开心tt 共回答了20个问题 |采纳率100%解题思路:(1)分析题干中的反应,判断反应物和生成物以及反应条件,写出化学方程式写出反应的化学方程式;
(2)根据反应的特点分析属于化合反应的反应;
(3)根据蒸发的操作分析用的仪器;
(4)根据产物的性质分析回答.(1)请根据上述步骤回答问题:
Ⅰ.贝壳煅烧成生石灰发生的反应是:CaCO3
高温
.
CaO+CO2↑;
Ⅲ.Mg(OH)2沉淀中加入盐酸中生成了氯化镁和水,发生的化学方程式是:Mg(OH)2+2HCl=MgCl2+2H2O;
(2)步骤Ⅰ-Ⅴ中,氧化钙与水的化合生成了氢氧化钙,属于化合反应;
(3)在实验室中进行蒸发操作需要的主要仪器有酒精灯、玻璃棒、蒸发皿、带铁圈的铁架台、坩埚钳等.
(4)海水中本身就含有氯化镁,由提取镁的过程可知,步骤Ⅱ、Ⅲ的作用是富集氯化镁并除去杂质.
(5)上述流程中,电解氯化镁生成了氯气,氯气可用于制取盐酸等.
故答为:(1)CaCO3
高温
.
CaO+CO2↑,Mg(OH)2+2HCl=MgCl2+2H2O;(2)Ⅰ(3)酒精灯、玻璃棒;(4)富集氯化镁并除去杂质;(5)电解生成的氯气用于制取盐酸等.点评:
本题考点: 对海洋资源的合理开发与利用;蒸发与蒸馏操作;酸的化学性质;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是对海水中物质的提纯应用的考查,主要是利用了酸碱盐之间的相关反应,解决了物质的相关转化,是复分解反应发生条件的具体应用.1年前查看全部
- 海水提镁,海水提溴,海水提碘的工艺流程和相关化学方程式
 尼罗河之梦1年前1
尼罗河之梦1年前1 -
 wyybaby 共回答了14个问题
wyybaby 共回答了14个问题 |采纳率85.7%海水提镁,基本的工艺技术是:先把石灰乳注入到盛有海水容器中,使海水中的氯化镁变为氢氧化镁沉淀,从海水中滤出的氢氧化镁再加盐酸,使之生成氯化镁,并将其溶液煮沸、浓缩、烘干成无水氯化镁,经过电解氯化镁,便得到金属镁和氧气.
在海水中,溴总是以溴化镁和溴化钠的形式存在.提取溴的方法常用空气吹出法,即用硫酸将海水酸化,通入氯气氧化,使溴呈气体状态,然后通入空气或水蒸气,将溴吹出来
1.3CO32- +3Br2=5Br- +BrO3- +3CO2↑
2.BrO3- +5Br- +6H+ =3Br2+3H2O
粉碎的海带(含I-)→水浸泡,通入Cl2→溶于水的I2→过滤→碘水(把滤渣分离)→萃取、提纯→I21年前查看全部
- 海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
 卡卡公主1年前2
卡卡公主1年前2 -
 coopcl 共回答了19个问题
coopcl 共回答了19个问题 |采纳率84.2%氢氧化镁沉淀分离后便于提取.氢氧化镁不稳定,受热后分解成氧化镁和水(Mg(OH)2----MgO+H2O)1年前查看全部
- 海水提镁 卤水化学讲卤水是晒盐后产生的水,但晒盐后水都蒸发掉了哪还有水?假设是水还未蒸发完时剩的水,为什么氯化镁较多?为
海水提镁 卤水
化学讲卤水是晒盐后产生的水,但晒盐后水都蒸发掉了哪还有水?假设是水还未蒸发完时剩的水,为什么氯化镁较多?
为什么氯化钠就结晶出来了而氯化镁没有? litiren1年前3
litiren1年前3 -
 糊糊2005 共回答了19个问题
糊糊2005 共回答了19个问题 |采纳率94.7%晒盐的过程:蒸发,使稀溶液转变为浓溶液直至为氯化钠的饱和溶液;再继续蒸发,就会有氯化钠晶体析出,当有大量晶体析出时,即可将底部析出的晶体从溶液中捞出来,就得到粗盐,剩余的少量液体就会人们说的卤水.
蒸发时,不能将水全部蒸干,那样就会使粗盐中含有更多的杂质如:氯化镁、氯化钙等.
在蒸发的过程中,同时对氯化镁也是一个浓缩的过程.
因为氯化镁在水中的溶解度很大,0℃时100克水能溶解59.5克氯化镁,20℃时能溶74g;而且氯化镁在海水的含量比氯化钠少,溶解度比氯化钠的大,但它也会有析出,只不过量很少,粗盐中也含有氯化镁这样的杂质.1年前查看全部
- 海水提镁的化学原理的化学式谁能告诉我海水提镁的化学式,
 蓝黑乐乐1年前1
蓝黑乐乐1年前1 -
 扬云帆 共回答了19个问题
扬云帆 共回答了19个问题 |采纳率94.7%方程式吧?
煅烧贝壳等:CaCO3=CaO+CO2↑(高温)
然后沉淀镁:Mg2+`+CaO+H2O=Ca2+`+Mg(OH)2↓
溶解Mg:Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2=Mg+Cl2↑(通电)
上面的氯气用于生产HCl,Cl元素循环利用.1年前查看全部
- 工业制造硫酸、合成氨、高炉炼铁、海水提镁的化学方程式
 蓝天空wxx1年前1
蓝天空wxx1年前1 -
 无心无知 共回答了19个问题
无心无知 共回答了19个问题 |采纳率84.2%制硫酸:
2SO2+O2==2SO3 (可逆反应,条件:高温高压、催化剂)
SO3+H2O==H2SO4(实际操作时用98%的浓硫酸吸收SO3 )
合成氨:
N2+3H2==2NH3(可逆反应,条件:高温高压、催化剂)
高炉炼铁:(原料是焦炭和铁矿石)
C+O2==CO2 (条件:高温或点燃)
CO2+C==2CO (条件:高温)
3CO+Fe2O3==2Fe+3CO2(CO是主要的还原剂,条件:高温)
海水提镁:
MgSO4+2NaOH==Na2SO4+Mg(OH)2(富集,也有MgCl2反应)
Mg(OH)2==MgO+H2O(条件:加热)
2MgO==2Mg+O2(条件:电解)(也可以将MgO与HCl反应制成更纯净的MgCl2再电解)1年前查看全部
- 海水提镁中没有涉及到的反应类型
 suandaodi1年前2
suandaodi1年前2 -
 君临天下CZX 共回答了20个问题
君临天下CZX 共回答了20个问题 |采纳率95%置换1年前查看全部
- 目前世界上60%的镁是从海水中提取的.海水提镁的主要流程如下: (1)向海水中加入石灰乳的作用是
目前世界上60%的镁是从海水中提取的.海水提镁的主要流程如下: (1)向海水中加入石灰乳的作用是目前世界上60%的镁是从海水中提取的.海水提镁的主要流程如下:
(1)向海水中加入石灰乳的作用是 .
(2)从充分利用海洋化学资源、提高经济效益的角度,生产生石灰的主要原料来源于海洋中的贝壳,生石灰和水反应的化学方程式是 .
(3)操作A是 ,加入的足量试剂a是 (填化学式).
(4)已知MgCl 2 的溶解度随温度的升高而增大.下列各图是某MgCl 2 饱和溶液的浓度随温度升高而变化的图象(不考虑溶剂的质量变化),其中正确的是
(5)海水提镁的过程中,将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁的原因是: .
(6)试剂a具有刺激性气味,我们刚进实验室就能闻到这种气味,说明分子的性质是: .
 eijn31年前1
eijn31年前1 -
 timfu 共回答了22个问题
timfu 共回答了22个问题 |采纳率81.8%(1)使Mg 2+ 形成Mg(OH) 2 沉淀.
(2)CaO+H 2 O═Ca(OH) 2 .
(3)过滤;HCl.
(4)C
(5)海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低.
(6)分子在永不停息地做无规律运动.
试题分析:(1)镁离子能与氢氧根离子反应生成氢氧化镁沉淀:Mg 2+ +2OH ﹣ =Mg(OH) 2 ↓,
(2)生石灰和水反应生成熟石灰,反应方程式是CaO+H 2 O═Ca(OH) 2 .
(3)分离不溶于水的固体和液体,可用过滤的方法,从沉淀池中得到氢氧化镁用过滤的方法;
从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH) 2 +2HCl=MgCl 2 +2H 2 O,加入的足量试剂a是HCl,
(4)将MgCl 2 饱和溶液加热后,虽然溶液由饱和变为不饱和,但溶质的质量与溶剂并未改变,所以溶质质量分数(即浓度)随着温度的升高并未改变.
(5)将海水中的氯化镁含量大,由于未富集,镁离子浓度很低,直接加热浓缩提取须消耗大量的电能,成本高,且提取的氯化镁盐中混有大量的其它氯化钠盐等离子,所以须将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁,
(6)试剂a具有刺激性气味,我们刚进实验室就能闻到这种气味,是因为分子在永不停息地做无规律运动.1年前查看全部
- 海水提镁要用到海滩上的贝壳.那么,贝壳在生产流程中起什么作用
 孤山秋意1年前1
孤山秋意1年前1 -
 欢欢的好aa 共回答了20个问题
欢欢的好aa 共回答了20个问题 |采纳率85%用作氢氧化钙或氢氧化钠的原材料.
贝壳的主要成分是碳酸钙.煅烧可得氧化钙,即生石灰.生石灰加水可制得氢氧化钙,即熟石灰.
氢氧化钙微溶于水,与海水中的氯化镁反应生成氢氧化镁沉淀,即最终产物.
也可以煅烧海滩上常见的藻类植物制取碳酸钠,然后与氢氧化钙反应生成碳酸钙和氢氧化钠,后者溶解度很大,用于与海水反应效果比氢氧化钙要好.1年前查看全部
- 目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池中发生反应的离子方程式:_________________________________________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl 2 在熔融状态下,通电后会产生Mg和Cl 2 ,该反应的化学方程式为________,从考虑成本和废物循环利用的角度,副产物氯气可以用于________。 bbcqcn1年前1
bbcqcn1年前1 -
 99457926 共回答了21个问题
99457926 共回答了21个问题 |采纳率85.7%(1)沉淀Mg 2 + [或使Mg 2 + 形成Mg(OH) 2 沉淀]
Mg 2 + +2OH - =Mg(OH) 2 ↓
(2)贝壳(或牡蛎壳等)
(3)过滤 加热浓缩(或蒸发结晶) (4)HCl
(5)MgCl 2 (熔融) Mg+Cl 2 ↑ 制盐酸,循环使用
Mg+Cl 2 ↑ 制盐酸,循环使用
(1)石灰乳中的Ca(OH) 2 与海水中的镁盐发生复分解反应生成Mg(OH) 2 沉淀。
(2)海滩上贝壳的主要成分是CaCO 3 ,可用于制取生石灰。
(3)从沉淀池中得到Mg(OH) 2 固体,应利用过滤操作,加热浓缩MgCl 2 溶液,可使其结晶出MgCl 2 晶体。
(4)溶解Mg(OH) 2 应用足量盐酸。
(5)MgCl 2 (熔融) Mg+Cl 2 ↑,Cl 2 可用于生产盐酸,循环利用。
1年前查看全部
Mg+Cl 2 ↑,Cl 2 可用于生产盐酸,循环利用。
1年前查看全部
大家在问
- 1一个一千克物体从三米高的地方落下
- 2已知函数f(x)=ax3次方+bx+c在x=2处取得极值为c-16.(1)求a,b的值;(2)若f(x)有极大...
- 3河南一次质量检测数学12题 求详解
- 4已知光的速度是不变的,无论在什么速度的车上,光也只是光速,没有增加或减少.但是如果一个人在火车里照
- 5某商场上月的营业额为5万元,本月比上月增长15%,那么本月的营业额为( )
- 63.6牛顿运动定律的应用:质量为2kg的物体……
- 7初一的科学,蜗牛的问题.火速紧急
- 8neither nor 的用法位置
- 9风驰边江听丝纶是什么意思?
- 10甲、乙两个工程队的人数比例是7:3,如果从甲队派30人到乙队,两队人数比例是3:2.两个工程队各有多少人
- 11宗.旦.尤加偏旁变新字并组词
- 12请以“不肯大团圆”作为话题,仿照下面的例句,再写两个句子。(6分)
- 13一步之遥全剧情解析一步之遥演的什么意思
- 14一个长方体高增加2厘米,就变成正方体,这时表面积增加了56平方厘米.长方体的体积是多少?
- 15iphone上哪个英文词典可以查可数和不可数名词?









