2KMnO4+10FeSO4+8H2SO4=K2SO4+5Fe2(SO4)3+2MnSO4+8H2O氧化剂与还原剂的比
 深爱深似海2022-10-04 11:39:542条回答
深爱深似海2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 载有关洋 共回答了23个问题
载有关洋 共回答了23个问题 |采纳率87%- 改成离子反应式:2MnO4 2-+10Fe2+ +16H+=10Fe3++2Mn2++8H2O
氧化剂:高锰酸根:2
还原剂:亚铁离子:10
∴氧化剂:还原剂=1:5 - 1年前
 依莲娜 共回答了2个问题
依莲娜 共回答了2个问题 |采纳率- 1:5
- 1年前
相关推荐
- 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(
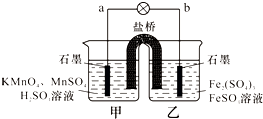 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.外电路的电流方向是从a到b 甜唯1年前1
甜唯1年前1 -
 motta332 共回答了13个问题
motta332 共回答了13个问题 |采纳率100%解题思路:由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,
A.b为负极,则乙烧杯中发生氧化反应,故A错误;
B.甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,则pH逐渐增大,故B错误;
C.阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,故C错误;
D.由上述分析可知,a为正极,电流由正极流向负极,即从a流向b,故D正确.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池的工作原理及常见的化学电源,明确氧化还原反应中元素的化合价变化及原电池工作原理是解答本题的关键,题目难度不大.1年前查看全部
- (2014•温州二模)利用下列反应可设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO
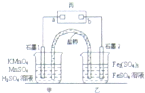 (2014•温州二模)利用下列反应可设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和K2SO4溶液,丙是浸有KI淀粉溶液的滤纸,a、b是Pt电极.下列叙述中不正确的是( )
(2014•温州二模)利用下列反应可设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和K2SO4溶液,丙是浸有KI淀粉溶液的滤纸,a、b是Pt电极.下列叙述中不正确的是( )
A.电池工作时.盐桥中的SO42-移向甲烧杯
B.电池工作时,电子由石墨1电极经外电路移向石墨2电极
C.甲烧杯中电极反应式为MnO4-+5e++8H+═Mn2++4H2O
D.滤纸丙的a电极附近出现蓝色现象 为了吃饭的nn1年前1
为了吃饭的nn1年前1 -
 eook00 共回答了13个问题
eook00 共回答了13个问题 |采纳率76.9%解题思路:根据电池反应式知,石墨2是负极、石墨1是正极,
A.放电时,盐桥中硫酸根离子移向负极所在电解质溶液;
B.放电时,电子从负极沿导线流向正极;
C.甲烧杯中高锰酸根离子得电子发生还原反应;
D.a为阳极、b为阴极,滤纸a电极上碘离子放电、b电极上氢离子放电.根据电池反应式知,石墨2是负极、石墨1是正极,
A.放电时,盐桥中硫酸根离子移向负极所在电解质溶液,所以盐桥中的SO42-移向甲烧杯,故A正确;
B.放电时,电子从负极石墨2沿导线流向正极石墨1,故B错误;
C.甲烧杯中高锰酸根离子得电子发生还原反应,电极反应式为MnO4-+5e++8H+═Mn2++4H2O,故C正确;
D.a为阳极、b为阴极,滤纸a电极上碘离子放电生成碘单质,碘遇淀粉试液变蓝色,所以滤纸丙的a电极附近出现蓝色现象,故D正确;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,根据电池反应式元素化合价变化确定正负极,再结合电解池中离子放电顺序分析解答,难点是电极反应式书写.1年前查看全部
- 某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H
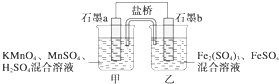 某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.回答下列问题:
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.回答下列问题:
(1)此原电池的正极是石墨______(填“a”或“b”),发生______反应.
(2)电池工作时,盐桥中的SO42-移向______(填“甲”或“乙”)烧杯.
(3)两烧杯中的电极反应式分别为
甲______,
乙______.
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5mol•L-1,则反应中转移的电子为______mol. dhallan1年前1
dhallan1年前1 -
 danmawang 共回答了19个问题
danmawang 共回答了19个问题 |采纳率84.2%解题思路:(1)反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,KMnO4作氧化剂,发生还原反应;
(2)电池工作时,阴离子向负极移动;
(3)甲烧杯中的电极发生还原反应;乙烧杯中的电极发生氧化反应;
(4)溶液中的MnSO4浓度由1mol•L-1变为1.5mol•L-1,计算物质的量,结合化合价的变化可计算转移电子的物质的量.(1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极,故答案为:a;还原;
(2)电池工作时,SO42-向负极移动,即向乙烧杯移动,故答案为:乙;
(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+═Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-═5Fe3+,
故答案为:MnO4-+5e-+8H+═Mn2++4H2O;5Fe2+-5e-═5Fe3+;
(4)溶液中的MnSO4浓度由1mol•L-1变为1.5mol•L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5mol•L-1×0.2L=0.1mol,转移的电子为0.1mol×5=0.5mol.
故答案为:0.5.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查原电池知识,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握原电池的工作原理,答题时注意体会电极方程式的书写方法,难度不大.1年前查看全部
大家在问
- 1二冲程和四冲程发动机的问题普遍都说二冲程发动机比四冲程发动机体积小重量轻功率大,不过我是这样理解的,在相同容积和相同转速
- 2阅读下面的一段文字,请说说“生成目标”的基本特征。
- 310除以6的商用循环小数表示是什么
- 4如图,正方形ABCD边长为4,点P在边AD上,且PE⊥AC,PF⊥BD,垂足分别为E、F,则PE+PF的值为______
- 5用be动词的适当形式填空:sam's and amy's room___over there.The little do
- 6匀速圆周运动的物体,所受向心力大小必定与什么成正比?
- 7W D N E 在地理上对应东西南北一个一个对上去哪个对哪个
- 8帮我看看三年级下册课文中的这段一共有几句话?妈妈还带我访问了其他一些网站,里面的内容太丰富了:有
- 9下图为《“三角贸易”示意图》。(注:①北美洲②拉美③欧洲④非洲)图中数字代表“三角贸易”经的四个洲。奴隶贩子的贸易路线一
- 10宇航员在某星球表面,将一小球从离地面h高处以初速度v 0 水平抛出,测出小球落地点与抛出点间的水平位移s.
- 11张华看一本书,第一天看了18页,第二天看了全书的1/8,还余45页没看,第二天看了多少页?
- 1227厘米等于多少尺
- 13找规律探究题,第一排有50个座位,第2排有53个座位,第3排有56个座位,第4排有59个座位.求第n排有多少个座位?说明
- 14已知,如图,在正方形abcd中,ac,bd相交于点o.ae平分∠bac交bd于e
- 15cow snow发音一样吗
