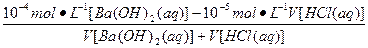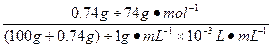25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
 三楼xx2022-10-04 11:39:545条回答
三楼xx2022-10-04 11:39:545条回答
25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH+4)< c(SO2-4) B.c(NH+4)=2c(SO2-4)
C.c(H+)>c(oH) D.c(OH-)+c(SO2-4)= c(H+)=c(NH+4)
-----------------
还有其他的正确关系应该是什么为什么
A.c(NH+4)< c(SO2-4) B.c(NH+4)=2c(SO2-4)
C.c(H+)>c(oH) D.c(OH-)+c(SO2-4)= c(H+)=c(NH+4)
-----------------
还有其他的正确关系应该是什么为什么

已提交,审核后显示!提交回复
共5条回复
 冬风雪花花 共回答了16个问题
冬风雪花花 共回答了16个问题 |采纳率93.8%- 答案选B,因为ph=7所以氢离子浓度等于氢氧根浓度,可以排除C.D,然后根据溶液的电荷守恒,即C(H+)+C(NH4+)=C(0Hˉ)+2C(S042-)所以A排除
- 1年前
 嘿灯吓火 共回答了19个问题
嘿灯吓火 共回答了19个问题 |采纳率- B H+= OH-
pH等于7说明氢离子和氢氧根离子都是 10的-7次方,所以相等
根据电荷平衡算出B - 1年前
 只是_为了ss 共回答了2个问题
只是_为了ss 共回答了2个问题 |采纳率- B
电荷守恒c(NH4+)+c(H+)=2c(SO4-)+c(OH-)且PH=7,所以c(H+)=c(OH-) - 1年前
 332010716 共回答了2个问题
332010716 共回答了2个问题 |采纳率- A
- 1年前
 w1988h 共回答了14个问题
w1988h 共回答了14个问题 |采纳率- B
- 1年前
相关推荐
- 25 ℃时,合成氨反应的热化学方程式为: N 2 (g)+3H 2 (g) 2NH 3 (g) △H=-92.4 kJ/
25 ℃时,合成氨反应的热化学方程式为: N 2 (g)+3H 2 (g)  2NH 3 (g) △H=-92.4 kJ/mol 在该温度时,取2mol N 2 和7 mol H 2 放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是
2NH 3 (g) △H=-92.4 kJ/mol 在该温度时,取2mol N 2 和7 mol H 2 放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是[ ]
A.92.4 kJ
B.92.4 kJ ~184.8 kJ
C.小于184.8 kJ
D.184.8 kJ 深圳oo1年前1
深圳oo1年前1 -
 ll了都要叫红尘_ 共回答了20个问题
ll了都要叫红尘_ 共回答了20个问题 |采纳率90%C1年前查看全部
- 2012·新课标全国卷)将玉米种子置于25 ℃、黑暗、水分适宜的条件下萌发,每天定时取相同数量的萌发种子,一半直接烘干称
2012·新课标全国卷)将玉米种子置于25 ℃、黑暗、水分适宜的条件下萌发,每天定时取相同数量的萌发种子,一半直接烘干称重,另一半切取胚乳烘干称重,计算每粒的平均干重,结果如图所示.若只考虑种子萌发所需的营养物质来源于胚乳,据图回答下列问题.图片在这儿http://zhidao.baidu.com/question/1817289127996776988.html 我就想问一下 萌发种子包含着胚乳 胚乳减少多少 萌发种子也肯定大于等于胚乳吧
 ab18761年前1
ab18761年前1 -
 wangenri 共回答了22个问题
wangenri 共回答了22个问题 |采纳率77.3%那个图中有两条曲线,上面的那条是种子的重量,下面的那条是胚乳的重量.
从图中也可以看出,无论是重量怎么变,种子的重量总是大于胚乳的重量.
这道题的意思就是说,每天定时测定胚乳的干重,同时每天定时测定萌发的种子的干重,通过对比种子减少量与胚乳减少量可以知道每天消耗胚乳是多少.1年前查看全部
- 25 ℃时,某NH 4 Cl溶液的pH为4,下列说法中不正确的是( ) A.溶液中c
25 ℃时,某NH 4 Cl溶液的pH为4,下列说法中不正确的是( )
A.溶液中c(H + )>c(OH - )且c(H + )·c(OH - )=1×10 -14 B.由水电离出来的c(H + )约为1×10 -14 mol·L -1 C.溶液中c(Cl - )>c( 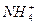 )>c(H + )>c(OH - )
)>c(H + )>c(OH - )D.此溶液中水的电离度比纯水的电离度大  恋冰蓝草1年前1
恋冰蓝草1年前1 -
 kqxwlb 共回答了23个问题
kqxwlb 共回答了23个问题 |采纳率91.3%1年前查看全部
- 25 ℃时,合成氨反应的热化学方程式为:
25 ℃时,合成氨反应的热化学方程式为:
N 2 (g) +3H 2 (g) 2NH 3 (g) Δ H =-92.4 kJ/mol
2NH 3 (g) Δ H =-92.4 kJ/mol
下列叙述正确的是A.混合气体的质量不变时,说明该反应一定达到平衡状态 B.将容器的体积扩大到原来的二倍, υ (正)减小, υ (逆)增大,平衡向左移动 C.催化剂既能提高N 2 的转化率,又能缩短达到平衡所需时间,提高生产效益 D.在密闭容器中放入1 mol N 2 和3 mol H 2 进行反应,测得反应放出的热量小于92.4 kJ  chenghuazi1年前1
chenghuazi1年前1 -
 zhanghuiru 共回答了17个问题
zhanghuiru 共回答了17个问题 |采纳率94.1%D
A.不管是反应物还是生成物,都是气体,所以说,无论是否达到平衡,混合气体的质量都不变。
B.将容器的体积扩大到原来的二倍,反应物、生成物浓度均减小,因此 υ (正)、 υ (逆)均较小,平衡向左移动
C.催化剂既不能提高N 2 的转化率,但能缩短达到平衡所需时间,提高生产效益
D.由于此反应时可逆反应,在密闭容器中放入1 mol N 2 和3 mol H 2 进行反应,测得反应放出的热量小于92.4 kJ1年前查看全部
- 在25 ℃、101 kPa下,1 g甲醇燃烧生成CO 2 和液态水时放热22.68 kJ,下列热化学方程式正确的是(
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO 2 和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH 3 OH(l)+O 2 (g)===CO 2 (g)+2H 2 O(l)ΔH=+725.8 kJ/mol B.2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(l)ΔH=-1 452 kJ/mol C.2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(l)ΔH=-725.8 kJ/mol D.2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(l)ΔH=+1 452 kJ•mol‾ 1  yforgetme1年前1
yforgetme1年前1 -
 尹红豆 共回答了15个问题
尹红豆 共回答了15个问题 |采纳率93.3%B
本题考查热化学方程式的书写。甲醇燃烧属于放热反应,因此选项A、D错误;由题意知1 g甲醇燃烧生成CO 2 和液态水时放热22.68 kJ,所以2mol甲醇燃烧放出的能量是:2×32×22.68 kJ=1451.52 kJ,所以选项B正确,而C是错误的。1年前查看全部
- 在25 ℃、101 kPa下,1 g甲醇(CH 3 OH)燃烧生成CO 2 和液态水时放热22.68 kJ,下列表示甲醇
在25 ℃、101 kPa下,1 g甲醇(CH 3 OH)燃烧生成CO 2 和液态水时放热22.68 kJ,下列表示甲醇燃烧热的热化学反应方程式是
A.CH 3 OH(l) + 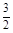 O 2 (g)=CO 2 (g)+2H 2 O(l)△H=+725.8 kJ·mol -1
O 2 (g)=CO 2 (g)+2H 2 O(l)△H=+725.8 kJ·mol -1 B.2CH 3 OH(l)+3O 2 (g)=2CO 2 (g)+4H 2 O(l)△H=-1452 kJ·mol -1 C.CH 3 OH(l) + 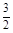 O 2 (g)=CO 2 +2H 2 O△H=-725.8 kJ·mol -1
O 2 (g)=CO 2 +2H 2 O△H=-725.8 kJ·mol -1 D.CH 3 OH(l) + 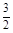 O 2 (g)=CO 2 (g)+2H 2 O(l)△H=-725.8 kJ·mol -1
O 2 (g)=CO 2 (g)+2H 2 O(l)△H=-725.8 kJ·mol -1  水中月_moon1年前1
水中月_moon1年前1 -
 大大皮皮鲁 共回答了15个问题
大大皮皮鲁 共回答了15个问题 |采纳率93.3%D
1年前查看全部
- 25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 莉儿1年前4
莉儿1年前4 -
 虾米007 共回答了4个问题
虾米007 共回答了4个问题 |采纳率75%c1年前查看全部
- 已知25 ℃时有关弱酸的电离平衡常数如下表:
已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸 CH 3 COOH HCN H 2 CO 3 电离平衡常数(25 ℃) 1.8×10 -5 4.9×10 -10 K 1 =4.3×10 -7
K 2 =5.6×10 -11
则下列有关说法正确的是( )
A.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na + )>c(CN - ),则a一定小于b
B.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C.各溶液pH关系为:pH(Na 2 CO 3 )>pH(NaCN)>pH(CH 3 COONa)
D.在0.1 mol/L CH 3 COONa溶液中,c(OH - )=c(CH 3 COOH)+c(H + ) tranble1年前1
tranble1年前1 -
 icbookII 共回答了24个问题
icbookII 共回答了24个问题 |采纳率91.7%D
A项中由c(Na + )>c(CN - ),据溶液中电荷守恒知c(H + )<c(OH - ),所以a可能等于或小于b,A项错;冰醋酸中逐滴加水,溶液的导电性先增大后减小,电离度增大,pH先减小后增大,B项错;C项中没有说明各溶液的物质的量浓度,故无法比较,C项错;由质子守恒得:c(OH - )=c(CH 3 COOH)+c(H + ),D项正确。1年前查看全部
- 用N A 表示阿伏加德罗常数的值。下列叙述正确的是( ) A.25 ℃时,pH=12的Ba(OH)
用N A 表示阿伏加德罗常数的值。下列叙述正确的是()
A.25 ℃时,pH=12的Ba(OH) 2 溶液中含有的OH - 数目为0.02N A B.室温下,14.0 g乙烯和丁烯的混合气体中含有C—H键数目为2.0N A C.1 L 0.5 mol·L -1 的(NH 4 ) 2 SO 4 溶液中含有的NH 4 + 数目为N A D.标准状况下,22.4 L CCl 4 中含有共用电子对数目为4.0N A  junqilee1年前1
junqilee1年前1 -
 kebiyun 共回答了8个问题
kebiyun 共回答了8个问题 |采纳率87.5%B
A项,未指明溶液的体积,错误;B项,乙烯和丁烯可写成(CH 2 ) n ,所以14.0 g混合气体中含有C—H键数目为2.0N A ,正确;C项,NH 4 + 水解,NH 4 + 数目应小于N A ,错误;D项,标况下,CCl 4 为液体。1年前查看全部
- 已知25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol -1 、285.8 kJ·
已知25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol -1 、285.8 kJ·mol -1 、
890.3 kJ·mol -1 、2 800 kJ·mol -1 ,则热化学方程式正确的是[ ]A.C(s)+1/2O 2 (g)====CO(g) ΔH=-393.5 kJ·mol -1
B.2H 2 (g)+O 2 (g)====2H 2 O(g) ΔH=+571.6 kJ·mol -1
C.CH 4 (g)+2O 2 (g)====2H 2 O(g)+CO 2 (g) ΔH=-890.3 kJ·mol -1
D.1/2C 6 H 12 O 6 (s)+3O 2 (g)====3CO 2 (g)+3H 2 O(l) ΔH=-1 400 kJ·mol -1 Changjiany1年前1
Changjiany1年前1 -
 孤舟寒雨 共回答了9个问题
孤舟寒雨 共回答了9个问题 |采纳率88.9%D1年前查看全部
- 在25 ℃、1.01×10 5 Pa下,反应2N 2 O 5 (g) 4NO 2 (g)+O 2 (g) ΔH="+56
在25 ℃、1.01×10 5 Pa下,反应2N 2 O 5 (g)
 4NO 2 (g)+O 2 (g) ΔH="+56.7" kJ·mol -1 能自发进行的合理解释是( )
4NO 2 (g)+O 2 (g) ΔH="+56.7" kJ·mol -1 能自发进行的合理解释是( )A.该反应是分解反应 B.该反应的熵增效应大于焓变效应 C.该反应是熵减反应 D.该反应是放热反应  yangcg02151年前1
yangcg02151年前1 -
 凭栏山水寒 共回答了21个问题
凭栏山水寒 共回答了21个问题 |采纳率85.7%B
该反应是吸热反应。不能只用焓判据来判断反应进行的方向,该反应过程中熵增大,是熵增反应。该反应能够自发进行,说明该反应的熵增效应大于焓变效应。1年前查看全部
- 25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A
25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。

t 2 ~t 3 t 4 ~t 5 t 5 ~t 6 t 7 ~t 8 K 1 K 2 K 3 K 4
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=___,从反应开始到第一次平衡时的平均速率v(A)为___。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是__________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K 1 、K 2 、K 3 、K 4 之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。 相当可以1年前1
相当可以1年前1 -
 sasd123 共回答了25个问题
sasd123 共回答了25个问题 |采纳率92%(1)A(g)+2B(g) 2C(g)(不写物质的状态也可)
2C(g)(不写物质的状态也可)
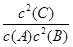 0.05 mol·L - 1 ·min - 1
0.05 mol·L - 1 ·min - 1
(2)增大压强(或缩小容器体积)
(3)K 1 >K 2 =K 3 =K 4 t 2 ~t 3
(1)由图1中曲线变化情况可知:A和B是反应物,C是生成物,再由物质的量的变化值可得化学计量数之比。(2)已知反应达平衡后,降低温度,A的转化率将增大,说明正反应是放热反应。在5~7 min内,K值不变,说明平衡移动不是由温度变化引起的,因此此处改变的条件只能是增大压强。(3)根据速率—时间图像分析,t 3 时改变的条件是升温,t 5 时改变的条件是使用催化剂,t 6 时改变的条件是减压,因此有K 1 >K 2 =K 3 =K 4 。由于t 3 、t 6 时条件的改变均导致化学平衡逆向移动,因此A的转化率最大的一段时间是t 2 ~t 3 。1年前查看全部
- 25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A
25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。

t 2 ~t 3 t 4 ~t 5 t 5 ~t 6 t 7 ~t 8 K 1 K 2 K 3 K 4
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是________________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K 1 、K 2 、K 3 、K 4 之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。 低语轻言1年前1
低语轻言1年前1 -
 重庆联不通 共回答了17个问题
重庆联不通 共回答了17个问题 |采纳率82.4%(1)A(g)+2B(g) 2C(g)(不写物质的状态也可)
2C(g)(不写物质的状态也可)  0.05 mol·L -1 ·min -1
0.05 mol·L -1 ·min -1
(2)增大压强(或缩小容器体积)
(3)K 1 >K 2 =K 3 =K 4 t 2 ~t 3
(1)由图1中曲线变化情况可知:A和B是反应物,C是生成物,再由物质的量的变化值可得化学计量数之比。(2)已知反应达平衡后,降低温度,A的转化率将增大,说明正反应是放热反应。在5~7 min内,K值不变,说明平衡移动不是由温度变化引起的,因此此处改变的条件只能是增大压强。(3)根据速率—时间图像分析,t 3 时改变的条件是升温,t 5 时改变的条件是使用催化剂,t 6 时改变的条件是减压,因此有K 1 >K 2 =K 3 =K 4 。由于t 3 、t 6 时条件的改变均导致化学平衡逆向移动,因此A的转化率最大的一段时间是t 2 ~t 3 。1年前查看全部
- 25 ℃时,某溶液中由水电离出的H + 的浓度为1×10 -a mol/L,以下说法正确的是( ) A.a>7时,水
25 ℃时,某溶液中由水电离出的H + 的浓度为1×10 -a mol/L,以下说法正确的是( )
A.a>7时,水的电离一定受到促进 B.a<7时,水的电离一定受到抑制 C.a>7时,溶液的pH为a或14-a D.a<7时,溶液的pH一定为a  妖艳的烟花雨1年前1
妖艳的烟花雨1年前1 -
 cqteas 共回答了22个问题
cqteas 共回答了22个问题 |采纳率95.5%C
常温下水的离子积是1×10 -14 ,由水电离出来的H + 的浓度为1×10 -7 mol/L,如果a>7肯定是水的电离受到了抑制,该溶液可能是酸溶液也可能是碱溶液。如果a<7,水的电离一定受到促进,是盐的水解起到了作用。A、B项正好答反,所以A、B都错。C选项,当a>7时,如果是碱溶液,则此时溶液中所有的H + 都是由水电离产生的,此时溶液的pH=a,如果是酸溶液,则此时溶液中所有的OH - 都是由水电离产生的,此时溶液的pOH=a,pH=14-a。D选项中,当a<7时,如果溶液呈酸性,溶液中的氢离子都是由水电离产生的,故有pH=a,如果溶液呈碱性,则溶液中所有的OH - 都是由水电离产生的,得到pOH=a,pH=14-a。1年前查看全部
- (9分)某温度(t ℃)时,水的离子积为 K W =1×10 -13 ,则该温度_ ___ 25 ℃(选填“>”“<”“
(9分)某温度(t ℃)时,水的离子积为 K W =1×10 -13 ,则该温度_ ___ 25 ℃(选填“>”“<”“=”),其理由是________________________________。若将此温度下pH=11的苛性钠溶液 a L与pH=1的稀硫酸 b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比。
(1)若所得混合溶液为中性,则 a ∶ b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____ 。(用 c (Na + )等表示)
(2)若所得混合液的pH=2,则a∶ b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____ 。(用 c (Na + )等表示) 倾心碎雨1年前0
倾心碎雨1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- .已知:25 ℃时,K[Mg(OH)2]=5.6110
.已知:25 ℃时,k[mg(oh)2]=5.6110
a.25 ℃时,饱和mg(oh)2溶液与饱和mgh溶液相比,前者的c(mg2+)***. 25 ℃时,在mg(oh)2的悬浊液中加入少量的nh4cl固体,c(mg2+)增大c. 25 ℃时,mg(oh)2固体在20 ml 0.01 mol·l-1氨水中的k比在20 ml 0.01 mol·l-1 nh4cl溶液中的k小d.25 ℃时,在mg(oh)2悬浊液中加入naf溶液后,mg(oh)2不可能转化为mgf2答案到底是b还是b yi06101年前0
yi06101年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:
已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:
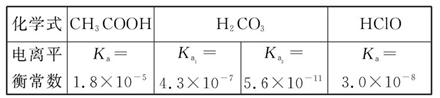
回答下列问题:
(1)物质的量浓度均为0.1 mol·L -1 的四种溶液:
a.CH 3 COONab.Na 2 CO 3 c.NaClOd.NaHCO 3
pH由小到大排列顺序是 (用编号填写)。
(2)常温下,0.1 mol/L的CH 3 COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
E.c(H + )·c(CH 3 COO - )/c(CH 3 COOH)A.c(H + ) B.c(H + )/c(CH 3 COOH) C.c(H + )·c(OH - ) D.c(OH - )/c(H + )
(3)体积均为100 mL pH=2的CH 3 COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”、“小于”或“等于”)CH 3 COOH的电离平衡常数,理由是 。
 arko1年前1
arko1年前1 -
 奇诚 共回答了14个问题
奇诚 共回答了14个问题 |采纳率100%(1)a<d<c<b
(2)B、D
(3)大于稀释相同倍数,一元酸HX的pH变化比CH 3 COOH的pH变化大,故HX酸性较强,电离平衡常数较大
(1)根据表中的电离平衡常数,可知酸性:CH 3 COOH>H 2 CO 3 >HClO>HCO 3 -
因此对应钠盐溶液的碱性:
CH 3 COONa<NaHCO 3 <NaClO<Na 2 CO 3 。
(2)CH 3 COOH加水稀释,电离程度增大,n(H + )增大,但c(H + )减小,A错;由于温度不变,电离平衡常数不变,水的离子积不变,C错、E错;c(H + )/c(CH 3 COOH)= K a /c(CH 3 COO - ),因此c(H + )/c(CH 3 COOH)增大,B对;c(H + )减小,而水的离子积不变,则c(OH - )增大,因此c(OH - )/c(H + )增大,D对。1年前查看全部
- 如图2-25所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中
如图2-25所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。

图2-25
试完成下列问题:
(提示:氢氧化钙的溶解度随温度升高而降低)
(1)实验中观察到的现象是_______________________________________________________。
(2)产生上述现象的原因是_______________________________________________________。
(3)写出有关反应的离子方程式:________________________________________________。
(4)由实验推知,MgCl 2 溶液和H 2 的总能量______________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。 linweitao19801年前1
linweitao19801年前1 -
 你我mm人 共回答了19个问题
你我mm人 共回答了19个问题 |采纳率94.7%(1)试管中有气泡产生、饱和石灰水中有白色固体析出(2)镁片溶于稀盐酸放出氢气,且此反应为放热反应,而温度升高,Ca(OH) 2 的溶解度变小(3)Mg+2H + ====Mg 2+ +H 2 ↑(4)小于 镁和盐酸的反应产生氢气...1年前查看全部
- (14分)(1)25 ℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与
(14分)
(1)25 ℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为
已知25 ℃时,0.1 L 0.1 mol·L -1 的NaA溶液的pH=10,溶液中各离子的物质的量浓度由大到小的顺序为 。
(2))若100 ℃时,K W =10 -12 ,则100 ℃时pH=11的Ba(OH) 2 溶液与pH=2的硫酸按体积比1:9混合充分反应后pH= ;若该温度下10体积的pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系为 。
。
(3)某温度下的水溶液中,c(H + )=10 x mol/L,c(OH - )=10 y mol/L。x与y的关系如图所示。
该温度下水的离子积为 。该温度下氯化钠溶液的pH为
该温度下0.01 mol/L NaOH溶液的pH为 。 miaowhui1年前1
miaowhui1年前1 -
 AlohaSnail 共回答了14个问题
AlohaSnail 共回答了14个问题 |采纳率85.7%1年前查看全部
- (10分)25 ℃时,硫氢化钾溶液里存在下列平衡:
(10分)25 ℃时,硫氢化钾溶液里存在下列平衡:
(a)HS - +H 2 O
 OH - +H 2 S
OH - +H 2 S
(b)HS - 
 H + +S 2 -
H + +S 2 -
(1)________是电离平衡;________是水解平衡。
(2)当向其中加入硫酸铜溶液时,生成了CuS沉淀,则电离平衡向________移动;水解平衡向________移动;c(H + )变________(填“大”或“小”)。
(3)当向其中加入氢氧化钠固体时,c(S 2 - )变________(填“大”或“小”)。
(4)若将溶液加热至沸腾,c(OH - )·c(H + )将变________(填“大”或“小”)。 fanny为了发贴1年前1
fanny为了发贴1年前1 -
 mobileislaji 共回答了19个问题
mobileislaji 共回答了19个问题 |采纳率78.9%1年前查看全部
- 水的电离平衡曲线如图所示: (1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度升高到100 ℃时,水的电离平衡
水的电离平衡曲线如图所示:
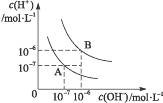
(1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从____________________增加到_____________________。
(2)将pH=8的Ba(OH) 2 溶液与pH=5的稀盐酸混合,并保持100 ℃的恒温,致使混合液的pH=7,则Ba(OH) 2 与盐酸的体积之比为________________________________。
(3)已知A n B m 的离子积=[C(A m+ )] n ·[C(B n- )] m ,式中的C(A m+ )、C(B n- )表示离子的物质的量浓度。若某温度下CA(OH) 2 溶解度为0.74 g,其饱和溶液密度设为1 g·mL -1 ,其离子积约为_____________________________________________。 findboy1年前1
findboy1年前1 -
 戴个帽子 共回答了18个问题
戴个帽子 共回答了18个问题 |采纳率94.4%1年前查看全部
- 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 k
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是

A.2H + (aq) + 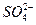 (aq)+
(aq)+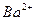 (aq)+2OH
(aq)+2OH (aq)=BaSO 4 (s)+2H
(aq)=BaSO 4 (s)+2H  O(1) ;
O(1) ;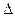 H=
H=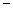 57.3 kJ/mol
57.3 kJ/mol
B.KOH(aq)+ 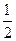 H
H  SO 4 (aq)=
SO 4 (aq)= 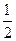 K
K  SO 4 (aq)+H
SO 4 (aq)+H  O(I);
O(I); 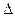 H=
H=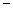 57.3kJ/mol
57.3kJ/mol
C.C 8 H 18 (I)+ 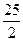 O
O  (g)=8CO
(g)=8CO  (g)+ 9H
(g)+ 9H  O;
O; 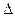 H=
H=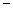 5518 kJ/mol
5518 kJ/mol
D.2C 8 H 18 (g)+25O  (g)=16CO
(g)=16CO  (g)+18H
(g)+18H  O(1);
O(1); 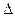 H=
H=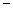 5518 kJ/mol
5518 kJ/mol


 靳林云1年前1
靳林云1年前1 -
 刘震荡 共回答了15个问题
刘震荡 共回答了15个问题 |采纳率100%B
A项不符合中和热的定义;C项中生成物水为气态,D项中辛烷的物质的量不是1mol,所以ACD错误。1年前查看全部
- 在25 ℃的纯水中通入一定量的氯化氢,当溶液的pH=1时,则由水电离出的C(H + )是(
在25 ℃的纯水中通入一定量的氯化氢,当溶液的pH=1时,则由水电离出的C(H + )是()
A.1×10 -1 mol·L -1 B.1×10 -6 mol·L -1 C.1×10 -8 mol·L -1 D.1×10 -13 mol·L -1  fxyy71071年前0
fxyy71071年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知水在25℃和95℃时,其电离平衡曲线如右图所示:①则25 ℃时水的电离平衡曲线应为 ;(填“A”或“B”)
已知水在25℃和95℃时,其电离平衡曲线如右图所示:①则25 ℃时水的电离平衡曲线应为 ;(填“A”或“B”)
请说明理由 .
②95℃时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是 .
(2)某温度(t℃)时,测得0.01 mol·L-1 的NaOH溶液的pH=13,请回答下列问题:
① 该温度下水的Kw= .
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va : Vb= .

 sun3041年前2
sun3041年前2 -
 哦我爱你 共回答了16个问题
哦我爱你 共回答了16个问题 |采纳率100%①A.因为在25℃,水的Ph=7,即氢离子浓度为10^-7.
②ph+poh=12
(2)因为ph=氢离子的负对数,且等于解离常数的负对数减去poh.测得0.01 mol·L-1 的NaOH溶液的pH=13,则poh=2
那么-logkw=ph+poh=13+2=15,所以kw=10^-15.
②pH=a的NaOH溶液浓度为c=10^-(15-12)=10^-3
pH=b的H2SO4溶液浓度为c=10^-2
根据题意有,10^-3xVa=2x10^-2xVb
解得Va:Vb=20:11年前查看全部
- 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 k
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是()
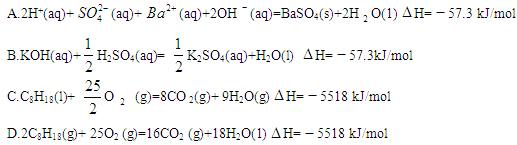
 swt124371年前1
swt124371年前1 -
 东方晨雾 共回答了12个问题
东方晨雾 共回答了12个问题 |采纳率100%B
A 错 中和热是生成1mol水时放出的热量,此反应生成了2mol水
C、D 错燃烧热指的是1mol可燃物完全燃烧,生成稳定的氧化物时放出的热量,C 中生成的不是液态水,D 中可燃物不是1mol。1年前查看全部
- 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断正确的是 我就问一下,:分别加入NaO
25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断正确的是 我就问一下,:分别加入NaOH固体,恢复到原温度,c(CO32-)前者增大后者减小是错的,应该是均增大.是不是因为加入了氢氧化钠 碳酸氢钠中钠离子增加,又为了达到平衡,化学平衡方向正移?所以c(CO32-)增大?碳酸钠同理?
 pearl71年前1
pearl71年前1 -
 giatngod 共回答了19个问题
giatngod 共回答了19个问题 |采纳率84.2%对于NaHCO3
CO32- + H2O(可逆符号)HCO3- + OH-
HCO3- + H2O(可逆符号)CO2 + OH-
加入的氢氧化钠电离出氢氧根离子抑制HCO3-水解并使它向CO32-转化所以浓度增大
对于Na2CO3
是因为加入的氢氧化钠电离出氢氧根离子抑制了碳酸根离子的水解,所以碳酸根浓度与原来相比增大1年前查看全部
- 在25 ℃、101 kPa下,1 g甲醇(CH 3 OH)燃烧生成CO 2 和液态水时放热22.68 kJ。下列热化学方
在25 ℃、101 kPa下,1 g甲醇(CH 3 OH)燃烧生成CO 2 和液态水时放热22.68 kJ。下列热化学方程式正确的是( )
A.CH 3 OH(l)+3/2O 2 (g)===CO 2 (g)+2H 2 O(l)Δ H =+725.8 kJ·mol -1 B.2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(l)Δ H =-1452 kJ·mol -1 C.2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(l)Δ H =-725.8 kJ·mol -1 D.2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(l)Δ H =+1452 kJ·mol -1  hujia07281年前1
hujia07281年前1 -
 kk九五二七 共回答了17个问题
kk九五二七 共回答了17个问题 |采纳率100%B
考查热化学方程式的书写以及反应热的计算。甲醇燃烧是放热反应,△H小于0,A。D不正确。2mol甲醇放出的热量是2×32×22.68 kJ=1452 kJ,所以答案是B。1年前查看全部
- 水的电离平衡曲线如图所示: 若以A点表示25 ℃时水电离平衡时的离子的浓度,当温度升高到100 ℃时,水的电离平衡状态到
水的电离平衡曲线如图所示:

若以A点表示25 ℃时水电离平衡时的离子的浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水的离子积增大的原因是 。 gcfad1年前1
gcfad1年前1 -
 哭泣海豚 共回答了16个问题
哭泣海豚 共回答了16个问题 |采纳率87.5%1×10 -14 1×10 -12 水的电离是吸热过程,温度升高,水的电离程度增大,水电离出来的c(H + )与c(OH - )增大,K W 增大
25 ℃时,K W =c(H + )·c(OH - )=1×10 -14 ,100 ℃时,K W =c(H + )·c(OH - )=1×10 -12 ,故水的离子积增大,原因是温度升高,水的电离程度增大,水电离出来的c(H + )与c(OH - )增大,K W 增大。1年前查看全部
- 研究 种子发芽所需的条件实验室采取了如下图所示的一种装置来研究种子发芽所需的条件,并将它置于适宜的温室(25 ℃~35
研究 种子发芽所需的条件
实验室采取了如下图所示的一种装置来研究种子发芽所需的条件,并将它置于适宜的温室(25 ℃~35 ℃)环境中培养.
几天后,发现位于水面以上与位于水面以下的种子都没有发芽,只有位于水面处的种子发芽了,并且可以观察到小试管中的澄清石灰水变浑浊了.由此说明:
(1)种子发芽所需要的条件是 .
(2)小试管中澄清石灰水变浑浊的原因可用化学方程式表示为:
(3)U形管中放入的NaOH和CaO固体混合物的作用是: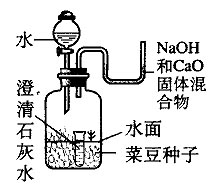
 我想找你1年前1
我想找你1年前1 -
 straydogwen 共回答了21个问题
straydogwen 共回答了21个问题 |采纳率95.2%这道题目要是放在以前我很快就知道了,现在老了,好久没做了,第三个问题是防止空气里的水进入小试管,做干燥剂
书上有二氧化碳、Ca(OH)2的化学方程式的,你自己查下,产生碳酸钙,所以浑浊
至于条件还真不知道,我想可能是需要二氧化碳和水吧,因为水以下没有二氧化碳,水以上没有水1年前查看全部
- 在101 kPa和25 ℃时,有关反应的热化学方程式如下:
在101 kPa和25 ℃时,有关反应的热化学方程式如下:
C(s)+1/2O 2 (g) =CO(g)ΔH1=-110.5 kJ·mol -1
H 2 (g)+ 1/2O 2 (g)=H 2 O(g)ΔH2=-241.7 kJ·mol -1
H 2 (g)+ 1/2O 2 (g)=H 2 O(l)ΔH3=-285.8 kJ·mol -1
下列说法正确的是[ ]A.C(s)+H 2 O(g)=CO(g)+H 2 (g)ΔH=-131.2 kJ·mol -1
B.H 2 燃烧热的热化学方程式为:2H 2 (g)+O 2 (g)=2H 2 O (l)ΔH=-571.6 kJ·mol -1
C.2H 2 O(g)=2H 2 (g)+O 2 (g)ΔH=-483.4 kJ·mol -1
D.H 2 O(g)=H 2 O(l)ΔH=-44.1 kJ·mol -1 fangyuti1年前1
fangyuti1年前1 -
 181907878 共回答了12个问题
181907878 共回答了12个问题 |采纳率91.7%D1年前查看全部
- 25 ℃时,0.1 mol·L-1NH4Cl溶液的pH=a,则NH4Cl溶液中c(H+)-c(NH3·H2O)=____
25 ℃时,0.1 mol·L-1NH4Cl溶液的pH=a,则NH4Cl溶液中c(H+)-c(NH3·H2O)=____________(用含有a的关系式表示
 wheir20011年前1
wheir20011年前1 -
 爱喝冰咖啡 共回答了20个问题
爱喝冰咖啡 共回答了20个问题 |采纳率85%由于NH4+的水解会生成NH3·H2O和H+,且他们是等量 的.
然后溶液的PH还由水的水解生成的H+(还生成等量的OH-)
PH=c(NH3·H2O)+c(OH-)
所以所求得c(OH-)=10^(a-14)1年前查看全部
- 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25 ℃时,有
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25 ℃时,有
HA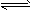 H + +A - ,则K=
H + +A - ,则K=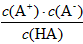 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)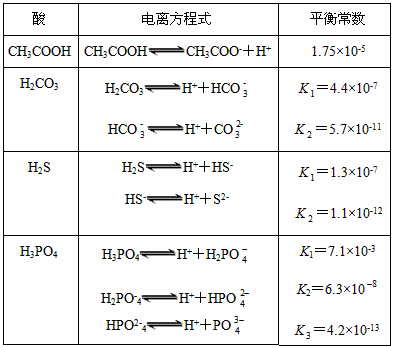
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是_______________________________。
(3)若把CH 3 COOH、H 2 CO 3 、HCO 3 - 、H 2 S、HS - 、H 3 PO 4 、H 2 PO 4 - 、HPO 4 2- 都看做是酸,其中酸性最强的是__________,最弱的是__________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是__________,产生此规律的原因是___________________________。 zz红尘1年前1
zz红尘1年前1 -
 没有你怎么办 共回答了18个问题
没有你怎么办 共回答了18个问题 |采纳率88.9%(1)增大
(2)K值越大,电离出的氢离子浓度越大,酸性越强
(3)H 3 PO 4 ;HPO 4 2-
(4)K1∶K2∶K3≈1∶10 -5 ∶10 -10 ;上一级电离产生的H + 对下一级电离有抑制作用1年前查看全部
- 现有25 ℃时0.1 mol·L -1 的氨水,请回答以下问题:
现有25 ℃时0.1 mol·L -1 的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,一水合氨的电离平衡________(填“向左”、“向右”或“不”)移动;此时溶液中 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入等浓度稀醋酸,使其恰好中和,写出反应的离子方程式:_________________;所得溶液的pH________7(填“>”、“<”或“=”),
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时[NH 4 + ]=a mol·L -1 ,则c(SO 4 2- )=________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是________________________________________。 0度时区1年前1
0度时区1年前1 -
 wenhsvictor 共回答了21个问题
wenhsvictor 共回答了21个问题 |采纳率81%1年前查看全部
- 下列说法或表示方法正确的是 A.反应物的总能量低于生成物的总能量时,该反应一定不能发生 B.在10l kPa、25 ℃时
下列说法或表示方法正确的是
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生 B.在10l kPa、25 ℃时,1 g H 2 完全燃烧生成气态水,放出120.9 kJ的热量,则氢气的燃烧热为241.8 kJ/mol C.已知:2SO 2 (g) + O 2 (g)  2SO 3 (g) ;△H = -98.3 kJ/mol。将1 mol SO 2 和0.5 mol O 2 充入一密闭容器中反应,放出49.15 kJ 的热量
2SO 3 (g) ;△H = -98.3 kJ/mol。将1 mol SO 2 和0.5 mol O 2 充入一密闭容器中反应,放出49.15 kJ 的热量D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s) ;△H<0  刑天灰1年前1
刑天灰1年前1 -
 阳光媚女人 共回答了25个问题
阳光媚女人 共回答了25个问题 |采纳率84%D
1年前查看全部
- 25 ℃ 时,下列各溶液中关系的叙述中,正确的是 [ ] A.pH=3的
25 ℃ 时,下列各溶液中关系的叙述中,正确的是 [ ]A.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c(Na + ) + c(H + )=c(OH - ) + c(CH 3 COO - )
B.pH=2的盐酸与pH=l的硫酸溶液中c(H + )之比为2∶1
C.0.1mol/L HA(某酸)溶液pH≠1,0.1mol/L BOH(某碱)溶液中c(OH - ) =0.1 mol/L,则BA(盐)溶液pH<7
D.4种pH相同的溶液①CH 3 COONa ②C 6 H 5 ONa ③NaHCO 3 ④NaOH中c(Na + )的大小顺序是
①>②>③>④ pwy161年前1
pwy161年前1 -
 风在火中 共回答了11个问题
风在火中 共回答了11个问题 |采纳率81.8%A1年前查看全部
- 25 ℃时,水的电离达到平衡:H 2 O H + +OH - ; >0,下列叙述正确的是 [
25 ℃时,水的电离达到平衡:H 2 O  H + +OH - ;
H + +OH - ; >0,下列叙述正确的是 [ ]
>0,下列叙述正确的是 [ ]A.向水中加入稀氨水,平衡逆向移动,c(OH - )降低
B.向水中加入少量固体硫酸氢钠,c(H + )增大,K W 不变
C.向水中加入少量固体CH 3 COONa,平衡逆向移动,c(H + )降低
D.将水加热,K W 增大,pH不变 sochemen5501年前1
sochemen5501年前1 -
 马勒戈壁 共回答了17个问题
马勒戈壁 共回答了17个问题 |采纳率88.2%B1年前查看全部
- 已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示 (1)则25 ℃时,水的电离平衡曲线应为__________(填“
已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示 
(1)则25 ℃时,水的电离平衡曲线应为__________(填“A”或“B”),请说明理由___________________________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H 2 SO 4 溶液混合,若所得混合溶液的pH=7,则NaOH溶液与
H 2 SO 4 溶液的体积比为__________。
(3)95℃时,若100体积pH 1 =a的某强酸溶液与1体积pH 2 =b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH 1 与强碱的pH 2 之间应满足的关系是_____________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:______________。 mj521年前1
mj521年前1 -
 4k_wugsh 共回答了22个问题
4k_wugsh 共回答了22个问题 |采纳率86.4%(1)A;水的电离是吸热过程,温度低时,电离程度小,c(H + )·c(OH - )小
(2)10∶1
(3)a+b=14(或pH 1 +pH 2 =14)
(4)曲线B对应95 ℃,此时水的离子积为10 -12 ,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H + ,使溶液pH=51年前查看全部
- 25 ℃时,合成氨反应的热化学方程式为:
25 ℃时,合成氨反应的热化学方程式为:
N 2 (g)+3H 2 (g) 2NH 3 (g) △ H =-92.4 kJ/mol
2NH 3 (g) △ H =-92.4 kJ/mol
在该温度时,取2mol N 2 和7 mol H 2 放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是[ ]A.92.4 kJ B.92.4 kJ ~184.8 kJ C.小于184.8 kJ D.184.8 kJ  NuRHiCHi1年前1
NuRHiCHi1年前1 -
 叶开捷琳娜 共回答了16个问题
叶开捷琳娜 共回答了16个问题 |采纳率87.5%C
正确答案:C
合成氨反应是可逆反应,转化率不可能达到100%,故C正确。1年前查看全部
- 1、25 ℃时,水的电离达到平衡:H2O H+ + OH- ;ΔH > 0 ,下列叙述正确的是 A.向水中加人稀氨水
1、25 ℃时,水的电离达到平衡:H2O H+ + OH- ;ΔH > 0 ,下列叙述正确的是 A.向水中加人稀氨水,
 雨打芭蕉点点滴滴1年前1
雨打芭蕉点点滴滴1年前1 -
 golferic 共回答了20个问题
golferic 共回答了20个问题 |采纳率95%楼主,你的题打完整了吗?
要注意从给的方程可以看出水或弱电解质的电离是吸热反应,因此体系温度升高利用水的电离,体系温度降低,水的电离减弱,而A选项加入稀氨水实质是加入了OH-,因此抑制水的电离
可以把题完整打出来吗?1年前查看全部
- 已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示 (1)则25 ℃时水的电离平衡曲线应
已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示 
(1)则25 ℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由_________________________________________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H 2 SO 4 溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H 2 SO 4 溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,pH1与pH2之间应满足的关系是________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因___________________________。 荒原逐日1年前1
荒原逐日1年前1 -
 拜见岳父 共回答了16个问题
拜见岳父 共回答了16个问题 |采纳率100%(1)A;水的电离是吸热过程,温度低时,电离程度小,c(H + )、c(OH - )小
(2)10∶1
(3)a+b=14或pH1+pH2=14
(4)曲线B对应95 ℃,此时水的离子积为10 -12 ,HA若为强酸,最后应为pH=6,现pH=5,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H +1年前查看全部
- 已知:①25 ℃、101 kPa时,2C(s)+O 2 (g) 2CO(g) ΔH="-221" kJ·mol -1 ②
已知:
①25 ℃、101 kPa时,2C(s)+O 2 (g) 2CO(g) ΔH="-221" kJ·mol -1
2CO(g) ΔH="-221" kJ·mol -1
②稀溶液中,H + (aq)+OH - (aq) H 2 O(l) ΔH="-57.3" kJ·mol -1
H 2 O(l) ΔH="-57.3" kJ·mol -1
又已知弱电解质电离吸热。下列结论正确的是( )A.C的燃烧热大于110.5 kJ·mol -1 B.①的反应热为221 kJ·mol -1 C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol -1 D.稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57.3 kJ热量  零度花雕1年前1
零度花雕1年前1 -
 天才39 共回答了18个问题
天才39 共回答了18个问题 |采纳率77.8%A
①的反应热为-221 kJ·mol -1 ;稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ·mol -1 ;稀醋酸与稀NaOH溶液反应生成1 mol水放出的热量小于57.3 kJ。1年前查看全部
- 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为-57.3 kJ/mol,辛烷的燃烧热为-5518
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为-57.3 kJ/mol,辛烷的燃烧热为-5518 kJ/mol。下列热化学方程式书写正确的是()
A.2H + (aq) +  (aq)+
(aq)+ (aq)+2
(aq)+2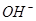 (aq) = BaSO 4 (s)+2H
(aq) = BaSO 4 (s)+2H 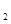 O(l) ;
O(l) ;  H =
H =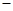 57.3 kJ/mol
57.3 kJ/molB.KOH(aq)+ 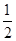 H
H 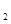 SO 4 (aq) =
SO 4 (aq) = 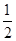 K
K 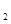 SO 4 (aq)+H
SO 4 (aq)+H 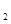 O(l);
O(l);  H=
H= 57.3kJ/mol
57.3kJ/molC.C 8 H 18 (l)+ 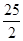 O
O 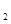 (g)=8CO
(g)=8CO 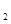 (g)+ 9H
(g)+ 9H 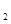 O(g);
O(g);  H=
H= 5518 kJ/mol
5518 kJ/molD.2C 8 H 18 (g)+25O  (g)=16CO
(g)=16CO  (g)+18H
(g)+18H  O(1);
O(1);  H=
H= 5518 kJ/mol
5518 kJ/mol 55556661年前1
55556661年前1 -
 guighost07 共回答了15个问题
guighost07 共回答了15个问题 |采纳率100%B
1年前查看全部
- 在25 ℃时,用石墨电极电解1000mL一定浓度的CuCl 2 溶液。5 min后电解完全,在一个石墨电极上只有1.28
在25 ℃时,用石墨电极电解1000mL一定浓度的CuCl 2 溶液。5 min后电解完全,在一个石墨电极上只有1.28 g Cu生成。试回答下列问题:
(1)总反应式为 。
(2)电解过程中转移的电子数为 mol, 同时生成标准状况下气体的体积为
(3) 该CuCl 2 溶液的物质的量浓度为 。
(4)有铜生成的是 (填“阳极”或“阴极”) 灌水专用1年前1
灌水专用1年前1 -
 libinbin6069 共回答了23个问题
libinbin6069 共回答了23个问题 |采纳率82.6%1年前查看全部
- 在25 ℃、101 kPa下,1 g甲醇(CH 3 OH)燃烧生成CO 2 和液态水时放热22.68 kJ。下列热化学方
在25 ℃、101 kPa下,1 g甲醇(CH 3 OH)燃烧生成CO 2 和液态水时放热22.68 kJ。下列热化学方程式正确的是
A.CH 3 OH(l)+3/2O 2 (g)===CO 2 (g)+2H 2 O(l)Δ H =+725.8 kJ·mol - 1 B.2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(l)Δ H =-1452 kJ·mol - 1 C.2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(l)Δ H =-725.8 kJ·mol - 1 D.2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(l)Δ H =+1452 kJ·mol - 1  CICI的葵1年前1
CICI的葵1年前1 -
 静观溪上 共回答了9个问题
静观溪上 共回答了9个问题 |采纳率100%B
甲醇燃烧是放热反应,△H小于0,AD不正确。1mol甲醇完全燃烧放出的热量是22.68 kJ×32=725.76kJ,所以正确的答案选B。1年前查看全部
- 已知25 ℃时,下列酸的电离常数:醋酸:1.75×10 -5 氢氰酸:4.93×10 -10
已知25 ℃时,下列酸的电离常数:醋酸:1.75×10 -5 氢氰酸:4.93×10 -10
氢氟酸:7.2×10 -4 甲酸:1.77×10 -4 则物质的量浓度均为0.1 mol·L -1 的上述溶液酸性最强的是()
A 醋酸 B 氢氰酸 C氢氟酸 D甲酸 沧海绝笑1年前1
沧海绝笑1年前1 -
 lwq13018492108 共回答了18个问题
lwq13018492108 共回答了18个问题 |采纳率94.4%C
正确答案:C
浓度相同时,组成相似的酸,电离常数越大,酸性越强,氢氟酸:7.2×10 -4 ,酸性最强。1年前查看全部
- 将颗粒完整的活种子分成甲、乙两组,在约25 ℃的条件下分别播种。甲组种在肥沃、湿润的土壤中,乙组种在贫瘠、湿润的土壤中,
将颗粒完整的活种子分成甲、乙两组,在约25 ℃的条件下分别播种。甲组种在肥沃、湿润的土壤中,乙组种在贫瘠、湿润的土壤中,这两组种子的发芽状况是()
A.甲先萌发 B.乙先萌发 C.同时萌发 D.都不萌发  第一线人1年前1
第一线人1年前1 -
 yanbo0201 共回答了27个问题
yanbo0201 共回答了27个问题 |采纳率100%C
1年前查看全部
- 25 ℃时,水的电离达到平衡:H2OH++OH- ΔH>0,下列叙述正确的是( ) A.向
25 ℃时,水的电离达到平衡:H2OH++OH- ΔH>0,下列叙述正确的是( ) A.向
25 ℃时,水的电离达到平衡:H2OH++OH- ΔH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,[OH-]降低
B.向水中加入少量固体硫酸氢钠,[H+]增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,[H+]降低
D.将水加热,Kw增大,pH不变
 treelynn1年前1
treelynn1年前1 -
 hhxzyh 共回答了30个问题
hhxzyh 共回答了30个问题 |采纳率93.3%A.向水中加入稀氨水,平衡逆向移动,但[OH-]增大,错
B.向水中加入少量固体硫酸氢钠,[H+]增大,Kw不变,对
C.向水中加入少量固体CH3COONa,平衡正向移动,[H+]降低,错
D.将水加热,Kw增大,pH变小,错1年前查看全部
- 有两个相同容积的密闭容器X、Y,在25 ℃时,X中充入agA气体,Y中充入agCH4气体,X与Y内的压强之比是4:11
有两个相同容积的密闭容器X、Y,在25 ℃时,X中充入agA气体,Y中充入agCH4气体,X与Y内的压强之比是4:11
则A的摩尔质量为? txcfzy1年前1
txcfzy1年前1 -
 炎炎_ly 共回答了21个问题
炎炎_ly 共回答了21个问题 |采纳率95.2%根据阿伏伽德罗定律:PV=nRT
已知:
V一定(两个相同容积)
T一定(25 ℃时)
则P1/P2=n1/n2
P1/P2=4:11
所以n1/n2=4:11
又因为n=m/M
则可以列出比例式
(a/MA)/(a/16)=4/11
得到:MA=44g/mol
有什么不懂的可以来问我哦!1年前查看全部
- 在一个封闭体系的 25 ℃ 水样中加入等量的下列物质,总酸度保持不变的是( )
在一个封闭体系的 25 ℃ 水样中加入等量的下列物质,总酸度保持不变的是( )
a 、氯化铝
b 、碳酸钠
c 、二氧化碳
d 、碳酸氢钠
^ 弯弯绕绕1年前1
弯弯绕绕1年前1 -
 yudama 共回答了16个问题
yudama 共回答了16个问题 |采纳率87.5%选择:b 、碳酸钠
a 、氯化铝 ---有氢氧化铝、氢离子生成,酸度变小
b 、碳酸钠
c 、二氧化碳 ---溶于水后生成碳酸,酸度变小
d 、碳酸氢钠 ----溶于水后,和水结合,有氢氧根生成,酸度变大.1年前查看全部
大家在问
- 1等温等容下,达平衡时增加c(HI),化学平衡向正向移动
- 2根据首字母提示完成句子Twenty and six is t____
- 3let's ask a policeman for ___
- 4物理11大题急救
- 5什么是厚弦比请解释下概念以及应用方面
- 6鲁迅先生上文所写的是小时候在家乡看戏的事,所看的叫什么戏
- 7FeCl3跟水全反应转化为Fe(OH)3胶体后,其中胶体粒子的数目为对吗?
- 8超细颗粒、胶体颗粒的颗粒是多大?
- 9如图,用字母表示阴影部分的面积.
- 10[化学]一种物质在另一种物质里面溶解,说明这两种物质反应了吗?
- 11请帮我把下面的名言警句!生于忧患,__________.烽火连三月,_______________.前世不忘,_____
- 12英语完型填空题
- 13甲水池有水382立方米,乙水池有水18立方米,如果甲水池里的水以每分钟9立方米的速度流入乙水池,多少钟后
- 14my favorite way of travel,英语作文.
- 15在含盐百分之20的盐水中加4克盐,16克水,这时的盐水比原来淡了还是比原来咸了还是