氯碱工业上在阴极加少量去离子水的目的是什么
 wangyj0092022-10-04 11:39:541条回答
wangyj0092022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 房子有约 共回答了23个问题
房子有约 共回答了23个问题 |采纳率87%- 阴极加纯水(去离子水),其实就是生产烧碱的原料.
氯碱工业的电解槽阳极发生的是电解氯离子的反应生成氯气,阴极则是电解水生成氢气和氢氧根,这样阴极生成的氢氧根和阳极渗透过来的钠离子就是所需要的烧碱.因此,阴极实际上消耗的是水(虽然从阳极也渗透过来一些水但是远远供给不上消耗),需要不断地补充原料---水. - 1年前
相关推荐
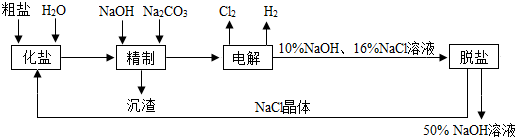
- 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下 依据上图,完成下列填空:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下 
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_______________________,与电源负极相连的电极附近,溶液pH值_____________(选填:不变、升高或下降)
(2)工业食盐含Ca 2+ 、Mg 2+ 等杂质。精制过程发生反应的离子方程式为_______________________,
_______________________。
(3)如果粗盐中SO 4 2- 含量较高,必须添加钡式剂除去SO 4 2- ,该钡试剂可以是___________(选填a、b、c,多选扣分)
a、Ba(OH) 2 b、Ba(NO 3 ) 2 c、BaCl 2
(4)为有效除去Ca 2+ 、Mg 2+ 、SO 4 2- ,加入试剂的合理顺序为____________(选填a,b,c多选扣分)
a、先加NaOH,后加Na 2 CO 3 ,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na 2 CO 3
c、先加钡试剂,后加NaOH,再加Na 2 CO 3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________、冷却、___________(填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl 2 与NaOH反应;采用无隔膜电解冷的食盐水时,Cl 2 与NaOH充分接触,产物仅是NaClO和H 2 ,相应的化学方程式为______________________ 米米_姜1年前1
米米_姜1年前1 -
 阿熏ài猪猪 共回答了18个问题
阿熏ài猪猪 共回答了18个问题 |采纳率88.9%(1)2Cl - -2e - =Cl 2 ;升高
(2)Ca 2+ +CO 3 2- ==CaCO 3 ↓;Mg 2+ +2OH - ==Mg(OH) 2 ↓
(3)ac
(4)bc
(5)蒸发;过滤
(6)Cl 2 +2NaOH==NaCl+NaClO+H 2 O1年前查看全部
- 下图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是 [
下图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是 
[ ]
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体 塞菲洛斯1年前1
塞菲洛斯1年前1 -
 ngln 共回答了15个问题
ngln 共回答了15个问题 |采纳率80%B1年前查看全部
- (2012•太原)氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是( )
(2012•太原)氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是( )
A.H2
B.Cl2
C.Na2CO3
D.NaOH rbcc1icl1年前1
rbcc1icl1年前1 -
 yesseu 共回答了14个问题
yesseu 共回答了14个问题 |采纳率78.6%解题思路:依据质量守恒定律可知化学反应前后元素的种类一定不变,所以通过电解食盐水制取的物质元素的含有情况,必与反应物食盐水含有的元素情况相同据此回答即可;质量守恒定律可知化学反应前后元素的种类一定不变,所以通过电解食盐水制取的物质元素的含有情况,必与反应物食盐水含有的元素情况相同,分析知反应物是氯化钠和水,所以反应后的物质中只能含有钠、氯、氢和氧四种元素.
A、氢气是由氢元素组成的,符合以上关于产物情况的分析,所以氢气可能是该反应的生成物;
B、氯气由氯元素组成,符合以上关于产物情况的分析,所以氯气可能是该反应的生成物;
C、碳酸钠是由碳、氧和钠三种元素组成,由以上分析可知生成物中不可能含有碳元素,所以生成物中不可能含有碳酸钠;
D、氢氧化钠是由钠、氧和氢三种元素组成,符合以上关于产物情况的分析,所以可能是生成物;
故选C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 根据反应物和生成物的元素种类需相同,来判断生成物的情况,如果所给物质中的一种元素,在反应物中找不到,就不可能是生成物.1年前查看全部
- 工业上利用电解饱和食盐水可制得重要化工产品,该工业又称为“氯碱工业”.
 工业上利用电解饱和食盐水可制得重要化工产品,该工业又称为“氯碱工业”.
工业上利用电解饱和食盐水可制得重要化工产品,该工业又称为“氯碱工业”.
(1)电解饱和食盐水的化学方程式为2nacl+2h2o
2naoh+cl2↑+h2↑通电 .2nacl+2h2o;电解时与电源正极相连的电极上产生的气体是______,常用______检验该气体.
2naoh+cl2↑+h2↑通电 .
(2)新制的氯水具有漂白性,能杀死水中的细菌,起消毒作用.研究证明,溶解在水中的部分氯气能与水发生反应,其反应的离子方程式为______;氯水不稳定,要现用现配,如图吸收氯气制备氯水的装置最合理的是______(选填图中选项的编号字母).
(3)***(cn)2、硫***(scn)2的化学性质和氯气的性质相似.它们的氧化性强弱为:cl2>br2>(cn)2>(scn)2>i2.试写出:
①(cn)2与koh溶液反应的化学方程式______;
②nabr和kscn的混合溶液中加入(cn)2,写出发生反应的离子方程式______. 灰雪姬1年前1
灰雪姬1年前1 -
 窗边有弦月 共回答了19个问题
窗边有弦月 共回答了19个问题 |采纳率94.7%解题思路:(1)电解氯化钠溶液时,在阳极上产生的是氯气,该气体能使湿润的淀粉碘化钾试纸变蓝;
(2)氯气可以和水之间反应生成盐酸和次氯酸,将氯气通到水中可以制取氯水,氯气的水溶性不大,氯气有毒,要进行尾气处理;
(3)①根据氯气与KOH溶液的反应,类推(CN)2与KOH(aq)的反应;
②阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-,NaBr和KSCN的混合溶液中加入足量(CN)2反应,只发生KSCN与(CN)2的反应.(1)电解氯化钠溶液的原理方程式为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,在阳极上产生的是氯气,该气体能使湿润的淀粉碘化钾试纸变蓝,故答案为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑;Cl2;湿润的淀粉碘化钾试纸;
(2)氯气可以和水之间反应生成盐酸和次氯酸,反应为:Cl2+H2O=H++Cl-+HClO,将氯气通到水中可以制取氯水,氯气的水溶性不大,氯气有毒,要进行尾气处理,故选d;
(3)①由Cl2+2KOH=KCl+KClO+H2O可知,(CN)2的化学性质和卤素很相似,则(CN)2与KOH(aq)反应的化学方程式为(CN)2+2KOH=KCN+KCNO+H2O,
故答案为:(CN)2+2KOH=KCN+KCNO+H2O;
②阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-,NaBr和KSCN的混合溶液中加入足量(CN)2反应,只发生KSCN与(CN)2的反应,该反应为2SCN-+(CN)2=(SCN)2+2CN-,
故答案为:2SCN-+(CN)2=(SCN)2+2CN-.点评:
本题考点: 电解原理;实验装置综合.
考点点评: 本题考查化学反应方程式的书写,明确信息及离子的还原性与反应的关系即可解答,(2)中注意优先氧化为学生解答的难点,题目难度中等.1年前查看全部
- (2010•上海)图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是( )
 (2010•上海)图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是( )
(2010•上海)图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是( )
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体 淡淡默默1年前1
淡淡默默1年前1 -
 大雪雪 共回答了19个问题
大雪雪 共回答了19个问题 |采纳率94.7%解题思路:A、氨气和氯气接触时生成氯化铵,产生白烟;
B、不能出现红棕色气体;
C、该反应中氨气中的氮元素化合价升高,表现还原性;
D、烧杯中的氢氧化钠可以吸收多余的有害气体.A、分析装置图,氨气中氮元素化合价为-3价,为最低价态,具有还原性,氯气具有强氧化性,氨气和氯气接触时发生反应生成氯化铵、氯化氢和氮气,反应的方程式为:
8NH3+3Cl2=6NH4Cl+N2,氯化铵为白色固体,烧瓶中出现白烟,故A正确;
B、氨气和氯气反应生成氮气,不能生成二氧化氮红棕色气体,所以烧瓶中不能出现红棕色,故B错误;
C、该反应中,氨气中的氮元素化合价由-3价升高到0价,化合价升高,表现还原性,故C正确;
D、氯气有毒,排放到空气中污染环境,烧杯中盛放的为氢氧化钠溶液可以和有害气体氯气反应,达到吸收有害气体的目的,故D正确.
故选B.点评:
本题考点: 氯碱工业;绿色化学;氧化还原反应;氯气的化学性质;氨的化学性质;气体发生装置的气密性检查.
考点点评: 此题考查化学实验、元素化合物的性质等知识,对某种元素来讲,其处于最高价时,只有氧化性;处于最低价时,只有还原性;中间价态,则既有氧化性又有还原性.故此对同一种元素可以依据价态判断,此题中氨气中的氮元素处于最低价,只有还原性.1年前查看全部
- (2010•盐城一模)MgSO4•7H2O医药上用作泻剂.工业上用氯碱工业中的一次盐泥为原料生产.已知一次盐泥中含有镁、
(2010•盐城一模)MgSO4•7H2O医药上用作泻剂.工业上用氯碱工业中的一次盐泥为原料生产.已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分.主要工艺如下:

(1)用硫酸调整溶液pH到1~2,硫酸的作用是______.
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是______ (写化学式).其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:______.
(3)若除杂后过滤,发现滤液发黄,需采取的措施是______.
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是______.
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4•7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时.为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→______.
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol•L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol•L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(
)=______.SO 2−4 biang9261年前1
biang9261年前1 -
 hql167 共回答了13个问题
hql167 共回答了13个问题 |采纳率84.6%解题思路:(1)将盐泥中的碳酸盐、硅酸盐转化为硫酸盐,硅酸盐转化为硅酸沉淀,钙盐转化为硫酸钙沉淀而除去;
(2)加热煮沸的主要目的是促进Al3+、Fe3+水解及Mn2+氧化成MnO2;
(3)滤液发黄可能含有三价铁离子;
(4)丙酮易挥发;
(5)重复脱水后恒重说明已经完全脱水;
(6)根据硫酸钡的质量求硫酸根的质量;(1)将盐泥中的碳酸盐、硅酸盐转化为硫酸盐,硅酸盐转化为硅酸(SiOrnH2O)沉淀,钙盐转化为硫酸钙沉淀而除去,故答案为:浸出Mg、Fe、Al、Mn离子,除去Si、Ca;
(2)Al3+、Fe3+水解生成Al(OH)3、Fe(OH)3,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,故答案为:Al(OH)3、Fe(OH)3;Mn2++2OH一+C1O一=MnO2↓+Cl一+H2O;
(3)滤液发黄可能含有三价铁离子,可添加适量的次氯酸钠溶液,次氯酸钠显碱性,可促进三价铁离子的水解,再煮沸、过滤,故答案为:添加适量的次氯酸钠溶液,再煮沸、过滤;
(4)用丙酮代替蒸馏水洗涤可减小硫酸镁的溶解损耗,并快速干燥,故答案为:减小硫酸镁的溶解损耗,并快速干燥;
(5)重复脱水后至恒重说明已经完全脱水,故答案为:称量后重复脱水→冷却→称量至恒重;
(6)m(
SO2−4)=[0.466g/233]×96=0.192g,w(
SO2−4)=[0.192g/0.5g]=38.4%,故答案为:38.4%;点评:
本题考点: 无机非金属材料;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查物质的制备、除杂,涉及物质的检验以及沉淀的转化等知识,题目较为综合,有一定难度,考查学生的分析能力.1年前查看全部
- 氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠。其中氯气用途十分广泛,除用于净水、环境消毒外,还
氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠。其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅、聚氯乙烯、氯苯等。(1)写出工业上制取盐酸的化学反应方程式:
(2)工业上可用氯气和石灰乳为原料制造漂白粉,写出漂白粉在空气中的漂白原理(用化学方程式表示) 。
(3)工业上生产半导体材料硅的流程如下:
①写出在制备粗硅时反应的化学方程式_____________________________,此反应中焦炭的作用是____________(填“氧化剂”或“还原剂”),若有0.6mol硅生成,反应中转移电子的物质的量是 mol。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点,难挥发性杂质,必须进行分离提纯。其提纯方法为____________。(填序号)
A、蒸馏B、过滤 C、萃取 D、结晶
③由四氯化硅通入氢气得到高纯硅和氯化氢气体,写出该反应的化学方程式:________________________________________。 厚道阿多1年前1
厚道阿多1年前1 -
 rgdhm123 共回答了20个问题
rgdhm123 共回答了20个问题 |采纳率90%(1)Cl 2 + H 2 == 2HCl
(2)Ca(ClO) 2 +H 2 O+CO 2 =CaCO 3 +2HClO
(3)① SiO 2 + 2C==Si + 2CO↑ 还原剂 2.4mol
② A
③SiCl 4 + 2 H 2 ==== Si + 4 HCl1年前查看全部
- 利用常温下氨跟氯气能发生置换反应的性质,氯碱工业生产中用来检查氯气是否泄漏,其模拟装置如图。下列有关说法错误的是
利用常温下氨跟氯气能发生置换反应的性质,氯碱工业生产中用来检查氯气是否泄漏,其模拟装置如图。下列有关说法错误的是

A.烧瓶中会出现白烟 B.烧瓶中会立即出现喷泉 C.烧瓶中发生的反应表明常温下氨气有还原性 D.烧瓶中还发生化合反应  醉狐狸09251年前1
醉狐狸09251年前1 -
 饿滴神华啊 共回答了17个问题
饿滴神华啊 共回答了17个问题 |采纳率88.2%B
1年前查看全部
- (2011•北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
 (2011•北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
(2011•北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
(1)溶液A的溶质是______.
(2)电解饱和食盐水的离子方程式是2Cl-+2H2O
H2↑+Cl2↑+2OH-通电 .2Cl-+2H2O.
H2↑+Cl2↑+2OH-通电 .
(3)电解时用盐酸控制阳极区溶液的pH在2~3.用化学平衡移动原理解释盐酸的作用:______.
(4)电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].精制流程如下(淡盐水和溶液A来自电解池):
①盐泥a除泥沙外,还含有的物质是______.
②过程I中将NH4+转化为N2的离子方程式是______.
③BaSO4的溶解度比BaCO3的小.过程II中除去的离子有______.
④经过程III处理,要求盐水c中剩余Na2SO3的含量小于5mg/L.若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10% Na2SO3溶液______kg(溶液体积变化忽略不计). f00w1年前1
f00w1年前1 -
 romeobox 共回答了18个问题
romeobox 共回答了18个问题 |采纳率83.3%解题思路:(1)根据电极反应判断阴极产物;
(2)根据两极的反应书写电解反应式;
(3)根据阳极产物和平衡移动原理分析;
(4)①根据杂质离子和溶液的酸碱性判断能反应生成的沉淀;
②根据A溶液成分和可能具有的性质,结合氧化还原反应和质量守恒定律书写离子方程式;
③根据溶液成分和溶解度大小判断生成的沉淀;
④根据反应方程式和质量守恒解答.(1)电解饱和食盐水时,阴极反应式为:2H2O+2e-═2OH-+H2↑,阳极反应式为:2Cl--2e-═Cl2↑,阴极产物为NaOH和H2,阳极产物是Cl2,据此可以确定溶液A的溶质是NaOH,故答案为:NaOH;
(2)根据阳极极和阴极的反应式可得电解反应的离子方程式是2Cl-+2H2O
通电
.
H2↑+Cl2↑+2OH-,故答案为:2Cl-+2H2O
通电
.
H2↑+Cl2↑+2OH-;
(3)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,故答案为:Cl2与水的反应为Cl2+H2O
HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,故答案为:Cl2与水的反应为Cl2+H2O HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;
(4)①根据粗盐水和淡盐水的化学成分,代入题给精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2,
故答案为:Mg(OH)2;
②将NH4+转化为N2的氧化剂是Cl2,对应的离子方程式是2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O,故答案为:2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O;
③过程II是利用沉淀溶解平衡原理,将溶液中的Ca2+和SO42-分别转化为CaCO3和BaSO4沉淀除去,故答案为:SO42-、Ca2+;
④NaClO与Na2SO3溶液反应的化学方程式为:NaClO+Na2SO3 NaCl+Na2SO4,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b时至少需要10%Na2SO3溶液
NaCl+Na2SO4,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b时至少需要10%Na2SO3溶液
74.5g
74.5g•mol−1×126g•mol−1×
100
10=1.26kg,若盐水c中剩余Na2SO3的含量为5mg/L,则还需添加10% Na2SO3溶液50g÷10%=0.5kg,因此至多添加10%Na2SO3溶液
的质量为1.26kg+0.5kg=1.76kg.故答案为:1.76.点评:
本题考点: 以氯碱工业为基础的化工生产简介;原电池和电解池的工作原理;粗盐提纯.
考点点评: 本题考查饱和食盐水的电解和粗盐的提纯,题目较为综合,注意平衡移动原理的应用以及物质的量应用于化学方程式的计算.做题时注意题中所给信息,用守恒的方法解答.1年前查看全部
- 图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是( ) A.烧瓶中立即出现白烟 B.烧瓶中立即出现红
图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是( ) A.烧瓶中立即出现白烟 B.烧瓶中立即出现红棕色 C.烧瓶中发生的反应表明常温下氨气有还原性 D.烧杯中的溶液是为了吸收有害气体 
 charloveboa1年前1
charloveboa1年前1 -
 open1982 共回答了25个问题
open1982 共回答了25个问题 |采纳率100%A、分析装置图,氨气中氮元素化合价为-3价,为最低价态,具有还原性,氯气具有强氧化性,氨气和氯气接触时发生反应生成氯化铵、氯化氢和氮气,反应的方程式为:
8NH 3 +3Cl 2 =6NH 4 Cl+N 2 ,氯化铵为白色固体,烧瓶中出现白烟,故A正确;
B、氨气和氯气反应生成氮气,不能生成二氧化氮红棕色气体,所以烧瓶中不能出现红棕色,故B错误;
C、该反应中,氨气中的氮元素化合价由-3价升高到0价,化合价升高,表现还原性,故C正确;
D、氯气有毒,排放到空气中污染环境,烧杯中盛放的为氢氧化钠溶液可以和有害气体氯气反应,达到吸收有害气体的目的,故D正确.
故选B.1年前查看全部
- (8分)(1998年上海)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下
(8分)(1998年上海)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下

依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca 2+ 、M g 2+ 等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO 4 2- 含量较高,必须添加钡试剂除去SO 4 2- ,该钡试剂可以
是 (选填a,b,c多选扣分)。
a.Ba(OH) 2 b.Ba(NO 3 ) 2 c.BaCl 2
(4)为有效除去Ca 2+ 、M g 2+ 、SO 4 2— ,加入试剂的合理顺序为 (选填a、b、c多选扣分)
a.先加NaOH,后加Na 2 CO 3 ,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na 2 CO 3
c.先加钡试剂,后加NaOH,再加Na 2 CO 3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl 2 与NaOH反应;采用无隔膜电解冷的食盐水时,Cl 2 与NaOH充分接触,产物仅是NaClO和H 2 ,相应的化学方程式为 。 小绣妞子1年前1
小绣妞子1年前1 -
 幸福鱼摆摆 共回答了18个问题
幸福鱼摆摆 共回答了18个问题 |采纳率94.4%(1)2Cl - -2e _ ====Cl 2 ;升高(2)Ca 2+ +CO 3 2— =====CaCO 3 ↓Mg 2+ +2OH - ====M g (OH) 2 ↓
(3)a、c (4)b、c (5)蒸发;过滤 (6)NaCl+H 2 O=====NaClO+H 2 ↑或2NaCl+2H 2 O=======H 2 ↑+Cl 2 ↑+2NaOH Cl 2 +2NaOH====NaCl+NaClO+H 2 O
略1年前查看全部
- 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应
 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
正极PbO2+4H++SO42-+2e-═PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式2NaCl+2H2O
2NaOH+Cl2↑+H2↑通电 .2NaCl+2H2O.
2NaOH+Cl2↑+H2↑通电 .
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为______极.
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g/cm3)时,
①若铅蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为______ L.
②若消耗硫酸amol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出)[40a1000×1.15−
(71+2)]×100%a/2 [40a1000×1.15−
(71+2)]×100% (用含a的代数式表示).a/2 赞
T帅 花朵
共回答了21个问题采纳率:81% 举报
解题思路:(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,原子守恒配平写出;
(2)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,电源A为正极;
(3)①依据电解氯化钠生成氯气电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算;
③依据铅蓄电池电极反应计算消耗硫酸转移电子,电解过程中电子守恒,根据电解氯化钠溶液的化学方程式计算电解后溶液中溶质和溶液质量得到氢氧化钠的质量分数;(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,反应的化学方程式为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑;
(2)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,D为阴极,电源A为正极,故答案为:正极;
(3)①蓄电池消耗H2SO4 2mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗2mol硫酸电子转移2mol,电解食盐水阴极电极反应2H++2e-=H2↑转移电子2mol生成氢气1mol,标准状况体积为22.4L,则可收集到H2的体积22.4L,
故答案为:22.4;
②依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗amol硫酸电子转移amol,2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,反应中转移电子2mol,生成氢氧化钠物质的量为2mol,消耗amol硫酸电子转移amol,生成氢氧化钠amol,氢气0.5amol,氯气0.5amol,得到氢氧化钠溶液的质量分数=[40a
1000×1.15−
a/2(71+2)]×100%,
故答案为:[40a
1000×1.15−
a/2(71+2)]×100%.点评:
本题考点: 电解原理.
考点点评: 本题考查了原电池,电解池电极分析判断,电极反应中电子守恒计算应用,注意电子守恒的分析判断是解题关键,题目难度中等.1年前
8可能相似的问题-
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
1年前1个回答
-
1年前1个回答
-
1年前1个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.048 s. - webmaster@yulucn.com Syrup51年前1
Syrup51年前1 -
 T帅 共回答了21个问题
T帅 共回答了21个问题 |采纳率81%解题思路:(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,原子守恒配平写出;
(2)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,电源A为正极;
(3)①依据电解氯化钠生成氯气电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算;
③依据铅蓄电池电极反应计算消耗硫酸转移电子,电解过程中电子守恒,根据电解氯化钠溶液的化学方程式计算电解后溶液中溶质和溶液质量得到氢氧化钠的质量分数;(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,反应的化学方程式为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑;
(2)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,D为阴极,电源A为正极,故答案为:正极;
(3)①蓄电池消耗H2SO4 2mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗2mol硫酸电子转移2mol,电解食盐水阴极电极反应2H++2e-=H2↑转移电子2mol生成氢气1mol,标准状况体积为22.4L,则可收集到H2的体积22.4L,
故答案为:22.4;
②依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗amol硫酸电子转移amol,2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,反应中转移电子2mol,生成氢氧化钠物质的量为2mol,消耗amol硫酸电子转移amol,生成氢氧化钠amol,氢气0.5amol,氯气0.5amol,得到氢氧化钠溶液的质量分数=[40a
1000×1.15−
a/2(71+2)]×100%,
故答案为:[40a
1000×1.15−
a/2(71+2)]×100%.点评:
本题考点: 电解原理.
考点点评: 本题考查了原电池,电解池电极分析判断,电极反应中电子守恒计算应用,注意电子守恒的分析判断是解题关键,题目难度中等.1年前查看全部
- (2013•延边州模拟)海洋是一座巨大的宝藏,海水中蕴含80多种元素.氯碱工业和金属镁的制备原料都来自于海水.
(2013•延边州模拟)海洋是一座巨大的宝藏,海水中蕴含80多种元素.氯碱工业和金属镁的制备原料都来自于海水.
Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示).
(1)写出两电极的反应式:阳极______;阴极______.
(2)石棉隔膜的作用是______.
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高.20世纪80年代起,隔膜法电解工艺逐渐被离子膜电解技术取代.
(1)离子膜电解槽(如图乙所示)中⑥、⑦分别是______、______.
(2)已知一个电子的电量是1.602×10-19C,在离子膜电解饱和食盐水时电路中通过电子1.929×105C,则产生NaOH______g.
Ⅲ.如图丙是工业上生产镁的流程.
(1)写出下列反应的化学方程式:
①沉淀池中:______;
②电解:MgCl2(熔融)
Mg+Cl2↑电解 .MgCl2(熔融).
Mg+Cl2↑电解 .
(2)整个生产流程中,循环使用的物质是______.
(3)简述加热氯化镁的水合晶体使之脱水转化为无水氯化镁的操作过程:______.
 mokey88261年前1
mokey88261年前1 -
 whp不哭 共回答了21个问题
whp不哭 共回答了21个问题 |采纳率90.5%解题思路:Ⅰ.(1)用惰性电极电解氯化钠溶液,阳极是氯离子放电生成氯气,阴极是氢离子放电生成氢气;
(2)Cl2和NaOH反应生成氯化钠、次氯酸钠和水,石棉隔膜的作用阻止气体通过;
Ⅱ.(1)离子膜电解槽只允许阳离子和水分子通过;⑥为氢氧化钠,⑦为钠离子;
(2)依据电极反应和电子守恒分析计算得到;
Ⅲ.(1)①在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,得到氢氧化镁沉淀,发生复分解反应;
②电解熔融氯化镁,为氧化还原反应,生成镁和氯气;
(2)根据流程图可以看出,氯气可以循环利用;
(3)氯化镁中的镁离子易水解,在酸性环境下可以抑制水解.Ⅰ.(1)用惰性电极电解饱和食盐时,阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极氯离子失去电子,发生氧化反应,发生的方程式为:2Cl--2e-═Cl2↑,阴极是氢离子放电生成氢气,阴极发生的方程式为:2H++2e-═H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
(2)Cl2和NaOH溶液接触,发生反应2NaOH+Cl2═NaClO+NaCl+H2O,防止Cl2和NaOH反应,石棉隔膜的作用是阻止气体通过,
故答案为:阻止气体通过;
Ⅱ.(1)电解饱和食盐水,电解槽离子膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阴极是氢离子放电生成氢气,同时生成氢氧化钠,所以⑥为氢氧化钠,⑦为Na+,
故答案为:NaOH溶液;Na+;
(2)已知一个电子的电量是1.602×10-19C,若在离子膜电解饱和食盐水时通过电量1.929×105C,电子数=
1.929×105C
1.602×10−19C=1.204×1024,
1.204×1024
6.02×1023=2mol,电子物质的量为2mol,阴极电极反应为:2H++2e-=H2↑,依据化学方程式和电子守恒分析计算2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,转移电子2mol生成氢氧化钠2mol,质量为80g,
故答案为:80;
Ⅲ.(1)①把海水中的氯化镁转化成氢氧化镁沉淀,是往海水中加熟石灰,氯化镁和石灰乳的成分氢氧化钙反应MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,由于氢氧化镁不溶于水,因此可以采用过滤的方法使沉淀分离出来,因石灰乳是悬浊物,所以氢氧化镁沉淀无需标沉淀,
故答案为:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2;
②无水氯化镁在熔融状态下,通过电解得到金属镁,化学方程式为:MgCl2(熔融)
电解
.
Mg+Cl2↑,
故答案为:MgCl2(熔融)
电解
.
Mg+Cl2↑;
(2)根据流程图可以看出,氯气可以循环利用,故答案为:氯气(或Cl2);
(3)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,得到无水MgCl2,
故答案为:为了防止氯化镁水解,要在氯化氢气体的氛围中进行加热.点评:
本题考点: 氯碱工业.
考点点评: 本题主要考查了氯碱工业和金属镁的制备,掌握电解饱和食盐水的反应原理和海水中镁的提取方法是解答的关键,题目难度中等.1年前查看全部
- (2010•崇文区二模)某化工厂用氯碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该
(2010•崇文区二模)某化工厂用氯碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验:将12g纯碱样品与足量的稀盐酸充分反应,将反应后的溶液加热蒸发、干燥后,称量剩余固体物质的质量为13.1g.请根据计算得出:该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
 xuelingfeixiang1年前1
xuelingfeixiang1年前1 -
 蓝归子 共回答了12个问题
蓝归子 共回答了12个问题 |采纳率91.7%解题思路:碳酸钠与足量的稀盐酸充分反应,生成氯化钠、水和二氧化碳,因此,反应后的溶液加热蒸发、干燥后,剩余固体物质为氯化钠,其中氯化钠一部分为原产品中所含的杂质氯化钠、另一部分为反应生成的氯化钠;根据反应生成的氯化钠质量计算出产品中的碳酸钠,然后由碳酸钠质量与纯碱样品的质量比求出该产品中碳酸钠的质量分数,并与包装袋上所注明的含量进行比对,做出是否合格的判断.设12g纯碱样品中氯化钠的质量为x
2HCl+Na2CO3═2NaCl+H2O+CO2↑
106 117
12g-x 13.1g-x
[106/12g−x=
117
13.1g−x] x=1.4g
该产品中含碳酸钠的质量分数=[12g−1.4g/12g]×100%≈88.3%<96%,因此,该产品中碳酸钠的质量分数不合格;
答:该产品中碳酸钠的质量分数不合格.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 化学方程式可以表示出反应中物质的质量关系,利用物质的质量关系,可由某一物质的质量计算出反应中其它物质的质量.1年前查看全部
- (2012•烟台一模)氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是( )
(2012•烟台一模)氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是( )
A.随着电解的进行,c(NaCl)降低,需不断补充饱和食盐水
B.电解过程中采用增大阳极区溶液pH的方法,可以减少Cl2在水中的溶解量
C.阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集
D.阳极表面用钛氧化物涂层处理,目的是降低电解产物Cl2对电极的腐蚀 xatvgy1年前1
xatvgy1年前1 -
 孔雀之家 共回答了17个问题
孔雀之家 共回答了17个问题 |采纳率94.1%解题思路:A.电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl;
B.增大阳极区溶液pH,会增大Cl2在水中的溶解量;
C.电解时,阳离子经过离子交换膜向阴极区移动;
D.Cl2具有强氧化性,能氧化电极材料.A.电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl,故A正确;
B.增大阳极区溶液pH,会增大Cl2在水中的溶解量,故B错误;
C.电解时,阳离子经过离子交换膜向阴极区移动,所以阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集,故C正确;
D.Cl2具有强氧化性,能氧化电极材料,则阳极表面用钛氧化物涂层处理来保护电极材料,故D正确;
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,侧重于氯碱工业的考查,注意把握题给信息,阳离子交换膜为解答该题的关键,注意审题,题目难度不大.1年前查看全部
- 氯碱厂电解饱和食盐水制取烧碱,同时制盐酸的工艺流程如下:根据题意完成下列填空:
氯碱厂电解饱和食盐水制取烧碱,同时制盐酸的工艺流程如下:根据题意完成下列填空:
(1)电解过程中发生反应的化学方程式是2NaCl+2H2O
2NaOH+H2↑+Cl2↑电解 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑电解 .
(2)氢气在电解池的______极逸出.氯气加压能得到液氯,这利用了氯气______的物理性质.
(3)HCl合成反应中保持过量的气体是______;从HCl合成塔的观察口能观察到的现象是______.
(4)利用HCl合成时放出的热量来产生水蒸汽,用于NaOH溶液的蒸发,这样做的优点是______.
(5)检验NaOH产品中是否含有NaCl的实验方案是______.
(6)为测定含少量NaCl的NaOH产品的纯度,某同学准确称取产品4.000g,溶于水配成1000mL溶液,用0.1000mol/L的标准盐酸滴定.实验记录的数据如下表:
他测得的上述产品中NaOH的纯度为______(用百分数表示),若样品的理论纯度为99.00%,则该同学本次实验的相对误差为______.实验次数 待测液体积(mL) 标准盐酸溶液体积(mL) 1 20.00 21.32 2 20.00 19.45 3 20.00 19.35  左宝琴右小昭1年前1
左宝琴右小昭1年前1 -
 风梦月清 共回答了14个问题
风梦月清 共回答了14个问题 |采纳率100%解题思路:(1)电解饱和食盐水得到氢氧化钠、氢气和氯气;(2)根据电解池的工作原理,分析两个电极上放电的离子,并确定生成的物质;根据氯气易液化;(3)为增大氯气的转化率,过量的气体是氢气;氢气在氯气中燃烧产生苍白色火焰;(4)利用HCl合成时放出的热量用来产生水蒸汽,用于NaOH溶液的蒸发,这样做的优点是充分利用能量;(5)根据氯离子的检验方法:加足量稀硝酸至呈酸性,然后滴加硝酸银溶液,若产生白色沉淀,则含氯离子;(6)先分析所耗盐酸标准液的体积的有效性,然后求出所耗盐酸标准液的体积平均值,然后根据关系式HCl~NaOH来解答.(1)电解饱和食盐水得到氢氧化钠、氢气和氯气;发生的反应为:2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑;
(2)电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程,阴极是氢离子得电子生成氢气的过程,在该极附近氢离子减少,氢氧根浓度增加,所以大量的氢氧化钠在阴极出现;氯气易液化,氯气加压能得到液氯,故答案为:阴;易液化;
(3)HCl合成反应中保持过量的气体是氢气,氢气在氯气中燃烧产生苍白色火焰,故答案为:氢气;苍白色火焰;
(4)利用HCl合成时放出的热量用来产生水蒸汽,用于NaOH溶液的蒸发,这样做的优点是充分利用能量,故答案为:充分利用能量;
(5)氯离子的检验方法是:加足量稀硝酸至呈酸性,然后滴加硝酸银溶液,若产生白色沉淀,则含有氯化钠,故答案为:加足量稀硝酸至呈酸性,然后滴加硝酸银溶液,若产生白色沉淀,则含有氯化钠;
(6)所耗盐酸标准液的体积分别为:21.32mL,19.45mL,19.35mL,第一组数据均无效,盐酸标准液的平均体积为19.40mL;
HCl~NaOH
0.1mol/L×19.40mL C(NaOH)×20mL
C(NaOH)=0.097mol/L,
则1000mL的溶液中含有NaOH的质量为:0.097mol/L×1L×40g/mol=3.88g,算烧碱样品的纯度为[3.88g/4.000g]×100%=97.00%,该同学本次实验的相对误差为:-2.02%,
故答案为:97.00%;-2.02%;点评:
本题考点: 氯碱工业;中和滴定;探究物质的组成或测量物质的含量.
考点点评: 本题考查了电解池原理、离子检验、化学计算等知识点,难度不大,根据所学知识即可完成.1年前查看全部
- (2011•姜堰市二模)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少
(2011•姜堰市二模)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染.
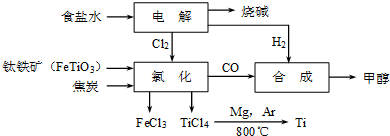
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式:______.
(2)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)⇌CH3OH(g).
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将______(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2t甲醇,至少需额外补充H2______t.
(3)用甲醇-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加6.4g.
①请写出燃料电池中的负极反应式:______.
②燃料电池正极消耗空气的体积是______(标准状况,空气中O2体积分数以20%计算). 独命鸟1年前1
独命鸟1年前1 -
 梦梦飞飞 共回答了13个问题
梦梦飞飞 共回答了13个问题 |采纳率92.3%解题思路:(1)从图示可知氯化时的反应物、生成物,再根据得失电子和原子守恒即可得出该反应的方程式;
(2)①根据浓度熵数值和平衡常数的大小关系来判断;
②根据CO和H2合成甲醇的方程式:CO(g)+2H2(g)⇌CH3OH(g)以及2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO和2NaCl+2H2O通电 .
2NaOH+H2↑+Cl2↑得到相应关系式来计算;通电 .
(3)①根据负极反应=总反应-正极反应来回答;
②根据电路中的电子守恒来计算回答.(1)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为
2FeTiO3+6C+7Cl2
通电
.
2FeCl3+2TiCl4+6CO,故答案为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO;
(2)①将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此状态的浓度熵Qc=
C(甲醇)
C(一氧化碳)C(氢气)2=[1
1×1.52=0.44>0.27,即Qc>K,
所以此时反应将向逆反应方向进行,故答案为:向逆反应方向进行;
②由方程式CO(g)+2H2(g)⇌CH3OH(g)、2FeTiO3+6C+7Cl2
通电
./ ]2FeCl3+2TiCl4+6CO和2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑得如下关系式:
6CH3OH→6CO→7Cl2→7H2,而6CH3OH→12H2,故每生产6molCH3OH(192g)需额外补充5molH2(10g),则生产19.2t甲醇,至少需额外补充1.0t氢气,故答案为:1.0;
(3)甲醇-空气碱性(KOH)燃料电池的总反应为:3O2+2CH3OH+4OH-=2CO32-+6H2O,正极反应式为:3O2+12e-+6H2O=12OH-,负极反应=总反应-正极反应,
即为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
电解精炼粗铜时,阴极电极反应为:Cu2++2e-=Cu,当生成6.4g纯铜,至少转移电子0.2mol,燃料电池的正极反应为:3O2+12e-+6H2O=12OH-,转移电子0.2mol,
消耗氧气0.05mol,折合成空气为0.25mol,在标准状况下的体积为5.6,故答案为:5.6 L.点评:
本题考点: 以氯碱工业为基础的化工生产简介;电极反应和电池反应方程式.
考点点评: 本题是一道有关电解原理的应用知识题目,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 氯碱工业中用饱和食盐水在通电条件下生产氯气氢气和氢氧化钠 写出化学反应方程式并配平
 bi537211年前1
bi537211年前1 -
 iibcz 共回答了23个问题
iibcz 共回答了23个问题 |采纳率91.3%2NaCl+2H2O=通电=2NaOH+Cl2↑+H2↑1年前查看全部
- (2014•济南一模)氯碱工业是最基本的化学工业之一,它的产品应用广泛.请回答下列问题:
(2014•济南一模)氯碱工业是最基本的化学工业之一,它的产品应用广泛.请回答下列问题:
(1)氯碱工业是利用电解食盐水生产______为基础的工业体系.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是______(填下列各项中序号).
a、碳酸钠、氢氧化钠、氯化钡b、碳酸钠、氯化钡、氢氧化钠
c、氢氧化钠、碳酸钠、氯化钡d、氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
利用盐泥生产MgSO4•7H2O晶体的工艺流程如图所示.成分 NaCl Mg(OH)2 CaCO3 BaSO4 其他不溶物 质量分数(%) 15~20 15~20 5~10 30~40 10~15 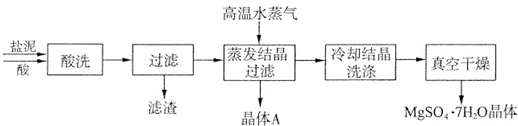
回答下列问题:
①酸洗过程中加入的酸为______,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是______.
②过滤所得滤渣的主要成分为______.
③据图分析,蒸发结晶过滤所得晶体A主要成分为______.
④真空干燥MgSO4•7H2O晶体的原因是______. 酷酷狗1年前1
酷酷狗1年前1 -
 遥远北极星 共回答了22个问题
遥远北极星 共回答了22个问题 |采纳率77.3%解题思路:(1)电解氯化钠溶液得到氯气和氢氧化钠;
(2)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(3)盐泥酸洗转化为硫酸镁、CaSO4、BaSO4,过滤将CaSO4、BaSO4、其它不溶物质除掉,溶液中剩余硫酸镁和氯化钠.蒸发结晶得到氯化钠,冷却结晶得到硫酸镁.(1)电解饱和食盐水得到氯气和氢氧化钠,故答案为:烧碱、氯气;
(2)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,故答案为:d;
(3)①生产MgSO4•7H2O,应加入硫酸,搅拌过程中CO2不断逸出,平衡向右移动,故答案为:硫酸;搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4⇌CaSO4+H2CO3(H2O+CO2↑)不断向右移动;
②CaSO4、BaSO4不溶于硫酸,过滤得到不溶于硫酸的物质,故答案为:CaSO4、BaSO4、其它不溶物质;
③晶体A主要成分为氯化钠,故答案为:氯化钠;
④真空干燥MgSO4•7H2O晶体防止失去结晶水,故答案为:防止失去结晶水.点评:
本题考点: 粗盐提纯;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查物质的分离提纯,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.1年前查看全部
- 1)氯碱工业中制备氯气的头化学方程式是? 2)氢氧燃料电池的能量转化主要形式是动?
 amin18021年前1
amin18021年前1 -
 fhtnl 共回答了20个问题
fhtnl 共回答了20个问题 |采纳率90%氯碱工业中制备氯气的化学方程式是:2NaCl+2H2O==通电==2NaOH+H2↑+Cl2↑
氢氧燃料电池的能量转化主要形式是化学能转化为电能.1年前查看全部
- 氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如图:
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如图:

依据图,完成下列填空:
(1)粗盐中含有的较多的可溶性杂质(氯化镁、氯化钙、硫酸钠等)和______,请用适当的数字和符号填空
②2个氯分子______③粗盐中含有的一种阳离子______
④零价的氢元素______⑤硫酸钠______
(2)工业食盐含有较多杂质,精制过程中加NaOH的作用是______.
(3)在电解过程中,发生反应的化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2 ↑通电 .2NaCl+2H2O,
2NaOH+H2↑+Cl2 ↑通电 .
电解后溶液的pH______.(填“升高”、“不变”、“降低”)
(4)粗盐中硫酸钠含量较高,必须添加钡试剂除去硫酸根离子,该钡试剂可以是______.
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
(5)为了有效地除去氯化镁、氯化钙、硫酸钠,加入试剂的合理顺序为______.
A.先加入NaOH,后加入Na2CO3,再加入钡试剂
B.先加入NaOH,后加入钡试剂,再加入Na2CO3
C.先加入钡试剂,后加入NaOH,再加入Na2CO3
D.先加入钡试剂,后加入Na2CO3,再加入NaOH
(6)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______(填写操作名称)、冷却、过滤除去NaCl.
(7)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应,Cl2和NaOH溶液充分接触,产物是NaClO和氯化钠和水,请写出Cl2和NaOH溶液反应的化学方程式______. 猫空爱晴1年前1
猫空爱晴1年前1 -
 yreyeewr 共回答了19个问题
yreyeewr 共回答了19个问题 |采纳率84.2%解题思路:(1)可根据粗盐的成分及有关化学式的意义和书写要求进行解答.
(2)加入氢氧化钠主要是除去镁离子.
(3根据图可看出电解氯化钠溶液的生成物,结合质量守恒定律定律配平即可.根据生成物的性质分析溶液pH的变化.(4)除杂的要求一般所加试剂最好是不引进新的杂质离子.
(5)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析.
(6)根据氯化钠的溶解度随温度变化不大的特征进行分析.
(7)根据题中所给反应物和生成物,配平即可.(1)粗盐来源于海水,还含有泥沙等不溶性杂质.一般数字写在化学式前面表示个数,写在右下角表示组成中原子的个数,写在右上角表示离子的电荷,但正负号要写在数字的右边.
故答案为:①不溶性杂质;②2Cl2 ③Na+ (Mg2+ Ca2+ );④H;⑤Na2SO4
(2)加入氢氧化钠主要是除去氯化镁,发生的反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
故答案为:除去氯化镁(镁离子).
(3)由图可看出电解氯化钠溶液的生成物有氯气、氢气和氢氧化钠,配平方程式为2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2 ↑因为有强碱氢氧化钠生成,所以电解后溶液的pH升高.
故答案为:2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2 ↑;升高.
(4)如选用B选项的Ba(NO3)2,会引入硝酸根,很难除去,所以B选项不正确.
故选AC.
(5)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去,加入加入Na2CO3的顺序必须在加入钡离子的后面即可,分析四个选项可知BCD三个都符合题意.
故答案为:BCD.
(6)因为氯化钠的溶解度随温度变化不大,所以可以采用蒸发溶剂法结晶,除去氢氧化钠中的氯化钠.
故填:蒸发.
(7)题中给出了反应物为Cl2和NaOH,产物是NaClO和氯化钠和水,根据质量守恒定律配平即可.
故答案为:2NaOH+Cl2 ═NaClO+NaCl+H2O.点评:
本题考点: 物质的相互转化和制备;混合物的分离方法;蒸发与蒸馏操作;溶液的酸碱性与pH值的关系;氯化钠与粗盐提纯;盐的化学性质;化学符号及其周围数字的意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力.1年前查看全部
- 工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2.无隔膜法电解冷的食盐水相应的离子方程式为Cl-+H2O
ClO-+H2↑电解 .Cl-+H2O.
ClO-+H2↑电解 .
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
①经精制的饱和NaCl溶液应从图中电解池的______(填写“左”或“右”)池注入.
②图中X是______(填化学式);乙中右室的电极反应式为:______,图示中氢氧化钠溶液质量分数a%与b%的关系是______(填字母).
A.a%=b%B.a%>b% C.a%<b%
③甲中的离子交换膜为______(填“阳离子交换膜”或“阴离子交换膜”).
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:
下列说法中,不正确的是______(填字母)溶质 Na2CO3 NaHCO3 NaClO NaHSO3 pH 11.6 9.7 10.3 5.2
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) 风江雪1年前1
风江雪1年前1 -
 wanxee 共回答了16个问题
wanxee 共回答了16个问题 |采纳率93.8%解题思路:(1)电解饱和食盐水产物是氢氧化钠、氢气和氯气,氯气还可以和氢氧化钠之间反应得到氯化钠、次氯酸钠和水;
(2)①根据物质的转化情况,电解池的左池是可以得到氢氧化钠来判断饱和NaCl溶液的进入情况;
②在燃料电池中,所以通入空气的极是正极,氧气发生得电子的还原反应,通入燃料的极是负极,氢氧燃料电池最后产生的是水,能将电解质稀释,据此回答判断;
③a.根据氯气和水的反应平衡移动的影响因素来回答;
b.盐的水解都对水的电离起到促进作用,水解规律:越弱越水解;
c.酸的酸性越强,则pH越小,酸的电离平衡常数可以反映酸的强弱;
d.根据亚硫酸氢钠溶液显示酸性,则阴离子的电离程度大于其水解程度,据此回答判断.(1)电解饱和食盐水产物是氢氧化钠、氢气和氯气,氯气还可以和氢氧化钠之间反应得到氯化钠、次氯酸钠和水,整个过程发生的反应是:Cl-+H2O
电解
.
ClO-+H2↑,故答案为:Cl-+H2O
电解
.
ClO-+H2↑;
(2)①根据物质的转化情况,电解池的左池是电解食盐水得到的氢氧化钠,所以经精制的饱和NaCl溶液应从图中电解池的左池进入,故答案为:左;
②在燃料电池中,氧气作正极,所以通入空气的极是正极,电极反应式为:O2+4e-+2H2O=4OH-,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%小于b%,故答案为:Cl2;O2+4e-+2H2O=4OH-;C;
③根据题意:装置中所用的离子膜都只允许阳离子通过,所以均是阳离子交换膜,故答案为:阳离子交换膜;
(3)a.向氯水中加入NaHCO3,可以和盐酸之间反应,促使氯气和水的反应平衡正向移动,增大氯水中次氯酸的浓度,故a正确;
b.四种溶液中,盐中酸根离子水解程度越大,则水的电离程度越大,碱性越强,水解程度越大,即水的电离程度最大的是Na2CO3,故b错误;
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,酸性顺序是:H2SO3>H2CO3>HClO,pH最大的是HClO,故c错误;
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故d错误.
故选bcd.点评:
本题考点: 电解原理.
考点点评: 本题考查学生电解池的工作原理以及溶液中的电离平衡和水解平衡的应用知识,属于综合知识的考查,综合性强,难度大.1年前查看全部
- (2014•海南模拟)氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
(2014•海南模拟)氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
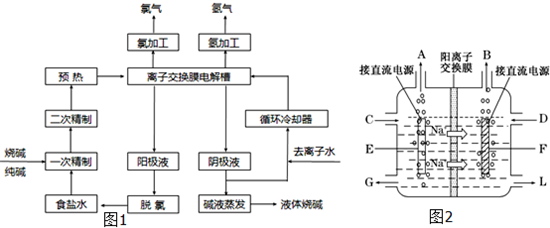
(1)该流程中可以循环的物质是______.
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果______.
(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成).则B处产生的气体是______,E电极的名称是______.电解总反应的离子方程式为2Cl-+2H2O
Cl2↑+H2↑+2OH-电解 .2Cl-+2H2O.
Cl2↑+H2↑+2OH-电解 .
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为______.
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为______. 麦芽拔拔拔1年前1
麦芽拔拔拔1年前1 -
 天慈-- 共回答了19个问题
天慈-- 共回答了19个问题 |采纳率78.9%解题思路:(1)根据工艺流程图结合电解工艺的原料以及产物知识来判断;
(2)除去钙离子使用碳酸钠试剂,除去镁离子使用氢氧化钠试剂,根据处理后的盐水中还含有少量杂质离子对装置的影响角度来回答;
(3)电解池中,阳离子移向阴极,根据电极反应确定产物,根据电解池的工作原理来书写方程式;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(5)计算生成NaOH的质量,根据理论耗电量和实际耗电量计算.(1)根据工艺流程图结中用到的原料以及产物,可以知道氯化钠、氢氧化钠是可以循环使用的,故答案为:氯化钠、氢氧化钠;
(2)除去钙离子使用碳酸钠试剂,Ca2++CO32-=CaCO3↓除去镁离子使用氢氧化钠试剂,Mg2++2OH-=Mg(OH)2↓,处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,碱性条件下会生成沉淀,对装置中的交换膜产生影响,
故答案为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;
(3)电解池中,阳离子钠离子移向阴极,所以B是电源的负极,A是正极,E是阳极,在阴极上产生的是氢气,电解饱和食盐水的原理方程式为:2Cl-+2H2O
电解
.
Cl2↑+H2↑+2OH-,故答案为:H2;阳极;2Cl-+2H2O
电解
.
Cl2↑+H2↑+2OH-;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,即Na2SO3+Cl2+H2O=Na2SO4+2HCl,故答案为:Na2SO3+Cl2+H2O=Na2SO4+2HCl;
(5)烧碱溶液质量为1.342×103kg/m3×113m3=1.516×105kg,
m(NaOH)=1.516×105kg×32%=4.85×104kg,
则理论上需要电流量为
4.85×107g
1.492g=3.252×107A,
则实际上耗电量为1.45×104A×8×300=3.48×107A,
该电解槽的电解效率为[3.252/3.48]×100%=93.45%,
故答案为:93.45%.点评:
本题考点: 氯碱工业;电解原理.
考点点评: 本题以氯碱工业为载体,考查学生生化学工艺流程题的解题方法知识,注意电解池的工作原理的灵活应用是关键,难度不大.1年前查看全部
- (2014•西宁模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
(2014•西宁模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
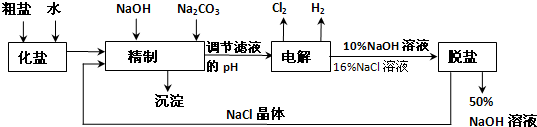
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为______.
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为______.
(3)精制过程要除去SO42-,可选择下列溶液中的______(填字母序号)
a.Ba(OH)2 b.Ba(NO3)2c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:______.
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、______、______(填操作名称)而制得50%的NaOH溶液.
(6)写出电解饱和食盐水的离子方程式:2Cl-+2H2O
2OH-+H2↑+Cl2↑电解 .2Cl-+2H2O.
2OH-+H2↑+Cl2↑电解 . dhgd1年前1
dhgd1年前1 -
 hqh6220 共回答了20个问题
hqh6220 共回答了20个问题 |采纳率75%解题思路:(1)在电解过程中,与电源正极相连的电极发生:2Cl--2e-=Cl2↑,与电源负极相连的电极发生2H++2e-=H2↑;
(2)精制过程就是将杂质离子转化为沉淀除去的过程,Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;当加入多种除杂试剂时,后面的试剂要为前面的操作去除残余,所以就要注意考虑先后的顺序,为有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(4)依据沉淀溶解平衡平衡移动影响因素分析,结合溶解度分析判断;
(5)根据氢氧化钠和氯化钠的溶解度随温度的变化关系来确定实现氯化钠和氢氧化钠分离获得氯化钠的方法;
(6)电解饱和食盐水生成氯气、氢气和氢氧化钠.(1)电解饱和食盐水的反应:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气,电极反应式为2H++2e-=H2↑,氢气的电子式为H:H,
故答案为:H:H;
(2)Mg2+和NaOH反应转化为沉淀,离子反应为:Mg2++2OH-═Mg(OH)2↓,
故答案为:Mg2++2OH-═Mg(OH)2↓;
(3)除杂的基本原则是除杂而不引杂,就是不能引入新的杂质.对于该混合物而言,氢氧根离子和氯离子都不是杂质,
而硝酸根离子却是杂质,所以可以选用氢氧化钡,也可以选用氯化钡,但是不能选用硝酸钡,
故答案为:ac;
(4)由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s)⇌Ba2+(aq)+CO32- (aq)平衡正向移动,生成更难溶的BaSO4沉淀;
故答案为:由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s)⇌Ba2+(aq)+CO32- (aq)平衡正向移动,生成更难溶的BaSO4沉淀;
(5)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,所以氢氧化钠和氯化钠分离的方法是:通过加热蒸发、冷却、结晶、过滤除去NaCl,
故答案为:结晶;过滤;
(6)电解饱和食盐水生成氯气、氢气和氢氧化钠,其反应为2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,该反应中NaCl与NaOH完全电离,则该反应的离子反应为
2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑.点评:
本题考点: 氯碱工业.
考点点评: 本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.1年前查看全部
- 含氢氧化钠的废液可用于吸收氯碱厂尾气中的氯化氢气体 属于什么反映
 轻笑浅1年前1
轻笑浅1年前1 -
 benq062 共回答了16个问题
benq062 共回答了16个问题 |采纳率100%NaOH + HCl = NaCl + H2O 中和反应,也是复分解反应1年前查看全部
- (15分)海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都可来自于海水。
(15分)海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都可来自于海水。

Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式 。
(2)图甲中流出的b是 溶液。
(3)石棉隔膜的作用是 。
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是_______、______________。
(2)已知一个电子的电量是1.602×10 -19C ,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×10 5 C的电量时,生成NaOH_ g。
Ⅲ.下图是工业上生产镁的流程。
(1)写出下列反应的化学方程式:
①沉淀池: ; ②电解: ;
(2)整个生产流程中循环使用的物质是 。
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项: 。 小雨春寒1年前1
小雨春寒1年前1 -
 河西虎咆 共回答了24个问题
河西虎咆 共回答了24个问题 |采纳率79.2%1年前查看全部
- 废硫酸提纯这里说的废硫酸是氯碱厂的废硫酸,浓度大约在75%--80%,含有水、氯气等物资.需要提纯至95%--98%,当
废硫酸提纯
这里说的废硫酸是氯碱厂的废硫酸,浓度大约在75%--80%,含有水、氯气等物资.需要提纯至95%--98%,当然在成本低的情况下浓度越高越好.技术转让、合作均可. shenyiemily1年前1
shenyiemily1年前1 -
 收声 共回答了19个问题
收声 共回答了19个问题 |采纳率100%到目前为止,好像还没有这样的技术,最好的蒸发法只能到86%左右,而且设备价格昂贵.1年前查看全部
- 工业上制取氯气大多采用电解食盐水的方法,以此为基础的工业称为“氯碱工业”,它是化工工业的一个重要支柱.电解氯化钠溶液时,
工业上制取氯气大多采用电解食盐水的方法,以此为基础的工业称为“氯碱工业”,它是化工工业的一个重要支柱.电解氯化钠溶液时,两电极上分别产生氯气和氢气,并在溶液中生成氯化钠,该反应的化学方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑通电 .
某小型氯碱厂采用电解氯化钠溶液的方法生产氯气、氢气和氢氧化钠.该工厂平均每天生产80%的氢氧化钠15t.试问:
(1)该工厂平均每天至少需要多少吨的氯化钠?
(2)理论上,该工厂平均每天生产标准状况下的氯气的体积为多少升? weigy1年前1
weigy1年前1 -
 zxhyxcz 共回答了23个问题
zxhyxcz 共回答了23个问题 |采纳率87%解题思路:(1)根据化学反应方程式,将氢氧化钠的质量代入计算来求需要的氯化钠;
(2)先利用化学反应方程式,将氢氧化钠的质量代入计算氯气的质量,再计算其标准状况下的体积.(1)设该工厂每天至少需要氯化钠的质量为x,可生产氯气的质量为y,则
2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑
117 80 71
x 80%×15t y
[117/80]=[x/80%×15%]
解得x=17.55t,
答:该工厂平均每天至少需要17.55吨的氯化钠;
(2)[80/71]=[80%×15t/y],解得y=10.65t,
氯气的物质的量为
10.65×106
71g/mol=0.15×106mol,
则该工厂平均每天生产标准状况下的氯气的体积为0.15×106mol×22.4L/mol=3.36×106L,
答:该工厂平均每天生产标准状况下的氯气的体积为3.36×106L.点评:
本题考点: 电解原理;化学方程式的有关计算.
考点点评: 本题考查学生利用电解的化学反应方程式来计算,较简单,学生将氯化钠的质量代入化学反应方程式计算即可.1年前查看全部
- (2012•曲阜市模拟)以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一
(2012•曲阜市模拟)以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制.以粗盐为原料的“氯碱工业”流程如下:

回答下列问题:
(1)操作④的名称是______.
(2)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3,溶液必须在BaCl2溶液之______(填“前”或“后”)加入,原因是______,有同学提出用______溶液代替BaCl2溶液可达到同样的目的.
(3)电解饱和NaCl溶液的化学方程式是2NaCl+2H2O
2NaOH+H2↑+Cl2↑通电 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑通电 . chenjing09081年前1
chenjing09081年前1 -
 宝贝乐乐爱 共回答了20个问题
宝贝乐乐爱 共回答了20个问题 |采纳率95%解题思路:根据题干提供的信息结合物质的性质进行分析,要将氯化钠溶液变成氯化钠的饱和溶液,可以采用加热蒸发的方法;在除去氯化钠中混有的可溶性杂质时,所加入的试剂反应后不能引入新的杂质,后面加的试剂要能把前面加的多余的试剂除掉,据此解答即可.(1)氯化钠溶液经过操作④得到了氯化钠的饱和溶液,则该操作是蒸发,故填:蒸发;
(2)Na2CO3,溶液必须在BaCl2溶液之后,以便把多余的氯化钡溶液反应掉,防止含有新的杂质,要除去硫酸根离子,还可以使用氢氧化钡溶液,反应后能生成硫酸钡沉淀和氢氧化钠,生成的氢氧化钠能在后面加入盐酸时反应生成氯化钠,故填:后,Na2CO3可以与过量的BaCl2反应,转变成NaCl和BaCO3沉淀,Ba(OH)2;
(3)电解饱和氯化钠溶液,能生成氢氧化钠、氯气和氢气,故填:2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑.点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题考查了常见物质间的转化,完成此题,可以依据已有的物质的性质进行.书写反应的化学方程式要注意配平.1年前查看全部
- (2013•高淳县二模)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
(2013•高淳县二模)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)电解时发生的主要化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑通电 .2NaCl+2H2O;
2NaOH+H2↑+Cl2↑通电 .
(2)工业食盐含Ca2+、Mg2+等杂质,加入NaOH、Na2CO3的目的就是为了除去这些杂质,但如果精制时发现其中SO42-含量也较高,必须添加含钡离子的试剂(简称钡试剂)除去SO42-,该试剂可以是______(选填:a、b、c).
a.Ba(OH)2b.Ba(NO3)2c.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为______(选填:a、b、c);
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)NaOH和NaCl的溶解度如下表所示:
脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______(填操作名称)、冷却等操作除去大部分NaCl.温度/℃ 0 10 20 30 40 50 60 70 80 90 100 NaCl溶解度/g 35.7 35.8 36.0 36.3 36.6 37 37.3 37.8 38.4 39.0 39.8 NaOH溶解度/g 42 51 109 119 129 145 174 299 314 329 347
(5)电解时,若与电源正、负极相连的两极区域没有分隔,电解产物就变为了NaClO和H2,相应的化学方程式为NaCl+H2O
NaClO+H2↑通电 .NaCl+H2O.
NaClO+H2↑通电 . s8u4n11年前1
s8u4n11年前1 -
 茅庐小童 共回答了20个问题
茅庐小童 共回答了20个问题 |采纳率100%解题思路:从要求问题的问题去看题干和需要解题的突破口:
(1)电解时,出现了氢气和氯气,同时右侧出现了氢氧化钠,而同时出现的氯化钠是原有物质,所以可以判定:氢气、氯气和氢氧化钠是生成物.原物质是氯化钠溶液,根据质量守恒定律可知,一定应该有氯化钠,同时氢气的生成说明水也是反应物.(2)除杂的基本原则是除杂而不引杂,就是不能引入新的杂质.
(3)当加入多种除杂试剂时,后面的试剂要为前面的操作去除残余,所以就要注意考虑先后的顺序.
(4)由于本操作目的是得到食盐晶体,而表中可以看出氯化钠的溶解度随温度变化不明显,因此分离氯化钠应该是蒸发溶剂,而不是降温.
(5)电解产物就变为了NaClO和H2,根据质量守恒定律,反应物应该是含有钠元素、氯元素、氢元素和氧元素,根据原物质可以判定反应物应该是氯化钠和水.这个反应说明控制反应条件和环境的重要性.(1)电解时,出现了氢气和氯气,同时右侧出现了氢氧化钠,而同时出现的氯化钠是原有物质,所以可以判定:氢气、氯气和氢氧化钠是生成物.原物质是氯化钠溶液,根据质量守恒定律可知,一定应该有氯化钠,同时氢气的生成说明水也是反应物.生成氢气和氯气都需要注明气体符号,反应为:2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑.(通电是条件,电解是过程和操作,注意区别)
(2)除杂的基本原则是除杂而不引杂,就是不能引入新的杂质.对于该混合物而言,氢氧根离子和氯离子都不是杂质,而硝酸根离子却是杂质,所以可以选用氢氧化钡,也可以选用氯化钡,但是不能选用硝酸钡,故答案是ac.
(3)当加入多种除杂试剂时,后面的试剂要为前面的操作去除残余,所以就要注意考虑先后的顺序.由于碳酸根离子和钡离子能够反应产生沉淀,也就是最后加入碳酸钠利于除去可能会过量的钡离子,所以碳酸钠应该放在最后.其余的试剂先后顺序没有明显的影响.故选bc.
(4)由于本操作目的是得到食盐晶体,而表中可以看出氯化钠的溶解度随温度变化不明显,因此分离氯化钠应该是蒸发溶剂,而不是降温.
(5)电解产物就变为了NaClO和H2,根据质量守恒定律,反应物应该是含有钠元素、氯元素、氢元素和氧元素,根据原物质可以判定反应物应该是氯化钠和水.NaCl+H2O
通电
.
NaClO+H2↑..
故答案为:(1)2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑;(2)ac; (3)bc; (4)蒸发结晶;(5)NaCl+H2O
通电
.
NaClO+H2↑.点评:
本题考点: 物质的相互转化和制备.
考点点评: 学会灵活处理信息和问题,信息量不大时,可以选择从信息入手去慢慢按照顺序去做题,当信息量较大较杂时,不妨先看问题,根据问题去到信息中寻找对应的信息用于解题即可.1年前查看全部
- 下列说法不正确的是 [ ] A.中学化学教材中的三大化工生产:氯碱工业、
下列说法不正确的是 [ ]A.中学化学教材中的三大化工生产:氯碱工业、硫酸工业、合成氨工业过程中均涉及氧化还原反应
B.人造纤维、合成纤维是有机高分子化合物,光导纤维是一种 新型无机非金属材料
C.北京奥运会上的“脚印”和烟花,让世界为之欢呼、倾倒燃放烟花过程中涉及“焰色反应”等相关变化,均属于物理变化
D.广州第16届亚运会积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类 可降解塑料,有利于节能减排、改善环境质量
可降解塑料,有利于节能减排、改善环境质量  lydtl1年前1
lydtl1年前1 -
 玛特的1002kk 共回答了19个问题
玛特的1002kk 共回答了19个问题 |采纳率94.7%C1年前查看全部
- 电解池的应用:氯碱工业中,为什么要电解饱和食盐水?解释通俗易懂点.
 feiniao9531年前1
feiniao9531年前1 -
 黑蝙蝠中队 共回答了16个问题
黑蝙蝠中队 共回答了16个问题 |采纳率100%在食盐水里氯化钠完全电离,水分子是微弱电离的,因而存在着Na+、H+、Cl-、OH-四种离子.
接通直流电源后,带负电的OH-和Cl-移向阳极,带正电的Na+和H+移向阴极.
在阳极,Cl-比OH-容易失去电子被氧化成氯气.
2Cl--2e=Cl2↑(氧化反应)
在阴极,H+比Na+容易得到电子,因而H+不断从阴极获得电子放出氢气.
2H++2e=H2↑ (还原反应)
由于H+在阴极上不断得到电子而生成氢气放出,溶液里OH-的数目相对地增多了.因而阴极附近形成了氢氧化钠的溶液.电解饱和食盐水的总的化学方程式可以表示如下:
2NaCl+2H2O===电解====2NaOH+H2↑+Cl2↑1年前查看全部
- 氯碱工业中,食盐水的精制除杂顺序
 风之凋1年前1
风之凋1年前1 -
 eelemon 共回答了25个问题
eelemon 共回答了25个问题 |采纳率96%通常用BaCl2除去SO42-,Na2CO3除去Ca2+,NaOH除去Mg2+.基本步骤为:
①粗盐溶解、沉降除去泥沙;②加入过量的氯化钡除去硫酸根离子;③再加入过量氢氧化钠溶液除去镁离子;④加入过量碳酸钠溶液除去钙离子;⑤过滤所有沉淀;⑥然后加入适量盐酸除去过量的碳酸根离子和氢氧根离子;⑦将溶液通过阳离子交换塔以进一步除去少量的钙离子和镁离子,得到精制的食盐水.1年前查看全部
- 如图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
如图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是

A.烧瓶中立即出现白烟 B.烧瓶中立即出现红棕色 C.烧瓶中发生的反应表明常温下氨气有还原性 D.烧杯中的溶液是为了吸收有害气体  小白菜妹妹1061年前1
小白菜妹妹1061年前1 -
 hljys 共回答了19个问题
hljys 共回答了19个问题 |采纳率89.5%B
1年前查看全部
- 某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:

(1)写出工业上电解食盐水反应的化学方程式2NaCl+2H2 O
2NaOH+H2↑+Cl2↑通电 .2NaCl+2H2 O.
2NaOH+H2↑+Cl2↑通电 .
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:______.
(3)已知:①Mg(s)+Cl2(g)═MgCl2(s);△H=-641kJ•mol-1
②Ti(s)+2Cl2(g)═TiCl4(s);△H═-770kJ•mol-1
则2Mg(s)+TiCl4(g)═2MgCl2(s)+Ti(s);△H═______,反应2Mg+TiCl4
2MgCl4+Ti在Ar气氛中进行的理由是______.800℃ .
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中正极上的电极反应式是______,负极区的pH______(填“增大”、“减小”、“不变”). lllpg6261年前1
lllpg6261年前1 -
 如今1 共回答了15个问题
如今1 共回答了15个问题 |采纳率93.3%解题思路:(1)电解食盐水生成NaOH、H2和Cl2,以此书写离子方程式;
(2)钛铁矿经氯化得到四氯化钛、氯化铁和一氧化碳;依据原子守恒配平写出;
(3)根据盖斯定律,①×2-②可得;Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化;
(4)碱性甲醇电池中,O2在正极得电子发生还原反应,负极甲醇消耗氢氧根离子生成碳酸盐;(1)电解食盐水生成NaOH、H2和Cl2,反应的化学方程式为:2NaCl+2H2 O
通电
.
2NaOH+H2↑+Cl2↑;
故答案为:2NaCl+2H2 O
通电
.
2NaOH+H2↑+Cl2↑;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2 =2FeCl3+2TiCl4+6CO;
(3)反应2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)可看做反应①×2-②得到,根据盖斯定律得△H-641kJ/mol×2-(-770 kJ/mol)=-512kJ•mol-1,反应2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化;
故答案为:-512 kJ•mol-1;Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化;
(4)碱性甲醇电池中,O2在正极得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,负极电极反应为:CH3OH-6e-+OH-=CO32-+H2O,负极附近消耗氢氧根离子,溶液PH减小;
故答案为:O2+2H2O+4e-=4OH-,减小;点评:
本题考点: 热化学方程式;原电池和电解池的工作原理;电解原理.
考点点评: 本题考查化学方程式的书写及计算、盖斯定律等,题目难度中等,注意根据盖斯定律解题.1年前查看全部
- (安徽省巢湖市一中2007—2008学年度第一学期第四次月考,化学,3)某氯碱车间为检验氯气管道是否漏气,以防氯气中毒,
(安徽省巢湖市一中2007—2008学年度第一学期第四次月考,化学,3)某氯碱车间为检验氯气管道是否漏气,以防氯气中毒,通常选用下列试剂中的
A.浓氨水 B.AgNO 3 溶液 C.烧碱溶液 D.淀粉溶液  sharkwu20051年前1
sharkwu20051年前1 -
 g56789g 共回答了14个问题
g56789g 共回答了14个问题 |采纳率64.3%A
为检验氯气管道是否漏气,常选用浓氨水,氯气与浓氨水反应生成白烟氯化铵,现象明显。1年前查看全部
- 下列不属于海水资源开发与利用的是 [ ] A.由海水发展氯碱
下列不属于海水资源开发与利用的是 [ ]A.由海水发展氯碱工业
B.从海水中开发海洋药物
C.利用潮汐能、波浪能发电
D.从海底开采多金属结核矿 雅典小丑1年前1
雅典小丑1年前1 -
 柳思雨 共回答了18个问题
柳思雨 共回答了18个问题 |采纳率88.9%D1年前查看全部
- (2009•广州模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
 (2009•广州模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
(2009•广州模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
(1)精制过程中反应的离子方程式为______.
(2)电解过程的总反应方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑电解 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑电解 .
(3)电解槽阳极产物可用于______(至少写出两种用途).
(4)已知NaOH、NaCl在水中的溶解度数据如下表:
根据上述数据,脱盐的主要工序应为______、______.脱盐后的碱液含NaOH约50%,含NaCl仅约2%左右,NaCl能够从溶液中大量析出的原因是______.温度/℃ 20 30 40 50 60 70 80 90 100 NaOH/g 109 118 129 146 177 300 313 318 337 NaCl/g 36 36.3 36.6 37 37.3 37.8 38.4 39 39.8  FW福王1年前1
FW福王1年前1 -
 森灵公主 共回答了21个问题
森灵公主 共回答了21个问题 |采纳率100%解题思路:(1)精制过程就是将杂质离子转化为沉淀除去的过程;
(2)电解饱和食盐水可以获得三大工业原料:氢氧化钠、氢气、氯气;
(3)电解池中阳极是阴离子发生失电子的氧化反应,根据氯气的用途来回答;
(4)根据氢氧化钠和氯化钠的溶解度随温度的变化关系来确定实现氯化钠和氢氧化钠分离获得氯化钠的方法.(1)精制过程中,加入氯化钡,可以将杂质离子硫酸根除去,即Ba2++SO42-=BaSO4↓,加入氢氧化钠,可以将杂质离子镁离子除去,即Mg2++2OH-=Mg(OH)2↓,加入碳酸铵,即可以将杂质钙离子除去,还可以将多余的钡离子除去,即Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,
故答案为:Ba2++SO42-=BaSO4↓,Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;
(2)电解饱和食盐水可以获得三大工业原料:氢氧化钠、氢气、氯气,电解反应方程式为:2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑;
(3)电解池中阳极是氯离子发生失电子的氧化反应生成氯气的过程,氯气的用途:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等,
故答案为:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种);
(4)根据表中数据可以得出:氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,固始县氢氧化钠和氯化钠分离的方法是:蒸发浓缩结晶的过程,脱盐后的碱液中会含有氯化钠晶体,因为发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动,
故答案为:蒸发;浓缩;蒸发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动(或:Na+浓度显著增加抑止了NaCl的溶解).点评:
本题考点: 氯碱工业.
考点点评: 本题是一道化学和工业生产相结合的知识题目,考查的知识点较多,是一道综合题目,难度不大.1年前查看全部
- 某氯碱厂打算利用电解食盐水所得气体生产盐酸.
某氯碱厂打算利用电解食盐水所得气体生产盐酸.
电解食盐水制取H2、Cl2的化学方程:2NaCl+2H20=H2+CL2+2NAOH,若该氯碱厂日产50%naoh溶液3000kg.如果把同时生产的cl2和h2都制成38%的盐酸,试计算理论上每天可生产盐酸的质量 davidwater1年前1
davidwater1年前1 -
 qiyuecho 共回答了24个问题
qiyuecho 共回答了24个问题 |采纳率95.8%2NaCl+2H20=H2+CL2+2NAOH
H2+Cl2 ==2HCl
则 NaOH ~~~~HCl
40 36.5
3000*50% x*38%
x==3000*50%*36.5/40/38%==3602 Kg
即盐酸 3602 KG1年前查看全部
- 氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠.其中氯气用途十分广泛,除用于净水、环境消毒外,还
氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠.其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅、聚氯乙烯、氯苯等.
(1)工业上可用氯气和石灰乳为原料制造漂白粉,漂白粉为______(填“纯净物”或“混合物”),制备漂白粉的化学方程式为______.
(2)工业上生产半导体材料硅的流程如图所示:
①石英砂的主要成分是二氧化硅,在制备粗硅时,焦炭的作用是______.(填“氧化剂”或“还原剂”)
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性杂质,必须进行分离提纯.其提纯方法为______.(填字母)
A.蒸馏B.过滤C.萃取D.蒸发
③四氯化硅与氢气在高温条件下反应得到高纯硅和氯化氢气体,写出该反应的化学方程式:SiCl4+2H2
Si+4HCl↑高温 .SiCl4+2H2.
Si+4HCl↑高温 . 笨鸟10231年前1
笨鸟10231年前1 -
 南亚丫头 共回答了21个问题
南亚丫头 共回答了21个问题 |采纳率90.5%解题思路:(1)漂白粉的主要成分为氯化钙、次氯酸钙,利用氯气与石灰乳制备漂白粉;
(2)①石英砂的主要成分是二氧化硅,制备粗硅发生SiO2+2C
Si+2CO↑,C元素的化合价升高;高温 .
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性杂质,利用沸点差异分离;
③四氯化硅与氢气在高温条件下反应得到高纯硅和氯化氢气体,以此书写化学反应.(1)漂白粉的主要成分为氯化钙、次氯酸钙,则漂白粉为混合物,利用氯气与石灰乳制备漂白粉,该反应为Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:混合物;Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
(2)①石英砂的主要成分是二氧化硅,制备粗硅发生SiO2+2C
高温
.
Si+2CO↑,C元素的化合价升高,则焦炭作还原剂,故答案为:还原剂;
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性杂质,因沸点不同,则分离提纯法选蒸馏法,故答案为:A;
③四氯化硅与氢气在高温条件下反应得到高纯硅和氯化氢气体,该反应为SiCl4+2H2
高温
.
Si+4HCl↑,故答案为:SiCl4+2H2
高温
.
Si+4HCl↑.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;制备实验方案的设计.
考点点评: 本题考查氯、硅及其化合物的性质,涉及氧化还原反应、化学反应方程式的书写、混合物的分离提纯等,注重常考考点的考查,题目难度中等.1年前查看全部
- (2013•徐州模拟)某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
 (2013•徐州模拟)某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
(2013•徐州模拟)某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaClO;氯气与热的氢氧化钠溶液反应可生成NaClO和NaClO3.②在酸性较弱时KI只能被NaClO氧化,在酸性较强时亦能被NaClO3氧化.
(1)该小组利用如右图所示装置制取家用消毒液(主要成分为NaClO),a得到了氢气,则a为______(填“阳极”或“阴极”).生成NaClO的离子方程式为______.
(2)该小组将0.784L(标准状况)Cl2通入50.00mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0mL.
①取稀释后的溶液25.00mL用醋酸酸化,加入过量KI溶液.用0.2000mol•L-1 Na2S2O3溶液滴定:I2+2S2O32-═2I-+S4O62-,消耗Na2S2O3溶液10.00mL时恰好到达终点.
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00mL.
①操作②中氯酸钠与碘化钾反应的离子方程式为______.
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为______.
③计算氢氧化钠溶液的物质的量浓度. bewaittm1年前1
bewaittm1年前1 -
 66292916 共回答了21个问题
66292916 共回答了21个问题 |采纳率95.2%解题思路:(1)电解饱和食盐水,生成了氢气和氯气;a得到了氢气,溶液中产生了氢氧根,发生了还原反应,故A为阴极,生成NaClO的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O;
(2)①在酸性较强I-能被NaClO3氧化成碘单质,反应方程式是:ClO3-+6I-+6H+═3I2+Cl-+3H2O;
②根据反应方程找出关系式ClO-~2I-~I2~2S2O32-、ClO3-~6I-~3I2 ~6S2O32-,然后计算出次氯酸钠和氯酸钠的物质的量;
③根据氯原子守恒,n(Cl)=n(NaOH)计算出氢氧化钠的物质的量,溶液体积是0.05L,带入公式:c(NaOH)=
,求出氢氧化钠溶液中氢氧化钠的物质的量浓度.n(NaOH) 0.05L (1)a极生成了氢氧根,溶液中水电离的氢离子得到电子被还原,a为阴极,反应生成NaClO的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:阴极;Cl2+2OH-═Cl-+ClO-+H2O;
(2)①酸性较强条件下,ClO3-将I-氧化成I2,根据化合价升降相等配平,反应的化学方程式是:ClO3-+6I-+6H+═3I2+Cl-+3H2O;
故答案为:ClO3-+6I-+6H+═3I2+Cl-+3H2O;
②用醋酸酸化,只有次氯酸钠氧化碘化钾,消耗Na2S2O3溶液10.00mL,根据关系式:ClO-~2I-~I2~2S2O32-
n(NaClO)=n(I2)=[1/2]×n(S2O32-)=[1/2]×0.2000mol/L×0.010L=0.001mol;
用盐酸酸化至强酸性,氯酸钾氧化碘化钠,消耗Na2S2O3溶液30.00mL;根据关系式:ClO3-~6I-~3I2 ~6S2O32-,
n(NaClO3)=[1/3]×n(I2)=[1/6]×n(S2O32-)=[1/6]×0.2000mol/L×0.03L=0.001mol;
故n(NaClO):n(NaClO3)=1:1;
故答案为:1:1;
③0.784L(标准状况)Cl2 的物质的量是:0.784 L÷22.4 L•mol-1=0.035mol;
根据关系式:Cl2~2NaOH,
1 2
n(NaOH)=2n(Cl2)=0.035mol×2=0.07mol,
c(NaOH)=[0.07mol/0.05L]=1.4mol/L,
故答案为:c(NaOH)=1.4mol/L.点评:
本题考点: 氯碱工业;氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查了电极反应、次氯酸钠、氯酸钠的性质,涉及了较多的计算,成分考查了化学计算能力,可以找出关系式进行求解,本题难度中等.1年前查看全部
- 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请
 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:______.
(2)石墨电极(C)的电极反应式为______.
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体体积为______ L.
(4)铜丝a处在开始一段时间的现象为______;原因是______.
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是______.
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为______. blueboy_xp1年前1
blueboy_xp1年前1 -
 xxhlzx 共回答了20个问题
xxhlzx 共回答了20个问题 |采纳率95%解题思路:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应.
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨是阳极,阳极上氯离子失电子发生氧化反应;
(3)根据串联电池中转移电子数相等计算铁电极上生成氢气的体积;
(4)a为阴极,阴极发生还原反应生成氢气,促进水的电离;
(5)铜的精炼时,粗铜为阳极,纯铜为阴极;
(6)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,铜被氧化,应为负极,正极上氧气被还原.(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O.
故答案为:CH4-8e-+10OH-═CO23-+7H2O;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-═Cl2↑;
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=[2.24L/22.4L/mol]×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48,
故答案为:4.48;
(4)a为阴极,发生2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红,
故答案为:溶液变红;由于2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红;
(5)电解精炼铜时利用了电解原理,电能转化为化学能,也有少量转化为热能.电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应.电解时,溶液中的阳离子向阴极移动,在阴极上得电子.粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近.此题应选b、d;
故答案为:bd;
(6)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,铜被氧化,应为负极,正极上氧气被还原,电极方程式为4H++O2+4e-═2H2O,
故答案为:4H++O2+4e-═2H2O.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查电解池和原电池知识,注意把握电化学工作原理,为高考常见题型,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,难度中等.1年前查看全部
- 海水中蕴含着80多种元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料
海水中蕴含着80多种元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人***活的各个领域.
(1)氯碱工业中发生反应的化学方程式为:2nacl+2h 2 o=2naoh+cl 2 ↑+a,则a的化学式为______.氯气常用于自来水的杀菌消毒,它与水反应生成盐酸和次氯酸(hclo),试写出该反应的化学方程式______.
(2)如图是甲、乙两种固体物质的溶解度曲线.
①p点的意义是______.
②甲物质中含有少量乙物质,提纯甲物质可用______方法(选填“降温结晶”、“蒸发结晶”之一).
③t 2 ℃时,甲的饱和溶液中溶质的质量分数是______.
 wkand1年前1
wkand1年前1 -
 家住冲坡桥头 共回答了18个问题
家住冲坡桥头 共回答了18个问题 |采纳率94.4%(1)根据质量守恒定律和氯碱工业中发生反应的化学方程式为:2NaCl+2H 2 O=2NaOH+Cl 2 ↑+A,推测A的化学式为H 2 ;根据“氯气常用于自来水的杀菌消毒,它与水反应生成盐酸和次氯酸(HClO)”,则其反应的化学方程式为:Cl 2 +H 2 O=HCl+HClO;
(2)①P点是t 1 ℃时甲、乙两物质的溶解度曲线的交点,表示的意义是在t 1 ℃时,甲、乙两物质的溶解度相等;
②从溶解度曲线可以看出:甲的溶解度变化受温度影响比乙大,所以甲物质中含有少量乙物质,可采用降温结晶的方法提纯A物质;
③从溶解度曲线可以看出,t 2 ℃时,甲的溶解度为60g,则甲的饱和溶液中溶质的质量分数=
60g
60g+100g ×100% =37.5%.
故答案为:
(1)H 2 ;Cl 2 +H 2 O=HCl+HClO;
(2)①在t 1 ℃,甲乙两物质溶解度相等;②降温结晶③37.5%1年前查看全部
- [化学-选修化学与技术]请回答氯碱的如下问题:(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品.理论上
[化学-选修化学与技术]
请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品.理论上k=______(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
①图中X、Y分别是______、______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小______;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______,负极:______;
③这样设计的主要节(电)能之处在于(写出2处)______、______. sdjnmds1年前1
sdjnmds1年前1 -
 wuqunfei 共回答了18个问题
wuqunfei 共回答了18个问题 |采纳率77.8%解题思路:(1)根据电解饱和食盐水的化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑,即可得到k=电解 .
=[71/80],以此计算;M(Cl2) 2M(NaOH)
(2)抓住除钡离子要放在除碳酸根离子前即可得到顺序关系:③①②;
(3)本题突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2;再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的X必然为Cl2;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4OH-可知NaOH浓度增大.(1)电解饱和食盐水的化学方程式为2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,则理论上k=
M(Cl2)
2M(NaOH)=[71/80]=1:1.13或0.89,
故答案为:
M(Cl2)
2M(NaOH)=[71/80]=1:1.13或0.89;
(2)应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、Fe3+等,过滤后加入盐酸可除去Na2CO3,故答案为:③①②;
(3)①通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2,则电解池左边应为阳极,生成Cl2,由于燃料电池正极发生O2+4e-+2H2O=4OH-,燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%,可知NaOH浓度增大,
故答案为:Cl2;H2;a%小于b%;
②燃料电池中正极氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,负极氢气失电子发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,
故答案为:O2+4e-+2H2O=4OH-;H2-2e-+2OH-=2H2O;
③据装置特点及反应过程可知,这样设计的优点是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗等,
故答案为:燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度.点评:
本题考点: 氯碱工业;原电池和电解池的工作原理;粗盐提纯.
考点点评: 本题前半部分基本就是氯碱工艺的再现,但后半部把原电池、电解的相关知识巧妙地融合在一起,使试题表现出了较好的创意,学习中要把氯碱工业的流程及教材电解饱和食盐水实验涉及到的各个知识点要理顺、理细,如饱和食盐水的精制、电解时的现象、电极产物检验、物质计算、电极反应式及电解反应的化学方程式书写等知识要清晰才行,避免一带而过、简单处理.1年前查看全部
- 氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是( )
氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是( )
A. H2
B. Cl2
C. Na2CO3
D. NaOH shenqin97111年前1
shenqin97111年前1 -
 碧浪一剑 共回答了12个问题
碧浪一剑 共回答了12个问题 |采纳率100%解题思路:依据质量守恒定律可知化学反应前后元素的种类一定不变,所以通过电解食盐水制取的物质元素的含有情况,必与反应物食盐水含有的元素情况相同据此回答即可;质量守恒定律可知化学反应前后元素的种类一定不变,所以通过电解食盐水制取的物质元素的含有情况,必与反应物食盐水含有的元素情况相同,分析知反应物是氯化钠和水,所以反应后的物质中只能含有钠、氯、氢和氧四种元素.
A、氢气是由氢元素组成的,符合以上关于产物情况的分析,所以氢气可能是该反应的生成物;
B、氯气由氯元素组成,符合以上关于产物情况的分析,所以氯气可能是该反应的生成物;
C、碳酸钠是由碳、氧和钠三种元素组成,由以上分析可知生成物中不可能含有碳元素,所以生成物中不可能含有碳酸钠;
D、氢氧化钠是由钠、氧和氢三种元素组成,符合以上关于产物情况的分析,所以可能是生成物;
故选C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 根据反应物和生成物的元素种类需相同,来判断生成物的情况,如果所给物质中的一种元素,在反应物中找不到,就不可能是生成物.1年前查看全部
- 氯碱工业以什么为基础制氯气
 疯孑1年前1
疯孑1年前1 -
 voita20 共回答了24个问题
voita20 共回答了24个问题 |采纳率79.2%氯化钠1年前查看全部
- 化学除杂加药品顺序是?氯碱工业中离子交换膜法制碱,为了有效除去Ca2+,Mg2+,SO4-,得到精致食盐水.加入试剂(1
化学除杂加药品顺序是?
氯碱工业中离子交换膜法制碱,为了有效除去Ca2+,Mg2+,SO4-,得到精致食盐水.加入试剂(1).NaOH,(2).Na2CO3,(3).钡试剂的合理顺序是:为什么是132或者213 无敌海景佛跳强1年前1
无敌海景佛跳强1年前1 -
 comefrombeijing 共回答了23个问题
comefrombeijing 共回答了23个问题 |采纳率95.7%钡试剂不能最后加,所以213的顺序是错的,这里加试剂的原则是钡试剂必须在碳酸钠之前加入,以便于利用碳酸钠除去过量的钡离子,至于氢氧化钠的加入时间可以随意,因为即使氢氧化钠和碳酸钠过量最后还是会用盐酸来中和,因此合理顺序为132、312或321.另在做题中为了保证一种试剂除去一种离子,通常NaOH会放在Na2CO3之前加入以先除去镁离子,即132的顺序.1年前查看全部
- 某氯碱长不慎有大量氯气溢出周围空间,此时,可以用浸有某种物质的一定浓度的水溶液的
某氯碱长不慎有大量氯气溢出周围空间,此时,可以用浸有某种物质的一定浓度的水溶液的
毛巾捂住鼻子.用KBr可以吗? 星台ll1年前1
星台ll1年前1 -
 vvx鱼 共回答了19个问题
vvx鱼 共回答了19个问题 |采纳率89.5%不可以.在日常的环境中这种置换反应根本不可能发生.个人认为可能这里指的某种物质应该是氢氧化钠等强碱类的东西,1年前查看全部
- 如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH) 2 的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH) 2 ,使用硫酸钠做电解质溶液,阳极选用 作电极。
 过眼vs云烟1年前1
过眼vs云烟1年前1 -
 ttqqTT 共回答了16个问题
ttqqTT 共回答了16个问题 |采纳率93.8%(1)CH 4 -8e - +10OH - =CO 3 2 - +7H 2 O
(2)2Cl - -2e - =Cl 2 ↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁
1年前查看全部
大家在问
- 11、组成两句不同意思的话.迟到 完全 上学 不能 小明 责怪(用词语造句)
- 2在水平地面上放置一质量为M的木块,一质量为m的子弹以水平速度v射入木块(未穿出),若木块与地面的动摩擦因数为u,求子弹射
- 3高二的数学题→_→求做
- 4根据意思填空(四年级下语第三单元) 1、形容十分恭敬的样子.( ) 2、忧愁的心情( )
- 5一小球在离地高H处从静止开始竖直下落,运动过程中受到的阻力大小与速率成正比,下列图像反映了小球的机械能E随下落高度h的变
- 6__your brother's homework.1.Here is 2.There is 为什么不是 2.There
- 7关于物质的密度,下列说法正确的是( )
- 8—The patient looks much better. ________ is it that has made
- 9bought presents是什么意思?
- 10用这几个短语造句子
- 11钢铁的密度大于水的密度,为什么钢铁制的轮船却能浮在水面上呢
- 12在化学反应2H2+2O2=(点燃)2H2O中,氢气、氧气、水之间的质量比为
- 13《石子》阅读题(自己打得好累的、呜呜呜、欲哭无泪)
- 14两数相乘,一个因数扩大10倍,另一个因数缩小20倍,积( )
- 15my view on DIY为题的英文作文




