某含铝90%的铝合金1.5g,跟40mL6mol/L的盐酸充分反应 (其它不反应),过滤除去不溶物,将滤液稀释到200m
 木棉22022-10-04 11:39:542条回答
木棉22022-10-04 11:39:542条回答(1)使滤液中的Al3+完全沉淀,所用的氨水至少要多少mL
(答案是1.68L,800mL)

已提交,审核后显示!提交回复
共2条回复
 ***2号 共回答了11个问题
***2号 共回答了11个问题 |采纳率81.8%- 用守恒法做,当Al3+完全沉淀时,溶液中的溶质只有NH4Cl.
NH4Cl的Cl-只来自于HCl,1个NH4Cl只含有1个Cl-,所以NH4Cl的物质的量=HCl的物质的量=6*0.04=0.24mol
1个NH4Cl与1个NH3·H2O都含有1个NH4+,所以NH4Cl的物质的量=NH3·H2O的物质的量=0.24mol
需要氨水的体积是V=n/c=0.24/0.3=0.8L=800mL - 1年前
 热带的寒雪 共回答了19个问题
热带的寒雪 共回答了19个问题 |采纳率- Al为1.5g*90%=1.35g(0.05mol),因为2AL~6HCl,所以盐酸反应0.15mol,剩余0.09mol。又因为1NH3H2O~1HCl,用氨水0.09mol;3NH3H2O~1Al3+,所以用氨水0.15mol,共计0.24mol。因为氨水为0.3mol/L,所以0.24/0.3=0.8L。
- 1年前
相关推荐
- 有一个质量为232g的铜铝合金球,其中含铝54g,求合金的密度为多少?(已知铜的密度为ρ铜=8.9g/cm3,铝的密度为
有一个质量为232g的铜铝合金球,其中含铝54g,求合金的密度为多少?(已知铜的密度为ρ铜=8.9g/cm3,铝的密度为ρ铝=2.7g/cm3)
 dancer12111年前1
dancer12111年前1 -
 清风龙吟 共回答了16个问题
清风龙吟 共回答了16个问题 |采纳率93.8%解题思路:已知合金球和铝的质量,可求铜的质量,根据密度公式可求铜和铝的体积,再求出总体积,总质量除以总体积就是合金球的密度.铜的质量m铜=m总-m铝=232g-54g=178g,
∵ρ=[m/V],
∴铜的体积为V铜=
m铜
ρ铜=[178g
8.9g/cm3=20cm3,
铝的体积为V铝=
m铝
ρ铝=
54g
2.7g/cm3=20cm3,
所以铜铝合金球的体积为V=V铝+V铜=20cm3+20cm3=40cm3,
合金球的密度ρ=
m总/V]=
232g
40cm3=5.8g/cm3.
答:合金球的密度为5.8g/cm3.点评:
本题考点: 密度的计算.
考点点评: 本题考查质量、体积、密度的计算,关键是公式及其变形的灵活运用,重点是求铜和铝的体积.1年前查看全部
- 有一个质量为232g的铜铝合金球,其中含铝54g,求合金的密度为多少?(已知铜的密度为ρ铜=8.9g/cm3,铝的密度为
有一个质量为232g的铜铝合金球,其中含铝54g,求合金的密度为多少?(已知铜的密度为ρ铜=8.9g/cm3,铝的密度为ρ铝=2.7g/cm3)
 tedddybear1年前3
tedddybear1年前3 -
 笨笨猪16 共回答了20个问题
笨笨猪16 共回答了20个问题 |采纳率85%解题思路:已知合金球和铝的质量,可求铜的质量,根据密度公式可求铜和铝的体积,再求出总体积,总质量除以总体积就是合金球的密度.铜的质量m铜=m总-m铝=232g-54g=178g,
∵ρ=[m/V],
∴铜的体积为V铜=
m铜
ρ铜=[178g
8.9g/cm3=20cm3,
铝的体积为V铝=
m铝
ρ铝=
54g
2.7g/cm3=20cm3,
所以铜铝合金球的体积为V=V铝+V铜=20cm3+20cm3=40cm3,
合金球的密度ρ=
m总/V]=
232g
40cm3=5.8g/cm3.
答:合金球的密度为5.8g/cm3.点评:
本题考点: 密度的计算.
考点点评: 本题考查质量、体积、密度的计算,关键是公式及其变形的灵活运用,重点是求铜和铝的体积.1年前查看全部
- 两种钢材,其中一种含铝10%,有10吨.另一种是含铝20%,有20吨,求混合以后的钢材含铝百分之几?
两种钢材,其中一种含铝10%,有10吨.另一种是含铝20%,有20吨,求混合以后的钢材含铝百分之几?
百分号前面保留一位小数 华汇在线1年前1
华汇在线1年前1 -
 晶井静 共回答了22个问题
晶井静 共回答了22个问题 |采纳率72.7%一共含铝 10×10%+20×20%=5(吨)
铝含量 5÷(10+20)=16.7%
答:混合以后的钢材含铝16.7%1年前查看全部
- (2009•肇庆)兴趣小组的同学在开展“废物利用、减少污染”的活动中,取某工厂合金废料(含铝、铁、铜)进行如下实验:
(2009•肇庆)兴趣小组的同学在开展“废物利用、减少污染”的活动中,取某工厂合金废料(含铝、铁、铜)进行如下实验:
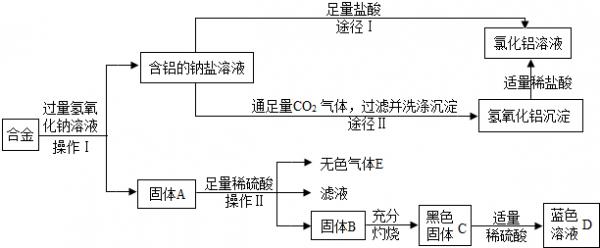
(1)操作Ⅰ的名称是过滤过滤;该操作需用到的铁制仪器为铁架台(带铁圈)铁架台(带铁圈).
(2)固体A的成分是铁、铜(或Fe、Cu);铁、铜(或Fe、Cu);;操作Ⅱ反应的化学方程式为Fe+H2SO4=FeSO4+H2↑Fe+H2SO4=FeSO4+H2↑.
(3)黑色固体C加适量稀硫酸反应的方程式为CuO+H2SO4=CuSO4+H2OCuO+H2SO4=CuSO4+H2O.
(4)图中由含铝的钠盐制备氯化铝有两种途径,你认为合理的途径是ⅡⅡ(填:“Ⅰ”或“Ⅱ”),理由是途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净.合理表述均可)途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净.合理表述均可). 澌菡1年前1
澌菡1年前1 -
 永远的康桥 共回答了20个问题
永远的康桥 共回答了20个问题 |采纳率75%由转化情况分析可知废料中的铝能和氢氧化钠反应生成含铝的钠盐,所以固体A中一定含有铁与铜,其中铁与硫酸可反应生成氢气,铜不反应,铜灼烧会生成黑色的氧化铜,氧化铜与硫酸反应会生成硫酸铜的蓝色溶液;途径I中没有去除钠盐的成分,而途径II则是让铝转化成了沉淀氢氧化铝,去除了钠盐,氢氧化铝与盐酸发生中和反应生成的氯化铝更纯净一些.
(1)操作I是分离固体与液体的操作应该是过滤,所用到的仪器有铁架台,三角架等.
(2)由D是蓝色溶液可知溶液中含有铜离子,则黑色固体是氧化铜,则固体B是单质的铜,合金与氢氧化钠反应后生成含铝的钠盐,则固体A中一定有铁与铜,因此可知固体A中的单质铁能与硫酸反应生成氢气,而铜不能.
(3)单质的铜灼烧会生成氧化铜,氧化铜与硫酸反应生成硫酸铜与水.
(4)途径I在反应过程中没有去除钠盐,所以制备的氯化铝中含有钠盐,而II能去除钠盐,所以氯化铝更纯净.
故答案为:(1)过滤;铁架台(带铁圈)、或三角架;(2)铁、铜(或Fe、Cu);Fe+H2SO4=FeSO4+H2↑
(3)CuO+H2SO4=CuSO4+H2O
(4)Ⅱ;途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净.合理表述均可)1年前查看全部
- 在铜,铁,铝的合金中加入过量的氢氧化钠溶液,得到含铝的钠盐溶液和固体A.在该溶液中:1,加入足量盐酸,得到氯化铝溶液;2
在铜,铁,铝的合金中加入过量的氢氧化钠溶液,得到含铝的钠盐溶液和固体A.在该溶液中:1,加入足量盐酸,得到氯化铝溶液;2,通足量的二氧化碳气体,并洗涤沉淀,得到氢氧化铝沉淀,再加入适量稀盐酸得到氯化铝溶液.而对于固体A,加入足量稀硫酸,得到1.无色气体E,2.滤液,固体B.固体B经过充分灼烧,得到黑色固体C,再加入适量稀硫酸得到蓝色液体D.
 普通放假1年前1
普通放假1年前1 -
 火镰蛾 共回答了16个问题
火镰蛾 共回答了16个问题 |采纳率93.8%铝遇到强碱可以体现出非金属性,与氢氧化钠反应生成偏铝酸钠NaAlO2和氢气,(高一书本上有此方程式)但是铁和铜不反应,
1、加入足量盐酸相当于强酸制弱酸得到偏铝酸HAlO2,偏铝酸立即得到一个水形成铝酸H3Al03即Al(OH)3沉淀,又与足量盐酸反应生成铝盐;
2、通入足量CO2即形成H2CO3与NaAlO2反应,以强制弱也生成HAlO2,偏铝酸立即得到一个水形成铝酸H3Al03即Al(OH)3沉淀,再与足量盐酸反应生成铝盐;
3、固体A中的Fe与稀硫酸反应得到氢气,铜不反应即固体B,铜灼烧得到黑色CuO,加稀硫酸得到蓝色的硫酸铜溶液D1年前查看全部
- 兴趣小组的同学在开展“废物利用、减少污染”的活动中,取某工厂合金废料(含铝、铁、铜)进行如下实验:
兴趣小组的同学在开展“废物利用、减少污染”的活动中,取某工厂合金废料(含铝、铁、铜)进行如下实验:
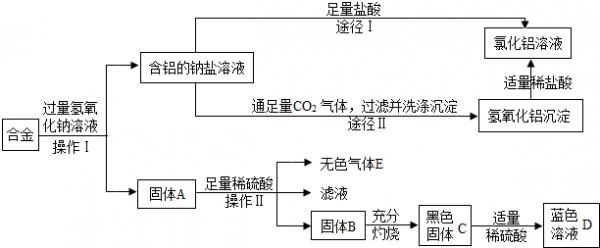
(1)操作II的名称是______;该操作需用到的铁制仪器为______.
(2)固体A的成分是______;氢氧化铝沉淀与稀盐酸反应的化学方程式为______.
(3)固体C与稀硫酸反应的方程式为______.
(4)图中由含铝的钠盐制备氯化铝有两种途径,你认为合理的途径是______(填:“Ⅰ”或“Ⅱ”),理由是______. 来小雨1年前1
来小雨1年前1 -
 AnderSven 共回答了22个问题
AnderSven 共回答了22个问题 |采纳率90.9%解题思路:(1)操作Ⅱ是分离固体与液体的操作应该是过滤操作,过滤过程中要用到铁架台,可以据此解答该题.
(2)由D是蓝色溶液可知溶液中含有铜离子,则黑色固体是氧化铜,则固体B是单质的铜,由废料的成分可知固体A是单质的铁.
(3)根据图中信息可以知道,得到蓝色溶液D为硫酸铜溶液,所以可以判断黑色固体C为氧化铜,可以据此写出固体C和硫酸反应的化学方程式;
(4)从制备过程中是否会引入杂质分析考虑.(1)从操作II的结果可以看出,分为滤液和固体,所以应该是固液分离过程,为过滤.过滤操作中,所用的铁制仪器为铁架台;
(2)由D是蓝色溶液可知溶液中含有铜离子,则黑色固体是氧化铜,则固体B是单质的铜,合金与氢氧化钠反应后生成含铝的钠盐,则固体A中一定有铁与铜,氢氧化铝是碱,而盐酸是酸,两者发生的反应是酸碱中和反应,生成盐和水,该反应的化学方程式为:Al(OH)3+3HCl═AlCl3+3H2O;
(3)根据图中信息可以知道,得到蓝色溶液D为硫酸铜溶液,所以可以判断黑色固体C为氧化铜,可以据此写出固体C和硫酸反应的化学方程式为:CuO+H2SO4═CuSO4+H2O;
(4)NaAlO2和盐酸反应生成氯化铝,由于有剩余的氢氧化钠溶液,所以是氢氧化钠和NaAlO2与盐酸的反应,均是在溶液中进行,导致得到的氯化铝中含有杂质.而NaAlO2和二氧化碳反应得到氢氧化铝沉淀,经过滤、洗涤后,氢氧化铝不再含有盐类杂质,加入适量盐酸后,沉淀溶解,所以得到的氯化铝较为纯净.故途径II更合适.
故答案为:(1)过滤;铁架台(带铁圈);
(2)铁、铜(Fe、Cu);Al(OH)3+3HCl═AlCl3+3H2O;
(3)CuO+H2SO4═CuSO4+H2O;
(4)Ⅱ;途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入了杂质钠盐,得到的氯化铝不纯净).点评:
本题考点: 金属的化学性质;过滤的原理、方法及其应用;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 从整个转化关系中需要隐含的信息提示,同时在方案评价中注意对关键信息的理解和运用(评价NaAlO2制备氯化铝的路径时要注意到反应环境以及先前加入的过量的氢氧化钠对过程和结果造成的干扰).1年前查看全部
- 初三化学:多少克Al(OH)3与51g氧化铝,含铝量相当?
初三化学:多少克Al(OH)3与51g氧化铝,含铝量相当?
注:(OH)3为氢氧根,
要求详细解答过程,及思路.
满意重赏! mackson1年前5
mackson1年前5 -
 alplfo3u 共回答了13个问题
alplfo3u 共回答了13个问题 |采纳率100%你好,
请看看我给你的(纯初中知识)
多少克Al(OH)3与51g氧化铝,含铝量相当?
我对这个题目的分析:
题目的意思是多少克Al(OH)3中Al元素的质量和51gAl2O3中Al元素的质 量相等.利用计算公式:求某化合物中某元素的质量=该化合物的质量该元素在化合物的质量分数,元素的质量分数=该原子的相对原子质量x原子个数/化合物的相对分子质量x100%
Al的相对原子质量27 O的相对原子质量16 H的相对原子质量1.
详细解题过程:
解: 设Al(OH)3的质量X
X.27/27+(16+1)x3 x100%=51gx27x2/27x2+16x3 x100%
X=78g1年前查看全部
- 一块合金重600千克,其中含铝60%,含锡20%,其余是铅.这块合金含铅多少千克?
 地上有贼1年前1
地上有贼1年前1 -
 小妮哈拽 共回答了18个问题
小妮哈拽 共回答了18个问题 |采纳率72.2%解题思路:把这块合金的总质量看成单位“1”,铅的含量是总质量的(1-60%-20%),用总质量乘上这个百分数,就是铅的质量.600×(1-60%-20%)
=600×20%
=120(千克)
答:这块合金含铅120千克.点评:
本题考点: 百分数的实际应用.
考点点评: 本题的关键是找出单位“1”,已知单位“1”的量求它的百分之几是多少用乘法.1年前查看全部
- 有一块铝锡合金,其中含铝36千克,锡的含量是铝的2倍.锡的含量是合金总量的几分之几?你能用几种方法计算?最简单的方法是怎
有一块铝锡合金,其中含铝36千克,锡的含量是铝的2倍.锡的含量是合金总量的几分之几?你能用几种方法计算?最简单的方法是怎样的?
 风云再器1年前1
风云再器1年前1 -
 荑牧 共回答了20个问题
荑牧 共回答了20个问题 |采纳率95%36×2 ÷(36×2+36)=2/3
2 ÷(1+2)=2/3 最简单的方法.1年前查看全部
- 一个质量为232g 的铜铝合金球,含铝54g ,已知铜的密度为8.9*10^3kg /m ^3,铝的密度为2.7*10^
一个质量为232g 的铜铝合金球,含铝54g ,已知铜的密度为8.9*10^3kg /m ^3,铝的密度为2.7*10^3kg /m ^3,合金球的密度是多少?
 shelflaura1年前1
shelflaura1年前1 -
 阳光葵 共回答了11个问题
阳光葵 共回答了11个问题 |采纳率90.9%V铝=m铝/密度铝=54g/2.7*10^3kg/m^3=20cm^3
m铜=m总-m铝=232g-54g=178g
V铜=m铜/密度铜=178g/8.9*10^3kg/m^3=20cm^3
密度合金球=m总/V总=232g/20cm^3+20cm^3=5.8g/cm^31年前查看全部
- 地壳里所含铝和铁元素的质量分别为7.7%和4.8% 假设地壳里所含铝和铁元素全部是单质,那么,它们的体积之比是
 zmop1年前0
zmop1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有一块铝锡合金,其中含铝36千克,锡的含量是铝的2倍.锡的含量是合金的总量的几分之几
 miner11131年前3
miner11131年前3 -
 纳兰十八若 共回答了17个问题
纳兰十八若 共回答了17个问题 |采纳率94.1%36X2/(36+36X2)=66.666%1年前查看全部
- 合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进
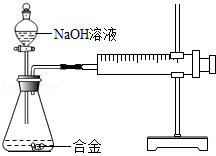 合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑(NaAlO2溶于水,溶液显无色)
【进行猜想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有______.
猜想3:该合金粉末中除铝外,还含有铁、铜.
【定性探究】下列实验(见表1)仅供选用的试剂:稀硫酸溶液、NaOH溶液.
表1实验记录
【得出结论】猜想______成立.实验步骤 实验现象 结论 ①取一定量的合金粉末,加过量的______,充分反应后滤渣备用. 粉末部分溶解,并有无色气体放出. 合金中一定含有______. ②取步骤①所得滤渣,加过量的______,充分反应. 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色. 合金中一定含有______.
【反思】
(1)一般来说,活泼金属能与稀硫酸发生反应,而铝与酸、碱都能发生反应,说明铝具有特殊的性质.
铝与稀硫酸反应的基本反应类型是______.
(2)若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是______.
【定量探究】
小明想通过实验确定该合金中铝的质量分数.他称取合金2克放入上述装置中,向其中滴加氢氧化钠溶液至合金不能再溶解为止,共收集到氢气200mL(已知:氢气密度为0.09g/L),试计算该合金中铝的质量分数.(写出具体计算过程) 天蓝蓝_1年前1
天蓝蓝_1年前1 -
 QQshirley 共回答了16个问题
QQshirley 共回答了16个问题 |采纳率100%解题思路:【猜想】根据可能含有的物质进行组合分析;
【定性探究】根据题目资料中的信息:铝会与碱反应生成氢气,而铁和铜不会与碱反应,根据铁能与酸反应产生气体且溶液呈浅绿色,联系题目中所给现象,滤渣溶解会生成气体,且溶液显浅绿色,可知合金中有铁,滤渣部分溶解,说明有不与酸反应的固体,铜在金属活动性顺序中排在氢的后面,不能与酸反应,得知合金中含有铜;
【得出结论】根据上面的分析得出正确的结论;
【反思】1、根据铝会与硫酸反应生成硫酸铝和氢气的化学方程式联系置换反应的定义进行分析;
2、根据在金属活动性顺序中,只有排在氢前面的金属才能与酸反应放出氢气,排在氢后面的金属,不能与酸反应,进行分析;
【定量探究】根据题中所给的数据结合化学方程式进行分析解答.【猜想】合金中除了含有铝之外,还含有铁、铜中的一种或两种,结合题中的猜想可知还有铜;
【定性探究】铝会与碱反应生成氢气,而铁和铜不会与碱,滤渣溶解会生成气体,且溶液显浅绿色,铜不会与酸反应,可以先用氢氧化钠鉴别铝的存在,然后再根据与酸反应时的现象鉴别铁和铜的存在;
【得出结论】通过上面的鉴别分析,可以判断铝、铁、铜三种金属是同时存在的;
【反思】1、铝和稀硫酸反应生成硫酸铝和氢气,满足置换反应的定义;
2、在金属活动性顺序中,铝和铁排在氢之前,铜排在氢的后面,加入足量的稀硫酸后,剩余的固体是铜;
【定量探究】
生成的氢气质量为:0.2×0.09=0.018g,
设合金中铝的质量为x,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54 6
x 0.018g
[54/x]=[6/0.018g]
x=0.162g
合金中铝的质量分数为:[0.162/2]×100%=8.1%
答:合金中铝的质量分数为8.1%.
故答案为:【猜想】铜;
【定性探究】
实验步骤 实验现象 结论
①NaOH溶液 铝
②稀硫酸 铁、铜【得出结论】3;
【反思】1、置换反应;
2、铜;
【定量探究】
生成的氢气质量为:0.2×0.09=0.018g,
设合金中铝的质量为x,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54 6
x 0.018g
[54/x]=[6/0.018g]
x=0.162g
合金中铝的质量分数为:[0.162/2]×100%=8.1%
答:合金中铝的质量分数为8.1%.点评:
本题考点: 实验探究物质的性质或变化规律;金属的化学性质;反应类型的判定;根据化学反应方程式的计算.
考点点评: 此题以实验探究的形式考查了金属的化学性质,在解此类题时,首先分析需要鉴别的物质的性质,然后结合题中的现象进行逐一的鉴别.1年前查看全部
- 兴趣小组的同学在开展“废物利用、减少污染”的活动中,取某工厂合金肥料(含铝、铁铜)进行如下实验:
兴趣小组的同学在开展“废物利用、减少污染”的活动中,取某工厂合金肥料(含铝、铁铜)进行如下实验:
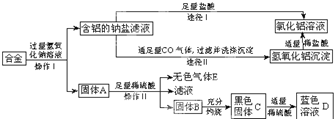
(1)操作I的名称是______;该操作需要用到的铁制为______
(2)固体A的成分是______,操作II发反应的化学方程式为______
(3)黑色固体C加适量稀硫酸反应的方程式为______(4)图中由含铝的钠盐制备氯化铝有两种途径,你认为合理的途径是______(填“I”或“II”),理由是______. 卓开1年前1
卓开1年前1 -
 jiaoxia 共回答了14个问题
jiaoxia 共回答了14个问题 |采纳率92.9%解题思路:(1)操作I是分离固体与液体的操作应该是过滤操作.
(2)由D是蓝色溶液可知溶液中含有铜离子,则黑色固体是氧化铜,则固体B是单质的铜,由废料的成分可知固体A是单质的铁.
(3)该反应是氧化铜与硫酸的反应.
(4)从制备过程中是否会引入杂质分析考虑.由转化情况分析可知废料中的铝能和氢氧化钠反应生成含铝的钠盐,所以固体A中一定含有铁与铜,其中铁与硫酸可反应生成氢气,铜不反应,铜灼烧会生成黑色的氧化铜,氧化铜与硫酸反应会生成硫酸铜的蓝色溶液;途径I中没有去除钠盐的成分,而途径II则是让铝转化成了沉淀氢氧化铝,去除了钠盐,氢氧化铝与盐酸发生中和反应生成的氯化铝更纯净一些.
(1)操作I是分离固体与液体的操作应该是过滤,所用到的铁制仪器是铁架台.
(2)由D是蓝色溶液可知溶液中含有铜离子,则黑色固体是氧化铜,则固体B是单质的铜,合金与氢氧化钠反应后生成含铝的钠盐,则固体A中一定有铁与铜,因此可知固体A中的单质铁能与硫酸反应生成氢气,而铜不能.
(3)单质的铜灼烧会生成氧化铜,氧化铜与硫酸反应生成硫酸铜与水.
(4)途径I在反应过程中没有去除钠盐,所以制备的氯化铝中含有钠盐,而II能去除钠盐,所以氯化铝更纯净.
故答案为:(1)过滤;铁架台(带铁圈);(2)铁、铜(或Fe、Cu);Fe+H2SO4=FeSO4+H2↑
(3)CuO+H2SO4=CuSO4+H2O
(4)Ⅱ;途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净.合理表述均可)点评:
本题考点: 物质的相互转化和制备.
考点点评: 此题是一道推断分析题,解题的关键是掌握一些物质的特有性质,如溶液的颜色等.1年前查看全部
- (2013•河南一模)为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设
 (2013•河南一模)为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设计下列三种不同实验方案进行探究.填写下列空白.
(2013•河南一模)为测定某含铝95%一97%的铝镁合金(不含其它元素)中铝的质量分数,研究性学习小组的三位同学分别设计下列三种不同实验方案进行探究.填写下列空白.
【探究一】实验方案:铝镁合金
测定剩余固体质量实验中发生反应的离子反应方程式______.NaOH
实验步骤:
(1)称取8.1g 铝镁合金粉末样品,投入VmL 2.0mol・L-1 NaOH溶液中,充分反应.NaOH溶液的体积V“≥”______.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得铝的质量分数将______(填“偏高”或“偏低”).
【探究二】实验方案:铝镁合金溶于盐酸溶液中测定生成气体的体积实验装置(如图1):
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置.你的意见是:______(填“需要”或“不需要”).
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______
②______
【探究三】实验方案:称量x g铝镁合金粉末.放在如图2所示装置的惰性电热板上,通电使其充分灼烧.
问题讨论:
(1)欲计算铝的质量分数,该实验中还需测定的数据是______.
(2)若用空气代替O2进行实验,对测定结果是否有影响?______(填“是”或“否”).
【实验拓展】
参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数.______. 欢欢QQ1年前1
欢欢QQ1年前1 -
 龙城鬼客 共回答了24个问题
龙城鬼客 共回答了24个问题 |采纳率95.8%解题思路:【探究一】铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
【探究二】(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;
(2)调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等会影响测定结果;
【探究三】(1)Mg、Al都能够与氧气化学反应生成氧化物;
(2)用空气代替O2进行实验,发生反应:3Mg+N2
Mg3N2,2Mg+CO2点燃 .
2MgO+C,测定生成固体的质量变大;点燃 .
【实验拓展】
根据探究一,可测定铝和氢氧化钠反应产生氢气的体积来计算铝的质量分数.【探究一】铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(1)含镁为零时,金属铝的含量最高,8.1g合金中铝的质量为,8.1g×97%=7.857g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g2mol
7.857g V×10-3L×2.0mol/L
所以54g:7.857g=2mol:(V×10-3L×2.0mol/L),
解得:V=145.5mL,故V(NaOH溶液)≥145.5mL;
故答案为:145.5mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,则铝的质量分数偏低;故答案为:偏低;
【探究二】(1)由于氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置,故答案为:不需要;
(2)调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等会影响测定结果;
故答案为:调整量气管C的高度,使C中液面与B液面相平;待冷却至室温再读体积等合理答案;
【探究三】
(1)Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,故答案为:充分灼烧后固体的质量;
(2)若用空气代替O2进行实验,发生反应:3Mg+N2
点燃
.
Mg3N2,2Mg+CO2
点燃
.
2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高,故答案为:是;
【实验拓展】
根据探究一,可测定铝和氢氧化钠反应产生氢气的体积来计算铝的质量分数,故答案为:称取一定量的镁铝合金,加入足量的氢氧化钠溶液,测定生成气体的体积.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.1年前查看全部
- Q345B的化学成份,是否含铝,含铝能.015以上么,Q345B是否能代替Q345C?
 澜枫1年前1
澜枫1年前1 -
 253469396 共回答了20个问题
253469396 共回答了20个问题 |采纳率70%1.Q345B的化学成份,不含铝;Q345C的化学成份,含铝大于等于0.015%.
2.从Q345B与Q345C的力学性能来说,其屈服点的强度和抗拉强度是一样的,Q345C的伸长率要好一点点,Q345B为21%,
Q345C为22%;Q345B在20摄氏度时与Q345C在0摄氏度时冲击性能是一样的.
所以,一般情况,Q345B是能代替Q345C的.1年前查看全部
- 1g明矾中的含铝元素质量与多少克氢氧化铝的铝元素的质量相等?)
 yangyukai1年前1
yangyukai1年前1 -
 霞雪 共回答了21个问题
霞雪 共回答了21个问题 |采纳率76.2%KAl(SO4)2.12H2O~Al
474 27
1g xg
x≈0.057
Al(OH)3~Al
78 27
x2g 0.057g
x2≈0.165
答:1g明矾中的含铝元素质量与0.165克氢氧化铝的铝元素的质量相等1年前查看全部
- 等体积的AlCl3溶液和NaOH溶液混合后,沉淀物中含铝的质量与溶液中含铝的质量相等,则AlCl3和NaOH两种溶液的物
等体积的AlCl3溶液和NaOH溶液混合后,沉淀物中含铝的质量与溶液中含铝的质量相等,则AlCl3和NaOH两种溶液的物质的量浓度之比是( )
A. 1:3
B. 2:5
C. 1:4
D. 2:7 1562218181年前1
1562218181年前1 -
 狂花妄草 共回答了16个问题
狂花妄草 共回答了16个问题 |采纳率93.8%解题思路:将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝元素存在形式可能为AlCl3或NaAlO2,结合反应:Al3++3OH-═Al(OH)3↓或Al3++4OH-=AlO2-+2H2O,讨论进行计算.等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,设氢氧化铝的物质的量为1mol,则溶液中AlCl3或NaAlO2也是1mol,
若溶液中铝元素以Al3+形式存在,则NaOH完全反应,发生反应:
Al3++3OH-═Al(OH)3
1mol 3mol 1mol
则原来AlCl3的物质的量为1mol+1mol=2mol,NaOH为3mol,则:AlCl3和NaOH两种溶液物质的量之比=2mol:3mol=2:3,AlCl3溶液和NaOH溶液体积相等,则:AlCl3和NaOH两种溶液物质的量浓度之比也为2:3;
若溶液中含铝元素以AlO2-形式存在,则:
Al3++3OH-═Al(OH)3
1mol 3mol 1mol
Al3++4OH-═AlO2-+2H2O,
1mol 4mol 1mol
则原来AlCl3的物质的量为1mol+1mol=2mol,NaOH的物质的量为3mol+4mol=7mol,则:AlCl3和NaOH两种溶液物质的量浓度之比=2mol:7mol=2:7,AlCl3溶液和NaOH溶液体积相等,则:AlCl3和NaOH两种溶液物质的量浓度之比也为2:7;
故答案为:D.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 本题考查了根据方程式进行计算,同时考查学生分析问题、解决问题能力,很多同学往往只考虑溶液中的铝元素为铝离子而漏掉为偏铝酸根离子而导致错误,为易错点.1年前查看全部
- 某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO 4 •7H 2 O)和胆矾晶体(CuSO 4
某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO 4 •7H 2 O)和胆矾晶体(CuSO 4 •5H 2 O),以探索工业废料的再利用.其实验方案如图: 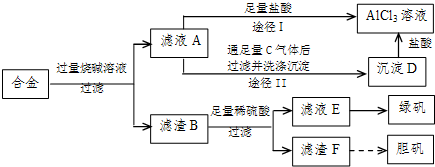
试回答下列问题:
(1)写出滤液A转化为沉淀D的离子方程式______.
(2)由滤液A制AlCl 3 溶液的途径有I和II两条,你认为合理的是途径______(填“I”或“II”),理由是______.
(3)从滤液E中得到绿矾晶体的实验操作是(不考虑E中的溶质被氧化这一因素):______.
(4)H 2 O 2 是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H 2 O 2 来制备胆矾晶体是一种绿色工艺,该反应的总的化学方程式为______.
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否合理?______.理由是______. 没有烟抽1年前1
没有烟抽1年前1 -
 吃烧饼的钳工 共回答了21个问题
吃烧饼的钳工 共回答了21个问题 |采纳率95.2%(1)铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠,可以和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,实质为:AlO 2 - +CO 2 +2H 2 O=Al(OH) 3 ↓+HCO 3 - ,
故答案为:AlO 2 - +CO 2 +2H 2 O=Al(OH) 3 ↓+HCO 3 - ;
(2)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,
故答案为:Ⅱ;因为滤液A是偏铝酸钠和氢氧化钠溶液,按途径I直接向A中加入盐酸得到的AlCl 3 溶液中含有大量的氯化钠杂质;按途径II通入二氧化碳气体,得Al(OH) 3 沉淀,将Al(OH) 3 溶解于盐酸中得到的是纯净的AlCl 3 溶液;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶;
(4)铜不能和稀硫酸反应,贴可以和硫酸反应,所以滤渣F是金属铜,Cu中加入稀硫酸和H 2 O 2 可以制备胆矾晶体,反应方程式为:Cu+H 2 SO 4 +3H 2 O+H 2 O 2 =CuSO 4 •5H 2 O,故答案为:Cu+H 2 SO 4 +3H 2 O+H 2 O 2 =CuSO 4 •5H 2 O;
(5)在实验方案一中,酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,需要的是适量的酸,这很难控,故答案为:不合理;因为该方案操作步骤多、时间长,消耗试剂量大.1年前查看全部
- 一个质量为232g的铜铝合金球,其中含铝54g,铜的密度为ρ铜=8.9g/cm3,铝的密度ρ铝=2.7g/cm3,求合金
一个质量为232g的铜铝合金球,其中含铝54g,铜的密度为ρ铜=8.9g/cm3,铝的密度ρ铝=2.7g/cm3,求合金球的密度.
 shuqin11111年前1
shuqin11111年前1 -
 rainyi1983 共回答了13个问题
rainyi1983 共回答了13个问题 |采纳率76.9%解题思路:已知合金球和铝的质量,可求铜的质量,根据密度公式可求铜和铝的体积,再求出总体积,总质量除以总体积就是合金球的密度.铜的质量m铜=m总-m铝=232g-54g=178g,铜的体积为V铜=m铜ρ铜=178g8.9g/cm3=20cm3,铝的体积为V铝=m铝ρ铝=54g2.7g/cm3=20cm3,所以铜铝合金球的体积为V=V铝+V铜=20cm3+20cm3=40cm3,合金球的密度ρ=m总V=232g40cm3=5...
点评:
本题考点: 空心、混合物质的密度计算;密度的计算;密度公式的应用.
考点点评: 本题考查质量、体积、密度的计算,关键是公式及其变形的灵活运用,重点是求铜和铝的体积.1年前查看全部
- 铜铁铝合金中加入过量氢氧化钠过滤后,一部分是含铝的钠盐,另一部分是固体铁 铜.为什么会这样
 喜欢黑夜静1年前2
喜欢黑夜静1年前2 -
 市长dd 共回答了16个问题
市长dd 共回答了16个问题 |采纳率81.3%因为只有Al和NaOH反应
2Al+2NaOH+H2O==2NaAlO2 +3H2
Cu和Fe不反应,就是固体了
Al变成了 NaAlO21年前查看全部
- (2009•中山模拟)某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体
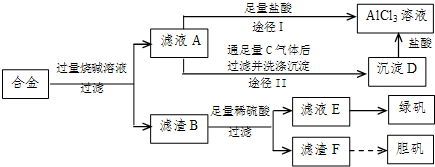
(2009•中山模拟)某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),以探索工业废料的再利用.其实验方案如图:
试回答下列问题:
(1)写出滤液A转化为沉淀D的离子方程式______.
(2)由滤液A制AlCl3溶液的途径有I和II两条,你认为合理的是途径______(填“I”或“II”),理由是______.
(3)从滤液E中得到绿矾晶体的实验操作是(不考虑E中的溶质被氧化这一因素):______.
(4)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总的化学方程式为______.
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否合理?______.理由是______. redngry1年前1
redngry1年前1 -
 紫灵梦雪 共回答了13个问题
紫灵梦雪 共回答了13个问题 |采纳率92.3%解题思路:(1)根据所发生的反应来确定溶液的组成情况,并书写发生的反应;
(2)根据反应所得产物的组成来选择合适的制取方案;
(3)根据溶液来得到晶体来分析实验操作;
(4)根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(5)根据实验中的酸和碱的量的情况来对比回答.(1)铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠,可以和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,实质为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,
故答案为:Ⅱ;因为滤液A是偏铝酸钠和氢氧化钠溶液,按途径I直接向A中加入盐酸得到的AlCl3溶液中含有大量的氯化钠杂质;按途径II通入二氧化碳气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶;
(4)铜不能和稀硫酸反应,贴可以和硫酸反应,所以滤渣F是金属铜,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+3H2O+H2O2=CuSO4•5H2O,故答案为:Cu+H2SO4+3H2O+H2O2=CuSO4•5H2O;
(5)在实验方案一中,酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,需要的是适量的酸,这很难控,故答案为:不合理;因为该方案操作步骤多、时间长,消耗试剂量大.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;制备实验方案的设计.
考点点评: 本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.1年前查看全部
- (2009•惠州二模)某化学兴趣小组用含铝、铁、铜的合金废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾
(2009•惠州二模)某化学兴趣小组用含铝、铁、铜的合金废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),方案如下:
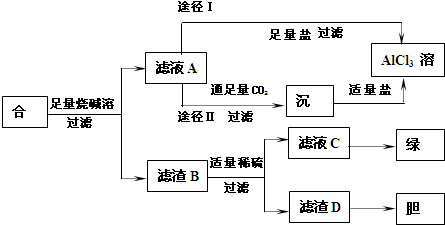
(1)该方案中进行了多次过滤、洗涤,过滤时需要用到的玻璃仪器除烧杯外还有______.
(2)从滤液C中得到绿矾晶体的操作是______.
(3)H2O2是一种应用广泛的绿色氧化剂,往滤渣D中加入稀硫酸和H2O2可以制备胆矾晶体,该反应的总化学方程式为______.
(4)由滤液A通过途径I和途径II都可得到AlCl3溶液,你认为最合理的是______(填“途径I”或“途径II”),理由是______. jing19831181年前1
jing19831181年前1 -
 zhang29042325 共回答了17个问题
zhang29042325 共回答了17个问题 |采纳率88.2%解题思路:分析流程可知,实验目的是用含铝、铁、铜的合金废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),流程分析得到,合金废料放入过量烧碱溶液中,其中铝溶解为偏铝酸钠溶液,滤渣B为铜和铁,放入稀硫酸溶液中,铁溶于适量硫酸溶液中生成硫酸亚铁,铜不反应得到滤渣D为铜,加入氧化剂早溶液中反应生成硫酸铜;滤液A中主要是偏铝酸钠溶液,途径Ⅰ是加入足量盐酸反应生成氯化铝和氯化钠混合溶液,途径Ⅱ是在偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀,过滤出沉淀加入适量盐酸溶解得到氯化铝溶液,提纯得到氯化铝;
(1)根据过滤实验用到的仪器来回答;
(2)根据溶液得到晶体的实验操作方法来分析实验操作;
(3)根据铜、稀硫酸的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(4)根据实验中的反应过程和产物分析,得到的溶液中是否引入杂质对比回答.实验目的是用含铝、铁、铜的合金废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),流程分析得到,合金废料放入过量烧碱溶液中,其中铝溶解为偏铝酸钠溶液,滤渣B为铜和铁,放入稀硫酸...
点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是对物质的分离和提纯知识点的考查,注意溶液中溶质分离的方法,流程产物和过程分析判断,题目难度不是很大,可以根据所学的知识进行.1年前查看全部
- 一种铝矿石中含铝70%,锰20%,其他物质10%.100吨这种矿石能提炼铝,锰各多少吨?
 luoxiasda1年前2
luoxiasda1年前2 -
 云城 共回答了15个问题
云城 共回答了15个问题 |采纳率80%铝:100*70%=70
锰:100*20%=201年前查看全部
- 一种铝矿石,100克中含铝30克,200吨这样的铝矿石含铝多少吨?(用比例解)
 天平米1年前1
天平米1年前1 -
 hefengfeng2001 共回答了18个问题
hefengfeng2001 共回答了18个问题 |采纳率77.8%30/100=X/200T
X=60T1年前查看全部
- (2013•徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉
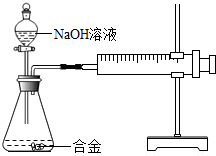 (2013•徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
(2013•徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑(NaAlO 2 溶于水,溶液现无色)
【进行猜想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有______.
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验(见表1)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液.
表1实验记录
【得出结论】猜想3成立.实验步骤 实验现象 结论 ①取一定量的合金粉末,加过量的______,充分反应后过滤,滤渣备用 粉末部分溶解,并有无色气体放出 合金中一定含有______ ②取步骤①所得滤渣,加过量______,充分反应 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 合金中一定含有______
【反思】
1.一般来说,活泼金属能与稀硫酸等算反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.铝与稀硫酸发生化学反应的基本类型是______反应.
2.上述实验中用到的稀硫酸由浓硫酸稀释得到,稀释浓硫酸的方法是:把______,并不断搅拌.
3.若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是______.
【拓展与分析】请你设计一个实验方案,比较铝、铁、铜的金属活动性强弱______. 放飞的小鸟1年前1
放飞的小鸟1年前1 -
 tianyu_26 共回答了16个问题
tianyu_26 共回答了16个问题 |采纳率81.3%解题思路:【猜想】根据可能含有的物质进行组合分析;
【实验探究】根据题目资料中的信息:铝会与碱反应生成氢气,而铁和铜不会与碱反应,根据铁能与酸反应产生气体且溶液呈浅绿色,联系题目中所给现象--滤渣溶解会生成气体,且溶液显浅绿色反应进行分析得知合金中有铁;滤渣部分溶解,说明有不与酸反应的固体,铜在金属活动性顺序中排在氢的后面,不能与酸反应,得知合金中含有铜.
【反思】1、根据铝会与盐酸反应生成氢气的化学方程式联系置换反应的定义进行分析;
2、稀释浓硫酸的方法是教材上的知识,由于浓硫酸溶于水时放热,所以要把浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌.
3、在金属活动性顺序中,只有排在氢前面的金属才能与酸反应放出氢气,排在氢后面的金属,不能与酸反应,其中铜排在氢的后面,不与酸反应;【猜想】合金中除了含有铝之外,还含有铁、铜中的一种或两种,结合题中的猜想可知还有铜,故答案为:铜;
【实验探究】铝会与碱反应生成氢气,而铁和铜不会与碱,滤渣溶解会生成气体,且溶液显浅绿色反应,铜不会与酸反应,可以先用氢氧化钠鉴别铝的存在,然后再根据与酸反应时的现象鉴别铁和铜的存在,故答案为:
实验操作 实验现象 实验结论
①30%氢氧化钠溶液 ------ 铝
②20%的硫酸溶液 ------ 铁、铜【反思】1、根据铝会与盐酸反应生成氢气的化学方程式联系置换反应的定义可知该反应属于置换反应,故答案为:置换
2、由于浓硫酸溶于水时放出大量的热,所以要把浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌.故答案为:浓硫酸沿烧杯壁慢慢注入水中
3、在金属活动性顺序中,铜排在氢的后面,不与酸反应,故答案为:铜
【拓展与分析】根据金属与盐溶液反应的条件,在金属活动性顺序中,排在前面的金属能把排在后面的金属从其盐溶液中置换,所以铝能置换出铁,铜不能置换出铁.
故答案为:把一根用砂纸打磨过的铝丝和铜丝分别插入盛有硫酸亚铁溶液的试管中,过一会观察现象.点评:
本题考点: 实验探究物质的性质或变化规律;浓硫酸的性质及浓硫酸的稀释;金属的化学性质;碱的化学性质;反应类型的判定.
考点点评: 此题以实验探究的形式考查了金属的化学性质,在解此类题时,首先分析需要鉴别的物质的性质,然后结合题中的现象进行逐一的鉴别.1年前查看全部
- (15分) 物质A、B、C有如下转化关系: 请回答下列问题:(1)若A、B、C均为含铝元素的化合物,M的化学
(15分)
物质A、B、C有如下转化关系: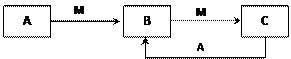
请回答下列问题:
(1)若A、B、C均为含铝元素的化合物,M的化学式可以是 。
(2)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子,C的化学式是 ,请写出C的一种用途 。
(3)若A是一种黄绿色气体,M是一种常见金属。写出C→B的离子方程式
。
(4)若A、B、C都是含硫化合物,已知:
A转化为B的热化学方程式为:2H 2 S(g)+ O 2 (g) =2S (s)+2H 2 O(l) △H=" -a" kJmol -1 ;
A转化为C的热化学方程式为:2H 2 S(g)+ 3O 2 (g) =2SO 2 (g)+2H 2 O(l) △H ="-b" kJmol -1 ;
请写出A与C反应转化为B的热化学方程式 。
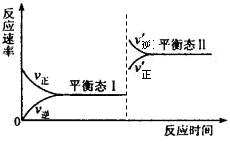
(5)若C+A→B的转化关系为4NH 3 +6NO 6H 2 O+5N 2 。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系图如右。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)
6H 2 O+5N 2 。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系图如右。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”) blqfd1年前1
blqfd1年前1 -
 李2 共回答了21个问题
李2 共回答了21个问题 |采纳率95.2%(15分)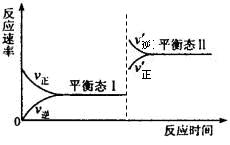
物质A、B、C有如下转化关系:

请回答下列问题:
(1)若A、B、C均为含铝元素的化合物,M的化学式可以是 。
(2)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子,C的化学式是 ,请写出C的一种用途 。
(3)若A是一种黄绿色气体,M是一种常见金属。写出C→B的离子方程式
。
(4)若A、B、C都是含硫化合物,已知:
A转化为B的热化学方程式为:2H 2 S(g)+ O 2 (g) =2S (s)+2H 2 O(l) △H=" -a" kJmol -1 ;
A转化为C的热化学方程式为:2H 2 S(g)+ 3O 2 (g) =2SO 2 (g)+2H 2 O(l) △H ="-b" kJmol -1 ;
请写出A与C反应转化为B的热化学方程式 。
(5)若C+A→B的转化关系为4NH 3 +6NO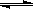 6H 2 O+5N 2 。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系图如右。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)
6H 2 O+5N 2 。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系图如右。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)
(15分)
(1)NaOH溶液或盐酸(其他合理答案)(2分)
(2)NaHCO 3 (2分)
发酵粉,胃药等合理答案(1分)
(3)2Fe 2+ +Cl 2 =2Fe 3+ +2Cl - (3分)
(4)2H 2 S(g) +2SO 2 (g)=3S (g)+2H 2 O(l) △H =-(3a-b) /2 kJmol -1 (3分)
(5)放热(2分)
减小(2分)
略1年前查看全部
- 含铝90%的铝合金1.5g跟40mL20%(d=1.095g/cm^3)HCl充分反应,其它成分不与HCl反应,过滤除去
含铝90%的铝合金1.5g跟40mL20%(d=1.095g/cm^3)HCl充分反应,其它成分不与HCl反应,过滤除去后,将滤液稀释到200mL,取稀释液10mL,加入0.3mol/L的氨水使Al3+完全沉淀.问:
(1)生成氢气多少升?(标准状况)
(2)要使Al3+完全沉淀所有的氨水至少要多少毫升? 风儿日落1年前2
风儿日落1年前2 -
 xiongfengling 共回答了31个问题
xiongfengling 共回答了31个问题 |采纳率96.8%首先你计算出铝的物质的量和HCL的物质的量,铝=1.5*0.9/27=0.05mol HCL=1.095*40*0.2/36.5=0.24 mol因为铝不足所以用铝计算 所以氢气=0.075mol*22.4=1.68L 剩下的盐酸=0.09mol 和0.05mol的ALCL3然后在稀释到200ml 那...1年前查看全部
- 一个质量为232g的铜铝合金球,其中含铝54g,铜的密度为ρ铜=8.9g/cm3,铝的密度ρ铝=2.7g/cm3,求合金
一个质量为232g的铜铝合金球,其中含铝54g,铜的密度为ρ铜=8.9g/cm3,铝的密度ρ铝=2.7g/cm3,求合金球的密度.
 pukuwwr1年前1
pukuwwr1年前1 -
 盘门ff 共回答了22个问题
盘门ff 共回答了22个问题 |采纳率90.9%解题思路:已知合金球和铝的质量,可求铜的质量,根据密度公式可求铜和铝的体积,再求出总体积,总质量除以总体积就是合金球的密度.铜的质量m铜=m总-m铝=232g-54g=178g,
铜的体积为V铜=
m铜
ρ铜=[178g
8.9g/cm3=20cm3,
铝的体积为V铝=
m铝
ρ铝=
54g
2.7g/cm3=20cm3,
所以铜铝合金球的体积为V=V铝+V铜=20cm3+20cm3=40cm3,
合金球的密度ρ=
m总/V]=
232g
40cm3=5.8g/cm3.
答:合金球的密度为5.8g/cm3.点评:
本题考点: 空心、混合物质的密度计算;密度的计算;密度公式的应用.
考点点评: 本题考查质量、体积、密度的计算,关键是公式及其变形的灵活运用,重点是求铜和铝的体积.1年前查看全部
- 某冶炼厂每天生产含铝99%的铝锭5t,假设该厂铝土矿的利用率为90%,在各步反应中总转化率为80%,问该厂每天需购进多少
某冶炼厂每天生产含铝99%的铝锭5t,假设该厂铝土矿的利用率为90%,在各步反应中总转化率为80%,问该厂每天需购进多少吨含氧化铝60%的铝土矿?
需购进X吨含氧化铝60%的铝土矿
X*0.6*0.8*0.9/102=5*0.99/27
X=43.3t
这样对吗 3721077561年前1
3721077561年前1 -
 nell419 共回答了22个问题
nell419 共回答了22个问题 |采纳率100%且来分析一下吧,铝土矿含氧化铝60%,而铝土矿的利用率为90%,也就是说有90%*60%
的反应物,总转化率为80%,也就是说反应物没有完全参与反应,参与反应的有90%*60%*80%
剩下的就是制取铝的反应了
Al2O3 ~ 2 Al
102 54
X*90%*60%*80% 5*99%
X=1年前查看全部
- 做馒头的香甜泡打粉配料含40%的硫酸铝铵(无水物),据说含铝的食品添加剂对人体有害,这个算吗?
 tian51151年前1
tian51151年前1 -
 边城雪 共回答了16个问题
边城雪 共回答了16个问题 |采纳率87.5%算,不过只是微量1年前查看全部
- 铝|计算题|某含铝90%的铝合金1.5g,跟40mL 6mol/L的盐酸充分反应(合金中的其他成分不与盐酸反应)
铝|计算题|某含铝90%的铝合金1.5g,跟40mL 6mol/L的盐酸充分反应(合金中的其他成分不与盐酸反应)
某含铝90%的铝合金1.5g,跟40mL 6mol/L的盐酸充分反应(合金中的其他成分不与盐酸反应),过滤出不溶物,将滤液稀释到200mL……
见图:
答案是:16.8L;800mL
我哪里做错了?
到底应该怎么做?
请详细说明,谢谢~~
 gezhidan1年前1
gezhidan1年前1 -
 天狼一笑 共回答了23个问题
天狼一笑 共回答了23个问题 |采纳率95.7%第1问,应该是1.68L,你做对的.
但第2问,你错了,盐酸过量,所以氨水先要中和盐酸.
可根据恰好完全与盐酸反应和沉淀Al3+后,溶液中只剩NH4Cl,即Cl-与NH4+等,则盐酸0.24mol,即需要氨水0.24mol,即800mL.1年前查看全部
- 质量为232的铜铝金球,含铝54克,求合金球的密度(P铜=8.9g P铝=2.7g/cm³ )
 红魔zz1年前1
红魔zz1年前1 -
 雪狼猢 共回答了26个问题
雪狼猢 共回答了26个问题 |采纳率88.5%m(AL)=54g
V(AL)=m(AL)/P(AL)=20cm3
m(Cu)=(232-54)g=178g
V(Cu)=20cm3
V总=40cm3
P总=m总/V总=5.8g/cm31年前查看全部
- 等体积的AlCl3溶液和NaOH溶液混合后,沉淀物中含铝的质量与溶液中含铝的质量相等,则AlCl3和NaOH两种溶液的物
等体积的AlCl3溶液和NaOH溶液混合后,沉淀物中含铝的质量与溶液中含铝的质量相等,则AlCl3和NaOH两种溶液的物质的量浓度之比是( )
A. 1:3
B. 2:5
C. 1:4
D. 2:7 139830735591年前2
139830735591年前2 -
 心情晴朗 共回答了21个问题
心情晴朗 共回答了21个问题 |采纳率90.5%解题思路:将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝元素存在形式可能为AlCl3或NaAlO2,结合反应:Al3++3OH-═Al(OH)3↓或Al3++4OH-=AlO2-+2H2O,讨论进行计算.等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,设氢氧化铝的物质的量为1mol,则溶液中AlCl3或NaAlO2也是1mol,
若溶液中铝元素以Al3+形式存在,则NaOH完全反应,发生反应:
Al3++3OH-═Al(OH)3
1mol 3mol 1mol
则原来AlCl3的物质的量为1mol+1mol=2mol,NaOH为3mol,则:AlCl3和NaOH两种溶液物质的量之比=2mol:3mol=2:3,AlCl3溶液和NaOH溶液体积相等,则:AlCl3和NaOH两种溶液物质的量浓度之比也为2:3;
若溶液中含铝元素以AlO2-形式存在,则:
Al3++3OH-═Al(OH)3
1mol 3mol 1mol
Al3++4OH-═AlO2-+2H2O,
1mol 4mol 1mol
则原来AlCl3的物质的量为1mol+1mol=2mol,NaOH的物质的量为3mol+4mol=7mol,则:AlCl3和NaOH两种溶液物质的量浓度之比=2mol:7mol=2:7,AlCl3溶液和NaOH溶液体积相等,则:AlCl3和NaOH两种溶液物质的量浓度之比也为2:7;
故答案为:D.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 本题考查了根据方程式进行计算,同时考查学生分析问题、解决问题能力,很多同学往往只考虑溶液中的铝元素为铝离子而漏掉为偏铝酸根离子而导致错误,为易错点.1年前查看全部
- 某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾和胆矾晶体,以探索工业废料的再利用.
 啡吗1年前1
啡吗1年前1 -
 dannal_2004 共回答了16个问题
dannal_2004 共回答了16个问题 |采纳率81.3%(1)、Fe和Cu CO2(铝铁铜只有铝会和氢氧化钠反应,所以A是偏铝酸和氢氧化钠,B是铁和铜,然后二氧化碳和偏铝酸反应会生成氢氧化铝沉淀,因为碳酸是弱酸,所以无法继续反应)(2)、AlO2- + CO2 + 2H2O ==== Al(OH)3↓ + HCO3-
Al(OH)3 + 3H+ ==== 3H2O +Al3+
(3)、 加热蒸发冷却结晶过滤洗涤干燥
(4)、2Cu + O2 ==加热== 2CuO
CuO + H2SO4 ==== H2O + CuSO41年前查看全部
- 纯铝有什么性质?1060纯铝中的含铝量是多少?纯铝塑性怎么样?
 网迷天下1年前1
网迷天下1年前1 -
 wszhongguoren 共回答了19个问题
wszhongguoren 共回答了19个问题 |采纳率89.5%1.纯铝的性质:①熔点低②密度小③可强化④塑性好,容易加工⑤抗腐蚀⑥导热、导电性好.
2.1060纯铝的含铝量是99.6%.
3.纯铝的塑性很好哦,易折弯,但是硬度较差.1年前查看全部
- 主要是反应方程式不清楚准确称量含铝试样0.3000g,加酸溶解后,加入8-羟基喹啉(其结构式为)将铝转化为8-羟基喹啉铝
主要是反应方程式不清楚
准确称量含铝试样0.3000g,加酸溶解后,加入8-羟基喹啉(其结构式为
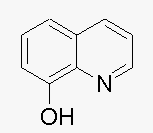 )将铝转化为8-羟基喹啉铝沉淀.过滤、洗涤分离出沉淀,并将沉淀溶解在盐酸中,加入25.00mL 0.02000mol/L KBrO3-KBr标准溶液进行反应,生成8-羟基喹啉的二溴代化合物,过量的Br2与KI 作用析出碘 ,以淀粉作指示剂,终点时需消耗0.1000mol/LNa2S2O3 标准溶液10.80mL. 计算试样中铝的质量百分含量.
)将铝转化为8-羟基喹啉铝沉淀.过滤、洗涤分离出沉淀,并将沉淀溶解在盐酸中,加入25.00mL 0.02000mol/L KBrO3-KBr标准溶液进行反应,生成8-羟基喹啉的二溴代化合物,过量的Br2与KI 作用析出碘 ,以淀粉作指示剂,终点时需消耗0.1000mol/LNa2S2O3 标准溶液10.80mL. 计算试样中铝的质量百分含量.  戏谷1年前1
戏谷1年前1 -
 aiya一声响 共回答了19个问题
aiya一声响 共回答了19个问题 |采纳率73.7%8-羟基喹啉与铝反应是8-羟基喹啉中的羟基与铝反应,其反应与酸和铝反应是一样的.
其次,所谓KBrO3-KBr标准溶液,你只要把它看做是3mol该溶液由1molBr2和2molK2BrO3的混合物就行了.当8-羟基喹啉铝溶于盐酸时,又还原为8-羟基喹啉,然后与Br2发生取代反应(像Br2与苯酚反应取代掉邻、对位就行了.然后通过未反应的Br2与Na2S2O3 标准溶液的反应算出剩下的Br2,即可知道与8-羟基喹啉反应的Br2与多少了,再然后就推出8-羟基喹啉的摩尔量了,再然后就推出与8-羟基喹啉反应的铝的量了,8-羟基喹啉与铝是3:1反应的1年前查看全部
- 一个物理问题关于密度的一个质量为232g的铜铝合金球,其中含铝54g,铜的密度为8.9g/cm3,铝的密度为2.7乘10
一个物理问题关于密度的
一个质量为232g的铜铝合金球,其中含铝54g,铜的密度为8.9g/cm3,铝的密度为2.7乘10三次方kg/m3.求合金球的密度为多少 喜欢相逢1年前2
喜欢相逢1年前2 -
 釉子111 共回答了18个问题
釉子111 共回答了18个问题 |采纳率94.4%232*10^(-3)kg
-----------------=P
V
V=54*10^(-3)/2.7*10^(-3)+(232-54)*10^(-3)/8.9*10^(-3)
解出,得:P=5.8g/cm31年前查看全部
- 1.一种铝矿石,每100克里含铝2.08克,1千克这种矿石可以提炼铝多少克?
1.一种铝矿石,每100克里含铝2.08克,1千克这种矿石可以提炼铝多少克?
2.为一条4.35千米长的铁路铺设枕木,已知平均3米的距离要用枕木5根,铁路两头都要铺.铺设这条铁路要用多少根枕木? 晴裳1年前2
晴裳1年前2 -
 天罡毒手 共回答了20个问题
天罡毒手 共回答了20个问题 |采纳率90%1、
每100克里含铝2.08克,又1千克=1000克
所以1千克这种矿石可以提炼铝:
2.08x(1000/100)=20.8克
2、
平均3米的距离要用枕木5根,又4.35千米=4350米
所以铺设这条铁路要用枕木:
5x(4350/3)+1=7251根1年前查看全部
- 含铝的盐溶液一定显酸性吗?
 zap374511年前1
zap374511年前1 -
 munder 共回答了14个问题
munder 共回答了14个问题 |采纳率85.7%不一定偏铝酸盐是碱性1年前查看全部
- 将2.3g金属钠投入到100ml 2mol/L的氯化铝溶液中,得到的含铝的产物是( )
将2.3g金属钠投入到100ml 2mol/L的氯化铝溶液中,得到的含铝的产物是( )
A. 铝
B. 氧化铝
C. 氢氧化铝
D. 偏铝酸钠 刘庆超1年前2
刘庆超1年前2 -
 唇上的蝶 共回答了21个问题
唇上的蝶 共回答了21个问题 |采纳率100%解题思路:2.3g钠的物质的量=[2.3g/23g/mol]=0.1mol,2Na+2H2O=2NaOH+H2↑,根据钠原子守恒得n(Na)=n(NaOH)=0.1mol,n(AlCl3)=2mol/L×0.1L=0.2mol,NaOH和AlCl3反应方程式为3NaOH+AlCl3=Al(OH)3↓+3NaCl、4NaOH+AlCl3=NaAlO2+3NaCl,根据n(NaOH)、n(AlCl3)的关系确定产物成分.2.3g钠的物质的量=[2.3g/23g/mol]=0.1mol,2Na+2H2O=2NaOH+H2↑,根据钠原子守恒得n(Na)=n(NaOH)=0.1mol,n(AlCl3)=2mol/L×0.1L=0.2mol,NaOH和AlCl3反应方程式为3NaOH+AlCl3=Al(OH)3↓+3NaCl、4NaOH+AlCl3=NaAlO2+3NaCl,
当n(NaOH):n(AlCl3)>4时生成NaAlO2;
当n(NaOH):n(AlCl3)<3时生成Al(OH)3;
当3<n(NaOH):n(AlCl3)<4时,生成Al(OH)3、NaAlO2,
实际上n(NaOH):n(AlCl3)=0.1mol:0.2mol=0.5<3,所以其产物为Al(OH)3,故选C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了物质间反应,明确氢氧化钠和氯化铝反应产物的分界点是解本题关键,再结合氢氧化钠和氯化铝物质的量的关系解答即可,题目难度不大.1年前查看全部
- 物理初二下学期密度应用题一个质量为232的铜铝合金块,其中含铝54克,求合金的密度.(铝的密度为2.7克/立方厘米,铜的
物理初二下学期密度应用题
一个质量为232的铜铝合金块,其中含铝54克,求合金的密度.(铝的密度为2.7克/立方厘米,铜的密度为8.9克/立方厘米) gzw77585211年前1
gzw77585211年前1 -
 lyg_xu 共回答了18个问题
lyg_xu 共回答了18个问题 |采纳率94.4%铝54克,
则铝的体积为重量/密度
=54/2.7=20 立方厘米
铜重232-54=178克,
则铜的体积为重量/密度
=178/8.9=20 立方厘米
总体积为20+20=40 立方厘米
而总重量为232克
那么合金的密度为
总重量/总体积
=232/40=5.8克/立方厘米.1年前查看全部
- 两种钢材,其中一种含铝10%,有10吨.另一种是含铝20%,有20吨,求混合以后的钢材含铝
 恐龙总动员1年前2
恐龙总动员1年前2 -
 lkl4321 共回答了11个问题
lkl4321 共回答了11个问题 |采纳率90.9%(10×10%+20×20%)÷(10+20)≈16.7%1年前查看全部
- 含铝的稀硫酸水用石灰中和后,水中还有铝吗?
 枫红落叶1年前2
枫红落叶1年前2 -
 小傻姑 共回答了18个问题
小傻姑 共回答了18个问题 |采纳率94.4%如果石灰水过量,铝元素会变为氢氧化铝沉淀下来1年前查看全部
- 是不是所有的含铝的化合物都能与酸或碱反应?
 christangdt1年前2
christangdt1年前2 -
 捡紫贝壳的女人 共回答了18个问题
捡紫贝壳的女人 共回答了18个问题 |采纳率94.4%不是,仅铝单质、氧化铝、氢氧化铝为两性.
其他铝盐(如氯化铝、硫酸铝)、偏铝酸盐不是两性.1年前查看全部
- 请问“醋酸铝”含铝、醋酸各多少?
 yuyu6988881年前1
yuyu6988881年前1 -
 lele4956 共回答了23个问题
lele4956 共回答了23个问题 |采纳率91.3%含Al:31.3953%
含醋酸根:68.61%1年前查看全部
- 若哈尔滨地铁工程需要铝合金108吨(含铝95%),在炼铝过程中,共损失铝5%,则需含氧化铝质量分数为60%的铝土矿质量为
若哈尔滨地铁工程需要铝合金108吨(含铝95%),在炼铝过程中,共损失铝5%,则需含氧化铝质量分数为60%的铝土矿质量为多少吨?只允许用初中范围内的知识,并写出用到的方程式,
 飘的风-是我1年前1
飘的风-是我1年前1 -
 我不是nn王 共回答了19个问题
我不是nn王 共回答了19个问题 |采纳率89.5%X×60%(1-5%)=108×95%
60%X=108
X=180
需含氧化铝质量分数为60%的铝土180吨1年前查看全部
- 它中氧元素的质量分数 39g它中含氧元素的质量 多少克它含铝27g 多少克它与51g氧化铝的含铝量相当?
 qq1763936691年前1
qq1763936691年前1 -
 cg89518 共回答了11个问题
cg89518 共回答了11个问题 |采纳率90.9%51g Al2O3 含有铝 1 mol(27g),对应氢氧化铝就是1mol,所以就是78克1年前查看全部
- 有一个质量为232g的铜铝合金球,其中含铝54g,求合金的密度为多少?(已知铜的密度为ρ铜=8.9g/cm3,铝的密度为
有一个质量为232g的铜铝合金球,其中含铝54g,求合金的密度为多少?(已知铜的密度为ρ铜=8.9g/cm3,铝的密度为ρ铝=2.7g/cm3)
 人生DIY1年前1
人生DIY1年前1 -
 yuelanfeng1981 共回答了8个问题
yuelanfeng1981 共回答了8个问题 |采纳率75%解题思路:已知合金球和铝的质量,可求铜的质量,根据密度公式可求铜和铝的体积,再求出总体积,总质量除以总体积就是合金球的密度.铜的质量m铜=m总-m铝=232g-54g=178g,
∵ρ=[m/V],
∴铜的体积为V铜=
m铜
ρ铜=[178g
8.9g/cm3=20cm3,
铝的体积为V铝=
m铝
ρ铝=
54g
2.7g/cm3=20cm3,
所以铜铝合金球的体积为V=V铝+V铜=20cm3+20cm3=40cm3,
合金球的密度ρ=
m总/V]=
232g
40cm3=5.8g/cm3.
答:合金球的密度为5.8g/cm3.点评:
本题考点: 密度的计算.
考点点评: 本题考查质量、体积、密度的计算,关键是公式及其变形的灵活运用,重点是求铜和铝的体积.1年前查看全部
大家在问
- 1问下哦!~是du you like swim?还是du you like swimming?
- 2一张方桌坐8人,两张方桌拼起来可以坐12人.如果有64人需要多少张方桌?四年
- 3Y在……的另一边,想要变得更加健康,不再……,牛仔服,套装,棉花,皮革,丝绸用英语怎么说?
- 4数学概率二项式题,箱中装有15张大小,重量一样的卡片,每张正面分别标有1到15中的一个号码,正面号码为n的卡片反面表的数
- 5在一幅比例尺为1:3000000的地图上,量得两地间的长度为10厘米,甲乙两车同时从两地相向而行,3小时后两车相已知甲,
- 6为什么吸气时胸内负压会变得更负,胸内负压为什么等于肺内压加上肺回缩压的负值
- 7我是一名英语课代表每次成绩都是前5名 就是没有第一名 同学们就一直在背后说我 问:课代表英语一定要第一
- 8Is Nancy watching TV?No,_______ _______a model piane.
- 9to be all curiosity专四短语如何翻译好
- 10线行代数问题求方程组的通解 x1+x2-3x3-x4=1,3x1-x2-3x3+4x4=4,x1+5x2-9x3-8x4
- 11生命,可爱而珍贵 (用英语怎么说)
- 12气体反应2A+B→A₂B,当A∶B=2∶1时,的混合气在某一条件下有0.4molA和0.2molB反应生成0.2molA
- 131的算术平方根的值是
- 14沙漠有沙子是太干燥、大海有水为何周围还有沙子
- 15连词成句1diet,is,bad,wha,a(?)2have,you,what,eaten(?)3are,good,th
