中和反应与ph40克氢氧化钠固体与200克20%的稀盐酸充分反应后,请计算溶液的ph应当在什么范围?
 jevry06062022-10-04 11:39:541条回答
jevry06062022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 大飞冲天 共回答了19个问题
大飞冲天 共回答了19个问题 |采纳率89.5%- 40 g(1mol)NaOH与200 g 20%(1.0958 mol)HCl反应 应该剩余0.0958molHCl.假设反映前后溶液体积不变(忽略加入氢氧化钠引起的体积微小变化.)根据相关数据,20%的HCl的密度为1.10 g/mL,可知溶液体积为181.82mL,反映后氢离子浓度应该为0.0005269mol/L 此时pH=3.27 可以认为在3-4之间
希望采纳 - 1年前
相关推荐
- 中和反应是指——和——反应生成——和——的化学反应.属于——反应
 cotton_cat1年前1
cotton_cat1年前1 -
 aiof 共回答了19个问题
aiof 共回答了19个问题 |采纳率94.7%酸和碱,生成盐和水,复分解反应1年前查看全部
- (2006•佳木斯)小天同学在做中和反应实验时,向盛有氢氧化钠溶液的烧杯中滴加稀盐酸后.发现忘了滴加指示剂.为确定稀盐酸
(2006•佳木斯)小天同学在做中和反应实验时,向盛有氢氧化钠溶液的烧杯中滴加稀盐酸后.发现忘了滴加指示剂.为确定稀盐酸和氢氧化钠溶液是否恰好完全反应,设计如下实验:
(1)从烧杯中取出少量反应后的溶液于试管中,向其中滴加酚酞试液,振荡观察到酚酞试液不变色.可以得出的结论是______.
(2)欲选用两类不同的试剂进一步探究,他可以选择的试剂:①______;②______.如果氢氧化钠溶液与稀盐酸没有恰好完全反应,加入试剂①观察到的现象应是______. zhuzny1年前1
zhuzny1年前1 -
 蓦然回首你在那里 共回答了17个问题
蓦然回首你在那里 共回答了17个问题 |采纳率88.2%解题思路:(1)根据酚酞在酸和碱性溶液及中性溶液中所显示的颜色进行分析;
(2)根据酸的化学性质进行解答.(1)酚酞试液不变色,说明溶液不显碱性,氢氧化钠已完全反应;
(2)酚酞试液不变色,可能是氢氧化钠和稀盐酸恰好反应,溶液呈中性,可能稀盐酸过量,要检验溶液是否是中性,可用石蕊试液,检验是否有盐酸,可加入金属、碳酸盐、金属氧化物等,根据溶液颜色变化或是否有气体生成来判断.稀盐酸和锌粒、碳酸钠反应分别生成氢气和二氧化碳,有气泡产生.
故答案为:
(1)氢氧化钠(或NaOH)已完全反应;
还可以是:反应后溶液不显碱性;反应后溶液可能为中性;反应后溶液可能为酸性;反应后的溶液中溶质可能为盐酸和氯化钠;反应后盐酸可能过量等;(其他合理答案均可)
(2)锌粒(或Zn),碳酸钠(或Na2CO3);
还可以为:紫色石蕊试液;较活泼的金属(如铁、铝等);某些金属氧化物(如氧化铜、氧化铁等);难溶性碱(如氢氧化镁、氢氧化铜等);碳酸盐(如碳酸钾、碳酸钙等)等均可
(3)有气泡产生.点评:
本题考点: 中和反应及其应用;证明碳酸盐;酸碱指示剂及其性质;酸的化学性质.
考点点评: 实验是研究化学的重要途径,本题以中和反应为载体,考查了学生对实验的分析能力,了解酸、碱的化学性质是解答的关键.1年前查看全部
- 一道初三化学题目2、在中和反应实验中滴加指示剂(酚酞溶液)的目的是 - .用滴管逐滴滴入盐酸的目的是 - .能与碱中和生
一道初三化学题目
2、在中和反应实验中滴加指示剂(酚酞溶液)的目的是 - .用滴管逐滴滴入盐酸的目的是 - .能与碱中和生成硫酸盐与水,分别写出NaOH、Cu(OH)2与稀硫酸反应的化学方程式 - ,- .中和胃酸(即盐酸)可服用含Al(OH)2的药物,其化学方程式为 - ,由于铝对人体有害,所以有的胃药已改为含Mg(OH)2则其中和胃酸的化学方程式为- . zz的男孩_zz1年前3
zz的男孩_zz1年前3 -
 so59 共回答了13个问题
so59 共回答了13个问题 |采纳率84.6%在中和反应实验中滴加指示剂(酚酞溶液)的目的是 -检验溶液的酸碱性 .
用滴管逐滴滴入盐酸的目的是 -使反应刚好完全 .
能与碱中和生成硫酸盐与水,分别写出NaOH、Cu(OH)2与稀硫酸反应的化学方程式 - ,- .
2NaOH+H2SO4==Na2So4+2H2O
Cu(OH)2+H2SO4==CuSO4+2H2O
中和胃酸(即盐酸)可服用含Al(OH)2的药物,其化学方程式为 - ,
Al(OH)3+3HCl==AlCL3+3H2O
由于铝对人体有害,所以有的胃药已改为含Mg(OH)2则其中和胃酸的化学方程式为- .
Mg(OH)2+2HCl==MgCl2+2H2O1年前查看全部
- 下列叙述,正确的是( )A.可以生成盐和水的反应称为中和反应B.碱的分子中必定含有氢元素和氧元素C.生成单质的反应,有
下列叙述,正确的是( )
A.可以生成盐和水的反应称为中和反应
B.碱的分子中必定含有氢元素和氧元素
C.生成单质的反应,有可能是置换反应
D.通过化合反应,无法得到单质 无知无谓AA1年前1
无知无谓AA1年前1 -
 紫花边雨伞 共回答了18个问题
紫花边雨伞 共回答了18个问题 |采纳率100%解题思路:根据已有的知识进行分析,中和反应是指酸和碱反应生成盐和水的反应,碱是指电离时生成的阴离子全部是氢氧根离子的化合物,置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,化合反应是指由两种或两种以上物质生成另一种物质的化学反应.A、中和反应的反应物为酸和碱,生成盐和水的反应不一定是酸和碱的反应,如二氧化碳和氢氧化钠反应能生成盐和水,故生成盐和水的反应不一定是中和反应,故A错误;
B、碱是指电离时生成的阴离子全部是氢氧根离子的化合物,碱的组成中一定含有氢元素和氧元素,但是碱不是由分子构成,而是由离子构成,故B错误;
C、置换反应或分解反应都能生成单质,故C正确;
D、化合反应的生成物是化合物,故D正确;
故选CD.点评:
本题考点: 中和反应及其应用;氧化物、酸、碱和盐的概念;化合反应及其应用;置换反应及其应用.
考点点评: 本题考查了常见的化学概念,完成此题,可以依据已有的知识进行,要求同学们熟练的理解有关的化学概念,以便灵活应用.1年前查看全部
- 酸碱中和反应就是复分解反应吧HCl+NH3=NH4Cl为什么是酸碱中和反应,为什么是复分解反应
 真正的刺客1年前2
真正的刺客1年前2 -
 nickywu 共回答了21个问题
nickywu 共回答了21个问题 |采纳率85.7%实质是:
HCl+NH3*H2O=NH4Cl+H2O1年前查看全部
- 下列叙述中,正确的是( ) A.中和反应一定是复分解反应 B.生成盐和水的反应一定是中和反应 C.复分解反应也叫中和反
下列叙述中,正确的是( )
A.中和反应一定是复分解反应
B.生成盐和水的反应一定是中和反应
C.复分解反应也叫中和反应
D.中和反应与复分解反应是两种不同基本类型的反应 A200125261年前1
A200125261年前1 -
 于入的 共回答了20个问题
于入的 共回答了20个问题 |采纳率95%A、中和反应一定是复分解反应,正确;
B、生成盐和水的反应不一定就是中和反应,如碱性氧化物和酸反应也生成盐和水,但不是中和反应,故此项错误;
C、复分解反应包含中和反应,它的范围比中和反应广的多,故此项错误;
D、中和反应属于复分解反应,是一种相同的基本反应类型,故此项错误.
故选A.1年前查看全部
- 请问:亚硫酸和NaoH生成NaHSo3为什么是中和反应?不是应该还有水生成的吗?
 lichong05331年前4
lichong05331年前4 -
 lotus_ke 共回答了18个问题
lotus_ke 共回答了18个问题 |采纳率83.3%酸与碱反应就叫中和反应!一般都会有水和盐式根产生
用离子方程式比较好理(H+) + (HSO3-) + ( Na+) + ( oH)- == H20+NaHSO3
如果你学了分子结构式,就会明白为什么的了1年前查看全部
- 在pH10 用Ca2+ 或Zn2+ 标定EDTA溶液时,为了中和基准溶液中的强酸,能否用酚酞代替甲基红来指示中和反应?
在pH10 用Ca2+ 或Zn2+ 标定EDTA溶液时,为了中和基准溶液中的强酸,能否用酚酞代替甲基红来指示中和反应?
如果不用酸碱指示剂,操作应怎样进行? whangong1年前2
whangong1年前2 -
 叮布 共回答了30个问题
叮布 共回答了30个问题 |采纳率96.7%指示剂变色只能从无色变有色,从浅色变深色.
所以不行.
如果不用酸碱指示剂,那么就是用PH计或电位滴定仪1年前查看全部
- NaOH与部分变质或全部变质与没有变质相比中和反应时消耗的量是多少
 CAOJUAN200211131年前3
CAOJUAN200211131年前3 -
 喜果 共回答了14个问题
喜果 共回答了14个问题 |采纳率92.9%NaOH与部分变质为Na2CO3
或者全部变质为Na2CO3
如果用酚酞作指示剂的话
发生的反应 Na2CO3+HCl=NaHCO3+NaCl(因为酚酞的指示范围在碱性)
消耗的量是减小的
如果用甲基橙为指示剂
发生的反应 Na2CO3+2HCl=CO2+H2ONaCl(因为甲基橙的指示范围在酸性)
消耗的量是不变的1年前查看全部
- 请举出离子方程式否定这些观点1.所有的离子方程式均可表示一类反应2.酸碱中和反应均可表示一类反应3.酸碱中和反应均可表示
请举出离子方程式否定这些观点
1.所有的离子方程式均可表示一类反应
2.酸碱中和反应均可表示一类反应
3.酸碱中和反应均可表示H+ + OH-=H2O
4.离子反应一定有离子参加
忘了题目要求是不能重复的方程式 cuzuka1年前3
cuzuka1年前3 -
 大眼儿妹 共回答了17个问题
大眼儿妹 共回答了17个问题 |采纳率100%1.HF+LIOH===H2O+LI++F-
2.H2S+2OH-==H2O+S2-
3.Ba2+ + 2OH- + 2H+ + SO42- == BaSO4!+ 2H2O
4.2Na+2H2O===2Na++2OH-+H21年前查看全部
- 在H、C、O、CL、Ca、Fe中写出中和反应
在H、C、O、CL、Ca、Fe中写出中和反应
就用这六种元素,写出中和反应 闲坐品咖啡1年前2
闲坐品咖啡1年前2 -
 披者羊皮的狼 共回答了23个问题
披者羊皮的狼 共回答了23个问题 |采纳率91.3%2HClO4 +Ca(OH)2=Ca(ClO4)2 +2H2O1年前查看全部
- 有水生成的复分解反应一定是中和反应吗
 38614261年前1
38614261年前1 -
 vv地耳 共回答了17个问题
vv地耳 共回答了17个问题 |采纳率88.2%有水生成的复分解反应不一定是中和反应
如:CuO+2HCl=CuCl2+H2O
这是有水生成的复分解反应而不是中和反应
【你的10分满意,我的无限动力】1年前查看全部
- 中和反应放热时,溶液本身的温度是升高还是降低?
中和反应放热时,溶液本身的温度是升高还是降低?
我觉得应该是降低 可是一张试卷上写: 氢氧化钠和稀盐酸反应 溶液温度先升高后降低 是放热反应 .这是为什么呢?放出了热量,那么溶液本身的温度不会降低吗?问这种问题,可不要骂我. 诗人张真1年前3
诗人张真1年前3 -
 249381070 共回答了16个问题
249381070 共回答了16个问题 |采纳率75%答案当然是升高.碱和酸发生中和反应,反应物化学键断裂放出热量(不是溶液放出热量),使溶液温度升高.待中和反应结束后,溶液恢复到室温1年前查看全部
- 鲁教版九年级全一册第二节,研究中和反应,先在氢氧化钠中滴加无色酚酞试液,试液变红,慢慢滴加稀盐酸,为什么慢慢滴加时反应不
鲁教版九年级全一册第二节,研究中和反应,先在氢氧化钠中滴加无色酚酞试液,试液变红,慢慢滴加稀盐酸,为什么慢慢滴加时反应不明显,还是红色,而到了一定时刻滴加一滴马上就变无色了吗?按理说应该是一边滴加红色一边变弱,为什么这个反应中要等到某一滴滴下时才突然变色?
为什么会有这么一个过程?log规定是什么?我们没有学到 救救工人1年前1
救救工人1年前1 -
 ak6412083 共回答了21个问题
ak6412083 共回答了21个问题 |采纳率95.2%pH中和滴定时有一个滴定突跃的过程.比如有0.1mol/L的盐酸20mL,0.1mol/L的烧碱20mL,碱滴酸.如果你算一下pH就会发现,当NaOH加到19.98mL时,那时的pH还在5左右,20mL时变成7,20.02mL时直接就变9了.因为pH的log规定是10倍关系,所以滴定完成就是那一滴不到的事,往往是一滴滴下就突然从酸变到碱了.
我来补充一下:
pH的定义是溶液中氢离子物质的量浓度的负对数.也就是说pH=-lg(c(H+)),lg是以10为底的log对数运算
比如说,10^-1=0.1,那么lg0.1=-1,10^-3=0.001,那么lg0.001=-3,也就是说它求的是指数.那么pH=1的盐酸与pH=2的盐酸,虽然pH只差1,但氢离子浓度已经差了10倍之多.
当加入19.98mLNaOH时,溶液中原有H+为20*10^-3*0.1=2*10^-3mol,加入的OH-为19.98*10^-3*0.1=1.998*10^-3,所以反应完H+还剩下了2*10^-6mol,此时溶液体积为39.98mL,所以H+的浓度为2*10^-6/0.03998=5.003*10^-5,用计算器上的log键取一下对数,pH=4.3.也就是说加入19.98mL烧碱时,pH=4.3.加入20mL时,毫无疑问完全中和,pH=7.按照上面的算法,可以算出20.02mL时,pH在9.7左右.所以pH在0.04mL这么小的范围里突然从4.3变成了9.7,这是非常快的.酚酞在一滴液体滴下的瞬间就变色了1年前查看全部
- 滴定反应,是否一定用在中和反应上?滴定二字的具体解释是什么?它的意义何在?
 不想长大的qq1年前2
不想长大的qq1年前2 -
 qy263 共回答了15个问题
qy263 共回答了15个问题 |采纳率100%不一定,氧化还原反应也可以滴定,如高锰酸钾滴定草酸,碘化钾淀粉溶液滴定氧化剂之后用硫代硫酸钠滴定上一步生成的碘
滴加(滴加滴定剂),定量(确定所求的量)
意义为 滴加滴定剂,根据滴定剂的量推出所求的量1年前查看全部
- 判断:化合反应、中和反应都是酸、碱、盐之间发生的反应
 静夜长思1年前1
静夜长思1年前1 -
 fddove 共回答了20个问题
fddove 共回答了20个问题 |采纳率100%错误
中和反应是酸、碱之间的反应
化合反应不一定是酸、碱、盐之间的反应,例如C+O2=CO21年前查看全部
- 化学反应问题 初中的硫酸和硫酸铜溶液里加氢氧化钠 为什么一开始就会产生沉淀? 不是酸碱中和反应优先吗 哪来沉淀?讲得通俗
化学反应问题 初中的
硫酸和硫酸铜溶液里加氢氧化钠 为什么一开始就会产生沉淀? 不是酸碱中和反应优先吗 哪来沉淀?
讲得通俗易懂点 长篇大论不给分 写太简单不给分 能懂就行 最好再举点其他例子 个突然让1年前7
个突然让1年前7 -
 yuhao198125 共回答了17个问题
yuhao198125 共回答了17个问题 |采纳率88.2%你往里加氢氧化钠,一开始有沉淀,是不是你摇了摇沉淀就消失了.
在溶液中都是以离子形式存在,离子之间相互碰撞能发生反应就立刻反应了.铜离子和氢氧根相互碰撞就生成氢氧化铜了,这时候还有氢离子,氢离子又碰到氢氧化铜就又生成铜离子和水了.
所以在初中时候说先和谁反应,后和谁反应都是相对加入物质混匀以后的,不是绝对的先反应后反应.1年前查看全部
- (2012•奉贤区模拟)图中表示“W、X与氧化还原反应的交叉关系”、“Y属于氧化还原反应的从属关系”、“中和反应属于Z的
 (2012•奉贤区模拟)图中表示“W、X与氧化还原反应的交叉关系”、“Y属于氧化还原反应的从属关系”、“中和反应属于Z的从属关系”.下列判断正确的是( )
(2012•奉贤区模拟)图中表示“W、X与氧化还原反应的交叉关系”、“Y属于氧化还原反应的从属关系”、“中和反应属于Z的从属关系”.下列判断正确的是( )
W X Y Z A 分解反应 化合反应 置换反应 复分解反应 B 化合反应 分解反应 复分解反应 置换反应 C 置换反应 分解反应 化合反应 复分解反应 D 复分解反应 置换反应 分解反应 化合反应
A.A
B.B
C.C
D.D hui19781年前1
hui19781年前1 -
 肖振海不是神 共回答了25个问题
肖振海不是神 共回答了25个问题 |采纳率92%解题思路:根据化合价的改变考虑,氧化还原反应中化合价一定发生了改变,复分解反应中化合价一定不变.氧化还原反应中必须有元素化合价的改变,复分解反应前后元素化合价一定没变,所以氧化还原反应与复分解反应属于并列关系,中和反应一定属于复分解反应,复分解反应不一定是中和反应,所以复分解反应包含着中和反应,所以Z是复分解反应;由于置换反应前后元素化合价一定发生了变化,所以置换反应一定是氧化还原反应,氧化还原反应不一定是置换反应,所以氧化还原反应包含着置换反应,所以Y是置换反应.化合反应和分解反应中化合价可能变化,可能不变,所以化合反应和分解反应与氧化还原反应属于交叉关系.
故选A.点评:
本题考点: 反应类型的判定.
考点点评: 解答本题关键是要知道化合价发生改变的反应一定是氧化还原反应,置换反应的化合价一定发生了改变,一定属于氧化还原反应,复分解反应前后元素化合价一定不变,一定不属于氧化还原反应.1年前查看全部
- 中和20g质量分数为20%的苛性钠溶液,需用质量分数为20%的盐酸(密度为1.11g/cm3)多少毫升才能使中和反应完成
中和20g质量分数为20%的苛性钠溶液,需用质量分数为20%的盐酸(密度为1.11g/cm3)多少毫升才能使中和反应完成?
 nb29881年前1
nb29881年前1 -
 假高手 共回答了21个问题
假高手 共回答了21个问题 |采纳率90.5%解题思路:由氢氧化钠溶液的质量和质量分数及氢氧化钠与稀盐酸反应的化学方程式可以计算出本题答案.设需用质量分数为20%的盐酸体积为x
NaOH+HCl═NaCl+H2O
4036.5
20g×20% x•1.11g/cm3•20%
[40/20g×20%=
36.5
x•1.11g/cm3•20%]
x=16.44ml
答:需用质量分数为20%的盐酸16.44ml才能使中和反应完成.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学方程式进行计算的能力,数量掌握相关的溶液及化学方程式基本计算是解题的关键所在;1年前查看全部
- 初中化学方程式中和反应
 雨在夏至1年前5
雨在夏至1年前5 -
 jefferyhsu 共回答了22个问题
jefferyhsu 共回答了22个问题 |采纳率90.9%很多的
碱+酸→盐+H2O
Cu(OH)2+2HCl==CuCl2+2H2O
Cu(OH)2+H2SO4==CuSO4+2H2O
NaOH+HCl==NaCl+H2O
2NaOH+H2SO4==Na2SO4+2H2O
NaOH+HNO3==NaNO3+H2O
Mg(OH)2+2HNO3==Mg(NO3)2+2H2O
Ba(OH)2+H2SO4==BaSO4↓+2H2O1年前查看全部
- 氢氧化钠和稀盐酸中和反应为什么要用酚酞溶液来证明刚好完全反应,为什么不用紫色石蕊?
 消炎镇痛1年前1
消炎镇痛1年前1 -
 live0820 共回答了15个问题
live0820 共回答了15个问题 |采纳率80%这是个老问题 因为石蕊如果褪色的时候氢氧化钠已经过量 在这个实验中一滴溶液 也能够很大程度上改变溶液的ph值 而相对于石蕊来说 酚酞就很能够更多降低反应的差量 其实化学没有很精确的时候 哪个更好 就哪个 与生活很像的 我上高中时最喜欢学化学了 快高考了加油啊,祝你金榜题名1年前查看全部
- 下列叙述中,正确的是( ) A.红磷在空气中燃烧产生大量白雾 B.生成盐和水的反应都是中和反应 C.电解水时加入氢氧化
下列叙述中,正确的是( ) A.红磷在空气中燃烧产生大量白雾 B.生成盐和水的反应都是中和反应 C.电解水时加入氢氧化钠可增强导电性 D.吹灭蜡烛后的瞬间,烛芯处产生大量黑烟  飘零尘埃1年前1
飘零尘埃1年前1 -
 ydydydcjcj 共回答了22个问题
ydydydcjcj 共回答了22个问题 |采纳率81.8%A、红磷在空气中燃烧,产生大量的白烟,而不是白雾,故选项说法错误.
B、生成盐和水的反应不一定都是中和反应,如二氧化碳与氢氧化钠反应生成碳酸钠和水,生成了盐和水,但不是中和反应;故选项说法错误.
C、电解水时加入氢氧化钠可增强导电性,故选项说法正确.
D、吹灭蜡烛后的瞬间,烛芯处产生大量白烟,而不是黑烟,故选项说法错误.
故选C.1年前查看全部
- 怎么判断化学反应速率大小例如 A强酸强碱溶液的中和反应B不使用催化剂的合成氨反应C氢气还原氧化铜的反应
 龙太太CC1年前4
龙太太CC1年前4 -
 Aline1979 共回答了17个问题
Aline1979 共回答了17个问题 |采纳率94.1%1、气泡冒出的速率;2、溶液变浑浊的快慢;3、溶液变色的快慢等等.
总之,只要本来有现象的反应,看现象出来的快慢即可.
你说的一般情况下,1最快,2最慢,3居中
原因1、液体间比气固快,2不加催当然最慢
不可控因素太多,我还是坚持看现象
以下参考看吧外界条件对化学反应速率的影响
(1)纯液体和固体浓度视为常数,它们的量的改变不会影响化学反应速率.但颗粒的大小导致接触面积的大小发生变化,故影响反应速率.
(2)固体、液体物质,由于压强改变时对它们的体积影响很小,因而压强对它们浓度的影响可看作不变,压强对无气体参加的化学反应的速率无影响.
(3)升高温度,不论吸热反应还是放热反应,也不论是正反应速率还是逆反应速率都增大.
(4)对于有气体参加的化学反应,有以下几种情况:
①恒温时:压缩反应体系的体积导致引起压强增大,进而导致引起反应物浓度增大,从而引起反应速率加快.
②恒温时,对于恒容密闭容器:
a.充入气体反应物导致引起气体反应物浓度增大(压强也增大),从而引起反应速率加快.
b.充入“惰性”气体导致引起气体总压强增大,但气体反应物的浓度没有改变,从而反应速率不变.
③恒温恒压时:充入“惰性”气体导致引起反应体系的体积增大,进而引起气体反应物浓度减小,从而引起反应速率减小.
(5)在其他条件相同时,使用催化剂,化学反应速率加快.
(6)另外光波、电磁波、超声波、溶剂等也能影响化学反应速率.1年前查看全部
- 将Ca(OH)2加入HCl中,溶液温度升高,可以说中和反应是放热反应吗?
 淘沙漠1年前2
淘沙漠1年前2 -
 sky_chn 共回答了14个问题
sky_chn 共回答了14个问题 |采纳率92.9%不能
只能说明他两的中和反应是放热
不能以偏概全
真要中和反应是放热反应
你需要理论的推倒和验证1年前查看全部
- 初中化学所有放热(吸热)反应我知道的有氧化反应、中和反应放热,请问还有哪些反应也放热呢?我貌似记得有四个.还有什么溶于水
初中化学所有放热(吸热)反应
我知道的有氧化反应、中和反应放热,请问还有哪些反应也放热呢?我貌似记得有四个.
还有什么溶于水也放热(吸热)之类的麻烦也列出来, liuzm5161年前3
liuzm5161年前3 -
 visioncly 共回答了24个问题
visioncly 共回答了24个问题 |采纳率95.8%浓硫酸溶于水放热
氢氧化钠溶于水放热
氧化钙与水反应放热
硝酸铵溶于水吸热
金属与酸反应生成氢气放热(如稀盐酸与镁反应放热)1年前查看全部
- 下列说法正确的是( )A. 生成盐和水的反应一定是中和反应B. 紫色的石蕊试液可使盐酸变红C. 中和反应一定生成盐和水
下列说法正确的是( )
A. 生成盐和水的反应一定是中和反应
B. 紫色的石蕊试液可使盐酸变红
C. 中和反应一定生成盐和水
D. 测定溶液的pH时,应先将pH试纸用蒸馏水润湿一下 uu小心感冒1年前1
uu小心感冒1年前1 -
 看你多牛多狠 共回答了19个问题
看你多牛多狠 共回答了19个问题 |采纳率100%解题思路:A、根据中和反应定义:酸与碱反应生成盐和水的反应考虑;B、变色的是酸碱指示剂;C、根据中和反应的定义考虑;D、根据测溶液pH的方法考虑.A、酸与碱反应生成盐和水的反应属于中和反应,生成盐和水的反应不一定是酸与碱的反应,例如金属氧化物和酸的反应,非金属氧化物和碱的反应,故A错;
B、盐酸使紫色石蕊试液变红,变色的是酸碱指示剂,故B错;
C、酸与碱反应生成盐和水的反应叫做中和反应,所以中和反应一定生成盐和水,故C正确;
D、测定溶液的pH时不能用水润湿,要用玻璃棒蘸取液体滴在pH试纸上,故D错.
故选C.点评:
本题考点: 中和反应及其应用;溶液的酸碱度测定;酸碱指示剂及其性质.
考点点评: 解答本题关键是要知道中和反应的定义,并能灵活解决实际问题,知道测溶液pH的方法,知道变色的是酸碱指示剂,而不是酸和碱.1年前查看全部
- 我要15个化学中和反应的化学式,急.
 飛一般遇見1年前4
飛一般遇見1年前4 -
 SS82 共回答了16个问题
SS82 共回答了16个问题 |采纳率87.5%37.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
38.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
39.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
40.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠与三氧化硫反应:2NaOH + SO3 ==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
47.消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49.盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O
51.盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
52.盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
57.硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
58.硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O1年前查看全部
- 为从定量角度认识中和反应,小明同学自行设计并进行了下面实验:
为从定量角度认识中和反应,小明同学自行设计并进行了下面实验:
①在小烧杯中倒人8%的氢氧化钠溶液l0g,滴入2滴酚酞试剂后,溶液呈红色;
②另取10%的稀盐酸逐滴滴加到氢氧化钠溶液中,边滴边振荡,随盐酸滴入,溶液颜色逐渐变浅;
③在溶液红色消失瞬间,停止实验。
若停止实验时,两溶液恰好反应。请分析小明实验后回答:
(1)实验中酚酞试剂的作用是_________________________;
(2)计算出这时共用去稀盐酸的质量是多少?(精确到0.1 junior3011年前1
junior3011年前1 -
 ruosipan 共回答了18个问题
ruosipan 共回答了18个问题 |采纳率88.9%(1) 判断反应进行和进行的程度;(2)7.3%
1年前查看全部
- 某同学想用NaoH固体和HCL反应来探究中和反应是否放热,请问他能得出正确的结论吗?请说明理由!
 isa包包1年前2
isa包包1年前2 -
 bsfh 共回答了24个问题
bsfh 共回答了24个问题 |采纳率91.7%不能
因为NaoH固体溶于水也会放热,所以无法说明放热一定是中和反应生成,所以要用氢氧化钠溶液.1年前查看全部
- 请问高中阶段常见的吸热反应和放热反应有哪些类型?如中和反应.这样的回答.
 zmccoming1年前1
zmccoming1年前1 -
 断絮残花 共回答了17个问题
断絮残花 共回答了17个问题 |采纳率94.1%放热反应:1.所有燃烧或爆炸反应.2.酸碱中和反应.3.多数化合反应.4.物质的缓慢氧化.5.自发进行的氧化还原反应.
吸热反应:(1)多数的分解反应(2)一些物质的溶解,如硝酸铵溶解等.(3)电离反应(4)盐类水解1年前查看全部
- 学会通过实验探究NaOH和Ca(OH)2的化学性质?(1)与指示剂;(2)与酸;什么叫中和反应?(3)与某些非金属氧化
学会通过实验探究NaOH和Ca(OH)2的化学性质?(1)与指示剂;(2)与酸;什么叫中和反应?(3)与某些非金属氧化
学会通过实验探究NaOH和Ca(OH)2的化学性质?
(1)与指示剂;(2)与酸;什么叫中和反应?(3)与某些非金属氧化物;(4)与某些盐;为什么它们具有相似的化学性质? ywgxw1年前1
ywgxw1年前1 -
 liangyiying7 共回答了19个问题
liangyiying7 共回答了19个问题 |采纳率94.7%(1)与指示剂;使紫色石蕊试液变蓝,无色酚酞试液变红.
(2)与酸;什么叫中和反应?
NaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2O
Ca(OH)2+2HCl==CaCl2+2H2O Ca(OH)2+H2SO4==CaSO4+2H2O
酸与碱反应生成盐和水的反应叫中和反应
(3)与某些非金属氧化物;
2NaOH + CO2 ==== Na2CO3 + H2O
2NaOH + SO2 ==== Na2SO3 + H2O
CO2 +Ca(OH)2 ==CaCO3↓+ H20
SO2 +Ca(OH)2 ==CaSO3↓+ H20
(4)与某些盐;为什么它们具有相似的化学性质?
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
阴离子都是氢氧根离子,所以具有相似的化学性质1年前查看全部
- 漂白粉中滴加稀盐酸,生成次氯酸的话,可以理解成中和反应生成弱电解质吗?离子方程式怎么写
 泪如雨下19841年前1
泪如雨下19841年前1 -
 cayan104 共回答了19个问题
cayan104 共回答了19个问题 |采纳率84.2%中和反应是指酸和碱反应生成盐和水
你这生成次氯酸不是中和反应
如果只看生成次氯酸,离子方程式就是[H+]+ClO-==HClO1年前查看全部
- 硫酸和氢氧化钠生成?反应都是中和反应
 云南我的梦1年前1
云南我的梦1年前1 -
 柳郁玲 共回答了12个问题
柳郁玲 共回答了12个问题 |采纳率66.7%硫酸钠和水啊1年前查看全部
- 中和反应在日常生活和工农业生产中有广泛的饮用.下列做法中,利用中和反应的是( )A.用熟石灰处理
中和反应在日常生活和工农业生产中有广泛的饮用.下列做法中,利用中和反应的是( )A.用熟石灰处理
中和反应在日常生活和工农业生产中有广泛的饮用.下列做法中,利用中和反应的是( )
A.用熟石灰处理硫酸厂废水含有的硫酸
B.用主要成分为碳酸氢钠的药物治疗胃酸过多
C.用熟石灰与硫酸铜溶液来配置农药波尔多液
D.用稀盐酸除去铁制品表面的铁锈
 皮皮鲁6661年前1
皮皮鲁6661年前1 -
 wangrui9825106 共回答了25个问题
wangrui9825106 共回答了25个问题 |采纳率88%A、熟石灰与硫酸反应生成硫酸钙和水,该反应是酸与碱反应生成盐和水的反应,属于中和反应,故选项正确.
B、碳酸氢钠与胃酸中的盐酸反应生成氯化钠、水和二氧化碳,该反应的反应物是盐和酸,生成物是盐、水和二氧化碳,不属于中和反应,故选项错误.
C、熟石灰与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钙,该反应的反应物是碱和盐,不属于中和反应,故选项错误.
D、铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,该反应的反应物是金属氧化物和酸,不属于中和反应,故选项错误.
故选:A.1年前查看全部
- 下列说法正确的是( )A. 需要加热的化学反应都是吸热反应B. 中和反应都是放热反应C. 原电池是将电能转化为化学能的
下列说法正确的是( )
A. 需要加热的化学反应都是吸热反应
B. 中和反应都是放热反应
C. 原电池是将电能转化为化学能的一种装置
D. 水力发电是将化学能转化为电能的过程 巨风大侠1年前1
巨风大侠1年前1 -
 sy1681 共回答了17个问题
sy1681 共回答了17个问题 |采纳率100%解题思路:A.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B.中和反应都是放热反应;
C.原电池是将化学能转化为电能的一种装置;
D.水力发电是将重力势能转化为电能的过程.A.放热反应有的需加热,有的不需加热.如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点.再如铝热反应也是,故A错误;
B.所有的中和反应都是放热反应,故B正确;
C.原电池是将化学能转化为电能的装置,故C错误;
D.水力发电是将重力势能转化为电能的过程,故D错误.
故选B.点评:
本题考点: 吸热反应和放热反应;常见的能量转化形式.
考点点评: 该题考查了吸热反应与放热反应,能量变化的原因.需正确理解放热吸热的本质,是解题的关键.1年前查看全部
- 25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;
25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷(C8H18)的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol
B.KOH(aq)+[1/2]H2SO4(aq)=[1/2]K2SO4(aq)+H2O(l)△H=-57.3kJ/mol
C.C8H18(l)+[25/2]O2(g)=8CO2(g)+9H2O(g)△H=-5518 kJ/mol
D.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol 吃烤肉要喝啤酒1年前1
吃烤肉要喝啤酒1年前1 -
 ttp5858 共回答了10个问题
ttp5858 共回答了10个问题 |采纳率90%解题思路:A、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,醋酸是弱酸,电离要吸热;
B、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,
C、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量;
D、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量,反应热与化学计量数成正比.A、因醋酸是弱酸,电离要吸热,所以该反应的反应热△H不是-57.3kJ/mol,故A错误;
B、符合中和热的概念,故B正确;
C、反应热化学方程式中生成的水是气体,不是稳定氧化物,故C错误;
D、热化学方程式中不是1mol物质燃烧,所以热化学方程式为:2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036kJ/mol,故D错误;
故选B.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了中和热、燃烧热的概念应用,注意概念的内涵理解是解题关键.1年前查看全部
- 有盐和水生成的反应不是中和反应的例子,及有单质和化合物生成但不是置换反应的例子
 到洛阳1年前2
到洛阳1年前2 -
 zi紫一yi 共回答了16个问题
zi紫一yi 共回答了16个问题 |采纳率87.5%有盐和水生成的反应不是中和反应:CuO+H2SO4==CuSO4+H2O
有单质和化合物生成但不是置换反应:CO+CuO===Cu+CO21年前查看全部
- 请回答下列问题(1)酸碱中和反应在生活、生产中有广泛的应用,请举一例说明。(2)酸雨是严重的环境问题之一,治理酸雨刻不容
请回答下列问题
(1)酸碱中和反应在生活、生产中有广泛的应用,请举一例说明。
(2)酸雨是严重的环境问题之一,治理酸雨刻不容缓。请说出酸雨的危害或防治措施(回答一条即可)。 zxcv23ljlkfdajsl1年前1
zxcv23ljlkfdajsl1年前1 -
 SMMCAT 共回答了20个问题
SMMCAT 共回答了20个问题 |采纳率90%(1)氢氧化铝治疗胃酸
(2)开发新能源,减少煤的燃烧1年前查看全部
- 关于酸碱中和为什么说“由于水是一种极弱的电解质,所以反应物中的酸和碱只要有一种是强电解质,中和反应就一定能发生?”难道弱
关于酸碱中和
为什么说“由于水是一种极弱的电解质,所以反应物中的酸和碱只要有一种是强电解质,中和反应就一定能发生?”
难道弱酸与弱碱不能发生中和反应吗? amamamare1年前2
amamamare1年前2 -
 feiji3 共回答了15个问题
feiji3 共回答了15个问题 |采纳率93.3%不是弱酸与弱碱就不能发生中和反应,在这里只是强调一下一定能发生的发应.
例如硫酸与氢氧化钠反应 ,如果水不是弱电解质,它会电离出氢离子和氢氧根离子,那么这个反应就相当于没有发生.1年前查看全部
- 中和反应都会放热,为什么?为什么H+和OH+反应会放热
 mbzzzz1年前1
mbzzzz1年前1 -
 lcj217 共回答了15个问题
lcj217 共回答了15个问题 |采纳率93.3%难道不知道化和过程多为放热过程么?
物质有高能向低能变迁的趋势,所以高能的物体不稳定,化合过程是多种变一种的过程,也就是不稳定到稳定,所以是放热1年前查看全部
- (2010•聊城)化学兴趣小组的同学做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生.是不是拿错了药品?经检
(2010•聊城)化学兴趣小组的同学做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生.是不是拿错了药品?经检验确认没有拿错药品,而是氢氧化钠溶液变质了.
【分析】氢氧化钠溶液变质的原因是______.
【提出问题】该氢氧化钠溶液是全部变质还是部分变质?
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓(白色)
②氯化钡溶液呈中性.
【设计实验】依据查阅的资料设计实验步骤,并进行实验,根据实验现象推断相应实验结论.
【实验结论】该兴趣小组的同学得出的结论是:氢氧化钠溶液______变质(填“部分”或“全部”).实验步骤 实验现象 实验结论 (1)取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡. 有白色沉淀产生. 说明原溶液中一定含有______. (2)取(1)试管中的上层清液滴加酚酞
试液.溶液变红色. 则溶液中一定含有______.
【进一步实验】该小组同学用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验.请你帮助他们解决下列问题:
(1)除去氢氧化钠溶液中存在的上述杂质可加入适量的______.
(2)借助于______可判断盐酸和氢氧化钠溶液恰好完全反应. 夏天是蓝色1年前1
夏天是蓝色1年前1 -
 爱毁在ww 共回答了21个问题
爱毁在ww 共回答了21个问题 |采纳率95.2%解题思路:【分析】根据实验中滴加盐酸有气体放出,可推断氢氧化钠中含有碳酸钠而变质;说明氢氧化钠吸收了空气中二氧化碳;
【实验设计】为检验变质程度,利用碳酸钠与氯化钡反应生成碳酸钡沉淀与氯化钠,可首先使用氯化钡除去变质生成的碳酸钠;然后取上层清液滴加酚酞,如果部分变质,剩余的氢氧化钠能使酚酞变红,如果全部变质,则滴加的酚酞不变色;
【实验结论】实验中观察到滴加的酚酞变红,说明上层清液中含有未变质的氢氧化钠,因此,可得出部分变质的结论;
【进一步实验】利用氢氧化钙溶液与碳酸钠发生反应生成氢氧化钠和碳酸钙沉淀,向变质的溶液中加入适量的氢氧化钙溶液充分反应后,过滤,除去碳酸钙沉淀后即可得到纯净的氢氧化钠溶液;根据酚酞遇碱变红、遇酸或中性溶液不变红的特点,可向溶液中滴入酚酞判断两者恰好完全反应.【分析】氢氧化钠能吸收空气中的二氧化碳发生反应生成碳酸钠和水而变质;故答案为:氢氧化钠与空气中的二氧化碳发生了反应;【实验设计】(1)加入的氯化钡溶液形成了白色沉淀,说明溶液中含有碳酸钠,与氯化钡生成...
点评:
本题考点: 药品是否变质的探究;碱的化学性质;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 检验氢氧化钠与碳酸钠的混合物时,可先把碳酸钠变成沉淀并且不生成影响氢氧化钠检验的碱性物质,然后使用酚酞检验氢氧化钠.1年前查看全部
- 中和反应在工农业生产和日常生活中有广泛的用途.下列应用与中和反应原理无关的是( )
中和反应在工农业生产和日常生活中有广泛的用途.下列应用与中和反应原理无关的是( )
A.蚊虫丁咬后可涂稀氨水减轻痛痒
B.服用含Al(OH)3的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸 第五天堂1年前1
第五天堂1年前1 -
 李骥 共回答了25个问题
李骥 共回答了25个问题 |采纳率88%解题思路:中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水,据此进行分析判断.A、稀氨水属于碱,能与蚊虫丁咬后产生的蚁酸反应生成盐和水,属于中和反应.
B、Al(OH)3与胃液中的盐酸反应生成氯化铝和水,是酸与碱的反应,属于中和反应.
C、熟石灰与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钙,不是酸与碱的反应,不属于中和反应.
D、NaOH溶液与硫酸反应生成硫酸钠和水,是酸与碱的反应,属于中和反应.
故选:C.点评:
本题考点: 中和反应及其应用.
考点点评: 本题难度不大,掌握中和反应的特征(反应物是酸和碱,生成物是盐和水)是正确解答此类题的关键.1年前查看全部
- 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和
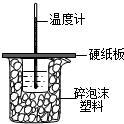 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL 0.5mol/L的盐酸与50mL.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL 0.5mol/L的盐酸与50mL.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是______;
(2)大烧杯上如不盖硬纸板,则求得的中和热数值______(填“偏大”、“偏小”、“无影响”);
(3)实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热______(填“相等”或“不相等”).
(4)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式______. xx制造1091年前1
xx制造1091年前1 -
 笑尘1225 共回答了21个问题
笑尘1225 共回答了21个问题 |采纳率85.7%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;中和热测定实验成败的关键是保温工作;
(2)不盖硬纸板,会有一部分热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据物质的物质的量与热量之间的关系以及热化学方程式的书写方法书写.(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是 保温、隔热,减少实验过程中的热量损失;
故答案为:环形玻璃搅拌棒;保温、隔热,减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的7少有关,若用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量增7,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成nmol水时放出的热,与酸碱的用量无关,所以用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行上述实验,测得中和热数值相等;
故答案为:不相等;相等;
(4)稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,稀盐酸和稀氢氧化钠溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol.点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的测定知识,注意中和热与酸、碱的物质的量无关,难度不大.1年前查看全部
- 什么叫置换反应;中和反应举个例子.简单一点.我现在还不明白什么是酸和碱.
 黑马金股1年前1
黑马金股1年前1 -
 tbjma 共回答了10个问题
tbjma 共回答了10个问题 |采纳率100%置换反应是无机化学反应的基本类型之一,指一种单质和一种化合物生成另一种单质和另一种化合物的反应,可表示为:
A+BC→B+AC
置换关系是指组成化合物的某种元素被组成单质的元素所替代.
例Zn+2HCl=H2↑+ZnCl2
中和反应
酸和碱互相交换成分,生成盐和水的反应.
(中和反应属于复分解反应)
中和反应的实质是:H+和OH-结合生成水(H2O).
酸+碱→盐+水 例如HCl+NaOH=NaCl+H2O1年前查看全部
- 1 在稀溶液中,酸跟碱发生中和反应生成1mol水所放出的热量称为中和热.(条件不应该还加上强酸强碱吗.)
1 在稀溶液中,酸跟碱发生中和反应生成1mol水所放出的热量称为中和热.(条件不应该还加上强酸强碱吗.)
2 中和热包括物质溶解,电离,水合等过程中的热效应.求问哪里错了 leooe1年前2
leooe1年前2 -
 ywq_001 共回答了23个问题
ywq_001 共回答了23个问题 |采纳率95.7%抱歉刚才只回答了你一个问题,我没有仔细看题请谅解1年前查看全部
- 下列叙述中,正确z是( )A.中和反应一定是复分解反应B.生成盐和水的反应一定是中和反应C.复分解反应也叫中和反应D.
下列叙述中,正确z是( )
A.中和反应一定是复分解反应
B.生成盐和水的反应一定是中和反应
C.复分解反应也叫中和反应
D.中和反应与复分解反应是两种不同基本类型的反应 f121844821年前1
f121844821年前1 -
 zhouhui818 共回答了21个问题
zhouhui818 共回答了21个问题 |采纳率90.5%解题思路:复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应;中和反应是酸和碱互相交换成分,生成盐和水的反应.中和反应属于复分解反应,是一种特殊的复分解反应.A、中和反应一定是复分解反应,正确;
B、生成盐和水的反应不一定就是中和反应,z碱性氧化物和酸反应也生成盐和水,但不是中和反应,故此项错误;
C、复分解反应包含中和反应,它的范围比中和反应广的多,故此项错误;
的、中和反应属于复分解反应,是一种相同的基本反应类型,故此项错误.
故选A.点评:
本题考点: 中和反应及其应用;复分解反应及其应用.
考点点评: 要明确中和反应和复分解反应的关系:中和反应一定是复分解反应,但是复分解反应不一定是中和反应,它们是包含关系.1年前查看全部
- 下列物质间的作用不属于中和反应的是
下列物质间的作用不属于中和反应的是
A、Cu(OH)2、H2SO4
B、Mg(OH)2、HCl
C、NaOH、HNO3
D、Ca(OH)2、CO2 andyross1年前1
andyross1年前1 -
 52137 共回答了24个问题
52137 共回答了24个问题 |采纳率95.8%选D
中和反应是酸碱之间的反应
D选项二氧化碳是酸性氧化物 不是酸1年前查看全部
- 酸碱一定发生中和反应吗?
 海南的1年前3
海南的1年前3 -
 xiaoqiumm 共回答了17个问题
xiaoqiumm 共回答了17个问题 |采纳率94.1%不一定,两者必须有一者是溶液
像硅酸和氢氧化铝就不反应1年前查看全部
- 在中和反应实验时,某化学兴趣小组设计了如下几个实验方案你认为较好的是
在中和反应实验时,某化学兴趣小组设计了如下几个实验方案你认为较好的是
指示剂 酸中颜色 pH变色范围 碱中颜色
酚酞 pH10 红色
石蕊 pH10 蓝色
A在滴有紫色石蕊的盐酸中滴加氢氧化钠溶液
B在滴有无色酚酞的盐酸中滴加氢氧化钠溶液
C在滴有紫色石蕊的氢氧化钠溶液中滴加盐酸
D在滴有无色酚酞的氢氧化钠溶液中滴加盐酸
此题为不定项选择.要理由过程, lousefigo1年前2
lousefigo1年前2 -
 k6poa6ha 共回答了15个问题
k6poa6ha 共回答了15个问题 |采纳率80%紫色石蕊酸色和碱色区别不明显,故A、C排除.
D选项中,酚酞ph变色范围是8~10,也就是说还没有等到pH=7,酚酞就褪色了.如果真的需要用酸滴碱,甲基橙指示剂相对准确和灵敏.
B选项在临近终点、有酚酞的盐酸(很淡的粉色)中再滴入一滴氢氧化钠溶液,振荡,溶液30秒不变色说明到达滴定终点.1年前查看全部
大家在问
- 1帮忙翻译一下这句话 英译汉You will be invoiced for later semesters once y
- 2远视眼戴眼镜看到的是实像还是虚像?
- 3at an end用法
- 4急速1.rt三角形abc的两条直角边a,b满足方程x^2-3x+1=0,则斜边c=
- 5会文言文的同志,将宁家贵女彩蝶斩讫,玉盘托美貌贵女姑娘螓首来报,
- 6hottest combination什么意思
- 7三枚一元硬币,全部反面朝上,每次翻动两枚硬币,问翻多少次全部正面朝上?
- 8请用 this is my day 写一篇英语作文,不少于65个单词,不要抄的,必采纳
- 9英语翻译请帮忙中翻英:附件已做修改,修改部分用绿色字体标示出来了,请审阅,如有问题请及时告知.
- 10从01—33总共33个红球中任选6个红球,总共多少种选法?C(33,6)=(33*32*31*30*29*28)/(1*
- 11多项式3(x-2)-2x(2-x)分解因式结果
- 12英语翻译Hi,我叫Hermione,我非常荣幸参加这次比赛,我非常喜欢英语,我喜欢听英语歌和英语广播剧.在这儿站着的所有
- 13小明给小刚4架飞机后,他们的纸飞机就同样多.原来小明折的飞机比小刚多多少架?
- 14木石木能组成什么字?石木石能组成什么字?
- 15what和hot中的wh和h读音一样吗
