氢氧燃料电池是符合绿色化学理念的新型发电装置。 下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性
 tianhaol2022-10-04 11:39:541条回答
tianhaol2022-10-04 11:39:541条回答| 氢氧燃料电池是符合绿色化学理念的新型发电装置。 下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答: |
 |
| (1)氢氧燃料电池的能量转化主要形式是 __________________,在导线中电子流动方向为_________ (用a、b表示)。 (2)负极反应式为_________________ 。 (3)电极表面镀铂粉的原因为________________________。 (4)该电池工作时,H 2 和O 2 连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下: |
  ↑ ↑ |
| ①反应I中的还原剂是__________ ,反应Ⅱ中的氧化剂是______________________。 ②已知LiH固体密度为0.82 g/cm 3 ,用锂吸收224 L(标准状况)H 2 ,生成的LiH体积与被吸收的H 2 体积比为_________________________。 ③由②生成的LiH与H 2 O作用,放出的H 2 用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为______________________ mol。 |

已提交,审核后显示!提交回复
共1条回复
 穿越赤道 共回答了15个问题
穿越赤道 共回答了15个问题 |采纳率93.3%- (1)由化学能转变为电能;由a到b
(2)2H 2 +4OH - -4e - ===4H 2 O或H 2 +2OH - - 2e - === 2H 2 O
(3)增大电极单位面积吸附H 2 、O 2 分子数,加快电极反应速率
(4)①Li ;H 2 O ②1/1148或8.71×10 -4 ;③32 - 1年前
相关推荐
- 氢氧燃料电池为什么氢气会自发失去电子
氢氧燃料电池为什么氢气会自发失去电子
网上有人说在一个氢气和氧气混合的瓶子里扔一点铂粉进去就能***.
可是问题是现在在整个装置中氢气在负极就自发地失去了电子,氢气和氧气分别是从两边通进来,我的理解是氢气还没遇上氧气呢,就遇到了铂就把自己的电子给出去了.
为啥?
如果氧极我不通入氧气,那么氢极的氢气因为铂的催化失去电子吗?如果不,那么铂是怎么得知氧极有氧气通入的? cao_sunli1年前1
cao_sunli1年前1 -
 紫三芸 共回答了9个问题
紫三芸 共回答了9个问题 |采纳率100%你可以把整个装置看做是一个循环水系统.能否得失电子或者说是否发生化学反应取决于电势差.氢气在负极失去电子,电子会顺着导线流向正极.相当于水从低压处流向高压处.化学发生的本质是得失电子,物质是不变的.它只会从一种状态变化成另一种状态.电子可以通过导体转移,因此发生反应是合乎情理的.1年前查看全部
- 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为______(用a、b表示).
(2)负极反应式为______.
(3)电极表面镀铂粉的原因为______.
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
2LIH;△ .
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是______,反应Ⅱ中的氧化剂是______.
②用锂吸收224L(标准状况)H2,生成的LiH与H2O作用后放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为______mol.
(5)肼一空气燃料电池是一种碱性电池,该电池放电时,肼作______极,其电极反应式为(生成无污染物质)______. RETSRA1年前1
RETSRA1年前1 -
 lajhuaxia 共回答了11个问题
lajhuaxia 共回答了11个问题 |采纳率72.7%解题思路:(1)原电池是将化学能转变为电能的装置,原电池放电时,电子从负极沿导线流向正极;
(2)负极上燃料失电子发生还原反应;
(3)参加反应的物质浓度增大,反应速率加快;
(4)根据化合价的变化判断氧化剂和还原剂,根据氢气和转移电子之间的关系式计算;
(5)燃料电池中,燃料易失电子发生氧化反应,所以燃料的电极是负极.(1)该装置是把化学物质中的能力转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是 由a到b,
故答案为:化学能转变为电能;由a到b;
(2)该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为H2+2OH--2e-═2H2O,故答案为:2H2+4OH--4e-═4H2O或 H2+2OH--2e-═2H2O.
(3)电极表面镀铂粉,增大了电极单位面积吸附H2、O2的分子数,使反应物的浓度增大,反应速率加快,
故答案为:增大电极单位面积吸附H2、O2的分子数,加快电极反应速率;
(4)①Ⅰ.2Li+H2
△
.
2LIH中锂失电子作还原剂,Ⅱ.LiH+H2O═LiOH+H2↑中水得电子作氧化剂,故答案为:Li;H2O;
②氢气的物质的量=[224L/22.4L/mol]=10mol,当吸收10molH2时,则生成20molLiH,20molLiH可生成20mol H2,实际参加反应的H2为20mol×80%=16mol,1molH2转化成1molH2O,转移2mol电子,所以16molH2可转移32mol的电子,故答案为:32;
(5)燃料电池中,通入燃料的电极是负极,则通入肼的负极是负极,负极上肼失电子和氢氧根离子反应生成氮气和水,电极反应式为:N2H4-4e-+4 OH-═N2+4H2O,
故答案为:负;N2H4-4e-+4 OH-═N2+4H2O.点评:
本题考点: 化学电源新型电池;氧化还原反应.
考点点评: 本题考查化学电源的工作原理及有关计算,题目难度较大,注意原电池电极反应式的书写以及从电子守恒的角度计算.1年前查看全部
- 请问氢氧燃料电池的负极反应式,正极反应式,总反应式怎么写?
 xhb151年前0
xhb151年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 电解质溶液为硫酸钠的氢氧燃料电池的正负极方程式~
 E叶孤舟1年前1
E叶孤舟1年前1 -
 追忆那夜醉意 共回答了23个问题
追忆那夜醉意 共回答了23个问题 |采纳率82.6%正极:O2 +2H2O+4e==4OH-
负极:H2 -2e ==2H+
总反应 2H2 +O2 ==2H2O1年前查看全部
- 燃料电池是原电池么?原电池不应该是自发的氧化还原反应吗?就氢氧燃料电池而言,我所知道的就是氧气氢气点燃能反应,那这个反应
燃料电池是原电池么?
原电池不应该是自发的氧化还原反应吗?就氢氧燃料电池而言,我所知道的就是氧气氢气点燃能反应,那这个反应还算是自发反应吗? 泠月1年前2
泠月1年前2 -
 yinyang 共回答了21个问题
yinyang 共回答了21个问题 |采纳率95.2%是的,只要是能在一定条件下发生的氧化还原反应都可以设计成电池,
而我们把燃料燃烧的原理的电池叫做燃料电池1年前查看全部
- 阿波罗号宇宙飞船上使用的氢氧燃料电池,其电池反应为:2H2+O2=2H2O ,电解质溶液为KOH溶液,反应保持在较高温度
阿波罗号宇宙飞船上使用的氢氧燃料电池,其电池反应为:2H2+O2=2H2O ,电解质溶液为KOH溶液,反应保持在较高温度,使H2O蒸发,则下列叙述中正确的是①此电池工作时能发出蓝色火焰
②通入氢气的电极为电池的正极
③电池工作时电解液的碱性不断增强
④负极的电极反应式为2H2+4OH--4e-===4OH- ③为什么错 米奇_米妮1年前2
米奇_米妮1年前2 -
 yusihui 共回答了15个问题
yusihui 共回答了15个问题 |采纳率86.7%碱性不断减弱1年前查看全部
- 燃料电池计算一个氢氧燃料电池要在半小时提供5.5千瓦时能量要消耗多少水?
 princedick1年前1
princedick1年前1 -
 无花果的花泪 共回答了17个问题
无花果的花泪 共回答了17个问题 |采纳率64.7%氢氧燃料电池是生成水的.1年前查看全部
- 氢氧燃料电池有高手能讲下反应原理吗?(希望能把电子转移过程说明)还有,氧气得电子后为什么一定和水反应,不会生成氧化钾之类
氢氧燃料电池
有高手能讲下反应原理吗?
(希望能把电子转移过程说明)
还有,氧气得电子后为什么一定和水反应,不会生成氧化钾之类?
以及此类的反应方程怎么写,.. zhongguolw1年前1
zhongguolw1年前1 -
 小小盗贼 共回答了18个问题
小小盗贼 共回答了18个问题 |采纳率83.3%燃料电池是一种化学电池,它利用物质发生化学反应时释出的能量,直接将其变换为电能.从这一点看,它和其他化学电池如锰干电池、铅蓄电池等是类似的.但是,它工作时需要连续地向其供给反应物质——燃料和氧化剂,这又和其...1年前查看全部
- 拿氢氧燃料电池来说在原电池中,如果环境是中性则氧气与水反应.如果是酸性环境下,则氧气与氢离子反应反应在电解池中的时候,没
拿氢氧燃料电池来说在原电池中,
如果环境是中性则氧气与水反应.如果是酸性环境下,则氧气与氢离子反应反应
在电解池中的时候,没说在什么环境下比如说电解液是氯化钠溶液那么溶液中就有 钠离子 氢离子 氢氧根 氯离子
但为什么同样都有电解质溶液中的原电池中性环境下就没有氢离子和氢氧根呢?
不都是有水的吗而电解池在中兴环境下,电解液就有氢离子和氢氧根.
比如说电解氯化钠,阴极就有氢离子 wujia_07291年前1
wujia_07291年前1 -
 小山雨果 共回答了20个问题
小山雨果 共回答了20个问题 |采纳率80%主要要比较阴阳离子的放电顺序了哦1年前查看全部
- 某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的 是
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的 是
A C D就不打了都会
B工作一段时间后,电解质中的KOH的物质的量不变 为什么正确请解释下, shanyufeng119091年前4
shanyufeng119091年前4 -
 nerves319 共回答了16个问题
nerves319 共回答了16个问题 |采纳率93.8%如果是氢氧燃料电池,碱性环境,那么,它的负极反应式为 2H2-4e+4OH-=4H2O 正极反应式为 O2+2H2O+4e=4OH-总反应,2H2+O2=2H2O整个过程或,KOH不参加反应,所以,它的物质的量不变.1年前查看全部
- 关于氢氧燃料电池,碱性环境中,正极,为什么氧离子与氢离子结合后要生成氢氧根离子,而不是生成水?什么时候生成水什么时候生成
关于氢氧燃料电池,碱性环境中,正极,为什么氧离子与氢离子结合后要生成氢氧根离子,而不是生成水?什么时候生成水什么时候生成氢氧根离子?
 青芙1年前1
青芙1年前1 -
 gj_luo 共回答了17个问题
gj_luo 共回答了17个问题 |采纳率76.5%正极 氧气得电子和水结合生成氢氧根
负极 氢气失电子和氢氧根结合生成水1年前查看全部
- 为什么在氢氧燃料电池中碱性环境中氢气不能生成氢离子而是生成水
 xuser91年前3
xuser91年前3 -
 ccfy 共回答了23个问题
ccfy 共回答了23个问题 |采纳率91.3%可以生成氢离子,但是氢离子会和氢氧根结合生成水1年前查看全部
- 为什么适合作实用性氢氧燃料电池的电解质是磷酸
为什么适合作实用性氢氧燃料电池的电解质是磷酸
为什么是磷酸而不是其他酸 C水灵儿1年前1
C水灵儿1年前1 -
 22Cher 共回答了21个问题
22Cher 共回答了21个问题 |采纳率81%一般来讲,书写燃料电池的化学反应方程式,需要高度注意电解质的酸碱性.在正、负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系.如氢—氧1年前查看全部
- 氢氧燃料电池,H2在负极发生氧化反应,哪地方不对
 孤煞寒星1年前1
孤煞寒星1年前1 -
 cxwlyy 共回答了9个问题
cxwlyy 共回答了9个问题 |采纳率66.7%H2失电子发生氧化反应是负极对的了啊.1年前查看全部
- 氢氧燃料电池可将热能直接转换为电能?
 lihao_1年前1
lihao_1年前1 -
 echo7658 共回答了25个问题
echo7658 共回答了25个问题 |采纳率96%热能转为化学能,再转为电能.1年前查看全部
- 氢氧燃料电池中负极的氢气为什么会无缘无故失去电子?
 想进来玩玩1年前2
想进来玩玩1年前2 -
 lanbinger 共回答了21个问题
lanbinger 共回答了21个问题 |采纳率90.5%它不是无缘无故的失电子,氢氧燃料电池是水的电解的逆反应,它的内部构造很复杂的,不想你想的那么简单, 氢氧燃料电池工作时,向氢电极供应氢气,同时向氧电极供应氧气.氢、氧气在电极上的催化剂作用下,通过电解质生成水,这时在氢电极上有多余的电子而带负电,在氧电极上由于缺少电子而带正电.接通电路后,这一类似于燃烧的反应过程就能连续进行.1年前查看全部
- 为什么氢氧燃料电池,工作一段时间后,电解液中KOH的物质的量浓度怎么变化
 peterhuang111年前2
peterhuang111年前2 -
 梦漂游 共回答了15个问题
梦漂游 共回答了15个问题 |采纳率93.3%氢氧燃料电池反应式:2H2+O2==2H2O
工作一段时间后由于生成水而使电解液中KOH的物质的量浓度变小.1年前查看全部
- 为什么在氢氧燃料电池中碱性环境中氢气不能生成氢氧根而是生成水
为什么在氢氧燃料电池中碱性环境中氢气不能生成氢氧根而是生成水
从电性角度能不能解释一下 yuyong221年前1
yuyong221年前1 -
 chen00lc 共回答了22个问题
chen00lc 共回答了22个问题 |采纳率77.3%氢气失去电子形成氢离子与氢氧根结合生成水了1年前查看全部
- 氢氧燃料电池不同电解质的方程式有什么规律么
 ray879896111年前1
ray879896111年前1 -
 yu_xiang0653 共回答了17个问题
yu_xiang0653 共回答了17个问题 |采纳率94.1%电解质溶液为酸性:负极:H2-2e==2H+ :
正极:O2+4e +4H+ ==2H2O
电解液为碱性: 负极:H2-2e+2HO- ==2H2O
正极:O2+4e +2H2O=4HO-
但是电池总反应是一样的,都是2H2 +O2=2H2O,
有一种比较麻烦的方法就是你把这两个基本的背下来,以后会学到甲烷,甲醛之类的电解方程式,根据总得减正或负极的1年前查看全部
- 不是说共价化合物发生氧化还原反应没有电子的转移吗,那为什么氢氧燃料电池里却发生了电子转移
 flyinghorsess1年前3
flyinghorsess1年前3 -
 肉肉胖胖 共回答了12个问题
肉肉胖胖 共回答了12个问题 |采纳率83.3%氧化还原反应是伴随著电子得失的,所以一定有电子的转移
只不过,共价化合物在反应时不会电离,也就是不会呈离子的状态,但是它的化合价还是变化的,也就是还是有电子转移的(化合价变化根本原因是电子转移)
所以,在写方程式的时候,像水这些共价化合物是不用拆成离子的
仅此而已
楼主应该是对这个搞混了吧
以上1年前查看全部
- 氢氧燃料电池碱性条件下是否会是溶液中的氢氧根浓度减小
 爱无尘1231年前3
爱无尘1231年前3 -
 更好生活 共回答了19个问题
更好生活 共回答了19个问题 |采纳率84.2%不对,因为O2-极不稳定,不能单独存在于溶液中,所以它和水生成OH-,以中和氢气生成H+,从而使电解液的pH值不变.1年前查看全部
- 请问:某氢氧燃料电池的电解液为KOH溶液,正极反应式为O3+2H2O+4e-==4OH-对吗?
 xhh1416681年前1
xhh1416681年前1 -
 168lxy 共回答了18个问题
168lxy 共回答了18个问题 |采纳率88.9%因该是O2+2H2O+4e-==4OH-,楼主打错了吧.但凡电解质为碱,正极都是这个反映方程式1年前查看全部
- 氢氧燃料电池能量转换率比氢气直接燃烧高?
 goal981年前1
goal981年前1 -
 卧室vv 共回答了14个问题
卧室vv 共回答了14个问题 |采纳率100%没错.在这里反映的温度越低,能量转化率越高.对于这个现象的解释稍稍用到一点大学的内容.氢氧燃料电池与氢气直接燃烧放出的能量是一定的,所以在相同的压力下他们的焓变(ΔH)是一样的.而反应所能做的有用功等于它的自由能变(ΔG),而ΔG=ΔH-Δ(TS),T是温度,S是熵,可以假设他不随温度改变,故ΔG=ΔH-TΔS,可以看出T越高,ΔG越低,所能做的有用功越少,因此效率越低.用这个道理也可以解释为什么生物转化化学能的效率较高.1年前查看全部
- 氢氧燃料电池中,氢气为何失电子?有什么促使它失电子吗
 323112841年前2
323112841年前2 -
 鲜橙浅绿 共回答了17个问题
鲜橙浅绿 共回答了17个问题 |采纳率100%氢失去的电子是被氧得了的,所以氧气的氧化性就是氢气失去电子的动力1年前查看全部
- 氢气和氧气的反应条件是点燃,为什么在氢氧燃料电池中无需点燃,氢却可以失电子与氧反应?
 樱飞月舞1年前1
樱飞月舞1年前1 -
 ttkaka 共回答了16个问题
ttkaka 共回答了16个问题 |采纳率81.3%你说的点燃和燃料电池的氧化反应一样的啊.点燃是氢氧在高温状态下的.剧烈的氧化反应.氢氧在高温下化学性质会非常活跃.会产生大量能量就是热.一时间无法流散.你就会看见光.燃料电池是在催化剂的作用下加速了氧化反应.两者性质一样的1年前查看全部
- 氢氧燃料电池固体氧化物电解质传氧离子电极反应方程式
 wangdeyin1111年前1
wangdeyin1111年前1 -
 h31h 共回答了19个问题
h31h 共回答了19个问题 |采纳率94.7%正极:0₂+4H-+4e-=2H₂O
负极:2H₂-4e-=4H+1年前查看全部
- 氢氧燃料电池,电解质是氯化钠的电极反应式
 mylnesochen1年前1
mylnesochen1年前1 -
 多爱我一点 共回答了19个问题
多爱我一点 共回答了19个问题 |采纳率94.7%2H2-4eˉ=4H(阳离子),正极为:O2+4eˉ+2H2O=4OHˉ1年前查看全部
- 氢氧燃料电池中碱性环境中生成的氢离子是与水中氢氧根反应还是与碱中的氢氧根离子反应?
氢氧燃料电池中碱性环境中生成的氢离子是与水中氢氧根反应还是与碱中的氢氧根离子反应?
氢离子在酸性和中性环境下不与氢氧根发生结合,是不是说在碱性溶液中与氢离子结合的氢氧根离子是碱性溶质中的而不是溶液中的水中的? xinyangyanggua1年前1
xinyangyanggua1年前1 -
 ginnygirl 共回答了19个问题
ginnygirl 共回答了19个问题 |采纳率84.2%对~会抑制水电解1年前查看全部
- 氢氧燃料电池 在碱性条件下的 反应方程式?
 ratxbpc1年前1
ratxbpc1年前1 -
 0798 共回答了24个问题
0798 共回答了24个问题 |采纳率91.7%负极反应式为:2H2 + 4OHˉ-4eˉ== 4H20 正极为:O2 + 2H2O + 4eˉ== 4OHˉ1年前查看全部
- 氢氧燃料电池酸性条件下负极为什么生成co2,而不是碳酸氢根?不是有有大量的氢离子吗?
 浅草沉钟1年前2
浅草沉钟1年前2 -
 中文之星星 共回答了19个问题
中文之星星 共回答了19个问题 |采纳率84.2%有大量的氢离子,所以才会是CO2啊.这是反应平衡,开始生成少量CO2,而它是气体,跑掉了,溶液中含量就好,因此平衡向着生成CO2的方向移动,然后一直生成它了,碳酸氢根只是中间过渡1年前查看全部
- 用某氢氧燃料电池(用氢氧化钾水溶液为电解质溶液)电解饱和亚硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极.下列说法正
用某氢氧燃料电池(用氢氧化钾水溶液为电解质溶液)电解饱和亚硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极.下列说法正确的是( )
A.当燃料电池正极消耗mg气体时,电解池阴极同时有mg气体生成
B.电解池的阳极反应式为:4OH--4e-=O2↑+2H2O
C.电解池中溶液pH变小
D.燃料电池中溶液pH变大 ll物理1年前1
ll物理1年前1 -
 jsafhkj2hkjhfaks 共回答了30个问题
jsafhkj2hkjhfaks 共回答了30个问题 |采纳率76.7%解题思路:该燃料电池为碱性电池,电池的正极反应为:O2+2H20+4e-═4OH-,负极反应为:H2-2e-═2H+,或H2+2e-+2OH-═H2O,电解Na2SO3水溶液阳极发生的反应为:SO3 2--2e-+H2O=SO4 2-+2H+,阴极反应为:2H++2e-═H2↑,以此回答各电极的变化.A、正极反应为:O2+2H20+4e-═4OH-,当正极消耗mg气体时,转移的电子的物质的量为[m/32mol×4=
m
8]mol,电解池阴极得电子为[m/8]mol,阴极反应为:2H++2e-═H2↑,阴极生成气体的质量为 [m/8]mol×2g/mol=[m/4]g,故A错误;
B、电解Na2SO3水溶液阳极发生氧化反应,电极反应为:SO3 2--2e-+H2O=SO4 2-+2H+,故B错误;
C、电解亚硫酸钠溶液时,溶质由亚硫酸钠变成硫酸钠,亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性,所以电解过程中溶液的pH变小,故C正确;
D、燃料电池的总反应为O2+2H2═2H20,溶质的物质的量不变,但溶液的体积增大,所以原电池中c(KOH)减小,故D错误;
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查了原电池和电解池原理,注意电极方程式的书写,易错选项是B,注意电解亚硫酸钠溶液时,阳极上亚硫酸根离子放电而不是氢氧根离子放电,为易错点.1年前查看全部
- 酸性溶液电解质的氢氧燃料电池正极氧气为什么不会与水反应
 沧天有涯1年前2
沧天有涯1年前2 -
 xtadtj 共回答了23个问题
xtadtj 共回答了23个问题 |采纳率91.3%氧原子得到电子后变成阴离子直接和酸性溶液中的H+结合生成了水.水本身电离出的H+比起溶液中的氢离子浓度小.1年前查看全部
- 氢氧燃料电池选择不同的电解质溶液有什么区别
 xyf19791年前1
xyf19791年前1 -
 无循 共回答了14个问题
无循 共回答了14个问题 |采纳率85.7%氢氧燃料电池用硫酸做电解质溶液和用氢氧化钠只电解液在书写电极反应式是不同的
用硫酸做电解质溶液:负极:H2-2e==2H+ :
正极:O2+4e +4H+ ==2H2O
用氢氧化钠最电解液:负极:H2-2e+2HO- ==2H2O
正极:O2+4e +2H2O=4HO-
但是电池总反应是一样的,都是2H2 +O2=2H2O1年前查看全部
- 氢氧燃料电池为什么必须有电解质溶液?
 x104181年前1
x104181年前1 -
 桑城学子 共回答了19个问题
桑城学子 共回答了19个问题 |采纳率84.2%因为需要使电子通过、形成电流,进而形成原电池的介质啊……1年前查看全部
- 在氢氧燃料电池中,消耗2mol氢气,可提供多少千焦的电能?(KOH做电解质)
在氢氧燃料电池中,消耗2mol氢气,可提供多少千焦的电能?(KOH做电解质)
1molH--H键,耗能436KJ 1molO==O键,耗能497.2KJ 1molO-----H键,耗能462.8KJ 1mol水蒸气变成1mol液态水释放能量44kj 箹锭1年前1
箹锭1年前1 -
 rube1126 共回答了21个问题
rube1126 共回答了21个问题 |采纳率95.2%生成2mol水需要打断2molH-H键,打断1molO==O键,生成4molO-H键
放出的热为4*462.8-2*436-497.2=482KJ
加上转化为液态水放热为2*44=88KJ
一共放热为482+88=570KJ,可提供570千焦的电能1年前查看全部
- 空间实验室“天宫一号”他供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合他可充电
 空间实验室“天宫一号”他供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合他可充电电池.如n为RFC工作原理示意n,有关说法正确他是( )
空间实验室“天宫一号”他供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合他可充电电池.如n为RFC工作原理示意n,有关说法正确他是( )
A.转移0.1mol电子时,a电极产生1.12LH2(标准状况)
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O dayangzining1年前1
dayangzining1年前1 -
 芭比娃娃麗 共回答了18个问题
芭比娃娃麗 共回答了18个问题 |采纳率94.4%解题思路:依据图示ab电极是电解池的电极,由电源判断a为阴极产生的气体是氢气,b为阳极产生的气体是氧气;c、d电极是原电池的正、负极,c是正极,d是负极;电解池中的电极反应为:b电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑,a电极为阴极得到电子发生还原反应:4H++4e-=2H2↑,原电池中是酸性溶液,电极反应为:d为负极失电子发生氧化反应:2H2-4e-=4H+,c电极为正极得到电子发生还原反应:O2+4H++4e-=2H2O,结合电极上的电子守恒分析计算.电解池s的电极反应为:b电极为阳极失电子发生氧化反应:4手H--4e-=rHr手+手r↑;a电极为阴极得到电子发生还原反应:4H++4e-=rHr↑;
原电池s是酸性溶液,电极反应为:d为负极失电子发生氧化反应:rHr-4e-=4H+;c电极为正极得到电子发生还原反应:手r+4H++4e-=rHr手;
A、阳极电极反应计算,当有w.1 w手四电子转移时,a电极产生1.1r四Hr故A正确;
B、b电极上发生的电极反应是4手H--4e-=rHr手+手r↑,故B错误;
C、c电极上进行还原反应,B池s的H+可以通过隔膜进入A池,故C正确;
D、d电极上发生的电极反应是:rHr-4e-=4H+;故D错误;
故选AC.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了化学电源新型电池,主要考查原电池和电解池的工作原理,电极判断,电极反应,关键是原电池中电解质溶液是酸性环境,注意电极书写.1年前查看全部
- 关于燃料电池反应原理的问题我想知道,电解质是什么,在反应中的作用,还有高一的课本中氢氧燃料电池的构造图中,通入氢气,氧气
关于燃料电池反应原理的问题
我想知道,电解质是什么,在反应中的作用,还有高一的课本中氢氧燃料电池的构造图中,通入氢气,氧气,但没有说怎么燃烧,我想知道比较具体的原理
最后一个问题,是不是电解质不一定参加电极反应,那它的作用是? 幸福就在身旁1年前3
幸福就在身旁1年前3 -
 wuhanming123456 共回答了22个问题
wuhanming123456 共回答了22个问题 |采纳率100%1、电解质是在水溶液中能够解离成自由移动的离子可以导电的化合物.
2、电解质参加电极反应.
3、电解质在燃料电池中的作用:
氢氧燃料电池工作时,向氢电极供应氢气,同时向氧电极供应氧气.氢、氧气在电极上的催化剂作用下,通过电解质生成水.这时在氢电极上有多余的电子而带负电,在氧电极上由于缺少电子而带正电.接通电路后,这一类似于燃烧的反应过程就能连续进行.
具体地说,燃料电池是利用水的电解的逆反应的"发电机".它由正极、负极和夹在正负极中间的电解质板所组成.最初,电解质板是利用电解质渗入多孔的板而形成,现在正发展为直接使用固体的电解质.工作时向负极供给燃料(氢),向正极供给氧化剂(空气,起作用的成分为氧气).氢在负极分解成正离子H+和电子e-.氢离子进入电解液中,而电子则沿外部电路移向正极.用电的负载就接在外部电路中.在正极上,空气中的氧同电解液中的氢离子吸收抵达正极上的电子形成水.这正是水的电解反应的逆过程.
在酸溶液中负极:2H2-4e-==4H+ 正极:O2 + 4H+ +4eˉ== 2H2O;
碱溶液中负极:2H2 + 4OHˉ-4eˉ== 4H20 正极:O2 + 2H2O + 4eˉ== 4OHˉ
盐溶液中负极:2H2-4eˉ=4H+(阳离子),正极:O2+4eˉ+2H2O=4OHˉ1年前查看全部
- 氢氧燃料电池在中性条件下的电极反应式
氢氧燃料电池在中性条件下的电极反应式
是中性,不是酸碱性哦!麻烦, jiashusheng1年前2
jiashusheng1年前2 -
 foreved 共回答了14个问题
foreved 共回答了14个问题 |采纳率85.7%电极写法为:
Pt|H2(g)|H2O(|)|O2(g)|Pt
负极失去电子:2H2 - 4e- == 4H+
正极得到电子:O2 + 4e- + 2H2O === 4OH-
总反应:2H2 + O2 = 2H2O1年前查看全部
- 氢氧燃料电池是不是永机动的?是不是可以用生成的电来点解生成的水 在用点解生成的氢气 氧气来推动电池持续生成电流 用多余的
氢氧燃料电池是不是永机动的?
是不是可以用生成的电来点解生成的水 在用点解生成的氢气 氧气来推动电池持续生成电流 用多余的电来供电 roseofpoor1年前2
roseofpoor1年前2 -
 Allison457 共回答了16个问题
Allison457 共回答了16个问题 |采纳率93.8%电解的时候除了直接作用于分子的电能,电路也会消耗部分能量.
氢气跟氧气当做电池的燃料,是化学能转化为电能的过程,过程中亦会损失能量.
比方说我用1度电来电解水,获得了Xg氢气,跟16xg的氧气,中间损耗了一部分,被电路中的导线以发热的形式消耗了.然后用这些氢气跟氧气做电池发电,发出来的电绝对不够一度.
能量守恒啊!1年前查看全部
- ①原子团,右上角的M+或M-表示的是整体带多少电荷吗?②无论在酸性介质,碱性介质还是在中性介质.氢氧燃料电池电解液的ph
①原子团,右上角的M+或M-表示的是整体带多少电荷吗?②无论在酸性介质,碱性介质还是在中性介质.氢氧燃料电池电解液的ph是否保持不变?
 fengshicanying1年前1
fengshicanying1年前1 -
 季风3318 共回答了19个问题
季风3318 共回答了19个问题 |采纳率84.2%1正确,2
pH偏向中性变化,生成水稀释了1年前查看全部
- 高一 化学 原电池燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,宇宙飞船上的氢氧燃料电池,其电极反应为
高一 化学 原电池
燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,宇宙飞船上的氢氧燃料电池,其电极反应为2H2-4e-+4OH-4H2O,O2+2H2O+4e-4OH-
燃料电池在发电的同时还合成了水,这正好解决了宇航员在太空中饮水的问题.若电池输出的电流强度为533 A,则每小时能合成多少克水?
求过程
问题补充: 每个电子所带的电量为1.6x10的负19次方。Q=It t37bl1年前1
t37bl1年前1 -
 过来过来 共回答了18个问题
过来过来 共回答了18个问题 |采纳率83.3%电流强度 I=533A
根据I=Q/t
Q=It=533x3600=1.92x10^6 C
转移电子的物质的量n=Q/F=1.92x10^6/96500mol=19.9mol
由于每生成1mol水需要2mol电子,则生成水9.95mol
则生成水180g1年前查看全部
- 氢氧燃料电池,2H2 O2=2H2O,氢为什么是失四个电子 这要怎么看转移电子数啊
 晒晒太阳眯眯眼1年前4
晒晒太阳眯眯眼1年前4 -
 shmillqy 共回答了18个问题
shmillqy 共回答了18个问题 |采纳率94.4%教你句口诀,很管用,升失氧,降得还--即化学价升高,失去电子,被氧化;化学价降低,得到电子,被还原.这里面,氢气为还原剂,氧气为氧化剂.H元素由氢气分子变为+1价的氢离子,化合价升高,O元素由氧气分子变为-2价的氧离子,化合价降低.
平时要多加记忆关于常用化学元素的常用化合价,除非有特殊的反应条件和说明,否则一般的元素变为离子时的化学价都是一样的.1年前查看全部
- 原电池问题1、氢氧燃料电池是将氢气和氧气分别通入电池,穿过浸入20%—40%的KOH溶液的多孔碳电极,则( ) A、工作
原电池问题
1、氢氧燃料电池是将氢气和氧气分别通入电池,穿过浸入20%—40%的koh溶液的多孔碳电极,则( )
a、工作一段时间后电解质溶液ph增大
b、工作时负极区附近ph减少
2、铅蓄电池的两极分别为pb、pbso4,电解质为硫酸,工作时( )
a、so2-只向pbso4极移动
b、电池液密度不断减少
c、溶液的ph值不断减少
选什么?why? 看水库的1年前1
看水库的1年前1 -
 红袖无香 共回答了21个问题
红袖无香 共回答了21个问题 |采纳率85.7%第一个选B
氢气失电子变H离子,氧气得电子变O2-(实际上不存在)结合产生水,电解质PH变小,(溶剂变多了),负极区H离子浓度增大,PH下降
第二个问题貌似不全啊.
但是so4离子应该往pb跑,H离子不反应吧,所以酸性不变,
貌似总反应应该是 PbO2+Pb+2H2SO4===2PbSO4+2H2O
答案应该是B,1年前查看全部
- 氢氧燃料电池氢气氧气怎么进入电解液?
氢氧燃料电池氢气氧气怎么进入电解液?
不是被多孔金属挡住了么,还怎么进去? 完美jx1年前1
完美jx1年前1 -
 wyblrxwb 共回答了19个问题
wyblrxwb 共回答了19个问题 |采纳率94.7%直接通入就可以了,气体可以从孔中穿过的嘛1年前查看全部
- 我想知道氢氧燃料电池是如何把氢气和氧气转化为离子的?
我想知道氢氧燃料电池是如何把氢气和氧气转化为离子的?
一楼的,能否从微观角度来解释一下 弘音1年前2
弘音1年前2 -
 heqlin 共回答了21个问题
heqlin 共回答了21个问题 |采纳率90.5%得失电子啊,氧气做正极,氢气做负极,最常用的碱性氢氧燃料电池,电解质用氢氧化钾溶液,电极反应:
负极:两摩尔氢气+两摩尔氢氧根-两摩尔电子=两摩尔水
正极:氧气+两摩尔水+四摩尔电子=四摩尔氢氧根1年前查看全部
- 2013年12月31日夜,上海外滩运用LED产品进行了精彩纷呈的跨年灯光秀.图是一种氢氧燃料电池驱动LED发光的装置.下
2013年12月31日夜,上海外滩运用LED产品进行了精彩纷呈的跨年灯光秀.图是一种氢氧燃料电池驱动LED发光的装置.下列有关叙述正确的是( )

A.a处通入氧气
B.b处为电池正极,发生了还原反应
C.该装置中只涉及两种形式的能量转化
D.P-型半导体连接的是电池负极 shtsong1年前1
shtsong1年前1 -
 kenvin_2007 共回答了17个问题
kenvin_2007 共回答了17个问题 |采纳率88.2%解题思路:根据电子移动方向知,a处通入的气体失电子发生氧化反应,b处通入气体得电子发生还原反应,燃料电池中,燃烧失电子、氧化剂得电子,所以a处通入的气体是氢气、b处通入的气体是氧气,再结合能量转化方式分析解答.根据电子移动方向知,a处通入的气体失电子发生氧化反应,b处通入气体得电子发生还原反应,燃料电池中,燃烧失电子、氧化剂得电子,所以a处通入的气体是氢气、b处通入的气体是氧气,
A.通过以上分析知,a处通入的气体是氢气,故A错误;
B.b处通入的气体是氧气,为原电池正极,得电子发生还原反应,故B正确;
C.该装置中涉及的能量转化方式有:化学能转化为电能、电能转化为光能和热能,故C错误;
D.b处通入的气体是氧气,为原电池正极,则P-型半导体连接的是电池正极,故D错误;
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了化学电源新型电池,根据电子流向确定原电池正负极,再结合得失电子确定通入的气体成分,易错选项是C,很多同学忘掉电能转化为热能而导致错误,为易错点.1年前查看全部
- 氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,
氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为______(用a、b表示).
(2)负极反应式为______.
(3)该电池工作时,H 2 和O 2 连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H 2
2LiH△ .
Ⅱ.LiH+H 2 O═LiOH+H 2 ↑
①反应Ⅰ中的还原剂是______,反应Ⅱ中的氧化剂是______.
②已知LiH固体密度为0.82g/cm 3 .用锂吸收224L(标准状况)H 2 ,生成的LiH体积与被吸收的H 2 体积比为______.
③由②生成的LiH与H 2 O作用放出的H 2 用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为______.
 nankaiww20001年前1
nankaiww20001年前1 -
 阿春天 共回答了20个问题
阿春天 共回答了20个问题 |采纳率70%(1)该题目中,氢氧燃料电池的工作原理属于原电池原理,是将化学能转化为电能的装置,在原电池中,电流从正极流向负极,而通入燃料氢气的电极是负极,通氧气的电极是正极,所以电子由a到b,故答案为:化学能转化为电能;由a到b;
(2)燃料电池中,通入燃料氢气的电极是负极,发生失电子的氧化反应,即2H 2 +4OH - -4e - ═4H 2 O或H 2 +2OH - -2e - ═2H 2 O,
故答案为:2H 2 +4OH - -4e - ═4H 2 O或H 2 +2OH - -2e - ═2H 2 O;
(3)①Li从零价升至+1价,作还原剂,H 2 O的H从+1降至H 2 中的零价,作氧化剂,故答案为:Li;H 2 O;
②由反应I,当吸收10molH 2 时,则生成20molLiH,V=
m
ρ =
20×7.9g
0.82×1 0 3 L =197.5×10 -3 L,
V(LiH)
V( H 2 ) =
197.5 ×10 -3 L
224L =8.82×10 -4 ,故答案为:8.82×10 -4 ;
③20molLiH可生成20molH 2 ,实际参加反应的H 2 为20mol×80%=16mol,1molH 2 转化成1molH 2 O,转移2mol电子,所以16molH 2 可转移32mol的电子,故答案为:32mol.1年前查看全部
- 用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中,正确的是( )
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中,正确的是( )
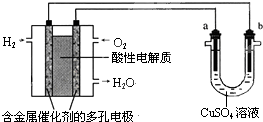 A. 燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
A. 燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 zatt1年前1
zatt1年前1 -
 湖畔清风 共回答了18个问题
湖畔清风 共回答了18个问题 |采纳率94.4%解题思路:左边装置是氢氧燃料电池,所以是原电池,原电池放电时,燃料失电子发生氧化反应,所以投放燃料的电极为负极,投放氧化剂的电极为正极,正极上氧化剂得电子发生还原反应,由于电解质溶液呈酸性,正极反应为:O2+4e-+4H+=2H2O;右边装置有外接电源,所以是电解池,连接负极的b电极是阴极,连接正极的a电极是阳极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应.A.因该燃料电池是在酸性电解质中工作,所以正极反应为:O2+4e-+4H+=2H2O,故A错误;
B.a与电池正极相连,a为电解池阳极,b与电池的负极相连,b为电解池正极,所以应该是a极的Fe溶解,b极上析出Cu,故B错误;
C.a极是粗铜,b极是纯铜时,为粗铜的精炼,电解时,a极逐渐溶解,b极上有铜析出,符合精炼铜原理,故C正确;
D.电解CuSO4溶液时,a极产生的气体为O2,产生1molO2需4mol电子,所以需要燃料电池的2molH2,二者的体积并不相等,故D错误.
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查原电池和电解池知识,题目难度中等,易错点为A,注意电解质的酸碱性,为解答该题的关键.1年前查看全部
- 下列有关电池叙述不正确的是( ) A.锌锰干电池是一种常用的二次电池 B.氢氧燃料电池比火力发电的能量转变率要高 C.
下列有关电池叙述不正确的是()
A.锌锰干电池是一种常用的二次电池 B.氢氧燃料电池比火力发电的能量转变率要高 C.锌锰干电池工作一段时间后锌外壳逐渐变薄 D.碱性燃料电池正极反应是O 2 + 2H 2 O + 4e - =4OH -  叶静思1年前1
叶静思1年前1 -
 我只说cc话的 共回答了19个问题
我只说cc话的 共回答了19个问题 |采纳率84.2%A
1年前查看全部
大家在问
- 1若(x²+ax+8)(x²-3x+b)的结果不含x²与x³项,试求a³
- 2高中化学金属与酸反应的计算题1.92g Cu与足量硝酸反应,生成标况下的气体完全溶于水后恰好能与100ml 0.5 mo
- 33e^(-x)的导数
- 4若函数f(x)和g(x)的定义域、值域都是R,则不等式f(x)>g(x)有解的充要条件是( )
- 5一件羊毛衫标价a元,打八折销售比原价便宜______元.
- 6初二数学计算题 方程 化简求值
- 7已知点A为定点,线段BC在直线L上滑动.已知lBCl=4,点A到直线L的距离为3,求三角形ABC的外心的轨迹方程
- 8白磷在空气中易自燃?
- 9请你帮我找一下四年级的日记250字
- 10写信时,有人这样写日期:24th April,19__ .这个"19___"是什么意思啊?
- 11已知一次函数图像经过(3,5)和0(—4,—9)两点 (1)求此一次函数的表达式 (2)若点(a,
- 12英语句子结构分析 I look at you look 为不及物动词,at you 做什么成分
- 13it is not so much our friend's help that helps us as the con
- 14As hand-held devices such as smartphones are becoming more c
- 15英语作文:生活中每个人都需要别人的帮助,我们都要做一个有爱心的人,社区正在招募志愿者.假设你是育明中学初一七班的马华,请
