铝条不像镁条那样在空气中容易燃烧,原因是
 玖瑰花开2022-10-04 11:39:544条回答
玖瑰花开2022-10-04 11:39:544条回答A铝的金属性没有镁强
D铝表面有一层致密的氧化物保护膜
两个答案那个对?还是都对?

已提交,审核后显示!提交回复
共4条回复
 linda_ll 共回答了19个问题
linda_ll 共回答了19个问题 |采纳率89.5%- D.
本题和金属性强弱无关.即使是非金属,燃烧也可以很剧烈,比如石墨,白磷,硫磺,等.
从热力学来看,反应越是放热越有利于该燃烧反应,铝的燃烧热比镁大.因此燃烧热也不能解释题目中所述的现象.
从动力学来看,铝的表面氧化膜非常致密,使得金属铝难以和空气接触,而且氧化铝的熔点很高,点火也无法穿透它.镁拿到空气中也很快氧化并在表面形成氧化膜,但是该膜不如铝的氧化膜致密,虽然氧化镁的熔点比氧化铝还要高,但是由于结构疏松,氧气可以进入接触到金属镁.
综上所述,镁条比铝条容易燃烧是由于铝的氧化膜十分致密造成. - 1年前
 苦瓜兔兔 共回答了1个问题
苦瓜兔兔 共回答了1个问题 |采纳率- 纯铝的物理燃点比镁高多了吧
若是铝合金,那是D - 1年前
 zhuzhunihao 共回答了1578个问题
zhuzhunihao 共回答了1578个问题 |采纳率- D 对
Al表面的氧化膜阻止氧气进一步跟单质铝接触,这也是生活中有大量铝制品存在的原因 - 1年前
 onlybeloved 共回答了56个问题
onlybeloved 共回答了56个问题 |采纳率- 明显是A嘛。。。
镁最外层只有两个电子,而铝元素有3个,镁更加容易失去电子被氧化,这也是它更加容易在于空气中燃烧的原因。 - 1年前
相关推荐
- 一道关于铝的高中化学题将表面蒙有氧化铝的10.2g的铝条放入1L 0.1mol/L硫酸溶液中,取出铝条后溶液质量增加15
一道关于铝的高中化学题
将表面蒙有氧化铝的10.2g的铝条放入1L 0.1mol/L硫酸溶液中,取出铝条后溶液质量增加15.0g,求溶液中硫酸铝溶液的物质的量浓度. jenniful1年前1
jenniful1年前1 -
 单眼皮的大脸猫 共回答了14个问题
单眼皮的大脸猫 共回答了14个问题 |采纳率57.1%Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
0.1 ---------------0.1
先增加10.2,还有4.8是Al的
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
27gAL放出3gH2 增加24
所以反应了0.2molAl
Al元素一共是0.1*2+0.2=0.4
也就是0.2mol的Al2(SO4)3 可以得到是0.2mol/L1年前查看全部
- 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 [ ] A.稀
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 [ ]A.稀硝酸
B.稀盐酸
C.硝酸铜
D.氢氧化钠 kacyjacy1年前1
kacyjacy1年前1 -
 Blue_Green 共回答了15个问题
Blue_Green 共回答了15个问题 |采纳率93.3%C1年前查看全部
- 会者不难”的题,进来看看吧将铝条头入到NaOH溶液中,加热片刻,发生反应的化学方程式为——————————取出铝条冲洗干
会者不难”的题,进来看看吧
将铝条头入到NaOH溶液中,加热片刻,发生反应的化学方程式为——————————取出铝条冲洗干净立刻投入到硝酸汞溶液中,此是反应的化学方程式为————————————————
取出铝条用滤纸吸干后露置于空气中,可以观察到的现象————————————————化学方程式————————————这种现象说明铝是去了致密的氧化模保护后,在常温下可与氧气反应. 岚枫筱月1年前1
岚枫筱月1年前1 -
 寻找的小鱼 共回答了20个问题
寻找的小鱼 共回答了20个问题 |采纳率85%1.2NaOH+Al2O3==2NaAlO2+H2O
2.2Al+3Hg(NO3)2==2Al(NO3)3+3Hg
3.形成1层致密氧化膜4Al+3O2=2Al2O31年前查看全部
- 将铝条投到一溶液中产生氢气,则此溶液中一定能够大量共存的离子组是 A.Cu2+,Cl-,NO3-,K+
将铝条投到一溶液中产生氢气,则此溶液中一定能够大量共存的离子组是 A.Cu2+,Cl-,NO3-,K+
B.HCO3- ,K+,SO4 2-,Cl- C.Fe2+,Cl-,Na+,NO3- D..Ba2+,Cl-,K+,NO3- abc19820111年前5
abc19820111年前5 -
 mimiduoduo 共回答了22个问题
mimiduoduo 共回答了22个问题 |采纳率90.9%铝既能与酸反应生成氢气 也能与强碱反应生成氢气 因此该溶液既可以为酸 也可以为碱 是酸时B中碳酸氢根不能存在 C中硝酸根与氢离子结合成硝酸会氧化二价铁 是碱时A中铜离子不能存在 B中碳酸氢根与氢氧根反应生成碳酸根和水 C中二价铁不能存在 故此题答案为D1年前查看全部
- 铝条插入硝酸汞溶液中长出“白毛”,取出铝条用滤纸吸去表面溶液,铝条上出现的黑斑,请问黑斑是什么物质?
铝条插入硝酸汞溶液中长出“白毛”,取出铝条用滤纸吸去表面溶液,铝条上出现的黑斑,请问黑斑是什么物质?
一楼的看清题目好伐
将此铝条放在空气中,黑斑周围长出白毛,白毛是氧化铝 ,那黑斑是什么呢?
二楼,汞单质(液体)不会被滤纸擦掉?而且汞单质是银白色的吧,怎么是黑色呢? daofenghan111年前1
daofenghan111年前1 -
 原文遗漏 共回答了17个问题
原文遗漏 共回答了17个问题 |采纳率70.6%黑色物质是Hg
汞通常是银白色液体.但是,被置换出来的金属一般都是黑色的.
如铝将Fe3+置换出来的铁是黑色的.但纯铁是银白色的.
这是由金属的聚集状态不同造成的.被置换出来的金属呈粉末状.
纯铁的晶体结构呈几何形状,因而铁块吸收一部分可见光,将另一部分可见光镜面反射了出来,显出白色;铁粉没吸收完的光却被漫反射,能够进入人眼的可见光少,所以是黑色的.
因此,在这个实验中,Hg被Al置换出来,是黑色的.白色的是Al2O3.1年前查看全部
- 把铝条放入盛有过量稀硫酸的试管中,不能加快氢气产生速率的是.
把铝条放入盛有过量稀硫酸的试管中,不能加快氢气产生速率的是.
A改铝条为镁条 B滴加少量硫酸铜溶液 C改为高浓度的浓硫酸 D升高溶液的温度 zjcsh19851年前7
zjcsh19851年前7 -
 乡土探戈 共回答了21个问题
乡土探戈 共回答了21个问题 |采纳率90.5%C
A从活动顺序表看,Mg在Al前,活泼性比Al强,与酸的反应速率更快
B Al把硫酸铜中的铜置换出来,附在AL表面,形成原电池,加快了氢气的生成
C 浓硫酸与Al发生钝化,形成致密氧化膜,阻止了反应
D 升高温度,粒子运动速率加快,反应速率增加,所以可以加快氢气的生成1年前查看全部
- 将镁条和铝条用砂纸打磨后,分别放入沸水中,并滴加酚酞,会有什么现象
 qingwei11年前1
qingwei11年前1 -
 东方红00 共回答了20个问题
东方红00 共回答了20个问题 |采纳率90%(1)有气体(氢气)产生,但由于是沸水,所以此现象不明显;
(2)滴加酚酞,由无色变红色.
Mg + 2H2O = Mg(OH)2 + H2
2Al + 6H2O = 2Al(OH)3 + 3H21年前查看全部
- 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A. HNO3
B. HCl
C. Cu(NO3)2
D. NaOH 观铃1年前1
观铃1年前1 -
 f2mi 共回答了17个问题
f2mi 共回答了17个问题 |采纳率88.2%解题思路:铝发生钝化时在其表面生成一层致密的氧化铝,根据氧化铝的性质,它是一种两性氧化物,既能与酸反应又能与碱反应,但和盐不能发生反应,只有能与氧化铝反应的,才符合本题要求.从而达到解决该题的目的.A.根据氧化铝的性质,氧化铝能与酸反应,将表面已完全钝化的铝条,插入HNO3溶液中,能发生如下反应:6HNO3+Al2O3═2Al(NO3)3+3H2O,故将表面已完全钝化的铝条,插入HNO3溶液中,会发生反应,故A错误;
B.根据氧化铝的性质,氧化铝能与酸反应,将表面已完全钝化的铝条,插入HCl溶液中,能发生如下反应:6HCl+Al2O3═2AlCl3+3H2O,故将表面已完全钝化的铝条,插入HCl溶液中,会发生反应,故B错误;
C.根据氧化铝的性质,它是一种两性氧化物,既能与酸反应又能与碱反应,但和盐不能发生反应,因此,将表面已完全钝化的铝条,插入Cu(NO3)2溶液中,Cu(NO3)2是盐,因此Cu(NO3)2和Al2O3不反应,故C正确;
D.根据氧化铝的性质,它是一种两性氧化物,能与碱发生反应生成盐和水,将表面已完全钝化的铝条,插入NaOH溶液中,能发生如下反应:2NaOH+Al2O3═2NaAlO2+H2O,故将表面已完全钝化的铝条,插入NaOH溶液中,会发生反应,故D错误;
故选C.点评:
本题考点: 镁、铝的重要化合物;铝的化学性质.
考点点评: 本题考查氧化铝的性质,运用性质将其发生的反应方程式写出,注意一定将化学变化与变化现象结合起来,此处易出错.1年前查看全部
- 帮我看下这几道题《1》将表面已经完全钝化的铝条插入下列溶液中,不会发生反应的是A.稀硝酸 B稀盐酸 c硝酸铜 D氢氧化纳
帮我看下这几道题
《1》将表面已经完全钝化的铝条插入下列溶液中,不会发生反应的是
A.稀硝酸 B稀盐酸 c硝酸铜 D氢氧化纳
《2》合成氨反应中,若进口时N2,H2,NH3的体积之比为5:15:3,出口时体积比为9:27:8,则N2的转换率多少
《3》形成原电池的后,原电池中的阴离子向负级移动,这句话对吗?
原电池的两极上均发生氧化还原反应,这句话对吗 屋里潮湿下脚小心1年前2
屋里潮湿下脚小心1年前2 -
 满满的烟灰缸 共回答了14个问题
满满的烟灰缸 共回答了14个问题 |采纳率85.7%1
选 C
钝化后表面是Al2O3,能和A.稀硝酸 B稀盐酸 D氢氧化纳 反应,但不能和 C硝酸铜反应.
2
N2 + 3H2 2NH3
5/23.15/23.3/23
x.3x.2x
5/23 - x.15/23 - 3x...3/23 + 2x
由已知:(5/23 - x)/(5/23 - x + 15/23 - 3x + 3/23 + 2x) = 9/44
解得x = 1/46
所以N2的转换率 = (1/46)/(5/23) = 10%
3
阴离子向阳极移动.对于原电池,阳极就是负极,所以这句话是对的.
原电池的两极上均发生氧化还原反应,这句话错的.因为负极失去电子,发生氧化反应;正极得到电子,发生还原反应.两极发生的是两个半反应,而氧化还原反应要是全反应才行.1年前查看全部
- 铝条与浓CuCl2的反应将铝条插入盛有CuCl2的浓溶液的烧杯中,反应过程中不可能出现的情况是A.产生气体B.产生氢氧化
铝条与浓CuCl2的反应
将铝条插入盛有CuCl2的浓溶液的烧杯中,反应过程中不可能出现的情况是
A.产生气体
B.产生氢氧化物沉淀
C.反应剧烈程度渐渐增强
D.试管内温度逐步降低
选什么?为什么? yoyo6681年前1
yoyo6681年前1 -
 casper_yl 共回答了21个问题
casper_yl 共回答了21个问题 |采纳率95.2%选D.试管内温度逐步降低
CuCl2的浓溶液:由于铜离子的水解,使溶液中氢离子浓度较大.铝与氢离子反应,生成氢气.
随着铜离子水解生成的氢离子消耗,平衡不断的正向移动,生成氢氧化物沉淀.
又由于铝与氢离子反应是放热反应,故反应速率越来越大,试管内温度逐步升高,反应剧烈程度渐渐增强 .1年前查看全部
- 将n铝条插入浓硝酸中,使其表面完全钝化.再将该铝条取出插人下列溶液中,不发生化学反应的是( )
将n铝条插入浓硝酸中,使其表面完全钝化.再将该铝条取出插人下列溶液中,不发生化学反应的是( )
A.稀硫酸
B.稀盐酸
C.硝酸铜
D.氢氧化钠 gukelao1年前1
gukelao1年前1 -
 dieklc 共回答了17个问题
dieklc 共回答了17个问题 |采纳率82.4%解题思路:铝性质活泼,可与浓硝酸发生钝化反应在表面生成一层致密的氧化铝,氧化铝为两性氧化物,可与酸、碱发生反应,以此解答.将一铝条插入浓硝酸中,使其表面完全钝化,则表面生成一层致密的氧化铝膜,氧化铝具有两性,可与稀硫酸、稀盐酸和氢氧化钠反应,与硝酸铜不反应.
故选C.点评:
本题考点: 铝的化学性质;镁、铝的重要化合物.
考点点评: 本题考查铝及氧化铝的性质,为高考常见题型和高频考点,注意把握氧化铝为两性氧化物的性质,难度不大,学习中注意相关基础知识的积累.1年前查看全部
- 下列化学反应方程式书写正确的是( ) A.木炭在空气中燃烧C+O 2 ═CO 2 B.铝条投入硫酸铜溶液中Al+CuS
下列化学反应方程式书写正确的是( ) A.木炭在空气中燃烧C+O 2 ═CO 2 B.铝条投入硫酸铜溶液中Al+CuSO 4 ═Cu+AlSO 4 C.用一氧化碳与铁矿石反应冶炼铁3CO+Fe 2 O 3
2Fe+3CO 2高温 . D.在双氧水中加入二氧化锰H 2 O 2
H 2 O+O 2Mn O 2 .  djch19831年前1
djch19831年前1 -
 Cegtec 共回答了20个问题
Cegtec 共回答了20个问题 |采纳率90%A、木炭在空气中燃烧需要点燃,该方程式缺少反应条件,正确的方程式为:C+O 2
点燃
.
CO 2 ,故A错误,
B、铝在化合物中常显+3价,硫酸铝的化学式书写错误,正确的方程式为:2Al+3CuSO 4 ═3Cu+Al 2 (SO 4 ) 3 故B错误,
C、一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,方程式书写正确,满足质量守恒定律,故C正确,
D、双氧水在二氧化锰的催化下分解成水和氧气,方程式没有配平,正确的方程式为:2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑,
故选C.1年前查看全部
- 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A. 稀硝酸
B. 稀盐酸
C. 硫酸铜溶液
D. 氢氧化钠溶液 mzqdd1年前2
mzqdd1年前2 -
 zhyd7822807 共回答了10个问题
zhyd7822807 共回答了10个问题 |采纳率100%解题思路:表面已完全钝化的铝条,存在氧化铝,氧化铝可溶于酸、强碱溶液,以此来解答.A.氧化铝能与酸反应,将表面已完全钝化的铝条,插入HNO3溶液中,能发生如下反应:6HNO3+Al2O3═2Al(NO3)3+3H2O,故将表面已完全钝化的铝条,插入HNO3溶液中,会发生反应,故A错误;
B.氧化铝能与酸反应,将表面已完全钝化的铝条,插入HCl溶液中,能发生如下反应:6HCl+Al2O3═2AlCl3+3H2O,故将表面已完全钝化的铝条,插入HCl溶液中,会发生反应,故B错误;
C.它是一种两性氧化物,既能与酸反应又能与碱反应,但和盐不能发生反应,因此将表面已完全钝化的铝条,插入Cu(NO3)2溶液中,Cu(NO3)2和Al2O3不反应,故C正确;
D.氧化铝是一种两性氧化物,能与碱发生反应生成盐和水,将表面已完全钝化的铝条,插入NaOH溶液中,能发生如下反应:2NaOH+Al2O3═2NaAlO2+H2O,故将表面已完全钝化的铝条,插入NaOH溶液中,会发生反应,故D错误;
故选C.点评:
本题考点: 铝的化学性质;镁、铝的重要化合物.
考点点评: 本题考查氧化铝的化学性质,为高频考点,注意表面已完全钝化的铝条表面为氧化铝,把握氧化铝的性质为解答的关键,注意氧化铝的两性,题目难度不大.1年前查看全部
- 将表面已完全钝化的铝条(表面是一层Al2O3薄膜),插入下列溶液中,不会发生反应的是( )
将表面已完全钝化的铝条(表面是一层Al2O3薄膜),插入下列溶液中,不会发生反应的是( )
A. 稀硝酸
B. 稀盐酸
C. 硝酸铜
D. 氢氧化钠 莱昂氏1年前5
莱昂氏1年前5 -
 356185621 共回答了16个问题
356185621 共回答了16个问题 |采纳率68.8%解题思路:氧化铝是两性氧化物,既能和强酸反应又能和强碱反应.氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,将表面已完全钝化的铝条(表面是一层Al2O3薄膜),插入盐酸、硝酸和氢氧化钠溶液中,均会将表面的氧化膜反应掉.
故选C.点评:
本题考点: 镁、铝的重要化合物;铝的化学性质.
考点点评: 本题考查学生氧化铝的化学性质,可以根据教材知识来回答,难度不大.1年前查看全部
- 把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是()
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是()
A盐酸浓度 B铝条的表面积 C溶液温度 D加少量硫酸钠
为什么D不影响,加入硫酸钠不是可以构成电解质溶液吗 基督山蕃茄1年前3
基督山蕃茄1年前3 -
 丝单2 共回答了10个问题
丝单2 共回答了10个问题 |采纳率90%是D的,因为盐酸溶液本来就是电解质溶液,该题目和电解质溶液没有关系,钠离子和硫酸根离子加到原溶液中根本不和任何物质反应1年前查看全部
- 将表面已完全钝化的铝条(表面是一层Al2O3薄膜),插入下列溶液中,不会发生反应的是( )
将表面已完全钝化的铝条(表面是一层Al2O3薄膜),插入下列溶液中,不会发生反应的是( )
A. 稀硝酸
B. 稀盐酸
C. 硝酸铜
D. 氢氧化钠 ss与cc1年前4
ss与cc1年前4 -
 w3cer0n 共回答了14个问题
w3cer0n 共回答了14个问题 |采纳率64.3%解题思路:氧化铝是两性氧化物,既能和强酸反应又能和强碱反应.氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,将表面已完全钝化的铝条(表面是一层Al2O3薄膜),插入盐酸、硝酸和氢氧化钠溶液中,均会将表面的氧化膜反应掉.
故选C.点评:
本题考点: 镁、铝的重要化合物;铝的化学性质.
考点点评: 本题考查学生氧化铝的化学性质,可以根据教材知识来回答,难度不大.1年前查看全部
- 表面已完全钝化的铝条是否与浓硝酸或浓硫酸反应.会的话写出方程式
 229522101年前1
229522101年前1 -
 大海中的小舟 共回答了13个问题
大海中的小舟 共回答了13个问题 |采纳率92.3%因为浓HNO3、浓H2SO4、KMnO4等氧化剂都可使金属钝化.金属钝化后,其电极电势向正方向移动,使其失去了原有的特性.理论认为钝化是由于金属与氧化性质作用,作用时在金属表面生成 一种非常薄的、致密的、覆盖性能良好的、牢固地吸附在金属表面上的钝化膜.这层膜成独立相存在,通常是氧化金属的化合物.它起着把金属与腐蚀介质完全隔开的作用,防止金属与腐蚀介质接触,从而使金属基本停止溶解形成钝态达到防腐蚀的作用.
铝条钝化后不与浓硫酸或浓硝酸反应.1年前查看全部
- 偏铝酸钠能使酚酞变色吗如题,昨天做了个实验...把铝条放进NaOH溶液中,再滴入酚酞,没过一会酚酞就褪色了~再滴变回红色
偏铝酸钠能使酚酞变色吗
如题,昨天做了个实验...把铝条放进NaOH溶液中,再滴入酚酞,没过一会酚酞就褪色了~再滴变回红色,但慢慢地又没了.我猜是酚酞不知和什么物质反应了,或者是碱性过强.但NaOH的浓度应该是降低才对, rose04161年前3
rose04161年前3 -
 FW福王 共回答了20个问题
FW福王 共回答了20个问题 |采纳率90%偏铝酸根离子水解显碱性1年前查看全部
- 电解铝使其生成Al2O3前,把铝条用苯和酒清洗的目的
电解铝使其生成Al2O3前,把铝条用苯和酒清洗的目的
然后又用NaOH洗,目的又是什么?
是以硫酸为电解液,铅为阴极,铝条为阳极 的 qiyunfeng4281年前1
qiyunfeng4281年前1 -
 3307537 共回答了14个问题
3307537 共回答了14个问题 |采纳率100%把铝条用苯和酒清洗的目的:去除油迹.1年前查看全部
- 做一个长1.2米,宽8分米,高1米的长方体鱼缸(无盖),鱼缸的四周用铝条镶嵌,做这个鱼缸至少要用多少米铝条?
 fpfdp71071年前1
fpfdp71071年前1 -
 小红莓来了呀 共回答了24个问题
小红莓来了呀 共回答了24个问题 |采纳率87.5%(1.2+0.8)*2*2+1*4=12米1年前查看全部
- 把两个棱长分别为4分米和5分米的正方形铁块熔铸成一根横截面边长为2厘米的长方形铝条,这跟铝条的长是多少
 炼魔狱1年前4
炼魔狱1年前4 -
 yy游戏人生 共回答了11个问题
yy游戏人生 共回答了11个问题 |采纳率72.7%两个正方体的体积分别是
4×4×4=64(立方分米)
5×5×5=125(立方分米)
长方体的体积是
64+125=189(立方分米)=189000(立方厘米)
长方体的横截面面积是
2×2=4(平方厘米)
铝条长
189000÷4=47250(厘米)=472.5(米)1年前查看全部
- 把铝条放入盐酸中,再加少量硝酸钾 生成什么?说明理由
 nancykong1年前1
nancykong1年前1 -
 爱在阳光空气中 共回答了18个问题
爱在阳光空气中 共回答了18个问题 |采纳率88.9%把铝条放入盐酸中:
发生的反应 2 Al + 6 HCl = 2 AlCl3 + 3 H2↑
如果在Al未反应完时,就加入KNO3,则相当于HNO3,
发生反应Al + 4 HCl + 4 KNO3 = 4 KCl + NO↑ + Al(NO3)3 + 2 H2O
如果Al已经反应完,溶液为AlCl3溶液,加入KNO3,没有反应发生1年前查看全部
- 把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
A. 盐酸的浓度
B. 铝条的表面积
C. 溶液的温度
D. 加少量Na2SO4 雪珠珠1年前1
雪珠珠1年前1 -
 voicethesea 共回答了17个问题
voicethesea 共回答了17个问题 |采纳率76.5%解题思路:过量稀盐酸,Al完全反应,不改变温度、接触面积、盐酸的浓度等,则不影响反应速率,以此来解答.A.改变盐酸的浓度,反应速率变化,故A不选;
B.改变接触面积,反应速率变化,故B不选;
C.改变温度,反应速率变化,故C不选;
D.加少量Na2S04固体,对反应无影响,则Al与盐酸反应生成氢气的速率不变,故D选;
故选D.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响反应速率的因素,明确温度、浓度、接触面积对反应速率的影响即可解答,注意反应的实质,题目难度不大.1年前查看全部
- 李师傅想用铝条焊接一个棱长为6dm的正方体的框架,至少要用多少分米铝条
 4053849071年前6
4053849071年前6 -
 ht8001 共回答了16个问题
ht8001 共回答了16个问题 |采纳率87.5%6乘12=721年前查看全部
- (08宝鸡质量检测,12)下列装置中发生的总反应为2AL+6H + =2AL 3 + +3H 2 ↑的是(铝条表面的氧化
(08宝鸡质量检测,12)下列装置中发生的总反应为2AL+6H + =2AL 3 + +3H 2 ↑的是(铝条表面的氧化膜均已除去):
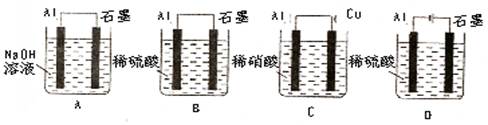
 远处走来1年前1
远处走来1年前1 -
 有话好好说or 共回答了14个问题
有话好好说or 共回答了14个问题 |采纳率85.7%B
本题考查原电池和电解池,较难题。A为原电池,总反应为:2Al+2OH - +2H 2 O=2AlO 2 - +3H 2 ↑;C为原电池,总反应为:Al+4H + +NO 3 - =Al 3 + +NO↑+2H 2 O;D项为电解池,总反应为:2H 2 O=2H 2 ↑+O 2 ↑。1年前查看全部
- 给一副长6分米,宽5分米的画做一个铝条画框,至少需要多长的铝条?如果给这个画框配上一块合适的玻璃,
给一副长6分米,宽5分米的画做一个铝条画框,至少需要多长的铝条?如果给这个画框配上一块合适的玻璃,
需要多大面积的玻璃? zgrfans1年前2
zgrfans1年前2 -
 qhrenjia 共回答了15个问题
qhrenjia 共回答了15个问题 |采纳率80%2×(6+5)=22分米
5×6=30平方分米
至少需要22分米的铝条如果给这个画框配上一块合适的玻璃,需要30平方分米的玻璃1年前查看全部
- (2009•平顶山一模)有一根粗铝条含铁和硅两种杂质.取等质量的样品分别投入足量的稀盐酸和足量的稀氢氧化钠溶液中,放出等
(2009•平顶山一模)有一根粗铝条含铁和硅两种杂质.取等质量的样品分别投入足量的稀盐酸和足量的稀氢氧化钠溶液中,放出等量的H2,则该粗铝中铁和硅的关系正确的是:( )
①物质的量之比为2:1;②物质的量之比为3:1; ③质量之比为2:1;④质量之比为4:1.
A.②④
B.②③
C.①④
D.只有④ 子楼梦盼1年前1
子楼梦盼1年前1 -
 rr之泪 共回答了19个问题
rr之泪 共回答了19个问题 |采纳率68.4%解题思路:粗铝条投入盐酸中发生反应:2Al+6HCl═2AlCl3+3H2↑、Fe+2HCl═FeCl2+H2↑,盐酸足量,Fe、Al完全反应.粗铝条投入氢氧化钠溶液中发生反应:Si+2NaOH+H2O═Na2SiO3+2H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由于氢氧化钠溶液足量,Al、Si完全反应,由方程式可知,相同物质的量的Al与盐酸、氢氧化钠溶液溶液产生的氢气的物质的量相等,两过程产生的氢气的物质的量相等,则Fe与盐酸产生的氢气等于Si与氢氧化钠溶液反应生成的氢气,据此计算判断.由应2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,相同物质的量的Al与盐酸、氢氧化钠溶液溶液产生的氢气的物质的量相等,
等质量的样品分别投入足量的稀盐酸和氢氧化钠溶液中,充分反应后都放出等量的氢气,则反应Fe+2HCl═FeCl2+H2↑、Si+2NaOH+H2O═Na2SiO3+2H2↑中生成的氢气相同,
若都生成2molH2,则n(Fe)=2mol,n(Si)=1mol,故粗铝中铁和硅的物质的量比为2mol:1mol=2:1,铁和硅的质量之比为2mol×56g/mol:1mol×28g/mol=4:1,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查Al、Fe、Si的化学性质阳极混合的有关计算等,根据发生的化学反应判断Fe与盐酸产生的氢气等于Si与氢氧化钠溶液反应生成的氢气是解题的关键,难度中等.1年前查看全部
- 铝条在氧气中会不会剧烈燃烧.
 fadai2171年前1
fadai2171年前1 -
 uubond 共回答了19个问题
uubond 共回答了19个问题 |采纳率94.7%铝在氧气中燃烧,产生更为耀眼的强光,放出大量的热,生成灰色固体Al2O3.(注意是纯氧中剧烈燃烧)1年前查看全部
- 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A.HNO3
B.HCl
C.Cu(NO3)2
D.NaOH kumikolu1年前1
kumikolu1年前1 -
 潘广丹 共回答了20个问题
潘广丹 共回答了20个问题 |采纳率100%解题思路:铝发生钝化时在其表面生成一层致密的氧化铝,根据氧化铝的性质,它是一种两性氧化物,既能与酸反应又能与碱反应,但和盐不能发生反应,只有能与氧化铝反应的,才符合本题要求.从而达到解决该题的目的.A.根据氧化铝的性质,氧化铝能与酸反应,将表面已完全钝化的铝条,插入HNO3溶液中,能发生如下反应:6HNO3+Al2O3═2Al(NO3)3+3H2O,故将表面已完全钝化的铝条,插入HNO3溶液中,会发生反应,故A错误;
B.根据氧化铝的性质,氧化铝能与酸反应,将表面已完全钝化的铝条,插入HCl溶液中,能发生如下反应:6HCl+Al2O3═2AlCl3+3H2O,故将表面已完全钝化的铝条,插入HCl溶液中,会发生反应,故B错误;
C.根据氧化铝的性质,它是一种两性氧化物,既能与酸反应又能与碱反应,但和盐不能发生反应,因此,将表面已完全钝化的铝条,插入Cu(NO3)2溶液中,Cu(NO3)2是盐,因此Cu(NO3)2和Al2O3不反应,故C正确;
D.根据氧化铝的性质,它是一种两性氧化物,能与碱发生反应生成盐和水,将表面已完全钝化的铝条,插入NaOH溶液中,能发生如下反应:2NaOH+Al2O3═2NaAlO2+H2O,故将表面已完全钝化的铝条,插入NaOH溶液中,会发生反应,故D错误;
故选C.点评:
本题考点: 镁、铝的重要化合物;铝的化学性质.
考点点评: 本题考查氧化铝的性质,运用性质将其发生的反应方程式写出,注意一定将化学变化与变化现象结合起来,此处易出错.1年前查看全部
- 稀盐酸与铝条反应的现象能得到什么结论
稀盐酸与铝条反应的现象能得到什么结论
在一支试管中加入2--3mL6mol/L的盐酸,再插入用砂纸打磨光的铝条.观察现象,并用温度计测量溶液温度的变化. pote3691年前5
pote3691年前5 -
 tujdnss 共回答了19个问题
tujdnss 共回答了19个问题 |采纳率89.5%,由于加热的缘故,将溶液中的溶剂蒸发掉,使得溶液中溶质的溶解度减小,因此,析出少量的生成物氯化铝晶体.所以有浑浊的现象.二,铝已经反应,完全生成的氯化铝是强酸弱碱盐,原因是再水中铝离子能够发生水解,产生了少量的氢氧化铝沉淀,因为水解反应是一个吸热反应,而加热的条件使得水解反应向离子浓度减小的方向移动,得到大量的氯化铝沉淀,因此,出现了浑浊的现象.1年前查看全部
- 现有擦亮的细铁丝、铝条、红磷、过氧化氢溶液、木炭、二氧化锰、硫磺,请选择合适的物质按要求完成下列反应的文字表达式,并注明
现有擦亮的细铁丝、铝条、红磷、过氧化氢溶液、木炭、二氧化锰、硫磺,请选择合适的物质按要求完成下列反应的文字表达式,并注明反应类型(填化合反应或分解反应).
(1)实验室制取氧气: _________ ;
(2)一种物质跟氧气反应,生成黑色固体物质: _________ ;
(3)一种物质跟氧气反应,生成大量浓厚的白烟: _________ ;
(4)一种物质跟氧气反应,生成使澄清石灰水变浑浊的气体: _________ . 山贼5051年前0
山贼5051年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 何为钝化的铝条?有什么性质?为什么不与硝酸铜反应?知道一点的也请告诉我
 无翼青鸟1年前1
无翼青鸟1年前1 -
 sonny5630 共回答了18个问题
sonny5630 共回答了18个问题 |采纳率88.9%铝条与冷的浓硫酸(注意是冷的)发生氧化还原反应,生成了二氧化硫和三氧化二铝,不是氢气.这个氧化铝呢 硬得很 生成后就附在铝条身上 并且氧化铝又不能再继续和浓硫酸反应 所以阻止了铝条和浓硫酸反应 一旦铝条周围所有位置都被氧化铝覆盖了 氧化还原反应就停止了 铝条也就不再被腐蚀了就是所谓的钝化.注:铁片也有这个性质.
氧化铝阻断了铝条和很多物质的反应 因为铝和其他物质没法接触 所以也就不能和硝酸铜发生置换反应了.1年前查看全部
- 将表面已完全钝化的铝条插入下列溶液中,不能发生反应的是( )
将表面已完全钝化的铝条插入下列溶液中,不能发生反应的是( )
A.氢氧化钠溶液
B.稀硝酸
C.浓硝酸
D.盐酸 ssd_20041年前1
ssd_20041年前1 -
 matthew_zdf 共回答了16个问题
matthew_zdf 共回答了16个问题 |采纳率87.5%解题思路:铝发生钝化时在其表面生成一层致密的氧化铝,根据氧化铝的性质,它是一种两性氧化物,既能与酸反应又能与碱反应,但和浓硝酸不能发生反应,只有不能与氧化铝反应的,才符合本题要求,从而达到解决该题的目的.A.氧化铝是两性氧化物,能与碱发生反应生成盐和水,将表面已完全钝化的铝条,插入NaOH溶液中,能发生如下反应:2NaOH+Al2O3═2NaAlO2+H2O,所以将表面已完全钝化的铝条,插入NaOH溶液中,会发生反应,故A错误;
B.氧化铝具有两性,氧化铝能与酸反应,将表面已完全钝化的铝条,插入稀HNO3溶液中,能发生如下反应:6HNO3+Al2O3═2Al(NO3)3+3H2O,所以将表面已完全钝化的铝条,插入HNO3溶液中,会发生反应,故B错误;
C.一些较活泼的金属在某些特定的介质环境中,会变为惰性状态,这是由于金属表面上覆盖了一层致密的氧化膜,铝能和浓硝酸发生钝化反应原理是表面生成致密的氧化铝阻止反应进一步发生,因此浓硝酸和表面已完全钝化的铝条不反应,故C正确;
D.根据氧化铝的性质,氧化铝能与酸反应,将表面已完全钝化的铝条,插入HCl溶液中,能发生如下反应:6HCl+Al2O3═2AlCl3+3H2O,所以将表面已完全钝化的铝条,插入HCl溶液中,会发生反应,故D错误;
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查氧化铝的性质,注意把握氧化铝为两性氧化物的性质,题目难度不大,学习中注意相关基础知识的积累.1年前查看全部
- 将铝条插入盛有CuCl2浓溶液的烧杯,反应过程中一定不可能出现的现象是( )
将铝条插入盛有CuCl2浓溶液的烧杯,反应过程中一定不可能出现的现象是( )
A.产生无色气体
B.产生蓝色絮状沉淀
C.紫红色固体析出
D.黄绿色气泡逸出 wsrf821年前1
wsrf821年前1 -
 yu_215 共回答了20个问题
yu_215 共回答了20个问题 |采纳率95%解题思路:将铝条插入盛有CuCl2浓溶液的烧杯,发生置换反应生成Cu,铜离子水解显酸性,氢离子与Al反应生成氢气促进水解平衡正向移动,以此来解答.A.铜离子水解显酸性,氢离子与Al反应生成氢气,故A不选;
B.铜离子水解显酸性,氢离子与Al反应生成氢气促进水解平衡正向移动,可能产生氢氧化铜蓝色絮状沉淀,故B不选;
C.Al与铜离子发生置换反应生成紫红色的Cu,故C不选;
D.氯离子不会失去电子,则不会有黄绿色气泡逸出,故D选;
故选D.点评:
本题考点: 铝的化学性质.
考点点评: 本题考查Al的化学性质,为高频考点,把握金属活泼性判断发生的置换反应、盐类水解及平衡移动为解答的关键,综合性较强,为易错题,题目难度不大.1年前查看全部
- →→化学问题 关于钝化取出插在硫酸铜溶液中的铝条,铝条表面附有一层红色物质,现欲除去表面的红色物质,最好选用A.稀硫酸B
→→化学问题 关于钝化
取出插在硫酸铜溶液中的铝条,铝条表面附有一层红色物质,现欲除去表面的红色物质,最好选用
A.稀硫酸
B.浓硫酸
C.稀硝酸
D.浓硝酸
请说明理由
我知道红色物质是铜,AC都是错的,都能和铜及铝反应 但BD区别是什么 wzalh1年前3
wzalh1年前3 -
 wyxapf 共回答了13个问题
wyxapf 共回答了13个问题 |采纳率100%选D,因为浓硫酸和铜不反应,除不了铜.两酸都有钝化铝的效果.1年前查看全部
- 把铝条放入盛有稀盐酸的试管中,以下因素不会影响氢气产生速率的是( )
把铝条放入盛有稀盐酸的试管中,以下因素不会影响氢气产生速率的是( )
A.盐酸浓度 B.加少量醋酸钠固体 C.加少量硫酸钠固体 D.溶液的温度
求详解 hp_locust1年前1
hp_locust1年前1 -
 grassroot520 共回答了15个问题
grassroot520 共回答了15个问题 |采纳率80%选C1年前查看全部
- (科学)某同学在做铝条与稀盐酸反应时,发现一个奇怪的现象;当他将一小段铝条放入试管.
(科学)某同学在做铝条与稀盐酸反应时,发现一个奇怪的现象;当他将一小段铝条放入试管.
某同学在做铝条与稀盐酸反应时,发现一个奇怪的现象;当他将一小段铝条放入试管中,再向其中加入约5毫升的稀硫酸,发现反应后并没有现象,一段时间后,铝条表面的气泡开始逐渐增多,可是再过一段时间后,铝条表面的气泡又开始逐渐减少,请你解释出现以上现象的原因.(希望回答能详细点咩) 光头阿二1年前2
光头阿二1年前2 -
 eyoweuwerrer 共回答了20个问题
eyoweuwerrer 共回答了20个问题 |采纳率100%1.开始没有反应:铝条表面有一层铝的氧化物,和酸反应,没有明显现象
2.一段时间后:铝条表面氧化物被溶解,铝和酸接触面积越来越大,气泡增多
3.再过一段时间:酸已经反应一部分,氢离子浓度慢慢变小,反应减弱1年前查看全部
- 很多人说铝遇浓硫酸浓硝酸钝化,钝化的铝条表面有一层氧化膜AL2O3,可是AL2O3可以和强酸反应啊?我很晕
 cscdk0071年前2
cscdk0071年前2 -
 城纶一夏 共回答了17个问题
城纶一夏 共回答了17个问题 |采纳率94.1%氧化铝的确可以和强酸反应,但是,实质是什么呢?
是氧化铝和氢离子在反应:Al2O3 + 6 H+ ===== 2 Al3+ + 3 H2O
而在浓硫酸/浓硝酸中,几乎都是以分子形式存在,没有电离出氢离子,所以钝化,但是如果加热的话,促进酸的电离,产生氢离子,就可以反应了1年前查看全部
- 把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是:选项在补充里!
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是:选项在补充里!
A盐酸的浓度B铝条的表面积C溶液的温度D加少量的硫酸钠
我知道答案选D
不要使用排除法【硫酸钠会与稀盐酸反应,反应完后,应该也会影响到稀盐酸里的浓度,那为什么不会影响氢气的产生速率呢?】
十万火急,愿你解释清楚一点, 娃哈哈v6151年前4
娃哈哈v6151年前4 -
 897164241 共回答了21个问题
897164241 共回答了21个问题 |采纳率90.5%溶液中参加反应的实际上是离子,氢离子.其实硫酸钠与盐酸不能发生离子反应的.这些离子能共存.所以,不影响.加的是硫酸钠固体.1年前查看全部
- 把铝条放入乘有过量稀盐酸的试管中,
把铝条放入乘有过量稀盐酸的试管中,
为什么加少量硫酸钠不会影响氢气的产生速率?不是有了硫酸了吗?而硫酸很难和铝反应啊 狗屠1年前1
狗屠1年前1 -
 charnshone 共回答了15个问题
charnshone 共回答了15个问题 |采纳率93.3%很高兴为你解答问题
请注意,
硫酸钠不会和稀盐酸发生反应,并生成硫酸的
所以加少量硫酸钠不会影响氢气的产生速率1年前查看全部
- 铜丝 铝条 尼龙线 玻璃棒 盐水 稀硫酸 干木棒 瓷棒 碳棒.哪些是导体
铜丝 铝条 尼龙线 玻璃棒 盐水 稀硫酸 干木棒 瓷棒 碳棒.哪些是导体
哪些是导体 哪些是绝缘体 月光凌乱1年前1
月光凌乱1年前1 -
 轻雪飞扬1 共回答了18个问题
轻雪飞扬1 共回答了18个问题 |采纳率88.9%导体:铜丝 铝条 盐水 稀硫酸 碳棒
绝缘体 就是剩下的哈
应该是这样的.1年前查看全部
- 硫酸铝中加入铝条的反应
 夕阳有睛天1年前4
夕阳有睛天1年前4 -
 wjallanlin 共回答了20个问题
wjallanlin 共回答了20个问题 |采纳率90%单纯的把铝条放入硫酸铝溶液当中是不会发生反应的1年前查看全部
- 将未打磨的铝条,插入下列溶液中,不会发生反应的是( )
将未打磨的铝条,插入下列溶液中,不会发生反应的是( )
A.硝酸铜
B.稀盐酸
C.稀硝酸
D.氢氧化钠 a5543417401年前1
a5543417401年前1 -
 brucejzh 共回答了18个问题
brucejzh 共回答了18个问题 |采纳率77.8%解题思路:未打磨的铝条表面已完全钝化,存在氧化铝,氧化铝可溶于酸、强碱溶液,以此来解答.A、它是一种两性氧化物,既能与酸反应又能与碱反应,但和盐不能发生反应,因此将表面已完全钝化的铝条,插入Cu(NO3)2溶液中,Cu(NO3)2和Al2O3不反应,故A正确;
B、氧化铝能与酸反应,将表面已完全钝化的铝条,插入HCl溶液中,能发生如下反应:6HCl+Al2O3═2AlCl3+3H2O,故将表面已完全钝化的铝条,插入HCl溶液中,会发生反应,故B错误;
C、氧化铝能与酸反应,将表面已完全钝化的铝条,插入HNO3溶液中,能发生如下反应:6HNO3+Al2O3═2Al(NO3)3+3H2O,故将表面已完全钝化的铝条,插入HNO3溶液中,会发生反应,故C错误;
D.氧化铝是一种两性氧化物,能与碱发生反应生成盐和水,将表面已完全钝化的铝条,插入NaOH溶液中,能发生如下反应:2NaOH+Al2O3═2NaAlO2+H2O,故将表面已完全钝化的铝条,插入NaOH溶液中,会发生反应,故D错误;
故选A.点评:
本题考点: 铝的化学性质.
考点点评: 本题考查氧化铝的化学性质,为高频考点,注意表面已完全钝化的铝条表面为氧化铝,把握氧化铝的性质为解答的关键,注意氧化铝的两性,题目难度不大.1年前查看全部
- 一道初二物理题,详细讲解一下一块长为L,质量为m的均匀铝条,支点在中点时,铝条恰在水平位置能平衡,如果把中点右端的铝条弯
一道初二物理题,详细讲解一下
一块长为L,质量为m的均匀铝条,支点在中点时,铝条恰在水平位置能平衡,如果把中点右端的铝条弯曲对折起来,此时铝条平衡状况是_____
仍保持平衡
右端下沉
左端下沉
无法判断
谢谢 fasterdai1年前2
fasterdai1年前2 -
 h0128 共回答了23个问题
h0128 共回答了23个问题 |采纳率95.7%因为右端的动力臂变小,而动力不变,根据F1*L1=F2*L2,得出:
左端下沉
选C
学习愉快1年前查看全部
- (2003•大连)某学习小组为探究金属的性质,将一根铝条放入盛有稀盐酸的试管中,实验现象记录如下:
(2003•大连)某学习小组为探究金属的性质,将一根铝条放入盛有稀盐酸的试管中,实验现象记录如下:
试解释上述实验过程中,产生一系列现象的原因:______.反应时间/min 1 5 8 10 13 15 实验现象 少量气泡 较多气泡 大量气泡 反应剧烈 少量气泡 反应停止铝条剩余  漫漫路长远1年前1
漫漫路长远1年前1 -
 huadj3312 共回答了23个问题
huadj3312 共回答了23个问题 |采纳率87%解题思路:本题探究影响金属与酸反应的影响因素.铝是较活泼金属,决定了铝与盐酸反应易发生,就是因为铝活泼,也易被空气中的氧气氧化,表面存在氧化层,所以该反应的开始阶段时氧化铝与酸反应,随氧化铝的减少,铝与盐酸接触面积增大,反应加快,后来盐酸的质量分数变小,反应减慢,直到反应停止.由表中实验现象的记录可知,反应的开始阶段是氧化铝和盐酸反应,随氧化铝的减少,铝与盐酸接触的面积增大,气泡增大,反应在加快,但又随盐酸质量分数的减小,反应变慢,气泡开始减少.
故答案为:铝易被空气中的氧气氧化,在铝条表面生成一层致密的氧化物保护膜.将铝条放入稀盐酸中,稀盐酸与铝条表面的氧化铝反应,所以气泡较少.随着氧化铝的减少,铝与盐酸接触面积增大,气泡逐渐增加并达到反应最快.后来盐酸的质量分数越来越小,反应速率减慢,直至停止.点评:
本题考点: 影响化学反应速率的因素探究;金属的化学性质.
考点点评: 本题考查影响反应快慢的主要因素是反应物本身的性质,如铝是较活泼金属,则与盐酸反应的就较快;本题还可以看出质量分数也影响反应的快慢.1年前查看全部
- 做一个长1米,宽6分米,高3分米的鱼缸用铝条做他的框架,需要铝条多少分米?(接头处忽略不算)
 piggie8309071年前2
piggie8309071年前2 -
 jolieyan 共回答了14个问题
jolieyan 共回答了14个问题 |采纳率92.9%求棱长总和:
4×(10+6+3)=76分米 .(1米=10分米)1年前查看全部
- 爸爸准备用长30厘米的铝条,做一个长9厘米,宽5厘米的长方形框架,你认为1根铝条够吗?,为什么?
 烟烟1331年前1
烟烟1331年前1 -
 richardhu299 共回答了24个问题
richardhu299 共回答了24个问题 |采纳率87.5%30厘米>2*(9厘米+5厘米)
够1年前查看全部
- 将表面已完全氧化的铝条插入下列溶液,会发生反应的是?A氯化钠溶液B稀硫酸C硫酸铜D硝酸钾 (请带上...
将表面已完全氧化的铝条插入下列溶液,会发生反应的是?A氯化钠溶液B稀硫酸C硫酸铜D硝酸钾 (请带上...
将表面已完全氧化的铝条插入下列溶液,会发生反应的是?A氯化钠溶液B稀硫酸C硫酸铜D硝酸钾
(请带上讲解, 红木湾人1年前4
红木湾人1年前4 -
 华丽的转音 共回答了17个问题
华丽的转音 共回答了17个问题 |采纳率82.4%B稀硫酸
表面已完全氧化的铝条Al2O3,结构致密,起保护层的作用,会保护内部的铝不再发生反应,
Al2O3+ 3H2SO4 = Al2(SO4)3+ 3H2O1年前查看全部
- (2013•丽水)某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积、相同质量分
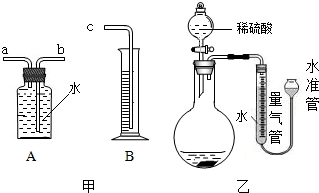 (2013•丽水)某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积、相同质量分数的稀硫酸反应,测定两种金属与稀硫酸反应得到相同体积氢气所需要的时间.
(2013•丽水)某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积、相同质量分数的稀硫酸反应,测定两种金属与稀硫酸反应得到相同体积氢气所需要的时间.
(1)利用图甲中A、B仪器可以组装一套实验室测量氢气体积的装置,该装置导管的连接顺序是______.
(2)图乙中量气管和水准管也可以用来测量氢气体积,为了准确地测量氢气体积,在读取量气管中液面读数的过程中,应注意______(填字母编号).
A、读数时视线与凹液面最低处相平
B、读数前应上下移动水准管,待两管液面相平再读数
C、保持水准管静止,待水准管中液面不再上升时再读数. bridget_tsi1年前1
bridget_tsi1年前1 -
 aicgliu 共回答了15个问题
aicgliu 共回答了15个问题 |采纳率73.3%解题思路:(1)根据氢气不易溶于水,通过排水法把水排入量筒内,量筒内水的体积就是收集到氢气的体积分析;
(2)在测量氢气体积时,为了使测量更为准确,要注意上下移动水准管,使左右两管的液面相平,以使量气管中的气压与大气气压相等,读数时视线应与左管内凹液面最低处相平,以减少观察误差.(1)利用等量代替的方法,量筒内水的体积就是收集到氢气的体积可知该装置导管的连接顺序是:b接c;
(2)读数时,要注意视线应于量气管凹液面的最低处保持水平;每次读数前应上下移动水准管,待两管液面相平再读数是为了防止水的压强造成的误差;故选AB.
故答案为:(1)b接c;(2)AB.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了量气的方法,关键是把握实验原理和操作方法,注重压强知识的运用及读数的方法.1年前查看全部
大家在问
- 1There ____ two glasses of milk on the table.为什么不能填is?milk是不可
- 2运动场的跑道一全长400m.甲练习骑自行车,平均每分骑350m;乙练习跑步,平均每分跑250m.两人从同一处同时方向出发
- 3很快就要中考了,一向成绩很好的晓燕总是诚惶诚恐,寝食不安,怕自己考不好。她听取了学校心理咨询室老师的建议,暂时放下课本,
- 4已知a、b、c分别为三角形的三条边,求证:a²-b²-c²-2bc<0
- 5若|2x+y+1|+(x-y+2)^2=0则(x^y*y)^2y+3=
- 62又3分之2乘以7分之6 12乘以1又6分之1 2又6分之5乘以1又3分之2
- 7关于万有引力的这一题,
- 8有一个近似于圆锥形的小麦堆,测得底面直径是4m,高是1.2m.每立方米小麦约重73.5kg,这堆小麦大约重多少
- 9PM2.5是指大气中直径小于或等于2.5μm(0.0000025m)的颗粒物,含有大量有毒、有害物质,也称可入肺颗粒物.
- 101=x+y 2=20x+30y
- 11What do you advice for____ the dirty mark from my bag? [
- 12呼之欲出是什么意思
- 13鱼在水里游为什么不受水的压强
- 141L 0.1mol/L的氨水中所含溶质粒子的物质的量是
- 15我想学英语· 可以提供一些常用的单词表么·?
