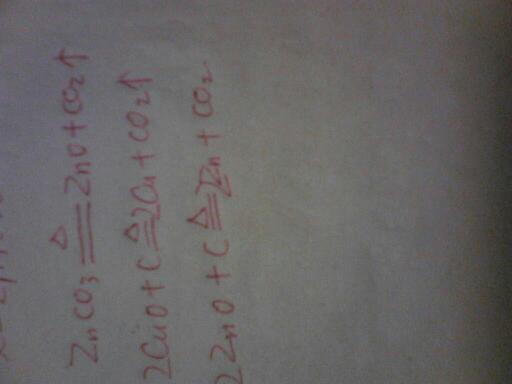在800℃时,下列反应达到平衡:CO+H2O(g)⇌CO2+H2,已知c(CO)焓=c(H2O)焓=0.01mol/L,
 葵言2022-10-04 11:39:541条回答
葵言2022-10-04 11:39:541条回答A.0.015mol•L-1
B.0.011mol•L-1
C.0.00751mol•L-1
D.0.00251mol•L-1

已提交,审核后显示!提交回复
共1条回复
 b_vivian1980 共回答了27个问题
b_vivian1980 共回答了27个问题 |采纳率85.2%- 解题思路:依据温度不变平衡常数不变并结合化学平衡的三段式列式列方程求氢气的浓度.
依据化学平衡三段式列式得到;
CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始量(mol/L) 0.01 0.01 0 0
变化量(mol/L) 0.005 0.005 0.005 0.005
平衡量(mol/L) 0.005 0.005 0.005 0.005
平衡常数K=1
若再充入水气0.02mol/L,再次列三段式根据温度不变平衡常数不变列方程求:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始量(mol/L) 0.005 0.025 0.005 0.005
变化量(mol/L) X X X X
平衡量(mol/L) 0.005-X 0.025-X 0.005+X 0.005+X
平衡常数K=1=
(0.005+X) 2
(0.005-X)×(0.025-X),X=0.0025,则H2的新的平衡浓度应0.005+0.0025=0.0075mol/L,
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡计算的分析判断,题目难度中等. - 1年前
相关推荐
- 硝酸铜受热易分解:2Cu(NO3)2 2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO 2C
硝酸铜受热易分解:2Cu(NO3)2 2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO 2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2?N2O4,2NO2→2NO+O2等反应).
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收.求若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是多少? 上种红菱下种藕1年前1
上种红菱下种藕1年前1 -
 masjia 共回答了16个问题
masjia 共回答了16个问题 |采纳率100%用原子守恒得,铜的物质的量不变,刚开始硝酸铜的物质的量为0.01moI,全部转化为氧化铜后,氧化铜的物质的量依然是0.01mol,故而CuO的质量为0.01*80=0.8g1年前查看全部
- ( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的交化如下表:
 ( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的交化如下表:
( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的交化如下表:
(1)写出该反应的平衡常数表达式:K=时间/s 0 1 2 3 4 5 n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007 c2(NO2) c2(NO)•c(O2) ,已知:K(300℃)>K(350℃),该反应是______反应(填“放热”或“吸热”);c2(NO2) c2(NO)•c(O2)
(2)如图中表示NO2的变化的曲线是______,用O2的浓度变化表示从0~2s内该反应的平均速率v=______;
(3)能说明该反应已经达到平衡状态的是______
a. v(NO2)=2v(O2);b.容器内压强保持不变;c.v逆(NO)=2v正(O2);d.容器内物质的密度保持不变.
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是______
a.及时分离出NO2气体;b.适当升高温度;c.增大O2的浓度;d.选择高效的催化剂.
( II)用石墨做电极电解:①稀H2SO4②K2SO4溶液③CuCl2溶液④CuSO4 溶液 ⑤KOH溶液.
(1)阴阳极都有气体产生,且体积比(相同条件下)为2:1的是______(填序号,下同),其阳极的电极反应式都是______,总反应的化学方程式是2H2O
2H2↑+O2↑电解 .2H2O.
2H2↑+O2↑电解 .
(2)阴极.阳极都有气体产生,其中溶液的pH变小的是______,pH变大的是______.
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小的是______,其总反应的化学方程式是2CuSO4+2H2O
2Cu+O2↑+2H2SO4电解 .2CuSO4+2H2O.
2Cu+O2↑+2H2SO4电解 . szvico1年前1
szvico1年前1 -
 jmzhuang 共回答了25个问题
jmzhuang 共回答了25个问题 |采纳率92%解题思路:(Ⅰ)、(1)化学平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
平衡常数K(300℃)>K(350℃),说明温度升高,平衡向逆反应移动,升高温度平衡向吸热反应移动.
(2)NO2是产物,随反应进行浓度增大,平衡时c(NO2)为NO浓度的变化量△c(NO),由表中数据可知3s时反应达平衡,平衡是n(NO)=0.007mol,△n(NO)=0.02mol-0.007mol=0.013mol,计算△c(NO),据此进行判断;
根据v=[△c/△t]计算v(NO),再根据速率之比等于化学计量数之比计算v(O2).
(3)可逆反应达到平衡时,v正=V逆 (同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,由此进行判断.解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
(4)a.及时分离出NO2气体,瞬间逆反应速率减小,正反应速率不变,平衡向正反应进行,随后反应混合物各组分的浓度降低,速率减小.
b.升高温度反应速率增大,平衡向吸热反应移动.
c.增大O2的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应进行,随后生成物的浓度增大,逆反应速速率增大.
d.加入高效催化剂,同等程度增大正、逆反应速率,平衡不移动.
(Ⅱ)、(1)由给出电解质溶液可知,阴阳极都有气体产生,且体积比(相同条件下)为2:1的,实质是电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解池的阳极发生氧化反应,氢氧根在阳极放电,生成氧气与水.
(2)由给出电解质溶液可知,阴阳极都有气体产生,实质是电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解后溶液的浓度增大.
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小,电解质的是④CuSO4溶液符合,电解硫酸铜溶液生成铜、氧气与硫酸.(Ⅰ)、(1)可逆反应2NO(g)+O2(g)⇌2NO2(g)的平衡常数k=
c2(NO2)
c2(NO)•c(O2);
平衡常数K(300℃)>K(350℃),说明温度升高,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应是放热反应.
故答案为:
c2(NO2)
c2(NO)•c(O2);放热.
(2)NO2是产物,随反应进行浓度增大,平衡时c(NO2)为NO浓度的变化量△c(NO),由表中数据可知3s时反应达平衡,平衡是n(NO)=0.007mol,△n(NO)=0.02mol-0.007mol=0.013mol,故c(NO2)=△c(NO)=[0.13mol/2L]=0.0065mol/L,所以图中表示NO2变化的曲线是b;
2s内用NO表示的平均反应速率v(NO)=
0.02mol−0.008mol
2L
2s=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,
所以v(O2)=[1/2]v(NO)=[1/2]×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1.
故答案为:b;1.5×10-3mol•L-1•s-1;
(3)a、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、随反应进行,反应混合气体总的物质的量在减小,压强减小,当压强不变,说明反应到达平衡,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故c正确;
d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.
故答案为:bc.
(4)可逆反应2NO(g)+O2(g)⇌2NO2(g)正反应是体积减小的放热反应.
a.及时分离出NO2气体,瞬间逆反应速率减小,正反应速率不变,平衡向正反应进行,随后反应混合物各组分的浓度降低,速率减小,故a错误;
b.升高温度反应速率增大,平衡向吸热反应移动,即平衡向逆反应移动,故b错误;
c.增大O2的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应进行,随后生成物的浓度增大,逆反应速速率增大,故c正确;
d.加入高效催化剂,同等程度增大正、逆反应速率,平衡不移动,故d错误.
故选:c.
(Ⅱ)、(1)由给出电解质溶液可知,阴阳极都有气体产生,且体积比(相同条件下)为2:1的,实质是电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解池的阳极发生氧化反应,氢氧根在阳极放电,生成氧气与水,阳极电极反应式4OH--4e-=O2↑+2H2O;
总反应的化学方程式是2H2O
电解
.
2H2↑+O2↑.
故答案为:①②⑤;4OH--4e-=O2↑+2H2O;2H2O
电解
.
2H2↑+O2↑.
(2)由给出电解质溶液可知,阴阳极都有气体产生,实质是电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解后溶液的浓度增大,①稀H2SO4电解后溶液的酸性增强,溶液PH值不变,②K2SO4溶液是中性溶液,电解后溶液PH值不变,⑤KOH溶液电解后溶液的碱性增强,溶液PH值增大.
故答案为:①;⑤.
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小,电解质的是④CuSO4溶液符合,电解硫酸铜溶液生成铜、氧气与硫酸,总反应的化学方程式为2CuSO4+2H2O
电解点评:
本题考点: 物质的量或浓度随时间的变化曲线;原电池和电解池的工作原理;化学平衡状态的判断.
考点点评: 本题考查了化学平衡及电解的有关知识,化学平衡状态的判断、电解的有关知识是高考的热点,是学习的重点.1年前查看全部
- 有一根烧红的铁钉,温度是800℃,质量是1.5g,温度降低到20℃,放出多少热量?
 hdfhgd1年前1
hdfhgd1年前1 -
 woshinibacaosini 共回答了25个问题
woshinibacaosini 共回答了25个问题 |采纳率92%解题思路:知道铁钉的质量、铁钉的初温和末温,从表中查得铁的比热容,利用放热公式Q放=cm△t求铁钉放出的热量.从课本比热容表中查得铁的比热容c=0.46×103J/(kg•℃),铁钉放出的热量:
Q放=cm△t=0.46×103J/(kg•℃)×1.5×10-3kg×(800℃-20℃)=538.2J.
答:铁钉放出的热量为538.2J.点评:
本题考点: 热量的计算.
考点点评: 本题考查了学生对放热公式Q放=cm△t的掌握和运用,因条件已给出,难度不大.1年前查看全部
- 有一根烧红的铁钉,温度是800℃,质量是1.5g,温度降低到20℃,放出多少热量?
 elitelaw1年前1
elitelaw1年前1 -
 shivvhaoyu 共回答了21个问题
shivvhaoyu 共回答了21个问题 |采纳率95.2%解题思路:知道铁钉的质量、铁钉的初温和末温,从表中查得铁的比热容,利用放热公式Q放=cm△t求铁钉放出的热量.从课本比热容表中查得铁的比热容c=0.46×103J/(kg•℃),铁钉放出的热量:
Q放=cm△t=0.46×103J/(kg•℃)×1.5×10-3kg×(800℃-20℃)=538.2J.
答:铁钉放出的热量为538.2J.点评:
本题考点: 热量的计算.
考点点评: 本题考查了学生对放热公式Q放=cm△t的掌握和运用,因条件已给出,难度不大.1年前查看全部
- 一块烧红的铁块,温度是800℃,质量是500克。当它的温度降低20℃时,它放热多少焦?它的内能变化了多少焦?(铁的比热容
一块烧红的铁块,温度是800℃,质量是500克。当它的温度降低20℃时,它放热多少焦?它的内能变化了多少焦?(铁的比热容为  焦/(千克·℃))
焦/(千克·℃)) hxiaoqiao1年前1
hxiaoqiao1年前1 -
 GRD风雅颂 共回答了16个问题
GRD风雅颂 共回答了16个问题 |采纳率93.8%4.6×10 3 焦; 4.6×10 3 焦1年前查看全部
- 如图曲线是800℃时,A、B、C三种气体物质的浓度随时间变化情况,能以此曲线表示的反应是( )
 如图曲线是800℃时,A、B、C三种气体物质的浓度随时间变化情况,能以此曲线表示的反应是( )
如图曲线是800℃时,A、B、C三种气体物质的浓度随时间变化情况,能以此曲线表示的反应是( )
A.2A⇌B+3C
B.B+3C⇌2A
C.A+C⇌B
D.A⇌B+C meicro1年前1
meicro1年前1 -
 jasonc 共回答了13个问题
jasonc 共回答了13个问题 |采纳率84.6%解题思路:根据反应物减少,生成物增加,变化的物质的量浓度之比等于反应中计量数之比,写出化学方程式,据此作判断.根据图可知,A浓度减小了(2.0-1.2)mol/L=0.8mol/L,所以A为反应物,B浓度增加了0.4mol/L,C的浓度增加了1.2mol/L,所以B、C为生成物,A、B、C的变化的浓度之比为0.8:0.4:1.2=2:1:3,反应中各物质计量数之比等于物质的浓度的变化量之比,则化学方程式为2A⇌B+3C,
故选A.点评:
本题考点: 化学平衡建立的过程;物质的量或浓度随时间的变化曲线.
考点点评: 本题主要考查了根据图象写化学方程式,难度不大,是对基础知识的考查,解题时注意正确理解图象的内容即可.1年前查看全部
- 求大神帮帮忙,要过程有一根烧红的铁钉,温度是800℃,质量是1.5g。它的温度降低到20℃,要放出多少热量?
 yuzhiyuzhe1年前1
yuzhiyuzhe1年前1 -
 爱已涅磐 共回答了9个问题
爱已涅磐 共回答了9个问题 |采纳率22.2%1年前查看全部
- 一块烧红的铁块,温度是800℃,质量是500g.当它的温度降低了20℃时,它放热多少J?(铁的比热容为c=0.46×10
一块烧红的铁块,温度是800℃,质量是500g.当它的温度降低了20℃时,它放热多少J?(铁的比热容为c=0.46×103J/(kg•℃))
 frankeeji1年前1
frankeeji1年前1 -
 hljwhq 共回答了25个问题
hljwhq 共回答了25个问题 |采纳率88%解题思路:知道铁块的质量、温度降低值、比热容,利用放热公式Q放=cm△t求铁块放出的热量.铁块放出的热量:
Q放=cm△t=0.46×103J/(kg•℃)×0.5kg×(800℃-20℃)=1.794×105J.
答:铁块能放出1.794×105J的热量.点评:
本题考点: 热量的计算.
考点点评: 本题考查了学生对放热公式Q放=cm△t的掌握和运用,计算时注意降低到(末温)、降低(△t)、降低了(△t)的区别,易错点!1年前查看全部
- 我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合后加热到800℃左右,得到一种外观似金子的合金名为“鍮石”.写
我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合后加热到800℃左右,得到一种外观似金子的合金名为“鍮石”.写出有关反应的化学方程式: ___ .
 利尔健康si1年前2
利尔健康si1年前2 -
 期待1 共回答了10个问题
期待1 共回答了10个问题 |采纳率70%解题思路:碳酸盐受热易分解,木炭具有还原性,能把氧化物还原得到金属和二氧化碳.由于碳酸盐受热易分解,所以碳酸锌受热分解生成氧化锌和二氧化碳;碳具有还原性能和金属氧化物反应生成金属和二氧化碳,所以碳与氧化锌反应生成锌和二氧化碳,碳和氧化亚铜反应生成铜和二氧化碳.
故答案为:①ZnCO3
800℃
.
ZnO+CO2↑
②2ZnO+C
800℃
.
2Zn+CO2↑
③2Cu2O+C
800℃
.
4Cu+CO2↑点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 通过回答本题知道碳酸盐受热易分解,生成金属氧化物和二氧化碳,碳具有还原性,能与金属氧化物反应生成金属和二氧化碳.1年前查看全部
- 我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到800℃,得到一种外观似金子的锌和铜的合金(即黄铜)
我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到800℃,得到一种外观似金子的锌和铜的合金(即黄铜).
(1)试写出上述变化中生成铜的反应的化学方程式:______;
(2)不法分子常用上述方法制得的黄铜制成“假金元宝”蒙骗人们,鉴别某“金元宝”的真伪,可以有很多方法,如测密度等.为了验证一个“金元宝”是“假金元宝”(即:黄铜),请你设计两种化学方法(用化学方程式表示)______,______. hshen1年前1
hshen1年前1 -
 jonsonli 共回答了28个问题
jonsonli 共回答了28个问题 |采纳率89.3%解题思路:(1)根据赤铜和木炭粉反应反应写出反应的方程式;(2)根据铜在金属活动性顺序表中排在氢后而锌在氢前,氢前的金属能和稀盐酸或稀硫酸反应生成氢气;铜金属活动性比锌弱,锌能和硫酸铜等可溶性铜盐反应分析解答.(1)赤铜和木炭粉在高温下反应生成了铜和二氧化碳,反应的化学方程式是:2Cu2O+C
高温
.
4Cu+CO2↑;
(2)铜在金属活动性顺序表中排在氢后而锌在氢前,氢前的金属能和稀盐酸或稀硫酸反应生成氢气;铜金属活动性比锌弱,锌能和硫酸铜等可溶性铜盐反应锌表面会析出铜,而金活动性比铜查,不能和硫酸铜等可溶性的铜盐反应析出铜,故答案:方法一:实验操作:将样品放入稀硫酸或稀盐酸中;现象:有气泡产生;解释:Zn+H2SO4=ZnSO4+H2↑或Zn+2HCl=ZnCl2+H2↑.方法二:实验操作:将样品放入硫酸铜溶液中;现象:表面有红色的固体析出;Zn+CuSO4=ZnSO4+Cu或Zn+CuCl2=ZnCl2+Cu.
故答案为:
(1)2Cu2O+C
高温
.
4Cu+CO2↑;(2)Zn+H2SO4=ZnSO4+H2↑;Zn+CuSO4=ZnSO4+Cu其他答案合理即可.点评:
本题考点: 金属的化学性质;碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 根据金属活动性,解答该题关键是掌握金属和酸的反应及金属和盐的反应条件.1年前查看全部
- 在800℃时,下列可逆反应达到化学平衡状态:CO(g)+H 2 O(g) CO 2 (g)+H 2 (g),已知CO和H
在800℃时,下列可逆反应达到化学平衡状态:CO(g)+H 2 O(g)
 CO 2 (g)+H 2 (g),已知CO和H 2 O(g)的初始浓度为0.01mol·L -1 时,H 2 平衡浓度为0.005mol·L -1 。若此时再加入0.02mol·L -1 的H 2 O(g),重新达到平衡时,H 2 平衡浓度为
CO 2 (g)+H 2 (g),已知CO和H 2 O(g)的初始浓度为0.01mol·L -1 时,H 2 平衡浓度为0.005mol·L -1 。若此时再加入0.02mol·L -1 的H 2 O(g),重新达到平衡时,H 2 平衡浓度为 A.0.0025 mol·L -1 B.0.0075 mol·L -1 C.0.010 mol·L -1 D.0.015 mol·L -1  Jecky_chen1年前1
Jecky_chen1年前1 -
 karmaor 共回答了13个问题
karmaor 共回答了13个问题 |采纳率84.6%B
增大水蒸气的浓度,平衡向正反应方向移动,但反应是可逆反应,所以最终平衡时,氢气的浓度应该大于0.005mol/L,但小于0.01mol/L,所以正确的答案选B。1年前查看全部
- 在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.
回答下列问题:
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为
转化率应为66.7%,但我算的是33.3%,为什么?
可是第二问不是在第一问已达平衡的基础上再加入的么,第一次反应后CO和H2O不都只剩0.5mol了么,为什么不用0.5减而还用1减呢? 百合的问道1年前3
百合的问道1年前3 -
 狼星焚天 共回答了8个问题
狼星焚天 共回答了8个问题 |采纳率87.5%开始时CO的转化率为(1-0.5)/1=50%
此反应的平衡常数0.5*0.5/(0.5*0.5)=1
再加H2O 1mol
平衡常数不变
设反应消耗CO xmol
平衡常数(1-x)*(2-x)/x*x=1
x=2/3
转化率增大为0.667/1=66.7%1年前查看全部
- 我国古代将炉甘石(ZnCo3) 、赤铜(Cu2O)和木炭粉混合后加热到约800℃,得到一种外观像金子的锌和铜的合金,试写
我国古代将炉甘石(ZnCo3) 、赤铜(Cu2O)和木炭粉混合后加热到约800℃,得到一种外观像金子的锌和铜的合金,试写出反映的化学方程式.
(提示:ZnCO3加热可分解为ZnO) Camry851年前7
Camry851年前7 -
 萧影的影子 共回答了20个问题
萧影的影子 共回答了20个问题 |采纳率90%答:纠正以上的错误!
1,合金组成比错误;
2,反应不是分步进行!
3,俗名上的错误!
最早的药金分两种,一种其实就是黄铜;另一种以铅为主料,在熔与铸的过程中辅 以各种"染料",炼出的酷似黄金的东西才是他们眼里真正的"药金",小球颗粒状的就叫做"金丹".
由于楼主没提到铅这种元素,估计是第一种,即“黄铜”而不是真正的“药金”.黄铜的含铜量80%、含锌量20%,铜和锌原子量比较接近,因此化学上写作4Cu*Zn.
反应式
ZnCO3+2Cu2O+C=4Cu*Zn+2CO2
正因为是同时投料的,没有那么多的分步反应,所以必须严格掌握用碳的质量数,以免在合金中混有杂质氧化物造成没有金属光泽的失败,这就是古代炼丹师的秘诀所在!
这个质量比是:炉甘石:赤铜:木炭=125:286:121年前查看全部
- 有一根烧红的铁钉,温度是800℃,质量是1.5g,温度降低到20℃,放出多少热量?
 臣儿1年前1
臣儿1年前1 -
 啼猿何必近孤舟 共回答了19个问题
啼猿何必近孤舟 共回答了19个问题 |采纳率89.5%解题思路:知道铁钉的质量、铁钉的初温和末温,从表中查得铁的比热容,利用放热公式Q放=cm△t求铁钉放出的热量.从课本比热容表中查得铁的比热容c=0.46×103J/(kg•℃),铁钉放出的热量:
Q放=cm△t=0.46×103J/(kg•℃)×1.5×10-3kg×(800℃-20℃)=538.2J.
答:铁钉放出的热量为538.2J.点评:
本题考点: 热量的计算.
考点点评: 本题考查了学生对放热公式Q放=cm△t的掌握和运用,因条件已给出,难度不大.1年前查看全部
- 1.我国古代将炉甘石(ZnCO3)赤铜(Cu2O)和木炭粉混合后加热到余额800℃,得到一种外观似金子的锌和铜得合金,试
1.我国古代将炉甘石(ZnCO3)赤铜(Cu2O)和木炭粉混合后加热到余额800℃,得到一种外观似金子的锌和铜得合金,试写出反应的化学的方程式(提示:ZnCO3加热可分解为ZnO)
2.某钢铁厂每天需消耗5000t含Fe3O3 76% 得赤铁矿石,该厂理论上可日产Fe 98% 的生铁得质量是多少?
3.冶炼2000t含杂质3% 得生铁,需要含Fe3O4 90% 得磁铁矿石的质量是多少? wanghuiato1年前3
wanghuiato1年前3 -
 dong7dong 共回答了18个问题
dong7dong 共回答了18个问题 |采纳率77.8%ZnCO3——(800摄氏度)ZnO+CO2(气体符号)
ZnO+Cu2O——(800摄氏度)Zn+2CuO
二
这里你打错了吧,赤铁矿的主要成分是Fe2O3不是Fe3O3
5000×76%×112/160=2660t(Fe元素质量)
2660/98%=2714.29t
三
2000×97%/(168/232)/90%=2976.7t1年前查看全部
- 某化学兴趣小组的同学在老师的指导下,用炉甘石(主要成分是ZnCO 3 )、赤铜(Cu 2 O)与木炭粉混合加热到800℃
某化学兴趣小组的同学在老师的指导下,用炉甘石(主要成分是ZnCO 3 )、赤铜(Cu 2 O)与木炭粉混合加热到800℃,得到了多种物质.其中不可能得到的物质是( ) A.锌 B.金 C.铜 D.二氧化碳  hwut1年前1
hwut1年前1 -
 pop147369 共回答了14个问题
pop147369 共回答了14个问题 |采纳率92.9%反应物炉甘石(主要成分ZnCO 3 )赤铜(Cu 2 O)与木炭粉中存在Zn、Cu、C、O 四种元素,所以生成物中也存在这四种元素,故不可能有金元素,就不能得到金.
故选B1年前查看全部
- 我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合后加热到800℃左右,得到一种外观似金子的合金名为“鍮石”.写
我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合后加热到800℃左右,得到一种外观似金子的合金名为“鍮石”.写出有关反应的化学方程式: ___ .
 kezeng181年前1
kezeng181年前1 -
 fgrthbvy 共回答了18个问题
fgrthbvy 共回答了18个问题 |采纳率77.8%解题思路:碳酸盐受热易分解,木炭具有还原性,能把氧化物还原得到金属和二氧化碳.由于碳酸盐受热易分解,所以碳酸锌受热分解生成氧化锌和二氧化碳;碳具有还原性能和金属氧化物反应生成金属和二氧化碳,所以碳与氧化锌反应生成锌和二氧化碳,碳和氧化亚铜反应生成铜和二氧化碳.
故答案为:①ZnCO3
800℃
.
ZnO+CO2↑
②2ZnO+C
800℃
.
2Zn+CO2↑
③2Cu2O+C
800℃
.
4Cu+CO2↑点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 通过回答本题知道碳酸盐受热易分解,生成金属氧化物和二氧化碳,碳具有还原性,能与金属氧化物反应生成金属和二氧化碳.1年前查看全部
- (2013•宁波模拟)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2
 (2013•宁波模拟)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g)⇌H2(g)+CO2(g),反应过程中测定的部分数据见下表:
(2013•宁波模拟)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g)⇌H2(g)+CO2(g),反应过程中测定的部分数据见下表:
①反应在2min内的平均速率为v(H2O)=______;反应时间/min 0 2 4 6 n(CO)/mol 1.20 0.90 0.80 n(H2O)/mol 0.60 0.20
②800℃时,化学平衡常数K的值为______;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率______(填“增大”或“减小”或“不变”).
④在恒温恒压密闭容器中通入CO和H2O各1mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1mol的CO和H2O的混合气体,请在右图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图. white_knight1年前1
white_knight1年前1 -
 空城戒 共回答了11个问题
空城戒 共回答了11个问题 |采纳率90.9%解题思路:①利用速率之比等于计量数之比,根据CO的速率计算水的速率;
②利用三段式计算平衡常数;
③根据影响平衡移动的条件可知,增加一种反应物浓度可以提高另一种反应物的转化率;
④由于该反应是前后体积不变的反应,在恒压条件下,再通入各1mol的CO和H2O的混合气体,与起始量之比相同,平衡后与原平衡为等效平衡,在增加反应物的开始,容器体积增大,反应物浓度增大,生成物浓度变小,所以正反应速率变大,逆反速率减小,但最终平衡不移动,据此答题.①根据v=[△c/t]可知,CO的反应速率为
1.2−0.9
2
2mol•L-1•min-1=0.075 mol•L-1•min-1,利用速率之比等于计量数之比可知水的速率为0.075 mol•L-1•min-1,故答案为:0.075 mol•L-1•min-1;
②在4分钟时,水的变化的物质的量为0.4mol,根据化学方程式可知,CO的变化的物质的量也为0.4mol,所以4min时CO的物质的量为1.2mol-0.4mol=0.8mol,而6min时也是0.8mol,所以反应在4min时达到平衡,
CO(g)+H2O(g)⇌H2(g)+CO2(g),
起始(mol) 1.2 0.6 0 0
转化(mol) 0.4 0.4 0.4 0.4
平衡(mol) 0.8 0.2 0.4 0.4
平衡常数为K=
0.4
2×
0.4
2
0.2
2×
0.8
2=1,故答案为:1;
③根据影响平衡移动的条件可知,增加一种反应物浓度可以提高另一种反应物的转化率,故答案为:增大;
④由于该反应是前后体积不变的反应,在恒压条件下,再通入各1mol的CO和H2O的混合气体,与起始量之比相同,平衡后与原平衡为等效平衡,在增加反应物的开始,容器体积增大,反应物浓度增大,生成物浓度变小,所以正反应速率变大,逆反速率减小,但最终平衡不移动,据此画出图为 ,
,
故答案为: .
.点评:
本题考点: 化学平衡建立的过程;化学反应速率变化曲线及其应用;化学平衡的计算.
考点点评: 本题主要考查了反应速率的计算、化学平衡常数的计算、影响平衡移动的因素等知识点,难度不大,注意基础知识的运用.1年前查看全部
- 在密闭容器中把CO和H2O的混合物加热到800℃,反应CO(g)+H2O⇌CO2(g)+H2(g)达到化学平衡状态,平衡
在密闭容器中把CO和H2O的混合物加热到800℃,反应CO(g)+H2O⇌CO2(g)+H2(g)达到化学平衡状态,平衡常数K=1,若在密闭容器中把2molCO和10molH2O混合加热到800℃,则CO的转化率为( )
A.16.7%
B.50%
C.66.7%
D.83.3% 天__涯何处无芳草1年前1
天__涯何处无芳草1年前1 -
 蓝源桢 共回答了25个问题
蓝源桢 共回答了25个问题 |采纳率84%解题思路:依据化学平衡的三段式列式计算,结合平衡常数表达式计算消耗的一氧化碳的物质的量,结合转化率概念计算得到,反应前后气体物质的量不变,可以利用气体物质的量代替平衡浓度计算平衡常数.在密闭容器中将CO和水蒸气的混合物加热到800℃时,达到平衡状态,设消耗一氧化碳物质的量为x:
CO+H2O⇌CO2+H2,
起始量(mol)2 10 0 0
变化量(mol) xx x x
平衡量(mol)2-x 10-x x x
反应前后气体物质的量不变,可以利用气体物质的量代替平衡浓度计算平衡常数,
平衡常数K=[x×x
(2−x)(10−x)=1.
x=
5/3]mol
则CO的转化率=[5/3mol/2mol]×100%=83.3%,
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 考查了化学平衡计算方法的分析应用,主要是平衡常数概念的计算,题目较简单.1年前查看全部
- 在容积为2L的密闭容器 在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O 2 混合发生反应:2N
在容积为2L的密闭容器
在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O 2 混合发生反应:
2NO+O 2 2NO 2 ,其中NO的物质的量随时间的变化如下表
2NO 2 ,其中NO的物质的量随时间的变化如下表 
请回答下列问题:
(1)用O 2 表示从反应开始至达到平衡(假设30s刚刚达到平衡)时的平均反应速率v(O 2 )=________,10s与10~20s的反应速率之比为____________.
(2)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO 2 ),则该反应是___(选填 “吸”或“放”)热反应.
(3)在800℃时,若缩小容器的体积,达新平衡时n(NO) ____(选填“>”、“=”或“<”)0.07 mol,
NO的转化率___(选填“提高”、“不变”或“降低”).
(4)上述800℃时的反应达到平衡时测得放出热量a kJ.试写出在此条件下该NO与氧气反应的热化学方程
式_____________. 墙茨1年前1
墙茨1年前1 -
 wuzhenhuafen 共回答了11个问题
wuzhenhuafen 共回答了11个问题 |采纳率100%1年前查看全部
- 工业合成氨与制备硝酸一般可连续生产,流程如图1:在800℃、铂催化剂存在条件下,氨与氧气反应的主要产物
工业合成氨与制备硝酸一般可连续生产,流程如图1:在800℃、铂催化剂存在条件下,氨与氧气反应的主要产物
工业合成氨与制备硝酸一般可连续生产,流程如图1:
在800℃、铂催化剂存在条件下,氨与氧气反应的主要产物是NO 和H2O.在实际生产中氨的氧化率与混合气中氧氨比(氧气与氨气物质的量比,以γ{n(O2)/n(NH3)}表示)的关系如图2所示.
请回答下列各题:
(1)若氨氧化率达到100%,理论上γ{n(O2)/n (NH3)}为1.25,而实际生产要将γ值维持在1.7~2.2之间,其原因是______.
(2)若使氨的氧化率达到95%,应控制氨在氨、空气混合气体中的体积分数约为______
(设氧气占空气的体积分数为20%).将γ=1.75的氨、空气混合气体通入800℃、盛有铂催化剂的氧化炉,充分反应后导入到吸收塔的气体的主要成分是______.
(3)现以a mol NH3和足量空气为原料(不考虑N2的反应)最大程度制取NH4NO3,经过一系列转化反应后,向反应后的混合物中加入b g水,得到密度为ρ g?mL-1的溶液,计算该溶液中NH4NO3物质的量浓度可能的最大值______.
 haoxian_20061年前1
haoxian_20061年前1 -
 原来飘渺 共回答了16个问题
原来飘渺 共回答了16个问题 |采纳率81.3%(1)由于一方面提高氧气量,增大氨的氧化率;另方面γ值在该范围,氨的氧化率已高达95~99%,再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本,所以而实际生产要将γ值维持在1.7~2.2之间,
故答案为:一方面提高氧气量,增大氨的氧化率;另方面γ值在该范围,氨的氧化率已高达95~99%,再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本;
(2)氨的氧化率达到95%,γ{n(O2)/n (NH3)}=1.7,设氨气的物质的量是xmol,n(O2)=1.7xmol,空气的物质的量是:1.7xmol×5=8.5xmol,
氨气的体积分数是:[xmol/xmol+8.5xmol]×100%=10.5%,
由于空气足量,一氧化氮完全转化成了二氧化氮,吸收塔中气体主要成分是N2、NO2、H2O,
故答案为:10.5%;N2、NO2、H2O;
(3)设a mol NH3中有x mol用于生产硝酸,其余(a-x) mol NH3跟生成的硝酸恰好完全反应生成NH4NO3.
由4NH3+5O2═4NO+6H2O,4NO+3O2+2H2O═4HNO3得
NH3+2O2 ═HNO3+H2O NH3 +HNO3═NH4NO3
x molx molx mol (a-x)mol x mol
依题意,最大程度制取NH4NO3,则应该满足(a-x)=x,
解得 x=0.5a,
所以,硝酸的物质的量浓度是:c(NH4NO3)═[0.5a
(0.5a×80+0.5a×18+b)÷1000ρ=
500aρ/49a+b]mol?L-1
故答案为:[500aρ/49a+b]mol?L-1 .1年前查看全部
- (1)如图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间.试回答:
(1)如图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间.试回答:
①该反应的反应物是______.
②该反应的化学方程式为______.
③达到平衡状态的所需时间是2min,A物质的平均反应速率为______.
(2)已知反应A(g)+3B(g)⇌2C(g)在一定温度下达到平衡,反应的平衡常数表达式为______.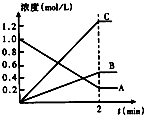
 wefsdefui1年前1
wefsdefui1年前1 -
 昭五 共回答了15个问题
昭五 共回答了15个问题 |采纳率93.3%(1)①由图可知,随着反应的进行,A的浓度降低,B、C的浓度增大,故A为反应物,B、C为生成物;
故答案为:A.
②由图可知,△c(A)=)=1.0mol/L-0.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A⇌B+3C.
故答案为:2A⇌B+3C.
③由图可知△c(A)=1.0mol/L-0.2mol/L=0.8mol/L,所v(A)=
0.8mol/L
2min =0.4mol/L.min;
故答案为0.4mol/(Lmin);
(2)K=
C 2 (C)
C(A). C 3 (B) ;
故答案为:
C 2 (C)
C(A). C 3 (B) .1年前查看全部
- 我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合后加热到800℃左右,得到一种外观似金子的合金名为“鍮石”.写
我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合后加热到800℃左右,得到一种外观似金子的合金名为“鍮石”.写出有关反应的化学方程式: ___ .
 61333401年前1
61333401年前1 -
 16619 共回答了17个问题
16619 共回答了17个问题 |采纳率94.1%解题思路:碳酸盐受热易分解,木炭具有还原性,能把氧化物还原得到金属和二氧化碳.由于碳酸盐受热易分解,所以碳酸锌受热分解生成氧化锌和二氧化碳;碳具有还原性能和金属氧化物反应生成金属和二氧化碳,所以碳与氧化锌反应生成锌和二氧化碳,碳和氧化亚铜反应生成铜和二氧化碳.
故答案为:①ZnCO3
800℃
.
ZnO+CO2↑
②2ZnO+C
800℃
.
2Zn+CO2↑
③2Cu2O+C
800℃
.
4Cu+CO2↑点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 通过回答本题知道碳酸盐受热易分解,生成金属氧化物和二氧化碳,碳具有还原性,能与金属氧化物反应生成金属和二氧化碳.1年前查看全部
- Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
 Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
(1)该反应的反应物是______.
(2)反应物的转化率是______.
(3)该反应的化学方程式为______.
Ⅱ:(7分)在体积为2L的恒容密闭容器中存在以下反应:
CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)判断该可逆反应达到平衡状态的依据是(填序号)______.
A.v正(CH3OH)=v正(CO2)B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
(2)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方向移动的是______(填序号).
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出水蒸气. 上弦月影1年前1
上弦月影1年前1 -
 五车八斗 共回答了16个问题
五车八斗 共回答了16个问题 |采纳率87.5%解题思路:Ⅰ(1)随反应进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断;
(2)由图象可知,A的起始浓度为2mol/L,平衡时浓度为1.2mol/L,据此计算A的浓度变化量,A的转化率=[A的浓度变化量/A的起始浓度]×100%;
(3)由图象可知A的浓度降低,A为反应物,B、C的浓度增大,二者为生成物,根据A、B、C的浓度变化量确定化学计量数,据此书写方程式;
Ⅱ(1)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)根据平衡移动原理分析,改变影响化学平衡的1个条件,平衡向着减弱这种改变的方向移动,据此结合选项分析.Ⅰ(1)由图象可知,随反应进行,A的浓度降低,故A是反应物;
故答案为:A;
(2)由图象可知,A的起始浓度为2mol/L,平衡时浓度为1.2mol/L,A的浓度变化量为2mol/L-1.2mol/L=0.8mol/L,故A的转化率=[0.8mol/L/2mol/L]×100%=40%;
故答案为:40%;
(3)由图象可知A的浓度降低,A为反应物,A的浓度变化量为2mol/L-1.2mol/L=0.8mol/L,B、C的浓度增大,二者为生成物,B的浓度变化量为0.4mol/L,C的浓度变化量为1.2mol/L,浓度变化量之比等于化学计量数之比,故A、B、C的化学计量数之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,故反应方程式为:2A⇌B+3C;
故答案为:2A⇌B+3C;
Ⅱ(1)A.v正(CH3OH)=v正(CO2)都表示正反应速率,自始至终都按1:1进行,不能说明到达平衡;故A错误;
B.容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,混合气体密度不变,不能说明到达平衡,故B错误;
C.混合气体的质量不变,混合气体的物质的量增大,随反应进行平均相对分子质量减小,混合气体的平均相对分子质量不变,说明到达平衡,故C正确;
D.平衡时各物质的浓度保持不变,CH3OH、H2O、CO2、H2的浓度都不再发生变化,说明到达平衡,故D正确;
故选CD;
(2)A.该反应正反应是吸热反应,升高温度,平衡正反应移动,故A错误;
B.该反应正反应是吸热反应,降低温度,平衡向逆反应移动,故B正确;
C.该反应正反应是体积增大的反应,增大压强,平衡逆反应移动,故C正确;
D.该反应正反应是体积增大的反应,减小压强,平衡正反应移动,故D错误;
E.加入催化剂缩短到达平衡时间,平衡不移动,故E错误;
F.移出水蒸气,水蒸气浓度降低,平衡向逆反应移动,故F正确;
故选BCF.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 考查平衡图象、化学平衡有关计算、平衡状态的判断、化学平衡的影响因素等,难度不大,注意基础知识的理解掌握.1年前查看全部
- (8分)在2L密闭容器内,800℃时反应:2NO(g)+O 2 (g) 2NO 2 (g)体系中,n(NO)随时间的变化
(8分)在2L密闭容器内,800℃时反应:2NO(g)+O 2 (g)
 2NO 2 (g)体系中,n(NO)随时间的变化如下表:
2NO 2 (g)体系中,n(NO)随时间的变化如下表:
(1)NO的平衡浓度c(NO)= 。时间(s) 0 1 2 3 4 5 n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
(2)用O 2 表示从0~2s内该反应的平均反应速率v= 。
(3)下图中表示NO 2 变化的曲线是
(4)800℃时,容器内起始压强和平衡后压强之比为___________________ wqh7461年前1
wqh7461年前1 -
 紫色漩涡2000 共回答了15个问题
紫色漩涡2000 共回答了15个问题 |采纳率86.7%(8分)⑴3.5×10 -3 mol·L - 1 (2)1.5×10 -3 mol·L - 1 ·s - 1 (3)b (4) 3 : 2.35
(1)3s时,NO的量不再改变,说明达到平衡状态;
(2)v(NO)= =0.003mol·L - 1 ,则v(O 2 )=0.0015mol·L - 1
=0.003mol·L - 1 ,则v(O 2 )=0.0015mol·L - 1
(3)由题设条件可知平衡时△n(NO)=0.013mol,生成NO 2 为0.013mol,则其c(NO)=0.0065mol·L - 1 ,结合图像可知NO 2 变化的曲线为b线
(4)2NO + O 2 2NO 2
2NO 2
始n:0.02 0.01 0
△n:0.013 0.0065 0.013
平n:0.007 0.0035 0.013
在恒容情况下,气体的物质的量比等于压强比,则起始压强和平衡后压强之比为 3 : 2.351年前查看全部
- 我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合后加热到800℃左右,得到一种外观似金子的合金名为“鍮石”.写
我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合后加热到800℃左右,得到一种外观似金子的合金名为“鍮石”.写出有关反应的化学方程式: ___ .
 summerfang1年前4
summerfang1年前4 -
 happyfanfan1984 共回答了20个问题
happyfanfan1984 共回答了20个问题 |采纳率95%解题思路:碳酸盐受热易分解,木炭具有还原性,能把氧化物还原得到金属和二氧化碳.由于碳酸盐受热易分解,所以碳酸锌受热分解生成氧化锌和二氧化碳;碳具有还原性能和金属氧化物反应生成金属和二氧化碳,所以碳与氧化锌反应生成锌和二氧化碳,碳和氧化亚铜反应生成铜和二氧化碳.
故答案为:①ZnCO3
800℃
.
ZnO+CO2↑
②2ZnO+C
800℃
.
2Zn+CO2↑
③2Cu2O+C
800℃
.
4Cu+CO2↑点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 通过回答本题知道碳酸盐受热易分解,生成金属氧化物和二氧化碳,碳具有还原性,能与金属氧化物反应生成金属和二氧化碳.1年前查看全部
- 反应CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)在800℃达到平衡时,分别改变下列条件,K值会发生变化
反应CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)在800℃达到平衡时,分别改变下列条件,K值会发生变化的是( ) A.将体积减小至原来的一半 B.加入催化剂 C.将反应温度升高至1000℃ D.增大水蒸气的浓度  xiazhixiang850101年前1
xiazhixiang850101年前1 -
 xmkcg 共回答了15个问题
xmkcg 共回答了15个问题 |采纳率86.7%A.减小体积压强增大,各物质浓度都增大,但平衡不移动,化学平衡常数K不变,故A错误;B.加入催化剂加快反应速率但平衡不移动,化学平衡常数也不变,故B错误;C.化学平衡常数只与无关有关,温度改变,平衡常数...1年前查看全部
- 我国古代将炉甘石(主要成分:ZnCO 3 )、赤铜矿(主要成分:Cu 2 O)和足量木炭粉加热至800℃,即可得到金光闪
我国古代将炉甘石(主要成分:ZnCO 3 )、赤铜矿(主要成分:Cu 2 O)和足量木炭粉加热至800℃,即可得到金光闪闪的“药金”.请回答:
(1)“药金”的主要成分是______;
(2)用上述方法和原料不能制得黄金(Au)的原因是______. empemp1年前1
empemp1年前1 -
 珍惜772 共回答了15个问题
珍惜772 共回答了15个问题 |采纳率93.3%(1)在高温条件下,ZnCO 3 分解为氧化锌和二氧化碳,碳能还原氧化锌和氧化亚铜,生成了锌和铜.所以,“药金”的主要成分是锌和铜;
(2)因为黄金的主要成分是金,它是由金元素组成;要制取黄金,根据质量守恒定律可知,反应物中一定要有金元素,但是上述反应物中不含有金元素,故不能制取.
故答为:(1)锌和铜;(2)反应物中没有金元素.1年前查看全部
- 下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
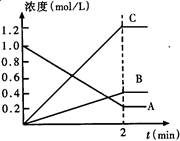
(1)该反应的反应物是______。
(2)该反应的化学方程式为__________。
(3)达到平衡状态的所需时间是2min,A物质的平均反应速率为_______。 心随残梦1年前1
心随残梦1年前1 -
 南至 共回答了24个问题
南至 共回答了24个问题 |采纳率91.7%(6分)(每小题各2分)(1)A (2)2A B+3C (不写可逆号扣1分)
B+3C (不写可逆号扣1分)
(3 ) 0.4mol/(L·min) (不写单位扣1分)
专题:化学平衡专题;化学反应速率专题.
分析:(1)随反应进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断.
(2)根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式.
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v=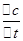 计算A物质的平均反应速率.
计算A物质的平均反应速率.
(1)由图可知,随反应进行A的浓度降低,A为反应物,B、C的浓度增大,故B、C为生成物.
故答案为:A.
(2)由图可知,△c(A)=)=2.0mol/L-1.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A?B+3C.
故答案为:2A?B+3C.
(3)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,所v(A)= =0.4mol/(L?min).
=0.4mol/(L?min).
故答案为:0.4mol/(L?min).
<>1年前查看全部
- (10分)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t表示时间。试回答:
(10分)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t表示时间。试回答:

(1)该反应的反应物是 。
(2)该反应的化学方程式为 。
(3)达到平衡状态的所需时间是2min,A物质的平均反应速率为
(4)其他条件不变,压缩容器容积,平衡______________(填向正或逆方向或不)移动;若正方向吸热,则升高温度,平衡平衡___________(填向正或逆方向或不)移动。 HyZed1年前1
HyZed1年前1 -
 告别的聚会 共回答了17个问题
告别的聚会 共回答了17个问题 |采纳率100%1年前查看全部
- 有一块烧红的铁块温度是800℃质量是500g,投入200g20℃的水中,不计热损失,求水温升高了多
 暗恋紫苏1年前0
暗恋紫苏1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)NO的平衡浓度c(NO)=______.时间(s) 0 1 2 3 4 5 n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
(2)用O2表示从0-2s内该反应的平均反应速率v=______.
(3)如图中表示NO2变化的曲线是______.
(4)能说明该反应已达到平衡状态的是______.
a.v(NO2)=2v(O2)
b.容器内气体总物质的量保持不变
c.V逆 (NO)=2v正(O2)
d.容器内气体的密度保持不变. 鸟人也会飞1年前1
鸟人也会飞1年前1 -
 叶子鸣 共回答了16个问题
叶子鸣 共回答了16个问题 |采纳率93.8%解题思路:(1)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡;
(2)根据v=[△c/△t]计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO);
(4)可逆反应达到平衡时,v正=V逆 (同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,由此进行判断.(1)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡,所以平衡时NO的浓度为[0.007mol/2L]=3.5×10-3mol•L-1,故答案为:3.5×10-3mol•L-1;
(2)2s内用NO表示的平均反应速率v(NO)=
△n(NO)
V
△t=
0.020mol−0.008mol
2L
2s=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,
所以v(O2)=[1/2]v(NO)=[1/2]×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1,故答案为:1.5×10-3mol•L-1•s-1;
(3)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)=[0.020mol−0.007mol/2L]=0.0065mol/L,所以图中表示NO2变化的曲线是b,
故答案为:b;
(4)a、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、随反应进行,反应混合气体总的物质的量在减小,气体总物质的量保持不变,说明反应到达平衡,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故c正确;
d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.
故答案为:bc.点评:
本题考点: 化学平衡的计算;化学平衡状态的判断;物质的量或浓度随时间的变化曲线.
考点点评: 本题主要考查反应速率、平衡平衡状态的判断及读图表能力,难度中等,判断平衡时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.1年前查看全部
- 将一定量的炉甘石(ZnCO 3 )和赤铜矿(Cu 2 O)粉末跟足量炭粉混合,加热至800℃左右,充分反应后可得到一种外
将一定量的炉甘石(ZnCO 3 )和赤铜矿(Cu 2 O)粉末跟足量炭粉混合,加热至800℃左右,充分反应后可得到一种外观类似黄金的合金。同学们对这种合金的成分很感兴趣,查阅资料:高温时木炭可将金属活动性顺序中铝以后金属的氧化物还原成金属单质;在高温条件下,ZnCO 3 可分解成金属氧化物和一种常见气体。
(1)写出ZnCO 3 分解反应的化学方程式 ___________。
(2)以下是同学们对该合金成分的几种猜想: a.可能是Zn、Cu b.可能是Zn、Cu、C c.可能是ZnO、CuO、Cu 如果想证明a中Zn的存在,可选用的试剂是____,反应的化学方程式为____。
(3)你认为几种猜想中应首先排除的是____(填“a”“b”或“c”),理由是____。 西伯利亚韩流1年前0
西伯利亚韩流1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将16gCuSO4加热至800℃,得到Cu2O固体和SO2,SO3,O2的混合气体,求该混合气体的平均摩尔质量
 wangzuolin19871年前2
wangzuolin19871年前2 -
 jesse0097 共回答了15个问题
jesse0097 共回答了15个问题 |采纳率93.3%设生成SO2、SO3、O2的质量分别为X、Y、Z
2CuSO4=高温=Cu2O+SO2↑+SO3↑+O2↑
320 64 80 32
16g X Y Z
X=3.2g
Y=4g
Z=1.6g
该混合气体的总物质的量n=3.2g/64g/mol+4g/80g/mol+1.6g/32g/mol=0.15mol
该混合气体的平均摩尔质量M=m/n=(3.2g+4g+1.6g)/0.015mol=58.7g/mol
希望我的回答能对你的学习有帮助!1年前查看全部
- 某人将镍铬——镍硅补偿导线极性接反,当电炉温度控制于800℃时,若热电偶接线盒处温度为50℃,仪表接线板处温度为40℃,
某人将镍铬——镍硅补偿导线极性接反,当电炉温度控制于800℃时,若热电偶接线盒处温度为50℃,仪表接线板处温度为40℃,问测量结果和实际差多少?
Eu (800℃)=33.29 mv;Eu (50℃)=2.02 mv; Eu (40℃)=1.61 mv; 有酒不醉1年前1
有酒不醉1年前1 -
 pangshunyuan 共回答了15个问题
pangshunyuan 共回答了15个问题 |采纳率93.3%当补偿导线正确连接时,仪表实得电势为
33.29 - 1.61 = 31.68 mv
如补偿导线接反,则仪表实得电势为
(33.29-2.02)-(2.02-1.61)=30.86 mv
查表得741.5℃,和实际相差-19.5 ℃.1年前查看全部
- 在2L密闭容器内,800℃时反应2NO(g)+O2(g)⇌2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)⇌2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)⇌2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
各物质的浓度的变化如图.时间(s) 0 1 2 3 4 5 n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
(1)如图表示NO2的变化的曲线是______.用O2表示从0~2s内该反应的平均速率v=______ mol•L-1•s-1.
(2)能说明该反应已达到平衡状态的是______.
a.2v逆(NO2)=v正(O2)b.容器内压强保持不变 c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是______.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度d.选择高效催化剂. 手若柔荑1年前1
手若柔荑1年前1 -
 amwwfndn 共回答了22个问题
amwwfndn 共回答了22个问题 |采纳率90.9%解题思路:(1)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO);根据v=[△c/△t]计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(3)为使该反应的反应速率增大,可采用增大压强、升高温度、加入催化剂、增大反应物浓度等方法,再结合平衡移动原理分析解答.(1)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)=[0.020mol−0.007mol/2L]=0.0065mol/L,所以图中表示NO2变化的曲线是b,2s内用NO表示的平均反应速率v(NO)=
△n(NO)
V
△t=
0.020mol−0.008mol
2L
2s=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,
所以v(O2)=[1/2]v(NO)=[1/2]×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1,
故答案为:b;1.5×10-3;
(2)a、当2v逆(NO2)=v正(O2)时,该反应未达平衡状态,而当v逆(NO2)=2v正(O2)时,反应才处于平衡状态,故a错误;
b、该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,故容器内压强保持不变时,反应达到平衡状态,故b正确;
c、v逆(NO):v正(O2)=2:1时,正逆反应速率相等,该反应达到平衡状态,故c正确;
d、根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故d错误;
故答案为:bc;
(3)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故a错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故b错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故c正确;
d.选择高效催化剂能增大反应速率,但平衡不移动,故d错误;
故答案为:c.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断、化学反应速率的计算等知识点,难度不大,注意催化剂只改变反应速率,但不影响平衡移动,为易错点.1年前查看全部
- 一卡诺机工作在800℃和20℃的两热源间.试求:
一卡诺机工作在800℃和20℃的两热源间.试求:
1、卡诺机的热效率
2、若卡诺机每分钟从高温热源吸入1000KJ热量.此卡诺机净输出功率为多少KW?
3、求每分钟向低温热源排出的热量?
要详细过程!没有过程不给分的 fan_miao71年前1
fan_miao71年前1 -
 zbh_6108 共回答了11个问题
zbh_6108 共回答了11个问题 |采纳率100%1.由卡洛热机视为理想热机,由其效率公式:
效率w=1-T2/T1
=1-(20+273.15)/(800+273.15)=73.7%
2.Q'=wQ=73.7%x1000=737kJ
P=Q'/t=737/60=12.3kW
3.Q'=Qw=737kJ1年前查看全部
- 我国古代将炉甘石,赤铜和木炭粉混合后加热到约800℃,得到一种外观似金子的锌和铜的合金,试写出反应的
 zhangfeng51601年前1
zhangfeng51601年前1 -
 Ph0nix 共回答了15个问题
Ph0nix 共回答了15个问题 |采纳率93.3%ZnCO3===ZnO+CO2↑ 2ZnO+C===2Zn+CO2↑ 2Cu2O+C===4Cu+CO2↑ 条件都是高温1年前查看全部
- 已知可逆反应CO+H2O CO2+H2在800℃时的化学平衡常数K为1,当上述可逆反应进行到
已知可逆反应CO+H2O CO2+H2在800℃时的化学平衡常数K为1,当上述可逆反应进行到
已知可逆反应CO+H2O CO2+H2在800℃时的化学平衡常数K为1,当上述可逆反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002 mol/L, c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L ,c(H2)=0.0025mol/L,此时可逆反应是否达到平衡状态? 改名狂人1年前3
改名狂人1年前3 -
 猫的脚印 共回答了17个问题
猫的脚印 共回答了17个问题 |采纳率88.2%k=[c(CO2)*c(H2)]/[c(CO)*c(H2O)]
=(0.0025*0.0025)/(0.002*0.003)=0.0000063/0.000006>1
反应朝逆方向1年前查看全部
- 第四题 我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,可得一种
第四题 我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,可得一种
第四题 我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,可得一种外观似金子的锌和铜的合金,试写出反应的化学方程式(提示:ZnCO3加热可分解为ZnO) hour9121年前1
hour9121年前1 -
 小鬼QQ 共回答了21个问题
小鬼QQ 共回答了21个问题 |采纳率81%1年前查看全部
- 水通过雾化不同温度下汽化时间水通过雾化后喷入 800℃、900℃、1000℃的高温烟气中下,汽化时间大概几秒 与雾化后水
水通过雾化不同温度下汽化时间
水通过雾化后喷入 800℃、900℃、1000℃的高温烟气中下,汽化时间大概几秒 与雾化后水珠的粒径有关系吗 似花似蝶1年前1
似花似蝶1年前1 -
 有一点伤心 共回答了19个问题
有一点伤心 共回答了19个问题 |采纳率89.5%与粒径大小有关,表面积大小不一样,吸热大小也不一样.1年前查看全部
- 第一问已解出,求第二问怎么解?有一根烧红的铁钉,温度是800℃,质量是1.5g,它的温度降低到20℃,要放出多少热量?可
第一问已解出,求第二问怎么解?有一根烧红的铁钉,温度是800℃,质量是1.5g,它的温度降低到20℃,要放出多少热量?可使质量为多少的水温度升高5℃?(不计热量损失)
 新睡觉1年前0
新睡觉1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g)⇌CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.
试回答下列问题:
(1)平衡时CO的转化率为______,该反应的化学平衡常数为______.
(2)如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将______(填“增大”、“减小”、“不变”),预计CO的转化率为______.
(3)427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果判断该反应的△H______0(填“>”、“=”、“<”). 5490liu1年前1
5490liu1年前1 -
 lwt35 共回答了15个问题
lwt35 共回答了15个问题 |采纳率93.3%解题思路:令容器体积为1L,根据反应的方程式H2O (g)+CO (g)⇌H2(g)+CO2 (g),分别计算起始、转化以及平衡时的浓度,首先可计算出800℃时该反应的平衡常数、转化率等,根据温度变化时平衡常数的变化可判断反应热.①令容器体积为1L,
H2O (g)+CO (g)⇌H2(g)+CO2 (g)
起始:1 1 0 0
变化:0.5 0.5 0.5 0.5
平衡:0.5 0.5 0.5 0.5
则800℃时该反应的平衡常数k=1.
平衡时CO的转化率为[0.5/1×100%=50%,
故答案为:50%;1;
②如果继续向该平衡体系中通入1.0mol的H2O(g),设从起始到平衡CO的浓度变化为xmol•L -1,
H2O (g)+CO(g)⇌H2(g)+CO2 (g)
起始:2 1 0 0
变化:x x x x
平衡:(2-x) (1-x) xx
k=
x2
(2−x)(1−x)]=1,解得x=[2/3],CO转化率为
2
3
1×100%=66.7%,转化率增大,
故答案为:增大;66.7%;
③427℃时该反应的平衡常数为9.4,若保持其他条件不变,将温度从800℃降到427℃,平衡常数增加意味着反应正向移动,说明正反应放热,则该反应的△H<0,
故答案为:<.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,综合考查学生对化学平衡的理解以及计算能力,题目难度中等,本题注意根据物质的量浓度的变化利用三段式法解答.1年前查看全部
- 水会被高温分解成氢和氧吗?比如在大火堆中放入一根湿木,近800℃的高温会使水分迅速汽化,然后分子结构会不会被高温继续剥离
水会被高温分解成氢和氧吗?
比如在大火堆中放入一根湿木,近800℃的高温会使水分迅速汽化,然后分子结构会不会被高温继续剥离成氢和氧从而助燃? emule0471年前3
emule0471年前3 -
 抿嘴一乐 共回答了17个问题
抿嘴一乐 共回答了17个问题 |采纳率94.1%因为H2O分解为H2 和02的属于分解反应.而2H2+O2=2H20所放的热量是800℃远远达不到的.只有通过电解的方式才能实现!1年前查看全部
- 在一恒容密闭容器中发生某化学反应2A(g)⇌B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ
在一恒容密闭容器中发生某化学反应2A(g)⇌B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol•L -1 )随时间(min)的变化如图所示:
试回答下列问题:
(1)在实验Ⅰ中,反应在20min至40min内A的平均反应速率为______.
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是______.
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向______(填“正”或“逆”)反应方向移动,该正反应是______(填“放热”或“吸热”)反应.
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8mol•L -1 ,其它条件不变,则达到平衡时所需用的时间______实验Ⅰ(填写“大于”、“等于”或“小于”).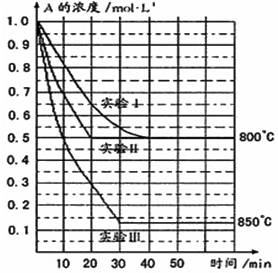
 12345想你1年前1
12345想你1年前1 -
 我爱12 共回答了14个问题
我爱12 共回答了14个问题 |采纳率85.7%(1)实验Ⅰ中,反应在20min至40min内A的浓度变化为0.65mol/L-0.5mol/L=0.15mol/L,所以v(A)=
0.15mol/L
40min-20min =0.0075mol•L -1 •min -1 .
故答案为:0.0075mol•L -1 •min -1 .
(2)实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快,改变压强平衡不移动,但物质的浓度发生变化,故实验Ⅱ应该使用了催化剂.
故答案为:实验Ⅱ使用了催化剂.
(3)实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动,降低温度平衡向放热反应移动,故正反应为吸热反应.
故答案为:逆;吸热.
(4)A的起始浓度改为0.8mol•L -1 ,等效为降低压强,反应速率降低,到达平衡时间增长,即达到平衡时所需用的时间 大于实验Ⅰ.
故答案为:大于.1年前查看全部
- 在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O……转化
在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O……转化率?
在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol.
如果继续向该平衡体系中通入1.0 mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率是?为什么? skynancy2081年前3
skynancy2081年前3 -
 WOAINIDESHIHOU 共回答了23个问题
WOAINIDESHIHOU 共回答了23个问题 |采纳率91.3%CO(g)+H2O(g) CO2(g)+H2(g)
起始 1 1 0 0
反应 x x x x
平衡 1-x 1-x x x
由已知得1-x = 0.5
x = 0.5
K = x^2/(1-x)^2 = 1
向该平衡体系中通入1.0 mol的H2O(g):
CO(g)+H2O(g) CO2(g)+H2(g)
起始 1 2 0 0
反应 y y y y
平衡 1-y 2-y y y
平衡时有K = y^2/[(1-y)(2-y)] = 1
得y = 2/3
所以达到新的平衡状态,则CO的转化率 = y/1 = 66.7%1年前查看全部
- 冶炼技术在中国有着悠久的历史,我国古代将炉甘石(ZnCO3)、赤铜矿(主要成分为Cu2O)和木炭粉混合加热至800℃左右
冶炼技术在中国有着悠久的历史,我国古代将炉甘石(ZnCO3)、赤铜矿(主要成分为Cu2O)和木炭粉混合加热至800℃左右,即可得到金光闪闪与黄金外观相似的“药金”.
(1)用上述方法不能制得黄金是因为______.
(2)药金的主要成分是______. 小妖精的苹果1年前1
小妖精的苹果1年前1 -
 月牙_牛牛 共回答了21个问题
月牙_牛牛 共回答了21个问题 |采纳率100%解题思路:黄金的成分主要是金,根据质量守恒定律可知,化学反应前后元素的种类不变,那么我们通过分析此题反应前是否存在金(Au)元素来判断能否制得黄金;根据“药金”的制取过程其主要含有的金属是锌和铜.(1)因为黄金的主要成分是金,它是由金元素组成;那么要制取黄金,根据质量守恒定律可知,反应物中一定要有金元素,但是上述材料不含有金元素,故不能制取.
(2)根据质量守恒定律,反应前后元素种类不变和“药金”的冶炼材料可知:与黄金外观相似的“药金”主要成分是Zn、Cu.
故正确答案:
(1)在化学反应中原子种类不变Zn、Cu、C、O不可能变成Au;
(2)Zn、Cu点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查了对质量守恒定律的应用情况,能够利用该定律解释一些生活中常见的现象;质量守恒定律是初中化学中一个非常重要的定理,也是中考中的热点问题,所以深刻理解质量守恒定律,并能够应用质量守恒定律解决问题对同学来说是非常重要的.1年前查看全部
- 在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
A. 800℃下,该反应的化学平衡常数为0.25
B. 427℃时该反应的平衡常数为9.4,则该反应的△H<0
C. 同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7%
D. 同温下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% public_88991年前1
public_88991年前1 -
 wangljy 共回答了12个问题
wangljy 共回答了12个问题 |采纳率91.7%解题思路:A、根据CO的物质的量,利用三段式计算平衡时各组分的物质的量,由于反应前后气体的体积不变,各物质的系数为1,故可以用物质的量代替浓度代入平衡常数表达式计算;
B、结合A中的平衡常数,判断降低温度平衡的移动方向,据此判断反应热效应;
C、同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),等效为开始加入1.0mol CO与2.0mol H2O,令平衡时参加反应的CO的物质的量为amol,利用三段式表示出平衡时各组分的物质的量,代入平衡常数列方程计算a的值,再根据转化率定义计算;
D、同温下,若继续向该平衡体系中通入1.0 mol的CO(g),等效为开始加入2.0mol CO与1.0mol H2O,令平衡时参加反应的CO的物质的量为bmol,利用三段式表示出平衡时各组分的物质的量,代入平衡常数列方程计算b的值,再根据转化率定义计算.A、平衡时CO的物质的量为0.5mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol):1 1 0 0
变化(mol):0.5 0.5 0.5 0.5
平衡(mol):0.5 0.5 0.5 0.5
故该温度下平衡常数k=[0.5×0.5/0.5×0.5]=1,故A错误;
B、427℃时该反应的平衡常数为9.4,大于800℃时的平衡常数1,故降低温度平衡向正反应进行,该反应正反应是放热反应,即△H<0,故B正确;
C、同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),等效为开始加入1.0mol CO与2.0mol H2O,令平衡时参加反应的CO的物质的量为amol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol):12 0 0
变化(mol):a a a a
平衡(mol):1-a2-a aa
所以[a×a
(1−a)×(2−a)=1,解得a=
2/3],故CO的转化率为
2
3mol
1mol×100%=66.7%,故C正确;
D、同温下,若继续向该平衡体系中通入1.0 mol的CO(g),等效为开始加入2.0mol CO与1.0mol H2O,令平衡时参加反应的CO的物质的量为bmol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol):21 0 0
变化(mol):b b b b
平衡(mol):2-b1-bbb
所以[b×b
(2−b)×(1−b)=1,解得b=
2/3],故CO的转化率为
2
3mol
1mol×100%=66.7%,故D错误;
故选BC.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡常数的有关计算,难度中等,注意化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率.1年前查看全部
- 有一根烧红的铁钉,温度是800℃,质量是1.5g,温度降低到20℃,放出多少热量?
 游义1年前4
游义1年前4 -
 gegewu009 共回答了10个问题
gegewu009 共回答了10个问题 |采纳率90%解题思路:知道铁钉的质量、铁钉的初温和末温,从表中查得铁的比热容,利用放热公式Q放=cm△t求铁钉放出的热量.从课本比热容表中查得铁的比热容c=0.46×103J/(kg•℃),铁钉放出的热量:
Q放=cm△t=0.46×103J/(kg•℃)×1.5×10-3kg×(800℃-20℃)=538.2J.
答:铁钉放出的热量为538.2J.点评:
本题考点: 热量的计算.
考点点评: 本题考查了学生对放热公式Q放=cm△t的掌握和运用,因条件已给出,难度不大.1年前查看全部
大家在问
- 1I have been thinking of you all the time~
- 2根据短文内容,从短文后的选项中选出能填入空白处的最佳选项。选项中有两项为多余选项。
- 3泉源路全长234米,在街道两旁种植桃树,两棵树间的距离都相等,共种158棵。求每两棵桃树间的距离。(两端都要植树)
- 4设f(x )的定义域为{x丨x>0}且满足条件f(4)=1 对于任意x1,x2∈(0,+∞).
- 5Ten Miles from Nowhere
- 6问题一:一个两位数,十位上的数字比个位上的数字少1,如果是为上的数字扩大到4倍,个位上的数字减2,那么,所得的两位数比原
- 7已知x的平方减3x减1等于0,求2x的平方减3x的平方减11x加8的值
- 8分析下面的句子成分Their hobbies have brought them lots of money.—————
- 9一道高一数学题:解方程:log(0.5x)(2)-log(0.5x^3)(X^2)=log(0.5x^3)(4) 求大神
- 10如图,矩形ABCD与矩形EDCF相似,且CD=1.求:BC•CF的值.
- 11100mL气体A2跟50mL气体B2恰好完全反应生成100mL气体C(体积均在相同条件下测定)则C的化学式为______
- 12小赵和小王交流暑假中的活动,小赵说:“我参加科技夏令营,外出一个星期,这七天的日期数之和为84,你知道我是几号出去的吗”
- 13堆雪人打雪仗英语怎么说
- 14(2014•石家庄二模)实数x,y满足y≥1y≤2x−1x+y≤b,如果目标函数z=x-y的最小值为-2,则实数b的值为
- 15怎样把双重复定句该陈成陈述句