xA+yB=mC+nD(x、y为化学计量数)中,
 长胡子猫猫2022-10-04 11:39:542条回答
长胡子猫猫2022-10-04 11:39:542条回答若A和B的质量都为a 克,充分反应后生成物的总质量小于或等于2a克,为什么?

已提交,审核后显示!提交回复
共2条回复
 jaspan 共回答了25个问题
jaspan 共回答了25个问题 |采纳率100%- 充分反应指反应达到平衡,即反应物和生成物的量不变了
因此,A与B可能恰好完全反应,生成C和D,此时生成物为2ag
还可能A或B有剩余,此时生成物小于2ag(质量守恒) - 1年前
 淡淡的笑了 共回答了5个问题
淡淡的笑了 共回答了5个问题 |采纳率- 质量守恒定律,完全反应则生成物质量等于2a克,不完全反应则生成物质量小于2a克
- 1年前
相关推荐
- 化学计量数之比等于什么
 东水楼1年前5
东水楼1年前5 -
 skipig 共回答了19个问题
skipig 共回答了19个问题 |采纳率100%要看条件三同定一同(温度,压强,体积,物质的量,其中有三个相同,另一个必相同)也就是说 同温同压下,V1/V2=n1/n2 同温同体积时,p1/p2=n1/n2=N1/N2同温同压等质量时,V1/V2=M2/M1 同温同压同体积时,M1/M2=ρ1/ρ2还有化学...1年前查看全部
- 平衡时的物质之比,遵循化学计量数之比吗?
 yangying2331年前2
yangying2331年前2 -
 两袖青锋 共回答了19个问题
两袖青锋 共回答了19个问题 |采纳率89.5%不遵循,只有三个量遵循化学计量数之比:1,各物质的 物质的量转化之比2.各物质的 浓度变化之比 3.速率之比.平衡物质之比与计量数没有必然关系,切记!1年前查看全部
- 化学计量数之比等于物质的量之比 这里指的物质的量是反应前的 变化的 还是平衡的
 cheney1年前1
cheney1年前1 -
 西米捞 共回答了25个问题
西米捞 共回答了25个问题 |采纳率88%化学计量数之比等于物质的量之比
这里指的物质的量是 变化的物质的量1年前查看全部
- 电子转移物质的量跟化学计量数有关吗?
电子转移物质的量跟化学计量数有关吗?
例题:8HNCO+6NO2=7N2+8CO2+4H2O
问:1molNO2在反应中转移的电子为4mol,为什么是对的?不用考虑前面的化学计量数吗? a8efq9jge1年前1
a8efq9jge1年前1 -
 winlin0712 共回答了24个问题
winlin0712 共回答了24个问题 |采纳率87.5%从题目可知,NO2中的N全部转化成N2中的N,所以与化学计量数无关.NO2中N的化合价为正4价,而N2中为0价,所以1molNO2转移4mol电子1年前查看全部
- 化学平衡中计量数与平衡标志问题我想问的是一个一定与可能的关系.一个可逆反应,当气体分子数之比等于方程式化学计量数的时候,
化学平衡中计量数与平衡标志问题
我想问的是一个一定与可能的关系.一个可逆反应,当气体分子数之比等于方程式化学计量数的时候,是一定不平衡,还是不一定平衡?我觉得是不一定平衡,但做题时它说一定不平衡, waiting-j1年前3
waiting-j1年前3 -
 接线 共回答了16个问题
接线 共回答了16个问题 |采纳率75%是不一定
有非常巧合的时候平衡的时候刚刚是计量数之比
我们化学老师也是该过的
祝学习顺利1年前查看全部
- 关于化学反应xA+yB═mC+nD,有下列说法:①化学计量数x与y的和一定等于m与n的和;②若A、C为单质,B、D为化合
关于化学反应xA+yB═mC+nD,有下列说法:①化学计量数x与y的和一定等于m与n的和;②若A、C为单质,B、D为化合物,则该反应一定是置换反应;③若B是碱,则C和D中一定有一种是盐;④若A和B各取10g混合,使其充分反应后,则C和D的质量总和一定为20g;⑤若B和D都是盐,则该反应一定是复分解反应;⑥若C和D分别为盐和水,则该反应一定是中和反应,其中正确的是( )
A.①②④⑤
B.②③⑤⑥
C.只有②③
D.只有② 天奈鼠1年前1
天奈鼠1年前1 -
 xycoolyy 共回答了18个问题
xycoolyy 共回答了18个问题 |采纳率100%解题思路:①根据质量守恒定律可知,化学反应前后分子的个数可能改变;②根据置换反应的定义可知若A、C为单质,B、D为化合物,则该反应一定是置换反应;③根据碱的性质可知,若B是碱,则C和D中一定有一种是盐;④根据质量守恒定律可知,参加化学反应的各物质的质量总和等于反应后各物质的质量总和;⑤根据复分解反应的含义进行解答;⑥若C和D分别为盐和水,则该反应不一定是中和反应.①根据质量守恒定律可知,化学反应前后分子的个数可能改变,化学计量数x与y的和不一定等于m与n的和,故①错误;②根据置换反应的定义可知若A、C为单质,B、D为化合物,则该反应一定是置换反应,故②正确;③根据碱的性质可知,若B是碱,则C和D中一定有一种是盐,故③正确;④根据质量守恒定律可知,参加化学反应的各物质的质量总和等于反应后各物质的质量总和,若A和B各取10g混合,使其充分反应后,但A和B不一定恰好反应,所以生成C和D的质量总和不一定为20g,故④错误;⑤若B和D都是盐,则该反应不一定是复分解反应,例如金属铁和硫酸铜溶液反应生成铜和硫酸亚铁就不是复分解反应,故⑤错误;⑥中和反应是指酸和碱反应生成盐和水的反应,若C和D分别为盐和水,则该反应不一定是中和反应,例如氧化铁和盐酸反应生成氯化铁和水,就不是中和反应,故⑥错误.
故选:C.点评:
本题考点: 置换反应及其应用;中和反应及其应用;复分解反应及其应用;质量守恒定律及其应用.
考点点评: 本题主要考查了化学方程式的正确书写的方法步骤,掌握中和反应、复分解反应和置换反应及其应用;学会反应类型的判定方法.1年前查看全部
- 醋酸钠电离,加水稀释为什么平衡正向移动,书上说因为向微粒数目增多的方向移动,可前后化学计量数相等啊?
 慕头猪猪1年前3
慕头猪猪1年前3 -
 yjhu235235 共回答了20个问题
yjhu235235 共回答了20个问题 |采纳率75%化学计量数相等?
CH3COOH=可逆符号=CH3COO- + H+
离子数目增多
化学计量数相等?1年前查看全部
- H2和CO是合成许多有机物的原料,有如下反应:mH2+nCO═wX(反应条件已省去,m、n、w为化学计量数).如m:n=
H2和CO是合成许多有机物的原料,有如下反应:mH2+nCO═wX(反应条件已省去,m、n、w为化学计量数).如m:n=l:1、w=l,则有机物X可能是①:HCHO ②:C2H5OH ③:CH3COOH ④:CH3CHO 中的( )
A.①和②
B.①和③
C.②和③
D.①和④ 心在滴血111年前1
心在滴血111年前1 -
 bjboy911 共回答了18个问题
bjboy911 共回答了18个问题 |采纳率100%解题思路:根据质量守恒定律和化合反应的定义和特点判断,主要是利用反应前后原子的种类不变,其数目比保持不变分析判断.根据题意mH2+nCO═wX(反应条件已省去,m、n、w为化学计量数).如m:n=l:1、w=l,可知生成物X中C、H、O元素的原子个数比为1:2:1.
故选B点评:
本题考点: 质量守恒定律及其应用.
考点点评: 化学反应前后原子种类、个数不变.1年前查看全部
- 计算电池电势是否要乘系数(化学计量数)?
计算电池电势是否要乘系数(化学计量数)?
比如Cu 2+/Cu 的电极电势为a,Ag+/Ag的电极电势为b,那么组成电池时,电池电势应该是b-a还是2b-a呢? 4214304581年前1
4214304581年前1 -
 步伐243 共回答了18个问题
步伐243 共回答了18个问题 |采纳率100%不用,回去好好看看《无机化学》.1年前查看全部
- 假如一个反应中 反应物和生成物都是气体,反应物的化学计量数的和大于生成物,且在一个容积不变的体积中,正反应放热,那么随着
假如一个反应中 反应物和生成物都是气体,反应物的化学计量数的和大于生成物,且在一个容积不变的体积中,正反应放热,那么随着反应的进行就相当于减小压强吗?为什么?还有就是在反应物和生成物都是气体的反应中,压强 浓度 体积 这三者之间有什么关系、?
 tong57773281年前2
tong57773281年前2 -
 frgthy11 共回答了23个问题
frgthy11 共回答了23个问题 |采纳率78.3%化学计量数减小,相当于反应后气体总摩尔数减少,所以压强减小.
容积不变,所以体积不变;PV=nRT,所以压强和摩尔数成正比,总压强与总摩尔数成正比;单物质之间,因为压强、体积一样,所以单物质之间浓度与摩尔数成正比.1年前查看全部
- 在化学方程式:aC2H5OH+bO2点燃..mCO2+nH2O各化学计量数间的关系正确的是( )
在化学方程式:aC2H5OH+bO2
mCO2+nH2O各化学计量数间的关系正确的是( )点燃 ..
A.a+b=m+n
B.a=2m
C.a+2b=2m+n
D.n=2b joey1234561年前1
joey1234561年前1 -
 joshua721 共回答了16个问题
joshua721 共回答了16个问题 |采纳率100%解题思路:根据反应前后各原子的种类和数目不变,列等式进行分析判断.反应物中含有2a个C原子、6a个氢原子、(a+2b)个氧原子,生成物中含有m个C原子、2n个氢原子、(2m+n)个氧原子.
A、根据反应前后氧原子个数不变,可得a+2b=2m+n,故选项关系式错误.
B、根据反应前后碳原子个数不变,可得2a=m,故选项关系式错误.
C、根据反应前后氧原子个数不变,可得a+2b=2m+n,故选项关系式正确.
D、根据反应前后氢原子个数不变:6a=2n,则3a=n,故选项关系式错误.
故选C.点评:
本题考点: 化学方程式的配平.
考点点评: 本题难度不大,抓住质量守恒定律中的原子守恒来确定物质化学计量数的关系是正确解答本题的关键.1年前查看全部
- 为什么化学反应中的气体体积之比等于化学计量数之比?
为什么化学反应中的气体体积之比等于化学计量数之比?
如CH4+2O2=2H2O+CO2.
其中气体甲烷、氧气、二氧化碳的体积之比就等于1:2:1.
为什么? echozh1年前3
echozh1年前3 -
 bardenbarden 共回答了20个问题
bardenbarden 共回答了20个问题 |采纳率95%因为化学反应在同一条件下反应,根据PV=nRT 同TP下,n之比等于V之比,n之比等于化学计量数之比,所以气体甲烷、氧气、二氧化碳的体积之比就等于1:2:1.1年前查看全部
- 为什么温度一定时 一个化学反应的平衡常数是一个定值?不是说平衡常数与化学计量数有关吗?
为什么温度一定时 一个化学反应的平衡常数是一个定值?不是说平衡常数与化学计量数有关吗?
那计量数变了化学平衡常数也就变了啊! kk狮子1年前4
kk狮子1年前4 -
 我不是美少女 共回答了13个问题
我不是美少女 共回答了13个问题 |采纳率84.6%温度一定时 一个化学反应的平衡常数是一个定值
前提是,“一个化学反应”始终不变.
2 SO2 + O2 = 2 SO3
你把它写成 SO2 + 1/2 O2 = SO3,这就不是同一个反应了.
计量数变了化学平衡常数也就变了.1年前查看全部
- 配平化学方程式时,判断所配化学计量数是否正确的依据是( ) A.反应前后所配化学计量数之和是否相等 B.反应前后元素种
配平化学方程式时,判断所配化学计量数是否正确的依据是( ) A.反应前后所配化学计量数之和是否相等 B.反应前后元素种类是否相等 C.反应前后各元素的原子总数是否相等 D.反应前后各物质质量是否相等  leejh88481年前1
leejh88481年前1 -
 zhubin1777 共回答了21个问题
zhubin1777 共回答了21个问题 |采纳率95.2%因化学反应的实质是原子重新结合生成新的分子,由质量守恒定律可知在化学反应的前后各元素的原子个数是相等的,则化学反应前后各元素的原子总数相等,即已配平,反之,若化学反应前后各元素的原子总数不相等,则未配平,化学方程式配平与化学计量数之和、物质的状态、元素种类无关.
故选C.1年前查看全部
- 配平化学方程式时,所配化学计量数是否正确的依据是反应前后( ) A.各化学式前化学计量数之和是否相等 B.各种元素的种
配平化学方程式时,所配化学计量数是否正确的依据是反应前后( ) A.各化学式前化学计量数之和是否相等 B.各种元素的种类是否相同 C.各种物质的状态是否相同 D.各种元素的原子总数是否相同  lwy10111年前1
lwy10111年前1 -
 q211aazzzz 共回答了19个问题
q211aazzzz 共回答了19个问题 |采纳率89.5%由质量守恒定律,反应前后,原子种类、数目均不变,配平的实质是化学方程式两边的化学式前配上适当的化学计量数,使化学方程式两边各元素的原子总数相等.
故选D.1年前查看全部
- 急 (30 19:31:23)当可逆反应某时,各物质的分子数之比等于化学计量数之比,则反应达到平衡了吗?为什么?
 以面包的名义1年前8
以面包的名义1年前8 -
 俩hh 共回答了13个问题
俩hh 共回答了13个问题 |采纳率92.3%不一定
达到化学平衡的标志是
各种物质浓度不再改变
各物质的分子数之比等于化学计量数之比的时候,
不能说明各种物质浓度不再改变1年前查看全部
- 在反应:□C2H6+□O2=□CO2+□H2O中,方框中各物质的化学计量数应该对应的是( )
在反应:□C2H6+□O2=□CO2+□H2O中,方框中各物质的化学计量数应该对应的是( )
A.2.7.4.6
B.1.5.1.4
C.1.7.2.5
D.2.5.4.5 cmml1年前1
cmml1年前1 -
 kekeqing 共回答了19个问题
kekeqing 共回答了19个问题 |采纳率94.7%解题思路:根据质量守恒定律:反应前后各原子的数目不变,选择相应的配平方法(最小公倍数法、定一法等)进行配平即可.本题可利用“定一法”进行配平,把C2H6的化学计量数定为1,则O2、CO2、H2O前面的化学计量数分别为:[7/2]、2、3,同时扩大2倍,则C2H6、O2、CO2、H2O前面的化学计量数分别为2、7、4、6.
故选:A.点评:
本题考点: 化学方程式的配平.
考点点评: 本题难度不大,配平时化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数,配平过程中若出现分数,必须把分数去分母转化为整数.1年前查看全部
- 难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各种离子的浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各种离子的浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。例如:Cu(OH) 2 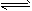 Cu 2+ +2OH - ,Ksp=c(Cu 2+ )·[c(OH - )] 2 =
Cu 2+ +2OH - ,Ksp=c(Cu 2+ )·[c(OH - )] 2 =
2×10 -20 。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO 4 溶液里c(Cu 2+ )=0.02 mol/L,如要生成Cu(OH) 2 沉淀,应调整溶液的pH,使之大于__________________。(请列出必要的计算过程)
(2)要使0.2 mol·L -1 CuSO 4 溶液中Cu 2+ 沉淀较为完全(使Cu 2+ 浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,溶液的pH为__________________。(请列出必要的计算过程) twinkle_z1年前1
twinkle_z1年前1 -
 打火机没气了 共回答了14个问题
打火机没气了 共回答了14个问题 |采纳率85.7%(1)5
(2)61年前查看全部
- 在化学方程式aC 2 H 6 +bO 2 点燃 . mCO 2 +nH 2 O,各化学计量数之间的关系,正确的是( )
在化学方程式aC 2 H 6 +bO 2
mCO 2 +nH 2 O,各化学计量数之间的关系,正确的是( )点燃 . A.2m=n B.n=3a C.b=m+n D.a=n-m  0tjk4bar1年前1
0tjk4bar1年前1 -
 沙发不好坐 共回答了23个问题
沙发不好坐 共回答了23个问题 |采纳率87%反应物中含有2a个C原子、6a个氢原子、2b个氧原子,生成物中含有m个C原子、2n个H原子、(2m+n)个氧原子.
A、根据反应前后碳原子个数不变,可得2a=m,故选项错误.
B、根据反应前后氢原子个数不变:6a=2n,则3a=n,故选项正确.
C、根据反应前后氧原子个数不变,可得2b=2m+n,故选项错误.
D、根据反应前后氧原子个数不变,可得2b=2m+n,故选项错误.
故选:B.1年前查看全部
- 难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(K
难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(K sp ).例如:Cu(OH) 2 
Cu 2+ +2OH - ,K sp =c(Cu 2+ )•[c(OH - )] 2 =2×10 -20 .当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO 4 溶液里c(Cu 2+ )=0.02mol/L,如果生成Cu(OH) 2 沉淀,应调整溶液pH,使之大于______.
(2)要使0.2mol•L -1 CuSO 4 溶液中Cu 2+ 沉淀较为完全(使Cu 2+ 浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为______. 黑寂!1年前1
黑寂!1年前1 -
 qius 共回答了21个问题
qius 共回答了21个问题 |采纳率100%(1)某CuSO 4 溶液里c(Cu 2+ )=0.02mol/L,如果生成Cu(OH) 2 沉淀,则应有c(OH - )≥
2× 10 -20
0.02 mol/L=10 -9 mol/L,则c(H + )≤
1× 10 -14
10 -9 mol/L=10 -5 mol/L,
所以pH≥-lg(10 -5 )=5,故答案为:5;
(2)Cu 2+ 沉淀较为完全是的浓度为
0.2mol/L
1000 =2×10 -4 mol/L,
则c(OH - )=
2× 10 -20
2× 10 -4 mol/L═10 8 mol/L,
则c(H + )=
1× 10 -14
10 -8 mol/L=10 -6 mol/L,
所以pH=-lg(10 -6 )=6,
故答案为:6.1年前查看全部
- 如果几种气体在体积可变的容器中反应,那气体总体积与化学计量数有关么
 fany20011年前3
fany20011年前3 -
 kkmars 共回答了15个问题
kkmars 共回答了15个问题 |采纳率100%关系不大,如果反应容器体积不可变,气体体积就与计量数成正比1年前查看全部
- 1.使用干粉灭火器灭火时发生的反应(配平 要填化学计量数)
1.使用干粉灭火器灭火时发生的反应(配平 要填化学计量数)
2.用活性碳除去对自来水进行消毒处理后残留的少量氯气.
3.硝酸应放在棕色试剂瓶中,原因是______________________
x的化学式是___________ lmj_05071年前3
lmj_05071年前3 -
 JUSTIN2005 共回答了12个问题
JUSTIN2005 共回答了12个问题 |采纳率91.7%1.2NaHCO3=Na2CO3+H2O+CO2
2.利用活性碳的吸附作用把残留的少量氯气除去
3.硝酸应放在棕色试剂瓶中,原因是HNO3见光易分解
4HNO3=H2O+4NO2+O2 见光
x的化学式是?1年前查看全部
- "比较化学反应速率与化学计量数的比值,即对于一般反应aA+bB===cC+dD,比较v(A)/a与v
"比较化学反应速率与化学计量数的比值,即对于一般反应aA+bB===cC+dD,比较v(A)/a与v(B)/b,若v(A)/a>v(B)/b,则A表示的反应速率比B大"对吗,求解释
而且化学反应速率之比不是等于化学计量数之比吗?化学反应速率与反应速率不一样吗 marswang20071年前1
marswang20071年前1 -
 benyatou2007 共回答了14个问题
benyatou2007 共回答了14个问题 |采纳率78.6%是一样的.对于同一个化学方程式来说,我们可以用其中任何一个来表示该反应的反应速率,只是数值不同而已,所以我们要比较那个的反应速率大时,必须化成相同的物质才能比较,比如这个题,
我们以A的速率为准,由化学反应速率之比等于化学计量数之比,可得B的速率等于b/a V(A),那么就有bV(A)=aV(B),所以,不对,那个条件都不可能成立啊.1年前查看全部
- 化学计量数之比等于什么 百度百科
化学计量数之比等于什么 百度百科
要回答全面点啊 vijf1231年前3
vijf1231年前3 -
 玩玩娃娃 共回答了24个问题
玩玩娃娃 共回答了24个问题 |采纳率95.8%化学方程式中的化学计量数之比
等于参加反映各物质的物质的量之比
如果体积相同的溶液还等于物质的量浓度之比
有气体参加的反应等于气体体积之比
等于气体分子数之比
等于各物质反应速率之比
等于可逆反应中各物质的转化量之比
等于离子反应中离子碰撞概率之比
够全面了吧1年前查看全部
- 高一化学第一章"化学计量数的应用"这里的所用公式 及拓展公式
高一化学第一章"化学计量数的应用"这里的所用公式 及拓展公式
万能公式
人教版的 guangwei00711年前2
guangwei00711年前2 -
 hbszlmz 共回答了16个问题
hbszlmz 共回答了16个问题 |采纳率100%……请 仔细阅读教科书
这里很简单1年前查看全部
- 化学计量数之比等于什么 摩尔还是什么
 wumanman1年前4
wumanman1年前4 -
 要爆就爆绝唱吧 共回答了16个问题
要爆就爆绝唱吧 共回答了16个问题 |采纳率100%等於物质的量之比1年前查看全部
- 什么是化学计量数?化学计量数之比等于什么?
什么是化学计量数?化学计量数之比等于什么?
谢谢~ 伽葉1年前4
伽葉1年前4 -
 younglei 共回答了18个问题
younglei 共回答了18个问题 |采纳率88.9%化学计量数 是化学方程式中每个化学式前面的那数字1年前查看全部
- 为什么化学计量数之比即为物质的量之比谢谢了,大神帮忙啊
 houjx9121年前1
houjx9121年前1 -
 意见投诉yy 共回答了7个问题
意见投诉yy 共回答了7个问题 |采纳率100%从微观的角度来说,化学反应是按照一定的粒子数进行的,化学计量数就计量了这一关系. 如果,粒子数除以每一摩尔的标准微粒数也就是阿佛加德罗常数,就是相应的物质的量了,这一比值化简后还是等于化学计量数的比.1年前查看全部
- 摩尔质量与化学计量数有关吗例如Baco3+2HCI=Bacl2+H2O+CO2,此时HCI的摩尔质量是73还是36.
 pengzhiyi1年前4
pengzhiyi1年前4 -
 德令哈游丝 共回答了26个问题
德令哈游丝 共回答了26个问题 |采纳率88.5%36.5g/mol 摩尔质量在数值上等于相对分子质量 是定值1年前查看全部
- 为什么分子数的比等于化学计量数的比时不一定平衡
 远日1年前1
远日1年前1 -
 Me莎拉 共回答了20个问题
Me莎拉 共回答了20个问题 |采纳率90%化学平衡是指正逆反应速率相等
应该是分子数变化(反应物减少生成物增多)的比等于化学计量数之比
至于它们的分子数多少与速率无关是无所谓的,只是可逆反应不能进行到底分子数不为0
不知讲清楚没1年前查看全部
- 化学反应的瞬时反应速率之比等于化学计量数之比等于平均反应速率之比?对否,自己推的...
 好想继续81年前5
好想继续81年前5 -
 语尽词穷 共回答了24个问题
语尽词穷 共回答了24个问题 |采纳率91.7%对的.因为化学反应是按固定比例参与的.1年前查看全部
- 当一个可逆反应达到化学平衡时,可以建立的等量关系?化学计量数之比=?
当一个可逆反应达到化学平衡时,可以建立的等量关系?化学计量数之比=?
就是那个化学计量数之比等于反应速率之比还等于……我忘了,请指教 追婕族1年前1
追婕族1年前1 -
 Finiter 共回答了15个问题
Finiter 共回答了15个问题 |采纳率86.7%mA+nB↔xC+yD 这是个最常见的可逆反应方程式
当化学平衡时:化学计量数之比=反应速率之比 例如:vB/vA=n/m
各物质的浓度不随时间变化而变化
各物质的体积百分比不随时间变化而变化
上面这个是不论什么情况的下面的要分情况:
m+n≠x+y时:当这个反应在压强不变的情况时(就是在瓶口处是个活塞的时候,如果不记得再留言给我吧.不过我可能要放学的时候才能回你)容积不变的时候反应达到平衡.
当这个反应在容积不变的情况时(就是一个密闭的瓶子.)压强不变的时候反应达到平衡.
m+n=x+y时:只有 化学计量数之比=反应速率之比 例如:vB/vA=n/m
各物质的浓度不随时间变化而变化
各物质的体积百分比不随时间变化而变化
这三个能用,因为容积和压强不论反应不反应都不会随着时间而改变的~
我记得的就这些了,如果还有什么遗漏的希望你也能告诉下我,1年前查看全部
- 化学计量数之比都等于哪些量的比
 binbinyan1年前2
binbinyan1年前2 -
 amoretti 共回答了12个问题
amoretti 共回答了12个问题 |采纳率91.7%等于反应物、生成物的物质的量的比 等于反应物,生成物的体积比1年前查看全部
- 化学计量数之比等于质量比还是体积比
 Qsnet1年前2
Qsnet1年前2 -
 白狼爱豹子 共回答了20个问题
白狼爱豹子 共回答了20个问题 |采纳率100%都不是.如果它们是同一状态下的气体,那就是体积比.1年前查看全部
- 为什么用各个物质表示的反应速率之比等于化学计量数之比不能说明达到化学平衡
 叶恬1年前4
叶恬1年前4 -
 夏落子边荻 共回答了26个问题
夏落子边荻 共回答了26个问题 |采纳率92.3%反应速率之比=化学计量数之比
这个关系在化学反应中是每时每刻都存在的,当化学反应一开始,这个等价关系就建立起来了.所以不能说明化学反应达到了平衡.1年前查看全部
- 相对分子质量和化学计量数之间的关系是什么
 无忧念奴娇1年前4
无忧念奴娇1年前4 -
 天主太一 共回答了19个问题
天主太一 共回答了19个问题 |采纳率89.5%在单个分子中,相对分子质量与化学计量数没有丝毫关系.
在化学反应中,为了方便计算,将反应的分子看作整体计算质量,那么,这时候的质量就是相对分子质量乘以化学计量数了.
多谢!1年前查看全部
- 氧化还原中的反应物质的量之比能等于化学计量数之比吗
氧化还原中的反应物质的量之比能等于化学计量数之比吗
例如MNO2+4HCL=MNCL2+CL2+2H2O的反应中,氯气与盐酸的物质的量,是不是等于化学计量数之比?4:
但为什么,计算时是按反应中几mol的盐酸被氧化成氯气的物质的量来算,用来氧化的盐酸:氯气=2:1 gxhqdym1年前5
gxhqdym1年前5 -
 thomastrain 共回答了14个问题
thomastrain 共回答了14个问题 |采纳率85.7%是的,才开始学吧!
之所以氧化的盐酸:氯气=2:1 ,是因为盐酸不都被氧化.
这么说吧,例如,1mol二氧化锰与4mol盐酸反应,其中有2mol盐酸表现的是还原性(被氧化),另两摩尔是表现的酸性.1年前查看全部
- 化学反应速率和化学计量数的关系该关系可有什么应用?
 akang37111年前4
akang37111年前4 -
 01021034 共回答了22个问题
01021034 共回答了22个问题 |采纳率95.5%化学反应速率和化学计量数的关系 是 成正比的.比如:2H2 + O2 === 2H2O
知道H2的反应速率为 1 那么O2的反应速率就是 0.5 生成水的速率就是11年前查看全部
- 全部气体参加的前后化学计量数改变的可逆反应,平均相对分子质量保持不变
全部气体参加的前后化学计量数改变的可逆反应,平均相对分子质量保持不变
这是为什么 hbycyf1年前2
hbycyf1年前2 -
 sadowsky 共回答了10个问题
sadowsky 共回答了10个问题 |采纳率100%这是不是判断反应达到平衡状态标志的问题
平均相对分子质量=气体总质量/气体总物质的量,只有在平衡时才保持不变1年前查看全部
- 化学平衡的改变量之比,平衡量之比是否等于化学计量数之比
 hjwycy1年前2
hjwycy1年前2 -
 御影清凌 共回答了26个问题
御影清凌 共回答了26个问题 |采纳率96.2%改变量之比等于化学计量数之比,平衡量之比是否等于化学计量数之比与他的初始量有关.1年前查看全部
- 反应进度与化学计量数的区别
 伸懒腰131年前1
伸懒腰131年前1 -
 rival312 共回答了15个问题
rival312 共回答了15个问题 |采纳率80%化学计量数是指反应方程式中各物质的配比数,反应进度是反应的速率的表示.反应物或者生成物的反应速率出一该物质的化学计量数就是反应进度.1年前查看全部
- 下列关于化学反应 x A + y B = m C + n D( x、y、m、n 为化学计量数)的说法中,一定正确的是 [
下列关于化学反应 x A + y B = m C + n D( x、y、m、n 为化学计量数)的说法中,一定正确的是 [ ]A. x + y = m + n
B.若生成物中有水,该反应是中和反应
C.参加反应的A和B的质量比等于生成物C和D的质量比
D.若A和B的质量都为a g,充分反应后生成物的总质量小于或等于2a g ufoaol9111年前1
ufoaol9111年前1 -
 besty00 共回答了18个问题
besty00 共回答了18个问题 |采纳率88.9%D1年前查看全部
- 由于反应方程式两边物质的化学计量数的总和相等,所以改变容器的体积对平衡无影响
 hb38012061年前2
hb38012061年前2 -
 想ii的小人物 共回答了19个问题
想ii的小人物 共回答了19个问题 |采纳率89.5%恩
得反应物和生成物的状态1年前查看全部
- 配平化学方程式时,判断所配化学计量数是否正确的依据是( )
配平化学方程式时,判断所配化学计量数是否正确的依据是( )
A.反应前后所配化学计量数之和是否相等
B.反应前后元素种类是否相等
C.反应前后各元素的原子总数是否相等
D.反应前后各物质质量是否相等 kikidw1年前1
kikidw1年前1 -
 hdsbamboo 共回答了26个问题
hdsbamboo 共回答了26个问题 |采纳率88.5%解题思路:根据质量守恒定律可知,化学方程式中遵循质量守恒、元素守恒、原子守恒,则可利用原子个数前后相等来配平化学反应方程式.因化学反应的实质是原子重新结合生成新的分子,由质量守恒定律可知在化学反应的前后各元素的原子个数是相等的,则化学反应前后各元素的原子总数相等,即已配平,反之,若化学反应前后各元素的原子总数不相等,则未配平,化学方程式配平与化学计量数之和、物质的状态、元素种类无关.
故选C.点评:
本题考点: 化学方程式的配平;质量守恒定律及其应用.
考点点评: 本题考查学生利用质量守恒定律来理解化学反应方程式的配平,原子守恒是配平的依据,也是常有的方法.1年前查看全部
- 增大压强后为什么化学计量数大的一方浓度增加的多?
 热带么1年前1
热带么1年前1 -
 gss825 共回答了14个问题
gss825 共回答了14个问题 |采纳率92.9%这是化学平衡知识,主要考虑到平衡常数的问题,压强增大,化学平衡向计量数小的方向移动.本题状态不明,把状态写详细点,我再分析下,比如等温,等体,或者有没有外加反应气体,或非反应气体等等.1年前查看全部
- 现有化学反应:xC2H6+yO2=zCO2+wH2O其中化学计量数之间关系正确的是 A.2z=x B.3x=w C.x=
现有化学反应:xC2H6+yO2=zCO2+wH2O其中化学计量数之间关系正确的是 A.2z=x B.3x=w C.x=z D.y=2z+w
 chlf1229love1年前1
chlf1229love1年前1 -
 索囡囡 共回答了20个问题
索囡囡 共回答了20个问题 |采纳率90%选择B
原理:反应前后原子个数守恒:
C原子守恒:2x=z
H原子守恒:6x=2w,所以 3x=w
O原子守恒:2y=2z+w1年前查看全部
- 对于恒温恒容的容器,改变起始时加入物质的物质的量,通过可逆反应的化学计量数换算成方程式同一边的物质的物质的量与原平横时相
对于恒温恒容的容器,改变起始时加入物质的物质的量,通过可逆反应的化学计量数换算成方程式同一边的物质的物质的量与原平横时相同,则两平衡等效
请问怎么换算?
比如对于这个反应:2SO2+O2=2SO3,设各物质初始的物质的量为A.B.C
为什么AC,AB满足的关系是a+c=2 2b+c=2?
原题:在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2 2SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a.b.c分别代表初始加入的SO2,O2和SO3的物质的量(mol)。如果a.b.c取不同的数值,他们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,则C=______。
(2)若a=0.5则b=_______,c=_______。
(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c:______ ID间测了么1年前4
ID间测了么1年前4 -
 arimawj 共回答了21个问题
arimawj 共回答了21个问题 |采纳率90.5%1、意思是起始时不管各物质的量怎么变化(可以三个都有,可以只有某两个或者只有其中一个),反应达到平衡的时候各物质的浓度时相同的.就叫等效平衡.就像从不同的地方都可以到北京一样,过程和轨迹不同,但最后结果都是到了北京.
2、做等效平衡的题目的时候,你先将化学变化看做不可逆反应,将题目中的物质都,变成同一物质,看要是不同的反应形式的物质多少是相同的那么他们就是等效平衡.
3、如上面的题,我不知道为什么!是不是你没有把题目说清楚?
(1)若a=0,则C=2----.
(2)若a=0.5则b=------0.25,c=------1.5.
(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c:a+c=2 2b+c=21年前查看全部
- 下列说法中错误的是( )A.在热化学方程式中无论反应物还是生成物必须标明聚集状态B.热化学方程式的化学计量数不能表示分
下列说法中错误的是( )
A.在热化学方程式中无论反应物还是生成物必须标明聚集状态
B.热化学方程式的化学计量数不能表示分子的个数
C.反应热指的是反应过程中放出的热量
D.所有的化学反应都伴随着能量的变化 蚊子飞飞1年前1
蚊子飞飞1年前1 -
 林天雨 共回答了14个问题
林天雨 共回答了14个问题 |采纳率92.9%解题思路:A、物质的聚集状态和反应能量变化有关,需要标注物质聚集状态;
B、热化学方程式中计量数只表示物质的量不能表示微粒数,所以可以用分数表示;
C、反应热是反应过程中吸收或放出的能量;
D、化学反应的实质是断裂旧化学键,形成新的化学键的过程,一定伴随能量变化.A、物质的聚集状态和反应能量变化有关,需要标注物质聚集状态,在热化学方程式中无论反应物还是生成物必须标明聚集状态,故A正确;
B、热化学方程式中计量数只表示物质的量不能表示微粒数,不能表示分子的个数,所以可以用分数表示,故B正确;
C、反应热是反应过程中吸收或放出的热量,故C错误;
D、化学反应的实质是断裂旧化学键,形成新的化学键的过程,一定伴随能量变化,所有的化学反应都伴随着能量的变化,故D正确;
故选C.点评:
本题考点: 热化学方程式;反应热和焓变.
考点点评: 本题考查了化学反应能量变化,反应焓变理解,热化学方程式的书写方法,掌握基础是关键,题目较简单.1年前查看全部
- 化学计量数可以表示什么?可以表示密度吗?然后劳驾回答下面的选择
化学计量数可以表示什么?可以表示密度吗?然后劳驾回答下面的选择
5、在容积不变的密闭容器中,在一定条件下发生反应:2A B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是A.若△H>0,则A为非气态 B.若△H<0,则A为气态C.在平衡体系中加入少量C,该平衡向逆反应方向移动D.改变压强对该平衡的移动无影响 曲终人散99991年前2
曲终人散99991年前2 -
 yhfjx0630 共回答了21个问题
yhfjx0630 共回答了21个问题 |采纳率95.2%化学的计量数,实际上在这里就是方程式的配平,如果把方程式用待定系数法配平以后,得到的数字就是它的系数,也就是计量数
化学计量数的概念应包括其内涵与外延,即化学计量数之比与粒子数之比、物质的量之比、气体体积比、反应速率之比等的关系反应式请补充完整1年前查看全部
大家在问
- 1一根铁丝刚好折成一个正方形,边长是15.7cm.如果把它拉直后围成一个最大的圆,那么
- 2畅想未来我们生活中有哪些新能源.新能源如何为我们的生活提供便捷服务.
- 3已知X等于5分之4Y(X,Y均不为0),那么X比Y等于多少
- 4英语语法:延续性动词是否不能组成不定式?例1:Nice to meet you.例2:Nice knowing you.
- 5光的传播距离与什么因素有光是传播距离跟什么因素有关.不是创波速度.例如就是光可以飞到多远跟什么因素有关.
- 6The day must be breaking,_the birds have begun singing.
- 7某班有46人,其中有40人会骑车,38人会打乒乓球,35人会打羽毛球,27个人会游泳,则这个班至少有多少人以上四项运动都
- 8写出一个{x=0.y=7}为解的二元一次方程组是什么
- 9林先生就是我想采访的人翻译
- 10演讲稿"我为班级争荣誉"
- 11花圃里有红花50行,黄花40行,红花的行数是黄花的《 》%,黄花的行数是红花的《 》%
- 12完成句子:(满分10分)小题1:这是她第一次离开自己的祖国。It was _________________ she _
- 13由1 2 3 4 5 6组成六位数中 有很多是64的倍数 最小的是123456 最大的是
- 141.用惰性电极电解稀硫酸溶液的总反应式方程式
- 15一个自然保护区里,天鹅的只数是丹顶鹤的2.2倍,天鹅比丹顶鹤多360只,天鹅有多少只? (列方程)
