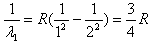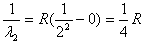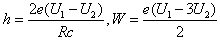巴耳末对当时已知的,在可见光区的氢原子光谱的四条谱线做了分析,发现这些谱线的波长满足公式:[1/λ]=R([122
 ANDY200317282022-10-04 11:39:541条回答
ANDY200317282022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 转身爱已成过去 共回答了18个问题
转身爱已成过去 共回答了18个问题 |采纳率94.4%- 解题思路:在可见光区的氢原子光谱的四条谱线做了分析,发现这些谱线的波长满足公式:1λ=R(122-1n2)(n=3,4,5,…),根据公式表示出最小波长与最大波长进行比较求解.
在可见光区的氢原子光谱的四条谱线做了分析,发现这些谱线的波长满足公式:
1/λ]=R([1
22-
1
n2)(n=3,4,5,…),
当n=∞时,波长最小,
1
λ1=
R
22
当n=3时,波长最大,
1
λ2=R(
1
22-
1
32)
解得:
λ1
λ2=
5/9].
答:氢原子光谱巴耳末系最小波长与最大波长之比是[5/9].点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 氢原子跃迁时.有高能级向低能级跃迁辐射出光子,利用巴尔末公式可以直接计算从各个能级向基态跃迁时释放的光子所对应的波长. - 1年前
相关推荐
- 对于巴耳末公式 的理解,下列说法正确的是( ) A.此公式是巴耳末在研究氢光谱特征时发现的
对于巴耳末公式 的理解,下列说法正确的是( ) A.此公式是巴耳末在研究氢光谱特征时发现的对于巴耳末公式
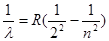 的理解,下列说法正确的是()
的理解,下列说法正确的是()A.此公式是巴耳末在研究氢光谱特征时发现的 B.此公式中n可以取任意值,所以氢原子光谱是连续的 C.此公式中n只能取整数,故氢原子光谱是线状谱 D.此公式不但适用于氢原子光谱,还适用于其他原子光谱
 王春a1年前1
王春a1年前1 -
 杨松天呐 共回答了15个问题
杨松天呐 共回答了15个问题 |采纳率93.3%AC
试题分析:从氢气放电管获得氢原子光谱,对可见光区的谱线进行了分析得到了巴尔末公式,巴尔末公式以简洁的形式反映了氢原子的线状光谱,因为其他原子的谱线相对复杂得多,所以巴尔末公式只适用于氢原子的谱线,且n只能取大于等于3的整数,则λ不能取连续值,故氢原子光谱是线状谱. AC正确,BC错误。
故选AC
点评:根据公式的发现过程,其他原子的谱线相对复杂得多,所以巴尔末公式只适用于氢原子的谱线1年前查看全部
- 关于原子中的电子的物理问题,求巴耳末光谱的最大和最小波长可不可以用 巴耳末公式1/人=R(1/m^2-1/n^2)或者
关于原子中的电子的物理问题,
求巴耳末光谱的最大和最小波长可不可以用 巴耳末公式1/人=R(1/m^2-1/n^2)或者 波尔频率条件hv=Eh-E1求出,结果一样吗?这两个公式有关系吗? 艳子来了1年前1
艳子来了1年前1 -
 阳阳03 共回答了24个问题
阳阳03 共回答了24个问题 |采纳率87.5%结果是一样的,我算过1年前查看全部
- 计算氢原子在光谱的巴耳末系谱线的波长范围
 jojozhang3151年前1
jojozhang3151年前1 -
 讨厌多 共回答了19个问题
讨厌多 共回答了19个问题 |采纳率84.2%巴尔末线系的波长可以用巴尔末公式表示:1/λ=R(1/2^2-1/n^2)
(n取3、4、5、、、、、、)
其中R=1.10*10^7m^-1.叫做里德伯常量.
氢的原子光谱是不连续的谱线.波长最长的为656.47nm
其它波长你自己可以练习代入上面的公式计算一下.注意单位的换算.
请你及时采纳.有问题再另行及时提问.我会随时给你解困释疑.1年前查看全部
- 处在激发态的氢原子向能量较低的状态跃迁时会发出一系列不同频率的光,称为氢光谱。氢光谱线的波长λ可以用下面的巴耳末一里德伯
处在激发态的氢原子向能量较低的状态跃迁时会发出一系列不同频率的光,称为氢光谱。氢光谱线的波长λ可以用下面的巴耳末一里德伯公式表示: 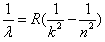 ,n、k分别表示氢原子跃迁后所处状态的量子数,k=1,2,3…对每一个k,有n=k+l,k+2,k+3,…R称为里德伯常量,是一个已知量。对于k=1的一系列谱线其波长处在紫外光区,称为莱曼系;k=2的一系列谱线其波长处在可见光区,称为巴耳末系。用氢原子发出的光照射某种金属进行光电效应实验,当用莱曼系波长最长的光照射时,遏止电压的大小为U 1 ,当用巴耳末系波长最短的光照射时,遏止电压的大小为U 2 ,已知电子电荷量的大小为e,真空中的光速为c,试求:普朗克常量和该种金属的逸出功。
,n、k分别表示氢原子跃迁后所处状态的量子数,k=1,2,3…对每一个k,有n=k+l,k+2,k+3,…R称为里德伯常量,是一个已知量。对于k=1的一系列谱线其波长处在紫外光区,称为莱曼系;k=2的一系列谱线其波长处在可见光区,称为巴耳末系。用氢原子发出的光照射某种金属进行光电效应实验,当用莱曼系波长最长的光照射时,遏止电压的大小为U 1 ,当用巴耳末系波长最短的光照射时,遏止电压的大小为U 2 ,已知电子电荷量的大小为e,真空中的光速为c,试求:普朗克常量和该种金属的逸出功。 wquanrui1年前1
wquanrui1年前1 -
 麒麟崔 共回答了15个问题
麒麟崔 共回答了15个问题 |采纳率100%1年前查看全部
- 关于巴耳末公式巴耳末系是指氢原子从n=3、4、5、6……能级跃迁到m=2能级时发出的光子光谱线系,因瑞士数学教师巴耳末(
关于巴耳末公式
巴耳末系是指氢原子从n=3、4、5、6……能级跃迁到m=2能级时发出的光子光谱线系,因瑞士数学教师巴耳末(J.J.Balmer) 于1885年总结出其波长通项公式(巴耳末公式)而得名.
巴耳末公式为
1/λ=R*[1/(2^2)-1/(n^2)].
R为里德伯常量,R=1.097*10^7m^-1.
其中最早发现的在可见光区的四条谱线波长如下:
Hα=656.3nm(红光),Hβ=486.1nm(绿光),Hγ=434.1nm(蓝光),Hδ=410.2nm(紫光).
当N>7时,发出的是紫外线.
当分子底数(加粗)的2改成其他正整数m时,该公式称为广义巴耳末公式(里德伯公式).
m=1时是莱曼系(n=2、3、4、5……)(在紫外区)
我的问题是:紫外区内的氢原子光谱是不是全部符合公式1/λ=R*[1/(1^2)-1/(n^2)],如果是,那么为什么在公式1/λ=R*[1/(2^2)-1/(n^2)]中N>7时的发出的紫外线波长与1/λ=R*[1/(1^2)-1/(n^2)]计算的结果不同?
如果不是,那么这么多的巴耳末公式的适用范围各是什么?它们有什么区别和联系? best221年前1
best221年前1 -
 yuyuboss 共回答了19个问题
yuyuboss 共回答了19个问题 |采纳率94.7%紫外区内的氢原子光谱不是全部符合公式1/λ=R*[1/(1^2)-1/(n^2)]的.考察所谓广义的巴耳末公式:
1/λ=R*[1/(m^2)-1/(n^2)] (n>m)
m=1时是莱曼系
m=2时是巴耳末系
m=3时是帕邢系……
m的物理意义是表示电子跃迁的下能级的量子数.就是说,根据m的不同把光谱分成不同的线系,方便研究.各谱线系的根本区别不在于它们的波长范围,而在于量子数m.莱曼系和巴耳末系系中都存在紫外区的光谱.各线系光谱符合各线系自己的规律,巴耳末公式只对巴耳末线系的各条谱线适用.1年前查看全部
- 巴耳末系都是可见光吗巴耳末于可见光的关系是什么,或者与无线电波波谱中与哪些有交集
 牛蛙哥哥爱吃shi1年前1
牛蛙哥哥爱吃shi1年前1 -
 就不一样_kk 共回答了20个问题
就不一样_kk 共回答了20个问题 |采纳率80%巴耳末其中最早发现的在可见光区的四条谱线波长如下:Hα=656.3nm(红光),Hβ=486.1nm(绿光),Hγ=434.1nm(蓝光),Hδ=410.2nm(紫光).当N>7时,发出的是紫外线.
有四条属于巴耳末系的光为可见光,其他的都是紫外线,1年前查看全部
- (2014•西城区一模)1885年瑞士的中学教师巴耳末发现,氢原子光谱中可见光部分的四条谱线的波长可归纳成一个简单的经验
(2014•西城区一模)1885年瑞士的中学教师巴耳末发现,氢原子光谱中可见光部分的四条谱线的波长可归纳成一个简单的经验公式:[1/λ=R(
−1 22
)1 n2  朵朵果果朵朵1年前0
朵朵果果朵朵1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1某化学兴趣小组回收利用废旧干电池.
- 2下列画线的才“之”字意义和用法相同的是()
- 3填一个表格 ,要求是 横着 竖着 ×斜着 都得等于65,数只有1-25.着急 请立即回
- 4为什么观察线粒体不是选择植物叶肉细胞
- 5书面表达 写一篇短文,介
- 6英文中二百以上的数字怎么写?急~~
- 7小明坐在行驶的小船中,看到河岸的青山往后运动,他是以下列哪个物体为参照物( )
- 8检验是否有硫酸根离子、碳酸根离子、氯离子,必须先除去碳酸根离子的干扰?
- 9英语翻译我对这次的分数很不满意,其实我有能力做好,但是因为太粗心导致成绩不好,我能考满分的,真的
- 10初中生圣诞节作文:圣诞节
- 11污水好氧生物处理系统中的微生物有哪些基本特点?
- 12同义句转换 1.Why not go on vacation?why___ ___go on vacation?2.wh
- 13有两根绳子,长短相同但粗细不同.从两根绳子的一段烧起,粗绳子可以烧160分钟,细绳子可以烧40分钟.现在从两根绳子的一段
- 14英语翻译1.bank guarantee form for advance payment2.bank guarante
- 15由数字1234567组成无重复数字的七位数,求三个偶数互不相邻的七位数的个数