早在1673年,英国化学家波义耳在一个敞口容器中加热一种金属,结果发现反应后的质量增加了.
 mlwsl2022-10-04 11:39:544条回答
mlwsl2022-10-04 11:39:544条回答(1)波义耳的实验结果是否违反质量守恒定律?简析原因.
(2)试从原子的角度解释质量守恒定律.
(3)碘的某种氧化物可以用来测定空气中CO的污染程度.已知1分子的该氧化物可将5分子的CO氧化为CO2,同时生成1分子的I2,则该碘的氧化物的化学式为______.

已提交,审核后显示!提交回复
共4条回复
 kysfnkd 共回答了19个问题
kysfnkd 共回答了19个问题 |采纳率89.5%- 解题思路:根据质量守恒定律:本题中反应后的容器中物质的质量增加的原因是:金属与氧气结合,所以后来质量会增加,这正是对质量守恒定律的应用.根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.根据在化学反应中,反应前后原子的种类没有改变,数目没有增减.
(1)因为参加反应的金属和参加反应的氧气的质量之和等于反应后生成物的质量,因此反应后生成的生成物的质量比反应前的质量大了.这个实验仍然符合质量守恒定律.
(2)化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质的过程.在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.
(3)根据反应物中元素种类及原子个数分别为C,5;O,10;已知生成物中元素种类及原子个数为I,2;比较分析知道X中含有I,2;O,5;从而知道X的化学式为I2O5
故答案为:
(1)不违反.金属与空气中的氧气反应,生成物的质量应该等于金属质量与氧气质量之和.
(2)在一切化学反应中,反应前后原子的种类、数目均没有改变,原子的质量也不改变.
(3)I2O5点评:
本题考点: 质量守恒定律及其应用;有关化学式的计算和推断.
考点点评: 该题要求学生利用化学知识解决实际问题,既考查了学生学以致用的能力,又能让学生感觉到生活中化学的存在,认识到化学的重要性,产生对化学的学习兴趣. - 1年前
 alw2001 共回答了2个问题
alw2001 共回答了2个问题 |采纳率- 金属和氧气反正生成固体类的氧化物质量当然增加啊 质量守恒指 发生反应的金属单质和消耗的氧气的质量和后来生成的氧化物的质量相等 I2O5
- 1年前
 琼海云羽 共回答了64个问题
琼海云羽 共回答了64个问题 |采纳率- (1)没有违反质量守恒定律
原因:是容器敞口放置,空气中的氧气参加了反应,所以质量增加。
(2)化学反应前后原子的种类没有改变,原子的数目没有增减,原子的质量几乎没有变化 。所以质量守恒。
化学式为I2O5 - 1年前
 冰点凤凰 共回答了1个问题
冰点凤凰 共回答了1个问题 |采纳率- 玻意耳朵 楼主强的
增加的质量是空气的 - 1年前
相关推荐
- 为探索物质在化学变化前后的质量关系,科学家们做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验,他将金属放在
为探索物质在化学变化前后的质量关系,科学家们做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验,他将金属放在密闭容器里煅烧,煅烧后他立即打开容器盖进行称量,结果发现反应后的固体质量增加了,该实验导致波义耳未能发现质量守恒定律,请你简要分析一下原因是什么?
 俺镇俺最衰1年前4
俺镇俺最衰1年前4 -
 bh1206 共回答了23个问题
bh1206 共回答了23个问题 |采纳率78.3%解题思路:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.将金属放在密闭容器里煅烧时,金属和氧气反应生成氧化物,煅烧后立即打开容器盖进行称量时,容器外的空气进入,导致发现反应后的固体质量增加.
点评:
本题考点: 质量守恒定律及其应用.
考点点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.1年前查看全部
- 1673年,英国化学家波义耳做了这样一个实验
1673年,英国化学家波义耳做了这样一个实验
他将全金属汞放入一敞口容器里煅烧,冷却后进行称量,得出的结论是固体物质的质量增加了.该实验导致波义尔与质量守恒定律擦肩而过.1.是什么原因导致波义耳未能发现质量守恒定律?2.总结波义耳的失败经历,如果你在实验室要验证质量守恒定量,你该注意什么? nihaowohao9981年前1
nihaowohao9981年前1 -
 夜卿眸 共回答了19个问题
夜卿眸 共回答了19个问题 |采纳率84.2%在18世纪以前,由于人们对化学的认识非常局限,因此化学的发展是非常缓慢的,化学只是经验规律,直到18世纪末拉瓦锡引入定量化学并证明质量守恒定律后化学才得到突飞猛进的发展,因此,拉瓦锡被世界公认为最伟大的化学家,被称为现代化学之父.
由于对化学规律缺乏认识、实验条件的限制和经验的局限性,导致波义尔在做这个实验时得出了错误的结论,他几次做类似的实验都得到相同的结果,于是他下结论:在加热过程中有一种人看不见的火素(他自己定义的,当然实际上是不存在的)穿过容器壁进入加热物中,火素是有质量的,这样就使得物质的质量增加.这就是火素论,它在定量化学引入以前的一百多年里,一直被奉为经典,统治着化学界.后来被拉瓦锡彻底推翻.
在实验室做验证质量守恒定律时,如果实验条件不是很好,实验仪器不够精密,我觉得比较好的方法是尽量不要做产生气体的实验,如果产生的都是固体,没有气体逸出,那操作会更简单一些,结果也会精确一些.如果试验中有气体产生,就一定要求实验仪器气密性足够好,这样产生的误差就会小一些.1年前查看全部
- (2000•青岛)为探索物质在化学变化前后的质量关系,科学家做了大量实验.1673年,英国物理学家波义耳做了一个有名的实
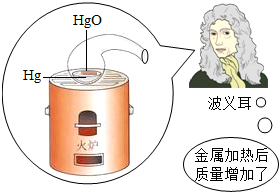 (2000•青岛)为探索物质在化学变化前后的质量关系,科学家做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验,他将金属放在密闭容器里煅烧,煅烧后他立即打开容器进行称量,结果发现反应的固体质量增加了.该实验导致波义耳未能发现质量守恒定律,请你简要分析一下其中的原因是什么?
(2000•青岛)为探索物质在化学变化前后的质量关系,科学家做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验,他将金属放在密闭容器里煅烧,煅烧后他立即打开容器进行称量,结果发现反应的固体质量增加了.该实验导致波义耳未能发现质量守恒定律,请你简要分析一下其中的原因是什么?  yanyanjiaxin1年前1
yanyanjiaxin1年前1 -
 2008mimi2008 共回答了17个问题
2008mimi2008 共回答了17个问题 |采纳率94.1%解题思路:空气中的氧气可以和金属反应生成氧化物使固体质量增加,根据质量守恒定律分析解答即可.密闭容器中有氧气,在加热后会使固体质量增加,由于称量的是反应前后的固体质量而没有考虑气体的质量变化.故答案为:
波义耳没有考虑参加反应的空气中的氧气质量点评:
本题考点: 质量守恒定律的实验探究;空气的成分及各成分的体积分数.
考点点评: 在验证质量守恒定律时,需要考虑反应物质量和生成物质量之间的关系,本题较灵活,难度不大.1年前查看全部
- 为探索物质在化学变化前后的质量关系,科学家做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验.他将金属放在密
为探索物质在化学变化前后的质量关系,科学家做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验.他将金属放在密闭容器中煅烧,煅烧后他立即打开容器盖进行称量,结果发现反应后的固体质量增加了.该实验导致波义耳未能发现质量守恒定律.之后俄国化学家罗蒙诺索夫在密闭玻璃瓶内燃烧金属,发现反应后质量不变,由此得出反应前后的质量守恒.
这两位科学家的实验相似,为何结论不同?某研究小组沿着科学家的足迹进行探究,请你完成以下相关内容:
(1)【交流讨论】两位科学家得出不同的结论究竟与哪些实验因素有关呢?
(2)【提出假设】若用同种金属,同一容器进行实验,两位科学家得出不同的结论主要是由于______的缘故.
(3)【实验验证】已知:钠在空气中受热燃烧生成过氧化钠固体.
(4)【得出结论】假设成立.操作步骤及实验现象 简答 (1)在底部铺有细沙的锥形瓶中,放入一小块金属钠,塞紧橡皮塞,称量,用砝码使天平平衡. 称量前需______. (2)取下锥形瓶,放在垫有石棉网的三角架上微热,观察到金属钠着火燃烧,冷却后,再称量. 称量时观察到______. (3)将锥形瓶瓶塞取出一会儿后,盖上瓶塞,再称量. 称量时观察到______.
(5)依据以上实验事实,解释两位科学家的实验结论:______. sunskyjn1年前1
sunskyjn1年前1 -
 爪子印 共回答了19个问题
爪子印 共回答了19个问题 |采纳率94.7%解题思路:(1)根据可能与反应容器是否密闭有关以及可能与反应物有关进行解答
(2)根据用同种金属,同一容器进行实验,两位科学家得出不同的结论主要是由于反应容器敞开与密闭的差异进行解答;
(3)根据称量物质质量的注意事项以及钠燃烧消耗氧气进行解答;
(5)根据实验是否在密闭容器内进行解答.(1)将金属放在密闭容器里煅烧,煅烧后他立即打开容器盖进行称量,发现反应后的固体质量增加了,是因为金属在煅烧时会与空气中的氧气反应产生固体氧化物,增加了氧气的质量,所以两位科学家得出不同的结论究竟可能与反应容器是否密闭有关或可能与反应物有关;
(2)用同种金属,同一容器进行实验,两位科学家得出不同的结论主要是由于反应容器敞开与密闭的差异;
(3)由称量物质质量的注意事项可知,称量前需检查天平是否平衡;由质量守恒定律可知,反应前后物质的质量相等,所以取下锥形瓶,放在垫有石棉网的三角架上微热,观察到金属钠着火燃烧,冷却后,再称量.观察到天平保持平衡;将锥形瓶瓶塞取出一会儿后,空气会进入,所以盖上瓶塞,再称量,称量时观察到天平指针向左偏移;
(5)依据以上实验事实可知,波义尔在敞口容器中实验,消耗氧气后,又不断补充空气,因此质量增加;而罗蒙诺索夫是在密闭容器中进行,质量不变.
故答案为:(1)可能与反应容器是否密闭有关或可能与反应物有关;
(2)反应容器敞开与密闭的差异;
(3)检查天平是否平衡;天平保持平衡;天平指针向左偏移;
(5)波义尔在敞口容器中实验,消耗氧气后,又不断补充空气,因此质量增加;而罗蒙诺索夫是在密闭容器中进行,质量不变.点评:
本题考点: 质量守恒定律的实验探究.
考点点评: 本题考查质量守恒定律的内容以及应用,具有新颖性,同时也考查了学生的分析和应变能力.1年前查看全部
- 为探索物质在化学变化前后的质量关系,科学家们做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验,他将金属放在
为探索物质在化学变化前后的质量关系,科学家们做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验,他将金属放在密闭容器里煅烧,煅烧后他立即打开容器盖进行称量,结果发现反应后的固体质量增加了,该实验导致波义耳未能发现质量守恒定律,请你简要分析一下原因是什么?
 lansono1年前3
lansono1年前3 -
 lona007 共回答了18个问题
lona007 共回答了18个问题 |采纳率100%解题思路:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.将金属放在密闭容器里煅烧时,金属和氧气反应生成氧化物,煅烧后立即打开容器盖进行称量时,容器外的空气进入,导致发现反应后的固体质量增加.
点评:
本题考点: 质量守恒定律及其应用.
考点点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.1年前查看全部
- 1673年,英国物理学家和化学家玻意耳(R.Boyle)做了一个著名的实验,他将金属放在密闭容器里
 草原小鸟1年前1
草原小鸟1年前1 -
 sen_ii 共回答了26个问题
sen_ii 共回答了26个问题 |采纳率96.2%1673年,英国物理学家和化学家玻意耳(R.Boyle)做了一个著名的实验,他将金属放在密闭容器里煅烧,煅烧后立即打开容器进行称量,结果发现反应的固体质量增加了.该实验导致玻意耳未能发现质量守恒定律.
原因:因为他未考虑到:煅烧金属时,是金属与空气中的氧气反应.生成的氧化物的质量等于参加反应的金属的质量加上消耗的氧气的质量,结果固体质量增加了.这导致他未能发现质量守恒定律.1年前查看全部
大家在问
- 1急,有一个四位数,在它的某位数前点上一个小数点,在与这个四位数相加,得数是2021.01,
- 2怎样理解happiness is U-shaped
- 3若x1,x2是方程 2^x=(1/2)^(-1/x +1)的2个实数解,则x1+x2= 麻烦写下过程
- 4五年级(2)班有学生48人,每人至少参加一项假日活动.其中参加写作的有35人,参加音乐的有16人,参加奥
- 5100毫升化成多少立方厘米是多少
- 6请分别用一个成语来概括《蚊子和狮子》……
- 7划分句子成分“Everything in the world is outside you but health bel
- 8空间直线与平面关系x+3/(-2) = y+4/(-7) = Z/3 与 4x-2y-2z=3 x=z/3+3/2,y=
- 9如图,de分别是△abc的边bc,ac上的点.且ab=ac,ad=ae
- 100可以作为被开方数吗
- 11行为放纵,言语荒唐,不守礼节.是什么词语
- 12知识就是力量 是17世纪英国哲学家( )的名言.
- 13you look a bit p— are you all right?首字母填空
- 14含有参数的不等式f(x)≤g(x)对任意x∈[p,q]恒成立的问题,是否等价于对任意x∈[p,q],[f(x)max]≤
- 15(2012•葫芦岛二模)为吸引顾客,石景山万达广场某餐饮店推出转盘抽奖打折活动,如图是可以自由转动的转盘,转盘被分成若干
