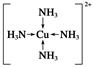
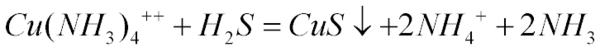从 硫酸四氨合铜 溶液中析出 水合硫酸四氨合铜铜晶体,为什么可以用无水乙醇,
 蕴青2022-10-04 11:39:541条回答
蕴青2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 cloudpeng 共回答了21个问题
cloudpeng 共回答了21个问题 |采纳率90.5%- 硫酸铜铵可溶于水,不溶于乙醇,而乙醇加进去后,与水互溶,相当于吸收了水分,因此硫酸铜铵可以析出
- 1年前
相关推荐
- 硫酸四氨合铜溶液加热至沸腾现象及解释
 longmahust1年前1
longmahust1年前1 -
 athody 共回答了19个问题
athody 共回答了19个问题 |采纳率94.7%硫酸四氨合铜溶液加热会分解.
[Cu(NH3)4]SO4 ==△== CuSO4 + 4 NH3↑
现象应该从方程式里看的很清楚,氨气会挥发出来,有刺激性气味,溶液是Cu离子的淡蓝色.1年前查看全部
- 硫酸四氨合铜与硫化氢反应的离子方程式是什么?
 allan071年前1
allan071年前1 -
 karl02 共回答了21个问题
karl02 共回答了21个问题 |采纳率90.5%1年前查看全部
- 硫酸四氨合铜中的铜含量,还可以用哪些方法测定
 xch20001年前1
xch20001年前1 -
 tulip2004 共回答了21个问题
tulip2004 共回答了21个问题 |采纳率95.2%1、电解重量法;
2、碘量法:加强碱加热以去除氨,调pH值至微酸性,加碘化钾,以硫代硫酸钠滴定,以淀粉为指示剂,滴至蓝色消失为终点.1年前查看全部
- 稀释硫酸四氨合铜溶液会出现什么现象,是什么原因(好像是出现沉淀,配体交换什么的)(用水稀释)
 坚强的豆腐1年前2
坚强的豆腐1年前2 -
 crazy522 共回答了25个问题
crazy522 共回答了25个问题 |采纳率84%用水稀释后,是因为水置换了四氨合铜络合离子中的氨分子,水中的氢氧根离子和铜离子形成了氢氧化铜沉淀.1年前查看全部
- 配位化合物命名!【Cu(NH3)4】SO4 命名是硫酸四氨合铜那个硫酸和四氨中间为什么不加点?而【Co(NH3)2(en
配位化合物命名!
【Cu(NH3)4】SO4 命名是硫酸四氨合铜
那个硫酸和四氨中间为什么不加点?
而【Co(NH3)2(en)2】(NO3)3命名硝酸·二氨·二乙二胺合钴
硝酸和二氨之间就加点呀? 非常潜水er1年前1
非常潜水er1年前1 -
 lhf-ld 共回答了15个问题
lhf-ld 共回答了15个问题 |采纳率73.3%【Co(NH3)2(en)2】(NO3)3
正确命名是硝酸二氨·二乙二胺合钴(III)
不应该加点
加点的写法是不严谨的,因为容易将硝酸根离子误当做配体.
【Cu(NH3)4】SO4 硫酸四氨合铜(II)
这样是对的
其他关于配合物的内容随时追问1年前查看全部
- 在硫酸四氨合铜溶液中加入乙醇为什么会有沉淀析出?
在硫酸四氨合铜溶液中加入乙醇为什么会有沉淀析出?
怎么让硫氰合铁从溶液中析出?将溶液蒸干可以吗? 海底沉龙1年前1
海底沉龙1年前1 -
 萍水相逢315 共回答了13个问题
萍水相逢315 共回答了13个问题 |采纳率100%硫酸四氨合铜晶体是离子晶体呀,加入乙醇后,乙醇与水互溶,导致溶剂的极性降低,这样盐类的溶解度减小,就有晶体析出
Fe(SCN)3在溶液里以胶体存在,呈血红色,可以用戊醇或醚萃取它,然后蒸干就可以获得了,比在水里蒸干容易,水里加热温度高,还容易破坏Fe(SCN)3的结构1年前查看全部
- EDTA的结构式,EDTA和硫酸四氨合铜反应的反应式是什么?
 湖北白夜1年前1
湖北白夜1年前1 -
 j_i_ai6e0dj73a_3 共回答了16个问题
j_i_ai6e0dj73a_3 共回答了16个问题 |采纳率87.5%Cu(NH3)4SO4+Y=CuY+4NH3 + SO4(2-)1年前查看全部
- 一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH 3 ) 4 ]SO 4 ·H 2 O)是一种重要的染料及农药中间体。某学习
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH 3 ) 4 ]SO 4 ·H 2 O)是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu 2 (OH) 2 CO 3 ,含少量Fe 2 O 3 和SiO 2 杂质)为原料制备该物质的流程如下:
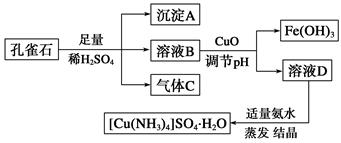
请回答:
(1)沉淀A的晶体中最小环上的原子个数为________,气体C分子中σ键和π键的个数比为________。
(2)溶液D的溶质阴离子的空间构型为__________,其中心原子的杂化轨道类型为________。
(3)MgO的熔点高于CuO的原因为______________________________________。
(4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH 3 ) 4 ] 2 + )的配位键________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm -3 (只要求列算式,不必计算出数值,阿伏伽德罗常数为N A )。 cc19881年前1
cc19881年前1 -
 mvg_4b8nl7f06 共回答了16个问题
mvg_4b8nl7f06 共回答了16个问题 |采纳率87.5%1年前查看全部
- 向硫酸四氨合铜内滴加硫酸为什么会得到无色溶液
向硫酸四氨合铜内滴加硫酸为什么会得到无色溶液
如题,实验做出来的结果. 小米菲菲1年前2
小米菲菲1年前2 -
 fenglie35 共回答了15个问题
fenglie35 共回答了15个问题 |采纳率93.3%只能说得到的溶液蓝色太浅,你误看成无色了.
也许你使用的硫酸四氨合铜(II)配合物溶液本来就很稀,但由于它是深蓝色,所以你能看出来;等你加入硫酸后会变成颜色浅得多的硫酸铜溶液,这样看起来很象是无色溶液.
[Cu(NH3)4](2+) + 4H3O(+) = [Cu(OH2)4](2+) + 4NH4(+)
深蓝 浅蓝1年前查看全部
- 硫酸四氨合铜和硫酸反应的产物是什么?
 飞雪无晴1年前2
飞雪无晴1年前2 -
 杂哈 共回答了15个问题
杂哈 共回答了15个问题 |采纳率86.7%[Cu(NH3)4]SO4 + 2H2SO4 = CuSO4 + 2(NH4)2SO41年前查看全部
- [化学一选修3:物质结构与性质]一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4SO4?H2O]是一种重要的染料及
[化学一选修3:物质结构与性质]一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4SO4?H2O]是一种重要的染料及
[化学一选修3:物质结构与性质]
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4SO4?H2O]是一种重要的染料及农药中间体.某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下图:
请回答:
(1)沉淀A的晶体中最小环上的原子个数为______,气体C分子中σ键和π键的个数比为______.
2)溶液D的溶质阴离子的空间构型为______,其中心原子的杂化轨道类型为______.
3)MgO的熔点高于CuO的原因为______.
4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键______.
(5)湿法炼铜就是利用溶液D制得铜单质,铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.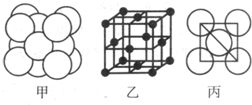
①铜单质晶体中原子的堆积方式为______,晶胞中Cu原子的配位数为______.
若Cu原子半径为acm,则Cu单质晶体的密度为______g/cm3(只列出计算式,阿伏加德罗常数的值为NA).
 淡水2711年前1
淡水2711年前1 -
 天人知我心 共回答了23个问题
天人知我心 共回答了23个问题 |采纳率78.3%孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质)和稀硫酸反应生成硫酸铜、二氧化碳、硫酸铁,二氧化硅不溶于稀硫酸,所以A是二氧化硅,B中含有硫酸铁、硫酸铜,C是二氧化碳,B中加入氧化铜调节溶液的pH生成氢氧化铁,则溶液中存在硫酸铜,
(1)二氧化硅晶体结构中,每个硅原子结合4个氧原子原子,同时每个氧原子结合2个硅原子原子,最小的环上,有6个Si原子和6个O原子,所以一共12个原子;二氧化碳分子中含有2个σ键和2个π键,所以σ键和π键个数比为1:1,
故答案为:12;1:1;
(2)溶液D的溶质阴离子为硫酸根离子,SO42-中价层电子对个数,4+[1/2](6+2-4×2)=4,所以为正四面体结构,中心原子采用 sp3 杂化,
故答案为:正四面体;sp3;
(3)离子晶体的熔点与晶格能成正比,晶格能与电荷成正比,与离子半径成反比,氧化镁的中镁离子直径小于铜离子,所以氧化镁的晶格能大于氧化铜,则氧化镁的熔点高,
故答案为:MgO的晶格能大;
(4)一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)中铜原子和氮原子形成4个配位键,其配位键表示为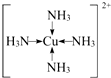 ,
,
故答案为: ;
;
(5)①根据图片知,铜单质为面心立方最密堆积,铜原子配位数=3×8×
1
2=12,
故答案为:面心立方最密堆积;12;
③Cu原子半径为acm,则晶胞边长=2
2acm,晶胞体积V=(2
2acm)3,每个晶胞中铜原子个数=8×[1/8+6×
1
2]=4ρ=
m
V=
M
NA×4
V=
64
NA×4
(2
2a)3g/cm3=
64×4
(21年前查看全部
- 一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4?H2O)是一种重要的染料及农药中间体.某学习小组以孔
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4?H2O)是一种重要的染料及农药中间体.某学习小组以孔
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4?H2O)是一种重要的染料及农药中间体.某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质)为原料制备该物质的流程如下:
请回答:
(1)沉淀A的晶体中最小环上的原子个数为______,气体C分子中σ键和π键的个数比为______
(2)溶液D的溶质阴离子的空间构型为______,其中心原子的杂化轨道类型为______.
(3)MgO的熔点高于CuO的原因为______.
(4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键______.
(5)一种铜金合金晶体具有面心立方最密堆积的结构.在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为______,若该晶胞的边长为apm,则合金的密度为______g?cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
 AWATER1年前1
AWATER1年前1 -
 亲爱的我吻你 共回答了17个问题
亲爱的我吻你 共回答了17个问题 |采纳率88.2%孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质),孔雀石和足量稀硫酸反应生成CuSO4、Fe2(SO4)3和CO2,SiO2不反应,所以沉淀A是SiO2,气体C是CO2,溶液B中的溶质是CuSO4、Fe2(SO4)3,向溶液B中加入CuO并调节溶液pH,则生成Fe(OH)3,溶液D中的溶质是CuSO4,向D溶液中加入适量氨水并蒸发、结晶得到[Cu(NH3)4]SO4?H2O.
(1)二氧化硅晶体结构中,每个硅原子结合4个氧原子原子,同时每个氧原子结合2个硅原子原子,最小的环上,有6个Si原子和6个O原子,所以一共12个原子;二氧化碳分子中含有2个σ键和2个π键,所以σ键和π键个数比为1:1,
故答案为:12;1:1;
(2)溶液D的溶质阴离子为硫酸根离子,SO42-中价层电子对个数,4+[1/2](6+2-4×2)=4,所以为正四面体结构,中心原子采用 sp3 杂化,
故答案为:正四面体;sp3;
(3)离子晶体的熔点与晶格能成正比,晶格能与电荷成正比,与离子半径成反比,氧化镁的中镁离子直径小于铜离子,所以氧化镁的晶格能大于氧化铜,则氧化镁的熔点高,
故答案为:MgO的晶格能大;
(4)一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)中铜原子和氮原子形成4个配位键,其配位键表示为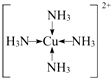 ,
,
故答案为: ;
;
(5)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×[1/8]=1,Cu原子个数=6×[1/2]=3,所以该合金中Au原子与Cu原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=
197+64×3
NA
(a×10?10)3g?cm-3,
故答案为:1:3;
197+64×3
NA
(a×10?10)3.1年前查看全部
- 一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题:(1
一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题:(1
 一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题:
一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题:
(1)Cu的核外电子排布式为______.
(2)N的L层中有______对成对电子;N
立体构型是______,其中心原子的杂化方式为______.H +4
(3)氨水溶液中存在多种氢键,任表示出其中两种______;
(4)[Cu(NH3)4]SO4?H2O中呈深蓝色的离子是______,该微粒中的“电子对给予一接受键”属于______键(填“σ”或“π”);
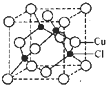
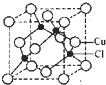
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______.
 5263340301年前1
5263340301年前1 -
 zhenzhulei2007 共回答了15个问题
zhenzhulei2007 共回答了15个问题 |采纳率86.7%(1)Cu元素是29号元素,原子核外电子数为29,核外电子排布式为1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)N元素原子的核外电子排布式为1s22s22p3,L层中s能级的电子为成对电子,
NH4+中,N原子成4个N-H,采取sp3杂化,不含孤对电子,为正四面体结构,
故答案为:1;正四面体;sp3;
(3)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、
O-H…O、N-H…N,
故答案为:O-H…N、N-H…O等;
(4)[Cu(NH3)4]SO4?H2O中呈深蓝色的离子是[Cu(NH3)4]2+,微粒中的“电子对给予一接受键”属于配位键,为单键,属于σ键,
故答案为:[Cu(NH3)4]2+;σ;
(5)由晶胞结构可知,Cu原子位于面心与顶点上,晶胞中Cu原子数目为8×[1/8]+6×[1/2]=4,晶胞中Cl原子处于体内,Cl原子的数目为4,故该化合物的化学式为CuCl,
故答案为:CuCl.1年前查看全部
- 一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4•H2O是一种重要的染料及农药中间体.某学习小组在实验室以氧化
一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4•H2O是一种重要的染料及农药中间体.某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线如图1:
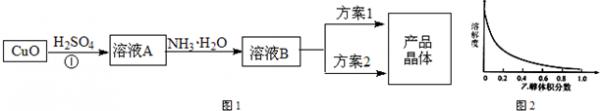
相关信息如下:
①溶液B为[Cu(NH3)4]SO4、(NH4)2SO4混合溶液;
②(NH4)2SO4在水中可溶,在乙醇中难溶;
③[Cu(NH3)4]SO4在乙醇水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图2;
④[Cu(NH3)4]SO4•H2O受热易失水分解,[Cu(NH3)4]SO4溶液受热易转化为Cu(OH)2或碱式硫酸铜[Cu2(OH)2SO4]沉淀;
请根据以上信息回答下列问题:
(1)请写①的化学反应方程式______.
(2)方案1的实验步骤为:
a.加热蒸发b.冷却结晶c.过滤d.洗涤e.干燥
该方案存在明显缺陷,因为得到的产物晶体中往往含有______杂质,产生该杂质的原因是______.
(3)方案2的实验步骤为:
a.向溶液B加入适量______,b.______,c.洗涤,d.干燥.
①请在上述空格内填写合适的试剂或操作名称.
②下列选项中,最适合作为步骤c的洗涤液______.
A.乙醇B.蒸馏水C.乙醇和水的混合液D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是______. 纯真的hh1年前1
纯真的hh1年前1 -
 mengfj 共回答了18个问题
mengfj 共回答了18个问题 |采纳率94.4%解题思路:(1)根据硫酸和氧化铜反应生成硫酸铜和水进行解答;
(2)根据氨气具有挥发性,物质的电离是吸热过程,加热促进使反应[Cu(NH3)4]2+⇌Cu2++4NH3平衡往右移动,且铜离子是弱碱离子易水解,所以导致产生杂质进行解答;
(3)①根据图象分析,[Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的增大而减小,为了减少[Cu(NH3)4]SO4•H2O的损失,应加入乙醇,降低其溶解度,然后抽滤的晶体;②根据图象[Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图及实验目的分析;③含结晶水的晶体加热易失水,不宜采用加热干燥的方法.(1)硫酸和氧化铜反应生成硫酸铜和水,反应的化学方程式:CuO+H2SO4=CuSO4+H2O;故答案为:CuO+H2SO4=CuSO4+H2O;
(2)该方案存在明显缺陷,因为得到的产物晶体中往往含有Cu(OH)2或Cu2(OH)2SO4杂质,产生该杂质的原因是加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+⇌Cu2++4NH3平衡向右移动,且Cu2+发生水解.
故答案为:Cu(OH)2或Cu2(OH)2SO4;加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+⇌Cu2++4NH3平衡往右移动,且Cu2+发生水解;
(3)①根据Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图知,随着乙醇体积分数的增大,Cu(NH3)4]SO4•H2O的溶解度降低,为了得到Cu(NH3)4]SO4•H2O,应向溶液C中加入适量乙醇,然后进行抽滤;
故答案为:乙醇;抽滤(或吸滤、减压过滤);
②根据Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图知,随着乙醇体积分数的增大,Cu(NH3)4]SO4•H2O的溶解度降低,为了减少
Cu(NH3)4]SO4•H2O的损失,应降低Cu(NH3)4]SO4•H2O的溶解度,所以应选用乙醇和水的混合液;
故答案为:C;
③[Cu(NH3)4]SO4•H2O在加热条件下能分解生成水和氨气,从而得不到纯净的[Cu(NH3)4]SO4 •H2O,所以不宜采用加热干燥的方法.
故答案为:加热易使[Cu(NH3)4]SO4•H2O 分解(失去水或失去氨气).点评:
本题考点: 物质的相互转化和制备;固体溶解度曲线及其作用;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学平衡移动、结晶等方式都是和实验有密切联系,在高考复习中尽量还原、复原课本实验,尽量将课本实验综合化是重要的复习思路.实验题是理综考试的必考题,而实验题也经常被我们认为是“最熟悉的陌生人”.分析近年来高考化学实验题,可以发现几乎所有试题均取材于自教材上的实验,特别是来自“实验化学”中的内容.认真复习课本中的实验,弄清实验原理、目的、要求、步骤和注意事项等实验基础知识,并能做到举一反三,是我们做好实验复习的保证.1年前查看全部
- 一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4•H2O]是一种重要的染料及农药中间体.请回答下列相关问题:
 一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4•H2O]是一种重要的染料及农药中间体.请回答下列相关问题:
一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4•H2O]是一种重要的染料及农药中间体.请回答下列相关问题:
(1)Cu的核外电子排布式为______.
(2)N的L层中有______对成对电子;N
立体构型是______,其中心原子的杂化方式为______.H +4
(3)氨水溶液中存在多种氢键,任表示出其中两种______;
(4)[Cu(NH3)4]SO4•H2O中呈深蓝色的离子是______,该微粒中的“电子对给予一接受键”属于______键(填“σ”或“π”);
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______. 就是一一枪1年前1
就是一一枪1年前1 -
 hnxdl 共回答了15个问题
hnxdl 共回答了15个问题 |采纳率80%解题思路:(1)Cu元素是29号元素,原子核外电子数为29,根据核外电子排布规律书写,注意半满、全满稳定结构;
(2)N元素原子的核外电子排布式为1s22s22p3,L层中s能级的电子为成对电子;NH4+中,N原子成4个N-H,采取sp3杂化,不含孤对电子,为正四面体结构;
(3)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键;
(4)[Cu(NH3)4]SO4•H2O中呈深蓝色的离子是[Cu(NH3)4]2+,微粒中的“电子对给予一接受键”属于配位键,为单键,属于σ键;
(5)由晶胞结构可知,Cu原子位于面心与顶点上,Cl原子处于体内,根据均摊法计算晶胞中Cu原子、Cl原子的数目,据此书写.(1)Cu元素是29号元素,原子核外电子数为29,核外电子排布式为1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)N元素原子的核外电子排布式为1s22s22p3,L层中s能级的电子为成对电子,
NH4+中,N原子成4个N-H,采取sp3杂化,不含孤对电子,为正四面体结构,
故答案为:1;正四面体;sp3;
(3)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、
O-H…O、N-H…N,
故答案为:O-H…N、N-H…O等;
(4)[Cu(NH3)4]SO4•H2O中呈深蓝色的离子是[Cu(NH3)4]2+,微粒中的“电子对给予一接受键”属于配位键,为单键,属于σ键,
故答案为:[Cu(NH3)4]2+;σ;
(5)由晶胞结构可知,Cu原子位于面心与顶点上,晶胞中Cu原子数目为8×[1/8]+6×[1/2]=4,晶胞中Cl原子处于体内,Cl原子的数目为4,故该化合物的化学式为CuCl,
故答案为:CuCl.点评:
本题考点: 配合物的成键情况;原子核外电子排布;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题主要考查化学键、晶胞计算、分子结构与杂化理论等,难度中等,注意(3)中氢键的表示,注意基础知识的全面掌握.1年前查看全部
- 为什么在做实验时在硫酸四氨合铜(II)中加入氢氧化钠没有沉淀产生;接着加入硫酸为什么深蓝色会褪去
 跳舞牛牛1年前1
跳舞牛牛1年前1 -
 kingna 共回答了23个问题
kingna 共回答了23个问题 |采纳率91.3%①硫酸四氨合铜是[Cu(NH3)4]SO4
其中没有Cu2+,有的是[Cu(NH3)4]2+离子
后者盛情氢氧化四氨合铜不是沉淀
②硫酸破坏[Cu(NH3)4]2+离子(深蓝色)的稳定
生成Cu2+(蓝色)和NH4HSO4或(NH4)2SO41年前查看全部
- 配位化合物硫酸四氨合铜中,铜离子和硫酸根离子所处的化学环境的差别
 yutong_ily1年前2
yutong_ily1年前2 -
 visualzhu 共回答了19个问题
visualzhu 共回答了19个问题 |采纳率89.5%前者属于复杂络离子内部中心离子,难电离出来,后者则是游离的自由离子1年前查看全部
- 一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4•H2O)是一种重要的染料及农药中间体.某学习小组以孔雀石(主
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4•H2O)是一种重要的染料及农药中间体.某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质)为原料制备该物质的流程如下:

请回答:
(1)沉淀A的晶体中最小环上的原子个数为______,气体C分子中σ键和π键的个数比为______
(2)溶液D的溶质阴离子的空间构型为______,其中心原子的杂化轨道类型为______.
(3)MgO的熔点高于CuO的原因为______.
(4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键______.
(5)一种铜金合金晶体具有面心立方最密堆积的结构.在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为______,若该晶胞的边长为apm,则合金的密度为197+64×3 NA (a×10−10)3 g•cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).197+64×3 NA (a×10−10)3  yange正在思考1年前1
yange正在思考1年前1 -
 libra15 共回答了15个问题
libra15 共回答了15个问题 |采纳率86.7%解题思路:孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质),孔雀石和足量稀硫酸反应生成CuSO4、Fe2(SO4)3和CO2,SiO2不反应,所以沉淀A是SiO2,气体C是CO2,溶液B中的溶质是CuSO4、Fe2(SO4)3,向溶液B中加入CuO并调节溶液pH,则生成Fe(OH)3,溶液D中的溶质是CuSO4,向D溶液中加入适量氨水并蒸发、结晶得到[Cu(NH3)4]SO4•H2O.
(1)在二氧化硅晶体结构中,每个硅原子结合4个氧原子,同时每个氧原子结合2个硅原子;二氧化碳分子中含有2个σ键和2个π键;
(2)溶液D的溶质阴离子为硫酸根离子,根据价层电子对互斥理论确定其空间构型和中心原子杂化方式;
(3)离子晶体的熔点与晶格能成正比,晶格能与电荷成正比,与离子半径成反比;
(4)一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)中铜原子和氮原子形成4个配位键;
(5)利用均摊法计算两种金属原子个数之比,根据ρ=[m/V]计算.孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质),孔雀石和足量稀硫酸反应生成CuSO4、Fe2(SO4)3和CO2,SiO2不反应,所以沉淀A是SiO2,气体C是CO2,溶液B中的溶质是CuSO4、Fe2(SO4)3,向溶液B中加入CuO并调节溶液pH,则生成Fe(OH)3,溶液D中的溶质是CuSO4,向D溶液中加入适量氨水并蒸发、结晶得到[Cu(NH3)4]SO4•H2O.
(1)二氧化硅晶体结构中,每个硅原子结合4个氧原子原子,同时每个氧原子结合2个硅原子原子,最小的环上,有6个Si原子和6个O原子,所以一共12个原子;二氧化碳分子中含有2个σ键和2个π键,所以σ键和π键个数比为1:1,
故答案为:12;1:1;
(2)溶液D的溶质阴离子为硫酸根离子,SO42-中价层电子对个数,4+[1/2](6+2-4×2)=4,所以为正四面体结构,中心原子采用 sp3 杂化,
故答案为:正四面体;sp3;
(3)离子晶体的熔点与晶格能成正比,晶格能与电荷成正比,与离子半径成反比,氧化镁的中镁离子直径小于铜离子,所以氧化镁的晶格能大于氧化铜,则氧化镁的熔点高,
故答案为:MgO的晶格能大;
(4)一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)中铜原子和氮原子形成4个配位键,其配位键表示为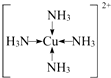 ,
,
故答案为: ;
;
(5)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×[1/8]=1,Cu原子个数=6×[1/2]=3,所以该合金中Au原子与Cu原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=
197+64×3
NA
(a×10−10)3g•cm-3,
故答案为:1:3;
197+64×3
NA
(a×10−10)3.点评:
本题考点: 晶胞的计算;共价键的形成及共价键的主要类型;配合物的成键情况;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查较综合,涉及晶胞的计算、配位键、杂化方式的判断、离子空间构型的判断等知识点,根据密度公式、价层电子对互斥理论等知识点来分析解答,难点是晶胞的计算,注意配位键的表示方法、pm与cm之间的进制,为易错点.1年前查看全部
- 为什么硫酸四氨合铜在乙醇中的溶解度小
 leasun9861年前3
leasun9861年前3 -
 仙仙幽幽 共回答了14个问题
仙仙幽幽 共回答了14个问题 |采纳率92.9%硫酸四氨合铜是离子晶体,在水中电离出离子,具有最强的极性.
(离子晶体具有最强的极性,强于任何一种极性分子)
乙醇的极性弱于水的极性,所以硫酸四氨合铜的溶解度在乙醇中的小1年前查看全部
- 一水硫酸四氨合铜(Ⅱ)的化学式为[ Cu( NH 3 ) 4 ]SO 4 ·H 2 O,是一种重要的染料及农药中间体。某
一水硫酸四氨合铜(Ⅱ)的化学式为[ Cu( NH 3 ) 4 ]SO 4 ·H 2 O,是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为: 
相关信息如下: ①[Cu( NH 3 ) 4 ]SO 4 ·H 2 O在溶液中存在以下电离(解离)过程:
[ Cu(NH 3 ) 4 ]SO 4 ·H 2 O=[ Cu( NH 3 ) 4 ] 2+ +SO 4 2- +H 2 O
[Cu(NH 3 ) 4 ] 2+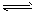 Cu 2+ +4NH 3 ②(NH 4 )·SO 4 在水中可溶,在乙醇中难溶。
Cu 2+ +4NH 3 ②(NH 4 )·SO 4 在水中可溶,在乙醇中难溶。
③[ Cu( NH 3 ) 4 ]SO 4 ·H 2 O在乙醇一水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下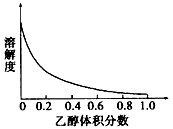
请根据相关信息回答下列问题:
方案l的实验步骤为: a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥
(1)①步骤c的抽滤装置如下图所示,该装置中的错误之处是____;抽滤完毕或中途需停止抽滤时,应先______,然后________。
②该方案存在明显缺陷,因为得到的产物晶体中往往含有____杂质,产生该杂质可能的原因是______ 。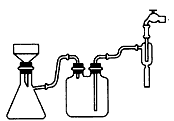
方案2的实验步骤为:
(2)a向溶液C中加入适量______,b_______,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
(3) ②下列选项中,最适合作为步骤c的洗涤液是____。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是__________。 lll_61年前1
lll_61年前1 -
 booksun 共回答了14个问题
booksun 共回答了14个问题 |采纳率85.7%1年前查看全部
- [Cu(NH3)4]SO4是硫酸四氨合铜(II) (II)怎么解释
 薄冰10251年前1
薄冰10251年前1 -
 big_small 共回答了21个问题
big_small 共回答了21个问题 |采纳率90.5%(II) 是中心原子Cu的化合价.
这个配合物中,配体是中性分子NH3,外界是SO42-,所以中心原子是Cu2+.
配合物命名时,要在最后写出中心原子的化合价(用罗马数字表示)
在无歧义的情况下,化合价也可以省略.直接写 硫酸四氨合铜1年前查看全部
- 为什么制取一水合硫酸四氨合铜在加入氨水制取配合物前须先用氨水将PH调至6-8?
 syu_sally1年前1
syu_sally1年前1 -
 天天33387 共回答了20个问题
天天33387 共回答了20个问题 |采纳率90%因为酸性过强的话,氨会变成铵,碱性过强会变成一水合氨1年前查看全部
- 加热硫酸四氨合铜晶体方程式
 leleya1年前2
leleya1年前2 -
 lisazuo 共回答了18个问题
lisazuo 共回答了18个问题 |采纳率94.4%加热[Cu(NH3)4]SO4时,配位的NH3要失配,得到硫酸铜和氨气
[Cu(NH3)4]SO4 ==△== CuSO4 + 4 NH3↑1年前查看全部
- 硫酸四氨合铜与氯化钡反应方程式
 兰花肉末茄子1年前0
兰花肉末茄子1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 硫酸四氨合铜与氢氧根方程式
 timlii1年前2
timlii1年前2 -
 xiao1107 共回答了19个问题
xiao1107 共回答了19个问题 |采纳率78.9%1、硫酸四氨合铜很难和氢氧化钠溶液反应的.原因主要是硫酸四氨合铜溶液中铜离子浓度很低,加入的氢氧化钠溶液浓度不很高,就无法反应,理论上,假如氢氧化钠溶液浓度足够高(是否能达到不一定,需要计算)也能反应.这个时候的方程式为
[Cu(NH3)4]2+ + 2OH- = Cu(OH)2 + 4NH3,氨气可以逸出.
2、硫酸四氨合铜一定可以和盐酸反应,可以先看到出现沉淀,然后沉淀消失.这个时候的方程式:
[Cu(NH3)4]2+ + 2H+ + 2H2O = Cu(OH)2 + 4NH4+,沉淀消失的原因是氢氧化铜和盐酸继续反应.1年前查看全部
- 加热硫酸铜晶体有什么结果是硫酸四氨合铜
 瞬间4561年前3
瞬间4561年前3 -
 ozamwg3 共回答了16个问题
ozamwg3 共回答了16个问题 |采纳率100%不知道你问的是什么硫酸铜晶体,那就都说一下.如果是带结晶水的硫酸铜,加热后由蓝色变为白色,因为结晶水失去.如果是无水硫酸铜,加热后无变化.1年前查看全部
- Cu2+跟氨水反应的化学方程式硫酸四氨合铜与氢氧化钠反应的方程式
 胡呀胡不归1年前3
胡呀胡不归1年前3 -
 greatsparkgb 共回答了19个问题
greatsparkgb 共回答了19个问题 |采纳率94.7%Cu2+跟氨水反应Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3==[Cu(NH3)4]2++2OH-
硫酸四氨合铜与氢氧化钠不会反应 从以下的方程式中你应该能理解吧:
Cu2(OH)2SO4+8NH3====2[Cu(NH3)4](正二价离子)+SO4(负二价)+2OH(负一价)1年前查看全部
- Cu2+跟氨水反应的化学方程式硫酸四氨合铜与氢氧化钠反应的方程式
 我不顶天早踏了1年前4
我不顶天早踏了1年前4 -
 vbkp7cy 共回答了15个问题
vbkp7cy 共回答了15个问题 |采纳率86.7%Cu2+ + 2NH3.H2O=Cu(OH)2↓+2NH4+
Cu(NH3)4SO4+2NaOH=Cu(OH)2↓+Na2SO4+4NH3↑1年前查看全部
- 铜原子失去一个电子是失去哪个能极上的,硫酸四氨合铜的配位数为什么是4?
 花花pgy1年前3
花花pgy1年前3 -
 bbsplayer1 共回答了17个问题
bbsplayer1 共回答了17个问题 |采纳率88.2%铜原子失去一个电子是失去4s1上的电子,形成3d10稳定状态.
Cu+电子排布[Ar] 3d10
铜离子为dsp2杂化,整个络离子呈平面正方形构型.或者说铜离子电子构型为3d9,采取dsp2杂化可以得到比较大的晶体场稳定化能.1年前查看全部
大家在问
- 1地球是生命的摇篮的意思
- 2点燃液化石油气观察到的主要现象有?
- 3请别担心我,因为我和大家相处的很融洽 英文翻译
- 4高中化学题(关于强弱电解质)“25度时,向水中加入ch3coona,水的电离平衡:h2o——h+ +oh- 逆向移动,c
- 5填空:Are you a student?(NO,I am not)填这个行不行,I am a teacher.
- 6解不等式最大最小值1)若正数x,y满足x+y=1,求1/x + 1/y的最小值2)已知x>1,则x+ 4/x-1的最小值
- 7“先君子后小人”还是“先小人后君子”?
- 8成长、发现、距离三个话题的作文素材!
- 9如图表示无籽西瓜的培育过程,根据图解,结合你学过的生物学知识,判断下列叙述错误的是( )A.秋水
- 10有4本不同的英语书,6本不同的数学书排在书架上,(1)若相同类型的书必须排在一起,有多少种排法?
- 11英语翻译请翻译的语句通顺一点,最好不要翻译器翻译完直接复制粘贴上The Cu2ZnSnSe4(CZTS) compoun
- 12什么是四大洲,八大洋?四大洲,八大洋是什么?
- 13①在“用双缝干涉测光的波长”实验中,装置如图1所示,③和④为两带狭缝光阑,其中③为______(填:“单缝”或“双缝”)
- 14设随机变量X~N(0,1),Y=2X+1,则Y服从( ) A)N(1,4) B) N(0,1) C) N(1,1) D)
- 15L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖