373K下,A(g)═2B(g)在一密闭容器中进行.
 9xodut2022-10-04 11:39:541条回答
9xodut2022-10-04 11:39:541条回答
373K下,A(g)═2B(g)在一密闭容器中进行.
(1)此反应的平衡常数K=
(填表达式).
(2)A(g)═2B(g)在不同温度(T )下的K值如表,则该反应的逆反应为______(填“吸热”或
“放热”)反应.
(3)升高温度,该平衡向______(填“向左”、“向右”或“不”)移动,反应速率______(填“增大”、“减小”或“不变”).
(4)373K下,A(g)═2B(g)在前110s内的反应进程如图(将该反应看作匀速进行).
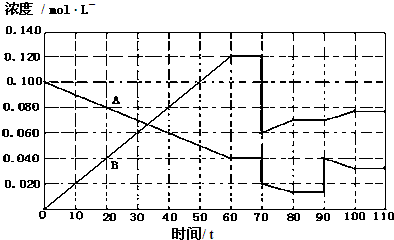
初始加入气体A,据图判断:
①80-90s内,平衡向哪个方向移动?______(填“向左”、“向右”或“不移动”);
②90s时,图中线条变化的原因是______;
③70s时,图中线条发生变化对应的条件可能是______(填标号).
A.加入催化剂B.扩大容器体积C.升高温度D.增大A的浓度.
| T/K | 273 | 323 | 373 |
| K | 0.005 | 0.022 | 0.36 |
| c2(B) |
| c(A) |
| c2(B) |
| c(A) |
(2)A(g)═2B(g)在不同温度(T )下的K值如表,则该反应的逆反应为______(填“吸热”或
“放热”)反应.
(3)升高温度,该平衡向______(填“向左”、“向右”或“不”)移动,反应速率______(填“增大”、“减小”或“不变”).
(4)373K下,A(g)═2B(g)在前110s内的反应进程如图(将该反应看作匀速进行).

初始加入气体A,据图判断:
①80-90s内,平衡向哪个方向移动?______(填“向左”、“向右”或“不移动”);
②90s时,图中线条变化的原因是______;
③70s时,图中线条发生变化对应的条件可能是______(填标号).
A.加入催化剂B.扩大容器体积C.升高温度D.增大A的浓度.

已提交,审核后显示!提交回复
共1条回复
 因为重所以轻 共回答了16个问题
因为重所以轻 共回答了16个问题 |采纳率100%- 解题思路:(1)依据化学方程式和平衡常数概念书写表达式;
(2)依据图标数据分析,随温度升高平衡常数增大,正反应方向进行为吸热反应;
(3)反应为吸热反应,升温增大反应速率,平衡正向进行;
(4)①依据图象分析可知,80s-90s是A、B浓度不变的过程,平衡不动;
②90s时,图中线条变化B浓度增大,A浓度突然增大后,B此时浓度不变,随反应进行A的浓度减少,说明平衡正向进行;
③70s时,图中线条发生变化,B浓度突然减小一半,A的浓度也在此时减小一半,说明是增大容器体积;(1)化学方程式为:A(g)═2B(g),依据平衡常数概念书写表达式K=
c2(B)
c(A);
故答案为:
c2(B)
c(A);
(2)依据图标数据分析,随温度升高平衡常数增大,正反应方向进行为吸热反应,逆反应为放热反应;
故答案为:放热;
(3)上述分析判断此反应为吸热反应,升高温度,增大反应速率,平衡向吸热反应方向进行,平衡正向进行,逆反应为放热反应;
故答案为:向右,增大;
(4)①图象分析可知,80s-90s是A、B浓度不变的过程,平衡不动;
故答案为:不移动;
②90s时,图中线条变化B浓度增大,A浓度突然增大后,B此时浓度不变,说明改变的条件是增大A的浓度,随反应进行A的浓度减少,说明平衡正向进行;
故答案为:增大A的浓度;
③70s时,图中线条发生变化,B浓度突然减小一半,A的浓度也在此时减小一半,说明是增大容器体积,随压强减小,平衡正向进行,AB反应速率减小,最后达到新的平衡状态;
A.加入催化剂加快反应速率,不改变平衡状态,故A不符合;
B.扩大容器体积,AB浓度减小,平衡正向进行,符合题意,故B正确;
C.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,速率变化不符合,故C不符合;
D.70s时,图中线条发生变化,B浓度突然减小一半,A的浓度也在此时减小一半,增大A的浓度不符合图象变化,故C不符合;
故答案为:B;点评:
本题考点: 化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题考查了化学平衡影响因素,平衡常数计算分析,平衡标志的分析判断,掌握图象分析方法和平衡移动原理是解题关键,题目难度中等. - 1年前
相关推荐
大家在问
- 1地球科学(地理)题!(2)A与C的界线大致以季风区与 ,毫米等降水线为界,其主导因素是 .(3)D与其他地区的分界线大致
- 2张明抄一篇稿件,第一小时抄了1600个字,第二小时抄了1900个字,第一小时比第二小时少抄了这篇稿件的3/8,
- 3某物体做匀变速直线运动,第1s内的平均速度为1.6m/s,头2s内的平均速度为1m/s
- 4已知等比数列{a n }的前n项和S n 满足:S 4 -S 1 =28,且a 3 +2是a 2 ,a 4 的等差中项.
- 5,一物体从倾角为30度,高度h=32m的斜坡顶端由静止开始匀加速下滑,下滑加速度2m/s^2
- 6利用余弦函数的图像,求满足条件cos(2x-x/3)≥√3/2的x的集合
- 7一个直角三角形的周长是90厘米,三条边长之比是13:12:5,它的面积是______平方厘米.
- 8英语翻译本人做了一篇09年12月A级阅读真题第2篇,文章是讲与老板的关系处理,其中有这样一句话不会翻译(要是有词组或熟语
- 9请帮忙翻译一句英文I am a "lady serving ladies and gentlemem",is a new
- 10(2014•长清区一模)某市体育中考现场考试内容有三项:50米跑为必测项目;另外在立定跳远和实心球中选一项,在坐位体前屈
- 11根据理解想名句陶渊明那朵菊花温暖了宁静深远的峰峦.李白的愁情汇成了滔滔江水.杜甫的雄心量出了泰山的高度.李清照憔悴如风中
- 12小明为了测量一颗玻璃球的体积,在100mL的量杯里盛了40mL水,当放入10颗玻璃球后,水位到了55mL
- 13下列物质化学式的读法和写法都正确的是( )
- 14还剩76天了,我化学基础还是可以,但是中途玩了一学期,现在复习很吃力,理综每次都是化学拖后腿,求各位学霸指点一二。。。怎
- 15化简下列各数:一(一68) 一(+0.75) 一(负五分之三),一(+3.8)
