超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:
 宴山亭062022-10-04 11:39:541条回答
宴山亭062022-10-04 11:39:541条回答
试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有______.(填字母序号)
A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子
C.[Cu(NH3)4]SO4的组成元素中配体是NH3,N原子提供空轨道
D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体
(2)NH4CuSO3中的金属阳离子的简化核外电子排布式为______.
(3)向硫酸铜的溶液中逐滴滴入氨水溶液至过量可得到[Cu(NH3)4]SO4溶液,出现的现象是______,用反应的离子方程式为:______;______.

已提交,审核后显示!提交回复
共1条回复
 xun3 共回答了23个问题
xun3 共回答了23个问题 |采纳率87%- 解题思路:(1)A.阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;
B.NH3为配体分子,溶液中不存在NH3;
C.根据配合物的组成及其概念来判断;
D.根据价层电子对互斥理论判断离子构型.
(2)NH4CuSO3中Cu的化合价为+1价,基态Cu+核外有28个电子,根据构造原理书写其核外电子排布式;
(3)先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液.(1)A.[Cu(NH3)4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键,故A正确;
B.NH3为配体分子,溶液中不存在NH3,故B错误;
C.根据配合物的组成可以判断配体是NH3,但N原子是提高孤对电子,中心原子是提供空轨道,故C错误;
D.SO42-离子中价层电子对数为4+[1/2]×(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型,故D正确.
故答案为:AD;
(2)Cu原子的核外电子排布式为[Ar]3d104s1,NH4CuSO3中Cu的化合价为+1价,基态Cu+核外有28个电子,根据构造原理金属阳离子的核外电子排布式为[Ar]3d10,
故答案为:[Ar]3d10;
(3)先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液,发生Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:形成蓝色沉淀,继续滴加氨水蓝色沉淀溶解,得到深蓝色溶液;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.点评:
本题考点: 铜金属及其重要化合物的主要性质;配合物的成键情况.
考点点评: 本题较为综合,突出考查配合物知识、核外电子排布、杂化类型、化学键、物质性质、配合物成键状况的了解,综合性较强,全面考查物质的结构和性质,题目难度较大. - 1年前
相关推荐
- 超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下: 
试回答下列问题:
(1)下列关于[Cu(NH 3 ) 4 ]SO 4 的说法中,正确的有______.(填字母序号)
A.[Cu(NH 3 ) 4 ]SO 4 中所含的化学键有离子键、极性键和配位键
B.[Cu(NH 3 ) 4 ]SO 4 含有NH 3 分子,其水溶液中也含有NH 3 分子
C.[Cu(NH 3 ) 4 ]SO 4 的组成元素中第一电离能最大的是氧元素
D.[Cu(NH 3 ) 4 ]SO 4 的外界离子的空间构型为正四面体
(2)NH 4 CuSO 3 中的金属阳离子的核外电子排布式为:______.
(3)SO
离子中S硫原子的杂化方式为______,与其互为等电子体的一种分子的分子式是______.2-3
(4)NH 3 易液化的原因是______.
(5)如图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为______.
(6)NH 4 CuSO 3 与硫酸微热时除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体.则该反应的离子方程式为______.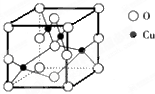
 呵呵15号1年前1
呵呵15号1年前1 -
 岩冰 共回答了15个问题
岩冰 共回答了15个问题 |采纳率93.3%(1)A.[Cu(NH 3 ) 4 ]SO 4 中硫酸根离子和[Cu(NH 3 ) 4 ] 2+ 存在离子键,N原子和铜原子之间存在配位键,NH 3 中H和N之间存在共价键,所以[Cu(NH 3 ) 4 ]SO 4 中所含的化学键有共价键、离子键、配位键,故A正确;
B.NH 3 为配体分子,溶液中不存在NH 3 ,故B错误;
C..元素周期律中,同一周期元素的第一电离能随着原子序数的增大而增大,但N原子最外层达到半饱和的稳定结构,难以失去电子,所以其第一电离能大小为N>O,故C错误
D.SO 4 2- 离子中价层电子对数为4+
1
2 ×(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型,故D正确.
故答案为:AD.
(2)Cu原子的核外电子排布式为[Ar]3d 10 4s 1 ,NH 4 CuSO 3 中Cu的化合价为+1价,则金属阳离子的核外电子排布式为
[Ar]3d 10 ,故答案为[Ar]3d 10 :
(3)SO 3 2- 中含有3个δ键和1个孤电子对,故为sp 3 杂化,离子含有4的原子,价电子总数为26,对应的等电子体有NF 3 (或PF 3 、NCl 3 、PCl 3 等),故答案为:sp 3 ;NF 3 (或PF 3 、NCl 3 、PCl 3 等);
(4)N元素的非金属性较强,对应的氢化物中含有氢键,沸点较高,易液化,故答案为:NH 3 分子间可形成氢键,
(5)晶胞中4个Cu位于晶胞内部,O位于晶胞的顶点和面心,共有8×
1
8 +6
1
2 =4,则该氧化物的化学式为CuO,
故答案为:CuO;
(6)除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体,说明生成Cu、Cu 2+ 和SO 2 ,反应的离子方程式为2NH 4 CuSO 3 +4H +
微热
.
2NH 4 + +Cu 2+ +Cu+2SO 2 ↑+2H 2 O,
故答案为:2NH 4 CuSO 3 +4H +
微热
.
2NH 4 + +Cu 2+ +Cu+2SO 2 ↑+2H 2 O.1年前查看全部
- 超细铜粉制取方程式
 诚心找gg1年前1
诚心找gg1年前1 -
 ximingxing 共回答了18个问题
ximingxing 共回答了18个问题 |采纳率94.4%球磨法(物理方法,需要氮气等保护气氛下进行),无方程式
化学方法一般是水合肼还原铜盐如硫酸铜
注意水合肼剧毒
N2H4 +CuSO4-->N2 +Cu + N2H6 SO41年前查看全部
- 铜单质及其化合物在很多领域有重要的用途.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和C
铜单质及其化合物在很多领域有重要的用途.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl 2 都是重要的化工原料,常用作颜料、防腐剂和消毒剂等.
Ⅰ.超细铜粉的某制备方法如图1:
(1)N、O、S三种元素的第一电离能由大到小顺序为______.
(2)化合物NH 4 CuSO 3 中,金属阳离子的核外电子排布式为______.
(3)化合物Cu(NH 3 ) 4 SO 4 中,N原子的杂化方式为______,SO 4 2- 的空间构型为______.
Ⅱ.氯化亚铜(CuCl)的某制备过程是:向CuCl 2 溶液中通入一定量SO 2 ,微热,反应一段时间后即生成CuCl白色沉淀.
(4)写出上述制备CuCl的离子方程式______.
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为______.
(6)CuCl的熔点比CuO的熔点______(选填“高”或“低”). jxs19741年前1
jxs19741年前1 -
 qyp416 共回答了25个问题
qyp416 共回答了25个问题 |采纳率96%Ⅰ(1)同一周期元素的第一电离能随着原子序数的增大呈增大趋势,氮元素2p能级处于半满稳定状态,能量低,氮元素的第一电离能高于同周期相邻元素第一电离能,所以第一电离能 N>O>S.
故答案为:N>O>S.
(2)化合物NH 4 CuSO 3 中铜为+1价,核外有28个电子,铜是29号元素,根据能量最低原理其态原子的电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 或,该原子失去一个电子时,生成亚铜离子,失去的电子是最外层电子,所以亚铜离子的基态的电子排布式为:1S 2 2S 2 2P 6 3S 2 3P 6 3d 10 .
故答案为:1S 2 2S 2 2P 6 3S 2 3P 6 3d 10 .
(3)NH 3 中氮原子呈3个N-H键,氮原子还有1对孤对电子对,杂化轨道数为4,所以氮原子采取SP 3 杂化.SO 4 2- 中硫原子的价电子层电子对数为
6+2
2 =4.孤电子对数为0,所以SO 4 2- 是正四面体.
故答案为:SP 3 杂化;正四面体.
Ⅱ(4)CuCl 2 溶液中通入一定量SO 2 ,微热生成CuCl沉淀,铜元素化合价由+2价降低为+1价,硫元素被氧化,二氧化硫被氧化为硫酸.所以该反应的离子方程式为:2Cu 2+ +2Cl - +SO 2 +2H 2 O
△
.
2CuCl↓+4H + +SO 4 2- .
故答案为:2Cu 2+ +2Cl - +SO 2 +2H 2 O2CuCl↓+4H + +SO 4 2-
(5)从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4.
故答案为:4.
(6)CuCl和CuO都是离子晶体,离子晶体中晶格能越大,熔点越高,晶格能与离子的半径和电荷有关,离子的半径越小,所带电荷越多,晶格能越大,熔点就越高,CuCl中氯离子半径大于CuO的中氧离子半径,CuCl中氯离子所带电荷小于CuO中氧离子所带电荷,所以CuCl的熔点比CuO的熔点低.
故答案为:低.1年前查看全部
- 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和C
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:
①[Cu(NH3)4]SO4中所含的化学键有______,N、O、S三种元素的第一电离能大小顺序为:______>______>______.(填元素符号)
②NH4CuSO3中的金属阳离子的核外电子排布式为:______.
③NH3分子中N原子的杂化方式为:______.
④SO42-离子的空间构型为______.
(2)氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
①出上述制备CuCl的离子方程式:2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-△ .2Cu2++2Cl-+SO2+2H2O.
2CuCl↓+4H++SO42-△ .
②CuCl的晶胞结构如上图所示,其中Cl原子的配位数为______.
③CuCl的熔点比CuO的熔点______.(填“高”或“低”) alabing111年前1
alabing111年前1 -
 我没有烦恼 共回答了23个问题
我没有烦恼 共回答了23个问题 |采纳率82.6%解题思路:(1)①阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;根据第一电离能的变化规律比较其大小;
②先判断金属离子的化合价,再根据根据核外电子排布式的书写规则书写,注意3d能级的能量大于4s能级的能量,失电子时,先失去最外层上的电子.
③先判断分子构型再判断原子的杂化方式.
④根据价层电子对互斥理论判断离子构型.
(2)①根据反应物、生成物和反应条件写出相应的反应方程式.
②根据晶体结构特点分析Cl原子的配位数.
③根据离子晶体的晶格能判断.(1)①[Cu(NH3)4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键; 元素周期律中,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅡA和第ⅢA、第ⅤA和第ⅥA互换,同一主族元素的第一电离能随着原子序数的增大而减小,所以其第一电离能大小为N>O>S.
故答案为:共价键、离子键、配位键;N>O>S.
②铜是29号元素,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,该原子失去一个电子时,生成亚铜离子,失去的电子是最外层电子,所以亚铜离子的基态的电子排布式为:1S22S22P63S23P63d10或[Ar]3d10.
故答案为:1S22S22P63S23P63d10或[Ar]3d10.
③NH3分子中价层电子对数为4,所以采取SP3杂化.
故答案为:SP3杂化.
④SO42-离子中价层电子对数为4+[1/2(6+2−4×2)=4,孤电子对数为0,所以是正四面体体型.
故答案为:正四面体型.
(2)①该反应中二氧化硫作还原剂生成硫酸根离子,铜离子得电子生成亚铜离子,反应条件是加热,所以该反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O
△
.
]2CuCl↓+4H++SO42-
故答案为:2Cu2++2Cl-+SO2+2H2O
△
.
2CuCl↓+4H++SO42-
②从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4,故答案为:4.
③CuCl和CuO都是离子晶体,离子晶体中晶格能越大,熔点越高,晶格能与离子的半径和电荷有关,离子的半径越小,所带电荷越多,晶格能越大,熔点就越高,CuCl的阴阳离子半径大于CuO的离子半径,CuCl阴阳离子所带电荷小于CuO阴阳离子所带电荷,所以CuCl的熔点比CuO的熔点低.
故答案为:低.点评:
本题考点: 化学键;原子核外电子排布;元素电离能、电负性的含义及应用;判断简单分子或离子的构型;离子晶体;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法.1年前查看全部
大家在问
- 1(2013•同安区一模)如图,在平行四边形ABCD中,已知∠ODA=90°,AC=10cm,BD=6cm,则AD的长为_
- 2我急找12-13学年鼓楼区小学二年级上册语文试卷
- 3五年级英语作文:Myneighbor
- 4请教一个中学英语语法问题,对于成分老搞不清楚.意思倒是知道.
- 5By the end of the month the estate agent_____ twenty houses.
- 6mobile是什么意思
- 7一次射箭比赛,甲、乙两位选手三次的环数之积均为36,且总环数相同,甲的最高环数大于乙的最高环数.求甲的三次成绩.
- 8烧饼歌公认失传了吗?
- 9every和each用法上的区别?好象一个是3者以上,一个2者?还有好象不能用each 4 days
- 10(个5五个•盐城)自行车是生活中最常见如交通工具,以下认识中错误如是( )
- 11Jack is good at swimming .He is______the city swim team.A.at
- 12如果两条直线平行那么其中一条直线上的各点到另一条直线的垂直距离相等 怎么求证
- 1359.3he told me that the meeting__the next daya.was to be hel
- 14Shanghai Waihuan Tunnel is already open to traffic, so it wi
- 15I'm heavy now.意思
