0.6mol 硝酸与一定量的镁铝铁合金反应生成0.15molNO和铁盐、铝盐、镁盐,再向反应后的溶液内加入3mol/L的
 wlc0152022-10-04 11:39:541条回答
wlc0152022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 lsys3d826 共回答了21个问题
lsys3d826 共回答了21个问题 |采纳率85.7%- 选择A
首先,硝酸是强氧化性的,所以生成的是Fe(NO3)3,Al(NO3)3,Mg(NO)2。
本体的重点在于使所有的金属沉淀,所以只要考虑金属的含量就可以了
写出三个盐的方程式,元素是守恒的0.6mol硝酸中只有0.6mol的N,去掉0.15mol的NO
剩下三种盐中的N,也就是硝酸根就都是0.15mol。
根据各个盐中的比例。
Fe(NO3)3,Fe和NO3的比例是1:3,NO3为0.15mol,Fe就是0.05mol,同理求出Al0.05mol,
Mg0.075mol
写出三种沉淀物的化学式Fe(OH)3,Al(OH)3,Mg(OH)2
与上面方法相同,求出需要OH 0.45mol
最后0.45mol/(3mol/L)=150ml - 1年前
相关推荐
- 0.6mol氧气所含的氧原子个数,与质量多少克的臭氧所含的氧原子个数相等?
 doxqt1n1年前3
doxqt1n1年前3 -
 bz8jd 共回答了9个问题
bz8jd 共回答了9个问题 |采纳率77.8%直接一比就比出来了.0.6mol *2 /3 = 0.4mol
0.4mol的臭氧 算一下质量 0.4*48 = 19.2g
所以,0.6mol氧气所含的氧原子个数与19.2g臭氧所含的氧原子个数相等.
楼上的同学你算错了..氧分子是O2..1年前查看全部
- 在体积100mL,含溶质MCl2(可溶性金属氯化物)40.5g,其中含Cl¯0.6mol,则该氯化物的摩尔质量
在体积100mL,含溶质MCl2(可溶性金属氯化物)40.5g,其中含Cl¯0.6mol,则该氯化物的摩尔质量为135g/mol,金属M的相对分子质量为64g,溶液的物质的量浓度为0.3mol/L.若取该溶质27g溶于___________g水中,才能使每10个水分子中溶有1个Cl¯.
 边看边忘1年前1
边看边忘1年前1 -
 一湾逝水 共回答了13个问题
一湾逝水 共回答了13个问题 |采纳率92.3%一个MCl2 有 2个Cl-
而Cl-有0.6 mol
则MCl2 有 0.6/2==0.3 mol
则摩尔质量==质量/物质的量==40.5/0.3==135 g/mol
M 的原子量为 135-35.5*2==65 !
溶液的物质的浓度为 0.3/0.1==3 mol /L 不是 0..3 mol/L
27 g 其物质的量为 27/135==0.2 mol
则 Cl- 为 0.2*2==0.4 mol
10个水有1个Cl-
则H2O 为 0.4*10==4 mol
质量为 4*18==72 g
即溶于 72 g水中1年前查看全部
- 在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)⇌2HI(g),△H<0反应中各物质的浓度随时间的变化情况如图1所示.试回答下列问题:
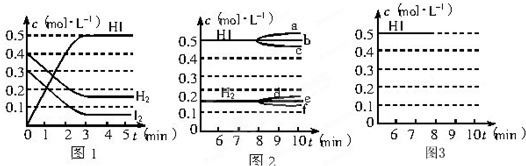
(1)该反应的化学平衡常数的表达式为c2(HI) c(H2)c(I2) .c2(HI) c(H2)c(I2)
(2)根据图1数据,反应开始至达到平衡时,反应的平均速率v(HI)为______.
(3)反应达到平衡后,第8min时:①若升高温度,化学平衡常数K______(填“增大”、“减小”或“不变”),HI的浓度变化正确的是______(用图2中的a~c的编号回答).
②若加入I2,H2浓度的变化正确的是______(用图2中的d~f的编号回答).
(4)反应达到平衡后,第8min时,若把容器的容积扩大一倍,请在图3中画出第8min后HI浓度的变化情况. 风信子51年前1
风信子51年前1 -
 pkking000 共回答了14个问题
pkking000 共回答了14个问题 |采纳率100%解题思路:(1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
(2)根据v=[△c/△t]计算平均速率v(HI);
(3)①根据化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,生成物浓度增大,反之,若平衡逆向移动,化学平衡常数K减少,生成物浓度减少;
②若加入I2,平衡正向移动,H2浓度减少;
(4)反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小.(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=
c2(HI)
c(H2)c(I2),故答案为:K=
c2(HI)
c(H2)c(I2);
(2)平均速率v(HI)=[0.5mol/L/3min]=0.167mol•L-1•min-1,故答案为:0.167mol;
(3)①该反应放热,升高温度,平衡逆向移动,化学平衡常数K减少,生成物浓度减少,故答案为:减少;c;
②若加入I2,平衡正向移动,H2浓度减少,故答案为:f;
(4)H2(g)+I2(g)⇌2HI(g),反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小,碘化氢浓度减小一半为0.25mol/L,画出的变化图象如图: ,故答案为:
,故答案为: .
.点评:
本题考点: 化学平衡常数的含义;化学平衡的影响因素;物质的量或浓度随时间的变化曲线.
考点点评: 本题主要考查了平衡常数、化学平衡移动以及化学反应速率的计算,难度不大,需要注意的是:化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,反之则减少.1年前查看全部
- 分别为0.6mol和0.5mol的A、B两种气体,充入0.4L密闭容器中发生反应:3A(g)+B(g)⇌mC(g)+2D
分别为0.6mol和0.5mol的A、B两种气体,充入0.4L密闭容器中发生反应:3A(g)+B(g)⇌mC(g)+2D(g),经5min达到平衡,此时C为0.2mol.又知在此反应时间内D的平均反应速率为0.1mol•L-1•min-1,回答下列问题:
(1)m值为______;
(2)B的转化率为______;
(3)平衡时容器内物质的总物质的量为______. ivws0011年前1
ivws0011年前1 -
 tgxg00 共回答了22个问题
tgxg00 共回答了22个问题 |采纳率86.4%解题思路:(1)根据v=
计算v(C),利用速率之比等于化学计量数之比计算m;△n V △t
(2)根据方程式计算参加反应的B的物质的量,B的转化率=[B的物质的量变化量/B的起始物质的量]×100%;
(3)利用差量法计算混合气体总的物质的量变化量,据此计算解答.(1)v(C)=
0.2mol
0.4L
5min=0.1mol/(L.min),速率之比等于化学计量数之比,故0.1mol/(L.min):0.1mol/(L.min)=m:2,故m=2,
故答案为:2;
(2)根据方程式可知,参加反应的B的物质的量=0.2mol×[1/2]=0.1mol,故B的转化率=[0.1mol/0.5mol]×100%=20%,
故答案为:20%;
(3)可能反应3A(g)+B(g)⇌2C(g)+2D(g),反应前后气体的体积不变,故混合气体总的物质的量不变,故平衡时容器内物质的总物质的量为0.6mol+0.5mol=1.1mol,
故答案为:1.1mol.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算,难度不大,注意对速率公式的理解与灵活应用.1年前查看全部
- 0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃的分子式为______.若该烃能使溴水褪色,
0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃的分子式为______.若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2-二甲基丁烷,则此烃属于______烃,结构简式为______,名称是______.写出该烃与溴水反应的化学方程式:______.
 xuezelinhai20051年前1
xuezelinhai20051年前1 -
 ballon_up 共回答了18个问题
ballon_up 共回答了18个问题 |采纳率83.3%解题思路:0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,根据原子守恒可知,该烃的分子式为C6H12,该烃能使溴水褪色,说明分子中含有1个C=C键,该烃属于烯烃,在催化剂作用下与H2加成生成2.2-二甲基丁烷( ),相邻两个碳原子都含有H原子为C=C双键位置,确定该烃的结构简式,据此解答.
),相邻两个碳原子都含有H原子为C=C双键位置,确定该烃的结构简式,据此解答.
0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,根据原子守恒可知,该烃的分子中N(C)=[0.6mol/0.1mol]=6,N(H)=[0.6mol×2/0.1mol]=12,故该烃的分子式为C6H12,
该烃能使溴水褪色,说明分子中含有1个C=C键,该烃属于烯烃,在催化剂作用下与H2加成生成2,2-二甲基丁烷(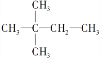 ),相邻两个碳原子都含有H原子为C=C双键位置,该烃的结构简式为:(CH3)3CCH=CH2,名称为3,3-二甲基-1-丁烯,与溴水反应的方程式为:(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br,
),相邻两个碳原子都含有H原子为C=C双键位置,该烃的结构简式为:(CH3)3CCH=CH2,名称为3,3-二甲基-1-丁烯,与溴水反应的方程式为:(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br,
故答案为:C6H12;烯;(CH3)3CCH=CH2;3,3-二甲基-1-丁烯;(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式确定、限制条件同分异构体书写、有机物的命名、烯烃的性质等,难度不大,侧重对基础知识的巩固,注意掌握燃烧法利用原子守恒确定有机物分子式.1年前查看全部
- 工业上合成氨的反应N2(g)+3H2(g)==2NH3(g).设在容积为2L的密闭容器中充入0.6mol N2(g)和1
工业上合成氨的反应N2(g)+3H2(g)==2NH3(g).设在容积为2L的密闭容器中充入0.6mol N2(g)和1.6mol H2(g),反应达到平衡时,NH3的物质的量分数为4/7.
(1)计算N2转化率 (2)2NH3(g)==N2(g)+3H2(g)的平衡常数
麻烦写写过程 特别是(2) wanghau22091年前1
wanghau22091年前1 -
 zhaojuan588 共回答了18个问题
zhaojuan588 共回答了18个问题 |采纳率94.4%N2(g) + 3H2(g)﹤=﹥2NH3(g)
开始0.6mol 1.6mol 0
反应 X 3X 2X
平衡0.6mol-X 1.6mol-3X 2X
达到平衡时,NH3的物质的量分数=2X/(0.6mol-X +1.6mol-3X +2X)=4/7
X=0.4mol
(1)计算N2转化率=0.4mol/0.6mol*100%=66.7%
(2)2NH3(g)﹤=﹥N2(g)+3H2(g)与上面的可逆反应是不同方向进行的可逆反应,但相同条件下这两个反应是等效平衡,所以达到平衡时各物质的量分别如下:
2NH3(g)﹤=﹥N2(g)+3H2(g)
平衡 0.8mol 0.2mol 0.4mol
平衡时各物质的量浓度:
C(NH3)=0.8mol/2L=0.4mol/L
C(N2)=0.2mol/2L=0.1mol/L
C(H2)=0.4mol/2L=0.2mol/L
2NH3(g)﹤=﹥N2(g)+3H2(g)的平衡常数=[0.1mol/L*(0.2mol/L)^3]/(0.4)^2=0.0051年前查看全部
- 在2L密闭容器中发生反应4A(s)+3B(g)⇌2C(g)+D(g),经2min,B的物质的量减少0.6mol,下列对该
在2L密闭容器中发生反应4A(s)+3B(g)⇌2C(g)+D(g),经2min,B的物质的量减少0.6mol,下列对该反应速率表示正确的是( ) A.在2min末的反应速率:v(B)=0.3mol•L -1 •min -1 B.用A表示的反应速率为:v(A)=0.4mol•L -1 •min -1 C.用D表示的平均反应速率为:v(D)=0.05mol•L -1 •min -1 D.分别用B、C表示的反应速率其比值为2:3  Kasseler1年前1
Kasseler1年前1 -
 乌鸦911 共回答了15个问题
乌鸦911 共回答了15个问题 |采纳率86.7%A.反应速率为平均速率,则2min内的反应速率v(B)=0.15mol•L -1 •min -1 ,故A错误;
B.因A物质为纯固体,则不能利用纯固体表示反应速率,故B错误;
C.用D表示的平均反应速率为v(D)=0.15mol•L -1 •min -1 ×
1
3 =0.05mol•L -1 •min -1 ,故C正确;
D.反应速率之比等于化学计量数之比,则分别用B、C表示的反应速率其比值为3:2,故D错误;
故选C.1年前查看全部
- 0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃的分子式为______.若该烃不能使溴水或高
0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃的分子式为______.若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和溴蒸气发生取代反应,其一溴取代物只有一种,则此烃结构简式为______,名称是______.若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2-二甲基丁烷,则此烃结构简式为______,名称是______,与溴发生加成反应的化学方程式为______.
 ypeda1年前1
ypeda1年前1 -
 ruyanzhang 共回答了13个问题
ruyanzhang 共回答了13个问题 |采纳率84.6%解题思路:根据C元素、H元素守恒确定该烃的分子式为C6H12;
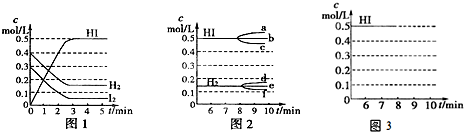
该烃的分子式为C6H12,不饱和度为1,若该烃不能使溴水或高锰酸钾溶液褪色,说明烃中苯环不饱和键,该烃为环烷烃,
其一溴取代物只有一种,说明分子中只有一种H原子,该烃为环己烷,环己烷与溴发生一元取代生成溴己烷与氯化氢;
若该烃能使溴水褪色,说明分子中含有1个C=C双键,该烃属于烯烃,在催化剂作用下与H2发生加成反应,生成2.2-二甲基丁烷,则该烃的结构简式为(CH3)3C-CH=CH2,(CH3)3C-CH=CH2与溴发生加成反应生成(CH3)3C-CHBr-CH2Br.n(烃):n(C):n(H)=n(烃):n(CO2):2n(H2O)=0.1mol:0.6mol:0.6mol×2=1:6:12,即1个分子中含有6个C原子、12个H原子,故该烃的分子式为C6H12;
该烃的分子式为C6H12,不饱和度为1,若该烃不能使溴水或高锰酸钾溶液褪色,说明烃中苯环不饱和键,故该烃为环烷烃,其一溴取代物只有一种,说明分子中只有一种H原子,该烃为环己烷,结构简式为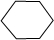 ,
,
若该烃能使溴水褪色,说明分子中含有1个C=C双键,该烃属于烯烃,在催化剂作用下与H2发生加成反应,生成2.2-二甲基丁烷,则该烃的结构简式为(CH3)3C-CH=CH2,名称为3,3-二甲基-1-丁烯,(CH3)3C-CH=CH2与溴发生加成反应生成(CH3)3C-CHBr-CH2Br,
故答案为:C6H12; ;环己烷;(CH3)3C-CH=CH2;3,3-二甲基-1-丁烯;(CH3)3C-CH=CH2+Br2→(CH3)3C-CHBr-CH2Br.
;环己烷;(CH3)3C-CH=CH2;3,3-二甲基-1-丁烯;(CH3)3C-CH=CH2+Br2→(CH3)3C-CHBr-CH2Br.点评:
本题考点: 有机物的推断;有关有机物分子式确定的计算.
考点点评: 本题考查有机物的推断,侧重于分子式的确定、烯烃的性质与命名等,比较基础,注意掌握燃烧法根据原子守恒确定有机物分子式,注意对基础知识的理解掌握.1年前查看全部
- 用1L 1.0mol•L-1的NaOH溶液吸收0.6mol CO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比
用1L 1.0mol•L-1的NaOH溶液吸收0.6mol CO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比约是( )
A.1:3
B.2:1
C.2:3
D.3:2 东西221年前1
东西221年前1 -
 豌豆尖女孩 共回答了25个问题
豌豆尖女孩 共回答了25个问题 |采纳率100%解题思路:用1L 1mol•L-1NaOH溶液吸收0.9molCO2,所得产物有Na2CO3和NaHCO3,根据Na元素和C元素守恒列式计算.用1L 1mol•L-1NaOH溶液吸收0.9molCO2,所得产物有Na2CO3和NaHCO3,设CO32-和HCO3-的物质的量分别为x、y,则
x+y=0.6mol
2x+y=1L×1.0mol/L
解得x=0.4mol,y=0.2mol,
同一溶液中浓度之比等于物质的量之比,
则所得溶液中的CO32-和HCO3-的物质的量浓度之比约是0.4mol:0.2mol=2:1,
故选B.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查离子反应的计算,为高频考点,题目难度不大,注意从原子守恒的角度分析.1年前查看全部
- 当20℃时,电解饱和硫酸铜溶液,假设有0.6mol电子发生转移,是电解进行完全,测得点解后溶液的密度为1.074
当20℃时,电解饱和硫酸铜溶液,假设有0.6mol电子发生转移,是电解进行完全,测得点解后溶液的密度为1.074
当20℃时,电解饱和硫酸铜溶液,假设有0.6mol电子发生转移,是电解进行完全,测得点解后溶液的密度为1.074 g/mL(20摄氏度时,硫酸铜的溶解度为20g,使用惰性电极)求:
.
1电解后溶液的物质的量浓度
2.取电解后溶液10mL稀释至1000mL,取出25ml用0.2mol/L的氢氧化钠溶液中和,所需氢氧化钠溶液的体积 hzq06211年前2
hzq06211年前2 -
 湛蓝的兰38 共回答了17个问题
湛蓝的兰38 共回答了17个问题 |采纳率94.1%(1) 电解中转移0.6mol电子,则参加电解的物质是硫酸铜和水 则电解后的溶液是硫酸溶液
电解后 硫酸铜的物质的量:0.125mol 电解后溶液体积:(100-0.125X64-1/16X32-0.175X18)/1.074=80.9ML =0.0809L 则电解后硫酸物质的量浓度; 0.125/0.0809=1.54mol/L
(2)第二问中 根据氢离子和氢氧根离子1:1的比例 有 1.54x0.01x2=0.2V 得所需氢氧化钠体积 V=15.4ML1年前查看全部
- 在某一容积为2L的密闭容器内,加入0.8mol 的H2和0.6mol 的I2,在一定的条件下发生如下
在某一容积为2L的密闭容器内,加入0.8mol 的H2和0.6mol 的I2,在一定的条件下发生如下反应:H2(g)+I2(g)⇌2HI(g)△H<0.反应中各物质的浓度随时间变化情况如图1:
(1)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为______(精确到小数点后第3位).
(2)反应达到平衡后,第8分钟时,若升高温度,HI浓度的变化是______(用图2中a-c的编号回答).
(3)反应达到平衡后,第8分钟时,若加入I2,则H2浓度的变化是______(用图2中d-f的编号回答).
(4)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出从第8分钟开始HI浓度的变化情况. one_guy1年前1
one_guy1年前1 -
 zgflr 共回答了19个问题
zgflr 共回答了19个问题 |采纳率89.5%解题思路:(1)根据v=[△c/△t]计算平均速率v(HI);
(2)温度改变,平衡逆向移动,生成物浓度减少;
(3)若加入I2,平衡正向移动,H2浓度减少;
(4)反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小.(1)平均速率v(HI)=[0.5mol/L/3min]=0.167mol•L-1•min-1,故答案为:0.167mol•L-1•min-1;
(2)该反应放热,升高温度,平衡逆向移动,生成物浓度减少,故答案为:c;
(3)若加入I2,平衡正向移动,H2浓度减少,故答案为:f;
(4)H2(g)+I2(g)⇌2HI(g),反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小,碘化氢浓度减小一半为0.25mol/L,画出的变化图象如图: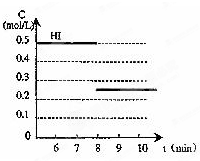 ,故答案为:
,故答案为:
点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的影响因素.
考点点评: 本题主要考查了平衡常数、化学平衡移动以及化学反应速率的计算,难度不大,注意化学平衡常数K只与温度有关.1年前查看全部
- 在体积为2L的密闭容器中合成氨,已知在时间t内,氨的物质的量增加了0.6mol,在此时间内,用H 2 表示的平均反应速率
在体积为2L的密闭容器中合成氨,已知在时间t内,氨的物质的量增加了0.6mol,在此时间内,用H 2 表示的平均反应速率是0.45mol/(L•s),则t是( ) A.0.44s B.1s C.1.33s D.2s  冰糕喳喳1年前1
冰糕喳喳1年前1 -
 李小丫 共回答了20个问题
李小丫 共回答了20个问题 |采纳率95%发生反应为N 2 +3H 3 ⇌2NH 3 ,
速率之比等于化学计量数之比,所以υ(NH 3 )=
2
3 υ(H 2 )=
2
3 ×0.45mol/(L•s)=0.3mol/(L•s),
故反应时间t=
△c
v =
0.6mol
2L
0.3mol/(L•s) =1s,
故选B.1年前查看全部
- 在标准状况下.由CO和CO2组成的混合气体0.6mol.其质量为24g.其混合气体中C和O两种原子的物质的量之比是
 兰儿12201年前1
兰儿12201年前1 -
 翟米恰布 共回答了18个问题
翟米恰布 共回答了18个问题 |采纳率94.4%是4比5吧.基础点,设CO为Xmol,CO2为Ymol,X+Y=0.6,28X+44Y=24,解得X为0.45,Y为0.15,那么C,O比就可求出了.好了给点支持吧!1年前查看全部
- 某生物实验小组需配置1升含钾离子、钠离子、硝酸根离子、硫酸根离分别为0.2mol,1.2mol,0.6mol ,0.4m
某生物实验小组需配置1升含钾离子、钠离子、硝酸根离子、硫酸根离分别为0.2mol,1.2mol,0.6mol ,0.4mol的营养液,则配置这种营养液,需要哪些物质?物质的量分别为多少?(所用药品不能超过三种,并写出解题过程)
我只剩这个问题了
 dishy211年前1
dishy211年前1 -
 stupid2000 共回答了19个问题
stupid2000 共回答了19个问题 |采纳率84.2%几种离子组成的物质可能为Na2SO4,K2SO4,NaNO3,KNO3,硫酸根0.4,则不管是Na2SO4还是K2SO4,阳离子应为0.8,硝酸根离,0.6,则不管是NaNO3还是KNO3,阳离子应为0.6.所以任意两种组合是不行的,所以至少三种,而又有要求所用药品不能超过三种,所以用三种来假设,1.硫酸根Na2SO4,K2SO4都存在,则NaNO3,KNO3只能存在一种,用硝酸根做突破口,则知Na2SO4,K2SO4,KNO3不行,Na2SO4,K2SO4,NaNO3,用硝酸根做突破口NaNO3 0.6,则Na2SO4 0.3,K2SO4 0.1成立.
2.NaNO3,KNO3都存在,则Na2SO4,K2SO4只能存在一种,用硫酸根做突破口,NaNO3,KNO3,K2SO4不成立,NaNO3,KNO3,Na2SO4,用硫酸根做突破口,Na2SO4 0.4,则NaNO3 0.4,KNO3 0.2成立.
所以结论:1.NaNO3 0.6,Na2SO4 0.3,K2SO4 0.1
2.Na2SO4 0.4,NaNO3 0.4,KNO3 0.21年前查看全部
- 把7.4g小苏打和Na2CO3*H2O组成的混合物溶于水制成100ml溶液,其中c(Na+)=0.6mol*L-1.若将
把7.4g小苏打和Na2CO3*H2O组成的混合物溶于水制成100ml溶液,其中c(Na+)=0.6mol*L-1.若将等质量的该混合物加热至恒重,则该混合物的质量减少了()?
为什么碳酸钠0.03mol yangzoe1年前2
yangzoe1年前2 -
 吴亮亮 共回答了13个问题
吴亮亮 共回答了13个问题 |采纳率84.6%很高兴为您解答.
7.4g小苏打和水合碳酸钠中含有0.1*0.6=0.06mol的钠,那么,如果这部分钠全部是碳酸钠的话(加热后的最终形态),则有0.03mol的碳酸钠,也就是0.03*106=3.18g,所以加热后质量会减少7.4-3.18=4.22g
以上为16:30分答案
以下为您补充问题后我补充之
我们已经求得钠的摩尔数是0.06mol,这点您可以理解吗?那么,碳酸钠是Na2CO3,也就是说,1mol碳酸钠有2mol的钠,现在有钠0.06mol,自然就有0.03mol 的碳酸钠.至于为什么最后是碳酸钠您应该可以理解吧:小苏打,也就是碳酸氢钠,加热分解为碳酸钠,水和二氧化碳.而Na2CO3*H2O加热分解也是碳酸钠,在分解过程中钠并没有流失,终产物都是碳酸钠.
这样,您明白了吗?若明白,请采纳我的回答,1年前查看全部
- 镁带在空气中燃烧的全部产物(MGO MG3N2)溶解在100ML 2.2MOL/L的盐酸中.在以50ML 0.6mol/
镁带在空气中燃烧的全部产物(MGO MG3N2)溶解在100ML 2.2MOL/L的盐酸中.在以50ML 0.6mol/l的NAOH 溶液中和多余的HCL,然后在此溶液中加入过量的NAOH把NH3正出,并用足量HCL吸收,测得NH3的质量为0.51,则镁带的质量为
2 [Mg] + 6 [Mg3N2] =0.19
2 [Mg3N2] =0.03
得到 [Mg]=0.05
[Mg3N2]=0.015
得到镁带质量 2.28 g 13CCC101年前1
13CCC101年前1 -
 sunyinan 共回答了26个问题
sunyinan 共回答了26个问题 |采纳率84.6%第一个公式错了,mg3n2与盐酸反应生成的NH3也会消耗盐酸,故一mol的mg3n2消耗8mol盐酸.应该为:2 [Mg] + 8 [Mg3N2] =0.19
嗯,就是这样.1年前查看全部
- 将0.2mol硝酸银、0.4mol硝酸铜、0.6mol氯化钾溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一
将0.2mol硝酸银、0.4mol硝酸铜、0.6mol氯化钾溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3mol铜,此是在另一极上产生的气体体积(标准状况)为多少( )
A. 4.48L
B. 5.6L
C. 6.72L
D. 7.84L qazqazq1年前3
qazqazq1年前3 -
 夜鹰01 共回答了19个问题
夜鹰01 共回答了19个问题 |采纳率100%解题思路:将0.2mol硝酸银、0.4mol硝酸铜、0.6mol氯化钾溶于水,配成100mL溶液,混合后银离子与氯离子发生反应,生成氯化银沉淀,依据离子方程式判断剩余离子类别和物质的量,依据放电顺序结合阴极与阳极得失电子守恒计算生成气体的物质的量,据此解答.将0.2mol硝酸银、0.4mol硝酸铜、0.6mol氯化钾溶于水,配成100mL溶液,混合后银离子与氯离子发生反应,Ag++Cl-=AgCl↓,反应后溶液中还剩0.4molCu2+和0.4molCl-,
阴极电极反应式为:Cu2++2e-=Cu,析出0.3mol铜,转移电子数为0.6mol;
阳极电极反应式:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑;依据得失电子守恒:
2Cl--2e-=Cl2↑,
2 2 1
0.4mol 0.4mol 0.2mol
4OH--4e-=2H2O+O2↑;
41
0.6mol-0.4mol0.05mol
所以产生氯气0.2mol,产生氧气0.05mol;
气体标况下体积V=0.25mol×22.4L/mol=5.6L,
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,为高考常见题型,明确电解原理、熟记离子的放电顺序为解答该题的关键,难度不大.1年前查看全部
- 在一定条件的2L密闭容器中,3H2+N2=2NH3反应,在10s内反应物N2物质的量由1mol降到0.6mol则则v(N
在一定条件的2L密闭容器中,3H2+N2=2NH3反应,在10s内反应物N2物质的量由1mol降到0.6mol则则v(NH3)为
 423431年前2
423431年前2 -
 130140555 共回答了22个问题
130140555 共回答了22个问题 |采纳率90.9%0.04mol/(s*L)1年前查看全部
- 在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)⇌2NH3(g)△H<0
(1)该反应450℃的平衡常数______500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是______
a.3v正(H2)=2v逆(NH3)b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度不随时间而变化d.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率v(N2)为______mol/(L•min)
(4)保持其他条件不变,若初始投入量为amolN2、bmolH2、cmolNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式:a+[c/2]=0.2,b+[3c/2]=0.6a+[c/2]=0.2,b+[3c/2]=0.6;
(5)第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,则平衡______移动(填“向正反应方向”“向逆反应方向”或“不”). 5279201年前1
5279201年前1 -
 车上车下 共回答了14个问题
车上车下 共回答了14个问题 |采纳率100%解题思路:(1)对于放热反应,温度越高,平衡常数越小;
(2)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(3)根据化学反应速率公式v=[△c/△t]来计算反应速率;
(4)根据极限转化的思想结合等效平衡知识来解决;
(5)根据增大反应物浓度化学平衡向着正反应方向进行来回答.(1)该反应是放热的,对于放热反应,温度越高,平衡常数越小,所以450℃的平衡常数>500℃时的平衡常数,故答案为:>;
(2)a.化学反应速率之比等于系数之比,当2v正(H2)=3v逆(NH3)才证明平衡,故a错误;
b.容器中气体的平均相对分子量M=[m/n],n对于该反应来说是变化的,当n不变化了,即M不变化了,达到平衡,故b正确;
c.容器中气体的密度ρ=[m/V],密度始终是不随时间而变化的一个定值,故c错误;
d.容器中气体的分子总数不随时间而变化证明各组分浓度保持不变了,故d正确;
故选bd;
(3)第5分钟时达到平衡,测得NH3的物质的量为0.2mol,所以减小的氮气物质的量为0.1mol,v(N2)=
0.1mol
2L
5min=0.01mol/(L•min),故答案为:0.01;
(4)初始投入量为amolN2、bmolH2、cmolNH3,极限转化为氮气和氢气,相当于投料为:(a+[c/2])mol的氮气和(b+[3c/2])mol的氢气,得到与上述相同的平衡,则a+[c/2]=0.2,b+[3c/2]=0.6,故答案为:a+[c/2]=0.2,b+[3c/2]=0.6;
(5)第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,相当于增大了反应物的浓度,增大反应物浓度化学平衡向着正反应方向进行,故答案为:正反应方向.点评:
本题考点: 化学平衡状态的判断;反应速率的定量表示方法;用化学平衡常数进行计算.
考点点评: 本题涉及化学反应速率的计算、平衡状态的判断以及化学平衡的有关计算知识,可以根据所学知识来回答,难度不大.1年前查看全部
- 1.由氧气和氮气组成的总压为100kPa的混合气体中,已知氧气的物质的量为0.6mol,氮气物质的量为0.4mol,则氧
1.由氧气和氮气组成的总压为100kPa的混合气体中,已知氧气的物质的量为0.6mol,氮气物质的量为0.4mol,则氧气的分压是多少Pa ,氮气的分压为多少Pa?
2.在HAc水溶液中存在有什么分子和什么离子?
3.查表得
Ksp (CdS)=1.40*10的-29 (CUS)=1.27*10的-26
(ZnS)=2.93*10的-25 (FeS)=6.3*10的-18
则往体积和浓度分别为10mol和0.1mol/L 的 CdSO4、ZnSO4、(NH4)2FeSO4水溶液中滴加0.01mol*L-1 Na2S 产生沉淀从先到后的顺序依次为 1.__、2.__、3.__、4.__.
4.多电子原子主量子数n=3 的电子层中有几个能级,该电子层最多可容纳多少个电子?
5.8号元素氧的基态核外电子排布式为_____; 有多少个未成对电子?
6.查表得298K时,Ksp,caco3 = 4.96*10的-9,往盛有1.0L纯水中加入0.1ml浓度为1.0mol/L的CaCl2和Na2CO3,有没沉淀生成,(有 / 无)
7.s轨道的角量子数1=0 (是 / 不是)
8.配合物(NH4)2[HgCl4]的称为什么?中心离子是什么?
配离子[Cu(NH3)4]2+ 的名称为什么?配原子是什么?配位体个数为?
计算题.
1.计算0.1mol * L-1 HAc 水溶液的pH值.已知Ka(HAc)=1.75*10的-5 求pH. QQ4392390931年前1
QQ4392390931年前1 -
 java_bin 共回答了14个问题
java_bin 共回答了14个问题 |采纳率100%1、氧的分压:100*0.6/1=60kPa,氮气分压:100-60=40Kpa
2、水分子、HAc分子、H+、OH-、Ac-
3、CdSCuSZnSFeS
4、9个能级、18个电子
5、1s2 2s2 2p4,2个未成对电子
6、有沉淀
7、正确
8、氯化氨基汞,汞离子,铜氨络合离子,配原子是氮,配体个数4
计算题:
X^2/(0.1-x)=1.75exp-5,解得X=0.01322
pH=-log0.01322=1.881年前查看全部
- 1.甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N2 0.6mol,H2 0.5mol,
1.甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N2 0.6mol,H2 0.5mol,在一定温度下进行N2(g)+3H2(g)2NH3(g) △H=- 92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.(1) 该温度时乙容器中平衡体系的平衡常数是_________________.(2) 若保持甲容器的温度和压强不变,向甲容器的平衡体系再中通入0.9mol N2,则平衡将________(填“正向”、“逆向”或“不”)移动.
只看第二问,为啥逆向移动?
2.
若室温下BaSO4的溶度积常数Ksp(BaSO4)=1.1×10-7;又知Ksp(BaCO3)=2.6×10-6,欲使 BaSO4转化为碳酸盐,方法是将BaSO4置于Na2CO3溶液中并不断搅拌.(1)请计算此转化的平衡常数 ; (2)若用1.0 LNa2CO3溶液将0.010mol的BaSO4完全溶解,则Na2CO3溶液的最初浓度不得低于________________(填写字母)mol/L.a.0.24 b.0.25 c.0.34 d.0.35
这个怎么算? kelly20002001年前1
kelly20002001年前1 -
 q96169we 共回答了24个问题
q96169we 共回答了24个问题 |采纳率87.5%1、第一次平衡时,容器中组成为0.5molN2,0.2molH2,0.2molNH3,体积为1L,平衡常数K=10充入0.9molN2之后,若要保持压强不变,则体积会变大成为2L各物质浓度变为0.7mol/LN2,0.1mol/LH2,0.1mol/LNH3,浓度积k=14.3>K,所以平衡...1年前查看全部
- 0.6mol氧和0.4mol臭氧的质量___(相等,或不相等,下同)_,它们所含的分子数____,所含的原子数____
 红色星空1年前3
红色星空1年前3 -
 黑雪石 共回答了14个问题
黑雪石 共回答了14个问题 |采纳率85.7%0.6*32
0.4*48如果得数相等就相等
分子数不等!
0.6*2=0.4*3相等1年前查看全部
- 化合物中一种元素的物质的量和整个化合物的关系 例如 某种氯化物Mcl2 CL离子的物质的量为0.6mol 那0.6mol
化合物中一种元素的物质的量和整个化合物的关系 例如 某种氯化物Mcl2 CL离子的物质的量为0.6mol 那0.6mol
与整个氯化物有什么关系 加我1103150835 讲得明白400全给你 出手快1年前3
出手快1年前3 -
 marcofeng 共回答了26个问题
marcofeng 共回答了26个问题 |采纳率92.3%你可以这样理解,1mol的Mcl2就是由NA个Mcl2分子,我们知道每一个Mcl2分子又有一个M和2个cl组成,这样我们就知道在NA个Mcl2分子中有NA个M原子和2NA个cl原子组成,也就是1mol的Mcl2中含有1mol的M和2mol的cl.1年前查看全部
- 100ml0.6mol/L Al3Cl3溶液与200mL NaOH溶液混合后,得到3.9g白色沉淀,NaOH溶液的浓度为
 夜_色1年前1
夜_色1年前1 -
 老谭仙生 共回答了12个问题
老谭仙生 共回答了12个问题 |采纳率83.3%氯化铝的物质的量=0.1*0.6=0.06摩尔
生成的沉淀是氢氧化铝,3.9克氢氧化铝的物质的量=3.9/78=0.05mol
分两种情况:
一、NaoH完全反应,Alcl3有剩余.
AlCl3---3NaOH-----Al(OH)3
1 3 1
0.05 0.15 0.05
NaOH溶液的浓度=0.15/0.2=0.75mol/L
二.NaoH过量,先完全沉淀,再溶解部分.
AlCl3---3NaOH-----Al(OH)3
1 3 1
0.06 0.18 0.06
生成沉淀0.06摩尔,再溶解0.06-0.05=0.01摩尔
Al(OH)3----NaOH-----NaAlO2
1 1 1
0.01 0.01 0.01
需要氢氧化钠总的物质的量=0.18+0.01=0.19摩尔
NaOH溶液的浓度=0.19/0.2=0.95mol/L1年前查看全部
- 在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)
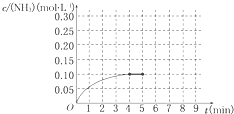 在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:
在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:
(1)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______(填字母序号).
A.0.20mol•L-1 B.0.12mol•L-1
C.0.10mol•L-1 D.0.08mol•L-1
(2)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡______移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数______(填“增大”、“减小”或“不变”).
(3)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol•L-1).请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线. 彬彬囡囡1年前1
彬彬囡囡1年前1 -
 hsp1970 共回答了17个问题
hsp1970 共回答了17个问题 |采纳率82.4%解题思路:(1)根据温度对化学平衡的影响分析;
(2)根据压强对化学平衡的影响分析;根据影响化学平衡常数的因素分析;
(3)先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图.(1)该反应是可逆反应,所以反应物不能完全转化为生成物,所以氨气的浓度不可能为0.20mol/L;Q>0,所以该反应是放热反应,升高温度,平衡向逆反应方向移动,降低温度,平衡向正反应方向移动,所以氨气的浓度不可能为0.10mol/L,故选AC,
故答案为:AC;
(2)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变,
故答案为;向正反应方向;不变;
(3)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L,所以第5分钟末到此平衡时NH3浓度的变化曲线为: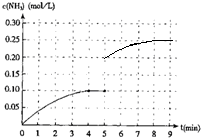 ,故答案为:
,故答案为: .
.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡建立的过程.
考点点评: 本题考查了化学反应速率的定量表示方法、化学平衡常数、化学平衡的影响因素等知识点,同一化学反应中化学平衡常数只与温度有关,与反应物、生成物的浓度无关.1年前查看全部
- 反应A(g)+3B(g)⇌2C(g)在2L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是
反应A(g)+3B(g)⇌2C(g)在2L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是( ) A.v(A)=0.005mol•L -1 •s -1 B.v(C)=0.02 mol•L -1 •s -1 C.v(B)=0.03mol•L -1 •s -1 D.v(A)=0.01 mol•L -1 •s -1  chaoran2581年前1
chaoran2581年前1 -
 老PIA 共回答了8个问题
老PIA 共回答了8个问题 |采纳率100%2L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,则:v(C)=
0.6mol
2L
30s =0.01mol/(L•s),
A、速率之比等于化学计量数之比,故v(A)=
1
2 v(C)=
1
2 ×0.01mol/(L•s)=0.005mol/(L•s),故A正确;
B、v(C)=
0.6mol
2L
30s =0.01mol/(L•s),故B错误;
C、速率之比等于化学计量数之比,故v(B)=
3
2 v(C)=
3
2 ×0.01mol/(L•s)=0.015mol/(L•s),故C错误;
D、速率之比等于化学计量数之比,故v(A)=
1
2 v(C)=
1
2 ×0.01mol/(L•s)=0.005mol/(L•s),故D错误;
故选A.1年前查看全部
- (1)0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃的分子式为______,若该烃不能使溴
(1)0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃的分子式为______,若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则此烃的结构简式为______,名称是______.
(2)1-丁炔与过量溴加成后产物的结构简式是______,与1-丁炔属于同系物的且所含碳原子数最少的有机物是______,它能发生______反应(填反应类别)制成导电塑料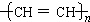 ,这是21世纪具有广阔前景的合成材料.
,这是21世纪具有广阔前景的合成材料.  泪流干的鱼1年前1
泪流干的鱼1年前1 -
 书林林 共回答了20个问题
书林林 共回答了20个问题 |采纳率85%解题思路:(1)根据C元素、H元素守恒确定该烃的分子式为C6H12;该烃的分子式为C6H12,不饱和对为1,若该烃不能使溴水或高锰酸钾溶液褪色,说明烃中苯环不饱和键,该烃为环烷烃,其一溴取代物只有一种,说明分子中只有一种H原子,该烃为环己烷;
(2)1-丁炔能与溴1:2发生加成反应生成1,1,2,2-四溴丁烷;炔烃中碳原子数最少的有机物是乙炔,能发生加聚反应.(1)n(烃):n(C):n(H)=n(烃):n(CO2):2n(H2O)=0.1mol:0.6mol:0.6mol×2=1:6:12,即1个分子中含有6个C原子、12个H原子,故该烃的分子式为C6H12;
该烃的分子式为C6H12,不饱和度为1,若该烃不能使溴水或高锰酸钾溶液褪色,说明烃中苯环不饱和键,故该烃为环烷烃,其一溴取代物只有一种,说明分子中只有一种H原子,该烃为环己烷,结构简式为 ,
,
故答案为:C6H12; ;环己烷;
;环己烷;
(2)1-丁炔能与溴1:2发生加成反应生成1,1,2,2-四溴丁烷,结构简式为CHBr2CBr2CH2CH3;
炔烃中碳原子数最少的有机物是乙炔,能发生加聚反应,生成导电塑料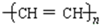 ;
;
故答案为:CHBr2CBr2CH2CH3;乙炔;加聚.点评:
本题考点: 有关有机物分子式确定的计算;有机物分子中的官能团及其结构.
考点点评: 本题主要考查了有机物的结构与性质、有机反应类型的判断,题目难度中等,注意掌握常见有机物的结构与性质,明确有机反应原理及反应类型.1年前查看全部
- 混合溶液的ph值0.02dm3 0.6mol/dm3 的氨水和0.01dm3 1.8mol/dm3的NH4CL混合,求混
混合溶液的ph值
0.02dm3 0.6mol/dm3 的氨水和0.01dm3 1.8mol/dm3的NH4CL混合,求混合液的ph值.已知K θ(θb,nh3)=1.77*10 -5(-5次方)打不出来. 隋vv1年前1
隋vv1年前1 -
 yongyou110 共回答了10个问题
yongyou110 共回答了10个问题 |采纳率90%pH=14-pKb+lg[0.02*0.6]/[0.01*1.8]1年前查看全部
- 0.6mol的o2与质量为多少克的o3所含的原子个数相等?
 朗朗天上一颗星1年前1
朗朗天上一颗星1年前1 -
 无为之爱 共回答了18个问题
无为之爱 共回答了18个问题 |采纳率88.9%19.21年前查看全部
- 0.6mol Ba(OH)2中,含有OH根离子的数目是多少?Ba2+的个数呢?
 verdish1年前1
verdish1年前1 -
 逆子天 共回答了23个问题
逆子天 共回答了23个问题 |采纳率87%0.6mol Ba(OH)2中含有 0.6×6.02×10^23个Ba2+,含有 1.2×6.02×10^23个OH-,请点击下面的“采纳答案”按钮,送咱一朵小 红花鼓励下吧!1年前查看全部
- 在标准状况下.由CO和CO2组成的混合气体0.6mol.其质量为24g.其混合气体中C和O两种原子的物质的量之比是
 dcrzxc1年前1
dcrzxc1年前1 -
 tyfkof 共回答了30个问题
tyfkof 共回答了30个问题 |采纳率76.7%co为xmol co2为ymolx+y=13.44/22.428x+44y=20x=0.4y=0.2碳/氧=(0.4+0.2)/(0.4+0.2*2)=3/41年前查看全部
- 0.2mol二氧化锰和0.6mol盐酸混合加热,加入硝酸银,为什么沉淀的物质的量大于0.3mol
 函哲1年前2
函哲1年前2 -
 lc_freely 共回答了19个问题
lc_freely 共回答了19个问题 |采纳率89.5%MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
0.2molMnO2与0.6mol盐酸反应,MnO2过量,盐酸不足
0.6molHCl如果完全反应,生成0.15mol的MnCl2,0.15mol的Cl2
0.15molMnCl2加入硝酸银,理论上应该生成0.3molAgCl沉淀
但是实际上生成沉淀多于0.3mol
因为MnO2只能与浓盐酸反应,在反应过程中,HCl浓度不断减小,所以到了后期盐酸浓度比较低的时候,反应已经停止了,那么生成氯气的量就会少于0.15mol,由于体系中的氯元素只以氯气和氯离子的形式存在,氯气少了,那么氯离子就多了,所以生成氯化银沉淀比“理论值”多1年前查看全部
- 现有NO2,NH3,O2三种混合气体共0.6mol,通过足量的HNO3溶液中,溶液质量增加了23.3g,气体全部被吸收,
现有NO2,NH3,O2三种混合气体共0.6mol,通过足量的HNO3溶液中,溶液质量增加了23.3g,气体全部被吸收,求混
和气体中的每种成分的体积,在标况下. 醉蝶鱼1年前1
醉蝶鱼1年前1 -
 小小依怜 共回答了13个问题
小小依怜 共回答了13个问题 |采纳率92.3%设NO2为xmol,NH3为ymol,O2为zmol
4NO2 + O2+2H2O=4HNO3 Δm
3mol 1mol 4*46+32=216
x mol x/4mol 216x/4
216x/4 + 17y=23.3
x+x/4+y=0.6
解之即得1年前查看全部
- 下列情况中,含微粒数最多的是A 1mol氮气中的氮原子B 0.5molNH4+中的电子C 0.6molH2SO4中的氧原
下列情况中,含微粒数最多的是
A 1mol氮气中的氮原子
B 0.5molNH4+中的电子
C 0.6molH2SO4中的氧原子
D 1molNa所含的质子数 爱说话的人啦1年前2
爱说话的人啦1年前2 -
 gw2910 共回答了20个问题
gw2910 共回答了20个问题 |采纳率85%D 1molNa所含的质子数1年前查看全部
- 用分解氯酸钾的方法制氧气,制取0.6mol氧气需要多少克的氯酸钾?这些氯酸钾与多少克硫酸所含的氧原子数相同?
 myiskcsj1年前1
myiskcsj1年前1 -
 yuyismillxy 共回答了19个问题
yuyismillxy 共回答了19个问题 |采纳率100%2kclo3=2kcl+3o2
0.4mol 0.6mol
m(kclo3)=0.4mol*(39+35.5+16*3)=49g
其中含有O0.4mol*3=1.2mol
H2SO4中含有1.2mol O 的话,需要0.3molH2SO4,m(h2so4)=0.3mol*98g/mol=29.4g1年前查看全部
- 1L浓度为1mol•L-1的NaOH溶液吸收0.6mol CO2,
1L浓度为1mol•L-1的NaOH溶液吸收0.6mol CO2,
所得溶液中 和 的物质的量浓度(不考虑离子的水解)之比是( )
A.1∶1 B.1∶2 C.2∶1 D.2∶3 黄昏雨疏1年前0
黄昏雨疏1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 高中化学 ph计算 25度时,100ml0.4mol/ml盐酸与等体积0.6mol/ml
高中化学 ph计算 25度时,100ml0.4mol/ml盐酸与等体积0.6mol/ml
氢氧化钠混合 ,溶液ph为
 彩mm贝1年前1
彩mm贝1年前1 -
 ledphantom 共回答了12个问题
ledphantom 共回答了12个问题 |采纳率91.7%HCl为0.4x0.1=0.04mol,NaOH为0.6x0.1=0.06mol
所以NaOH过量,反应后OH-剩余,溶液显碱性.
应该计算OH-:
c(OH-)=n(OH-) / V(总)=(0.06-0.04) / (0.1+0.1)=0.1mol/L
所以 c(H+)=10-13 mol/L,则PH=131年前查看全部
- 有五瓶溶液分别为 10ml0.6mol/L NAOH水溶液,20ml0.5mol/L H2SO4水溶液,30ml 0.4
有五瓶溶液分别为 10ml0.6mol/L NAOH水溶液,20ml0.5mol/L H2SO4水溶液,30ml 0.4mol/L HCL水溶液 ,40ml 0.3mol/L CH3COOH水溶液,50ml 0.2mol/L蔗糖水溶液,以上各瓶溶液中所含离子,分子总数的大小顺序是?(求详细说明.)
 chenwei0031年前1
chenwei0031年前1 -
 zdl2yh 共回答了13个问题
zdl2yh 共回答了13个问题 |采纳率84.6%10ml0.6mol/L NAOH 10*0.6*2==12
20ml0.5mol/L H2SO4 20*0.5*3=30
30ml 0.4mol/LHCL 30*0.4*2=24
40ml 0.3mol/L CH3COOH 40*0.3*x==x很小 CH3COOH是个弱酸,只有很少CH3COOH的电离出离子了
50ml 0.2mol/L蔗糖 蔗糖非电解质,木有电离出离子 ,就是水电离出极少的离子
所以 从多到少为:H2SO4 > HCL > NAOH > CH3COOH > 蔗糖1年前查看全部
- 在一定温度下将CO和水蒸气各1mol放在密闭容器中反应:CO+H2O⇌CO2+H2,达平衡后测得CO2为0.6mol.再
在一定温度下将CO和水蒸气各1mol放在密闭容器中反应:CO+H2O⇌CO2+H2,达平衡后测得CO2为0.6mol.再通入4mol水蒸气,达到新的平衡后,CO2的物质的量为( )
A.0.6mol
B.1mol
C.>1mol
D.0.6mol<n(CO2)<1mol cjlcjl0011年前1
cjlcjl0011年前1 -
 吕一鸣 共回答了25个问题
吕一鸣 共回答了25个问题 |采纳率84%解题思路:反应CO+H2O(g)⇌CO2+H2达平衡后,加入水蒸气,化学平衡会向着正反应方向进行,但是反应物不可能全部转化为生成物.根据题意:CO+H2O(g)⇌CO2 +H2,
初始物质的量:11 0 0
变化物质的量:0.60.60.6 0.6
平衡物质的量:0.40.40.6 0.6
此时二氧化碳和氢气的物质的量之和是1.2mol,再通入4mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各0.4mol,此时CO2的物质的量1mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2的物质的量介于0.6mol-1mol之间.
故选D.点评:
本题考点: 化学反应的可逆性.
考点点评: 本题考查学生可逆反应的特征以及化学平衡移动方面的知识,注意知识的积累是解题的关键,难度不大.1年前查看全部
- 2A+3B=C+2D 1分钟过后 在2l的容器里 C增加了0.6mol 求A B C 的反应速率 将就点手打的.
 gdsspt1年前4
gdsspt1年前4 -
 33你好48 共回答了15个问题
33你好48 共回答了15个问题 |采纳率80%V(C) = 0.6mol/(2LX1min)=0.3mol/(L.min)
再根据反应速率之比等于化学方程式系数之比
V(A) =0.6mol/(L.min)
V(B) =0.9mol/(L.min)1年前查看全部
- 溶液的pH计算等体积的0.1mol/L盐酸与0.6mol/LBa(OH)2溶液混合后,溶液的pH等于多少解题思路:0.1
溶液的pH计算
等体积的0.1mol/L盐酸与0.6mol/LBa(OH)2溶液混合后,溶液的pH等于多少
解题思路:0.1mol/L的酸和碱恰好中和,而碱多出了0.2mol/L,于是就按多出的碱来计算溶液中氢离子的浓度,最后求出pH
但是我的问题是:如果按照(盐酸中氢离子浓度再加上Ba(OH)2溶液中的氢离子浓度)/2,求出氢离子浓度,最后同样可以算出pH,为什么这样做就不行?
为什么0.1mol/L的酸和碱恰好中和就不再考虑了?是因为呈中性了还是因为pH=7?可是pH=7不是必须氢离子浓度要等于10^(-7) 那盐溶液中的氢离子浓度不一定就是这么多啊?这又是怎么回事? 西贝月1年前2
西贝月1年前2 -
 didizi 共回答了19个问题
didizi 共回答了19个问题 |采纳率89.5%一部分氢离子与氢氧根离子反应了生成水了1年前查看全部
- 将38.4gCu完全溶于足量浓HNO3溶液中,收集到氮的氧化物(NO、NO2、N2O4)混合气体共0.6mol,将这些气
将38.4gCu完全溶于足量浓HNO3溶液中,收集到氮的氧化物(NO、NO2、N2O4)混合气体共0.6mol,将这些气体完全通入烧碱溶液充分反应后,共消耗NaOH0.7mol.(有关反应①N2O4=2NO2②2NO2+2NaOH=NaNO2+NaNO3+H2O③NO+NO2+2NaOH=2NaNO2+H2O)试计算:
(1).Cu与HNO3反应后消耗HNO3的物质的量
(2).原0.6mol混合气体中各气体的物质的量
(3).最终溶液中生成的NaNO2的物质的量 衣服裤子鞋子1年前3
衣服裤子鞋子1年前3 -
 kylin_tang 共回答了13个问题
kylin_tang 共回答了13个问题 |采纳率84.6%1.根据N原子守恒做.
HNO3最后都转化为Cu(NO3)2,NaNO3和NaNO2,nN=nHNO3=1.2+0.7=1.9mol
+2 +4 +4
2.设XmolNO,YmolNO2,ZmolN2O4
nCu=38.4/64=0.6mol
nē(电子)=0.6*2=1.2mol
根据电子守恒(原来HNO3中N是+5价):3X+Y+2Z=1.2
X+Y+2Z=0.7
∵原来n总=0.6mol
∴X+Y+Z=0.6
3X+Y+2Z=1.2
X+Y+2Z=0.7
X+Y+Z=0.6
得出:X=0.25 Y=0.25 Z=0.1
3.N2O4=2NO2
0.1 0.2
后面的nNO2=0.25+0.2=0.45mol
NO+NO2+2NaOH=2NaNO2+H2O
0.25 0.25 0.5
2NO2+2NaOH=NaNO2+NaNO3+H2O
0.2 0.1
∴nNaNO3=0.6mol1年前查看全部
- 某金属氧化物有MCL2有40.5克,含有0.6mol的cl离子,则该氧化物的摩尔质量为几?金属M的相对原子质量为几?
 蓝心透1年前1
蓝心透1年前1 -
 tianxie6677 共回答了20个问题
tianxie6677 共回答了20个问题 |采纳率90%40.5克MCl2,其中含有0.6mol的Cl-也就是0.6×35.5=21.3g,0.6÷2=0.3mol的MCl2,含有M的物质的量为0.3摩尔,质量为40.5-21.3=19.2g,所以M的摩尔质量为19.2g÷0.3mol=64g/mol,也就是M的相对原子质量为64.1年前查看全部
- 反应速率浓度4A(S)+3B(G)=2C(G)+D(G)经2分钟,B的浓度减少0.6MOL每L用A表示的反应速率为?在这
反应速率浓度
4A(S)+3B(G)=2C(G)+D(G)经2分钟,B的浓度减少0.6MOL每L
用A表示的反应速率为?
在这两分钟内用B和C表示的反应速率都是逐渐减小的,为什么? 烟花绚丽1年前4
烟花绚丽1年前4 -
 莲花山南 共回答了17个问题
莲花山南 共回答了17个问题 |采纳率94.1%vB=△c/△t=0.6/2=0.3mol/(L*min)
在可逆反应中的各物质的反应速率之比等于它前面的化学计量数之比.所以,用A来表示:0.3*(4/3)=0.4mol/(L*min)
第二句话什么意思?1年前查看全部
- 弱酸和强碱弱酸盐混合求PHHX的Ka=6×10^-7,在含有0.6mol/lHX和0.9mol/l的NaX溶液中,其氢离
弱酸和强碱弱酸盐混合求PH
HX的Ka=6×10^-7,在含有0.6mol/lHX和0.9mol/l的NaX溶液中,其氢离子的浓度约为多少,答案是4×10^-7mol/l. 女人抓住俺把柄1年前0
女人抓住俺把柄1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (1/2)现向Cu、Cu2O、CuO组成的混合中通入0.6mol硝酸恰好使混合物溶解,同时收集到0.1molNO ,若将
(1/2)现向Cu、Cu2O、CuO组成的混合中通入0.6mol硝酸恰好使混合物溶解,同时收集到0.1molNO ,若将上述...
(1/2)现向Cu、Cu2O、CuO组成的混合中通入0.6mol硝酸恰好使混合物溶解,同时收集到0.1molNO ,若将上述混合物用足量的氢气加 工5551年前1
工5551年前1 -
 幸福向日葵 共回答了9个问题
幸福向日葵 共回答了9个问题 |采纳率77.8%HNO3中的N转化为NO和Cu(NO3)2 Cu(NO3)2为(0.6-0.1)/2=0.25mol Cu元素全部转化为Cu(NO3)2,那么总Cu也0.25mol.HNO3中的H全部转化为H2O 为0.6/2=0.3mol
(1/2)1年前查看全部
- 实验室用铜与稀硝酸反应制取NO气体,若反应中转移电子数目的物质的量为0.6mol,计算被还原的HNO3的物质的量
 选择性骂人1年前1
选择性骂人1年前1 -
 beus600 共回答了17个问题
beus600 共回答了17个问题 |采纳率100%HNO3→NO
1molHNO3还原成NO得到3mol电子,N元素化合价降低3价,所以当转移电子的物质的量为0.6mol时,有0.2molHNO3被还原.1年前查看全部
- 0.1mol单甘油酯完全氢化消耗0.6mol,说明每个不饱和脂肪酸上有2个双键.
0.1mol单甘油酯完全氢化消耗0.6mol,说明每个不饱和脂肪酸上有2个双键.
这是为什么呢?一个双键需要2个H,2个双键需要4个H啊 媳妇至尊宝1年前2
媳妇至尊宝1年前2 -
 ytjrtjhe 共回答了24个问题
ytjrtjhe 共回答了24个问题 |采纳率95.8%单甘油酯的通式为:
R-COOCH2
R-COOCH
R-COOCH2(其中右边的CH2、CH、CH2中三个碳原子是连接起来的)
假设每个RCOOH中含有一个双键,因为一分子中有三个RCOOH,所以要加成3分子氢气.
而这里0.1mol要加成0.6mol氢气,则说明每个单甘油酯上有6个碳碳双键.则每个不饱和脂肪酸上有2个双键.1年前查看全部
- 0.6mol NH4分子中含有原子数与()gH2O分子中所含有的原子数相等
 genans1年前1
genans1年前1 -
 top1000 共回答了21个问题
top1000 共回答了21个问题 |采纳率90.5%18g即1mol1年前查看全部
大家在问
- 1求例析用十字相乘法解含未知参数的一元二次方程.
- 2你只属于我的英语怎么说?有人说是Only belongs to me这样的.到底哪个才是对的啊.SOS.
- 3求我的母亲丰子恺答案
- 4[生物]蚂蚁能看见光线么?对光线敏感么?
- 5Minute is a summarized or condensed record of what has taken
- 6连词成句,以下1、hart ,your,does,nost?2、will ,you,better ,feel,soon.
- 7电阻型号为1243的电阻有多大
- 8My favourite animal is dog.dog前可以加a吗,为什么
- 9铝和铜联通,放进浓硝酸构成原电池,为什么铜为负极 其相关的方程式是什么 铝被钝化的方程式是什么
- 10急 答对有奖--------速救!
- 11陪伴 作文
- 12黑板反光是漫反射还是镜面反射啊?
- 13为什么快乐的时间总是过得那么快? 作文
- 14英语翻译我们在这些零件的生产过程中遇到一些问题,由于模具和板材料厚的关系,压制成型后会出现表面不平整、筋线高度达不到图纸
- 15我的铅笔盒 作文
