铁触媒的铁是单质铁还是二价铁或三价铁
 天外访客2022-10-04 11:39:541条回答
天外访客2022-10-04 11:39:541条回答谢谢

已提交,审核后显示!提交回复
共1条回复
 票票预先 共回答了15个问题
票票预先 共回答了15个问题 |采纳率100%- 单质铁
铁触媒:主要是铁,还要加少量K2O、Al2O3作助催化剂
http://zhidao.baidu.com/question/3728642.html - 1年前
相关推荐
- 下列有关工业生产的叙述错误的是 [ ] A.合成氨工业用铁触媒作催化剂,
下列有关工业生产的叙述错误的是 [ ]A.合成氨工业用铁触媒作催化剂,可加快正、逆反应速率
B.合成氨工业对原料气进行压缩,可增大原料气的转化率
C.硫酸工业中,采取通入适当过量的空气,以提高SO 2 的转化率
D.硫酸工业中,在催化反应室安装热交换装置可利用SO 3 转化为H 2 SO 4 时放出的热量 jacqueszuo1年前1
jacqueszuo1年前1 -
 漫步风雨中66 共回答了24个问题
漫步风雨中66 共回答了24个问题 |采纳率87.5%D1年前查看全部
- 合成氨的催化剂铁触媒的分子式?
 jingboye1年前1
jingboye1年前1 -
 ss嫁给ss吧 共回答了19个问题
ss嫁给ss吧 共回答了19个问题 |采纳率89.5%合成氨工业中普遍使用的主要是以铁为主体的多成分催化剂,又称铁触媒.铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择在500 ℃左右进行的重要原因之一.主要成分是Fe3O4,助催化剂K2O、Al2O3、CaO、MgO等含量小于催化剂总质量的9%,低压催化剂还增加了CoO(A201等),没有固定的分子式.
氧化态催化剂主体是磁铁矿,其化学计量式是FeO.Fe2O3或Fe3O4.1年前查看全部
- 合成氨工业中用铁触媒来催化N2和H2合成NH3 .若将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b升
合成氨工业中用铁触媒来催化N2和H2合成NH3 .若将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b升,气体体积均在同温同压下,该b升气体中氨气体体积分数
 corlo1年前1
corlo1年前1 -
 李燕妮1 共回答了20个问题
李燕妮1 共回答了20个问题 |采纳率95%氨气通过铁触媒发生的是合成氨反应的逆反应.按照方程式,a升是未分解的氨气,b升是分解后的混合气,包括未分解的氨气,生成的氢气与氮气.弄清楚这些,用常规方法或用气体体积差量法可解.可算出分解的氨气是(b-a),未分解的氨气是(2a-b)最后答案为(2a-b)/b.这是一道高考题.1年前查看全部
- 工业制硫酸用的催化剂是V2O5还是铁触媒啊
工业制硫酸用的催化剂是V2O5还是铁触媒啊
下列关于硫酸工业生产过程的叙述错误的是
A.在接触室中使用铁粉作催化剂
B.在接触室中运用热交换技术可充分利用能源
C.把硫铁矿磨成细粉末,可以提高原料的利用率
D.该反应采用450℃~500℃主要是因为该温度下催化剂活性好
13. A【解析】本题通过硫酸工业生产考查考生化学与技术,意在考查考生对硫酸工业的理解.硫酸工业生产中,在接触室中用铁触媒作催化剂,使SO2氧化为SO3,A项错误;使用热交换装置可节约能源,B项正确;把硫铁矿磨碎可增大其与氧气的接触面,使反应更充分,速率更快,可提高原料的利用率,C项正确;反应温度采用450~500℃是因为该温度下催化剂活性最高,D项正确 日番谷冬狮郎221年前1
日番谷冬狮郎221年前1 -
 hxc1011 共回答了25个问题
hxc1011 共回答了25个问题 |采纳率88%五氧化二钒
如果是中学做题的话就是这个答案.1年前查看全部
- 在高中的所有实验中,用铁触媒做催化剂的是____ ,用V2O5做催化剂的是_____,用Cr2O3做催化剂的是_____
在高中的所有实验中,用铁触媒做催化剂的是____ ,用V2O5做催化剂的是_____,用Cr2O3做催化剂的是_____ 用铂丝做催化剂的是______.
 zzhiyu1年前4
zzhiyu1年前4 -
 dd老仙2007 共回答了21个问题
dd老仙2007 共回答了21个问题 |采纳率100%合成氨工业,二氧化硫和氧气反应 ,在氯酸钾制氧气的实验中,氨的催化氧化1年前查看全部
- 实验室为了简便制取干燥的氨气A.加热氯化铵固体,产生的气体用碱石灰干燥 B.在N2和H2混合气中加入铁触媒并加热至500
实验室为了简便制取干燥的氨气
A.加热氯化铵固体,产生的气体用碱石灰干燥
B.在N2和H2混合气中加入铁触媒并加热至500℃
C.在浓氨水中加入NaOH固体并加热,气体用固体NaOH干燥
D.加热NH4HCO3,气体用P2O5干燥
选什么,为什么 lieberex1年前2
lieberex1年前2 -
 solomon__ 共回答了20个问题
solomon__ 共回答了20个问题 |采纳率90%选C,因为浓氨水与碱性物质不发生反应,在加热的环境下分解成氨气和水,然后用氢氧化钠直接吸收,操作简便,对于实验室便于掌握.
而A在加热氯化铵的同时有氯化氢生产,碱石灰固然能吸收氯化氢但吸收效果不好,不能保证纯度.
B选项是工业制备氨气的,不属于实验室制备.
D选项加热碳酸氢铵分解生成氨气二氧化碳和水,而五氧化二磷只能吸收水不能吸收二氧化碳所以排除1年前查看全部
- 把N2和H2按1:1(物质的量之比)混合均匀后分成四等份,分别充入A、B、C、D四个装有铁触媒的真空密闭容器中(容积不变
把N2和H2按1:1(物质的量之比)混合均匀后分成四等份,分别充入A、B、C、D四个装有铁触媒的真空密闭容器中(容积不变),在保持相同温度的条件下,四个容器相继达到化学平衡状态,分析下表数据,回答下列问题:
(1)平衡时,______容器中NH3所占的比例最大.容器代号 A B C D 平衡时混合物平均式量 16 17 平衡时N2的转化率 20% 平衡时H2的转化率 30%
(2)达到平衡时反应速率最小的容器是______.
(3)四个容器的压强自小到大的排列次序是______. summertime1231年前1
summertime1231年前1 -
 ZZ1616 共回答了23个问题
ZZ1616 共回答了23个问题 |采纳率91.3%解题思路:由于在相同温度的条件下,4个容器中装入等物质的量的N2和H2,而达到平衡状态时N2的转化率以及混合体系的平均相对分子质量不同,则说明A、B、C、D四个容器的大小不同.又因合成氨反应是气体分子总数缩小的反应,故容器的容积越小的,该体系内压强越大,反应向正反应方向进行的程度大,故α(N2)和α(H2)越大,平衡混合气体NH3的含量越大,则平均相对分子质量越大,令四个容器内的N2和H2均为1 mol,利用三段式计算平衡时甲、乙容器内各组分的物质的量,进而计算平均相对分子质量,
(1)平均相对分子质量越大,容器中NH3所占的比例最大;
(2)容器体积越小,压强越大,平衡时的反应速率越大,压强越大平衡时平均相对分子质量越大;
(3)压强越大,反应向正反应方向进行的程度大,物质的转化率大,则平均相对分子质量越大.解析:设四个容器内的N2和H2均为1 mol
对A容器:N2+3H2⇌2NH3
起始(mol):1 1 0
变化(mol):0.20.60.4
平衡(mol):0.80.40.4
则平均相对分子质量为[1×28+1×2/0.8+0.4+0.4]=18.75,
对于B容器:N2+3H2⇌2NH3
起始(mol):1 1 0
变化(mol):0.10.30.2
平衡(mol):0.90.70.2
则平均相对分子质量为[1×28+1×2/0.9+0.7+0.2]=16.67
故平均相对分子质量M:A中为18.75、B中为16.67、C中为16、D中为17,
(1)由上述分析可知,A中平均相对分子质量M最大,则含NH3的物质的量分数最大,
故答案为:A;
(2)由上述分析可知,C中平均相对分子质量M最小,故C中压强最小,反应速率最小,
故答案为:C;
(3)由上述分析可知,平均相对分子质量A>D>B>C,故压强C<B<D<A,
故答案为:C<B<D<A.点评:
本题考点: 化学平衡的计算.
考点点评: 考查化学平衡的有关计算,解题的关键是根据平衡移动判断平均相对分子质量或物质的转化率越大压强越大,难度较大.1年前查看全部
- 在50MPA,500`C和铁触媒催化的条件下,用1.2MOL氨气和3MOL氢气合成氨.氢气完全消耗掉?
 lemontree2171年前2
lemontree2171年前2 -
 urchin2008 共回答了20个问题
urchin2008 共回答了20个问题 |采纳率80%.题目写错了吧,是1.2mol氮气吧...首先写出方程式或者熟悉的话直接写关系式1N2----3H2
然后呢,判断过量,两种思路:一是可以从H2出发,3molH2需要1MOL N2,现在N2是1.2MOL,所以H2可以反应完
二呢是可以从N2出发,1.2MOL N2需要3.6MOL氢气,明显N2有剩余,H2反应完毕
上面的阿门写错了吧,极端条件下小于1X10-5次方认为反应完全吧.不过做题目时看情况而定咯1年前查看全部
- 下列叙述中,不能用勒夏特列原理解释的是( ) A.合成氨需用铁触媒加快反应速率 B.高
下列叙述中,不能用勒夏特列原理解释的是()
A.合成氨需用铁触媒加快反应速率 B.高压比常压有利于合成SO 3 的反应 C.由H 2 、I 2 (g)、HI(g)气体组成的平衡体系加压后颜色变深 D.收集氯气可用排饱和食盐水法  sgj01481年前1
sgj01481年前1 -
 流星00 共回答了18个问题
流星00 共回答了18个问题 |采纳率72.2%AC 催化剂只能改变反应速率,不难改变平衡状态,A正确。氢气和碘合成碘化氢的反应是体积不变的可逆反应,所以增大压强,平衡不移动。颜色加深是因为体积减小,浓度增大导致的,C正确。B属于压强对平衡...1年前查看全部
- 合成氨中使用铁触媒的作用是什么?
 盘古壹号1年前2
盘古壹号1年前2 -
 可爱的贤士 共回答了14个问题
可爱的贤士 共回答了14个问题 |采纳率92.9%铁触媒:
----降低反应的活化能,使N2和H2更容易反应生成NH3,加快反应的反应速度.
----铁触媒吸附N2和H2于铁的表面,在铁的表面两气体分子内的共价键被弱化,几乎以原子的形式的存在,然后在铁的表面,氮原子和氢原子结合生成NH3.1年前查看全部
- 在一定温度、压强和有铁触媒的条件下,在密闭容器中充入N2、H2和NH3 .若起始时n(N2)=x mol、n(H2)=y
在一定温度、压强和有铁触媒的条件下,在密闭容器中充入N2、H2和NH3 .若起始时n(N2)=x mol、n(H2)=y mol、n(NH3)=z mol (x、y、z均不为0 ),平衡时,n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol.下列有关判断不合理的是()
A.x :y =1 :3
B.N2、H2的转化率不相等
C.平衡时,H2与NH3的生成速率之比为3 :2
D.x的取值范围为0<x<0.14 jaykinfeng1年前2
jaykinfeng1年前2 -
 阳光树鱼 共回答了13个问题
阳光树鱼 共回答了13个问题 |采纳率92.3%答案选B
N2+3H2=可逆=2NH3
A.达到平衡时,氮气和氢气的物质的量之比为1:3
又反应中消耗或生成氮气和氢气的物质的量之比为1:3
所以加入氮气和氢气的物质的量也是1:3
x:y=1:3
B.反应前后氮气和氢气的物质的量都是1:3.所以他们的转化率之比为1:1
C.达到平衡时,正反应和逆反应的速率相等.
V正(H2)=V逆(H2)
又2V逆(H2)=3V逆(NH3)
所以,平衡时,生成氢气和氨气的速率之比为3:2
D.用极限法来求
加入初始投入的全部为氢气和氮气,此时,投入氮气为0.14mol
加入投入全部为氨气,氨气物质的量为0.28mol,氢气和氮气物质的量为0
所以01年前查看全部
- 把氮气和氢气按1:1(物质的量之比)混合均匀后分为等两份,装入两个装有铁触媒的真空密闭容器A,B中,在保持温度的条件 下
把氮气和氢气按1:1(物质的量之比)混合均匀后分为等两份,装入两个装有铁触媒的真空密闭容器A,B中,在保持温度的条件 下.数据如下:A瓶:平衡时混合物平均式量18.75、平衡时氮气的转化率20%、平衡时氢气的转化率60%;B瓶:平衡时混合物平均式量17、平衡时氮气的转化率11.7%、平衡时氢气的转化率35.3%.
我的问题是:显然A当中的气体分子总数是少于B的,那温度和体积都相同的情况下,根据克拉伯龙方程p∝n,所以pApB.出现矛盾. 山指1年前6
山指1年前6 -
 rucie 共回答了21个问题
rucie 共回答了21个问题 |采纳率90.5%我觉得是你对问题的理解有错,题目中只有温度相等的条件,没有体积想等的条件啊,如果温度和体积都相等,怎么可能会出现转化效率不一样的结果?因为这个反应是向气体分子数减少的方向走的,所以压力增大肯定是伴随着体积减小的,所以,还是要从化学角度来考虑,而不能从物理角度来考虑,从物理角度来考虑缺少体积条件.1年前查看全部
- 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2⇌2NH3△H<0.
(1)已知N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ•mol-1,拆开1mol H-H键,1mol N≡N键分别需要的能量是436kJ、946kJ,则拆开1mol N-H键需要的能量是______.
(2)如图2所示,在甲、乙两容器中分别充入1mol N2和3mol H2,使甲、乙两容器初始容积相等.在相同温度下发生反应N2(g)+3H2(g)⇌2NH3(g),并维持反应过程中温度不变.已知甲容器中H2的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图象.
(3)若反应N2 (g)+3H2(g)⇌2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变.反应达到平衡后.
①增大NH3的浓度,达到平衡,NH3的体积分数______(填“增大”“减小”或“不变”).
②若平衡从正向建立,且起始时N2与H2的物质的量分别为a mol、b mol,当a:b=______时,达到平衡后NH3的体积分数最大. gbxh8881年前1
gbxh8881年前1 -
 心千千结 共回答了18个问题
心千千结 共回答了18个问题 |采纳率88.9%解题思路:(1)焓变利用键能求算时,△H=反应物键能和-生成物键能和,据此分析;
(2)乙平衡时体积缩小,相当于甲平衡时增大压强;
(3)①在容积固定不变的容器内进行,增大NH3的浓度,相当于在原平衡的基础上增大压强;
②若平衡从正向建立,要想达平衡时生成物的体积分数最大,则投料量之比应等于反应物的化学计量数之比.(1)设1mol N-H键需要的能量是xKJ,由△H=反应物键能和-生成物键能和,得-92kJ=436kJ×3+946kJ-6x,解得:x=391KJ,故答案为:391KJ;
(2)乙平衡时体积缩小,相当于甲平衡时增大压强,反应速率加快,达平衡时缩短,氢气的转化率增加,所以 ,故答案为:
,故答案为: ;
;
(3)①在容积固定不变的容器内进行,增大NH3的浓度,相当于在原平衡的基础上增大压强,平衡正向移动,NH3的体积分数增大,故答案为:增大;
②若平衡从正向建立,要想达平衡时生成物的体积分数最大,则投料量之比应等于反应物的化学计量数之比,所以a:b=1:3,故答案为;1:3.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程;化学平衡的计算.
考点点评: 本题考查通过反应物和焓变求算生成物的键能大小的方法,化学平衡移动的问题等,侧重于化学平衡移动的综合考查,题目难度中等.1年前查看全部
- (2014•山东模拟)铁触媒(铁的氧化物)是硫酸工业的催化剂.某同学设计了以下两种方案研究铁触媒的组成.
(2014•山东模拟)铁触媒(铁的氧化物)是硫酸工业的催化剂.某同学设计了以下两种方案研究铁触媒的组成.
方案一:用下列装置测定铁触媒的含铁量,确定其组成.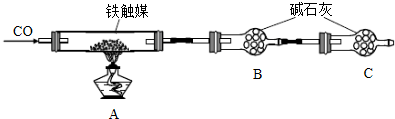
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成.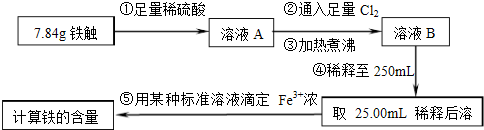
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______.
(2)因为通入Cl2不足量,“溶液B”中还含有______会影响测定结果.
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2.请设计实验方案检验Cl2,完成下列实验报告.
限选试剂:0.1mol•L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL•L-1KSCN溶液
(4)“干燥管C”的作用是______.实验操作 实验现象与结论 ______ ______
(5)称取15.2g铁触媒进行上述实验.充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为______. lgl011年前1
lgl011年前1 -
 wzygj0223 共回答了12个问题
wzygj0223 共回答了12个问题 |采纳率100%解题思路:(1)容量瓶是一种玻璃定容仪器;
(2)氯气具有氧化性,可以将亚铁离子氧化为三价铁离子,铁触媒和硫酸以及氯气反应的产物来回答;
(3)根据氯气的性质:能使石蕊试液先变红后退色来检验氯气的存在;
(4)一氧化碳可以和铁的氧化物之间发生反应,得到气体产物二氧化碳,干燥管B可以吸收生成的二氧化碳,但是要排除空气的干扰,据此来回答;
(5)根据一氧化碳和铁的氧化物之间发生的反应,“干燥管B”增重11.0g即为生成的二氧化碳的质量来回答.(1)将溶液稀释为250mL,可以采用定容仪器容量瓶,故答案为:250mL容量瓶;
(2)通入Cl2的作用是将亚铁离子氧化为铁离子,氯气量不足时,“溶液B”中会含有亚铁离子,即FeCl2或者FeSO4,故答案为:FeCl2或者FeSO4或者Fe2+;
(3)氯气的性质:能使石蕊试液先变红后退色,向溶液B中加入石蕊试液,如果石蕊试液显红色,后红色褪去,这是氯水的性质,证明含有氯气,若溶液变红后不褪色,溶液B不含有Cl2,故答案为:
实验操作 预期现象和结论
取适量溶液B于试管中,滴加2-3滴紫色石蕊试液,振荡,观察现象. 若溶液显红色,后红色褪去,则溶液B中含Cl2;
若溶液变红后不褪色,则溶液B不含有Cl2(4)一氧化碳可以和铁的氧化物之间发生反应,得到气体产物二氧化碳,干燥管B可以吸收生成的二氧化碳,测定二氧化碳的量可以获得铁触媒的量,但是要排除空气成份的干扰,所以C的作用是:防止空气中的CO2和水蒸气进入B中,故答案为:防止空气中的CO2和水蒸气进入B中;
(5)根据实验方案一的原理,15.2g铁触媒充分反应生成二氧化碳的质量是11.0g,设发生的反应为:
yCO+FexOy
加热
.
xFe+yCO2,
1 y
[15.2/56x+16y][11/44]
即[15.2y/56x+16y=
1
4],解得x:y=4:5,
所以氧化物的化学式为:Fe4O5或2FeO•Fe2O3,故答案为:Fe4O5或2FeO•Fe2O3.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题是一道考查学生物质的含量和组成的综合知识考查题,涉及氯气的性质、一氧化碳和铁的氧化物之间的反应等知识,综合性强,难度大.1年前查看全部
- (2010•台州一模)合成氨工业中用铁触媒来催化N2和H2合成NH3.若将a L NH3通过灼热的装
(2010•台州一模)合成氨工业中用铁触媒来催化N2和H2合成NH3.若将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),则该b L气体中的NH3体积分数是( )
A.[b−a/a]
B.[b−a/b]
C.[2a−b/a]
D.[2a−b/b] bdtymp1年前1
bdtymp1年前1 -
 安然_rose 共回答了20个问题
安然_rose 共回答了20个问题 |采纳率95%解题思路:氨气在热的铁触媒作用下发生分解反应:2NH3
N2+3H2.气体体积变化(b-a)L,由方程式差量可知,参加反应的氨气为(b-a)L,所以剩余的氨气的体积为(2a-b)L,在根据体积分数定义计算.催化剂 .△ 气体体积变化(b-a)L,则:
2NH3
催化剂
.
△N2+3H2 体积增大△V
2 13 1+3-2=2
(b-a)L (b-a)L
所以混合气体中氨气的体积为aL-(b-a)L=(2a-b)L.
所以该b L气体中的NH3体积分数是
(2a−b)L
bL=[2a−b/b].
故选:D.点评:
本题考点: 化学方程式的有关计算;阿伏加德罗定律及推论.
考点点评: 考查根据方程式的计算,难度不大,氨气在试管中发生反应是关键,注意不是氨的催化氧化反应,注意差量法的利用,可以简化计算.1年前查看全部
- 在试管前口通入C0到试管中与铁触媒反应,试管后口装置一个含碱石灰的干燥管B,称取 15.2g 铁触媒进行上述实验.充分反
在试管前口通入C0到试管中与铁触媒反应,试管后口装置一个含碱石灰的干燥管B,称取 15.2g 铁触媒进行上述实验.充分反应后,测得“干燥管 B”增重 11.0g,则该铁触媒的化学式可表示为 .(Fe405或2Fe0.Fe203)是怎样计算来的
 心火为你而起1年前5
心火为你而起1年前5 -
 nwutony 共回答了17个问题
nwutony 共回答了17个问题 |采纳率82.4%增重的是二氧化碳,二氧化碳的氧的质量:11×32/44=8g,但只有一个氧来自铁触媒,还有一个氧来自一氧化碳.
所以铁触媒中氧:8g/2=4g
铁元素:15.2-4=11.2
所以Fe:O=11.2:4=14:5
Fe405中Fe:O=(56*4):(16*5)=14:5
所以是Fe4051年前查看全部
大家在问
- 1学校门前新修的马路长96米,要在马路两边栽上树,每两棵树之间相距8米(两端都要栽).一共要栽多少棵树?
- 2欲做一个底为正方形,容积为32立方厘米的长方体开口容器,怎样做法用料最省?
- 3记忆细胞和效应细胞一种效应细胞不是对应一种记忆细胞?(与抗原的特异性)那为什么二次免疫时,记忆变成效应还要“分化”?分化
- 410的负七次方米等于多少纳米
- 5任何一组数都有中位数和平均数.判断对错,并说明理由
- 6整体法受力分析的一道题RT已知地面光滑,小车加速上升时,得弹簧是处于伸长状态答案上说是用整体法分析,怎么分析
- 7我没有基础 但想一周背会一本高中词汇
- 8钙怎样变成氧化钙?
- 9通过什么化学反应可以使钙变成氧化钙?
- 10已知两条平行直线被第三条直线所截下列结论中,正确的有哪些?
- 11三峡夏季和春冬季节的景物各有什么特点?请分别用一个短语概括回答
- 12老师这样无微不至地关心我,教导我,不正像春天的喜雨昰什么诗句
- 13太阳能热水器原理、用热力学第二定率解释物理现象
- 14k为何值时,多项式x^2+xy-2y^2+8x+10y+k有一个因式是x+2y+2
- 15向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液
