往AgNO3和Cu(NO3)2的混合溶液中加入一定量的Fe粉.Fe先置换Ag还是Cu.
 9姨太2022-10-04 11:39:544条回答
9姨太2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 304220144 共回答了22个问题
304220144 共回答了22个问题 |采纳率90.9%- 先置换出Ag
电极电势理论我就不说了,
假设先置换出铜,那么刚生成的铜也会立即和AgNO3反应置换出Ag - 1年前
 橙色的列那狐狸 共回答了15个问题
橙色的列那狐狸 共回答了15个问题 |采纳率93.3%- 先置换出Ag。因为Ag的金属恬动性最低。
- 1年前
 StrayX 共回答了1个问题
StrayX 共回答了1个问题 |采纳率- Ag应该太不反映
- 1年前
 lalalalal 共回答了1个问题
lalalalal 共回答了1个问题 |采纳率- cu
- 1年前
相关推荐
- 简单化学电解将浓度均为2mol/L的AgNO3与Cu(NO3)2溶液各0.5L混合,以铜为电极进行电解,过一会阴极上有1
简单化学电解
将浓度均为2mol/L的AgNO3与Cu(NO3)2溶液各0.5L混合,以铜为电极进行电解,过一会阴极上有1.6克铜析出,问溶液铜离子浓度
yuanyin zhendezhe1年前1
zhendezhe1年前1 -
 gbqh 共回答了22个问题
gbqh 共回答了22个问题 |采纳率95.5%既然有Cu2+说明Ag已经全部析出,2x0.5=1mol,所以这个时候有0.5mol的Cu变成Cu2+,之有Cu2+的转化是守恒的,所以浓度是(0.5+1)/1=1.5mol/L,那个条件只说明Ag全部析出,数据没用...1年前查看全部
- 用酒精灯加热 34.6g KMnO4 和 Cu(NO3)2 混合物,使其中的两种物质全部分解,生成的气体全部通入 100
用酒精灯加热 34.6g KMnO4 和 Cu(NO3)2 混合物,使其中的两种物质全部分解,生成的气体全部通入 100 mL
4℃时的水中,待生成的气体与水充分反应后,还逸出 1.12 L 无色气体(标准状况下测定),所得溶液的密度 为 1.05 g/mL.求:(1) 原混合物中各组成成分的质量; (2) 所得溶液的物质的量浓度是多少?(注:2Cu(NO3)2 2CuO+4NO2↑+O2↑) my-dear-baby1年前2
my-dear-baby1年前2 -
 莫明其妙被封了 共回答了11个问题
莫明其妙被封了 共回答了11个问题 |采纳率81.8%(1) 2KMnO4 K2MnO4+MnO2+O2↑
2Cu(NO3)2 2CuO+4NO2↑+O2↑
4NO2+O2+2H2O = 4HNO3
所以,逸出的气体是O2,且为 =0.05 mol,
故混合物中含KMnO4为 0.05 mol×2×158 g / mol=15.8 g,
Cu(NO3)2为 34.6 g-15.8 g=18.8 g
(2) 因为原混合物中Cu(NO3)2为 =0.1 mol,
所以NO2为0.2mol,O2为0.05mol.
又因为溶液体积为 =105.52 mL,
所以,所得溶液的物质的量浓度为 =1.895 mol / L1年前查看全部
- 化学来配平(氧化还原)CuS+HON3(浓)----Cu(NO3)2+H2SO4+NO+H20
 qazdt1年前1
qazdt1年前1 -
 zhangmiaoting611 共回答了19个问题
zhangmiaoting611 共回答了19个问题 |采纳率94.7%HON3(浓)是什么?
如果是硝酸的话,S上升8,N下降3
3CuS+14HNO3(浓)----3Cu(NO3)2+3H2SO4+8NO+4H201年前查看全部
- 硝酸铜化学式怎么表示?为什么是Cu(NO3)2?硝酸根不是NO3-吗?铜的化合价不是+2吗?怎么不是Cu3(NO)2?怎
硝酸铜化学式怎么表示?
为什么是Cu(NO3)2?
硝酸根不是NO3-吗?铜的化合价不是+2吗?怎么不是Cu3(NO)2?
怎么得出来的? gedjm11年前4
gedjm11年前4 -
 cctv07084 共回答了22个问题
cctv07084 共回答了22个问题 |采纳率72.7%你的这个Cu3(NO)2里面的硝酸根就不对啊,硝酸根是NO3,所以说Cu(NO3)2是对的1年前查看全部
- Cu2S+HNO3=Cu(NO3)2+CuSO4+NO2+NO+H2O 配平
Cu2S+HNO3=Cu(NO3)2+CuSO4+NO2+NO+H2O 配平
Cu2S+HNO3=Cu(NO3)2+CuSO4+NO2+NO+H2O 配平 谢谢. 八月初的月亮1年前1
八月初的月亮1年前1 -
 hyl5363287 共回答了21个问题
hyl5363287 共回答了21个问题 |采纳率90.5%Cu2S+8HNO3=Cu(NO3)2+CuSO4+4NO2+2NO+4H2O
待定系数法1年前查看全部
- 往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,反应后过滤有金属析出,洗涤后往滤渣中加入稀盐酸.
往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,反应后过滤有金属析出,洗涤后往滤渣中加入稀盐酸.
(1)若无气体放出,则原滤液中可能存在的物质是--------
(2)若有无色无味的气体放出,则滤渣中一定能存在的物质是------- 仰望星空的姑娘1年前1
仰望星空的姑娘1年前1 -
 zhenya1026 共回答了20个问题
zhenya1026 共回答了20个问题 |采纳率100%分析:向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,铁先与硝酸银溶液反应,只有硝酸银完全反应后,铁才能与硝酸铜.因为铁如果先和硝酸铜反应,生成的铜又会和硝酸银反应,所以还是铁先和硝酸银反应,后与硝酸铜反应.只有硝酸银、硝酸铜先后完全反应后,铁粉才能有剩余.反应的有关化学方程式为:
Fe+2AgNO3=Fe(NO3)2+2Ag
Fe+Cu(NO3)2=Fe(NO3)2+2Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
铁、铜、银三种金属只有铁能与稀盐酸反应生成气体,因为金属与盐酸反应的条件是:在金属活动顺序中只有排在氢前面的金属才能置换出酸中的氢.
(1)若无气体放出,说明滤渣中不含铁.一定能置换出银,也可能置换出铜,则原滤液中可能存在的物质是硝酸铜或硝酸银和硝酸铜,
(2)若有无色无味的气体放出,则滤渣中一定能存在的物质是铁、铜、银.1年前查看全部
- 500mlKNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol/L,用石墨做电极电解此溶液,当通电一段时候后,
500mlKNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol/L,用石墨做电极电解此溶液,当通电一段时候后,两极均收集到22.4L气体(标况),假定电解后溶液体积仍为500ml,
问,原溶液中K+的溶度?电解过程中共转移多少摩尔电子?电解后溶液中H+的溶度? 无悔我这一生1年前1
无悔我这一生1年前1 -
 promising64 共回答了21个问题
promising64 共回答了21个问题 |采纳率90.5%n(O2)=n(H2)=1mol
2n(Cu)+2n(H2)=4n(O2)
n(Cu)=1mol
c(Cu)=2mol/L
c(k+)=c(NO3-)-2c(Cu)=2mol/L
n(e-)=4n(O2)=4mol
c(H+)=c(NO3-)-c(k+)=4mol/L1年前查看全部
- 常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的
常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为112mL时,假设溶液体积不变,下列说法正确的是( )
A.阴极增重1.4 g B.所得溶液 pH1
我明白是0.02mol的Cl2 和0.01mol的氧气 0.02mol的氯气同时生成0.04mol氢氧根 0.01mol的氧气同时消耗 0.04mol氢氧根 然后如何推出ph值呢?
 kevin0212191年前1
kevin0212191年前1 -
 fxq_qhd 共回答了12个问题
fxq_qhd 共回答了12个问题 |采纳率83.3%因为0.01mol的Cu2+生成cu单质转移0.02mol的电子,0,01mol的Ag+生成Ag单质转移0.01mol的电子,所以一共转移了0.03mol的电子,
又因为1mol的电子相当于1mol的OH-,OH-=H+
所以H+浓度=0,03/0.01L=0,31年前查看全部
- 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+离子,同时析出0.1molAg.下列结论错误的是( )
A.Fe3+的氧化性大于Cu2
B.1molFe可还原2molFe3+
C.反应后溶液中Cu2+与Fe2+物质的量比为1:2
D.氧化性:Zn2+>Cu2+>Fe3+>Ag+ heihei11231年前3
heihei11231年前3 -
 江郎才劲 共回答了19个问题
江郎才劲 共回答了19个问题 |采纳率94.7%错误的答案是D.
A:Fe3+的氧化性大于Cu2+.正确
B:将2molFe3+还原成还原2molFe2+需要2mol电子,这可由1molFe提供.正确
C:反应后溶液中Cu2+与Fe2+物质的量比为1:2.原来Cu和Fe比为1:1,又加入了0.1mol铁粉.正确
D:氧化性:Ag+>Fe3+>Cu2+>Zn2+,所以错误.1年前查看全部
- 100ML由KNO3和CU(NO3)2组成的混合溶液中,硝酸根的浓度为6摩尔每升,用石墨作电极点解此溶液,通电一段时间后
100ML由KNO3和CU(NO3)2组成的混合溶液中,硝酸根的浓度为6摩尔每升,用石墨作电极点解此溶液,通电一段时间后,两极均收集到4.48L气体,标况,假定电解后的溶液体积仍为100ML,则原溶液中钾离子浓度?
 35nyq1年前1
35nyq1年前1 -
 云漠漠3223 共回答了18个问题
云漠漠3223 共回答了18个问题 |采纳率83.3%n(O2)=0.2mol
n(H2)=0.2mol
n(Cu)=0.2mol
c(K+)=2mol/L1年前查看全部
- 1.某固体样品中,可能含有Na2CO3、Na2SO4、NaCl、Cu(NO3)2、Ca(NO3)2中的一种或几种.将样品
1.某固体样品中,可能含有Na2CO3、Na2SO4、NaCl、Cu(NO3)2、Ca(NO3)2中的一种或几种.将样品溶于水得到无色溶液,滴加BaCl2溶液后产生白色沉淀.过滤,向白色沉淀中加入足量的稀硝酸,沉淀部分溶解.推断:该固体中肯定存在---------------------------------
肯定不存在 -----------------2.5、在硝酸银溶液中加入盐A的溶液,产生白色沉淀.过滤后在滤渣中滴加稀硝酸,沉淀不溶解;在滤液中再加入钠盐B的溶液,又产生白色沉淀.过滤后在滤渣中的加稀硝酸,沉淀不溶解.则A为____________;B为____________.
3. cryo-crystal1年前3
cryo-crystal1年前3 -
 竹林街 共回答了15个问题
竹林街 共回答了15个问题 |采纳率93.3%肯定存在 na2co3 na2so4 因为沉淀部分溶解 baco3溶于硝酸 而 baso4不溶于硝酸 肯定没有 cu(no3)2 因为 cu2+ 有颜色 与题目不符
A bacl2 bacl2与硝酸银反应生成沉淀 且不溶于稀硝酸
B na2so4 同样生成沉淀 baso4 不溶于稀硝酸1年前查看全部
- Cu(NO3)2 怎样生成HNO3
 沙中淼1年前1
沙中淼1年前1 -
 seesea2008 共回答了20个问题
seesea2008 共回答了20个问题 |采纳率85%加硫化氢,H2S
Cu(NO3)2+H2S----CuS沉淀+HNO31年前查看全部
- Cu(NO3)2+NaOH=?RT
 HOTTIGGER1年前2
HOTTIGGER1年前2 -
 兰色晶晶 共回答了19个问题
兰色晶晶 共回答了19个问题 |采纳率84.2%Cu(NO3)2+2NaOH=2NaNO3+Cu(OH)2沉淀1年前查看全部
- 常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的
常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的
常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为112mL时,假设溶液体积不变,下列说法正确的是( )
A.阴极增重1.4 g B.所得溶液 pH1 小百无忌J1年前1
小百无忌J1年前1 -
 若尘心 共回答了18个问题
若尘心 共回答了18个问题 |采纳率94.4%因为0.01mol的Cu2+生成cu单质转移0.02mol的电子,0,01mol的Ag+生成Ag单质转移0.01mol的电子,所以一共转移了0.03mol的电子,
又因为1mol的电子相当于1mol的OH-,OH-=H+
所以H+浓度=0,03/0.01L=0,31年前查看全部
- 向含有AgNO3,Cu(NO3)2的混合物溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,
向含有AgNO3,Cu(NO3)2的混合物溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为( )
A Ag,Cu两种单质的混合物
B Cu,Fe两种单质的混合物
C Ag,Fe两种单质的混合物
D Ag,Cu,Fe三种单质的混合物 欣赏巴乔1年前6
欣赏巴乔1年前6 -
 凌雪飘 共回答了22个问题
凌雪飘 共回答了22个问题 |采纳率86.4%D
铁粉一定未反应完,有铁剩余.
1:Fe会参与反应直到到Ag,Cu置换完成而Fe有剩余
2:Fe完全反应而Ag,Cu未置换完成两种情况.
由于滴加稀硫酸,有气体生成可知Fe有剩余,属于第一种情况.故D
好吧,我承认我是来蹭分的1年前查看全部
- Zn和H2SO4制氢气,若加入Cu(NO3)2会加快氢气速率吗?为什么?
 my2779286351年前1
my2779286351年前1 -
 harpon 共回答了17个问题
harpon 共回答了17个问题 |采纳率88.2%会生成一氧化氮的,先没有氢气生成的,锌与硝酸反应生成NO1年前查看全部
- 向AgNO3、Cu(NO3)2、Mg(NO3)2的混合液中加入一些锌粉,完全反应后过滤,不可能存在的情况是
向AgNO3、Cu(NO3)2、Mg(NO3)2的混合液中加入一些锌粉,完全反应后过滤,不可能存在的情况是
A.滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+
B.滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+
C.滤纸上有Ag、Cu、Zn,滤液中有Zn2+、Mg2+
D.滤纸上有Ag、Cu、Zn、Mg,滤液中有Zn2+、Mg2+
讲下原因、 jingdd12051年前2
jingdd12051年前2 -
 暴风使者 共回答了17个问题
暴风使者 共回答了17个问题 |采纳率94.1%D1年前查看全部
- 向AgNO3,Cu(NO3)2,Mg(NO3)2混合物溶液中加入一些锌粉,完全反应后过滤.不可能存在的情况是
向AgNO3,Cu(NO3)2,Mg(NO3)2混合物溶液中加入一些锌粉,完全反应后过滤.不可能存在的情况是
A:滤纸上有Ag,滤液中有Ag+,Cu2+,Zn2+,Mg2+ B:滤纸上有Ag,Cu,Zn,滤液中有Zn2+,Mg2+,C:滤纸上有Ag,Cu,滤液中有Ag+,Zn2+,Mg2+ D:滤纸上有AgCu,Zn,Mg,滤液中有Zn2+
(请问为什么溶液里有离子出现, 蓝天白云0011年前5
蓝天白云0011年前5 -
 ch8088 共回答了22个问题
ch8088 共回答了22个问题 |采纳率90.9%c d
如果溶液中仍然存在Ag离子,而Cu又存在单质的话,根据活性顺序,银离子会继续和铜金属反应,生成铜离子与金属银,直至将银离子或者铜金属其中之一消耗完才结束.
此外,Mg的活性比Zn高,不会被Zn置换1年前查看全部
- 10.向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,%
10.向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,%
10.10.向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为 ( )
A.Ag、Cu两种单质的混合物 B.Cu、Fe两种单质的混合物
C.Ag、Fe两种单质的混合物 D.Ag、Cu、 Fe三种单质的混合物 徐清晨1年前1
徐清晨1年前1 -
 帖子好长啊 共回答了15个问题
帖子好长啊 共回答了15个问题 |采纳率93.3%选D.
向AgNO3加入铁粉,根据金属的活动性可知Fe的金属活动性比Ag强,故Fe可将Ag置换出来AgNO3+Fe==FeNO3+Ag ,生成金属固体Ag.
同理,Fe也可将Cu置换出来CuNO3+Fe==FeNO3+Cu,
由题可知,向滤出的固体滴加HCl,由于Ag,Fe的金属活动性比H弱,故不反应.又因有气体生成 所以一定有铁剩余 .
故有Ag,Cu,Fe三种单质的混合物,即选D.1年前查看全部
- 某化工厂排出的废液中含有AgNO3、Zn(NO3)2和Cu(NO3)2三种物质.请你设计方案回收金属银、铜和硝酸锌.注
 薄荷花茶1年前1
薄荷花茶1年前1 -
 luyufeng 共回答了25个问题
luyufeng 共回答了25个问题 |采纳率84%先加Cu后加Zn1年前查看全部
- KNO3、Cu(NO3)2、 Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则三者物质的量之比可能是?
 黑不拉几1年前1
黑不拉几1年前1 -
 爽520 共回答了17个问题
爽520 共回答了17个问题 |采纳率100%首先KNO3不分解,而后两者分解为CuO和Fe2O3与NO和NO2和O2.因为未收集到任何气体,说明三气体的量刚好可以与水生成硝酸.换言之把混合气体看成一个整体的话它的N:O=2:5时,无气体被收集.而Cu(NO3)2分解产生的氮氧比也是2:5而Fe(NO3)2是4:9.所以三者物质量之比为x:y:01年前查看全部
- 要制取相同质量的CU(NO3)2,下列反应中消耗HNO3最少的是( )
要制取相同质量的CU(NO3)2,下列反应中消耗HNO3最少的是( )
A CU和浓HNO3
B CU和稀HNO3
C CUO和HNO3
D CU2O和HNO3 yjtmac1年前2
yjtmac1年前2 -
 heima5313 共回答了17个问题
heima5313 共回答了17个问题 |采纳率94.1%上面说的有点不准确,CU和稀HNO3生成NO,和浓的生成NO2,别弄错了,其他的上面都 说的很对,分析是正确的1年前查看全部
- Cu2S与一定量浓度的HNO3反应,生成 Cu(NO3)2 CuSO4 NO2 NO和 H2O,当NO2和NO的物质的量
Cu2S与一定量浓度的HNO3反应,生成 Cu(NO3)2 CuSO4 NO2 NO和 H2O,当NO2和NO的物质的量为2:1时,实际参加
Cu2S与一定量浓度的HNO3反应,生成 Cu(NO3)2 CuSO4 NO2 NO和 H2O,当NO2和NO的物质的量为1:1时,实际参加反应的Cu2S与
HNO3的物质的量之比为 dudu_lan1年前2
dudu_lan1年前2 -
 imood 共回答了18个问题
imood 共回答了18个问题 |采纳率94.4%2Cu2S+ 14HNO3 = 2Cu(NO3)2 + 2CuSO4 + 5 NO2 +5 N0 + 7 H2O
实际参加反应的Cu2S与HNO3的物质的量之比=2:14=1:71年前查看全部
- Cu+HNO3=Cu(NO3)2+NO2↑+NO↑+H2O 为什么会有多组配平系数?急.
 did乖乖1年前1
did乖乖1年前1 -
 夹河是海 共回答了17个问题
夹河是海 共回答了17个问题 |采纳率88.2%因为no2还要与水反应,判断的话有公式a*2=b*1+c*3(a是铜的系数,b是no2的,c是no的.)1年前查看全部
- Cu(NO3)2的水解过程怎么写
 寄盼悠悠1年前2
寄盼悠悠1年前2 -
 花中花C 共回答了20个问题
花中花C 共回答了20个问题 |采纳率100%Cu2++2H2O=可逆=Cu(OH)2+2H+(应该是没有沉淀)1年前查看全部
- 将浓度均为200mol/L的AgNo3和Cu(NO3)2溶液各0.5l混合,以铜为电极进行点解,一段时间后阴极上有1.6
将浓度均为200mol/L的AgNo3和Cu(NO3)2溶液各0.5l混合,以铜为电极进行点解,一段时间后阴极上有1.6g铜析出
1这段时间内直流电源共输出多少摩尔电子?
2点解后铜离子的浓度为多少?(忽略溶液体积变化) feya_new1年前1
feya_new1年前1 -
 hcpe 共回答了17个问题
hcpe 共回答了17个问题 |采纳率82.4%没太看懂题目啊 为什么不太对呢……1年前查看全部
- Al2(SO4)3,Cu(NO3)2,Na2CO3,CH3COONa,NaS的水溶液电解方程式
 CRayman_061年前1
CRayman_061年前1 -
 皇家xx4 共回答了17个问题
皇家xx4 共回答了17个问题 |采纳率94.1%Na2CO3,CH3COONa,Al2(SO43)是电解水,2H2O=2H2↑+O2↑(电解)
2Cu(NO3)2+2H2O=2Cu+O2+4HNO3(电解)
Na2S+2H2O=2NaOH+H2↑+S (电解)1年前查看全部
- 求三道氧化还原反应方程式配平!1.Fe2+ + O2 + H2O = Fe3+ + Fe(OH)32.Cu(NO3)2
求三道氧化还原反应方程式配平!
1.Fe2+ + O2 + H2O = Fe3+ + Fe(OH)3
2.Cu(NO3)2 = CuO + NO2 + O2
3.P4 + KOH + H2O = KH2PO4 +PH3 bjyong1年前1
bjyong1年前1 -
 雨过尘稀 共回答了24个问题
雨过尘稀 共回答了24个问题 |采纳率83.3%12Fe2+ + 3O2 + 6H2O = 8Fe3+ + 4Fe(OH)3
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2P4 + 3KOH + 9H2O = 3KH2PO4 +5PH31年前查看全部
- 将难溶物CuS投入到稀硝酸中所发生的反应为 CuS+4HNO3=Cu(NO3)2+SO2↑+2NO↑+2H2O.在此反应
将难溶物CuS投入到稀硝酸中所发生的反应为 CuS+4HNO3=Cu(NO3)2+SO2↑+2NO↑+2H2O.在此反应中,化合价降低的元素是 ,价态降低的原子个数是 ,每个原子价态降低的值是 价;CuS 在此反应中 电子,是 剂,其氧化产物是[ ];该反应的离子方程式可表示为
 shanxicao1年前1
shanxicao1年前1 -
 jnyinzi1265 共回答了23个问题
jnyinzi1265 共回答了23个问题 |采纳率87%N 2 3 失 还原 SO2 CuS+4H(+)+2NO3(-)=Cu(2+)+2H2O+SO2↑+2NO↑1年前查看全部
- 将浓度均为2mol/L的AgNO3与Cu(NO3)2溶液各0.5L混合,以铜为电极进行电解,过一会阴极上有1.6克铜析出
将浓度均为2mol/L的AgNO3与Cu(NO3)2溶液各0.5L混合,以铜为电极进行电解,过一会阴极上有1.6克铜析出,问溶液铜离子浓度
yuanyin
5 7svaac1年前1
7svaac1年前1 -
 welly0330 共回答了19个问题
welly0330 共回答了19个问题 |采纳率73.7%AgNO3与Cu(NO3)2电解,银离子首先被还原,当有铜析出的时候说明银离子已经反应完毕,由于是用铜电极电解,所以阳极不断有铜溶解进入溶液,银离子反应时相当于Cu+2Ag+=Cu2++2Ag,所以由银离子的物质的量2*0.5=1mol可得银全部析出后进入溶液的铜离子量为0.5mol;铜析出时不改变溶液中铜离子浓度,所以溶液中铜离子浓度为(2*0.5+0.5)/1=1.5mol/L.1年前查看全部
- 有一包固体A,可能是由AgNO3,K2SO4,Cu(NO3)2,NH4Cl,Mg(OH)2五种物质中的一种或几种物质组成
有一包固体A,可能是由AgNO3,K2SO4,Cu(NO3)2,NH4Cl,Mg(OH)2五种物质中的一种或几种物质组成…
有一包固体A,可能是由AgNO3,K2SO4,Cu(NO3)2,NH4Cl,Mg(OH)2五种物质中的一种或几种物质组成,为了确定其组成,做了如下实验:1取少量固体A,加水充分振荡后得到澄清透明溶液,2取1所得溶液少许于试管中,向其中加入过量NaOH溶液充分反应,结果出现蓝色沉淀,并产生使湿润红色石蕊试纸变蓝的气体,3再取1溶液少许于试管中,加入适量BaCl2溶液后出现白色沉淀,向白色沉淀中滴加稀HNO3,结果沉淀不溶解.
根据以上实验事实回答下列问题:(1)固体A中一定含有的物质是_,肯定不存在的物质是_;(2)写出2中产生蓝色沉淀的化学反应方程式,写出3中产生白色沉淀的化学反应方程式. 50291年前3
50291年前3 -
 liu20080917 共回答了22个问题
liu20080917 共回答了22个问题 |采纳率90.9%首先 澄清透明 一定没有 Cu(NO3)2
和 Mg(OH)2
而且 AgNO3,K2SO4 .NH4Cl.
不能共存 硫酸银 氯化银 是沉淀
氢氧化银在水中会变成 氧化银 Ag2O 黑色沉淀
但是 第二步
又有蓝色沉淀 说明一定有 Cu2+ 离子
这说明 一定有硝酸铜
可能浓度很低 所以没有颜色
有NH3产生 所以一定有NH4Cl
所以 没有 AgNO3
3步有沉淀 所以 一定有K2SO4
一定有 Cu(NO3)2 K2SO4 NH4Cl
一定没有 AgNO3 Mg(OH)2
Cu(NO3)2 + 2 NaOH === Cu(OH)2 + 2 NaNO3
BaCl2 + K2SO4 === BaSO4 + 2 KCl1年前查看全部
- Cu2S+HNO3 - Cu(NO3)2+H2SO4+NO+H2O中Cu的化学价为什么是从+1到+2 呢
 飞泉泉1年前4
飞泉泉1年前4 -
 似是但是非 共回答了22个问题
似是但是非 共回答了22个问题 |采纳率77.3%Cu2S中的Cu是+1价,S-2价,+1价Cu具有还原性,能被强氧化性HNO3 氧化成+2价的Cu.1年前查看全部
- fe(no3)2中含有[cu(no3)2]怎么除去杂质
fe(no3)2中含有[cu(no3)2]怎么除去杂质
说出操作步骤和反应化学方程式 WH0604251年前2
WH0604251年前2 -
 kinjooh 共回答了21个问题
kinjooh 共回答了21个问题 |采纳率90.5%加入过量的铁粉然后再过滤.
Cu(NO3)2+Fe=Fe(NO3)2+Cu1年前查看全部
- 在含有Cu(NO3)2,Zn(NO3)2,Fe(NO3)3,AgNO3各0.01mol的混合溶液中加入0.015mol铁
在含有Cu(NO3)2,Zn(NO3)2,Fe(NO3)3,AgNO3各0.01mol的混合溶液中加入0.015mol铁粉,经充分搅拌,产生的变化是( )
A.铁溶解,没有任何金属生成
B.铁溶解,析出银,且溶液中不再含有Fe3+
C.析出0.01molAg和0.01molCu
D.析出0.01molAg和0.005molCu tonyzgrw1年前4
tonyzgrw1年前4 -
 永远的阿木兰 共回答了27个问题
永远的阿木兰 共回答了27个问题 |采纳率88.9%氧化性Ag+>Fe3+>Cu2+,因此,可能发生的反应依此为:
2Ag+ + Fe = Fe2+ + 2Ag
2Fe3+ + Fe = 3Fe2+
Cu2+ + Fe = Fe2+ + Cu
根据反应计算可知,析出0.01molAg和0.005molCu,且Fe3+ 已完全反应
综上所述,选D1年前查看全部
- 将mmolCU2s和足量稀HNO3反应,生成Cu(No3)2,CuSO4,NO和H2O,则参加反应的硝酸中被还原的物质的
将mmolCU2s和足量稀HNO3反应,生成Cu(No3)2,CuSO4,NO和H2O,则参加反应的硝酸中被还原的物质的量是?
是怎么配平的?求详解 抗震ll1年前2
抗震ll1年前2 -
 lizzyliu_114 共回答了23个问题
lizzyliu_114 共回答了23个问题 |采纳率95.7%利用电荷(化合价)守恒.亚铜都变为铜一共升了2m价 ;明显降价的是N元素 ,由部分+5价变成+2价(降3价),这可以算出NO前面的系数x:2m(升)=3x(降),得到系数为2m/3.
利用S守恒,得到硫酸铜的系数为m;然后铜守恒 硝酸铜的系数也是m;然后N元素守恒 得到硝酸的系数;最后通过H元素守恒得到反应生成水的系数.
之后可以通过系数化简得到纯的数字摩尔比.这些就自己处理去吧.
PS:有的配平题目里 反应物需要自己加水,当然这题没有涉及到.
一般配平就是 首先用化合价守恒得到有变价元素物质前的系数然后元素守恒就玩出来了.1年前查看全部
- 求助啊向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn
求助啊向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn
,溶液质量与加入zn的质量关系如图所示,下列说法正确的是Aa点溶液中的溶质有2种Bc点溶液中溶质为ZN(NO3)2C若取b到c段溶液,滴加hcl,有白色沉淀D取d点的固体,加入hcl无气泡产生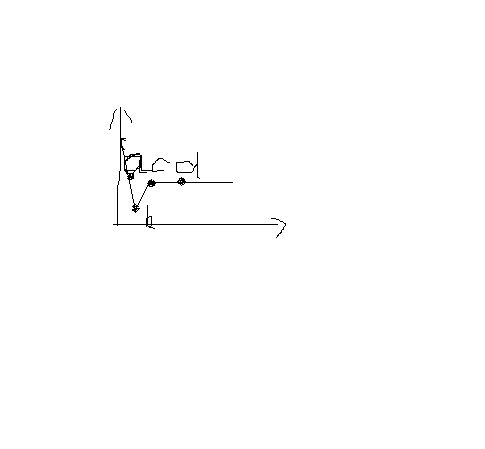
 君子小任1年前1
君子小任1年前1 -
 handapple 共回答了27个问题
handapple 共回答了27个问题 |采纳率81.5%Zn+2AgNO3=2Ag+ Zn(NO3)2 65 216Zn+Cu(NO3)2=Cu+ Zn(NO3)2 65 64金属与多种盐溶液的反应,原则是越远越先反应的,所以锌先和硝酸银反应,从方程式看到,溶液质量会减少的,所以从开始直到b点一直是锌和硝酸银溶液反应,...1年前查看全部
- 为了实现下列的转换,需加入还原剂的是 A KI——I2 B Fe ——Fecl2 C CU——Cu(No3)2 DFe2
为了实现下列的转换,需加入还原剂的是 A KI——I2 B Fe ——Fecl2 C CU——Cu(No3)2 DFe2O3——Fe
 airyoung1年前1
airyoung1年前1 -
 Gogorush 共回答了17个问题
Gogorush 共回答了17个问题 |采纳率94.1%A,化合价升高,需要氧化剂.
B,化合价升高,需要氧化剂.
C,化合价升高,需要氧化剂.
D,化合价降低,需要还原剂.1年前查看全部
- AgNO3和Cu(NO3)2的混合液中加一定量的铁粉.问什么铁粉先与AgNO3反应喃?
 shkj3481年前2
shkj3481年前2 -
 凌洛 共回答了16个问题
凌洛 共回答了16个问题 |采纳率81.3%高中学习会知道:因为银离子氧化性比铜离子强,所以还原剂铁优先于氧化性强的物质反应.
初中可以这样理当溶液中还有银离子时,铁即使和铜离子反应生成铜了,这些生成的铜还会继续和溶液中的银离子反应生成银和铜离子(因为活动性顺序中铜排在银前面),所以在银析完以前,铜不会析出.1年前查看全部
- 将Zn,Fe放入Cu(NO3)2,AgNO3混合溶液中,反应顺序是什么
将Zn,Fe放入Cu(NO3)2,AgNO3混合溶液中,反应顺序是什么
不是,我的意思是,比如,Zn先和硝酸银反应,然后和硝酸铜反应,反应的同时Fe在不发生任何反应等Zn反应完了才反应吗》?还是在同时反应?还是在穿插着反应(虽然很不可能)? 骆九天1年前3
骆九天1年前3 -
 G梦飘渺 共回答了20个问题
G梦飘渺 共回答了20个问题 |采纳率85%先和Ag+反应,再和Cu2+反应
先生成Ag,后铜
Zn先发生置换反应,Fe再发生置换反应1年前查看全部
- 在Cu(NO3)2和AgNO3的混合溶液中加入一少量的铁粉,充分反应后过滤,在滤液中加入稀盐酸
在Cu(NO3)2和AgNO3的混合溶液中加入一少量的铁粉,充分反应后过滤,在滤液中加入稀盐酸
有不溶于稀硝酸的白色沉淀产生,则过滤后滤纸上有_______,产生白色沉淀的化学方程式为_____________________. jxdx661年前2
jxdx661年前2 -
 aprilandroy 共回答了17个问题
aprilandroy 共回答了17个问题 |采纳率82.4%Ag
AgNO3+HCl=HNO3+AgCl(沉淀)1年前查看全部
- 化学离子共存问题条件:pH=1 (1)Cu(NO3)2 NaCl KNO3 (2)MgSO4 NaNO3 KCl 问哪一
化学离子共存问题条件:pH=1 (1)Cu(NO3)2 NaCl KNO3 (2)MgSO4 NaNO3 KCl 问哪一组可大量共存
 mofan33101年前1
mofan33101年前1 -
 246813 共回答了17个问题
246813 共回答了17个问题 |采纳率94.1%A、B都可以 因为没有沉淀、气体和水生成1年前查看全部
- 关于物质的量的一道化学题等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液
关于物质的量的一道化学题
等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的 浓度分别为a mol·L—1和b mol·L—1.则a与b的关系为
A.a = b B.a = 2b C. 2a = b D.a = 5b
为什么没有A(HNO3的量很少) 原谅他吧1年前1
原谅他吧1年前1 -
 mandylxl 共回答了23个问题
mandylxl 共回答了23个问题 |采纳率91.3%答案C 没错.但是题干不严谨,应该说溶解于足量的相同体积硝酸中,这样的话就选C了.设等质量为m,据n=m/M这个公式,则CuO和MgO的n之比为其M之比的反比,且变成溶液后铜离子、镁离子的数量都不变且等于粉末中的量,得到a:b=1:2.故选C!希望对你有帮助!呵呵1年前查看全部
- 化学:麻烦配平...Cu+HNO3----Cu(NO3)2+NO+H2O就是配平下谢谢啦若有0.3mol铜参加反应,可以
化学:麻烦配平...
Cu+HNO3----Cu(NO3)2+NO+H2O
就是配平下
谢谢啦
若有0.3mol铜参加反应,可以生成NO----L?
记得过程
谢谢 vszp1年前1
vszp1年前1 -
 海海的梦 共回答了17个问题
海海的梦 共回答了17个问题 |采纳率94.1%3Cu+8HNO3----3Cu(NO3)2+2NO+4H2O1年前查看全部
- Cu与HNO3反应生成Cu(NO3)2的反应方程式…
 路人甲乙丙丁之一1年前1
路人甲乙丙丁之一1年前1 -
 贫困山区 共回答了21个问题
贫困山区 共回答了21个问题 |采纳率90.5%化学反应方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑
离子反应方程式:3Cu + 8H+ + 2(NO3)- =3Cu2+ + 4H2O + 2NO↑
化学反应方程式:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
离子反应方程式:Cu + 4H+ + 2(NO3)- =3Cu2+ + 4H2O + 2NO2↑1年前查看全部
- 配平;Cu2S+HNO3_Cu(NO3)2+H2SO4+NO+H2O.请写出祥细过程和结果,谢谢了
 斜阳春愁1年前2
斜阳春愁1年前2 -
 davidleelei 共回答了23个问题
davidleelei 共回答了23个问题 |采纳率91.3%3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO+8H2O
Cu2S中的2个Cu由+1价升高到+2价,失去2个电子,1个S由-2价升高到+6价,失去8个电子,还原剂共失去2+8=10个电子;HNO3中的N由+5价降低到+2价,得到3个电子,氧化剂共得到3个电子.
所以Cu2S前面填3,HNO3前面填10
然后看等号后面:Cu(NO3)2前面应该是3*2=6;H2SO前面是3,NO前面是10.
由于6Cu(NO3)2中有6*2=12个未参加氧化还原的NO3-,所以前面HNO3的系数为10+12=22.
最后配平H和O就可以了.1年前查看全部
- 实验室用Cu与浓HNO3在常温下反应制取NO2气体,同时生成Cu(NO3)2和H2O,试回答:
实验室用Cu与浓HNO3在常温下反应制取NO2气体,同时生成Cu(NO3)2和H2O,试回答:
1.写出铜和硝酸反应的化学方程式.
2.若实验室用足量的浓硝酸制取23克NO2气体,则需要加入铜多少克?
3.反应中同时有多少克HNO3被还原? sddlphoenix1年前4
sddlphoenix1年前4 -
 smartkobe 共回答了22个问题
smartkobe 共回答了22个问题 |采纳率81.8%1.反应方程式为:Cu + 4HNO3 = Cu(NO3)2 + 2NO2 ↑ + 2H2O
2.由关系式:Cu 2NO2
64 92
X g 23g
可得 X=16g
3.此反应中硝酸一部分起还原作用,一部起酸性作用.
被还原硝酸与其还原产物NO2间的关系式:
HNO3 NO2
63 92
Yg 23g
可得 Y = 15.75g
则被还原的硝酸为15.75g1年前查看全部
- NO2能否支持燃烧 加热Cu(NO3)2
NO2能否支持燃烧 加热Cu(NO3)2
2Cu(NO3)2=4NO2+O2+2CuO
产生的气体能让带火星的木炭复燃
这个现象能否说明NO2支持燃烧.Why? 柳细细1年前2
柳细细1年前2 -
 dennis_zhang3 共回答了22个问题
dennis_zhang3 共回答了22个问题 |采纳率95.5%可以,理由如下
空气中O2约占五分之一,由分解的方程可以看出,NO2与O2混合气体中O2约占五分之一,同空气中的比例一样
但是,分解产生的气体却可以使带火星的木炭复燃,说明NO2支持燃烧1年前查看全部
- 向含AgNO3,Cu(NO3)2,Mg(NO3)2的混合溶液中,加入一定量的锌
向含AgNO3,Cu(NO3)2,Mg(NO3)2的混合溶液中,加入一定量的锌
1.向含AgNO3,Cu(NO3)2,Mg(NO3)2的混合溶液中锌粒,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体中一定有( )A.Ag Cu Mg B.Cu Mg Zn C.Ag Cu Zn D.Ag Mg Zn
2下列各组物质在溶液里能够大量共存的是( )A.NaOH NaCl CuCl2
B.Ca(OH)2 KCL Na2CO3 C.BaCl2 HCL Na2SO4 D.KCL Na2CO3 NaOH seth481年前1
seth481年前1 -
 金碧楼台相倚 共回答了14个问题
金碧楼台相倚 共回答了14个问题 |采纳率85.7%有氢气产生,肯定有Zn,肯定没有Mg,因为Zn不可能把Mg置换出来,那么只能选择C
D
A中有氢氧化铜生成
B中有碳酸钙生成
C中有硫酸钡生成1年前查看全部
- 初三化学(关于锌粉与AgNO3和Cu(NO3)2溶液的反应?拜托各位了 3Q
初三化学(关于锌粉与AgNO3和Cu(NO3)2溶液的反应?拜托各位了 3Q
某溶液中仅含有AgNO3和Cu(NO3)2两种溶质,将其分成A、B两份,各加入一定量的锌粉,充分反应后,过滤洗涤,分别得到滤渣和滤液; 1.将A得到的滤渣加入到稀盐酸中有气泡产生,则该滤渣中含有的物质是 ; 2.往B得到的滤液中滴加稀盐酸,有白色沉淀产生,则对应的滤渣中含有 ,滤液中含有的溶质是 . cdh9161年前2
cdh9161年前2 -
 灭螨灵 共回答了15个问题
灭螨灵 共回答了15个问题 |采纳率86.7%1、锌、铜、银 2、银; 硝酸银、硝酸铜、硝酸锌1年前查看全部
大家在问
- 1类似于这种化学题该怎么答?下列四种物质中,能将Na2SO4、Na2co3、BaCl2三种物质的溶液一次区别开的是:A.N
- 2植物体的三种组织系统在体内如何分布,各起什么作用?
- 3我是多么想念童年住在北京城南的那些景色和人物啊?(缩句 )
- 4用两个同样的长、宽、高分别为4厘米、3厘米和2厘米的小长方体,拼成一个表面积最大的长方体,这个大长方体的表面积是多少平方
- 5“树冠”这个词里的“冠”怎么念?非常紧急!今天之内必有!
- 6如图,正方形网格中的每个小正方形边长都是1,每个小格的顶点叫做格点,以格点为顶点分别按下列要求画三角形(涂上阴影).
- 7某企业2007年总生产成本比2006年上升了50%,产量增加了25%,则单位成本提高多少?
- 8化简求值:x的平方+2xy+y的平方/x的平方+xy乘x,其中x=2,y=-1.
- 9三个金“鑫“三个水叫“淼“三个人叫“众“那么三个鬼叫什么?脑筋急转弯
- 10we often by bus to Beijing.这句话应该不对吧
- 11磁场的方向是( )A.小磁针北极受力的方向B.小磁针静止时N极所指的方向C.磁针N极到S极的方向D.磁感线上某一点的切
- 12英语完形填空Recently,a record has shown that 10 percent of the fre
- 13写一篇作文,不少于50词。要用到下列词语:1.where did you go?2.Did you go with an
- 14下表为某电饭锅的主要参数.由此可知,在额定电压下工作,通过电饭锅的电流约是 ______A,电饭锅正常工作0.5h,消耗
- 15(2012•广州模拟)为构建节约型社会,加强公民节水意识,某城市制定了以下用水收费标准:每户每月用水量不超过10吨时,每
