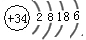氧族元素中氧和硫的所有方程式起码80个以上
 龙吟天崖2022-10-04 11:39:541条回答
龙吟天崖2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 314878 共回答了17个问题
314878 共回答了17个问题 |采纳率94.1%- (1) 硫与金属单质反应,如:
2Na + S =(研磨)Na2S
Hg + S = HgS
Fe + S = (加热) FeS
(2)硫与非金属单质反应,如:
S + H2 =(加热) H2S
S + O2 = SO2
(3)硫与强碱反应,如:
3S +6NaOH = 2Na2S + Na2SO3 +3H2O
(4)硫与强氧化酸反应,如
S + 6HNO3(浓)= H2SO4 + 6NO2 + 2H2O
S + 2H2SO4(浓)=(加热) 3SO2(气体) + 2H2O
硫及其化合物的性质
1. 铁与硫蒸气反应:Fe+S△==FeS
2. 铜与硫蒸气反应:2Cu+S△==Cu2S
3. 硫与浓硫酸反应:S+2H2SO4(浓)△==3SO2↑+2H2O
4. 二氧化硫与硫化氢反应:SO2+2H2S=3S↓+2H2O
5. 铜与浓硫酸反应:Cu+2H2SO4△==CuSO4+SO2↑+2H2O
6. 二氧化硫的催化氧化:2SO2+O2 2SO3
7. 二氧化硫与氯水的反应:SO2+Cl2+2H2O=H2SO4+2HCl
8. 二氧化硫与氢氧化钠反应:SO2+2NaOH=Na2SO3+H2O
9. 硫化氢在充足的氧气中燃烧:2H2S+3O2点燃===2SO2+2H2O
10. 硫化氢在不充足的氧气中燃烧:2H2S+O2点燃===2S+2H2O
氯及其化合物的性质
1. 氯气与氢氧化钠的反应:Cl2+2NaOH=NaCl+NaClO+H2O
2. 铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl3
3. 制取漂白粉(氯气能通入石灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
4. 氯气与水的反应:Cl2+H2O=HClO+HCl
5. 次氯酸钠在空气中变质:NaClO+CO2+H2O=NaHCO3+HClO
6. 次氯酸钙在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
F2 + H2 === 2HF
F2 +Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2 +2M===2MFn (表示大部分金属)
2F2 +2H2O===4HF+O2
2F2 +2NaOH===2NaF+OF2 +H2O
F2 +2NaCl===2NaF+Cl2
F2 +2NaBr===2NaF+Br2
F2+2NaI ===2NaF+I2
F2 +Cl2 (等体积)===2ClF
3F2 (过量)+Cl2===2ClF3
7F2(过量)+I2 ===2IF7
Cl2 +H2 ===2HCl
3Cl2 +2P===2PCl3
Cl2 +PCl3 ===PCl5
Cl2 +2Na===2NaCl
3Cl2 +2Fe===2FeCl3
Cl2 +2FeCl2 ===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
Cl2+SO2 +2H2O===H2SO4 +2HCl
Cl2 +H2O2 ===2HCl+O2
2Fe+3Br2===2FeBr3
Fe+I2===FeI2
4HCl(浓)+MnO2===MnCl2+Cl2+2H2O
4HCl(g)+O2===2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O - 1年前
相关推荐
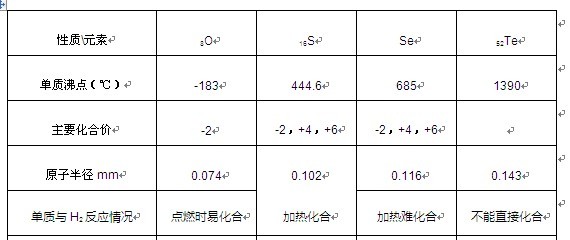
- 归纳整理是科学学习的重要方法之一.在学习了元素周期表之后,有关氧族元素的各种性质,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了元素周期表之后,有关氧族元素的各种性质,可归纳整理出如下表所示的表格(部分).
请根据上表回答下列问题:性质元素 8O 16S 34Se 52Te 单质熔点(℃) -218.4 113 450 单质沸点(℃) -183 444.6 685 1390 主要化合价 -2 -2,+4,+6 -2,+4,+6 原子半径 逐渐增大 单质与H 2 反应 点燃时易化合 加热化合 加热难化合 不能直接化合
(1)硒的熔点范围可能是______
(2)碲的化合价可能有______
(3)氢硒酸有较强的______(填“氧化性”或“还原性”),因此把它放在空气中长期保存容易变质,其可能发生的化学方程式为______. zhffync1年前1
zhffync1年前1 -
 小飞侠啊 共回答了14个问题
小飞侠啊 共回答了14个问题 |采纳率92.9%(1)由表可知:从氧到碲,单质的熔点逐渐升高,所以硒的熔点范围可能是113℃~450℃,故答案为:113℃~450℃
(2)因硒的化合价有-2,+4,+6,碲的性质与硒相似,所以碲的化合价可能有-2,+4,+6,故答案为:-2,+4,+6;
(3)因氢硒酸中硒的化合价处于-2价,处于最低价,具有还原性,能被空气中的氧气氧化,故答案为:还原性;2H 2 Se+O 2 =2H 2 O+2Se↓1年前查看全部
- 氧族元素中含有18个电子的两种氢化物的电子式
 做着梦的_心雨1年前0
做着梦的_心雨1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (8分)类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。请结合
(8分)类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。请结合元素周期律完成下列问题:(1)硒的熔点范围可能是 。
元素 8 O 16 S 34 Se 52 Te 单质熔点(℃) -218.4 113 450 单质沸点(℃) -183 444.6 685 1390 主要化合价 -2 -2,+4,+6 -2,+4,+6 原子半径 逐渐增大 单质与H 2 反应情况 点燃时易化合 加热化合 加热难化合 不能直接化合
(2)碲的化合价可能有 。
(3)氢硒酸有较强的还原性。因此放在空气中长期保存易变质,其可能发生的化学方程式为:
。
(4)工业上Al 2 Te 3 可用来制备H 2 Te,完成下列化学方程式:
Al 2 Te 3 + →Al(OH) 3 ↓+ H 2 Te↑ 冬天的桃之妖妖1年前1
冬天的桃之妖妖1年前1 -
 sjun651 共回答了22个问题
sjun651 共回答了22个问题 |采纳率90.9%(1)113~450℃(2分) (2)-2、+4、+6(2分)
(3) 2H 2 Se+O 2 ===2H 2 O+2Se(2分)
(4)Al 2 Te 3 +6H 2 O===2Al(OH) 3 ↓+3H 2 Te↑(2分)
学会分析数据;
(1)观察“单质熔点”一行数据:由左到右,逐渐升高,故硒的熔点范围可能是113~450℃;
(2)观察“主要化合价”一行数据,且同主族元素,由上到下,失电子能力逐渐增强,故会逐渐表现出正价;1年前查看全部
- 随着电荷数的增加,氧族元素的性质变化规律正确的是
随着电荷数的增加,氧族元素的性质变化规律正确的是
为什么
单质都是非金属,故不能导电
是错的? taiangh1年前5
taiangh1年前5 -
 lyfforever 共回答了23个问题
lyfforever 共回答了23个问题 |采纳率100%单质都是非金属吗?非金属都不能导电吗?明显是错的 检举氧族元素硒下面的元素的单质是金属.
非金属性越来越强
石墨也能导电的为~1年前查看全部
- 第一节 氧族元素1)2.0g硫和碳的混合物,充分燃烧后得二氧化碳和二氧化硫气体的总质量是6.0g.则原混合物中含碳多少克
第一节 氧族元素
1)2.0g硫和碳的混合物,充分燃烧后得二氧化碳和二氧化硫气体的总质量是6.0g.则原混合物中含碳多少克?
2)强碱(如NaOH)加热至沸,反应后硫转化为硫2-和三氧化硫2-,则反应的硫和生成硫2-,三氧化硫2-的物质的量之比为[ ]
A.2:1:1 B.3:2:1 C.3:1:2 D.4:1:3
3)一种比黄金贵百倍的(质量数为18,质子数为8)的O2气体,不久前在兰州近代物理研究所制备成功,1mol这种(质量数为18,质子数为8)的O2气体中所含中子的物质的量为[ ]
A.36mol B.20mol C.16mol D.10mol
4)甲,乙两种氧化物是分别含R元素为50%和40%,若已知甲是三原子分子,R元素与氧元素的质量比为1:1,则乙的化学式可能为[ ]
A.RO2 B.RO3 C.RO D.R2O3 十年股龄1年前2
十年股龄1年前2 -
 375169477 共回答了23个问题
375169477 共回答了23个问题 |采纳率91.3%1题:
设S为A,C为B,C+O2=CO2,S+O2=SO2,则有SO2的质量为2A,CO2的质量为11B/3,这两个加起来是6g,A+B=2g,2元一次的方程会解吧~
2题:你给的条件不够,哪来的S啊!,给全了我再给你解~
3题:质量数=质子数+中子数,则18mol(质量数)=8mol(质子数)+10mol(中子数),选D
4题:你说的是甲是三原子分子,R元素与氧元素的质量比为1:1,R那么R=2*16,或2*R=16,则R=32或R=8,32Y/(R+16X)=40%,X是O的个数,Y是R的个数,原题是选择而且是可能,估计是无法直接算出来了,但是可一把答案的数带入验证1下,可以的是啦~1年前查看全部
- 怎么比较氢化物的还原性?比如氧族元素与卤素
 mouseyao1年前2
mouseyao1年前2 -
 我是大懒虫 共回答了20个问题
我是大懒虫 共回答了20个问题 |采纳率80%氧化性强的一般还原性就弱,反之亦然1年前查看全部
- 两个有关氧族元素的问题向稀硫酸中加入铜不反应,若加入以下某中盐可以使铜溶解,符合条件的是( )A.NaNO3 B.KCl
两个有关氧族元素的问题
向稀硫酸中加入铜不反应,若加入以下某中盐可以使铜溶解,符合条件的是( )
A.NaNO3 B.KCl C.ZnSO4 D.Al2(SO4)3
8好意思,忘了打另一个问题了!
将SO2通入BaCl2溶液直至饱和未见沉淀,继续将另一种气体通入,也没出现沉淀,问那种气体可能是?
A.NO2 B.NH3 C.CO2 D.SO3
能不能劳驾把选项都解释一下选或不选的理由? redink20071年前1
redink20071年前1 -
 仪陇潜龙 共回答了22个问题
仪陇潜龙 共回答了22个问题 |采纳率90.9%A...
NO3-根在酸性条件下可以和Cu发生氧化还原反应,招致Cu单质溶解.
补充问题
选CO2..
解体思路:
首先直接可以得出的初步结论
由于SO2不能产生沉淀,所以估计有H+离子存在,即溶液呈酸性.
由于NH3位碱性气体,会消耗H+离子,然后溶液恢复中性或偏碱性,则原来溶解的亚硫酸根和Ba2+离子反应,生成沉淀.所以首先排除B.
SO3也比较容易排除,由于SO3和水反应生成硫酸根,和Ba2+在任何酸、碱中性环境都产生难容性沉淀.所以不可能为SO3气体.
NO2气体溶于水,生成强氧化性的硝酸,硝酸根可以氧化亚硫酸根离子为硫酸根离子,则也应该产生沉淀.所以排除NO2气体.
最后剩下CO2情况和原来SO2气体情况类似,由于无法改变溶液酸性环境,也不能氧化亚硫酸根,CO2也不能与Ba2+反应生成沉淀,所以应该没有明显现象.1年前查看全部
- 氧族元素1由铁与氯气、铁与氧气、铁与硫反应的化学方程式比较氯气、氧气、硫的氧化性强弱
 yyzone1年前1
yyzone1年前1 -
 清冷的调调 共回答了16个问题
清冷的调调 共回答了16个问题 |采纳率81.3%2Fe+3Cl2==2FeCl3
3Fe+2O2==Fe3O4
Fe+S==FeS
从这道题问法上看,应从氧化物价态判断非金属氧化性强弱
因此,氯气>氧气>硫1年前查看全部
- 将氧族元素,氮族元素,卤素,碳族元素的性质归纳一下
将氧族元素,氮族元素,卤素,碳族元素的性质归纳一下
不用太仔细 hy8381年前1
hy8381年前1 -
 漂泊咴念 共回答了21个问题
漂泊咴念 共回答了21个问题 |采纳率85.7%这四族的性质是相似的,以O族为例:
1.非金属性:从上到下,非金属性越来越弱,
2.金属性:越来越强.
3.原子半径:由于电子层不同,所以电子层多的原子半径越大.即从上到下依次半径增大.
反正根据元素周期律来归纳了,建议先精通元素周期律.1年前查看全部
- 氧族元素的递变性问题为什么从O到Po,水溶液酸性增强,而从S到Te,最高价氧化物对应的水化物酸性却减弱?能不能回答的详细
氧族元素的递变性问题
为什么从O到Po,水溶液酸性增强,而从S到Te,最高价氧化物对应的水化物酸性却减弱?能不能回答的详细一点. 未羽1年前2
未羽1年前2 -
 黄黄hyh_shine 共回答了15个问题
黄黄hyh_shine 共回答了15个问题 |采纳率93.3%氢化物水溶液的酸性与其在水中质子电离的难易有关,这个电离平衡,与生成的阴离子(即共轭碱)的稳定性有关,而这个稳定性与多出来的负电荷在粒子表面的分布有关.
形象地说,HPo-与OH-相比,同样带一个单位的负电,但是HPo-半径大很多,单位面积上分得的电荷就小很多,对H+的吸引也小很多,重新质子化的可能也小,共轭碱碱性小则酸性强.
最高价氧化物对应的含氧酸的酸性,中学化学的提法是,这个对应的是元素非金属性的强弱,自然是S到Te递减的.其实还是与酸根离子(共轭碱)的电子分布有关,也就是酸根上氧元素带的负电的多少,电负性与氧越相似,吸引电子的能力就越强,氧上带的负电就相应的少,重新被质子化的可能性小.
如果您还在上中学,可能对我说的有点难以理解,欢迎追问.1年前查看全部
- 氧族元素最高价含氧酸的化学式一定为H3RO4 这句话为什么不对
氧族元素最高价含氧酸的化学式一定为H3RO4 这句话为什么不对
RT piero36611年前1
piero36611年前1 -
 WanderForLove 共回答了21个问题
WanderForLove 共回答了21个问题 |采纳率90.5%这句话不对
这一族包含氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五种元素,其中钋为金属,碲为准金属,氧、硫、硒是典型的非金属元素.在标准状况下,除氧单质为气体外,其他元素的单质均为固体.
在和金属元素化合时,氧、硫、硒、碲四种元素通常显-2氧化态;但当硫、硒、碲处于它们的酸根中时,最高氧化态可达+6.
因为除氧,钋外最高价为+6价,所以最高价含氧酸是H2RO4,如:H2SO41年前查看全部
- 氧族元素硒酸钾(K2SeO4)与硫酸钾
氧族元素硒酸钾(K2SeO4)与硫酸钾
氧族元素硒(Se)形成的硒酸钾(K2SeO4)与硫酸钾的结构相似,若已知硫的相对原子质量为32,其他元素的相对原子质量未知。又知在硫酸钾(K2SO4)中硫元素的质量分数为a%。在硒酸钾中硒元素的质量分数为b%,求硒的相对原子质量。
 我是天天呀1年前1
我是天天呀1年前1 -
 查德威科 共回答了21个问题
查德威科 共回答了21个问题 |采纳率90.5%其他元素的相对原子质量未知?是不是意味着我不能用常规的想法解这个呀???1年前查看全部
- 在氧族元素的单质中,氧化性最强的是A:氧
在氧族元素的单质中,氧化性最强的是A:氧
B:硫
C:硒
D:碲 续集11年前1
续集11年前1 -
 wfq131 共回答了13个问题
wfq131 共回答了13个问题 |采纳率84.6%当然是氧 同一主族的元素 从上而下氧化性逐渐变弱```1年前查看全部
- 要求:字数不低于300字涉及高一氧族元素知识
 wpschang1年前1
wpschang1年前1 -
 coolwangbo 共回答了20个问题
coolwangbo 共回答了20个问题 |采纳率95%提示:硫元素的化合物,尤其是SO2的性质
氧元素的研制臭氧的性质
三百字很好写,只要重点介绍这些氧族元素组成的物质,在强调一下环保就行了1年前查看全部
- 请在这里概述您的问题指出氧族元素氢化物的挥发性,酸性和氧化 还原性的递变规律,并加以解释.
 xiaoniaobie1年前2
xiaoniaobie1年前2 -
 不同包 共回答了17个问题
不同包 共回答了17个问题 |采纳率82.4%氧族元素包括氧硫硒碲钋,其氢化物的的挥发性,酸性及氧化性均与该族元素的氧化性有关,而它们的氧化性由于其核外电子数有关,核外电子数由上到下依次增多,原子核对其最外层电子的束缚能力依次减弱,失去电子的能力依次增强.氢化物的挥发性越来越易挥发,酸性先增强后减弱,氧化性越来越弱.1年前查看全部
- 关于化学氧族元素的问题硫通常是一种黄色晶体,硫蒸气有橙色、无色、红棕色三种颜色,他们都是硫单质,但每个分子中硫原子的个数
关于化学氧族元素的问题
硫通常是一种黄色晶体,硫蒸气有橙色、无色、红棕色三种颜色,他们都是硫单质,但每个分子中硫原子的个数不同,可用Sx表示.对3种硫蒸气测定结果是:
1)橙色蒸气密度折算成标准状况后是11.34g/L,则它的化学式是()
2)红棕色蒸气的质量是相同状况相同体积空气的6.62倍,则它的化学式是()
3)无色蒸气对氢气的相对密度是64,则它的化学式是() wangwanga1年前1
wangwanga1年前1 -
 阿追1 共回答了17个问题
阿追1 共回答了17个问题 |采纳率100%(1)、11.34*22.4约=256,此时是得到的是1mol标准状态下蒸气的质量,即相对分子质量,256/32=8,即物质由8个S构成,答案S8
(2)、空气平均分子量是29(应该知道才行),可知硫蒸气分子量为:6.6*29=192,即硫原子个数:192/32=6
(3),氢气分子量:2,(两种相同状态下气体密度之比等于分子量之比),所以硫蒸气分子量:2*64=128,硫原子数:128/32=4,答案是S4 (哎,终于写好了,拿手机写真够累^_^)1年前查看全部
- 元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含74)的部分知识如d表所示,
 元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含74)的部分知识如d表所示,
元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含74)的部分知识如d表所示,
请总结表中知识规律,并依据元素周期律回答d列问题:元素 84 1uS 34Se 下我Te 单质熔点(℃) -我18.4 113 4下0 单质沸点(℃) -183 444.u u8下 1390 元素主要化合价 -我 -我,+4,+u -我,+4,+u 原子半径 逐渐增大 单质与H我反应情况 点燃时易化合 加热化合 加热难化合 不能直接化合
(1)单质硒的熔点范围可能是______.
(我)元素碲的主要化合价可能有______.
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是______(用化学式表示).
(4)氢硒酸有较强的______(填“氧化性”或“还原性”),因此露置在空气中长期保存易变质,其可能发生反应的化学方程式为______.
(下)如z所示为氧族元素单质与H我反应过程中的能量变化示意z,其中a、b、c、d分别表示氧族元素中某一元素的单质,纵坐标为相同物质的量的单质与H我反应过程中的能量变化(能量变化>0表示放热,能量变化<0表示吸热).则:b代表______,d代表______(均写单质名称). baobeiwolf1年前1
baobeiwolf1年前1 -
 wimp 共回答了25个问题
wimp 共回答了25个问题 |采纳率88%解题思路:(1)氧族元素单质的熔沸点随着原子序数的增大而增大;
(2)同一主族元素性质具有相似性,根据表中数据变化规律确定Te元素的主要化合价;
(3)S、Se、Te原子半径依次增大,与氢气反应越来越难,非金属性减弱,H-X键减弱;
(4)根据氢硒酸中硒的化合价处于-2价,处于最低价,有较强的还原性,H2Se易被O2氧化生成 Se;
(5)根据氧族元素的单质与氢气化合的越来越难且Se和Te分别与氢气反应需要吸收能量,推导出a、b、c、d分别为O2、S、Se、Te.(4)氧族元素单质的熔沸点随着原子序数的增大而增大,所以Se的熔点大于S而小于Te,即大于441℃,小于4中l℃,故答案为:大于441℃,小于4中l℃;(五)因硒的化合价有-五,+4,+1,碲的性质与硒相似,所以碲的化合...
点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查了元素周期律的综合应用,明确同一主族元素性质的相似性及递变性是解本题关键,根据相同点进行类推,但不能盲目类推,注意方法的灵活运用,题目难度中等.1年前查看全部
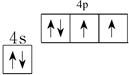
- 怎么看出氧族元素最外层有两个电子未成对呢?
怎么看出氧族元素最外层有两个电子未成对呢?
最外层电子排步nS2nP6.有三个轨道,第一个轨道两个箭头一上一下后面两个轨道分别都是象上.这和电子云的伸展方向怎么看出呢?
那么为什么后面两个轨道上上面的两个箭头不能朝下而要向上.为什么第一个轨道里面两个电子不能在后面的两个轨道里面呢? ublbhuuuu1年前1
ublbhuuuu1年前1 -
 乙肝病毒携带 共回答了21个问题
乙肝病毒携带 共回答了21个问题 |采纳率85.7%最外层的2p能级有4个电子,占有3个轨道.其中有1个2p轨道填满了2个电子,有2个2p轨道都只有1个未成对电子.因为这3个轨道位于同一能级,能量相同,彼此互相排斥(因为轨道是电子云的轮廓,而带负电的电子彼此排斥),所以2p能级的这3个轨道两两垂直,每个轨道都是哑铃形状,伸展方向类似直角坐标系的3个坐标箭头方向,3个轨道分别用2px、2py、2pz分别表示.
电子排布式:1s2 2s2 2p4
轨道排布式:[↑↓] [↑↓] [↑↓][↑][↑]
1s 2s 2px 2py 2pz
2Px,2Py和2Pz呈哑铃状排列,并且成相互垂直分布(2Px,2Py,2Pz are dumb-bell shaped,and are oriented at right angles to each other).
对于您补充的问题:
“那么为什么后面两个轨道上上面的两个箭头不能朝下而要向上?”
这是轨道排布式的人为规定,只是为了统一和方便起见.就像一般说“热量”而不说“冷量”一样.
“为什么第一个轨道里面两个电子不能在后面的两个轨道里面呢?”
电子会尽量往能量低的能级里排布,这样符合最低能量原理,可以到达最稳定的状态.一个轨道最多放两个自旋相反的电子,这是泡利不相容原理,它是根据实验总结出来的规律,没有为什么.所有遵守泡利不相容原理的粒子自旋数为整数,叫费米子,而不遵守这一原理的粒子自旋数为分数,叫玻色子,电子属于费米子.后面的两个轨道能量高,前面的轨道能量低,电子就会优先排满能层的轨道,以达到最稳定状态.对于2p能级,有4个电子和3个轨道,其中3个电子先按洪特规则各占据一个轨道,最后一个电子就随便选择一个空位入住就行了.[↑↓][↑][↑]3个符号的顺序也是属于人为规定.如果各种顺序可以乱写,那么图看起来会很不方便(尤其是到了识别核外电子很多的原子,若要识别随意书写的轨道式,眼睛都会看花去).1年前查看全部
- 归纳整理是科学学习的重要方法之一.在学习了元素周期表之后,有关氧族元素的各种性质,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了元素周期表之后,有关氧族元素的各种性质,可归纳整理出如下表所示的表格(部分).
请根据上表回答下列问题:性质元素 8O 16S 34Se 52Te 单质熔点(℃) -218.4 113 450 单质沸点(℃) -183 444.6 685 1390 主要化合价 -2 -2,+4,+6 -2,+4,+6 原子半径 逐渐增大 单质与H2反应 点燃时易化合 加热化合 加热难化合 不能直接化合
(1)硒的熔点范围可能是______
(2)碲的化合价可能有______
(3)氢硒酸有较强的______(填“氧化性”或“还原性”),因此把它放在空气中长期保存容易变质,其可能发生的化学方程式为______. zhy7575751年前1
zhy7575751年前1 -
 春绿绮 共回答了18个问题
春绿绮 共回答了18个问题 |采纳率100%解题思路:(1)由表可知:从氧到碲,单质的熔点逐渐升高;
(2)根据硒的化合价来推测;
(3)根据氢硒酸中硒的化合价处于-2价,处于最低价;(1)由表可知:从氧到碲,单质的熔点逐渐升高,所以硒的熔点范围可能是113℃~450℃,故答案为:113℃~450℃
(2)因硒的化合价有-2,+4,+6,碲的性质与硒相似,所以碲的化合价可能有-2,+4,+6,故答案为:-2,+4,+6;
(3)因氢硒酸中硒的化合价处于-2价,处于最低价,具有还原性,能被空气中的氧气氧化,故答案为:还原性;2H2Se+O2=2H2O+2Se↓点评:
本题考点: 同一主族内元素性质递变规律与原子结构的关系.
考点点评: 本题主要考查了氧族元素的性质,考查了类推法的应用,应根据不同知识的特点类推,不能盲目类推,并注意知识点与方法的有机结合,做到具体问题能具体分析.1年前查看全部
- 二氧化硫的价电子对数目怎么算?由价层电子对互斥理论,S的价电子数是6,氧族元素按不提供价电子计算,那么价电子对数=(6+
二氧化硫的价电子对数目怎么算?
由价层电子对互斥理论,S的价电子数是6,氧族元素按不提供价电子计算,那么
价电子对数=(6+0)/2=3不是平面三角形吗? 0320321101年前2
0320321101年前2 -
 ngwxr 共回答了16个问题
ngwxr 共回答了16个问题 |采纳率87.5%如果算上SO2中的那一对孤对电子,的确是平面三角形,但是我们说分子构型的时候都是忽略了孤对电子的,而只考虑带核的配体,所以SO2是V型(折线形).
希望对你有所帮助!1年前查看全部
- 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可整理出如下表所示部分数据和性质.请根据下表回答问题:
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可整理出如下表所示部分数据和性质.请根据下表回答问题:
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可整理出如下表所示部分数据和性质.请根据下表回答问题:
(1)碲的常况下单质的色态为______;硒最稳定化合价可能是______.性质元素 8O 16S 34Se 52Te 原子半径(nm) 0.066 0.104 0.117 0.137 主要化合价 -2 -2,+4,+6 -2、+4、+6 常况下单质色态 无色气体 淡黄色固体 灰色固体
略带金属光泽的主要单质熔点(℃) -218.4 113 217 450 单质与H2反应情况 点燃时易化合 加热化合 加热难化合 不能直接化合
(2)氧只能与周期表中某一种元素反应生成+2价化合物,该化合物的化学式为______;氧族元素中含有18e-的两种氢化物的化学式为______.
(3)氢硒酸敞放在空气中易变质,其可能发生的化学方程式为______.
(4)工业上用Al2Te3来制备H2Te,请完成化学方程式:______A12Te3+______═______A1(OH)3↓+______H2Te↑
(5)已知:在298K、1.01×105Pa(标准热力学状态)下,
由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
①请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系______.
②写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式为______.
(6)工业上常用价格便宜的Na2S代替NaOH作为碱来使用,结合离子方程式解释其原因:______. 帮我取个绰号撒1年前1
帮我取个绰号撒1年前1 -
 广州vv 共回答了14个问题
广州vv 共回答了14个问题 |采纳率78.6%解题思路:(1)根据同主族元素形成的单质物理性质的递变性从氧到碲,单质的颜色逐渐加深,熔点逐渐升高,单质的氧化性逐渐减弱,还原性逐渐增强;
(2)只有F的非金属性大于O,氢化物所含电子等于各原子所含电子数之和;
(3)根据氢硒酸中硒的化合价处于-2价,处于最低价;
(4)根据质量守恒定律来解题;
(5)①根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断.
②根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式;
(6)Na2S是弱酸强碱盐,水解呈碱性.(1)根据同主族元素形成的单质物理性质的递变性分析:从氧到碲,单质的颜色逐渐加深,熔点逐渐升高,因此碲的常况下单质的色态为带金属光泽的固体;从氧到碲,单质的氧化性逐渐减弱,还原性逐渐增强,因此硒具有较强的还原性,稳定的化合价应为最高价+6价,
故答案为:带金属光泽的固体;+6;
(2)只有F的非金属性大于O,氧只能与周期表中某一种元素反应生成+2价化合物是OF2;H2O2含有的电子数为1×2+8×2=18,
H2S含有的电子数为1×2+16×1=18,因此氧族元素中含有18e-的两种氢化物的化学式为H2O2和H2S,
故答案为:OF2;H2O2、H2S;
(3)因氢硒酸中硒的化合价处于-2价,处于最低价,具有还原性,能被空气中的氧气氧化,化学方程式为:2H2Se+O2=2H2O+2Se↓,
故答案为:2H2Se+O2=2H2O+2Se↓;
(4)根据质量守恒定律可得化学方程式为:A12Te3+6H2O=2A1(OH)3↓+3H2Te↑,故答案为:1;6H2O;2;3;
(5)①非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O,
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
②由①可知,b为H2Se的生成热数据,则H2Se分解放热,且△H=-81kJ/mol,
所以H2Se发生分解反应的热化学反应方程式为H2Se(g)═Se(s)+H2(g)△H=-81 kJ•mol-1,
故答案为:H2Se(g)═Se(s)+H2(g)△H=-81 kJ•mol-1;
(6)Na2S是弱酸强碱盐,在水溶液中发生水S2-+H2O⇌HS-+OH-,使溶液显强碱性,因此可以用Na2S代替NaOH作为碱来使用,
故答案为:Na2S是弱酸强碱盐,发生水S2-+H2O⇌HS-+OH-,使溶液显强碱性.点评:
本题考点: 同一主族内元素性质递变规律与原子结构的关系;热化学方程式.
考点点评: 本题主要考查了氧族元素的性质,侧重于递变规律、类推法、盐类水解的应用,应根据不同知识的特点类推,不能盲目类推,并注意知识点与方法的有机结合,做到具体问题能具体分析.1年前查看全部
- 氧族元素的各种性质可归纳整理为如下图所示的表格(部分) 回答下列问题:
氧族元素的各种性质可归纳整理为如下图所示的表格(部分) 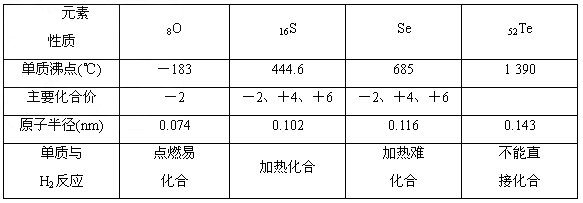
回答下列问题:
(1)硒的原子结构示意图为________。
(2)H 2 O 2 可以作脱氯剂,用于消除水中的Cl 2 ,写出该反应的化学方程式___________________________________________。
(3)碲的主要化合价可能有________。
(4)工业上可用Al 2 Te 3 制备H 2 Te,化学方程式为__________________________________。 ws02121年前1
ws02121年前1 -
 如果我是你的传说 共回答了16个问题
如果我是你的传说 共回答了16个问题 |采纳率93.8%1年前查看全部
- (14分) 某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得的资料如下:
(14分) 某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得的资料如下:
①常温下,硒(Se)和碲(Te)为固体,H 2 Se和H 2 Te为气体;
②Te和H 2 不能直接化合生成H 2 Te;
③氧气、硫、硒、碲与1 mol H 2 反应的焓变(△H)情况如下表所示。请回答下列问题:物质 O 2 S Se Te
Δ H (kJ·mol - 1 ) -242 -20 81
(1)写出氧族元素中含有18个电子的两种氢化物的化学式 、 。
(2)写出硒化氢发生分解反应的热化学方程式: 。
(3)已知H 2 Te分解反应的Δ S >0,Δ H =-154 kJ·mol - 1 ,请解释Te和H 2 不能直接化合的原因
。
(4)H 2 S的水溶液显弱酸性,写出其电离方程式 ;它的第一级电离常数可用 K a1 来表示,当温度升高时, K a1 的值 (填“一定增大”、“一定减小”或“不能确定”)。
(填“一定增大”、“一定减小”或“不能确定”)。
(5)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别充入2 mol SO 2 、1 molO 2 和4 mol SO 2 、2 mol O 2 ,在相同条件下使其反应。最终达到平衡后,甲、乙两容器中SO 2 转化率分别为50%和 α (乙),则反应的平衡常数 K c = L·mol - 1 (填写具体数据),此时 α (乙) 50%(填“大于”、“小于”或“等于”)。 joviqqq1年前1
joviqqq1年前1 -
 小桥流水我家 共回答了24个问题
小桥流水我家 共回答了24个问题 |采纳率95.8%1年前查看全部
- 下列叙述中,完全正确的是 [ ] A.同一周期的氧族元素比碳族元素的非金
下列叙述中,完全正确的是 [ ]A.同一周期的氧族元素比碳族元素的非金属性弱
B.正常雨水的PH值约为5.6,酸雨的PH<5.6;CO、Cl 2 、SO 2 都能污染大气
C.在化学反应中SO 2 +2H 2 S==S↓+2H 2 O,表现了SO 2 的还原性
D.碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱 wwwpengtao31年前1
wwwpengtao31年前1 -
 匪兵51号 共回答了19个问题
匪兵51号 共回答了19个问题 |采纳率94.7%B1年前查看全部
- 补充说明在6,9,34,17号元素中.,属于氧族元素的是.下列分子中,原子最外层满足8电子的是\?xef2.h2s.pc
补充说明
在6,9,34,17号元素中.,属于氧族元素的是.
下列分子中,原子最外层满足8电子的是?xef2.h2s.pcl3.hclo.
7克铁粉与足量硫粉共热,最多可得到硫化亚铁多少.22.15.11.10.5
在下列元素中,最高正化合价最大的是.na.s.cl.ar
某元素原子核外有3个电子层,最外层有4个电子,则原子核内质子数是多少.
下列各组物质,化学键类型相同的是.,hi和nal.naf和kcl.cl2和hcl.f2和nabr
下列物质不要互相发生反应的使.sio2和cao.高温sio2和naoh.常温 sio2 和c.高温 sio2和hno3.
下列具有漂白性的物质中.漂白原理不一样的是.hclo.o3.h2o2.so2.
下列不能用单质化合直接生成的是,cus.so2.cu2s.fes.
w 富贵竹开花1年前4
富贵竹开花1年前4 -
 punkxx 共回答了20个问题
punkxx 共回答了20个问题 |采纳率85%在6,9,34,17号元素中.,属于氧族元素的是.
34号元素是氧族元素.
下列分子中,原子最外层满足8电子的是?xef2.h2s.pcl3.hclo.
pcl3符合原子最外层是8电子.P最外层有5电子,与氯形成三个共用电子对,有6个电子,再加上未成键的两个电子,最外层有8个电子;每个氯原子,有一个共用电子对,再加上未成键的6个电子,也是8个电子.
7克铁粉与足量硫粉共热,最多可得到硫化亚铁多少.22.15.11.10.5
Fe-----FeS
56-----88
7-------X
X=11克
在下列元素中,最高正化合价最大的是.na.s.cl.ar
Cl是+7价
某元素原子核外有3个电子层,最外层有4个电子,则原子核内质子数是多少.
2+8+4=14 ,原子核内质子数14个.
下列各组物质,化学键类型相同的是.,hi和nal.naf和kcl.cl2和hcl.f2和nabr
naf和kcl都是离子键
下列物质不要互相发生反应的使.sio2和cao.高温sio2和naoh.常温 sio2 和c.
高温 sio2和hno3.
在常温下 sio2 和c不反应
下列具有漂白性的物质中.漂白原理不一样的是.hclo.o3.h2o2.so2.
so2.是和有色物质结合生成无色物质.其它三种是强氧化性,将有色物质氧化为无色物质.
下列不能用单质化合直接生成的是,cus.so2.cu2s.fes.
不能用单质化合直接生成的是cus.硫和铜反应生成Cu2S1年前查看全部
- 氧族元素的物理性质有哪些相同性 递变性是什么```
 痞子加菜鸟1年前1
痞子加菜鸟1年前1 -
 ljq63814 共回答了16个问题
ljq63814 共回答了16个问题 |采纳率75%2.化学性质相似:⑴氧、硫、硒的单质可以直接与氢气化合生成氢化物,碲不能直接化合,只能通过其他反应间接制取碲化氢.⑵硫、硒、碲均有二氧化物、三氧化物,且均是酸酐.⑶能与大多数金属直接化合.二、氧族元素的递变性(从O→Te) 1.原子结构 ⑴核电荷数逐渐增大 ⑵电子层数逐渐增多 ⑶原子半径逐渐增大 2.物理性质(单质) ⑴熔点、沸点:随核电荷数增大逐渐升高 ⑵密度:随核电荷数增大逐渐增大 ⑶导电性:随核电荷数增大逐渐增强 3.化学性质 ⑴与氢化合由易到难(Te不直接化合) ⑵与氢反应剧烈程度渐弱 ⑶氢化物稳定性渐小 ⑷最高价氧化物水化物的酸性渐弱 ⑸非金属性逐渐减弱,单质氧化性逐渐减弱 团子丿大家族 的感言:不错````` 2010-02-131年前查看全部
- 高三化学题(氧族元素)12题,说实话,我没看懂题意15题的C选项,为什么不对呢?第8题
高三化学题(氧族元素)

12题,说实话,我没看懂题意

15题的C选项,为什么不对呢?

第8题 aa岁的好i为1年前5
aa岁的好i为1年前5 -
 失散的影子 共回答了12个问题
失散的影子 共回答了12个问题 |采纳率83.3%12 物质的量和质量一样的 情况 首先考虑的就是同一种元素 这样质量才能一样 D肯定不一样
A里都是Cl B都是N C都是C
15 反应条件不一样呀
8 性质相似,也就是说S和O差不多
第一个里As2S3 As+3价 S -2价 还原性 化合价升高,所以As化合价要升高 到+5
Na2S2 S -1价 氧化性 S化合价要降低 所以方程式为
下面的式子中As为+5,S为-2 的选A1年前查看全部
- 类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,根据下表提供的氧族元素的部分性质,结合元素周期律完成下列问
类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,根据下表提供的氧族元素的部分性质,结合元素周期律完成下列问题 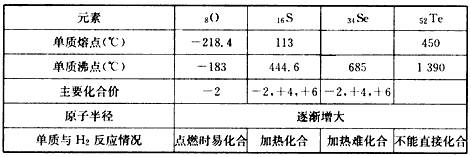
(1)硒的熔点范围可能是________________。
(2)碲的化合价可能有____________。
(3)硫、硒、碲的氢化物的稳定性由强至弱的顺序是_______________(填化学式)。
(4)氢硒酸有较强的___________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为____________________。 hl7891471年前1
hl7891471年前1 -
 冰点水冰 共回答了17个问题
冰点水冰 共回答了17个问题 |采纳率82.4%(1)113~450℃
(2)-2、+4、+6
(3)H 2 S>H 2 Se>H 2 Te
(4)还原性;2H 2 Se+O 2 =2H 2 O+2Se1年前查看全部
- 28,氧族元素的各种性质可归纳整理出如下图所示的表格
28,氧族元素的各种性质可归纳整理出如下图所示的表格
性质元素
8O
16S
Se
52Te
单质沸点(℃)
-183
444.6
685
1390
主要化合价
-2
-2,+4,+6
-2,+4,+6
原子半径mm
0.074
0.102
0.116
0.143
单质与H2反应情况
点燃时易化合
加热化合
加热难化合
不能直接化合
回答下列问题:
(1) 硒的原子结构示意图为:
(2) H2O2可以作脱氧剂,用于消除水中的Cl2,写出该反应的化学方程式: wallacechung1年前1
wallacechung1年前1 -
 luohuazhiyi 共回答了11个问题
luohuazhiyi 共回答了11个问题 |采纳率63.6%(1)根据上面的归纳的表格数据可知硫的核电荷数为16,第四周期元素有18种,所以硒元素的核电荷数=16+18=34,原子结构示意图如图(电脑可能有问题,图片不能上传),简单说一下,你自己画一画.
+34 2 8 18 6
(2)H2O2+Cl2=2HCl+O2
H2O2中的O呈-1价,氧元素的化合价既可以升高又可以降低,所以过氧化氢既是氧化剂又是还原剂.过氧化氢与强氧化剂反应时,表现出还原性;过氧化氢与强还原剂反应时,表现出氧化性.1年前查看全部
- 类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。请结合元素周期
类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。请结合元素周期律完成下列问题:
元素 8 O 16 S 34 Se 52 Te 单质熔点(℃) -218.4 113 x 450 单质沸点(℃) -183 444.6 685 1390 主要化合价 -2 -2,+4,+6 -2,+4,+6 原子半径 逐渐增大 单质与H 2
反应情况点燃时
易化合加热化合 加热难
化合不能直
接化合
(1)硒的熔点(x)范围可能是 。
(2)碲的主要化合价可能是 。
(3)在H 2 O、H 2 S、H 2 Se、H 2 Te四种氢化物中,沸点最低的物质是 ;沸点最高的物质是 。 zhouyh29121年前1
zhouyh29121年前1 -
 dd_ 共回答了20个问题
dd_ 共回答了20个问题 |采纳率95%(1)1132 S;H 2 O
根据元素的性质递变规律可知,硒的熔点应该大于硫的,而小于碲的。同主族元素性质是相似的,所以碲的主要化合价和硒是相同的。由于水中存在氢键,所以水的沸点最高。其余氢化物的沸点随相对分子质量的增大而增大。1年前查看全部
- 类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。 请结合元素周
类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。 
请结合元素周期律完成下列问题:
(1)硒的熔点(x)范围可能是_______________。
(2)碲的主要化合价可能是_______________。
(3)在H 2 O、H 2 S、H 2 Se、H 2 Te四种氢化物中,沸点最低的物质是______________;沸点最高的物质是_____________。 亚当66991年前1
亚当66991年前1 -
 奇论 共回答了19个问题
奇论 共回答了19个问题 |采纳率84.2%(1)113(2)-2,+4,+6
(3)H 2 S;H 2 O1年前查看全部
- 氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用
氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1) S单质的常见形式为S 8 ,其环状结构如下图所示,S原子采用的轨道杂化方式是 。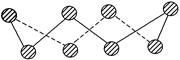
(2)Se原子在元素周期表中位置为 ;
其基态原子核外价电子的轨道表示式为 。
(3)气态SeO 3 分子的立体构型为 。
(4)H + 可与H 2 O形成H 3 O + ,H 3 O + 中存在的共价键类型为: 。H 3 O + 中H—O—H键角比H 2 O中H—O—H键角大,原因为_____________________________________________________ hyundai0071年前1
hyundai0071年前1 -
 uremybb 共回答了18个问题
uremybb 共回答了18个问题 |采纳率72.2%1年前查看全部
- 氧族元素包括O、S、Se、Te等元素。下列关于硒及其化合物的叙述不正确的是( ) A.硒化钠是以离子键形成的离子化合
氧族元素包括O、S、Se、Te等元素。下列关于硒及其化合物的叙述不正确的是( )
A.硒化钠是以离子键形成的离子化合物 B.硒难溶于水 C.H 2 S剧毒,H 2 Se无毒 D.硒与金属、非金属分界线相邻,是良好的半导体材料  刘显刚1年前1
刘显刚1年前1 -
 上吊的猪宝宝 共回答了19个问题
上吊的猪宝宝 共回答了19个问题 |采纳率73.7%C
由Na 2 S类推可知Na 2 Se是离子化合物,A项正确。由S难溶于水类推,可知Se难溶于水,B项正确。由H 2 S剧毒类比,可知H 2 Se剧毒,C项不正确。D项正确。1年前查看全部
- 石西酸的酸性比硫酸强吗?那个字打不出了是石加个西 氧族元素的一种这个问题参考书上说的都不相同
 OKLONG20041年前1
OKLONG20041年前1 -
 cbafcu0 共回答了18个问题
cbafcu0 共回答了18个问题 |采纳率88.9%这个说法虽有道理,但不妥.
有参考书上确实是这么说的,硒酸酸性比硫酸强.但这是一个值得商榷的说法,本人为此查了一下电离常数,发现它们的一级电离都是完全的,二级电离常数一样,都是1.2*10^-2.数据来源上海教育出版社的<中学化学教师手册>329~330.因此我以为在物质的量浓度相同的条件下它们的酸性是相同的.
对于硒酸而言,这已是了不起的.因为按周期律来说应该是硫酸酸性强,实际上碲酸就是弱酸,而硒酸的酸性不逊于硫酸,这已是反常了.
另外,硒酸的氧化性比硫酸强.硒酸可以氧化氢氯酸为氯气.1年前查看全部
- 价层电子对互斥模型疑问其中说:“氧族元素不向中心提供电子”,
 6suciih1年前1
6suciih1年前1 -
 HUANGSXW 共回答了14个问题
HUANGSXW 共回答了14个问题 |采纳率71.4%氧族元素最外层电子排布为 2s2 2p4 发生杂化时留有一个空的p轨道可以接受一对电子发生配位,不向中心原子提供电子1年前查看全部
- 氧族元素的题.下列物质,与另外三种漂白原理不同的是:A:HCLO B:H2O2 C:SO2 D:O3
 wqskjq1年前4
wqskjq1年前4 -
 妖刀_村正 共回答了17个问题
妖刀_村正 共回答了17个问题 |采纳率94.1%C:SO2
ABD都是利用它的氧化性.1年前查看全部
- 氧族元素最高价含氧酸的酸性强弱
 birdnew1年前2
birdnew1年前2 -
 weemoon 共回答了20个问题
weemoon 共回答了20个问题 |采纳率85%硫酸>硒酸>碲酸
H2SO4>H2SeO4>H6TeO61年前查看全部
- 填空题(114页 - 2)2.氧族元素原子的最外电子层都有【 】个电子.在化学反应里,氧族元素的原子容易从他原子【 】个
填空题(114页 - 2)
2.氧族元素原子的最外电子层都有【 】个电子.在化学反应里,氧族元素的原子容易从他原子【 】个电子,生成【 】价的化合物.氧族元素中,有的还能生成【 】价或【 】价的化合物. zhuyan9111年前4
zhuyan9111年前4 -
 16点20分 共回答了13个问题
16点20分 共回答了13个问题 |采纳率92.3%氧族元素原子的最外电子层都有【6】个电子.在化学反应里,氧族元素的原子容易从他原子【得到2】个电子,生成【-2】价的化合物.氧族元素中,有的还能生成【+4】价或【+6】价的化合物.
+4如SO2,+6如SO3.1年前查看全部
- 填空题 (114页)1.氧族元素随着和电荷数的增加,电子层数【 】,原子半径逐渐【 】,原子核吸引电子的能力依次【 】,
填空题 (114页)
1.氧族元素随着和电荷数的增加,电子层数【 】,原子半径逐渐【 】,原子核吸引电子的能力依次【 】,因此,它们的非金属性依【 】的顺序逐渐减弱,金属性逐渐【 】. jasja12331年前2
jasja12331年前2 -
 gracefulni 共回答了17个问题
gracefulni 共回答了17个问题 |采纳率94.1%1.氧族元素随着和电荷数的增加,电子层数【 增大 】,原子半径逐渐【增大 】,原子核吸引电子的能力依次【 减弱 】,因此,它们的非金属性依【 从上到下 】的顺序逐渐减弱,金属性逐渐【 增大 】.1年前查看全部
- 氧族元素氢化物沸点高低全部的元素氢化物
 娃哈哈4ehl1年前1
娃哈哈4ehl1年前1 -
 candy827 共回答了10个问题
candy827 共回答了10个问题 |采纳率90%氧的氢化物水由于含有氢键,沸点较硫、硒高
硫的氢化物硫化氢,硒的氢化物氢化硒是分子化合物,比较式量知硫化氢的沸点低于硒化氢
碲化氢属于离子化合物,沸点最高
钋属于放射性元素,不比较其氢化物.1年前查看全部
- 一些物质熔沸点反常的问题(1)对于结构相似的物质(分子)熔沸点在于该物质的相对分子量的大小例如:氧族元素的氢化物的熔沸点
一些物质熔沸点反常的问题
(1)对于结构相似的物质(分子)熔沸点在于该物质的相对分子量的大小
例如:氧族元素的氢化物的熔沸点,相对分子量大的熔沸点高(van der wal力大)
但是H2O却因为存在分子间氢键而熔沸点反常的高..
但是O2 和N2的沸点的确是O2稍高..可是N2熔点却比O2的高,这是什么原因?
(2)对于原子晶体,熔沸点由原子间共价键大小决定(即原子半径的大小).
但是O原子半径比C原子半径小.为什么SiO2的熔沸点低于SiC的熔沸点? boyworld11年前1
boyworld11年前1 -
 爱车没车 共回答了16个问题
爱车没车 共回答了16个问题 |采纳率100%若不考虑可变因素,相同环境下,物质的不同化学结构决定了物质的特性.但是物质的特性受到环境微小变化会发生逆转,这里讲到的H2O熔沸点高是因为分子间氢键的存在和O2与N2的熔点、沸点相逆都是物质存在的形式,原子半径的大小并不能单纯的决定物质的熔沸点,任何细微的化学变化都会改变物质的特性,甚至是完全相反的特性.而熔沸点恰恰是所有物质都必有的表象特性.1年前查看全部
- 为什么说氧族元素的非金属性越强,生成氢化物时放出的热量越多
 Gillobilly1年前1
Gillobilly1年前1 -
 秋香美美 共回答了22个问题
秋香美美 共回答了22个问题 |采纳率100%氧族非金属性越强,氧化应越强,越容易氧化氢气,声称氢化物
H2X(X为氧族元素),X非金属性越强,周期表中位置越考上,原字半径约小,电负性越强,越已吸引H形成稳定的化合物,化合物越稳定,它含有的能量越少,因此防热是越多1年前查看全部
- 为什么说氧族元素的非金属性越强,生成氢化物时放出的热量越多
 白天是hhwh1年前1
白天是hhwh1年前1 -
 33206407 共回答了20个问题
33206407 共回答了20个问题 |采纳率95%因为非金属性越强,则氢化物越稳定;而欲使稳定,则需放出的热量越多;逆向思维,欲分解非金属性强的氧族元素氢化物,需要的能量也越多!1年前查看全部
- 氧族元素的 1道计算已知 CuSO4 质量分数为2.0%的溶液密度为1.02g/cm3.计算: 1.配制500 mL 这
氧族元素的 1道计算
已知 CuSO4 质量分数为2.0%的溶液密度为1.02g/cm3.计算:
1.配制500 mL 这种溶液,需要 CuSO4.5H2O的质量.
2,所得溶液中CUSO4的物质的量浓度.
我其实是 硫酸铜结晶水那么地方处理不来
how to 算 zhangge1231年前1
zhangge1231年前1 -
 jony0305 共回答了16个问题
jony0305 共回答了16个问题 |采纳率75%1.CuSO4的质量=(500mL*1.02g/mL)*2.0%=10.2g,
CuSO4%=CuSO4/CuSO4.5H2O=(160/250)*100%=64%
CuSO4.5H2O的质量=10.2g/64%=15.9375g
2.C=1000*1.02g/cm3*2.0%/160=0.1275mol/L1年前查看全部
- 化学有关氧族元素的问题往400毫升0.5摩尔每升的氢氧化钠溶液中通入一定量的硫化氢气体,然后在低温下蒸发溶液,得到白色固
化学有关氧族元素的问题
往400毫升0.5摩尔每升的氢氧化钠溶液中通入一定量的硫化氢气体,然后在低温下蒸发溶液,得到白色固体7.92克.求A所有可能的组成 sunnysky19991年前2
sunnysky19991年前2 -
 不怕ss的小猫 共回答了14个问题
不怕ss的小猫 共回答了14个问题 |采纳率92.9%2NaOH+H2S=Na2S+2H2O
2Na2S+H2S+=2NaHS
氢氧化钠物质的量=0.4*0.5=0.2mol
M(NaOH)=40,M(Na2S)=78,M(NaHS)=56
四种情况
1 NaOH过量,则白色固体为NaOH和Na2S混合物
2 恰好完全反应,白色固体为Na2S 0.1mol
3 H2S稍微过量,白色固体为Na2S和NaHS混合物
4 H2S大大过量,白色固体全为NaHS
0.2mol
情况2的质量为0.1*78=7.8g
情况4的质量为0.2*56=11.2g
最初溶液中含有NaOH固体8g
所以整个通H2S的过程中,白色固体的质量变化规律是先从8g逐渐下降到7.8g,随后又逐渐增加到11.2g,然后就不再变化.
所以A所有可能的组成
1.NaOH和Na2S混合物
2.Na2S和NaHS混合物1年前查看全部
- 氧族元素3一定体积的氧气放电后有百分之六十转化为臭氧,放电后所得混合气体对氢气的相对密度为多少?
 opencn1年前1
opencn1年前1 -
 rainbownsdf 共回答了13个问题
rainbownsdf 共回答了13个问题 |采纳率84.6%设有100mol的氧气其中有60mol转化为臭氧,由3O2=2O3知臭氧有40mol所以现在总体积就是80mol所以其混合物的摩尔质量是质量除以摩尔数,就是M=m/n=100*32/80=40而氢气摩尔质量为2,所以相对密度是201年前查看全部
- 填空题(127页)1.氧族元素通常指【 】,【 】,【 】,【 】等元素.位于第四周期的氧族元素是【 】,它的K、L、M
填空题(127页)
1.氧族元素通常指【 】,【 】,【 】,【 】等元素.位于第四周期的氧族元素是【 】,它的K、L、M、N层分别有【 】个电子.他的氢化物的化学式为【 】;最高价氧化物所对应的水化物的化学式为【 】.
请帮我填空一下! ewxq1071071年前4
ewxq1071071年前4 -
 czcchl 共回答了10个问题
czcchl 共回答了10个问题 |采纳率100%氧族元素通常指【O 】,【 S】,【Se 】,【 Te 】等元素.位于第四周期的氧族元素是【 Se 】,它的K、L、M、N层分别有【 2,8,18,6 】个电子.他的氢化物的化学式为【 H2Se 】;最高价氧化物所对应的水化物的化学式为【 H2SeO4 】1年前查看全部
- 28,氧族元素的各种性质可归纳整理出如下图所示的表格
28,氧族元素的各种性质可归纳整理出如下图所示的表格
回答下列问题:
(1) 硒的原子结构示意图为:
(2) H2O2可以作脱氧剂,用于消除水中的Cl2,写出该反应的化学方程式: 痴豆1年前1
痴豆1年前1 -
 人左木右 共回答了14个问题
人左木右 共回答了14个问题 |采纳率92.9%(1)根据上面的归纳的表格数据可知硫的核电荷数为16,第四周期元素有18种,所以硒元素的核电荷数=16+18=34,原子结构示意图如图(电脑可能有问题,图片不能上传),简单说一下,你自己画一画.
+34 2 8 18 6
(2)H2O2+Cl2=2HCl+O2
H2O2中的O呈-1价,氧元素的化合价既可以升高又可以降低,所以过氧化氢既是氧化剂又是还原剂.过氧化氢与强氧化剂反应时,表现出还原性;过氧化氢与强还原剂反应时,表现出氧化性.
表格中Te主要化合价为-2、+4、+6.
表格补充:
元素名称 原子结构示意图 颜色 状态 氢化物化学式 氧化物化学式 最高价氧化物水化物化学式
氧 +8 2 6 无色 气体 H2O
硫 +16 2 8 6 黄色 固体 H2S SO2 SO3 H2SO4
硒 +34 2 8 18 6 灰色 固体 H2Se SeO2 SeO3 H2SeO4
碲 +52 2 8 18 18 6 银白色 固体 H2Te TeO2 TeO3 H2TeO4
气态氢化物的稳定性逐渐减弱.1年前查看全部
大家在问
- 1当X等于多少时,下列式子的结果是0?当X等于多少时,下列式子的结果是1?当X等于多少时,下列式子的结果是10?(2X-4
- 2小明去图书馆,去时每小时6千米,回来时每小时9千米,共用3小时,来回共用多少小时
- 3下面这段文字画线的两句话,各有一处语病,请加以修改。
- 4如图,二次函数y=ax²+bx+c(a≠0)的图像与x轴交于A、B两点,与y轴相交于点C,连接AC、BC,A、
- 5解释一下同分异构中的替代法.例如丙烷的二氯和四氯代物
- 6英语翻译1.我是景区执法人员 2.这是我的执法证,3.我可以问您一些问题吗?4.请配合我们进行调查 5.不会浪费您很多时
- 7像洁白如玉的词语有哪些
- 8送杜少府之任蜀州 本诗押韵的字是( )
- 9(1)若abc小于0,a+b+c=0,且x=a分之|a|+b分之|b|+c分之|c|,则x的2003次幂—92x+2=?
- 10(2009•延庆县一模)为防止骨质疏松,应补充的元素是( )
- 11碳酸铵是弱酸弱碱盐吧,那他会发生水解么?
- 12已知向量组a1=(1,-1,2,4)T a2=(3,0,7,14)T a3=(0,3,1,2)T a4=(1,-1,2,
- 13单摆试验摆长为L,书上说L=绳长+小球的半径 为什麽是半径,绳子是穿在小球里面的要加应该加直径啊?
- 14根号(1-25分之9)等于多少
- 15tanθ/(tan^2θ+1)=60/169 求tan