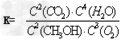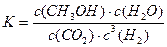甲醇燃料电池方程式酸性条件总反应式:2CH3OH + 3O2 = 2CO2 + 4H2O 正极:3O2 + 12e– +
 你是你而我是我2022-10-04 11:39:541条回答
你是你而我是我2022-10-04 11:39:541条回答酸性条件
总反应式:2CH3OH + 3O2 = 2CO2 + 4H2O
正极:3O2 + 12e– + 12H+ → 6H2O
负极:2CH4O - 12e– + 2H2O → 12H+ + 2CO2 负极的 2CO2 用加 气体放出符号么?

已提交,审核后显示!提交回复
共1条回复
 fuji3029 共回答了22个问题
fuji3029 共回答了22个问题 |采纳率95.5%- 需要 因为负极反应的反应物没有气体 生成物有气体
- 1年前
相关推荐
- 甲醇燃料电池能在高温下使用吗?为什么需要酶?
 zhenglingmz1年前2
zhenglingmz1年前2 -
 6小时睡眠时间 共回答了15个问题
6小时睡眠时间 共回答了15个问题 |采纳率93.3%是催化剂,不是酶
通常使用温度从0~40度1年前查看全部
- 如图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路
如图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到
达另一极与氧气反应,电池总反应式为2CH3OH+3O2=2CO2+4H2O.下列说法正确的是( )
 A. 左电极为电池的正极,a处通入的物质是甲醇
A. 左电极为电池的正极,a处通入的物质是甲醇
B. 右电极为电池的负极,b处通入的物质是甲醇
C. 负极反应式为CH3OH+H2O−6e−=CO2+6H+
D. 正极反应式为O2+2H2O+4e−=4OH− 于桥水库1年前1
于桥水库1年前1 -
 叼到天鹅的青蛙 共回答了30个问题
叼到天鹅的青蛙 共回答了30个问题 |采纳率96.7%解题思路:根据电子流向知,通a气体的电极是负极,负极上燃料失电子发生氧化反应,通入b气体的电极是正极,正极上氧化剂得电子发生还原反应,据此分析解答.A.根据电子流向知,左电极为负极,负极上甲醇失电子发生氧化反应,所以a处通入的气体是甲醇,故A错误;
B.根据电子流向知,右电极是正极,正极上氧化剂氧气得电子发生还原反应,所以b处通入的气体是氧气,故B错误;
C.负极上甲醇失电子和水反应生成二氧化碳和氢离子,所以电极反应式为CH3OH+H2O-6e-=CO2+6H+,故C正确;
D.正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O,故D错误;
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查了化学电源新型电池,明确正负极的判断方法、正负极上发生的反应是解本题关键,根据电子流向确定正负极,题目难度中等.1年前查看全部
- (10分)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H 2 为原料合成甲醇,该反应的
(10分)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H 2 为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H 2 (g) CH 3 OH(g) △H 1 =-116 kJ·mol -1
CH 3 OH(g) △H 1 =-116 kJ·mol -1
(1)下列措施中有利于增大该反应的反应速率的是_____________。
(2)乙醇燃料电池具有很高的实用价值。下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。则该电池的负极反应式为 。A.随时将CH 3 OH与反应混合物分离 B.降低反应温度 C.增大体系压强 D.使用高效催化剂 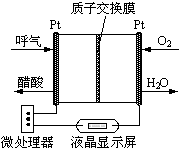
(3)已知:CO(g)+1/2 O 2 (g)=CO 2 (g);△H 2 =-283 kJ·mol -1
H 2 (g)+1/2 O 2 (g)=H 2 O(g) △H 3 =-242 kJ·mol -1
则表示1mol气态甲醇完全燃烧生成CO 2 和水蒸气时的热化学方程式为
(4)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H 2 和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答: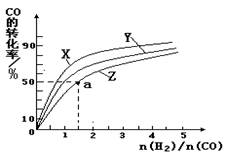
①在上述三种温度中,曲线Z对应是 。
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H 2 (g) CH 3 OH(g) 的平衡常数K = 。
CH 3 OH(g) 的平衡常数K = 。 eook001年前1
eook001年前1 -
 坐板凳的人 共回答了18个问题
坐板凳的人 共回答了18个问题 |采纳率100%(1)CD (2)CH 3 CH 2 OH+H 2 O-4e - =CH 3 COOH+4H +
(3)CH 3 OH(g)+3/2O 2 (g) = CO 2 (g)+ 2H 2 O(g) △H=-651kJ·mol -1
(4)①270℃ ②4
1年前查看全部
- (10分)科学家预言,燃料电池将是2l世纪获得电力的重要途径。一种甲醇燃料电池是采用铂或炭化钨作电极,在硫酸电解液中直接
(10分)科学家预言,燃料电池将是2l世纪获得电力的重要途径。一种甲醇燃料电池是采用铂或炭化钨作电极,在硫酸电解液中直接加入净化后的甲醇。同时向一个电极通入空气。
回答如下问题:
(1)配平电池放电时发生的化学反应方程式:
□CH 3 OH+□O 2 →□CO 2 +□H 2 O
(2)在硫酸电解液中,CH 3 OH(C为-2)失去电子。此电池的正极发生的反应是 ,负极发生的反应是 。
(3)电解液中的H + 向 极移动;向外电路释放电子的电极是 。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其主要有两点:首先燃料电池的能量转化效率高,其次是 。
(5)甲醇燃料电池与氢氧燃料电池相比.其主要缺点是甲醇燃料电池的输出功率较低.但其主要优点是 。 dogystone1年前1
dogystone1年前1 -
 ckz1120 共回答了17个问题
ckz1120 共回答了17个问题 |采纳率70.6%(1)2 3 2 4 (2)O 2 +4H + +4e - ===2H 2 OCH 3 OH+H 2 O-6e - ===CO 2 ↑+6H +
(3)正 负极 (4)减少污染 (5)甲醇比H 2 廉价,甲醇是液态(常温下),易于运输和保存
(1)甲醇中碳原子是-2价的,氧化产物中碳原子是+4价的,所以1mol甲醇失去6mol电子,而1mol氧气只能得到4mol电子,所以氧化剂和还原剂的物质的量之比是3︰2,所以方程式为2CH 3 OH+3O 2 =2CO 2 +4H 2 O.
(2)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以氧气再正极通入,甲醇再负极通入。由于是酸性溶液,所以电极反应式分别为)O 2 +4H + +4e - ===2H 2 O、CH 3 OH+H 2 O-6e - ===CO 2 ↑+6H + 。
(3)原电池中阳离子向正极移动,负极失去电子,向外电路释放电子。
(3)由于生成物是水和CO 2 ,没有污染。
(4)由于甲醇比H 2 廉价,且甲醇是液态(常温下),易于运输和保存。1年前查看全部
- 电池能量转化率【化学】已知甲醇燃料电池没生成1mol的液态水放出286kj热量,又知该电池每发1kw.h电能生成350g
电池能量转化率【化学】
已知甲醇燃料电池没生成1mol的液态水放出286kj热量,又知该电池每发1kw.h电能生成350g水,该电池能量转化率 静_子1年前1
静_子1年前1 -
 Hilo 共回答了12个问题
Hilo 共回答了12个问题 |采纳率91.7%350g水即350/18=19.44mol,可放出能量19.44*286=5561kJ即5561/3600=1.545kw.h,
该电池能量转化率=1/1.545=64.7%1年前查看全部
- 甲烷燃料电池质子交换膜、甲醇燃料电池(固体、质子交换膜、熔融碳酸钠)的电极方程式
 a64157361年前1
a64157361年前1 -
 3ab3 共回答了17个问题
3ab3 共回答了17个问题 |采纳率94.1%碱性介质下的甲烷燃料电池
负极:CH4+10OH - - 8e-===CO32- +7H2O
正极:2O2+8e-+4H2O===8OH-
离子方程式为:CH4+2O2+2OH-===CO32-+3H2O
总反应方程式为:CH4+2O2+2KOH===K2CO3+3H2O1年前查看全部
- (8分)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,甲醇燃料电池的工作原理如图所示。
(8分)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,甲醇燃料电池的工作原理如图所示。
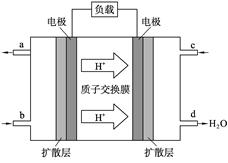
(1)请写出c口通入的物质发生的相应电极反应式 。
(2)工作一段时间后,当0.2 mol甲醇完全反应生成CO 2 时,有 N A 个电子转移。
(3)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用相关的电极反应式表示):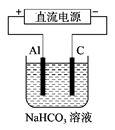
① ②Al 3+ +3HCO 3 - =Al(OH) 3 ↓+3CO 2 ↑ ddinyi1年前1
ddinyi1年前1 -
 efree 共回答了22个问题
efree 共回答了22个问题 |采纳率90.9%(1)O 2 +4e-+4H + =2H 2 O (3分) (2) 1.2(3分)
(3)①Al-3e-=Al 3+ (2分)
(1)原电池中阳离子向正极移动,所以根据氢离子的移动方向可知,c是正极,通入的是氧气,所以电极反应式为O 2 +4e-+4H + =2H 2 O 。
(2)甲醇碳原子的化合价是-2价,所以1mol甲醇失去(4+2)mol,因此当0.2 mol甲醇完全反应生成CO 2 时,有1.2N A 个电子转移。
(3)因为铝和电源的正极相连,作阳极,失去电子,生成铝离子,反应式为Al-3e-=Al 3+ 。铝离子和碳酸氢钠反应生成氢氧化铝沉淀和CO 2 气体。1年前查看全部
- 大神来.甲烷.甲醇燃料电池的正负极反应方程式,是在KOH电板条件下的,分别写出来,谢谢.
 八骄果汁1年前1
八骄果汁1年前1 -
 爱情是花 共回答了10个问题
爱情是花 共回答了10个问题 |采纳率90%甲烷碱性燃料电池
总反应:CH4+2O2+2OH- === CO3^2- + 3H2O
正极反应:O2 + 4e- + 2H2O === 4OH-
负极反应:CH4 - 8e- + 10OH- === CO3^2- + 7H2O
甲醇碱性燃料电池
总反应:2CH3OH + 3O2 + 4 OH- === 2CO3^2- + 6H2O
正极反应:O2 + 4e- + 2H2O === 4OH-
负极反应:CH3OH - 6e- + 8 OH- === CO3^2- + 6H2O1年前查看全部
- Ⅰ:甲醇燃料电池的种类很多。(1)我们常用的一种甲醇燃料电池,是以甲醇与氧气的反应为原理设计的,其电解质溶液是KOH溶液
Ⅰ:甲醇燃料电池的种类很多。
(1)我们常用的一种甲醇燃料电池,是以甲醇与氧气的反应为原理设计的,其电解质溶液是KOH溶液。写出该电池负极的电极反应式_______________。
(2)下图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。该装置中________(填“a”或“b”)为电池的正极, 已知任何反应都具有一定的可逆性。该甲醇质子交换膜燃料电池在实际工作中,各反应物、生成物均以气态的形式存在且反应也具有一定可逆性,即其反应原理可表示为 2CH 3 OH(g)+3O 2 (g) 2CO 2 (g)+4H 2 O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。
2CO 2 (g)+4H 2 O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。 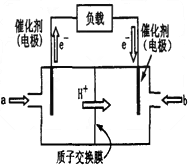
(3)已知在常温常压下:
①2CH 3 OH(l)+3O 2 (g)===2CO 2 (g)+4H 2 O(g) ΔH1=-1 275.6 kJ·mol -1
②2CO(g)+O 2 (g)===2CO 2( g)ΔH2=-566.0 kJ·mol -1
③H 2 O(g)===H 2 O(l) ΔH3=-44.0 kJ·mol -1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________。
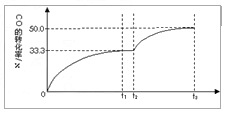
II:某温度下,向密闭容器中充入2.0 mol CO和1.0mol H 2 O,发生反应:
CO(g)+H 2 O(g)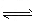 CO 2 (g)+H 2 (g)。 CO的转化率随时间变化关系如图,回答下列问题:
CO 2 (g)+H 2 (g)。 CO的转化率随时间变化关系如图,回答下列问题: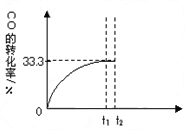
(4)如果一个可逆反应的平衡常数K值很大,下列说法正确的是_________(填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量很小
D.该反应一定是放热反应
E.该反应使用催化剂意义不大
(5)t 2 时刻向平衡体系中再通入1.0 mol H 2 O(g),t 3 时刻重新建立平衡,请在原坐标图中将改变这一条件后CO的转化率的变化趋势表示出来,必须注明再次建立平衡后CO的转化率。 龙婉儿1年前1
龙婉儿1年前1 -
 jasonwangyu 共回答了18个问题
jasonwangyu 共回答了18个问题 |采纳率72.2%1年前查看全部
- 甲醇燃料电池,稀硫酸电解液中直接加入纯化过的甲醇,同时向一个电极通入空气,求放电时的化学反应方程式
 风移花影动1年前1
风移花影动1年前1 -
 电亲 共回答了21个问题
电亲 共回答了21个问题 |采纳率95.2%总反应式与甲醇燃烧相同,2CH3OH + 3O2 == 2CO2 + 4H2O;1年前查看全部
- 甲醇燃料电池酸性条件下负极为什么和水反应
 MOICI14号1年前1
MOICI14号1年前1 -
 快乐叮叮猫 共回答了15个问题
快乐叮叮猫 共回答了15个问题 |采纳率93.3%根据方程式写出来的啊
先是正极的O2+2H2O+4E-=4OH-
酸性,所以又H++OH-=H20
写一起就是正极的方程式o2+4e-+4h+=2H2O(1)
总方程式为2CH3OH+3O2=2CO2+4H2O(2)
(2)-3(1)(方程式左右两边同时乘)
然后就是负极方程式了1年前查看全部
- 酸性和碱性甲醇燃料电池,酸性和碱性甲烷燃料电池的电极反应式,分别写出正极,负极和总反应式.并解释
 清风细浪寄深情1年前2
清风细浪寄深情1年前2 -
 0风声水起 共回答了21个问题
0风声水起 共回答了21个问题 |采纳率90.5%酸性:正极 8H(+)+2O2+8e(-)===4H2O负极 CH4+2H2O===C02+8H(+)+8e(-)总 CH4+2O2===CO2+2H2O碱性:正极 4H2O+2O2+8e(-)===8OH(-)负极 CH4+8OH(-)===C02+6H2O+8e(-)总 CH4+2O2===CO2+2H2O以前有人问过.见参考....1年前查看全部
- (12分)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(12分)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH 3 OH完全燃烧生成稳定的氧化物放出热量726.51 kJ,则甲醇燃烧的热化学方程式为 。
(2)甲醇燃料电池的结构示意图如下左图。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。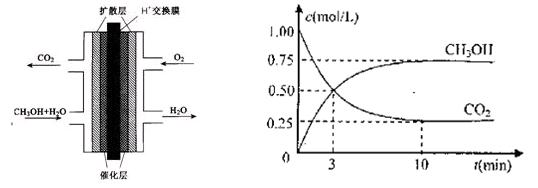
(3)目前工业上有一种方法是用CO 2 来生产燃料甲醇。为探究反应原理,现进行如下实验。在体积为1L的密闭容器中,充入1molCO 2 和3molH 2 ,一定条件下发生反应:
CO 2 (g)+3H 2 (g) CH 3 OH(g)+H 2 O(g)△H =-49.0KJ/mol
CH 3 OH(g)+H 2 O(g)△H =-49.0KJ/mol
测得CO 2 和CH 3 OH(g)的浓度随时间变化如上右图所示。
①从反应开始到平衡,氢气的平均反应速率v(H 2 )=
②该反应的平衡常数表达式为 。
③下列措施中能使n(CH 3 OH)/n(CO 2 )增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H 2 O(g)从体系中分离 D.再充入1molCO 2 和3molH 2 comtx1231年前1
comtx1231年前1 -
 daisy88 共回答了20个问题
daisy88 共回答了20个问题 |采纳率100%1年前查看全部
- 甲醇燃料电池可把电能转化为化学能?
 衰神也是神1年前1
衰神也是神1年前1 -
 四大证据 共回答了19个问题
四大证据 共回答了19个问题 |采纳率94.7%甲醇燃料电池可把化学能转化为电能1年前查看全部
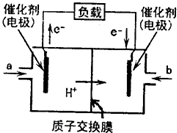
- 2013年3月30日拉萨金矿山体滑坡导致83人被埋.甲醇燃料电池(DMFC)可用于生命探测仪,该燃料电池以甲醇为燃料,氧
2013年3月30日拉萨金矿山体滑坡导致83人被埋.甲醇燃料电池(DMFC)可用于生命探测仪,该燃料电池以甲醇为燃料,氧气为氧化剂,电解质可以是质子交换膜(可传导氢离子),甲醇和氧气分别在多孔金属电极上发生反应,从而将化学能直接转化为电能,如图所示.下列说法不正确的是( )
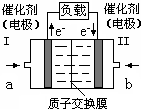
A.电极Ⅱ为电池正极,b处通入的物质是空气
B.电极Ⅰ为电池负极,a处通入的物质是空气
C.正极反应式为O2+4H++4e-=2H2O
D.负极反应式为CH3OH+H2O-6e-=CO2+6H+ doomknight1年前1
doomknight1年前1 -
 咸蛋大超人 共回答了14个问题
咸蛋大超人 共回答了14个问题 |采纳率85.7%解题思路:原电池因为电子从负极流出,所以依据装置图分析,电极Ⅰ为负极,依据甲醇与去的反应可知,甲醇在负极上发生 氧化反应,故a处充入甲醇,b处充入空气发生还原反应,电极Ⅱ为正极,电解质溶液为酸性溶液,正极发生还原反应的电极反应为:O2+4e-+4H+=2H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+.所以依据装置图分析,原电池因为电子从负极流出,电极Ⅰ为负极,依据甲醇与去的反应可知,甲醇在负极上发生 氧化反应,故a处充入甲醇,b处充入空气发生还原反应,电极Ⅱ为正极,电解质溶液为酸性溶液,正极发生还原反应的电极反应为:O2+4e-+4H+=2H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+;
A、电极Ⅱ为电池正极,b处通入的物质是空气,故A正确;
B、电极Ⅰ为电池负极,a处通入的物质是甲醇,故B错误;
C、正极发生还原反应的电极反应为:O2+4e-+4H+=2H2O,故C正确;
D、负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,故D正确;
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理的分析判断,电极名称电极判断,电极反应,主要是电子流向分析电极名称是解题关键,题目难度中等.1年前查看全部
- 甲醇燃料电池 正负极反应方程式碱性条件总反应式:2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O 正
甲醇燃料电池 正负极反应方程式
碱性条件
总反应式:2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O
正极:3O2 + 12e– + 6H20 → 12OH–
负极:2CH3OH - 12e– + 16OH~ → 2CO32- + 12H2O
酸性条件
总反应式:2CH3OH + 3O2 = 2CO2 + 4H2O
正极:3O2 + 12e– + 12H+ → 6H2O
负极:2CH4O - 12e– + 2H2O → 12H+ + 2CO2
为什么碱性电极的总反应方程式中+OH-而酸性电极的总反应方程式中不用+H+ 武当窝窝头1年前2
武当窝窝头1年前2 -
 lwq2007 共回答了18个问题
lwq2007 共回答了18个问题 |采纳率77.8%酸性条件下加不加都一样总反应方程式不变看正极反应就知道了其实是加的只是在负极中一样得到了所以总反应方程式不用写
碱性条件下正极得到12个OH–负极失去16OH~所以总反应方程式要写1年前查看全部
- 甲醇燃料电池已经面世,其结构示意图如图.甲醇在催化作用下提供质子(H+)和电子,电子经外电路、质子(H+)经内电路到达另
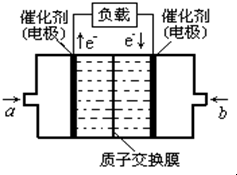 甲醇燃料电池已经面世,其结构示意图如图.甲醇在催化作用下提供质子(H+)和电子,电子经外电路、质子(H+)经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2═2CO2+4H2O,下列说法不正确的是( )
甲醇燃料电池已经面世,其结构示意图如图.甲醇在催化作用下提供质子(H+)和电子,电子经外电路、质子(H+)经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2═2CO2+4H2O,下列说法不正确的是( )
A.右电极为电池正极,b处通入的物质是空气
B.左电极为电池负极,质子(H+)从右侧通过交换膜进入左侧
C.负极反应式为:CH3OH+H2O-6e-=CO2+6H+
D.正极反应式为:O2+4H++4e-=2H2O 冰璇儿1年前1
冰璇儿1年前1 -
 双黑大贤者 共回答了17个问题
双黑大贤者 共回答了17个问题 |采纳率64.7%解题思路:由电子的方向可知a为负极,b为正极,甲醇在负极被氧化,由题意可知生成CO2和H+,负极反应为CH3OH+H2O-6e-=CO2+6H+,氧气在正极得电子被还原,生成水,正极反应式为O2+4e-+4H+=2H2O,以此解答该题.A.b为正极,氧气在正极得电子被还原,通入空气,故A正确;
B.a为负极,b为正极,原电池放电时,氢离子向正极移动,所以质子(H+)从左侧通过交换膜进入右侧,故B错误;
C.甲醇在负极被氧化,生成CO2和H+,负极反应为CH3OH+H2O-6e-=CO2+6H+,故C正确;
D.氧气在正极得电子被还原,生成水,正极反应式为O2+4e-+4H+=2H2O,故D正确.
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度中等,解答本题的关键是根据图示电子的转移方向判断电极,根据总反应式结合题意确定电极方程式,此为该题的难度,也是易错点.1年前查看全部
- 甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示.下列有关叙述正确的是( )
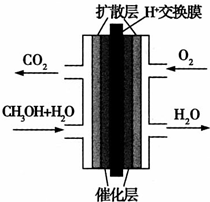 甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示.下列有关叙述正确的是( )
甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示.下列有关叙述正确的是( )
A.通氧气的一极为负极
B.H+从正极区通过交换膜移向负极区
C.通甲醇的一极的电极反应式为CH3OH+H2O−6e−
CO2↑+6H+..
D.甲醇在正极发生反应,电子经过外电路流向负极 游戏此生1年前1
游戏此生1年前1 -
 songchengfang 共回答了10个问题
songchengfang 共回答了10个问题 |采纳率100%解题思路:根据图片知,电解质溶液是酸性溶液,甲醇燃料电池中,通入甲醇的电极是负极,负极上失电子发生氧化反应,电极反应式为CH3OH(l)+H2O(l)-6e-=CO2(g)↑+6H+,正极反应式为O2+4e-+4H+=2H2O.A.通入氧气的电极是正极,正极上得电子发生还原反应,故A错误;
B.放电时,氢离子向正极移动,故B错误;
C.通入甲醇的电极是负极,负极上电极反应式为CH3OH(l)+H2O(l)-6e-=CO2(g)↑+6H+,故C正确;
D.甲醇易失电子发生氧化反应,所以甲醇在负极发生反应,电子从负极沿导线流向正极,故D错误;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了甲醇燃料电池,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写.1年前查看全部
- 酸性和碱性甲醇燃料电池,分别写出正极,负极和总反应式.
 dongnao2301年前1
dongnao2301年前1 -
 伯乐鼠 共回答了20个问题
伯乐鼠 共回答了20个问题 |采纳率100%首先,甲醇是做负极 氧气是做正极
其实在酸碱条件下 只不过反应物和生成物稍稍有点区别.
甲醇中的C最终变成+4 ,在酸性条件下就是CO2 在碱性条件下就是碳酸跟.
氧气则最终变成负2价,在酸性条件下有大量氢离子 就变成水,在碱性条件下无大量H+,就只能跟水反应生成OH-.
故酸性条件,有大量的H+ ,所以生成物是CO2.
负极:CH4O - 6e- + H2O CO3 2- + 6 H2O (电子得失守恒)
正极:O2 + 4 e- + 2H2O ==== 4OH-
总反应:2CH4O + 3O2 + 4OH- ===2CO3 2- + 6H2O1年前查看全部
- 如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电
 如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2=2CO2+4H2O下列说法中正确的是( )
如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2=2CO2+4H2O下列说法中正确的是( )
A.左边的电极为电池的负极,a处通入的是氧气
B.右边的电极为电池的负极,b处通入的是空气
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH- 阳光沐浴1年前1
阳光沐浴1年前1 -
 hcd910 共回答了15个问题
hcd910 共回答了15个问题 |采纳率86.7%解题思路:A、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;
B、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,流入的一端为正极,得到电子发生还原反应;
C、负极是甲醇失电子发生氧化反应,依据电极反应的产物和环境写出电极反应式;
D、正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式.A、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;所以a处是失电子的一端,通的是甲醇,故A错误;
B、原电池中电子是从负极流向正极;电子流出的一端是负极,流入的一端为正极,得到电子发生还原反应;电子流入的一端是正极,通入氧气得到电子发生还原反应,故B错误;
C、负极是甲醇失电子发生氧化反应,依据电池反应和酸性环境,2CH3OH+3O2=2CO2+4H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,故C正确;
D、正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式;电池的正极反应式为:O2+4H++4e-=2H2O,故D错误;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池的原理应用,电极判断,电极名称,电极反应,电极反应式书写的分析判断,掌握原电池原理是解题关键,燃料电池的特征是燃料是电子在负极反应,氧气再正极发生还原反应,题目难度中等.1年前查看全部
- 甲醇燃料电池在中性电解质中的总反应以及正极负极反应方程式
 download001年前0
download001年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO 4 溶液.请回答下列问题: 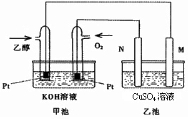
(1)N的电极反应式为______.
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气______L(标准状况下).
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇______ g.
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO 2 (g)+6H 2 (g)
CH 3 CH 2 OH(g)+3H 2 O(g) 25℃时.K=2.95×10 11催化剂 .
反应II:2CO 2 (g)+4H 2 (g)
CH 3 CH 2 OH(g)+H 2 O(g)25℃时,K=1.7l×10 22催化剂 .
①写出反应I的平衡常数表达式K=______,
②条件相同时,反应I与反应II相比,转化程度更大的是______.
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:温度升高,K值______(填“增大”、“减小”或“不变”),提高氢碳比.n(H 2 )/n(CO 2 ),对生成乙醇______(填“不利”或“有利”).
温度(K)
CO 2 转化率(%)
n(H 2 )/n(CO 2 )500 600 700 800 1.5 45 33 20 12 2 60 43 28 15 3 83 62 37 22  上ii知了1年前1
上ii知了1年前1 -
 joselt 共回答了23个问题
joselt 共回答了23个问题 |采纳率100%(1)燃料电池中,通入燃料的电极是负极,通入氧气的电极是正极,所以N极是电解池的阳极,放电的是电解质中的氢氧根离子,即4OH - -4e - =O 2 ↑+2H 2 O,故答案为:4OH - -4e - =O 2 ↑+2H 2 O;
(2)乙池中M极是阴极,该极上析出金属铜,电极反应为:Cu 2+ +2e - =Cu,当生成金属铜6.4g即0.1mol时,转移电子为0.2mol,甲池和乙池是串联电路,电路中转移电子的量相等,根据甲池中氧气的放电反应O 2 +2H 2 O+4e - =4OH - ,当转移0.2mol电子时,消耗氧气的物质的量为0.05mol,体积是0.05mol×22.4L/mol=1.12L,,故答案为:1.12;
(3)乙池中阳极反应是4OH - -4e - =O 2 ↑+2H 2 O,阴极反应依次是:Cu 2+ +2e - =Cu,2H + +2e - =H 2 ,当铜离子全部放电时,转移电子是0.6mol,设转移nmol电子时,两极上产生气体的体积相等,则两极上产生气体的物质的量等式表示为:0.25n=0.5(n-0.6),解得n=1.2,根据反应C 2 H 6 O+3O 2 =2CO 2 +3H 2 O,在转移,12mol电子时,消耗C 2 H 6 O的量为1mol,当转移1.2mol电子时,理论上消耗乙醇0.1moL,质量是4.6g,故答案为:4.6;
(4)①平衡常数K=
生成物平衡浓度系数次方的乘积
反应物平衡浓度系数次方的乘积 =
[C 2 H 6 O][ H 2 O ] 3
[C O 2 ] 2 [ H 2 ] 6 ,故答案为:
[C 2 H 6 O][ H 2 O ] 3
[C O 2 ] 2 [ H 2 ] 6 ;
②根据平衡常数表征的意义:K越大表示反应物的转化程度大,故答案为:反应II;
③根据表中的数据可以看出,温度越高,二氧化碳的转化率越小,所以平衡越往左移动,说明向左的方向是吸热的,即反应是放热,温度越高K越小,根据表中数据提高氢碳比n(H 2 )/n(CO 2 ),二氧化碳的转化率增大,所以向右进行,有利于乙醇的生成,故答案为:减小,有利.1年前查看全部
- 如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电
 如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2=2CO2+4H2O.下列说法中正确的是( )
如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2=2CO2+4H2O.下列说法中正确的是( )
A.右边的电极为电池的负极,b处通入的是空气
B.正负两电极材料一定不同
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH- zhangjunyan1年前1
zhangjunyan1年前1 -
 高峰发 共回答了17个问题
高峰发 共回答了17个问题 |采纳率88.2%解题思路:由电子的方向可知a为负极,b为正极,甲醇在负极被氧化,由题意可知生成CO2和H+,负极反应为CH3OH+H2O-6e-=CO2+6H+,氧气在正极得电子被还原,生成水,正极反应式为O2+4e-+4H+=2H2O,以此解答该题.A.b为正极,氧气在正极得电子被还原,通入空气,故A错误;
B.该装置属于燃料电池,两个电极材料可能相同,故B错误;
C.甲醇在负极被氧化,生成CO2和H+,负极反应为CH3OH+H2O-6e-=CO2+6H+,故C正确;
D.氧气在正极得电子被还原,生成水,正极反应式为O2+4e-+4H+=2H2O,故D错误.
故选:C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度中等,解答本题的关键是根据图示电子的转移方向判断电极,根据总反应式结合题意确定电极方程式,此为该题的难度,也是易错点.1年前查看全部
- (2011•江苏二模)甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,该燃料电池是以甲醇为燃料,氧气为氧化剂,电解质可
(2011•江苏二模)甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,该燃料电池是以甲醇为燃料,氧气为氧化剂,电解质可以是质子交换膜(可传导氢离子),也可以是固体氧化物(可传导氧离子),甲醇和氧气分别在多孔金属电极上发生反应,从而将化学能直接转化为电能.下列叙述中错误的是( )
A.电池放电时,甲醇在负极发生氧化反应
B.以固体氧化物为电解质的电池放电时,氧离子由负极移向正极
C.以质子交换膜为电解质的电池放电时,正极的反应为:O2+4H++4e-=2H2O
D.电池的总反应是:2CH3OH+3O2=2CO2+4H2O 什度1年前1
什度1年前1 -
 good252 共回答了20个问题
good252 共回答了20个问题 |采纳率95%解题思路:甲醇燃料电池中,CH3OH参与反应的电极为负极,负极上电极反应式为CH3OH+H2O-6e-═CO2+6H+,正极反应式为O2+4H++4e-=2H2O,电池总反应为2CH3OH+3O2=2CO2+4H2O,以固体氧化物为电解质的电池放电时,阴离子向原电池负极移动,据此分析解答.A.该电池放电时,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH+H2O-6e-═CO2+6H+,故A正确;
B.以固体氧化物为电解质的电池放电时,氧离子由负极移向负极,故B错误;
C.以质子交换膜为电解质的电池放电时,正极上氧气得电子和氢离子反应生成水,正极的反应为:O2+4H++4e-=2H2O,故C正确;
D.负极上电极反应式为CH3OH+H2O-6e-═CO2+6H+,正极反应式为O2+4H++4e-=2H2O,电池总反应为2CH3OH+3O2=2CO2+4H2O,故D正确;
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池原理,明确原电池放电时正负极上的电极反应式是解本1年前查看全部
- 甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO
+6H2O.则下列说法正确的是( )2−3
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-+H2O═CO2↑+6H+
C.由于CO
水解显碱性,电池放电时,电解质溶液的pH逐渐增大2−3
D.电池放电时每消耗1 mol CH3OH转移6 mol电子 avbnovea1年前1
avbnovea1年前1 -
 kaoniniang 共回答了33个问题
kaoniniang 共回答了33个问题 |采纳率90.9%解题思路:根据电池总反应:2CH3OH+3O2+4OH-=2CO32-+6H2O知,负极甲醇失去电子发生氧化反应;正极上氧气得电子发生还原反应,根据电池反应式判断溶液的pH值变化.A、正极氧气上得电子发生还原反应,则氧气参与反应的电极为正极,故A错误;
B、放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故B错误;
C、电池总反应:2CH3OH+3O2+4OH-=2CO32-+6H2O,反应消耗氢氧根离子,所以反应后溶液的pH减小,故C错误;
D、甲醇失电子和氢氧根离子反应生成碳酸根离子和水,则电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,所以电池放电时每消耗1 mol CH3OH转移6 mol电子,故D正确;
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题以燃料电池为载体考查了原电池原理,根据电池反应式判断正负极上发生反应的物质及溶液pH值的变化即可解答本题,难度中等.1年前查看全部
- 甲醇燃料电池碱性电解质(KOH溶液为例)总反应式:2CH4O + 3O2 +4KOH=== 2K2CO3 + 6H2O正
甲醇燃料电池
碱性电解质(KOH溶液为例)
总反应式:2CH4O + 3O2 +4KOH=== 2K2CO3 + 6H2O
正极的电极反应式为:3O2+12e- + 6H20===12OH-
负极的电极反应式为:CH4O -6e-+8OH- === CO32-+ 6H2O
怎么化出来的?电子是怎么转移的? zz男神3311年前1
zz男神3311年前1 -
 sweetkissme 共回答了13个问题
sweetkissme 共回答了13个问题 |采纳率92.3%电子从负极流向正极 以6个电子为基准讲解这个题 在负极的氧化反应中
C由负2价失去电子变成碳酸中的正4价正好失去6个 然后电子转移到正极当中参与还原反应 其还原了1.5单位氧气分子 电子的流动就造成了电流的产生 想想电流的定义 这道题还是很简单的1年前查看全部
- 甲醇燃料电池的反应式中用等号还是箭头符号
 willaal1年前1
willaal1年前1 -
 yqkgzgj 共回答了16个问题
yqkgzgj 共回答了16个问题 |采纳率81.3%等号:
碱性条件 总反应式:2CH4O + 3O2 + 4OH-= 2CO32- + 6H2O
正极:3O2 + 12e– + 6H20 → 12OH–
负极:2CH4O - 12e– + 16OH~→ 2CO32- + 12H2O
酸性条件 CH4 +2O2→CO2+2H2O
正极:3O2 + 12e– + 12H+ → 6H2O
负极:2CH4O - 12e– + 2H2O → 12H+ + 2CO21年前查看全部
- 甲醇燃料电池在酸性条件下的电极方程式应该怎么写
 痛欲生1年前2
痛欲生1年前2 -
 cgeyg 共回答了17个问题
cgeyg 共回答了17个问题 |采纳率100%告诉你一个书写燃料电池方程式的窍门:
已知任意一种燃料(如乙醇)和电解质的性质(一般为酸或碱).
氧气变水(酸性)或氢氧根(碱性),一个氧原子得两电子,共四电子.
然后把氧的式子写出来:
O2+ 4H+ +4e- = 2H2O(当然你问的是酸性,如果是碱性:
O2+ 2H2O +4e- =4OH-)
总的式子:2CH3OH+3O2=2CO2+4H2O
总的式子减去氧的式子乘以养的系数(这里为3,总的式子里有3O2)
3O2+ 12H+ +12e-=6H2O
相减:2CH3OH - 12H+ -12e-=2CO2-2H2O
带负号的移到对面去:
2CH3OH+2H2O=2CO2+ 12H+ +12e-.
就写完了.
当然你化简一下也可以.
遇到比较麻烦的就相减就可以了.1年前查看全部
- 科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇燃料电池是采用铂或碳化
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。
回答下列问题:
(1)这种电池放电时发生的化学反应方程式是____。
(2)此电池的正极发生的电极反应式是____;负极发生的电极反应式是____。
(3)电解液中的H + 离子向____极移动;向外电路释放电子的电极是____。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是___。 zzylulu1年前1
zzylulu1年前1 -
 nan_myme 共回答了17个问题
nan_myme 共回答了17个问题 |采纳率88.2%(1) 2CH 3 OH+3O 2 ==2CO 2 +4H 2 O
(2) 3O 2 +12H + +12e - == 6H 2 O; 2CH 3 OH+2H 2 O-12e - ==2CO 2 +12H +
(3)正; 负极
(4)燃料电池减少了对空气的污染1年前查看全部
- 甲醇燃料电池的电池反应为:2CH3OH+3O2放电充电2CO32-+6H2O,则下列说法不正确的是( )
甲醇燃料电池的电池反应为:2CH3OH+3O2
2CO32-+6H2O,则下列说法不正确的是( )放电 充电
A.充电时,电能转化为化学能
B.充电时,电解质溶液中pH逐渐增大
C.放电时,CH3OH参与反应的电极为负极,发生还原反应
D.放电时,负极的电极反应为:CH3OH-6e-+8OH-═CO32-+6H2O lloveyou0041年前1
lloveyou0041年前1 -
 KEN102 共回答了15个问题
KEN102 共回答了15个问题 |采纳率93.3%解题思路:放电时,根据电池反应式知,C元素的化合价升高,所以甲醇所在电极为原电池的负极,O元素的化合价降低,所以通入氧气的极为原电池的正极,负极上发生氧化反应,正极上发生还原反应,充电时,阴阳极上电极反应式为正负极的电极反应式的逆反应;根据电子守恒计算消耗的甲醇,以此来解答.A.充电时,是电解池装置,电能转化为化学能,故A正确;
B.充电时,电解质溶液中有氢氧根离子生成,所以溶液的pH增大,故B正确;
C.放电时,CH3OH参与反应的电极是负极,C元素的化合价升高,发生了氧化反应,故C错误;
D.放电时,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故D正确;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,明确充放电时各个电极上发生的电极反应是解本题关键,难点是电极反应式的书写,要注意结合电解质溶液酸碱性书写,为易错点.1年前查看全部
- 甲醇燃料电池的负极为什么除甲醇水外还要家氢氧化纳
 getdown7771年前2
getdown7771年前2 -
 renqinwu 共回答了17个问题
renqinwu 共回答了17个问题 |采纳率100%有助于O2与H2O反应生成OH-在碱溶液中定向移动,而甲醛的H失去电子变成H+能与OH-反应生成H20,加入碱能保证导电性能.也可以加入酸.
碱性溶液时
负极:CH3OH-6e-+8OH-=CO3 2-+6H2O
正极:O2+6e-=8OH-
酸性溶液时:
负极:CH3OH-6e-+H2O=CO2+6H+
正极:O2+ H+ + 6e-=H2O1年前查看全部
- 下列化学用语正确的是( )A.HCl的电子式:B.CO2的比例模型:C.在电解液为氢氧化钾溶液的甲醇燃料电池内电路中,
下列化学用语正确的是( )
A.HCl的电子式: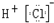
B.CO2的比例模型:
C.在电解液为氢氧化钾溶液的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8 OH -=C
+6 H2OO 2−3
D.次氯酸的结构式
 honghong10081年前1
honghong10081年前1 -
 栩栩如楠 共回答了22个问题
栩栩如楠 共回答了22个问题 |采纳率90.9%解题思路:A.HCl是共价化合物;
B.碳原子半径比氧原子半径大;
C.碱性条件下,负极上甲醇失电子生成碳酸根离子;
D.次氯酸中O原子成2个共价键,H原子、Cl原子成1个共价键,O原子分别与H、Cl原子形成1对共用电子对.A.HCl是共价化合物,不能用中括号,不用标电荷,故A错误;
B.碳原子半径比氧原子半径大,但比例模型中C原子的比较比O原子半径小,故B错误;
C.碱性条件下,负极上甲醇失电子生成碳酸根离子,所以负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故C正确;
D.次氯酸中O原子成2个共价键,H原子、Cl原子成1个共价键,O原子分别与H、Cl原子形成1对共用电子对,次氯酸的电子式为 ,结构式为H-O-Cl,故D错误.
,结构式为H-O-Cl,故D错误.
故选C.点评:
本题考点: 电子式;结构式;球棍模型与比例模型;电极反应和电池反应方程式.
考点点评: 本题考查常用化学用语的书写与理解等,比较基础,注意次氯酸的电子式容易受化学式影响书写错误.1年前查看全部
- 甲醇燃料电池可用于笔记本电脑、汽车等,它一极通入甲醇,电解质是能够传导氢离子的溶液,电池工作时,甲醇被氧化为CO2和H2
甲醇燃料电池可用于笔记本电脑、汽车等,它一极通入甲醇,电解质是能够传导氢离子的溶液,电池工作时,甲醇被氧化为CO2和H2O,下列叙述不正确的是( )
A.电池总反应为:2CH3OH+3O2=2CO2+4H2O
B.负极的反应为:CH3OH-6e-+H2O=CO2+6H+
C.正极的反应是:O2+2H2O+4e-=4OH-
D.电池工作时,H+移向正极 法案小子1年前1
法案小子1年前1 -
 mzjzsjly 共回答了15个问题
mzjzsjly 共回答了15个问题 |采纳率73.3%解题思路:甲醇燃料电池中,负极上甲醇失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动.A.甲醇燃料电池中,甲醇和氧气反应生成二氧化碳和水,所以电池反应式为:2CH3OH+3O2═2CO2+4H2O,故A正确;
B.负极上甲醇失电子和水反应生成二氧化碳和氢离子,所以电极反应式为:CH3OH+H2O-6e-═CO2↑+6H+,故B正确;
C.正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-═2H2O,故C错误;
D.该原电池放电时,氢离子由负极向正极移动,故D正确;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理,明确元素的化合价变化、氧化还原反应与原电池反应的关系是解答本题的关系,注意电解质溶液中阴阳离子的移动方向,为易错点.1年前查看全部
- 方程式怎样快速配平? 比如甲醇燃料电池碱性条件下的反应式?
 在风中消散1年前1
在风中消散1年前1 -
 helenren 共回答了19个问题
helenren 共回答了19个问题 |采纳率84.2%甲醇:CH3OH 即 CH4O
酸性条件 2CH4O +3O2→2CO2+4H2O
正极:O2 + 4e(-) + 4H(+) → 2H2O
负极:CH4O - 6e(-) + H2O → 6H(+) + CO2
附:
碱性条件 总反应式:2CH4O + 3O2 + 4OH-= 2CO32- + 6H2O
正极:O2 + 4e(-)+ 2H20 → 4OH(-)
负极:CH4O - 6e(-) + 8OH(-) → CO3(2-) + 6H2O
方程式怎样快速配平?
待定系数法配平
例如对于 HNO3——H2O+NO2↑+O2↑的反应,可以如下方法配平:
1、先假设系数为a 、b、 c、 d,则aHNO3=bH2O+cNO2↑+dO2↑
2、根据质量守衡定律,反应前后原子的种类和个数不变.
对于H原子,反应前为a个,反应后为2b个,即a=2b
对于N原子,反应前为a个,反应后为c个,即a=c
对于O原子,反应前为3a个,反应后为b+2c+2d个,即3a=b+2c+2d
3、任意设一个整数,比如a=1
4、解方程组,得a=1,b=1/2 ,c=1,d=1/4
5、代入方程式中,得到HNO3= H2O+NO2↑+ O2↑
6、将方程式乘以4,去掉分母,得到4HNO3=2H2O+4NO2↑+O2↑1年前查看全部
- 甲醇燃料电池每生成1mol水放出286千焦热量,该电池每发1千瓦时电能生成350克水,问该电池的能量转化率
甲醇燃料电池每生成1mol水放出286千焦热量,该电池每发1千瓦时电能生成350克水,问该电池的能量转化率
迷糊了哦,从哪算啊,要思路, wangxiaojuan_1231年前2
wangxiaojuan_1231年前2 -
 宿庐阳 共回答了20个问题
宿庐阳 共回答了20个问题 |采纳率75%第一:1mol水是18克吧,那350克是多少摩尔水?会算吧.假设是a mol,第二:那么每发电1千瓦时不就可以算出消耗多少摩尔的水了吗,第三:然后就可算出每摩尔的水产生的电能了吗.第四:每摩尔的水产生能量是286千焦,由第三步算出了每摩尔的水产生的电能了吧,所以两者比值就得出转化率了啊.1年前查看全部
- 用能传导氧离子的固体作电极的甲醇燃料电池的电极反应和总反应
 春秋_蠢丘1年前1
春秋_蠢丘1年前1 -
 xn_trypsin 共回答了11个问题
xn_trypsin 共回答了11个问题 |采纳率90.9%甲醇燃料电池
总反应:2CH3OH+3O2+4KOH=2K2CO3+6H2O
正极:2O2+4H2O-8e-=8OH-
负极:2CH3OH+16OH-+12e-=2CO3(2-)+12H2O1年前查看全部
- 附加题:科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用
附加题:科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.回答下列问题:(甲醇的化学式:CH3OH)
(1)此电极的正极发生的电极反应式是______;
负极发生的电极反应式是______.
(2)电解液中的H+离子向______极移动;向外电路释放电子的电极是______极.
(3)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是______. 轮回中的缘份1年前1
轮回中的缘份1年前1 -
 yiyi470896013 共回答了14个问题
yiyi470896013 共回答了14个问题 |采纳率85.7%解题思路:(1)根据得失电子及反应类型判断电极反应式;
(2)根据原电池工作原理分析;
(3)根据对环境的影响分析.(1)燃料燃烧时,燃料失电子发生氧化反应,氧气得电子发生还原反应;原电池中负极上发生氧化反应,正极上发生还原反应,所以燃料在负极上发生反应,氧气在正极上发生反应;正极上氧气得电子和氢离子反应生成水;负极上燃料失电子和水反应生成氢离子和二氧化碳.
故答案为:3O2+12H++12e-═6H2O;2CH3OH+2H2O-12e-═12H++2CO2;
(2)负极上失电子,所以电子从负极沿外电路流向正极,正极上有大量的电子,负极附近有大量阳离子生成,根据异性电荷相吸,溶液中的氢离子向正极移动.
故答案为:正;负;
(3)燃料电池把化学能转变成电能,对环境影响很小,燃料直接燃烧会对环境造成污染.故答案为:污染少.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了化学电源新型电池,对燃料电池的考查类型主要有电极反应式、电池反应式的书写、正负极的判断等,书写电极反应式时注意:原料相同,若电解质溶液不同,电极反应式就不同.1年前查看全部
- 甲烷燃料电池和甲醇燃料电池分别在碳酸根和氧二负离子存在下的电极反应方程式
 彷徨的苹果虫儿1年前1
彷徨的苹果虫儿1年前1 -
 神雕大瞎 共回答了13个问题
神雕大瞎 共回答了13个问题 |采纳率92.3%碱性介质下的甲烷燃料电池 负极:CH4+10OH-—8e-===CO32- + 7H2O 正极:O2+4e-+2H2O===4OH-离子方程式为:CH4+2O2+2OH-===C O32-+3H2O 总反应方程式为:CH4+2O2+2KOH== =K2CO3+3H2O 酸性介质下的甲烷燃料电池:负极:CH 4-8e-+2H2O=CO2+8H+ 正极:O2+4e-+ 4H+=2H2O CO32-是碳酸根,反应过程就是把原来的 直接燃烧变成间接的,通过酸性或碱性的 溶液介质,让溶液中的氢氧根或水分子等 和反应物质先反应,电子通过外部的导线 传递,溶液内的离子通过浓度差从阳极迁 移到阴极或从阴极到阳极,保持溶液内离 子浓度的平衡.如第一个碱性条件下,CH4和OH-反应,给出8个电子,通过外部导线传到正极,这样外部就产生电流,正极的氧就结合负 极给出的电子,和水结合在生成OH-,正 常电池反应中溶液浓度是不会变化的,单 此处溶液PH会逐渐降低,因为甲烷燃烧 产生的是CO2,CO2和水结合产生H2CO3 ,这里就会产生H+,所以PH会降低,同 时因为OH-浓度的改变也会影响电池的效 率,所过过一段时间就要通过其他的方法 改变一下溶液的PH,保证电池的效率.酸性条件按碱性类推一下就出来了.1年前查看全部
- 有些问题比较懵,如甲醇燃料电池在碱性条件下的负极方程式为{CH3OH-6e-+8OH-==CO32- +6H2O } 失
有些问题比较懵,如甲醇燃料电池在碱性条件下的负极方程式为{CH3OH-6e-+8OH-==CO32- +6H2O } 失去6个e-我明白 ,但不会计算出那8个OH-和Co32-的化学计数量,求技巧.
 ziwan2171年前1
ziwan2171年前1 -
 ityviewer7 共回答了24个问题
ityviewer7 共回答了24个问题 |采纳率83.3%这个问题很简单,就是电荷守恒问题.
因为甲醇中的C是-2价,被氧化生成CO32-,其中C+4价,失去6e-,C守恒,则有
1CH3OH - 6e-+ OH- ----》1CO32- + H2O
再根据电荷守恒,电子呈负电,即- 6e-显+6, +6 -X=-2, 则OH-前放8,最后再观察法配平.
1CH3OH - 6e-+ 8OH- = 1CO32- + 6 H2O1年前查看全部
- 如图是甲醇燃料电池工作的示意图1,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的
如图是甲醇燃料电池工作的示意图1,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.

(1)甲中负极的电极反应式为______.
(2)乙中A极析出的气体在标准状况下的体积为______.
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2,则图中②线表示的是______离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要______mL 5.0mol/L NaOH溶液. wangqsh1年前1
wangqsh1年前1 -
 plm12qaz 共回答了21个问题
plm12qaz 共回答了21个问题 |采纳率95.2%解题思路:(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,注意电解质溶液是碱性溶液;
(2)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气;A电极为阳极,溶液中的氢氧根离子失电子生成氧气;阳极电极反应和电子守恒计算得到;
(3)C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4xx
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L,故答案为:2.24L;
(3)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据(2)计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,溶液中有Fe3+ 0.2mol,Fe2+ 0.3mol,Cu2+为0.1mol,所以需要加入NaOH溶液1.4mol,所以NaOH溶液等体积为,[1.4mol/5mol/L]=0.28L=280ml,
故答案为:Fe2+;280.点评:
本题考点: 化学电源新型电池.
考点点评: 本题综合原电池电解原理乙级原电池知识,综合性强,难度大,主要考查学生分析问题的能力,是高考的热点习题.1年前查看全部
- 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料
 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
(1)甲池中O2所在电极为______极,乙池中M为______极
(2)N的电极反应式为______.
(3)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气为______升(标准状况下).
(4)在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况下),理论上需通入______克乙醇. MiraiNoYume1年前1
MiraiNoYume1年前1 -
 黑舞 共回答了11个问题
黑舞 共回答了11个问题 |采纳率81.8%解题思路:(1)燃料电池中氧气为正极反应物,燃料为负极反应物,与原电池的负极相连为阴极;
(2)电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,和电源的负极相连的是阴极,该极上发生得电子的还原反应;
(3)根据电极反应式结合电子守恒来计算;
(4)根据电极反应式结合电子守恒来计算.(1)燃料电池中氧气为正极反应物,燃料为负极反应物,与原电池的负极相连为阴极,则M与负极相连为阴极;
故答案为:正;阴;
(2)燃料电池的正极上是氧气发生得电子的还原反应,电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,所以N是阳极,该极上电极反应为:2H2O-4e-=O2↑+4H+,故答案为:2H2O-4e-=O2↑+4H+;
(3)乙池中M电极析出金属铜6.4g,根据电极反应:Cu2++2e-=Cu,析出金属铜6.4g即0.1mol,转移电子的物质的量是0.2mol,在燃料电池的正极上发生电极反应:
O2+2H2O+4e-=4OH-,当转移电子的物质的量是0.2mol时,消耗氧气的物质的量是0.05mol,体积是0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)乙池中发生的反应分别是:阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol•L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,乙醇燃料电池的负极上发生反应:C2H6O+16OH--12e-=2CO32-+11H2O,当转移电子是1.2mol,消耗乙醇的物质的量是0.1mol,质量是0.1mol×46g/mol=4.6g,
故答案为:4.6.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理和电解池原理的应用,注意根据串联电路中转移的电子的物质的量相等结合电极方程式计算分析,题目难度中等.1年前查看全部
- 甲醇燃料电池酸性碱性条件下怎么写?我知道答案,需要的是过程,怎么写出来,总不可能靠死记硬背吧,
甲醇燃料电池酸性碱性条件下怎么写?我知道答案,需要的是过程,怎么写出来,总不可能靠死记硬背吧,
求方法 迷迭11年前1
迷迭11年前1 -
 小白028 共回答了23个问题
小白028 共回答了23个问题 |采纳率82.6%2CH3OH+2H2O=2CO2+ 12H+ +12e-
教个简单方便又好用的方法你吧,首先要写出方程式,最重要的是要注意反应的酸碱性,酸性的和碱性的是不同的.方法是先预测在中性环境中反应的产物是什么,再看它跟所处的环境即H+和OH-是否反应,如反应,则反应产物才是最终产物.
步骤一:先算出碳原子得失多少电子(利用化合价的升降来得出),然后个数就是电子的系数
步骤二:利用电荷守恒(应该懂吧?)
步骤三:利用物料守恒(原子守恒)
只要你学会了,我敢保证你的方程式是绝对正确的,我就是最好的例子.
另上楼的方法是不容易出错的,但是浪费时间,而我们在考试的时候最宝贵的就是时间,我用这个方法比那些用楼上的方法的人的时间快了不止一倍,是很省时间的,当然如果你的成绩不是很好的话,那么楼上的方法对你来说是最好的了1年前查看全部
- 甲醇燃料电池可不可以用碱液做电解质
 幽蓝悠然1年前1
幽蓝悠然1年前1 -
 漫步人生梦 共回答了13个问题
漫步人生梦 共回答了13个问题 |采纳率100%以现有技术,尚不能在甲醇燃料电池中采用碱性电解质.原因很简单,甲醇燃料电池正常运行时的排出产物是水和二氧化碳,而二氧化碳是弱酸性气体,会和碱液之类物质反应生成碳酸盐和水.这样,电解质就被燃料电池自己的排出产物所消耗,使得工作性能严重衰减了.1年前查看全部
- 急求! 高中化学原电池甲醇燃料电池强碱为电解质电极反应式,总方程式!
 gege5201年前4
gege5201年前4 -
 yymamaha 共回答了22个问题
yymamaha 共回答了22个问题 |采纳率95.5%正极 O2 + 2H2O + 4e- = 4OH-
负极 CH3OH + 8OH- - 6e- = (CO3)2- + 6H2O
总反应 2CH3OH + 3O2 + 4OH- = 2(CO3)2- + 6H2O1年前查看全部
- 高中化学甲醇燃料电池酸性条件下总反应CO2为什么不变CO32-
 罗南希1年前1
罗南希1年前1 -
 冰咖啡浮罗多 共回答了16个问题
冰咖啡浮罗多 共回答了16个问题 |采纳率81.3%CO32-在酸性条件下不存在
CO32-和氢离子生成CO21年前查看全部
- 甲醇燃料电池碱性条件下为什么不产生碳酸根
 樱桃cherry1年前3
樱桃cherry1年前3 -
 美丽心情777 共回答了23个问题
美丽心情777 共回答了23个问题 |采纳率95.7%碱性条件下即存在OH-
CO3(2-)+OH(-)=CO2↑+H2O
所以碳酸根和氢氧根直接变成二氧化碳和水
故不存在碳酸根
【风雨清华路】为你解答1年前查看全部
- (Ⅰ)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(Ⅰ)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)25℃、101 kPa时,1 mol CH 3 OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为: 。
(2)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),写出该极的电极反应式 。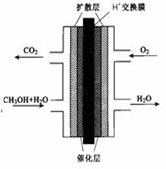
(Ⅱ)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO 2 +4H + +2SO 4 2 - 2PbSO 4 +2H 2 O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO 4 +2H 2 O,请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是 电解液中H 2 SO 4 的浓度将变 ;
(2)在完全放电耗尽PbO 2 和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 B电极上生成 。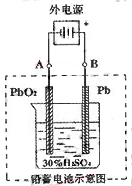
 cyone20061年前1
cyone20061年前1 -
 卜超卜超 共回答了16个问题
卜超卜超 共回答了16个问题 |采纳率81.3%(Ⅰ)(1)CH 3 OH(l) + 3/2 O 2 (g)= CO 2 (g) + 2H 2 O(l) △H ="-726.51" kJ/mol
(2)负 CH 3 OH + H 2 O -6 e - = CO 2 + 6 H +
(Ⅱ)(1)PbO 2 +2e - +4H + +SO 4 2 - =PbSO 4 +2H 2 O 小 (2)Pb PbO 2
1年前查看全部
- 笔记本甲醇燃料电池的工作原理
 我是雪1年前1
我是雪1年前1 -
 emilieyan 共回答了10个问题
emilieyan 共回答了10个问题 |采纳率100%直接甲醇燃料电池是质子交换膜燃料电池的一种变种,它直接使用甲醇而勿需预先重整.甲醇在阳极转换成二氧化碳,质子和电子,如同标准的质子交换膜燃料电池一样,质子透过质子交换膜在阴极与氧反应,电子通过外电路到达阴极,并做功 .较其它电池能量转化率高. 总反应式:2CH4O + 3O2 = 2CO2 + 4H2O 酸 2CH4O+3O2+4OH–=2CO3(2-) +6H2O 碱 碱性条件 :正极:3O2 + 12e– + 6H20 → 12OH– 负极:2CH4O - 12e– + 16OH– →2CO3( 2-) + 12H2O 酸性条件 :正极:3O2 + 12e– + 12H+ → 6H2O 负极:2CH4O - 12e– + 2H2O → 12H+ + 2CO2 这种电池的期望工作温度为120℃以下,比标准的质子交换膜燃料电池略高,其效率大约是40%左右1年前查看全部
- 甲醇燃料电池分别在酸中和碱中的化学方程式和电极方程式?
 zkr19881年前2
zkr19881年前2 -
 小雨阳光小草 共回答了16个问题
小雨阳光小草 共回答了16个问题 |采纳率87.5%碱性条件
化学方程式:2CH4O + 3O2 + 4OH-= 2CO32- + 6H2O
正极:O2 + 4e(-)+ 2H20 → 4OH(-)
负极:CH4O - 6e(-) + 8OH(-) → CO3(2-) + 6H2O
酸性条件
化学方程式:2CH4O +3O2→2CO2+4H2O
正极:O2 + 4e(-) + 4H(+) → 2H2O
负极:CH4O - 6e(-) + H2O → 6H(+) + CO21年前查看全部
大家在问
- 1____ nice gift it is!
- 211乘以11又11分之10=?谢谢
- 3有关于大雁的诗句
- 4麦迪在一次比赛中22投14中得28分,除了3个三分球全中外,他还投中了 ___ 个两分球和 ___ 个罚球.
- 5某商人要坐船渡到对岸,已知船在静水中的速度2米/秒,当时的水速为4米/秒河宽为6米.则他到达对岸至少所需时间( )
- 6tom asked his teacher how he could piay the violin well改为直接引
- 7(2013•无锡)高纯氧化钙是用于电子工业重要的无机化工原料.用硝酸钙溶液制备高纯氧化钙的工艺流程如图:
- 8法兰克加工中心中的G16后X为负的是什么意思?
- 9can you tell me what shoud i do
- 10为什么f(x)在x=1处左导数存在,右导数不存在?
- 11同学们参加春游活动,五、六年级一共去了330人,六年级的人数是五年级的1.2倍,两个年级各去了多少人?
- 12已知椭圆x^2/a^2+y^2/b^2=1(a>b>0)的左焦点为F,左,右顶点分别为A,C,上顶点为B,O为原点,P为
- 13已知一组数据A1,A2,A3,A4的方差是4,且A1的平方+A2的平方+A3的平方+A4的平方=20,则这组数据的平均数
- 14(2014•东阳市二模)设全集U=R,集合A={x|x2-2x<0},集合B={x|y=lg(x-1)},则A∩B=(
- 15f(x)=√3sinxcosωx-cos²ωx(ω>0)的周期为π/2.