锑的原子量为121.760 已知锑有两种以上的天然同位素,则121,760是( )
 simia112022-10-04 11:39:541条回答
simia112022-10-04 11:39:541条回答A.用各种锑的天然同位素质量数和这些同位素所占的一定百分比计算出的平均值 B.用各种锑的天然同位素原子量和这些同位素所占的一定百分比计算出的平均值

已提交,审核后显示!提交回复
共1条回复
 nebulaer 共回答了16个问题
nebulaer 共回答了16个问题 |采纳率81.3%- B
A只能计算近似值 B计算的是精确值 - 1年前
相关推荐
- 为什么锇的密度最大?我想问问有何物理解释,因为它有什么特点才密度最大,比它原子量大的元素很多.多几个来回答一下嘛,第一个
为什么锇的密度最大?
我想问问有何物理解释,因为它有什么特点才密度最大,比它原子量大的元素很多.
多几个来回答一下嘛,第一个回答里其实我想知道也就是第一句话,够了? 蜀ee云阳人1年前1
蜀ee云阳人1年前1 -
 yzqua 共回答了20个问题
yzqua 共回答了20个问题 |采纳率85%这个涉及到物理化学(含结构化学)的高深知识,在网上估计找不到现成的答案,你应该再买一些相关的书来看看.锇的共价半径特别小,也就是说锇原子相互之间排列得非常紧密,密度也就相当大,密度排名第二的铱共价半径比锇略小...1年前查看全部
- 目前发现的原子量最大的元素是什么,理论推算的不算,以实际出现(人工的也算)的为准
 喜欢小馋猫1年前1
喜欢小馋猫1年前1 -
 conrand 共回答了21个问题
conrand 共回答了21个问题 |采纳率85.7%118号元素吧 元素周期表最后一个 Uuo 原子量294 不算其他同位素1年前查看全部
- 如何计算一种元素的原子量?
 一个人去兴隆沙1年前1
一个人去兴隆沙1年前1 -
 zhushujie 共回答了13个问题
zhushujie 共回答了13个问题 |采纳率92.3%是以一种叫做 碳12 原子的质量的十二分之一为标准,用其他原子的质量除以它,所得的比值就是原子量,比如氢的原子量是1,氧的是16.
某种原子的质量与碳-12原子质量的1/12(约1.66×10-27 kg)的比值称为该原子的原子量,又称相对原子质量,单位为1.由于大多数元素是由两种或两种以上的同位素构成的,因此原子量是按各同位素所占百分比求得的平均值.由于原子质量很小,采用千克作为质量单位,书写、记忆、计算和使用都不方便.因此国际上采用原子的相对质量,即相对原子质量来表示原子的质量.1年前查看全部
- 高中化学常用方程式的相对原子量学摩尔这张常用的化学式的相对原子量
 searchfor_love1年前1
searchfor_love1年前1 -
 wwwwf1212 共回答了20个问题
wwwwf1212 共回答了20个问题 |采纳率75%哈哈.你是刚学化学吧?话不成句啊!开玩笑.你想记住常见的各元素的相对原子质量?那好,记住:前二十号元素,奇数号的元素其相对原子质量为2x+1,偶数号的元素其相对原子质量为2x.(x为该元素的原子序数).氯元素的平均相对原子质量为35.5.怎么样?1年前查看全部
- M层有两个电子的元素跟L层有5个电子的元素组成的化合物的式量为(式量就是化学式的原子量)!
M层有两个电子的元素跟L层有5个电子的元素组成的化合物的式量为(式量就是化学式的原子量)!
28、60、72、100,哪一个?讲原因, yingzi607011年前2
yingzi607011年前2 -
 nanat1981 共回答了12个问题
nanat1981 共回答了12个问题 |采纳率83.3%M层有两个电子,也就是电子排布是2、8、2的是Mg原子;L层有5个电子,也就是电子排布是2、5的是N原子.两者结合成Mg3N2,式量为100.1年前查看全部
- 某元素有元素X和Y组成,这两种元素的质量比是7:3,写出物质的化学式_______,如果X的原子量为56,则Y的原子量是
某元素有元素X和Y组成,这两种元素的质量比是7:3,写出物质的化学式_______,如果X的原子量为56,则Y的原子量是_______.那么,X元素的质量百分比是(写出计算过程)______________,X和Y元素能组成物质的化学式有____________________________
 歌未寒1年前1
歌未寒1年前1 -
 78978 共回答了20个问题
78978 共回答了20个问题 |采纳率90%Fe2O3;16;56*2/(56*2+16*3);Fe3O4;FeO1年前查看全部
- 化学元素周期表中的原子量需要掌握吗?
化学元素周期表中的原子量需要掌握吗?
就是那些小数 比如:氢1.00794(7) 温柔小刀的zz1年前1
温柔小刀的zz1年前1 -
 joker23 共回答了16个问题
joker23 共回答了16个问题 |采纳率100%不用1年前查看全部
- 某元素R的气态氢化物的化学式为RH3,在其最高氧化物中R的质量分数为43.66%.求R的原子量.
 karlin9991年前1
karlin9991年前1 -
 zicai85 共回答了9个问题
zicai85 共回答了9个问题 |采纳率100%因为R的气态氢化物的化学式为RH3 所以最高氧化物为H3RO4 R的质量分数为43.66% 43.66%=R/(R+3+64) R约等于521年前查看全部
- 关于同位素原子量..有同位素的元素中,怎么确定各种同位素的原子量?比如Na元素,它的原子量是22.98977,他还有同位
关于同位素原子量..
有同位素的元素中,怎么确定各种同位素的原子量?
比如Na元素,它的原子量是22.98977,他还有同位素,那么他的同位素的原子量是多少?
是要计算吗?都需要那些量?还是能查到?到什么地方查? 亲爱的啄木鸟1年前1
亲爱的啄木鸟1年前1 -
 chyo 共回答了21个问题
chyo 共回答了21个问题 |采纳率85.7%还需要知道同位素的丰度,也就是该种同位素在该种元素中所占比例,然后把每种同位素的原子量加权平均一下就可以了.1年前查看全部
- 原子量和质量数某种元素的原子量取整数,就是其质量数,这句话对吗?原子量跟质量数有联系吗,区别是什么.
 lingfeng_6111年前1
lingfeng_6111年前1 -
 啊5 共回答了29个问题
啊5 共回答了29个问题 |采纳率75.9%质量数与原子量是两个概念,对于某种原子两者数值近似相等,质量数是质子和中子数之和,原子量是原子质量与哪个标准计算得到的,带小数.元素的原子量是各同位素原子量按自然界存在量所计算的平均值.1年前查看全部
- 简单解释一下原子相对原子量和元素相对原子量,比如说碳
 4663741年前1
4663741年前1 -
 东奔西顾 共回答了18个问题
东奔西顾 共回答了18个问题 |采纳率100%原子相对原子量:是指确定的某种核素的相对原子量
元素相对原子量:是某元素所有同位素按比例计入后的相对原子量1年前查看全部
- 关于计算原子质量计算硫酸氨中的氮元素的质量,为什么氢的原子量是1而不是2呢?惭愧,把这些学过的知识都忘光了.
 jessica05011年前1
jessica05011年前1 -
 逸风843 共回答了22个问题
逸风843 共回答了22个问题 |采纳率77.3%H只有一个质子,没有中子1年前查看全部
- 分子量 原子量 区别是什么.我知道原子量是一个化学式相对质量之和.那分子量呢.通俗的理解是什么.
 aki_sang1年前1
aki_sang1年前1 -
 sqsq520180 共回答了19个问题
sqsq520180 共回答了19个问题 |采纳率89.5%你搞反了.分子量才是一个化学式的相对原子量之和
原子量就是这个原子的相对原子量.1年前查看全部
- A B两种元素的原子量之比是8∶9.将两中金属单质按物质的量之比为3∶2组成1.26克混合物.将此混合物与足量
A B两种元素的原子量之比是8∶9.将两中金属单质按物质的量之比为3∶2组成1.26克混合物.将此混合物与足量
A B两种元素的原子量之比是8∶9。将两中金属单质按物质的量之比为3∶2组成1.26克混合物。将此混合物与足量稀硫酸溶液反应,放出1.344升(标准状况)氢气。若这两种金属单质在反应中生成氢气的体积相等,则A的摩尔质量是__,B的摩尔质量是__ 趴趴熊烧香1年前1
趴趴熊烧香1年前1 -
 sanqindan 共回答了22个问题
sanqindan 共回答了22个问题 |采纳率81.8%虽然题目没结束,但根据多年做题经验,我猜是 Al2O3 相关的反应了1年前查看全部
- 原子量、相对分子质量、质量数分别是什么?它们之间的关系?
 45枯天在夺1年前1
45枯天在夺1年前1 -
 三木豆豆 共回答了19个问题
三木豆豆 共回答了19个问题 |采纳率84.2%相对分子质量等于分之中各原子量之和,质量数是原子中质子数与中子数之和,与其它没关系,原子量是相对于碳12质量的12分之1的质量之比,无单位.1年前查看全部
- X、Y两元素的原子量之比为2:1,由两元素形成的化合物中X、Y元素的质量比为2:3,其中X元素的化合物价为+a,则化合物
X、Y两元素的原子量之比为2:1,由两元素形成的化合物中X、Y元素的质量比为2:3,其中X元素的化合物价为+a,则化合物中Y元素的化合价为( )
A. -[a/2]
B. -[a/3]
C. -[3a/2]
D. -[2a/3] moses991年前2
moses991年前2 -
 二月候鸟 共回答了25个问题
二月候鸟 共回答了25个问题 |采纳率92%解题思路:要计算化合物中元素Y的化合价,首先要确定两元素所组成化合物的化学式;而确定物质的化学式需要确定分子中的两种原子的原子个数;利用原子个数比=[元素质量比/相对原子质量比]可确定原子个数比,从而写出化学式,然后根据化合物中各元素的化合价代数和为0,计算元素Y的化合价.因为X、Y两元素的原子量之比为2:1,由两元素形成的化合物中X、Y元素的质量比为2:3;
X、Y元素组成的化合物中两种元素的原子个数比=
2
3
2
1=[1/3],则该化合物的化学式可表示为XY3,
设化合物XY3中Y元素的化合价为x,已知X元素为+a价;
根据化合物中各元素的化合价代数和为0的原则,有+a+x×3=0,
解得x=-[a/3];
故选B.点评:
本题考点: 有关元素化合价的计算;元素质量比的计算.
考点点评: 本题考查学生对化合物中各元素质量比与化合价计算方法在解题中的灵活应用.1年前查看全部
- 原子量是什么 原子序约等于什么?原子的质量叫什么
 万里独行dxc1年前1
万里独行dxc1年前1 -
 这老A的ii 共回答了10个问题
这老A的ii 共回答了10个问题 |采纳率90%原子量是原子实际质量与碳12原子质量的1/12的比值.
原子序数=核外电子数=核电荷数=核内质子数
原子的质量就叫原子的质量.1年前查看全部
- 1mol物质的质量为什么等于它的相对分子量或原子量?
 llaa1年前2
llaa1年前2 -
 qinying_1979 共回答了15个问题
qinying_1979 共回答了15个问题 |采纳率93.3%首先,相对原子量是以1个C-12原子质量的1/12作为1个单位数量标准,其他元素1个原子的质量与此标准相比的数值即为该原子的相对原子量,如:氢是1;氧是16,
其次,1mol的氢原子质量是1克,在数值上刚好等于氢原子的相对原子量1(无单位),同理,
1mol的氧原子质量是16克,
可见,当引入物质微粒个数单位:1mol概念后,经相对原子量这一桥梁,就沟通了自微观世界到宏观世界的物质进行质量计量的方法,因而,物质mol质量的单位是:克/mol,此概念类同物质密度,这是化学定量计算的基础.1年前查看全部
- a克二价金属容入足量稀硫酸,完全反应产生B克氢气,金属的相对原子量
 liruhai1年前1
liruhai1年前1 -
 异地恋好辛苦 共回答了18个问题
异地恋好辛苦 共回答了18个问题 |采纳率100%2a/B1年前查看全部
- 找二价钙离子,二价镁离子,钾离子的原子量和分子量
 traineewang1年前1
traineewang1年前1 -
 流浪宠儿 共回答了19个问题
流浪宠儿 共回答了19个问题 |采纳率84.2%他们都是单原子金属,原子量数值与分子量相等,Ca离子40,Mg离子24,K离子391年前查看全部
- α粒子就是氦原子核,为什么原子量为4原子量是什么
 隔离村只牛1年前1
隔离村只牛1年前1 -
 挖坑葬吾 共回答了19个问题
挖坑葬吾 共回答了19个问题 |采纳率84.2%就是相对原子质量1年前查看全部
- 原子量:H:1 O:16 S:32 C:12 Na:23 CI:35.5
原子量:H:1 O:16 S:32 C:12 Na:23 CI:35.5
1.某元素原子的最外层电子数为次外层电子数的3倍,则该元素原子核内质子数为
A.6 B.24 C.8 D.10
2.从11号元素钠到17号元素氯,下列各项中按顺序递减的是
A.最外层电子数 B.最高正化合价 C.元素的非金属性 D.原子半径
3.根据原子序数,下列各组原子之间能以离子键结合的是
A.10与19 B.6与16 C.12与17 D.12与26
4.下列分子中具有极性键非极性分子是
A.NH3 B.CO2 C.H2O D.N2
5.摩尔是
A.物质的物理量单位 B.微粒数单位 C.物质质量的单位 D.物质的量的单位
6.相同质量的气体,在标准状况下体积最大的是
A.CI2 B.CO C.H2S D.H2
7.决定化学反应速率的主要原因是
A.温度 B.浓度 C.催化剂 D.反应物的本性
8.下列溶液或液体,哪个不能导电
A.液态氧 B硫酸水溶液 C.氯水 D.液态氢氧化钠
9下列物质哪个是弱电解质
A.NaAc B.NH4C1 C.KNO3 D.H2S
二,填空
14 23 35 24 35 14
1.在 N,Na,C1,Mg,C1,C几种核素中
7 11 17 12 17 6
(1) 和 互为同位素;
(2) 和 的质量数相等,但不能互称同位素;
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素.
2.某元素的原子核外有3个电子层,最外层电子数是核外电子总数的1/6,该元素的元素符号是 ,原子结构示意图为 .
3.现有Na,Ne,S,C1,4种原子,其中:
(1)各电子层都达到2n(2平方)个电子的是 ;
(2)最外层电子数最多的是 ,最少的是;
(3)次外层电子数等于最外层与最内层电子数之和的是 ;
4.用元素符号会的原子序数11~18的元素的以下问题
(1)最高价氧化物的水化物碱性最强的是 ;
(2)最高价氧化物的水化物酸性最强的是 ;
(3)最高正价和负价绝对值之差等于4的是 .
三,判断题
1.阴阳离子之间只有强烈的吸引作用,而没有排斥作用,所以离子之间的核间距相当小.
2-
2.硫酸分子中有H+和SO 两种离子.
4
3.非极性分子中的化学键一定是非极性键.
4.以离子键结合的化合物是离子化合物,任何离子化合物中不可能包含共价键.
5.完全由极性键形成的分子不一定是极性分子,分子的极性还与它的空间结构有关.
6.人们已经发现 112种元素,所以说就是发现了112种原子.
7.所有原子的原子核都是由质子和中子组成.
8.同位素就是质量数或者是中子数相同的一类原子.
9.元素周期表中共有18个纵行,即18个族.
10.同一周期的主族元素,从左到右原子半径逐渐减小,非金属性逐渐增强. ol20041年前1
ol20041年前1 -
 干城 共回答了19个问题
干城 共回答了19个问题 |采纳率100%1.c 2.D 3.C 4.B 5.C 6.D 7.D 8.A 9.D1年前查看全部
- 等质量的金属镁铁锌,金属的原子量越小产生的氢气就越多
等质量的金属镁铁锌,金属的原子量越小产生的氢气就越多
RT,为什么,是这样的吗 fancy6M1年前1
fancy6M1年前1 -
 不眠之夜xd 共回答了19个问题
不眠之夜xd 共回答了19个问题 |采纳率84.2%和酸反应吧?不列式子简单给你描述一下,金属镁铁锌和酸反应都是生成二价阳离子,等微粒数的镁铁锌产生等量氢气····金属的原子量越小单位质量所含相应金属微粒越多,产生氢气越多1年前查看全部
- 为什么说相同价态的等质量金属,其原子量越小,与足量酸反应生成氢气越多?
 1755868991年前1
1755868991年前1 -
 上班下班上下班 共回答了20个问题
上班下班上下班 共回答了20个问题 |采纳率90%相同质量原子量越小所含的原子数越多、反应生成的氢气就越多1年前查看全部
- (2008•石鼓区模拟)X元素1个原子的质量是m克,Y元素的原子量为A;化合物XY2的式量是M,则w克XY2中含有Y的原
(2008•石鼓区模拟)X元素1个原子的质量是m克,Y元素的原子量为A;化合物XY2的式量是M,则w克XY2中含有Y的原子数是( )
A.2W(M−2A) Mm
B.[2MWm(M−2A)  wangsheng980311年前1
wangsheng980311年前1 -
 osuoai 共回答了16个问题
osuoai 共回答了16个问题 |采纳率100%解题思路:一定量的化合物中组成元素的原子个数=[化合物中元素的质量/原子的质量],由于题中没有给出元素y的原子质量,因此不能直接计算出y的原子质量;但根据物质的化学式xy2可得分子中x原子与y原子个数比为1:2,因此,可利用x原子的质量计算出原子个数,x的原子个数的2倍即为y的原子个数.Wg化合物xy2中含有元素y的质量=Wg×[A×2/M]×100%=[2WA/M]g,则Wg化合物xy2中含有元素x的质量=Wg-[2WA/M]g=
W(M−2A)
Mg
因此,Wg化合物xy2中含有元素x的原子个数=
W(M−2A)
Mg
mg=
W(M−2A)
mM,则Wg化合物xy2中含有元素y的原子个数=
W(M−2A)
mM×2=
2W(M−2A)
mM
故选A点评:
本题考点: 原子的有关数量计算;相对分子质量的概念及其计算.
考点点评: 元素是原子的总称,物质中元素的质量就是构成该物质的所有分子中该元素的原子的总质量,因此,原子的个数为元素质量与原子质量的比.1年前查看全部
- 已知铜的密度为8.9×103千克/米3,铜的原子量为64,质子和中子的质量均为1.67×10-27kg,则铜块中平均每个
已知铜的密度为8.9×103千克/米3,铜的原子量为64,质子和中子的质量均为1.67×10-27kg,则铜块中平均每个铜原子所占的空间体积约为______m3.
 m89sejhsuea1年前1
m89sejhsuea1年前1 -
 胡甘棠 共回答了18个问题
胡甘棠 共回答了18个问题 |采纳率94.4%解题思路:根据铜的原子量为64,所以共有质子和中子的个数是64,计算出一个铜原子的质量,1米3的铜除以一个铜原子的质量即平均每个铜原子所占的空间体积.一个铜原子的质量:m0=64×1.67×10−27kg
1米3的铜质量为8.9×103千克,1米3的铜的原子的个数:n=
m
m0=
8.9×103
64×1.67×10−27=8.327×1028个
所以平均每个铜原子所占的空间体积:V0=
V
n=
1
8.327×1028=1.2×10−29m3
答:平均每个铜原子所占的空间体积约1.2×10-29m3点评:
本题考点: 阿伏加德罗常数.
考点点评: 该题要计算平均每个铜原子所占的空间体积,先计算出1米3的铜的原子的个数是关键.1年前查看全部
- 等质量金属与足量酸产生氢气的质量与金属原子量无必然关系?比如说Al(27)和Mg(24),而Al的多?
等质量金属与足量酸产生氢气的质量与金属原子量无必然关系?比如说Al(27)和Mg(24),而Al的多?
但是对大部分金属来说都还适用? 加洲大脸猫1年前3
加洲大脸猫1年前3 -
 330409281 共回答了20个问题
330409281 共回答了20个问题 |采纳率85%设铝的质量为X克,与酸反应生成氢气的质量为Y克.
2Al+6HCl=2AlCl3+3H2↑
2×27 3×2
X Y
2×27 /X= 3×2/Y
Y=3×2×X/2×27 =3/27×X(3是铝的化合价,27是铝原子的相对原子质量)
由此可得出:金属与酸反应生成氢气的质量=(金属质量×金属化合价)/金属相对原子质量.
【或者:设金属M的化合价为X,金属的相对原子质量为y,金属质量为a,生成氢气质量为z,则
M+xHCl=MClx+x/2H2
y x
a z
得z=ax/y 因为金属的质量相等,所以氢气的质量就取决于金属的相对原子质量与其反应中的化合价比值,比值越大,产生的氢气质量越少.上述解答取用稀盐酸,如果换用稀硫酸,结果也是一样的.】1年前查看全部
- 已知铜的原子量为M,密度为ρ,每摩尔铜原子有n个可以自由移动的电子,今有一根横截面积为S的铜导线,当通过的电流为I时,铜
已知铜的原子量为M,密度为ρ,每摩尔铜原子有n个可以自由移动的电子,今有一根横截面积为S的铜导线,当通过的电流为I时,铜导线内电子平均定向移动的速率为( )
A. 光速c
B. [MI/neSρ]
C. [ρI/neSM]
D. [I/MeS] zhaf1191年前1
zhaf1191年前1 -
 007zwp 共回答了22个问题
007zwp 共回答了22个问题 |采纳率81.8%解题思路:铜导线单位长度电子数等于原子数;设自由电子定向移动的速率为v,求出导线中单位长度自由电子的数目,根据电流的定义式推导出电流的微观表达式,解得自由电子定向移动的速率.单位长度质量为:M′=ρ•S•1;
单位长度原子数为:N=[M′/M]•NA=
ρSNA
M;
每个银原子可以提供一个自由电子,故电子数为n=
ρSNA
M;电流I=[q/t]=[ne/t];
而t=[l/v];
解得:v=[l/t]=[lI/ne]=[MI/nesρ];
故选:B.点评:
本题考点: 电流、电压概念.
考点点评: 本题关键是建立微观模型,假设每个电子均以平均速度做匀速直线运动,然后结合电流的定义进行列式计算.1年前查看全部
- 某化合物合钠29.1%,硫40.5%,氧30.4%,计算最简化学式(原子量:硫32,钠23,
 sparklejay1年前3
sparklejay1年前3 -
 chuxiaoyang 共回答了21个问题
chuxiaoyang 共回答了21个问题 |采纳率85.7%mNa:mS:mO=29.1:40.5:30.4
nNa:nnS:nO=29.1/23:40.5/32:30.4/16=2:2:3
∴最简化学式为Na2S2O31年前查看全部
- 氖的摩尔质量在数值上等于它的原子量 为什么,氖的摩尔质量为20,而它的的原子量不是20啊
氖的摩尔质量在数值上等于它的原子量 为什么,氖的摩尔质量为20,而它的的原子量不是20啊
1mol氩气和1mol氟气具有相同的质子数,怎么求的,我理解能力比较差 寻找孙菲菲1年前2
寻找孙菲菲1年前2 -
 maizuru 共回答了9个问题
maizuru 共回答了9个问题 |采纳率100%单位物质的量的物质所具有的质量称为摩尔质量(molar mass),用符号M表示.当物质的质量以克为单位时,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量.
氖气由原子直接构成,每个氖原子有18个质子,氟气是双原子分子,化学式为F2,每个分子中也有18个质子.所以1mol氩气和1mol氟气具有相同的质子数.1年前查看全部
- 已知油酸的密度为6.37×102kg/m3,油酸的原子量为282.试估算油酸分子的直径有多大?
 smzcom20001年前1
smzcom20001年前1 -
 gfqqp 共回答了20个问题
gfqqp 共回答了20个问题 |采纳率85%用扩散法,在一个大烧杯中加入282克油酸,量出他扩散的面积有多大,体积可以用质量除以密度算,用体积除以油酸扩散的面积就是油酸分子的直径1年前查看全部
- 物理微观题,已知氯化钠的微观结构图和钠原子量23,氯的原子量35.5,食盐的密度是2.2*10^3kg/m^3,试确定氢
物理微观题,
已知氯化钠的微观结构图和钠原子量23,氯的原子量35.5,食盐的密度是2.2*10^3kg/m^3,试确定氢原子的质量. 军呵1年前3
军呵1年前3 -
 ywy313313 共回答了21个问题
ywy313313 共回答了21个问题 |采纳率90.5%微观结构图有标边长否?肯定是那个每个面有9个原子的正方体图咯?
如果边长是a,则一个氯化钠晶胞有四个氯原子和四个钠原子,则总共的原子量是
4*23+4*35.5=234
质量为:密度乘以a的三次方
即2.2*10^3(kg/m^3)*a^3注意单位
所以氢原子质量为:
2.2*10^3(kg/m^3)*a^3/234
如果不知道边长,但是知道阿伏伽德罗常数,也可以计算.
但是这就不需要晶体微观结构了,直接用1g除以阿氏常数就可以了,所以应该不是该题目的解吧1年前查看全部
- 一份金属M的氧化物5.46g,含氧0.96g,则M的原子量多少?
 XMTINA1年前2
XMTINA1年前2 -
 fdcaptain 共回答了19个问题
fdcaptain 共回答了19个问题 |采纳率84.2%化合物是K2O.金属K,39.1年前查看全部
- 原子量与相对原子量有区别吗?若已知一种原子的Z和N可以确定其原子量为Z+N吗?
原子量与相对原子量有区别吗?若已知一种原子的Z和N可以确定其原子量为Z+N吗?
或可以说此原子的相对原子量为N+Z吗? jiaxuansummer1年前1
jiaxuansummer1年前1 -
 bxfxyltc 共回答了15个问题
bxfxyltc 共回答了15个问题 |采纳率86.7%原子量=中子+质子+电子
但是由于电子质量很小 可以忽略不计1年前查看全部
- 则B原子的相对原子量为A原子的质子数为E,B原子比A原子少4个电子,核内有N个中子,则B原子的相对原子为________
则B原子的相对原子量为
A原子的质子数为E,B原子比A原子少4个电子,核内有N个中子,则B原子的相对原子为________. 我二伯1年前2
我二伯1年前2 -
 zpa39447 共回答了6个问题
zpa39447 共回答了6个问题 |采纳率100%B原子比A原子少4个电子则质子数也少四个,所以质子数为E-4,则B原子的相对原子量为N+E-41年前查看全部
- 某氢化物的分子式为R2H2氢元素的质量占7.7%R元素的原子量为( )
某氢化物的分子式为R2H2氢元素的质量占7.7%R元素的原子量为( )
A 4 B 8 C 16 D 12 星光无限00发1年前2
星光无限00发1年前2 -
 1桔梗 共回答了19个问题
1桔梗 共回答了19个问题 |采纳率84.2%设R元素的原子量为X,则:
2/(2X+1×2)= 7.7%
7.7%(2X+2)= 2
0.154X = 1.846
X ≈ 12
所以,答案是:D 121年前查看全部
- 元素周期表中钴排镍前,为啥原子量钴比镍大
元素周期表中钴排镍前,为啥原子量钴比镍大
像标题那样. exen11年前1
exen11年前1 -
 zhangls8296 共回答了13个问题
zhangls8296 共回答了13个问题 |采纳率84.6%Co的中子比Ni多,更深层的原因说不上来.除了Co-Ni外,Te的原子量也比I大.1年前查看全部
- 铁的相对原子量是56,镁的相对原子量是24.100克镁和100克铁中那个所含的电子数多
 北方喜欢南方1年前2
北方喜欢南方1年前2 -
 夏日冰激淋 共回答了20个问题
夏日冰激淋 共回答了20个问题 |采纳率95%100gMg为100/24mol,1个Mg原子含12个电子,则100gMg含电子的物质的量为50mol;
100gMg为100/56mol,1个Fe原子含26个电子,则100gFe含电子的物质的量为325/7mol,小于50mol;
故100gMg中所含的电子数多1年前查看全部
- 氯元素的近似原子量为35.5,由23Na,35CL,37CL构成的11.7克NaCl中,37Cl— 的质量是
 cllyuwan1年前1
cllyuwan1年前1 -
 四面屏风 共回答了16个问题
四面屏风 共回答了16个问题 |采纳率87.5%11.7g是0.2MOL 又35CL和37CL的比是 (37-35,5):(35.5-35)=3:1 所以 有37CL0.2*1/4=0.05MOL 所以有0.05*37=1.85G1年前查看全部
- 欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每
欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每种仪器只允许用一次)。请回答下列问题:
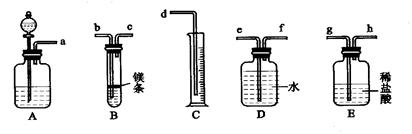
⑴假设气流方向由左向右,则各仪器的接口连接的先后顺序为a→ → →b→c→f→e→d(填写字母)。
⑵装置A中的分液漏斗中盛放的液体是 ,作用是 。
⑶连好仪器后,要进行的操作步骤有以下几步:
① 待仪器B中的物质恢复至室温时,测量量筒C中水的体积(假设将测定的体积换算成标准状况下为VmL);
② 擦掉镁条表面的氧化膜,将其置于天平上称量(假设其质量为mg),并将其投入试管B 中;
③ 检查各装置的气密性;
④ 旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。(2分)
⑷若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑸若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑹甲、乙、丙三位同学用下图装置来测定一定质量的镁完全反应后生成氢气的体积:
实验步骤如下:
① 检查装置的气密性;
② 向试管B中加入镁条;
③ 准确操作,记录C中液面刻度(C为带有刻度的量气管,D为可上下移动的水准管);
④ 由A向B中滴加稀盐酸至过量;
⑤ B中不在有气体产生并恢复至室温后,准确操作,记录C中液面刻度,计算得到气体的体积为Vml
Ⅰ、甲同学检查该装置气密性的方法是连接好装置,从D管注水,C、D两管液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平、冷至室温外,还应 ;
Ⅱ、甲同学认为镁带在实验前应打磨,目的是 ;
Ⅲ、通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ;理由是 。
Ⅳ、以上是乙、丙两位同学所用实验装置,在步骤⑤读数时所处的稳定状态图,则将会对实验结果产生的影响是(假设其余步骤完善且操作准确无误):乙 ,丙 (填“偏大”、“偏小”或“无影响”)。 水儿的家1年前1
水儿的家1年前1 -
 忘记密码uu 共回答了16个问题
忘记密码uu 共回答了16个问题 |采纳率100%⑴h、g(1分)水使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
⑶③②④① (2分)⑷偏低 ⑸偏高
⑹不变调节D管,使CD两管中液面相平
Ⅱ、除去表面的氧化层;
Ⅲ、重新实验因为中途加酸,装置中的气体会逸出
Ⅳ、偏小偏大
(1)E图中气体应该从长管进来,否则就会将液体压出去了。
(2)装置A中的分液漏斗中盛放的液体是水,其作用是可以使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
(3)先后顺序为③②④①
(4)若未将试管B冷却至室温,会导致测量的气体偏多,也就会使测得的相对原子质量会偏少,
(5)若未擦净镁条表面氧化膜就进行实验,则所测得气体质量会偏少,也就会使测得的相对原子质量会偏大,
(6)高度差不变,就说明气密性良好。调节D管,使CD两管中液面相平,这样可以消除液体压强的影响。
镁表面有氧化膜,不除掉会影响测量结果。
因为中途加酸,装置中的气体会逸出,就会使测量结果不准确。
乙同学的装置图右边液面高,就会使右边压强比左边大,会使左边测得的气体体积偏小,所以乙同学的测量结果偏小,丙同学的装置左边是密闭的,当盐酸流下后会使左边气压变小,所以最终使测量结果偏高大。1年前查看全部
- 金属的相对原子量计算问题有一题是这样的7g某种金属和稀硫酸发生反应,生成了19g的金属化合物.并生成了氢气,则金属的相对
金属的相对原子量计算问题
有一题是这样的
7g某种金属和稀硫酸发生反应,生成了19g的金属化合物.并生成了氢气,则金属的相对原子质量为多少.( )
A.24 B,40 C.56 D.65
我希望大家帮我解决问题后,能归纳金属算数题的方法和解题思路. duchy1年前1
duchy1年前1 -
 SASA口耐 共回答了19个问题
SASA口耐 共回答了19个问题 |采纳率68.4%选C.金属相对原子质量计算就是求金属质量计算的逆运算.可设该金属相对原子质量为X由于金属与酸的反应方程式(铝除外)为
X+H2SO4==XSO4+H2(气体)可写成这样的方程:
X X+96
7克 19克
X/7=(X+96)/19解得X=56
还有一点,这种题数目都算好了,一见56就想铁,24就想镁.若解出这方程不是整数那这金属可能是铝,再按铝的方程解就行了1年前查看全部
- 元素A和元素B形成AB3型化合物,其质量为氦气的20倍,在AB3中元素A的百分含量为40%,又知元素A的原子量是元素B原
元素A和元素B形成AB3型化合物,其质量为氦气的20倍,在AB3中元素A的百分含量为40%,又知元素A的原子量是元素B原子量的2倍,求:A的原子量为______ ,A原子的质子数为______ ,B原子的原子量为_______ ,写出AB3的化学式______.
 欢喜如梦1年前2
欢喜如梦1年前2 -
 rr7 共回答了21个问题
rr7 共回答了21个问题 |采纳率71.4%质量为氦气的20倍,则AB3相对分子质量=4*20=80
在AB3中元素A的百分含量为40%,又知元素A的原子量是元素B原子量的2倍,所以M(AB3) = M(5B) = 80
B的相对原子质量 = 80/5 = 16,是氧
A的相对原子质量 = 16*2 = 32,是硫
A的原子量为___32___ ,A原子的质子数为___16___ ,B原子的原子量为___16____ ,写出AB3的化学式___SO3___.1年前查看全部
- 一个SO2的分子的质量为nkg,一个SO3分子的质量为mkg,以硫原子的质量的1/32为原子量的标准,SO3的分子量
一个SO2的分子的质量为nkg,一个SO3分子的质量为mkg,以硫原子的质量的1/32为原子量的标准,SO3的分子量
急 taolexi1年前2
taolexi1年前2 -
 299689 共回答了19个问题
299689 共回答了19个问题 |采纳率78.9%m/(3n-2m)*321年前查看全部
- 13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子
13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子量为( )
A. 23
B. 27
C. 40
D. 56 好好点1年前4
好好点1年前4 -
 inb3tv 共回答了25个问题
inb3tv 共回答了25个问题 |采纳率84%解题思路:13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,则水的质量为13.9g-7.6g=6.3g,利用组成中的质量可知,XSO4与水的物质的量之比为1:n,以此来计算解答.13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,则水的质量为13.9g-7.6g=6.3g,
若X的原子量为结晶水分子数的8倍,
XSO4与水的物质的量之比为1:n,
则
7.6g
n×8+96:
6.3
18=1:n,
解得n=7,
则X的相对原子质量为7×8=56,
故选D.点评:
本题考点: 相对原子质量及其计算.
考点点评: 本题考查相对原子质量的计算,明确定组成是解答本题的关键,题目难度不大,但计算较繁琐.1年前查看全部
- 周期表中Co和Ni Te和I处为何出现了原子量的倒减?这里隐含了什么秘密?
 applexyy20081年前1
applexyy20081年前1 -
 8qq27224 共回答了17个问题
8qq27224 共回答了17个问题 |采纳率88.2%因为前一个元素中子多
Co和Ni 钴的中子数比镍多
Te和I Te的中子数比I多1年前查看全部
- 某元素R的最高价氧化物分子式为RO2,其中R的含量占27.3%,则R的原子量为
某元素R的最高价氧化物分子式为RO2,其中R的含量占27.3%,则R的原子量为
如题 addisonpi1年前1
addisonpi1年前1 -
 ptaclh 共回答了14个问题
ptaclh 共回答了14个问题 |采纳率100%12,CO2,是二氧化碳1年前查看全部
- 蛋白质分子量=氨基酸总分子量—脱水总分子量(—脱氢总原子量)=na—18(n—m);
 小芭果1年前1
小芭果1年前1 -
 秋雨梧桐888 共回答了14个问题
秋雨梧桐888 共回答了14个问题 |采纳率92.9%是水的相对分子质量1年前查看全部
- 某+3价的金属化合物mg,一定条件下与足量氢气完全反应,得到ng金属单质.则该金属相对原子量为:〔〕
某+3价的金属化合物mg,一定条件下与足量氢气完全反应,得到ng金属单质.则该金属相对原子量为:〔〕
A.24n/〔m-n〕B.〔m-n〕/nC.〔m-n〕/16n
选哪个?为什么? 胭脂香味1年前1
胭脂香味1年前1 -
 小冰heart 共回答了13个问题
小冰heart 共回答了13个问题 |采纳率92.3%设金属化合物为:A2O3,A的相对原子质量为x
则A2O3+3H2=2A+3H2O
所以m/(2x+48)=n/2x
解得x=24n/(m-n)
所以选A
这个题目有点问题,题目中没有说明是氧化物.1年前查看全部
- 126号元素的原子量是多少?
 菜叶子常青1年前3
菜叶子常青1年前3 -
 烟波酒徒 共回答了17个问题
烟波酒徒 共回答了17个问题 |采纳率94.1%126号元素未被发现,可能的性质为
虽然126号元素(Unbihexium)尚未被合成,但由于其处在假想的稳定元素岛中而引起兴趣.
历史
Unbihexium的名字是作为元素周期表中的一个占位符使用的,例如用于关于探求126号元素的科学文章中.钚以后的超铀元素都是人工制造的,并且通常最终以科学家的名字或在原子物理中做出贡献的实验室的所在地的名字命名.
稳定的126号元素
根据使用非相对论Skyrme能量密度按Hartree-Fock-Bogoliubov法进行的计算,其很可能是在一个稳定性"井"中或稳定元素岛中最稳定的元素.
估计的126号元素的外观和性质
它是一种金属
有放射性(或稳定的)
半衰期(''最稳定同位素''):超过一百万年
颜色:亮银色或灰色
会迅速氧化
在空气中能被火引燃,像镁一样发出非常明亮的光
是固体
熔点:>600°C
沸点:>1500°C
硬度:大约 2.5-6.0 Mohs
Kryptonite
在John Byrne所着的《Action Comics》一书中,将Kryptonite元素虚构为元素周期表中的126号元素.1年前查看全部
大家在问
- 1铝、铜和酒精发生反应吗?温度在0度一下,会发生反应吗?
- 2乙醇和甲醇组成液体1.24克,加足量钠充分反应,产气体336摩尔,混合物两者物质的量比A2:1B1:2C1:4D3:1
- 3Joyce怎么读?这个英文名怎么读?
- 4带鸟名的诗句有哪些
- 5从百草园到三味书屋不必说也不必说单是什么写景顺序
- 6学校要配制成5%的消毒液进行卫生大扫除,现在浓度为20%的消毒液500ml,需要加水多少ml
- 7英语第四节⒈根据所给的汉语提示,用词的适当形式填空.1.I am really ( )at his words.(吃惊)
- 8我国著名化学家候德榜写的《_》一书,揭开了制碱秘密.
- 9我国著名化学家张青莲教授测定的锑元素的相对原子质量为121.760,早在1993年已被国际相对原子质量委员会确认为锑的国
- 10初唐至盛唐诗歌发展进程
- 11个位上的数是十位上的4倍.是7与一位数相乘的积.
- 12氯气是一种强氧化剂,无还原性是错还是对
- 13氯气是不是氧化剂?它有还原性吧?所有氧化剂都有还原性被?
- 14铁在什么时候显正三价,什么时候显正二价?
- 15酸性条件下kIO3溶液与KI溶液反应生成I2的离子方程式
